Periodiska systemet
• Varje grundämne har en kemisk beteckning, t.ex.
H=väte eller O=syre
• Atomnummer – antalet protoner och även antalet
elektroner
• Atommassan – massan hos en atom av grundämnet
• Man skiljer på metaller och icke metaller
• http://www.ptable.com/?lang=sv
Ädelgaserna
• Finner vi i grupp 18 längst till höger i det periodiska
systemet.
• Är de ämnen där atomen har fullt yttersta skal.
• Alla ämnen vill uppnå ”ädelgasstruktur”, det får de
genom att fylla sitt yttersta skal på olika sätt.
• Ädelgaserna varken reagerar med andra ämnen eller
bildar molekyler med varandra, de är redan nöjda.
• Ädelgaserna är:
- Helium (He), universums näst vanligaste
grundämne.
- Neon (Ne), främst i lysrör och vissa lampor.
- Argon (Ar), t.ex. skyddsgas vid svetsning.
- Krypton (Kr), används i vissa glödlampor.
- Xenon (Xe), används i blixtlampor.
- Radon (Rn), har ingen praktisk användning. Är
farlig och kan ge lungcancer, finns i marken och
kan ta sig upp i hus.
Elektronparbindning – kovalent
bindning
• Innebär att två atomer delar på två elektroner
– ett elektronpar
• Genom elektronparbindning uppnår de
ädelgasstruktur eftersom de delar på
elektroner som då kan fylla deras yttersta skal.
• Atomer som håller ihop med
elektronparbindning bildar molekylföreningar
- T.ex. vätgas, klorgas och vatten.
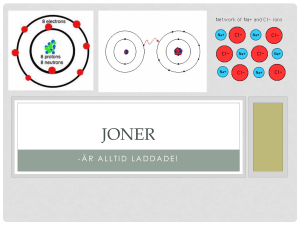
Joner
• Ännu ett sätt att uppnå ädelgasstruktur!
• Elektriskt laddade atomer kallas joner
• Protonerna i kärnan håller kvar elektronerna, men e- är
lättrörliga och en eller flera e- kan lämna en atom helt.
Den som avlämnar e- får fler p+ och blir positivt laddad
Den som får/tar upp e- får fler e- och blir negativt laddad
- De har blivit elektriskt laddade! De får nu andra egenskaper,
kan bl.a. leda ström.
• Atomerna väljer alltid det lättaste alternativet,
om de bara har en valenselektron släpper de
hellre den än att ta till sig 7, det går åt mindre
energi!
Väteatom
Vätejon