KEMI: Lärarhandledning
Spektrum Kemi –Testa Dig Själv Facit
Facit till alla Testa Dig Själv frågor finns som kopieringsunderlag i lärarhandledningen. För dig som
vill sammanställa, redigera eller på annat sätt bearbeta facit har vi även samlat facit i word-format på
cd´n.
Till omfattande frågor av berättartyp finns svaret ibland angivet som en sidhänvisning till boken.
Ur bokens text ska eleverna då själva efter förmåga utforma sina svar.
TESTA DIG SJÄLV
2.1
1. Egenskaper beskriver hur ett ämne uppför sig i olika situationer. Om det brinner, luktar eller
vilken färg det har. Om det är fast, flytande eller en gas. Allt som är speciellt för just det ämnet.
2. Socker och salt smakar olika.
3. Exempel på egenskaper som man kan upptäcka med sina sinnen är smak, lukt, färg, om ämnet är i
fast, flytande eller gasform, om ämnet är hårt eller mjukt. Exempel på egenskaper man behöver
hjälpmedel för att upptäcka är ledningsförmåga för ström, densitet, smältpunkt och kokpunkt.
4. Båda är vita, består av kristaller och är lösliga i vatten. Men smaken och vissa andra egenskaper är
olika.
5. Med hjälp av lukten eller smaken kan du avgöra om det är fruktsoda eller mineralvatten. Med
hjälp av synen kan du se om en medalj är av guld eller silver. Genom att känna tyngden kan du
märka om en mugg är gjord av plast eller porslin.
• Nej, alla ämnen har olika egenskaper. Om ämnena hade haft exakt samma egenskaper hade det
varit exakt samma ämne. Om det ändå skulle finnas två ämnen som hade precis samma egenskaper
skulle vi inte veta om det, för kemisterna skulle inte kunna upptäcka att det var olika ämnen.
TESTA DIG SJÄLV
2.2
1. En atom är en liten partikel, en byggsten. Alla ämnen runtomkring oss är byggda av atomer.
2. Det finns ungefär 100 olika atomslag.
3. De vanligaste atomerna i din kropp är syreatomer, kolatomer, väteatomer, kväveatomer och
kalciumatomer.
4. Med hjälp av några få sorters legobitar kan man bygga upp många olika saker. På samma sätt kan
de ungefär 100 olika atomslagen bygga de miljontals olika ämnen som finns omkring oss.
5. Den engelske kemisten John Dalton bevisade att atomerna finns.
6. Det är en modell som visar hur atomer är sammankopplade i en molekyl.
7. 10 miljoner atomer i rad är en millimeter. En människa består av femtusen kvadriljoner atomer.
8. En modell ska vara praktisk att använda och är därför en förenkling av verkligheten. Den ena
modellen kan passa bättre än den andra i vissa sammanhang, och ibland tvärtom. Med
pinnmodeller ser man lätt alla atomerna. Men kalottmodeller visar tydligare att atomerna hakar i
varandra.
• Andra exempel på byggstenar är levande celler, tegelstenar, noter ...
TESTA DIG SJÄLV
2.3
1. Ett grundämne är ett ämne som består av en enda sorts atomer
2. En kemisk förening är ett ämne där varje molekyl innehåller minst två olika slags atomer.
3. Grundämnena kan delas in i metaller och icke-metaller
4. Ett exempel på en kemisk förening är vatten – två väteatomer är sammankopplade med en
syreatom.
5. Metaller leder ström och värme och har metallglans.
6. Till exempel: Syre är en osynlig gas som vi behöver andas. Helium är en lätt gas som används i
ballonger. Järn är en metall som vi bygger många saker av. Den leder värme och elektricitet och
kan smidas. Guld är en gulglänsande metall som vi gör smycken av. Det leder också värme och
elektricitet och kan smidas.
7. Periodiska systemet är en tabell över alla atomslag och grundämnen.
TESTA DIG SJÄLV
2.4
1
KEMI: Lärarhandledning
1. En blandning av syre och väte kallas knallgas.
2. När du tänder eld på knallgas sker en explosion. Det sker en snabb reaktion mellan väte och syre
som då bildar vatten. Väte- och syremolekylerna tas isär och sätts ihop till vattenmolekyler.
3. En kemisk reaktion är en ”förvandling” där det bildas nya molekyler, och därmed nya ämnen.
4. Atomerna i pappret bildar nya molekyler tillsammans med syret i luften. Det blir då nya ämnen
som inte fanns före reaktionen, till exempel gasen koldioxid.
• Maten i din kropp förvandlas, luften du andas in förvandlas, frukostägget förvandlades när du
kokade det.
TESTA DIG SJÄLV
2.5
1. En molekylformel är en beskrivning av en molekyl med hjälp av kemiska tecken. Molekylformeln
visar vilka atomer som sitter ihop i molekylen.
2. Siffran två visar att det finns två väteatomer i vätemolekylen.
3. Siffran tre visar att man har tre vattenmolekyler.
4. Vätgas - H2, syrgas - O2 och kvävgas - N2.
5. En reaktionsformel visar vilka ämnen som deltar i reaktionen och vilka ämnen som bildas.
6. 2 H2 + O2 2 H2O. Två molekyler vätgas reagerar med en molekyl syrgas och bildar två
molekyler vatten.
7. När svavel regerar med syre sker reaktionen S + O2 SO2
TESTA DIG SJÄLV
2.6
1. De tre formerna är fast, flytande och gas.
2. Kondensering är när ett ämne övergår från gasform till vätska.
3. Förångning är när ett ämne går från vätska till gas.
4. En fysikalisk omvandling innebär att ämnet endast ändrar form, till exempel när is smälter till
vatten. Men det är fortfarande samma molekyler; det sker alltså ingen kemisk förvandling.
5. Värme är när byggstenarna – atomerna och molekylerna – i ett ämne rör sig. Snabbare rörelse
mäter vi som högre temperatur.
6. Vid –10 °C ligger vattenmolekylerna nästan helt stilla i ett speciellt mönster. De darrar lite fram
och tillbaka. Vid 0 °C börjar de röra sig lite mer och glida runt varandra – isen övergår till en
vätska. Molekylernas rörelser ökar mer och mer upp till 100 °C. Då får de en sådan fart att de kan
ta sig loss och lämna vattnet och bilda vattenånga.
TESTA DIG SJÄLV
3.1
1. Blandningar är vanligast.
2. Vatten, lacknafta och aceton är olika lösningsmedel.
3. I en mättad lösning har det lösts så mycket av ett ämne att det inte går att lösa mer. Om man ändå
försöker lösa upp ännu mer blir det en rest kvar på botten.
4. Sockret delar upp sig i små partiklar, sockermolekyler, som blandar sig med tevattnet.
Sockermolekylerna fördelar sig jämt i hela koppen.
5. Man leder in havsvatten i bassänger och låter vattnet avdunsta. Kvar blir saltet.
6. Kalkvatten är en uppslamning där man kan se bitar av ämnet, det ser grumligt ut. Socker i vatten
är en lösning. Därför är det en klar vätska. En emulsion är en finfördelad vätska i en annan vätska,
som exempelvis vispgrädde (en emulsion av fett och vatten).
7. Vårt blod är ett exempel på en vätska som både är lösning och emulsion.
TESTA DIG SJÄLV
3.2
1. Uppslamningar kan separeras genom dekantering, filtrering eller centrifugering.
2. Ämnen i en lösning kan separeras genom destillation.
3. Ingenting, både det lösta ämnet och vätskan passerar genom filterpapperet.
4. Man upphettar lösningen så att vätskan kokar bort och kvar får man det lösta ämnet. Ångan kyls
ner så att man får tillbaka ren vätska. Metoden kan användas för att separera olika ämnen i en
lösning, exempelvis de olika ämnena i råolja.
5. De metoder man använder för att separera blandningar fungerar inte när man vill dela upp
atomslagen i en kemisk förening. För att göra det krävs kemiska reaktioner.
2
KEMI: Lärarhandledning
6. Man har en fast del och en rörlig del som vandrar förbi den fasta. Vissa ämnen följer lättare med
den rörliga delen, som till exempel kan vara vatten. Andra ämnen fastnar lätt i den fasta delen,
som till exempel kan vara papper. Om man gör kromatografi på en färg delas färgen upp i sina
komponenter.
• Man kan centrifugera mjölken i en mjölkseparator för att separera bort fettet. Om man får bort allt
fett får man kvar skummjölk, som är en lösning. Den kan man destillera för att separera vattnet
från de lösta ämnena. Man kan också använda kromatografi som separerar fram mjölkprotein,
mjölksocker, kalcium, vitaminer, med mera.
TESTA DIG SJÄLV
4.1
1. Luft består av kväve 78 %, syre 21 %, koldioxid 0,04 % och ädelgaser 0,93 %.
2. Kväve är den gas som det finns mest av i luften, 78 %.
3. 1/5, eller 21 %, av luften består av syre.
4. Atmosfären tar slut på cirka 100 km höjd.
5. Luftens densitet minskar ju högre upp man kommer. Det blir alltså glesare mellan molekylerna ju
högre upp man kommer.
6. Stoppa ner en glödande sticka i gasen som ska testas. Om det är syre börjar stickan brinna.
7. I kvävgas- och syrgasmolekylerna sitter atomerna ihop två och två. Därför skriver man formlerna
N2 respektive O2.
8. Syrgas används bland annat vid järnframställning och papperstillverkning, i syrgasmasker och vid
svetsning. Kväve används exempelvis till kylning och i handelsgödsel.
9. Först kyler man ner luften så att den blir flytande. Sedan utnyttjar man luftgasernas olika
kokpunkter för att skilja dem åt genom destillation.
• Eftersom saker brinner bättre ju mer syre det finns så skulle det vara gott om explosionsartade
bränder. Om några djur överhuvudtaget skulle överleva alla eldar så skulle de ha mindre lungor än
nu eftersom det skulle vara lättare att få tillräckligt med syre ur luften. Om det utvecklades
människor, skulle de ha svårt att utnyttja elden på ett reglerat sätt, eftersom allt skulle brinna
fortare och lättare.
TESTA DIG SJÄLV
4.2
1. Ozonmolekylen består av tre syreatomer och skrivs O3.
2. Freoner används bland annat som drivgas i sprayburkar och som kylmedel. Nu är de dock
förbjudna i Sverige.
3. Ozon vid marken bildas när bilavgaser utsätts för solljus och vid elektriska urladdningar. Det är
skadligt för växter och djur. Hos människor orsakar ozon lungskador.
4. Ozonskiktet är ett lager av ozon som finns på flera mils höjd i atmosfären. Där tar ozonet bort det
mesta av det skadliga ultravioletta ljuset från solen.
5. Ozonlagret förstörs av freonutsläpp och av de avgaser som jetplan släpper ut.
6. Solljuset slår sönder syremolekyler till fria syreatomer som sedan kan slå sig ihop med en annan
syremolekyl och bilda ozonmolekyler med tre syreatomer, O3. Men solljuset bryter också sönder
ozonmolekyler i samma takt. På det viset blir det balans i mängden ozon.
• Redan när man tillverkar olika produkter måste man tänka på vart ämnena som vi använder tar
vägen och vilken effekt de har på naturen. Inga atomer försvinner, de sprids bara eller dyker upp i
nya kemiska föreningar. De nya föreningarna kan ibland vara giftigare än ursprungsämnena.
TESTA DIG SJÄLV
4.3
1. Helium, neon, argon och krypton är de vanligaste ädelgaserna.
2. Ädelgaser vill inte bilda kemiska föreningar med andra ämnen. Det är därför de kallas ädla.
3. Neon används i neonskyltar, argon i glödlampor och helium i ballonger.
4. Skyddsgaser kan exempelvis användas vid svetsning och tillverkning av läkemedel, då materialet
inte tål syre och kväve.
• Gasen bryr sig inte om att reagera med andra ämnen. Man kan jämföra det med att människor som
är lata och tröga inte "orkar" reagera.
TESTA DIG SJÄLV
4.4
1. Oxider är föreningar som innehåller syreatomer.
3
KEMI: Lärarhandledning
2. Koldioxid, kväveoxider och svaveloxid finns i luften.
3. En förbränning är en kemisk reaktion där ett ämne förenar sig med syre.
4. Koldioxid bildas när ämnen som innehåller kol får brinna – till exempel ved, olja, stenkol och
papper. Koldioxid bildas också när vi förbränner maten i våra kroppar.
5. Gröna växter kan omvandla koldioxid till socker och syre med hjälp av solljuset. Den processen
kallas fotosyntes.
6. Koldioxidmängden ökar eftersom vi förbränner stora mängder kol och olja. Dessa fossila bränslen
har legat dolda i jordskorpan och ingår inte i det naturliga kretslopp vi har idag. Det ställer till
bekymmer trots att koldioxid inte är giftigt. Koldioxiden ökar nämligen växthuseffekten. Det
betyder att klimatet kan komma att förändras på jorden.
7. Biobränslen är bränslen som är tillverkade av trä eller andra växter. Medan träden växer tar de upp
koldioxid från luften och när de används kommer koldioxiden tillbaka till luften. Den totala
mängden koldioxid ökar alltså inte och därför bidrar biobränslen inte till växthuseffekten.
• Avgaserna väger mycket mer. När bensinen förbränns i motorn slår atomerna i bensinen ihop sig
med syreatomer från luften och bildar oxider. Atomerna från bensinen tillsammans med
syreatomerna från luften kommer att väga mer än vad bensinen gjorde från början.
TESTA DIG SJÄLV
4.5
1. Luftföroreningarna började öka kraftigt vid industrialismens genombrott eftersom man började
elda med kol. Det var för ungefär 200 år sedan.
2. Surt regn orsakas främst av svaveldioxid och kväveoxider.
3. Smog är en blandning av dimma, rök och andra luftföroreningar.
4. I storstäderna där utsläppen är som störst.
5. Kolmonoxid bildas vid förbränning om det är ont om syre. Kolmonoxiden är giftig eftersom den
hindrar syret att transporteras med de röda blodkropparna. Man kvävs.
6. När man förbränner fossila bränslen så bildas både svaveldioxid och kväveoxider. De reagerar
med vatten i luften och bildar syror som kommer ner med regnet. Det sura regnet skadar
byggnader och grundvattnet genom att syrorna lakar ut metaller som sedan kommer ner i vårt
dricksvatten. Även växter och djur skadas av försurningen.
• Man kan mycket enkelt avlägsna sot och småpartiklar i luftutsläppen med hjälp av filter. Men
oxiderna fastnar inte i några filter eftersom molekylerna är så små.
TESTA DIG SJÄLV
4.6
1. 90 % av alla atomer på jordytan är väteatomer.
2. Det är lätt och billigt att framställa. Men väte är brandfarligt och olyckor kan lätt hända.
3. Väte används bland annat vid margarintillverkning, som raket- och bilbränsle samt vid tillverkning
av ammoniak och saltsyra.
4. Båda är grundämnen, gaser och sitter samman två och två i molekylerna. Kväve kväver eld medan
väte brinner.
• Väte är så lätt så att jordens gravitation inte räcker till för att hålla kvar gasen. Solen och Jupiter är
mycket större himlakroppar och har därför den gravitation som krävs för att hålla kvar vätet.
TESTA DIG SJÄLV
5.1
1. Cirka 67 % av kroppen består av vatten.
2. Vi förbrukar ungefär 200 liter varje dag.
3. Ungefär 97 % av vattnet är saltvatten i haven, 2 % finns i isar, 0,6 % i grundvatten och någon
hundradels procent i sjöar.
4. Båttransporter på hav, sjöar och kanaler är energisnåla och billiga. Golfströmmen i Atlanten
transporterar värme till vår kontinent och blodet transporterar näringsämnen i vår kropp.
5. Vatten är ju en bristvara redan nu på jorden. Om bara 10 % av jorden var vatten skulle den bristen
vara ännu mycket större, och vi skulle kanske kriga med varandra för att komma åt vattnet. Genom
historien har det varit lättare att färdas och transportera saker på havet än på land. Transporterna
skulle därför ha varit svårare och det skulle ha tagit längre tid att utforska jorden. Fortfarande idag
sker många viktiga transporter med fartyg – till exempel oljetankers – och det skulle inte fungera
om det fanns så lite hav. Eftersom stora delar av landområden skulle ligga väldigt långt från hav,
4
KEMI: Lärarhandledning
är det troligt att det skulle finnas mer öknar, och de skulle göra det ännu svårare att färdas över
land.
TESTA DIG SJÄLV
5.2
1. Vattenmolekylen består av två väteatomer och en syreatom. Formeln är H2O.
2. Vatten är som tyngst vid +4 °C.
3. I en isbit ligger vattenmolekylerna i ett glest mönster och tar större plats än i flytande vatten. En
liter is blir därför lättare än en liter flytande vatten eftersom isen innehåller färre antal molekyler.
Det medför att is flyter i vatten. Om det inte var så skulle isen samlas på botten av alla
vattensamlingar och det skulle döda alla djur och växter under vintern.
4. Ytspänning är att vatten verkar ha en seg hinna eftersom molekylerna håller ihop. Ytspänningen
märker vi till exempel när en insekt springer på vattenytan, eller när vi ser en vattendroppe hänga
under vattenkranen.
5. Vattnet är trögt att värma och kyla. Det krävs mycket värme för att höja temperaturen på vatten
och det tar lång tid innan varmt vatten svalnar.
6. Kapillärkraften gör att vattnet sugs upp genom de smala gångarna i jorden. Sedan sugs det upp
genom växternas rötter, vidare genom de tunna rören i stammen och fram till växtens blad.
• Varje dag som det har varit varmare än 30 minusgrader har du haft glädje av Golfströmmen och
vattnets höga värmekapacitet. Den höga värmekapaciteten har kanske också hjälpt till att ge värme
i elementen, antingen hemma eller i skolan. Varje gång du har ätit eller använt något som kommer
från växter har du faktiskt haft nytta av kapillärkrafterna i vattnet, som ser till att växterna får
tillräckligt med vatten. Om du har åkt skridsko på en sjö har du haft nytta av isens låga densitet,
och om du har blåst såpbubblor var vattnets ytspänning viktig. Om inte vattnet hade sina speciella
egenskaper skulle det antagligen aldrig ha kunnat utvecklas några mer avancerade livsformer på
jorden, så då skulle du inte ha funnits.
TESTA DIG SJÄLV
5.3
1. När en vätska övergår till en gas utan att koka kallas det avdunstning.
2. Vattenånga är osynlig.
3. Vissa vattenmolekyler rör sig lite snabbare än andra och får så hög fart att de kan ”slita sig loss”
och bli till vattenånga fastän det inte är 100 °C.
4. Vatten i hav och sjöar avdunstar till vattenånga. Vattenångan kondenserar sedan till vatten som
regnar ner och rinner ut i sjöarna och haven igen.
5. Atomerna i vattenmolekylerna flyttas ständigt om och byggs in i nya ämnen. Det sker vid olika
kemiska reaktioner. Det är alltså inte samma vattenmolekyler som finns i kretsloppet idag som för
miljontals år sedan, utan atomerna byts ut hela tiden.
• Eftersom vatten rinner neråt samlas det mesta vattnet i djupa sänkor på jordklotet, det vill säga i
haven. Medan vattnet rinner dit löser det upp små mängder salt som finns i sten och jord. Det är
därför som havsvattnet är salt. Det enda vatten som inte är salt är regn eller snö som har fallit
ganska nyligen och inte har hunnit rinna till haven. I kalla områden kan nederbörden samlas i
glaciärer, som finns kvar under längre tid. Därför finns en stor del av sötvattnet i glaciärer.
TESTA DIG SJÄLV
5.4
1. Ytvatten är vatten från sjöar och vattendrag.
2. De fyra stegen vid rening av ytvatten: silning, flockning, filtrering och tillsats av bakteriedödande
medel.
3. De tre stegen vid avloppsrening är: mekanisk rening, biologisk rening och kemisk rening.
4. Om man använder ytvatten är det alltid förorenat och kanske skadligt.
5. För att ta bort sådant som kan skada naturen och för att vi återigen ska kunna dricka vattnet.
6. Se sidan 88 i grundboken (sidan 47–48 i lightboken).
• Vatten renas naturligt. Det filtreras genom sand, bakterier tar hand om föroreningar m.m.
Dessutom avdunstar vattnet som en del av vattnets kretslopp, och när det regnar ner är det alldeles
rent. Anledningen till att vi behöver reningsverk idag är att vi är så många som använder vattnet
att naturens egna reningsverk inte räcker till.
TESTA DIG SJÄLV
6.1
5
KEMI: Lärarhandledning
1.
2.
3.
4.
5.
6.
7.
•
Ett mineral är ett visst ämne (grundämne eller kemisk förening) som ingår i sten.
Syre, kisel och aluminium är de vanligaste atomslagen i sten.
Jorden kan delas upp i mineraljord och organisk jord.
Mineraljorden består av små stenkorn.
Den organiska jorden bildas av döda växter och djur som förmultnat.
Vatten löser upp näringsämnen som finns i jorden. Näringsämnen följer med vattnet in i växterna.
Se figur sidan 99.
Eftersom det inte finns liv på månen finns där bara mineraljord.
TESTA DIG SJÄLV
6.2
1. De viktigaste atomslagen är kol, syre, väte, kväve, fosfor och kalium.
2. Kol-, syre- och väteatomer finns i vatten och luft.
3. Kväve-, fosfor- och kaliumatomer finns i jorden.
4. Kvävets kretslopp betyder att kväveatomerna används om och om igen.
5. Se figur sidan 101.
TESTA DIG SJÄLV
6.3
1. Handelsgödsel innehåller lättlösliga näringsämnen som man tillverkat i fabriker.
2. Förr odlade man bara sådant som kom till användning på gården eller i närområdet. Avfall togs
om hand och spreds på åkrarna. Näringsämnena kom på så vis tillbaka till åkern i form av bland
annat kogödsel och avföring.
3. Handelsgödseln ger större skördar på sämre mark. Men användning av handelsgödsel kan också
leda till övergödning av sjö och mark.
4. Övergödning betyder att det blir för mycket näringsämnen på fel ställen. De lättlösliga
näringsämnena i handelsgödsel följer lätt med regnvatten och hamnar utanför åkrarna och i sjöar
och vattendrag. Där orsakar näringsämnena igenväxning med bakterier och alger.
5. Dels kan man kontrollera noga så att man inte lägger på för mycket gödning på åkern. Dels kan
man se till att åkern är grön året om, det vill säga att det alltid växer något på åkern som binder
näringsämnena.
6. Egentligen borde komposten läggas tillbaka på åkern. Först då sluter man kretsloppet.
• Inte ens experterna vet precis hur man ska göra. Det bästa är antagligen om man kan kombinera
gamla och nya metoder. Till exempel försöker man återvinna så mycket och använda stallgödsel
och gröngödning. Samtidigt utnyttjar man moderna mätmetoder för att ta reda på vilka
näringsämnen som jorden behöver och modern teknik för att sprida dem och se till att de stannar
på rätt ställe.
TESTA DIG SJÄLV
7.1
1. Det finns syror i exempelvis citroner, filmjölk och ättiksgurka.
2. Alla syror smakar surt.
3. Baser är motsatsen till syror.
4. Natriumhydroxid och bikarbonat är exempel på baser.
5. En neutral lösning är varken sur eller basisk.
6. Lackmus, BTB och fenolftalein är olika indikatorer.
7. Indikatorer ändrar färg beroende på om vattenlösningen är sur eller basisk. På så sätt kan man ta
reda på om en lösning är sur, basisk eller neutral.
8. Om pH är mindre än 7 är det surt. Om pH är högre än 7 är lösningen basisk. Om det är precis 7
kallas lösningen neutral.
9. Det är viktigt att blodet har rätt pH-värde, cirka 7,4. Om det avviker skadas framförallt hjärnan
och nervsystemet.
10. Man kan motverka surt regn genom att hälla baser där det har blivit försurat. Den bas man oftast
använder är kalk.
TESTA DIG SJÄLV
7.2
1. En atom är byggd av protoner och elektroner.
2. En jon är en atom som har lämnat ifrån sig eller tagit upp elektroner.
3. Hydroxidjonen är sammansatt jon.
6
KEMI: Lärarhandledning
4. En atom har lika många protoner och elektroner och är därför oladdad. En jon har olika många
protoner och elektroner och är därför laddad.
5. Magnesiumjonen skrivs Mg2+.
TESTA DIG SJÄLV
7.3
1. Vätejonen, H+, finns i alla syror.
2. Vanliga syror är citronsyra, kolsyra och fosforsyra i läsk och saltsyra i magsäcken.
3. Saltsyra, svavelsyra och salpetersyra.
4. En stark syra är surare än en svag syra, även om de är lika mycket utspädda. Det beror på att precis
alla syramolekyler i den starka syran delas upp och bildar vätejoner. I en svag syra är det bara en
del molekyler som delas upp.
5. I en koncentrerad syra finns fler syramolekyler i varje liter. Man har inte spätt ut den med vatten.
En koncentrerad syra är surare än en utspädd syra.
6. Saltsyra är gasen HCl som är upplöst i vatten. Då är den en färglös vätska med stickande lukt.
Svavelsyra (H2SO4) är färglös, trögflytande och luktlös. Salpetersyra (HNO3) är färglös och
luktfri. Den gulfärgar proteiner, till exempel i naglar. De starka syrorna används till att tillverka
handelsgödsel, färgämnen, plaster och läkemedel.
7. När en väteatom förvandlas till en vätejon gör den sig av med sin enda elektron. Kvar blir bara en
ensam, mycket liten, proton.
8. Citronsyra är en svag syra. Den är inte jättesur ens när den är koncentrerad. En stark syra är sur
även när den är ganska mycket utspädd. Att en syra är stark är en egenskap hos själva
syramolekylen (hur gärna den vill delas upp och bilda vätejoner). Att syran är koncentrerad talar
istället om att det finns många syramolekyler per liter.
9. Ja, det kan den. Om man späder en stark syra tillräckligt mycket kommer den få högre pH än en
svag syra.
TESTA DIG SJÄLV
7.4
1. Tvättmedel, diskmedel och bakpulver är exempel på produkter som innehåller baser.
2. Baser tar upp vätejoner och bildar hydroxidjoner.
3. Mängden hydroxidjoner (OH–) avgör hur basisk lösningen är.
4. Det är förmågan att bilda hydroxidjoner som avgör basens styrka. I starka baser bildar varje
molekyl minst en hydroxidjon, i svaga baser är det bara en del molekyler som bildar
hydroxidjoner.
5. Natriumhydroxid är en stark bas, bikarbonat är en svag bas.
6. Natriumhydroxid används som propplösare, för att ta bort färg och vid tillverkning av tvål och
pappersmassa.
7. Basen kalciumkarbonat används vid kalkning av försurade sjöar, bikarbonat används mot
halsbränna.
8. Natriumhydroxiden bildar tvål med det fett som finns i proppen, så att den kan lösas upp med
vatten.
9. Ammoniaken, NH3, löser sig i vatten. Sedan reagerar en del av molekylerna enligt formeln: NH3 +
H2O NH4+ + OH–. Hydroxidjonerna gör lösningen basisk.
TESTA DIG SJÄLV
7.5
1 Sura lösningar har pH-värden under 7.
2. Basiska lösningar har pH-värden över 7.
3. Det som bestämmer pH-värdet är typen av syra eller bas samt koncentrationen på lösningen.
4. Syrorna är inte lika starka, det vill säga det bildas inte lika många vätejoner i de två lösningarna.
5. En pH-indikator ändrar färg beroende på om den doppas i en sur eller basisk lösning. Det beror på
att den själv fungerar som syra och bas. Om man exempelvis doppar den i en sur lösning, där det
finns gott om vätejoner, tar den upp en vätejon och får då en annan färg.
6. Juicen har lägre pH och därför flest antal vätejoner. Den har 100 gånger
(10 • 10) fler vätejoner.
TESTA DIG SJÄLV
7.6
1 En buffert är en blandning som kan dämpa pH-förändringar när man tillsätter en syra eller en bas.
7
KEMI: Lärarhandledning
2. Buffertar är viktiga i bland annat blodet och marken.
3. En buffert innehåller både en bas och en syra. Om man häller i en syra så tar buffertens bas hand
om den, om man häller i en bas så tar buffertens syra hand om den.
4. I stora delar av Europa är marken rik på kalksten. Kalksten kan buffra mot syror, och därför är de
områden inte så känsliga för surt regn. De flesta delarna av Sverige har ont om kalksten och klarar
därför inte av surt regn lika bra.
• Nej, det kan man inte. Till slut kommer alla basmolekyler i bufferten som kan ta emot vätejoner
att vara "upptagna". Om man då fortsätter att hälla i syra kan vätejonerna inte tas om hand utan
pH-värdet sjunker.
TESTA DIG SJÄLV
8.1
1. Salter består av positiva metalljoner och en negativ jon från en syra. De är fasta, kristallformiga
ämnen. Många är vita men de kan ha andra färger.
2. Natriumklorid är vanligt koksalt som vi använder i maten. Kalciumsulfat är gips, som används
som byggnadsmaterial, i förband och i prydnader. Natriumvätekarbonat används som bakpulver
och mot halsbränna.
3. Hydroxidjonen och vätejonen bildar vatten. Den positiva metalljonen från basen och den negativa
jonen från syran bildar ett salt.
4. Olika metalljoner ger olika färg åt en låga. Det kan användas i fyrverkerier eller för att ta reda på
vilka metalljoner som finns i exempelvis en lösning.
5. När man tillsätter koksalt till en lösning med silverjoner bildas en fällning av silverklorid. Ag+ +
Cl– AgCl. Silverklorid är ett svårlösligt salt.
TESTA DIG SJÄLV
8.2
1. Metalloxider är uppbyggda som jonföreningar mellan en metall och syre.
2. När järn brinner bildas järnoxid. Det bildas röd järnoxid (Fe2O3) om järn brinner i syrgas, och
svart järnoxid (Fe3O4) om järn brinner i luft.
3. De två typerna av järnmalm heter blodstensmalm och svartmalm.
4. Rubiner och safirer består av aluminiumoxid.
5. Metalloxider är fasta jonföreningar. Icke-metalloxider är små molekylföreningar som har låg
kokpunkt och därför oftast är gaser.
6. Den röda järnoxiden Fe2O3 ingår i blodstensmalm (hematit). Den svarta järnoxiden Fe3O4 ingår i
svartmalm (magnetit).
7. När man löser en metalloxid i vatten blir det en basisk lösning. Jonen O2- är en stark bas som tar en
vätejon från en vattenmolekyl och bildar hydroxidjoner.
• Det beror på att aluminium bildar en skyddande hinna av aluminiumoxid när det kommer i kontakt
med syre.
TESTA DIG SJÄLV
8.3
1. Granit, gnejs och sandsten är vanliga bergarter i Sverige.
2. Syre, kisel och aluminium är de vanligaste atomslagen i sten.
3. Kvarts och fältspat är vanliga mineraler.
4. De flesta mineraler är uppbyggda av joner.
5. Ett mineral är ett visst ämne (grundämne eller kemisk förening) som ingår i sten.
6. En bergart är en blandning av olika mineraler.
7. Det finns magmatiska, sedimentära och metamorfa bergarter. Magmatiska bergarter är smälta
mineraler som har stelnat. Sedimentära bergarter är gruskorn och djurskelett som har packats ihop.
Metamorfa bergarter är sten som har pressats ner i jordens inre och förvandlats.
TESTA DIG SJÄLV
9.1
1. Kolföreningar kan man bland annat i hitta mat, kläder, bränslen, plaster, växter och djur.
2. Organiska ämnen är ämnen som innehåller kolatomer. Organisk kemi handlar om sådana ämnen.
3. De tre vanligast formerna av kol är diamant, grafit och amorft kol.
4. Grafit finns exempelvis i smörjmedel, elektroder och blyertspennor. Diamant finns i smycken,
glasskärare och borrar.
8
KEMI: Lärarhandledning
5. I diamant bildar kolatomerna en kristall där alla atomer sitter hårt ihop i ett stabilt nätverk.
Kolatomerna i grafit sitter däremot ihop i platta lager där lagren kan glida över varandra. I amorft
kol sitter kolatomerna huller om buller.
6. Träkol består till största delen av amorft kol där kolatomerna sitter huller om buller. Det kan
framställas genom att trä hettas upp utan tillgång till syre.
7. I fullerener bildar kolatomerna 5- och 6-hörningar som sitter ihop i en molekyl som liknar en
fotboll. Nanorör är smala rör av kolatomer. Karbyner är kedjor av kolatomer där varje kolatom
sitter ihop med sin granne med flera bindningar.
TESTA DIG SJÄLV
9.2
1. Kolatomen kan binda fyra andra atomer samtidigt. Kolatomerna kan dessutom kopplas ihop i
långa kedjor. Tack vare de egenskaperna kan kol bilda enormt många olika föreningar.
2. De enklaste kolföreningarna innehåller bara kol- och väteatomer.
3. De fyra första kolföreningarna i alkanserien är metan, etan, propan och butan. Molekylformlerna
är CH4, C2H6, C3H8 respektive C4H10. Strukturformler finns på sidorna 156-159 i grundboken
(sidan 83 i lightboken).
4. Metan används till bränsle och etan till plasttillverkning. Propan och butan säljs som gasol och
används som bränsle.
5. Gaserna i alkanserien har 1–4 kolatomer medan vätskor har 5–16 kolatomer. När alkanerna har
17 kolatomer eller fler är de fasta ämnen.
6. En alkan med 14 kolatomer har 30 väteatomer.
7. Isomerer är molekyler som har samma molekylformel men olika strukturformler. Man kan också
säga att de innehåller precis samma atomer men atomerna sitter ihop i lite olika ordning.
• Det kan finnas fem isomerer av hexan (C6H14). Om du har fått fler än fem är det några som blir
likadana om du vänder på dem. (Namnet på de fem isomererna är: hexan, 2-metylpentan, 3metylpentan, 2,2-dimetylbutan, 2,3-dimetylbutan. Din lärare kan förklara och rita strukturformler
för de fem isomererna.)
TESTA DIG SJÄLV
9.3
1. En dubbelbindning är när två atomer binds ihop med hjälp av två bindningar istället för en.
2. Acetylen och etyn är de två namnen på det kolväte som används vid svetsning.
3. Alkener är kolväten som innehåller en dubbelbindning. Alkyner har en trippelbindning.
4. Omättade kolväten har minst en dubbel- eller trippelbindning mellan två kolatomer. Både alkener
och alkyner är omättade. I mättade kolväten finns det bara enkelbindningar mellan kolatomerna.
Alkaner är alltså mättade.
5. I ”meten” skulle det bara finnas en enda kolatom, och därför kan det inte finnas någon
dubbelbindning mellan två kolatomer som ändelsen -en säger.
TESTA DIG SJÄLV
9.4
1. Stenkol är en blandning av rent kol (amorft kol) och omättade kolväten.
2. Råolja består till största delen av mättade kolväten.
3. Den kallas oljeraffinaderi. Där delas råoljan upp i olika grupper av kolväten. Grupperna kallas
fraktioner.
4. Fossila bränslen är olja, stenkol och naturgas. De har bildats av döda växter och djur som för
miljontals år sedan samlades på botten av sjöar, hav och träskmarker. Brist på syre, hård
sammanpressning och värme förvandlade dem långsamt till olika kolväten.
5. Torv är växter som bara delvis förmultnat men inte pressats samman på samma sätt som
exempelvis stenkol. På mycket lång sikt kan torven omvandlas till stenkol.
6. Metoden bygger på att kolvätena i oljan har olika kokpunkter. Därför är destillation en bra
separationsmetod. Eftersom man får flera olika fraktioner kallas den fraktionerad destillation.
7. Oktantal är ett mått på bensinens kvalitet. Bensinen jämförs med två olika kolväten – heptan med
oktantalet 0, och isooktan med oktantalet 100.
• Vi skulle inte ha sådana bilar, flygplan och fartyg som idag och inte sådana kolkraftverk som
används på många håll i världen. Historien från 1700-talet och framåt skulle se väldigt annorlunda
ut. Eftersom det inte fanns något stenkol, skulle vi inte ha fått den industrialisering som började
då, utan världen skulle antagligen vara mycket mer "gammaldags". Antagligen skulle vi utveckla
9
KEMI: Lärarhandledning
andra energikällor, som vindenergi, solenergi och olika sorters kärnkraft. Kanske skulle de
energikällorna ha blivit betydelsefulla mycket tidigare än vår nuvarande värld. Men det skulle
också ha varit mycket svårare att få fram dem, när det inte fanns industrier av vår typ.
TESTA DIG SJÄLV
9.5
1. Alkoholmolekylen innehåller alltid minst en OH-grupp.
2. Metanol och etanol är de två enklaste alkoholerna. Metanol har en kolatom (CH3OH) och kallas
även träsprit. Etanol har två kolatomer (C2H5OH) och ingår i alkoholhaltiga drycker.
3. Metanol och glykol är två mycket giftiga alkoholer.
4. Etanolen i öl och vin uppkommer genom att jästsvampar förvandlar socker till alkohol och
koldioxid.
5. Alkoholer kan framställas av växter och behöver därför inte ta slut. Dessutom ökar dessa bränslen
inte koldioxidhalten i luften.
6. Glykol och glycerol är två exempel på alkoholer som innehåller mer än en OH-grupp.
7. Butanol består av 4 kolatomer mättade med väte och en OH-grupp; CH3–CH2–CH2–CH2–OH
(C4H9OH)
• Att det finns två isomerer av propanol beror på att OH-gruppen antingen kan sitta på den mittersta
kolatomen eller den yttersta.
H H H
| | |
H—C—C—C—OH
| | |
H H H
H OH H
| | |
H—C—C—C—H
| | |
H H H
TESTA DIG SJÄLV
9.6
1. Äppelsyra, citronsyra och vinsyra finns i frukter. Ättiksyra finns i gurkinläggningar och
stearinsyra finns i stearinljus.
2. Stearin är en blandning av stearinsyra med 18 kolatomer och palmitinsyra med 16 kolatomer.
3. Myrsyra (HCOOH) finns i myror och nässlor. Etansyra (CH3COOH) finns i ättika och vinäger.
4. Vinäger görs av vin som får surna i kontakt med luftens syre. Då förvandlas alkoholen i vinet till
ättiksyra.
5.
O H H O
|| | | ||
C—C—C—C
| | | |
OH H H OH
TESTA DIG SJÄLV
9.7
1. En ester är en förening mellan en alkohol och en karboxylsyra.
2. Naturliga estrar finns bland annat i frukter, konstgjorda estrar finns i godis, läsk och glass.
3. En ester kan till exempel bildas genom att man låter ättiksyra regera med etanol. Då bildas estern
etyletanoat.
CH3COOH (syra) + C2H5OH (alkohol) CH3COOC2H5 (ester)
4.
H H O
H H
| | |
| |
H—C—C—C—O—C—C—H
| |
| |
10
KEMI: Lärarhandledning
H H
H H
CH3–CH2–COO–CH2–CH3.
Om din formel är spegelvänd jämfört med den ovan är den ändå rätt, men kemisterna brukar rita
den åt det här hållet.
TESTA DIG SJÄLV
10.1
1. Kolhydrater, fetter, proteiner och nukleinsyror är de ämnesgrupper som bygger upp allt levande.
2. Med biokemi menas livets kemi. Inom biokemin tittar man framför allt på de mycket stora
organiska ämnen som finns i levande organismer.
3. Socker, stärkelse och cellulosa är exempel på vanliga kolhydrater.
4. Energin i vår mat kommer ursprungligen från solen.
5. Vid fotosyntesen fångas solenergi in av växterna. I de gröna bladen omvandlas koldioxid från
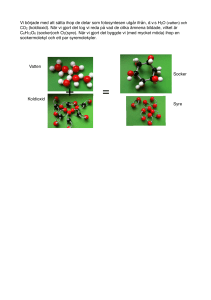
luften och vatten från marken till druvsocker och syrgas. Energin lagras i druvsockret. Formel för
fotosyntesen kan skrivas så här:
Koldioxid + vatten + solenergi druvsocker + syrgas
6 CO2 + 6 H2O + solenergi C6H12O6 + 6 O2
6. En enkel sockerart är en enstaka ”socker-byggsten”. Den innehåller oftast 6 kolatomer. Glukos
(druvsocker) och fruktos (fruktsocker) är exempel på enkla sockerarter.
7. "Dubbla sockerarter" består av två enkla sockermolekyler som kopplats ihop. Sackaros (rörsocker)
och laktos (mjölksocker) är exempel på dubbla sockerarter.
8. Stärkelse och cellulosa består av tusentals druvsockermolekyler som kopplats ihop i långa kedjor.
Det som skiljer de två kolhydraterna är hur druvsockermolekylerna kopplats samman. Stärkelse är
växtens energilager, medan cellulosa används som stödjande ämne (fibrer) i växten.
9. När en glukosmolekyl reagerar med syre i kroppen bildas sex koldioxidmolekyler och sex
vattenmolekyler.
• För att få energi när man anstränger sig förbränner kroppen druvsocker. Det går snabbt. Därför får
man snabbt extra energi om man äter druvsocker. Stärkelsen i pastan kan sönderdelas till
druvsocker och sedan förbrännas, men det tar längre tid. Men det gör också att energin i pastan
räcker under längre tid. Därför passar den bra till ett maratonlopp.
TESTA DIG SJÄLV
10.2
1. Kroppens överskottsenergi lagras som fett. Fettet blir ett energilager men fungerar också som
värmeisolering och ”stötdämpare”. Fetter bygger även upp cellernas membraner och används vid
hormontillverkning.
2. I växternas frön hittar man växtfetter. Exempel är sojabönor, oliver, raps- och linfrön.
3. Ämnen som lätt blandar sig med vatten kallas vattenälskande. De ämnen som inte gillar vatten
kallas vattenavvisande.
4. Fettmolekylen är en ester av alkoholen glycerol och tre fettsyror (se bild på sidan 192 i
grundboken, sidan 100 i lightboken). Fettsyrorna kan vara av många olika slag.
5. I mättade fetter finns det bara enkelbindningar mellan kolatomerna i fettsyrorna. I omättade fetter
finns det en eller flera dubbelbindningar. Omättade och fleromättade fetter är nyttigare för oss.
Sådana fetter finns det gott om i växter. Djurfetter är oftare mättade.
6. Den feta känslan beror på att ämnena innehåller långa kolvätekedjor. Sådana molekyler vill inte
gärna blanda sig med vatten. Fetter, fettsyror och oljor (kolväten) är några exempel.
7. En del fettmolekyler i smör kan vara en ester av glycerol och tre smörsyramolekyler. De ser ut
som modellen i grundboken sidan 192, men med tre smörsyramolekyler på fettsyrornas platser.
Men smörsyra är inte den enda fettsyran i smör, utan bara en liten del. Den vanligaste fettsyran i
smör är oljesyra, som har 18 kolatomer och en dubbelbindning.
• Det får plats mer energi i 1 gram fett än i 1 gram stärkelse. Därför kan man spara mer energi i fett
utan att det väger så mycket. Men det är enklare att tillverka stärkelse och det går fortare att få
fram energin ur stärkelsen. Eftersom djur behöver röra på sig (för att få mat eller fly undan från
rovdjur) är det bra om de inte väger så mycket. Därför lagrar de energin som fett. Växter behöver
inte röra sig, utan de kan använda stärkelse. Undantaget är växternas frön. För att fröna ska kunna
spridas lång väg är det bra om de väger mindre, och därför lagrar de sin energi som fett.
11
KEMI: Lärarhandledning
TESTA DIG SJÄLV
10.3
1. Kött, fisk, ägg, ost och bönor innehåller mycket proteiner.
2. Byggstenarna i proteinerna kallas aminosyror. Ett protein består av en lång kedja av olika
aminosyror.
3. Proteinerna byggs upp av 20 olika aminosyror som kopplas ihop i långa kedjor, som kan bestå av
flera hundra aminosyror. Proteinet får olika form beroende på vilka aminosyror som ingår. En del
proteiner ser ut som ett dragspel, andra som långa spiraler. Formen avgör proteinets funktion i
kroppen.
4. Alla enzymer är proteiner. Det är de som sköter om alla kemiska reaktioner i kroppen. Proteinet
hemoglobin sköter transporten av syre i kroppen, andra proteiner bygger upp kroppens muskler.
5. Om proteinerna värms så koagulerar de – proteinet klumpas ihop och stelnar. Det händer till
exempel när du kokar ägg eller om du råkar tvätta en ylletröja för varmt.
6. DNA är en nukleinsyra som finns i alla celler. Det fungerar som ett slags ritning för tillverkningen
av alla proteiner som behövs i kroppen.
7. Essentiella (nödvändiga) aminosyror är sådana aminosyror som kroppen inte kan framställa själv.
Man måste därför få i sig dem med maten. 9 av de 20 aminosyrorna är essentiella.
8. Fett och kolhydrater innehåller inget kväve, vilket alltid måste ingå i proteinerna.
• Enzymerna styr de kemiska reaktionerna i kroppen. Vissa sönderdelar ämnen, andra bygger upp
ämnen. För att kunna styra vilka reaktioner som ska ske i kroppen måste enzymerna kunna
”stängas av” och ”slås på”. På så sätt kan reaktionerna anpassas till kroppens behov vid ett visst
tillfälle.
TESTA DIG SJÄLV
10.4
1. Vitaminer är en grupp små organiska ämnen som kroppen behöver små mängder av för att vi ska
må bra.
2. Mineralämnen är oorganiska ämnen som kroppen behöver för att vi ska må bra.
3. En del vitaminer fungerar som medhjälpare till enzymer, medan andra är råvaror för tillverkningen
av olika ämnen i kroppen. Vitaminer skyddar också mot så kallade fria radikaler i kroppen.
4. Fria radikaler är ”trasiga” molekyler som kan orsaka skador på andra molekyler i kroppen. A- Coch E-vitaminer och mineralämnet selen kan förhindra deras skadliga effekt.
5. Mineralämnena kalcium och fosfor behövs för att bygga upp skelettet. Järn behövs för att
hemoglobinet i blodet ska fungera. Selen skyddar mot fria radikaler.
6. A-vitamin behövs för att tillverka ljusmottagarna i ögat. Om man äter för lite A-vitamin fungerar
ljusmottagarna dåligt och man får svårt att se i svagt ljus.
• Varje vitamin har sina bestämda funktioner och behövs bara i liten mängd. Om man är sjuk av
någon annan anledning än vitaminbrist kan inte extra vitaminer göra någon nytta.
TESTA DIG SJÄLV
10.5
1. Smuts består till största delen av feta ämnen eller små partiklar som är inbäddade i fett.
2. Vatten kan inte lösa feta ämnen eftersom de är vattenavisande. Utan tvål blir alltså sådan smuts
kvar på kroppen.
3. Tensiderna har en vattenälskande del och en fettälskande del. Den fettälskande delen kan tränga in
i fettet. Den vattenälskande delen vänds däremot utåt mot vattnet som ett skal. Det gör att de små
”smutspaketen” kan sköljas bort med tvättvattnet. (Se bild på sidan 200 i grundboken, sidan 105 i
lightboken.) Tensider minskar också vattnets ytspänning och gör på så sätt vattnet ”våtare”.
4. Enzymer ser till att fläckar som innehåller proteiner sönderdelas.
5. Tensiderna bäddar in det feta margarinet och vänder sin vattenälskande del utåt. Då kan margarin
och tensider tillsammans sköljas bort av vattnet. Enzymerna i tvättmedlet sönderdelar proteinet i
äggfläcken så att smådelarna sedan kan sköljas bort av vattnet. Om ändå inte allt går bort hjälper
blekmedlet till att göra fläcken osynlig.
TESTA DIG SJÄLV
10.6
1. Grundbeståndsdelen i nästan allt smink är en emulsion av fett och vatten.
2. Huden behöver fukt och tillverkar en egen ”fuktkräm” som kallas talg. Men när vi tvättar oss
tvättar vi bort talgen. Om man stryker på fuktkräm hålls fukten kvar mellan huden och krämen.
12
KEMI: Lärarhandledning
3. Puder och nagellack är inte några emulsioner.
4. Rengöringsmjölk är en tunn emulsion av flytande fett i vatten. Fettet i emulsionen löser upp det
fett som finns i sminket som sedan lätt kan sköljas bort.
5. Här får du själv välja bland de produkter som nämns på sidorna 204–207 i grundboken. Du kan
även titta på innehållsdeklarationen på några kosmetikaprodukter och försöka lista ut vad de
innehåller.
TESTA DIG SJÄLV
10.7
1. Antibiotika dödar främmande bakterier, medan cellgifter dödar kroppens egna celler som blivit
cancerceller.
2. Organiska lösningsmedel löser upp fetter i cellmembranen som skyddar cellerna. Effekten märks
tydligast i hjärnan.
3. Biologiska gifter stör ofta kroppens signalämnen.
4. Hygieniska gränsvärden talar om hur mycket det som mest får finnas av ett visst ämne eller en
blandning i arbetsmiljön. Det är ett mått på hur höga halter en människa kan utsättas för utan att
riskera skador.
5. Olika sjukdomar har olika orsaker och därför kan det inte finnas ett botemedel mot allt.
TESTA DIG SJÄLV
11.1
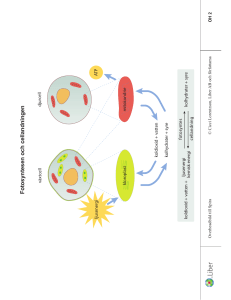
1. Det mesta av den kemiska energin har bildats med hjälp av energi från solljuset. Solenergin
omvandlas till kemisk energi vid fotosyntesen.
2. Snabb förbränning med öppen eld och långsam förbränning i kroppens celler (cellandningen).
3. I fotosyntesen använder växterna solenergin för att bygga energirika druvsockermolekyler av
koldioxid i luften och vatten från marken. Samtidigt bildas även syrgas. Formeln kan skrivas:
Koldioxid + vatten + solenergi druvsocker + syrgas
6 CO2 + 6 H2O + solenergi C6H12O6 + 6 O2
4. Kemisk energi är den energi som finns bunden i kemiska ämnen. När något brinner frigörs den
kemiska energin och omvandlas till ljus- och värmeenergi.
5. Tack vare enzymer kan förbränning ske i kroppen vid 37 °C. Enzymerna hjälper syremolekylerna
att reagera med sockermolekylerna. När druvsockret förbränns bildas koldioxid och vatten.
6. Kolatomer finns i atmosfären i form av koldioxid. Den fångas upp av växterna som med hjälp av
fotosyntesen omvandlar koldioxiden till olika kolhydrater. Kolhydraterna äts av djur och
människor och förbränns då till koldioxid vid cellandningen. Koldioxiden andas ut och kommer
åter till luften. Döda växter och djur sönderdelas av nerbrytare till koldioxid. Koldioxiden tas
sedan åter upp av växer varvid kretsloppet är fullbordat. Den koldioxid som sedan miljontals år
funnits bunden i fossila bränslen frigörs när vi eldar med dessa bränslen. (Se kretsloppsbild sidan
220 i grundboken).
• Det var speciella bakterier i haven som för flera miljarder år sedan började omvandla gasen
koldioxid till syrgas. Det var början på fotosyntesen. När växterna sedan utvecklades fortsatte de
omvandla koldioxid till syre.
TESTA DIG SJÄLV
11.2
1. Vid förbränning av fossila bränslen bildas alltid koldioxid och vatten, men ofta även giftiga gaser,
som kolmonoxid, svaveloxider och kväveoxider.
2. Förnybara energikällor är energikällor som inte tar slut, de förnyas ständigt. Exempel är vind,
vatten och biobränslen.
3. Sol-, vind-, kärn- och vattenkraft innebär inte någon förbränning.
4. Växthuseffekten orsakas av olika gaser i atmosfären som hindrar värme från att stråla ut från
jordklotet. Att växthuseffekten ökar beror på att vi släpper ut allt mer växthusgaser som koldioxid,
freoner och metan i atmosfären. Den ökande växthuseffekten kan medföra att medeltemperaturen
kommer att stiga på jorden.
5. Ved, träavfall, metanol och biogas är exempel på biobränslen. Den koldioxid som bildas då de
förbränns ökar inte mängden koldioxid i luften. Det beror på att den bildade koldioxiden tas upp
när nya biobränslen växer.
13
KEMI: Lärarhandledning
6. Med hjälp av en katalysator ser den till att förbränningen blir fullständig. Den innehåller en ”burk”
med en mycket stor yta av platina. Den ytan kan hålla föroreningsmolekyler så att de får en större
chans att träffa på syre.
• Transporterna och användningen av vätgas skulle vara besvärliga eftersom gasen är så brandfarlig.
Om den nästan helt ersatte andra energikällor skulle det bli så stora mängder vattenånga att det
troligen skulle påverka vårt väder. Dessutom skulle vätgasen ändå ta slut någon gång, så vi blev
tvungna att utnyttja förnybara källor istället.
TESTA DIG SJÄLV
11.3
1. Kemiska reaktioner behöver många gånger tillföras energi för att komma igång. Den energin
kallas aktiveringsenergi.
2. För att veden ska börja brinna behövs det aktiveringsenergi för att bindningarna i
cellulosamolekylerna ska börja brytas sönder. Aktiveringsenergin kan vara värmen från en
tändsticka.
3. Katalysatorn gör att kemiska reaktioner går snabbare. Det beror på att den minskar
aktiveringsenergin. Då kommer reaktionen igång lättare. Det kanske räcker med energin vid
rumstemperatur istället för den i en eldslåga.
TESTA DIG SJÄLV
11.4
1. Det behövs värme, bränsle och syre för att få en eld.
2. De tre sätten att släcka en eld är att kyla, kväva eller ta bort bränslet.
3. Antändningstemperaturen är den lägsta temperatur som räcker för att ett visst ämne ska kunna
antändas.
4. Det finns ämnen som kan antändas av sig själva. Det beror på att de reagerar långsamt med luftens
syre så att temperaturen stiger. Till slut uppnås antändningstemperaturen så att de börjar brinna.
För att förhindra detta kan man lägga ämnena i lufttäta kärl.
5. Flampunkt är den temperatur vid vilken ett ämne avger brännbara gaser.
6. Stålullen är finfördelad och kommer därför i kontakt med mycket luft som innehåller syre som kan
underhålla en förbränning. Stålklumpen är däremot kompakt.
TESTA DIG SJÄLV
12.1
1. Material är ämnen som vi kan tillverka saker av.
2. Material kan delas in i polymerer, keramer och glas, fibrer, kompositer och metaller.
3. Källsortering innebär att man sorterar sina sopor i exempelvis hushållet innan de slängs bort.
4. Om vi inte återvinner så kommer materialen så småningom att ta slut.
5. Återanvändning innebär att samma sak används flera gånger. Materialåtervinning innebär att man
gör nya saker av materialet.
6. Det kostar mycket pengar i början när industrin ska skaffa ny utrustning för att kunna utnyttja det
som återvunnits. Dessutom är det av stor vikt att återvinningsmaterialet inte är förorenat. Ofta
innebär återvinning också mycket transporter som belastar miljön. I längden tjänar man pengar på
att använda återvunnet material. Renheten får man lösa genom noggrann källsortering men även
maskiner som kan sortera och kontrollera. Transportproblemet får man lösa genom att ha
miljövänliga transportmedel, samordna transporterna och bygga små, lokala industrier.
TESTA DIG SJÄLV
12.2
1. Trä består av cellulosa och lignin.
2. Trä kan användas till papper, virke, ved och till framställning av rayon, celluloid och andra plaster
samt framställning av terpentin, harts och lack.
3. Papper är cellulosafibrer som pressats samman och formats till tunna ark.
4. Industrin har minskat sina utsläpp och släpper inte ut ligninet som förr. Det eldas istället upp i en
så kallad sodapanna för att få energi till pappersbruket. De kemikalier som används tas tillvara och
återanvänds i ett så kallat slutet system. Man har också slutat att använda klor vid blekningen.
Istället används syrgas.
5. Du ska beskriva hela vägen hur det går till att tillverka finpapper, från det man börjar med trä. Se
sidan 243–245 i grundboken.
14
KEMI: Lärarhandledning
•
Nu för tiden skulle vi säkert använda plast istället för papper i många fall. Fastän vi har papper har
plasten ändå tagit över många användningsområden där man använde papper för 100 år sedan.
Under medeltiden, innan man hade uppfunnit papper, använde man torkade djurhudar, pergament.
Det skulle man säkert ha fortsatt med om man inte hade kommit på papper. Kanske skulle vi
använda tyg också. Men om det inte fanns papper skulle antagligen böcker och tidningar vara
mycket dyrare och mer sällsynta.
TESTA DIG SJÄLV
12.3
1. Plast är konstgjorda polymerer.
2. En polymer är en jättemolekyl som består av massor med hopkopplade småmolekyler, så kallade
monomerer.
3. Polyeten byggs upp av etenmolekyler och används till plastpåsar, matfolie, mjuka flaskor, leksaker
och avloppsrör.
4. PVC är byggt av molekyler som liknar eten, men där en väteatom är utbytt mot en kloratom.
Plasten används till stuprör, fönsterkarmar, vattenledningsrör, golvmattor, slangar och som
isolering kring elkablar.
5. PET är en polyester och kan användas till läskedrycksflaskor och kläder.
6. Ibland kan man återanvända föremålen, till exempel hårda PET-flaskor. Plast kan också återvinnas
genom nersmältning och tillverkning av nya produkter, det vill säga materialåtervinning. Kemisk
återvinning är när man sönderdelar plasten till monomerer och sedan gör en ny plast eller andra
kemiska produkter.
7. Det beror på vilka saker du ser. En plaststol skulle förmodligen vara av trä istället, en lampa av
metall eller tyg. En ryggsäck skulle förmodligen vara av skinn eller tyg. En penna skulle nog vara
av metall. En TV eller datorskärm skulle vara av trä eller metall. Om golvet är av plastmatta skulle
det i stället vara av trä eller linoleum (korkmatta). Muggar och liknande som nu är av plast skulle
förstås vara av porslin. Du kan säkert komma på mera själv. Plasten kan nästan alltid ersättas av
andra material, men det är inte alltid som de fungerar lika bra.
TESTA DIG SJÄLV
12.4
1. Naturgummit kommer från latexsaft som man utvinner ur gummiträdet.
2. Gummimolekylen är uppbyggd av monomerer som kopplats ihop till långa kedjor, polymerer.
3. Syntetgummi är konstgjort gummi, där molekylerna inte alltid ser likadana ut som i naturgummi.
Syntetgummi görs av råolja.
4. I ett gummiband som inte är utdraget är gummimolekylerna hopknycklade. När man drar i
gummibandet rätas molekylerna ut. När man släpper gummibandet återtar molekylerna sin
ursprungliga form.
5. Man fryser ner gummit till –200 °C. Då blir det sprött och kan pulvriseras. Det skiljs då från
textilfibrer och metaller som kan finnas med från början. Gummipulvret kan sedan blandas med
nytt gummi och bli nya däck eller blandas i asfalt. Man kan också återanvända däck genom
regummering.
6. Bilismens genombrott gjorde att det behövdes stora mängder gummi till alla däck.
TESTA DIG SJÄLV
12.5
1. Keramikprodukter består av lera som bränts i ugnar. Porslin är ett exempel.
2. Eftersom keramer tål höga temperaturer användas de i motorer, raketmunstycken, spishällar och
värmeskydd på rymdfärjor. De används också som isoleringsmaterial inom elindustrin.
3. Lera formas till ett föremål som sedan bränns i en ugn. Då blir föremålet hårt och kan inte suga
upp vatten och bli mjukt igen. De små kornen i leran har delvis smält och klistrats ihop med
varandra.
4. Lera och metalloxider är några ämnen som kan bilda keramer.
5. Keramer tål höga temperaturer, är tåliga mot kemisk frätning och ofta mer slitstarka än metaller.
6. Supraledande keramer är keramer som kan leda ström utan något elektriskt motstånd.
• Stenarna består oftast av korn av oorganiska ämnen, bland annat metalloxider, som smälts ihop
och bränts av värmen i jordens inre.
TESTA DIG SJÄLV
12.6
15
KEMI: Lärarhandledning
1. Den viktigaste ingrediensen i glas är sand.
2. Sodaglas är glas som innehåller soda och kalksten. Det sänker glasets smältpunkt och gör det mer
lättarbetat.
3. Pyrex är ett glas som innehåller en förening med boratomer. Det gör att glaset tål kemikalier och
stora temperaturväxlingar. Kristallglas är glas där man tillsatt blyoxid. Det ger glaset en särskild
tyngd och klang. Det används till kristallkronor och prydnadsföremål.
4. Vindrutan är gjord av lamellglas – två eller flera tunna glasskivor som limmats på ett tunt
plastskikt. Om rutan skadas så håller plasten ihop glaset.
5. Returglas pantas och när de ska användas igen diskas de och fylls återigen på med nya drycker.
Mycket glas återvinns via materialåtervinning. Glaset krossas först och smälts sedan ner för att
formas till nya glasprodukter.
6. När man tillverkar kristallglas tillsätts tungmetallen bly, som är giftig.
TESTA DIG SJÄLV
12.7
1. Fibrer är material i trådform.
2. Bomull, silke, ull och lin är naturliga fibrer. Konstgjorda fibrer är nylon, viskos, rayon, modal,
akryl och polyestrar.
3. Ett kompositmaterial är sammansatt av olika material, där man utnyttjar materialens bästa
egenskaper.
4. Armerad betong, kolfiberarmerad plast och glasfiberarmerad plast är exempel på
kompositmaterial.
5. När man tillverkar konstgjorda fibrer används olika polymerer som råmaterial. De smälts eller
löses upp och sprutas sedan ut genom små munstycken så att det bildas långa fibrer.
6. Genom att upphetta organiska fibrer utan syretillgång får man en fiber av ren grafit (kol).
Kolfibrer används som armering i olika plastprodukter som används i flygplan, satelliter och
sportredskap.
7. Skelettet innehåller proteiner och hårda kristaller av kalciumfosfat. Proteinet är segt och lite
elastiskt. Kristallerna gör det hårt så att det kan stå emot tryck.
8. Ren betong tål tryck men inte krafter som drar i det. Armeringsjärnen gör att betongen också tål
drag genom att de gör den segare.
9. Glasfiberarmerad plast används bland annat till fritidsbåtar och som byggmaterial.
Kolfiberarmerad plast används bland annat i sportredskap och rymdfarkoster. Kevlararmerad plast
används i flygplan och skottsäkra västar.
10. Några exempel är silke, jute, hampa, angora, mohair, tagel, piassava, rami, polypropen, vinyl och
elastan.
• Här finns inga svar som är fel. Om du bara har kombinerat två olika material på något sätt så är det
rätt. Fast en del förslag kanske fungerar lite bättre i verkligheten. Kanske har du kommit på att
göra porslin med ett skelett av plast, så att en tallrik inte går sönder lika lätt om man tappar den.
Eller också kan du ha hittat på att armera betong med trä i stället för med järn, så att den blir
lättare.
En sak som du också kan ha tänkt på är att många tyger faktiskt är en sorts kompositmaterial,
eftersom man ofta väver samman fibrer av olika material. Ett vanligt exempel är en blandning av
bomull och polyester, som används i många skjortor, blusar, klänningar och jackor.
En ny typ av kompositmaterial som forskarna just nu håller på att utveckla är kol-kolkompositer. De har ett skelett av kolfibrer med en grafitliknande massa runtomkring. Man kan då
få material som är både styvare, starkare och lättare än stål och andra metaller.
TESTA DIG SJÄLV
13.1
1. Alla metaller leder ström bra, leder värme, har metallglans, hög smältpunkt, kan smidas och
formas och är ofta hårda och tunga.
2. I en metallbindning sitter atomerna inte ihop två och två. Istället hålls atomerna i metallbiten ihop
i ”en enda stor bindning” som är fördelad över alla metallatomer.
3. Metallbindningen är stark. Därför behövs det höga temperaturer för att smälta metaller. Att
metaller är bra elektriska ledare beror på att strömmen kan gå genom metallbindningen och på så
vis genom hela metallbiten. Metallers hårdhet och höga densitet beror på att atomerna hålls tätt
16
KEMI: Lärarhandledning
•
ihop av metallbindningen. Trots att metallbindningen är stark kan atomerna glida lite åt olika håll.
Det gör att metaller leder värme bra och kan smidas till olika former.
Man kan inte ge ett alldeles bestämt svar utan bara fundera över de olika användningsområdena.
Allra svårast skulle det nog vara att ersätta metallerna i alla elektriska ledningar av olika slag. Om
vi inte hade järn till armerad betong skulle vi också vara tvungna att bygga våra hus och broar med
helt annorlunda teknik. Men för olika människor är det olika användningsområden som är viktiga.
Du kanske har kommit på något som är extra viktigt för dig.
TESTA DIG SJÄLV
13.2
1. Malm är mineral som innehåller så mycket metall att det lönar sig att utvinna. Malmen bryts i
gruvor.
2. I järnmalm finns atomslagen järn och syre.
3. Slagg är det ”skräp” som blir kvar när man har fått fram metallen ur malmen.
4. Bly, kadmium och kvicksilver är miljöfarliga tungmetaller.
5. De sju stegen i metallhanteringen är: malmbrytning, grovkrossning, anrikning, metallen frigörs
genom kemiska reaktioner (till exempel i masugn), rening, bearbetning till metallvaror samt
sophantering/återvinning.
6. Järn består bara av järnatomer, medan det i stål även finns bland annat kolatomer.
7. Eftersom metaller inte är någon oändlig resurs måste vi återvinna dem. Om metallerna vi använt
inte återvinns kan de också förstöra vår natur där de blir liggande. Att återvinna metall är
dessutom billigare än att utvinna ny ur malm.
8. Malmbrytning kan förfula naturen. Regnvatten kan ta med sig tungmetaller och andra föroreningar
från slagghögar och förgifta natur och grundvatten. Vid metallframställning kan svavel från
malmen komma ut i form av svaveldioxid och bidra till försurningen. För att minska
miljöskadorna kan vi rena rökgaserna, använda svavel och slagg till nyttiga produkter samt
återvinna metallskrot.
TESTA DIG SJÄLV
13.3
1. Den metall vi använder mest är järn.
2. Koppar används till elledningar, hustak, rörledningar, mynt med mera.
3. Guld används bland annat till smycken och prydnader samt inom elektronikindustrin.
4. Koppar och guld var de första metaller som användes eftersom de finns i metallform i naturen.
5. När aluminium kommer i kontakt med syre bildas en skyddande hinna av aluminiumoxid som
hindrar metallen från att rosta.
6. Här finns inga svar som är fel.
TESTA DIG SJÄLV
13.4
1. Legeringar – blandningar av metaller – får ofta bättre egenskaper än rena metaller.
2. Rostfritt stål består oftast av järn, krom och nickel.
3. Brons består av ungefär 10 % tenn och 90 % koppar. Brons används till blixtlås, fjädrar, kugghjul,
ventiler och statyer.
4. Mässing är en legering mellan koppar och zink. Den används framförallt till patronhylsor, skruvar,
urverk, ventiler och musikinstrument. Nysilver består av koppar, zink och nickel och används till
bestick, brickor och prydnadsföremål.
5. På rostfritt stål bildas det en skyddande hinna av kromdioxid.
6. Lödtenn är en legering av tenn och bly. Legeringen har en lägre smältpunkt än rent tenn, vilket gör
att elektronikkretsarna inte skadas vid lödning. När man ska gjuta metallföremål är det också
lättare om man inte behöver ha så hög temperatur för att smälta metallen.
TESTA DIG SJÄLV
13.5
1. Korrosion kallas den kemiska reaktion när rena metaller förvandlas till kemiska föreningar så att
metallmaterialet förstörs.
2. Rost är järnoxider som innehåller vattenmolekyler.
3. Järn vill hellre ingå i kemiska föreningar än finnas i ren form i naturen.
4. Luften på västkusten innehåller både fukt och salt vilket påskyndar rostningen.
5. Aluminium får en skyddande hinna av aluminiumoxid som hindrar fortsatt korrosion.
17
KEMI: Lärarhandledning
6. Målning, förzinkning och legering.
7. Målning hindrar luftens syre att nå metallen. Olika legeringar, som i rostfritt stål, hindrar också
korrosion, liksom att täcka metallen med en metall som bildar en skyddande oxidhinna
(förzinkning).
• Den främsta anledningen är att man kan hitta de ädla metallerna i ren form i naturen. De fanns
alltså tillgängliga utan större tekniska kunskaper. Koppar och järn lyckades man framställa så
småningom med en ganska enkel teknik medan exempelvis aluminium kräver en avancerad
teknik. Därför är aluminium ett modernt material trots att det är det vanligaste metallatomslaget i
jordskorpan. Lite förenklat kan man säga att ju oädlare en metall är, desto mer energi krävs det för
att omvandla malmen till färdig metall.
TESTA DIG SJÄLV
14.1
1. I atomens kärna finns protoner. Runt kärnan kretsar elektroner.
2. Skillnaden mellan olika atomslag är antalet protoner i kärnan.
3. Protoner är positivt laddade, medan elektroner är negativt laddade.
4. En atom är alltid oladdad eftersom den innehåller lika många protoner som elektroner.
5. Elektroner och protoner har motsatt laddning och dras därför till varandra. Men eftersom
elektronerna rör sig så snabbt runt atomkärnan dras de inte in i den.
• Atomkärnan är stor och tung och ligger i mitten precis som solen. Elektronerna är mycket mindre
och kretsar runt kärnan precis som planeterna runt solen. Men det finns ingen elektrisk laddning
mellan planeterna och solen, utan det är tyngdkraft som håller ihop dem. Och man kan inte hitta
några mindre delar i solen som skulle motsvara protonerna i atomkärnan. Elektronerna rör sig
också mycket fortare än vad planeterna gör.
TESTA DIG SJÄLV
14.2
1. Det var ryssen Dimitrij Mendelejev som kom på systemet.
2. Atomnumret är detsamma som antalet protoner i atomens kärna. I det periodiska systemet är
atomslagen ordnade efter atomnumret.
3. De vågräta raderna kallas perioder, och de lodräta kallas grupper.
4. Elektronskal kallas de banor som elektronerna rör sig i runt atomkärnan. Valenselektroner är
elektronerna i atomens yttersta skal.
5. De olika atomslagen i en och samma grupp har alla lika många valenselektroner.
6. Här får du ta hjälp av grundämnestabellen och det periodiska systemet längst bak i boken.
7. Rutherford skickade en stråle av små atomkärnor (positiva) mot en guldfolie. De flesta gick tvärs
igenom men några studsade tillbaka. Han antog då att det måste finnas en positiv kärna i mitten av
guldatomen. Bara de kärnor som träffade rakt på en kärna studsade tillbaka. De andra kunde åka
igenom mellan kärnan och elektronerna. Elektronerna måste alltså vara mycket små och röra sig
runt kärnan.
• De olika atomslagen i en och samma period har alla lika många elektronskal.
TESTA DIG SJÄLV
14.3
1. Molekylbindningar finns i alla ämnen som består av molekyler, exempelvis vatten, vätgas, syrgas
och organiska ämnen.
2. Ädelgasstruktur betyder att atomen har ett fullt ytterskal. Alla atomer strävar efter att få det.
3. I en molekylbindning delar två atomer på ett elektronpar och stannar därför tillsammans.
4. Syreatomen har sex valenselektroner. För att få ett fullt ytterskal måste varje atom få ytterligare
två elektroner. För att få det delar de två syreatomerna i syremolekylen (O2) på två stycken
elektronpar. Det kallas för en dubbelbindning.
TESTA DIG SJÄLV
14.4
1. En jon är en atom som förändrats så att den blivit elektriskt laddad. Den har antingen lämnat bort
eller tagit upp elektroner.
2. I jonföreningar finns inga avgränsade molekyler. Jonföreningar bildar kristaller.
Molekylföreningar bildar små avgränsade molekyler.
3. I en metall bildar elektronerna ett ”hav” som metallatomerna ”badar” i. Elektronerna hör inte till
någon speciell metallatom, utan delas av alla.
18
KEMI: Lärarhandledning
4. Positiva joner bildas av metallatomer och väte (till vänster i det periodiska systemet). Negativa
joner bildas av ickemetaller (till höger i det periodiska systemet).
5. Om atomerna i en bindning är lika bra på att dra till sig elektroner bildas en molekylbindning.
Atomerna delar alltså på elektronerna i elektronpar. Men om den ena atomen gärna ger bort och
den andra gärna tar emot elektroner bildas en jonbindning.
6. Aluminiumklorid: AlCl3, Magnesiumklorid: MgCl2, Magnesiumoxid: MgO
• När man löser upp en jonförening, delar den upp sig helt i positiva och negativa joner. Om jonerna
vandrar genom lösningen bär de med sig elektrisk laddning – det fungerar precis som strömmen av
elektroner i en elektrisk ledning. När man löser upp socker, delas det upp i sockermolekyler. De är
oladdade och kan därför inte transportera någon laddning genom lösningen.
TESTA DIG SJÄLV
14.5
1. De oladdade partiklarna i atomkärnan kallas neutroner.
2. Isotoper är atomer med lika många protoner men olika många neutroner i kärnan.
3. Neutronerna hjälper till att hålla samman partiklarna i atomkärnan. Utan neutroner skulle de
positiva protonerna stöta bort varandra.
4. En mol av ett ämne är lika många gram av ämnet som atommassan eller formelmassan är uttryckt i
u.
5. Kol (C) väger 12 u. Väte (H) väger 1 u. Metan CH4 väger därför 12 u + 4 · 1 u = 12 u + 4 u = 16 u.
Man behöver alltså 12 g kol och 4 g väte.
TESTA DIG SJÄLV
15.1
1. En redoxreaktion är när ett ämne avger elektroner och ökar sin laddning, samtidigt som ett annat
ämne tar upp elektroner och minskar sin laddning.
2. Ädla metaller är exempelvis platina, guld och silver. Oädla metaller är till exempel kalcium,
natrium och magnesium.
3. Den oädla metallen bildar joner, medan den ädlare förvandlas till metall.
4. En offeranod är en metallbit som är oädlare än den metall som ska skyddas. Antingen sätter man
offeranoden direkt på metallen som ska skyddas, eller så sammanbinder man metallen och
offeranoden med en metallkabel. Offeranoden kommer att förstöras snabbare än den metall som
ska skyddas.
5. Järnnyckeln överdras med ett tunt silverskikt. Silverjonerna blir till silveratomer. Samtidigt
förvandlas en del järnatomer till järnjoner som går ut i lösningen.
6. Ingenting eftersom guld är ädlare än järn.
7. Silver är ädlare än de metaller som ingår i diskbänksplåten, så att det kan uppstå galvanisk
korrosion. Då kommer diskbänken att rosta fastän den är gjord av ”rostfritt” stål.
TESTA DIG SJÄLV
15.2
1. Primärbatterier kan inte återuppladdas, men det kan laddningsbara batterier.
2. Ett alkaliskt batteri består av ett ytterhölje av zink. Inuti höljet finns manganoxid i en lösning av
kaliumhydroxid. Zinken förvandlas till zinkjoner, Zn Zn2+ 2e–. Zinken blir minuspol och
skickar elektroner genom en sladd till kolstaven i manganoxiden. De positiva manganjonerna dras
dit och reduceras till manganatomer, Mn4+ + 4e– Mn.
3. Laddningsbara batterier är exempelvis blyackumulatorer (bilbatterier), Nicad-batterier,
litiumjonbatterier och metallhydridbatterier.
4. Jonlösningen leder ström och jämnar ut överskottet på minusladdningar. Om det inte fanns någon
jonlösning skulle den elektriska strömmen omedelbart skapa ett överskott på minusladdningar i
pluspolen, så att strömmen inte kunde fortsätta.
5. Galvani upptäckte att man kunde få elektricitet från järn och mässing om de var i kontakt med
grodmuskler. Han trodde att elektriciteten kom från ”livskraft” i muskeln. Det var hans landsman
Volta som visade att man bara behövde en jonlösning mellan metallerna för att skapa ett batteri.
TESTA DIG SJÄLV
15.3
1. Vid en elektrolys använder man elektrisk energi för att driva en kemisk reaktion som ger mer
energirika ämnen.
2. Vid elektrolys av saltsyra (HCl) får man vätgas (H2) och klorgas (Cl2).
19
KEMI: Lärarhandledning
3. Galvanisering innebär att man med hjälp av elektrolys belägger en järnbit med zinkmetall.
4. Vid elektrolys av saltsyra dras vätejonerna till minuspolen som har ett överskott på elektroner. Där
tar de upp en elektron och bildar väteatomer som slår sig samman och bildar vätgas. De negativa
kloridjonerna dras till pluspolen där de lämnar sin överskottselektron och bildar kloratomer. De
slår sig samman två och två och bildar klorgas.
5. Järnspiken får vara katod medan en zinkbit får vara anod. Båda sänks ner i en lösning med
zinkjoner. När strömmen slås på blir spiken negativt laddad och drar till sig positiva zinkjoner.
Zinkjonerna tar upp elektroner och bildar zinkmetall som lägger sig på spiken. Samtidigt drar
strömkällan bort elektroner från zinkblecket så att zinkatomerna omvandlas till positiva zinkjoner
som går ut i lösningen.
6. Aluminiummalmen bauxit är aluminiumoxidhydroxid. Med NaOH och upphettning omvandlas
den till aluminiumoxid. Sedan använder man elektrolys. Man leder ström genom den smälta
aluminiumoxiden så att aluminiumjonerna tar upp elektroner och förvandlas till aluminiummetall.
7. Om zinkytan är oskadad har den en skyddande oxidhinna, som gör att bilen inte rostar. Om
zinkytan är skadad, så att syre och vatten kan komma åt järnet i bilplåten, så fungerar ändå zinken
runtomkring som en offeranod och skyddar järnet.
20