Processkemi
7,5 högskolepoäng
Provmoment: Tentamen
Ladokkod: TH171A
Tentamen ges för:
Högskoletekniker i energi- och processteknik
Namn:
Personnummer:
Tentamensdatum:
Tid:
2015-03-18
9:00-13:00
Hjälpmedel:
papper, penna, radergummi kalkylator och periodiska systemet
Totalt antal poäng på tentamen:
För att få respektive betyg krävs:
20p - 3, 30p – 4, 40p - 5
50 poäng
Allmänna anvisningar:
Rättningstiden är i normalfall tre veckor, annars är det detta datum som gäller:
Viktigt! Glöm inte att skriva namn på alla blad du lämnar in.
Lycka till!
Ansvarig lärare:
Telefonnummer:
Tatiana Svedén
070-541 64 86
Atomens byggnad och periodiska systemet
1. Vilket av följande ämnen är flytande vid 25 ˚C och normalt tryck:
a)
b)
c)
d)
e)
gallium,
jod,
klor,
brom,
fluor.
(1p)
2. Ämnet kalcium, Ca bildar kalciumjon, Ca2+. Vilket av följande påståenden är korrekt?
Atomen Ca och jonen Ca2+ har alltid:
a)
b)
c)
d)
e)
samma radie
samma färg
samma kemiska egenskaper
samma kärnladdning
samma antal elektronskal som innehåller elektroner.
(1p)
3. Betrakta följande jon:
. Vilka tre av följande påståenden om den jonen är
sanna?
a) Den är tvåvärt positiv.
b) I grundtillståndet har den samma antal skal som rutenium, Ru.
c) Den har samma antal elektroner som Co3+.
d) Den har 26 protoner i kärnan.
e) Den har masstalet 65,8.
f) Den har lika många protoner som neutroner.
(3p)
4. I vilket hörn av det periodiska systemet finns den största atomen?
a) övre vänstra,
b) övre högra,
c) nedre vänstra,
d) nedre högra.
(1p)
5. Vilka tre av följande påståenden är korrekta?
a) Litiumkarbonat har formeln Li2CO3.
b) Litiumnitrid har formeln Li3N.
c) Litium reagerar häftigare än natrium med vatten.
d) En vattenlösning av litiumklorid har basisk reaktion.
e) Litium är lättare än vatten.
(3p)
Kemisk bindnig med grundläggande organisk kemi
6. Vilken typ av kemisk bindning bryts när:
a) natrium smälter,
b) kaliumbromid smälter,
c) etanol kokar,
d) koldioxid sublimerar (dvs. går direkt från fast form till gasform),
e) naftalen, C10H8 sublimerar,
f) diamant smälter.
(3p)
7. Rita elektronstrukturformeln och ange om molekylen är en dipol eller ej. Motivera
svaret. Rita alla elektroner i yttersta skalet som prickar eller elektronpar som streck.
a) vätesulfid, H2S (byggd som H2O)
b) silan, SiH4 (byggd som CH4).
8. Skriv molekylformler och rita strukturformler för:
a) pentan
b) penten
c) bensen.
(4p)
(3p)
9. Vilken av föreningarna etanol och pentanol är mest vattenlöslig? Varför? (2p)
Reaktionsformler och beräkningar
Fullständig lösning och (i förekommande fall) balanserade reaktionsformler
krävs.
10.
a) Balansera nedanstående reaktionsformler:
Sb(s) + O2(g) → Sb2O3(s)
Na2CO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)
b) Skriv och balansera reaktionsformeln för fullständig förbränning av etan, C2H6.
c) Aluminiumsulfat reagerar med kalciumhydroxid och aluminiumhydroxid och
kalciumsulfat bildas. Skriv och balansera reaktionsformeln.
(6p)
11. Förbränning av etanol sker enligt följande formel:
C2H5OH + 3O2 → 2CO2 + 3H2O
Om man förbränner 1 mol etanol, hur många mol vatten bildas? Ange bara rätt
alternativ från 1-6.
1. 6 mol
2. 3 mol
3. 2 mol
4. 3/2 mol
5. 1 mol
6. 2/3 mol.
(2p)
12. Beräkna massan av de ämnen som visas nedan (a – c). Substansmängden för varje
ämne är 0,100 mol. Para ihop ämnena (a – c) med rätt massa (1 - 3).
a) Järnoxid, Fe2O3
b) Kaliumdikromat, K2Cr2O7
c) Koboltkloridhexahydrat, CoCl2*6H2O
1. 29,419 g
2. 15,970 g
3. 23,784 g
(3p)
13. Termitreaktionen är en av de allra varmaste reaktionerna man känner till. Förr i tiden
användes termitreaktionen bl.a. för att svetsa järnvägsspår. Reaktionen sker då en
finfördelad blandning av aluminium och järnoxid antänds:
Fe2O3 + 2Al → 2Fe + Al2O3
a) Vilket oxidationstal har järn i Fe2O3?
1. +III
2. +II
3. 0
4. –III
5. +I
(1p)
b) Reaktionen frigör enormt mycket värme. Vad kallas en sådan reaktion:
1. Endemisk
2. Empirisk
3. Endoterm
4. Fusion
5. Exoterm.
(1p)
c) Hur mycket metalliskt järn bildas då en termitblandning bestående av 50,0 g
järnoxid och 15,0 g aluminium antänds? Redovisa dina beräkningar och svara med
en decimal.
(4p)
14. 17,3 g kaliumsulfat, K2SO4 löses i vatten så att volymen blir 500,0 cm3. Beräkna
a) lösningens koncentration
b) [K+]
c) [SO42-]
(3p)
Syror och baser och redoxkemi
Fullständig lösning och (i förekommande fall) balanserade reaktionsformler
krävs.
15. Salpetersyran är en stark syra.
a) Skriv formeln för salpetersyrans protolys i vatten och namnge alla bildade joner.
(1p)
b) Vilket pH får en 0,00250 mol/dm3 lösning av salpetersyra?
(1p)
c) Hur stor volym av syran i fråga b) ska du ta och spädda till 0,500 dm3 för att den
ska få koncentrationen 0,00075 mol/dm3?
(2p)
16. En galvanisk cell består av ett zinkbleck i en zinknitratlösning och ett silverbleck i
silvernitratlösning, förbundna med varandra på ett lämpligt sätt. Skriv cellschema,
reaktion vid plus- och minuspolen, samt cellreaktionen för cellen och förklara
galvaniska cellens funktion.
(3p)
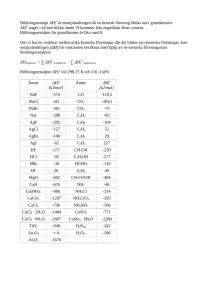
17. Använd tabellen över normalpotentialer och förklara varför zink och magnesium, men
inte ten, kan användas som offermetall på järn.
(2p)