Kväve Metabolism
Elin Johansson, Maria Grahn och Beatrice Lundin
KE0026
Stefan Knight
2004-05-31
Inledning
Tillförsel av kväve till naturen sker genom olika processer som tex urladdningar vid
åskväder, gödsling och med hjälp av kvävefixerande organismer.
I naturen är det bara vissa prokaryota organismer som har förmågan att fixera
atmosfäriskt kväve som sedan kan användas vid syntes av andra molekyler. Högre
stående organismer har inte denna förmåga utan är helt beroende av att dessa ”enkla”
organismer förser dem med denna viktiga beståndsdel.
Bakterier fixerar årligen ca 200 miljoner ton kväve per år i landekosystemen.
Symbios mellan bakterier och växter
Den största andelen av kvävefixering sker via sk kvävefixerande bakterier. Dessa verkar
oftast i symbios med en växt, vanligen ärtväxter, och är lokaliserade till växtens
rotsystem. Där befinner sig bakterierna inneslutna i ”rotknölar” där utbyte av
näringsämnen kan ske mellan värdväxten och bakterien. Växten förser bakterien med
skydd och kolhydrater medan bakterien tillhandahåller växten med kväve.
Kväve behövs för uppbyggnad av nukleotider och aminosyror som i sin tur är viktiga i
bla DNA.
Fixeringen av atmosfäriskt kväve på detta sätt sker genom enzymet nitrogenas som finns
i bakterierna. Nitrogenas omvandlar N2 till ammoniak, NH3, och ammoniumjoner, NH4+.
N2 + 3 H2 ‡ 2 NH3 (1)
Kvävgasmolekylen som innehåller en trippelbindning kräver stora mängder energi för att
brytas. Denna energi fås i form av hydrolys av ATP.
Den totala reaktionen kan tecknas:
N2 + 10 H+ + 8 e- + 16 ATP ‡ 2 NH4+ + 16 ADP + 16 Pi + H2 (2)
Fixeringen sker i bakterierna under “normala” förhållanden med avseende på temperatur
och tryck. Energimängden, 16 ATP, som krävs är att jämföra med den industriella
process där trippelbindningen bryts och N2 omvandlas till ammoniak. Där behövs
energitillförsel i form av en temperatur på ca 500 ºC och ett tryck på ca 300 atm.
Det är i form av ammoniak och ammoniumjoner som kväve sedan går vidare i sitt
kretslopp.
2
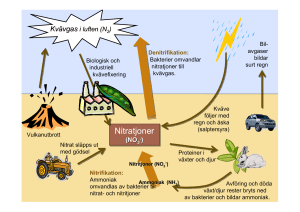
Kvävets kretslopp
Bild 1. Kvävets kretslopp (Campbell, 1999)
Efter det att kväve har fixerats i bakterierna finns det flera alternativa reaktionsvägar, se
bild 1.
1. Upptag direkt av värdväxten för omvandling till aminosyror. Eftersom ammoniak är
skadligt för växten måste det omvandlas omedelbart. Detta sker genom att syntetisera
aminosyran glutamat från NH4+ och a-ketoglutarat genom inverkan av enzymet glutamat
dehydrogenas.
NH4+ + a-ketoglutarat + NADPH + H+ ‡ glutamat + NADP+ + H2O (3)
Glutamat omvandlas sedan vidare till aminosyran glutamin genom fortsatt reaktion med
NH4+. Glutamat ger även upphov till ett flertal andra aminosyror.
2. Utsläpp av ammoniak till jorden. Ammoniak tillförs jorden på olika sätt, dels genom
överskott från de kvävefixerande bakterierna, dels från nedbrytning av organiskt material
samt från gödsling och nederbörd.
I jorden finns olika bakterier som har förmågan att omvandla ammoniak till nitratjoner,
NO3-, detta kallas nitrifikation. Bakterierna använder syret från nitrat istället för syrgas
till sin cellandning.
3
Det är i form av nitratjoner som kväve kan lagras i marken. Alla växter har möjlighet att
tillgodogöra sig kväve genom nitrat.
3. Kvävet går vidare i näringskjedjan genom växtätarna. Nedbrytningen i
magtarmkanalen spjälkar upp växternas proteiner och aminosyror vilket frigör kvävet för
uppbyggnad av nya aminosyror. Vissa aminosyror, sk essentiella, måste tillföras via
födan då alla aminosyror inte kan syntetiseras pga avsaknad av vissa enzymer.
Genom avföring och död återförs kvävet till markens kretslopp.
4. Deniktrifikation innebär att vissa bakterier i marken omvandlar nitrat direkt till
kvävgas under anaeroba förhållanden. Eftersom detta sker i en syrefri miljö använder
bakterierna nitratet i stället för syre vid ATP-syntes och detta genererar kvävgas som en
restprodukt.
Nitrogenaskomplexet och dess funktion
Nitrogenaskomplexet består av ett flertal olika protein bla dinitrogenas reduktas och
dinitrogenas.
Dinitrogenas reduktas består av två identiska subenheter, en sk dimer. Dess redoxcenter
består av Fe4-S4 komplex, som har två bindningsställen för ATP. Huvudfunktionen för
dinitrogenas reduktas är att transportera elektroner. Komplexet oxideras och reduceras av
en elektron. För att en elektron ska transporteras krävs 2 ATP. När ATP binder och
hydrolyseras sker en konformationsförändring som för proteinet närmare dinitrogenas.
Redox-potentialen sänks och på så sätt kan elektroner lättare överföras till
reduktioncentret i dinitrogenas.
Dinitrogenas är en a2b2 tetramer där a och b subenheterna är väldigt lika varandra och
homologa. Ett annat namn för proteinet är Molybdenum-Järn protein (MoFe-protein).
Proteinet består i sin tur av en FeMo cofaktor (se bild 2) och ett P-kluster där FeMo
cofaktorn består av två FeMoS kluster medan P-klustret består av två stycken Fe4-S3
kluster.
Dinitrogenas
FeMo cofaktor _
P-kluster
_
2 Fe3MoS3 kluster
2 Fe4-S3 kluster
Bild 2. FeMo-cofaktor med inbundet kväve. (Stryer, 2002)
4
När elektroner transporteras från dinitrogenas reduktas tas de emot av P-klustret för
vidare överföring till FeMo cofaktorn.
Varje FeMo cofaktor kan binda till sig en N2, detta görs pga att varje järnatom endast har
bundit tre andra atomer och därför har möjlighet att binda en atom till, vilket blir kvävet.
Pga kväve-järn interaktionerna i komplexet försvagas bindningen mellan kväveatomerna
och därigenom sänks aktiverinsenergin för reduktion. Av de totalt 8 elektroner som krävs
för fixeringen går 6 st till själva kvävereduceringen och 2 st går till bildandet av H2.
Vätgas bildas som en energislösande biprodukt vid kvävefixering. Se reaktion 2.
Kvävefixeringen sker hos bakterier i en anaerob miljö. En syrefattig miljö är nödvändig
för en effektiv process eftersom enzymet nitrogenas inhiberas av syre.
Hur kan en reduktionsprocess ske i en oxidativ miljö?
Trots att nitrogenas inhiberas av syre kan reduktionsprocessen ske i en syrerik miljö.
Bakterierna har löst detta problem med anpassningar av olika slag.
1. Vissa aeroba bakterier har möjlighet att delvis koppla
om elektrontransporten från ATP syntesen för att kunna
förbränna syre. Syret förbränns direkt när det kommer in i
cellen och det avges värme.
2. Cyanobakterier omvandlar var nionde cell till en
specialiserad kvävefixerande cell med tjockare väggar för
att förhindra att syre tar sig in. Denna typ av cell kallas
för heterocyst.
3. Bakterier som lever i symbios med växter kapslas in i
rotknölar. Se bild 3. I hålrummet inuti knölen som
bakterien befinner sig i finns en vätska som innehåller
leghemoglobin. Det är ett syrebindande protein som
produceras av växten. Leghemoglobinet transporterar
bort det syre som kommer in i rotknölarna och skapar
den syrefattiga miljö som krävs.
Bild 3. Rotknölar
(Lehninger,1993)
Från ammoniak till aminosyra
När kvävet har fixerats reduceras det till ammoniak och ammoniumjoner. Dessa tas sedan
tillvara för bildningen av aminosyror.
_-ketoglutarat, en intermediär från citronsyracykeln, bildar tillsammans med ammoniumjoner aminosyran glutamat. Se reaktion (3).
Glutamat omvandlas sedan vidare till glutamin genom reaktionen:
NH4+ + glutamat + ATP ‡ glutamin + ADP + Pi (4)
Alla organismer bildar glutamat och glutamin men enbart de prokaryota har förmågan att
bilda glutamat från glutamin vilket sker då NH4+ koncentrationen är låg.
5
Glutamat och glutamin är basen för alla andra aminosyror då de bidrar med aminogrupper. Kolskelettet byggs upp av intermediärer från citronsyracykeln, glykolysen eller
från ”the pentose phosphat pathway”.
Olika aminosyror är olika ”svåra” att syntetisera och det är framförallt de aromatiska som
är mest komplexa. Det är dessa som oftast är essentiella och behöver tas in genom födan.
Urea-cykeln
Det finns olika sätt för kvävet i aminosyror att återvända till kretsloppet, dels genom
nedbrytning av dött organiskt material, dels via avföring och urin. Fiskar har förmågan att
avlägsna kväve i form av ammoniak. Fåglar och reptiler utsöndrar kväve i form av
urinsyror medan människor och djur bildar urinämne, sk urea. Dessa olika anpassningar
är en följd av tillgången på vatten.
Urinämne skapas i urea-cykeln där
aminosyror bryts ner för att återvända till
naturen. Se bild 4.
I mitokondrierna kondenseras
ammoniumjoner tillsammans med
koldioxid och bildar carbamoyl fosfat,
det är i denna form kväve går in i urea
cykeln. Carbamoyl fosfat reagerar med
ornithine och bildar citrullin som
transporteras till cytosolen. Aspartat
bidrar med ytterligare ett kväve genom
att reagera med citrullin och bilda
arginosuccinate som sedan delas för att
bilda arginin och fumarate. Fumarate går
in i citronsyracykeln medan arginin
hydrolyseras och bildar urea och
regenerarar ornithine som går tillbaka in
i urea cykeln. Urea transporteras sedan
via blodet till njurarna för att utsöndras
ur kroppen i form av urin.
Bild 4. Urea-cykeln (Stryer, 2002)
Sammanfattning
Kväve är en av de viktigaste byggstenarna i uppbyggnaden av levande organismer.
Eftersom det enbart är vissa bakterier som har förmågan att fixera atmosfäriskt kväve är
vi väldigt beroende av dem. Kvävets kretslopp består av många olika vägar tack vare
bakteriernas mångfald.
Nitrogenas är ett oerhört komplext enzym där forskning om dess funktion och struktur
fortfarande pågår. Vi har därför valt att inte gå in på för djupa detaljer angående enzymet.
I bild 5 sammanfattas kvävets kretslopp och dess reaktionsvägar väl.
6
Bild 5. Kvävets kretslopp. (Campbell, 1999)
Litteratur
•
•
•
•
•
•
Stryer. L, Berg. J M, Tymoczko. J L, Biochemistry, 5 ed, W.H Freeman & Co,
2002
Lehninger. A L, Nelson. D L, Cox. M M , Principles of Biochemistry, 2 ed, Worth
Publishers, 1993
Campbell. M K, Biochemistry, 3 ed, Harcourt Brace & Co, 1999
Sprent. J I, Sprent. P, Nitrogen Fixing Organisms, Chapman and Hall, 1990
Karlsson. J, Krigsman. T, Molander. B O, Wickman. P O, Biologi 1, 1 ed, Liber
Utbildning AB, 1994
http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=1
2642670
7