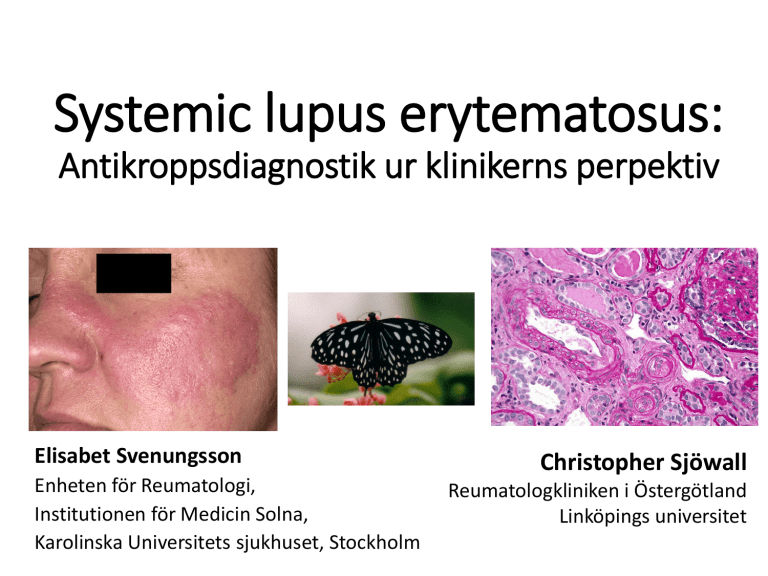
Systemic lupus erytematosus:
Antikroppsdiagnostik ur klinikerns perpektiv
Elisabet Svenungsson
Enheten för Reumatologi,
Institutionen för Medicin Solna,
Karolinska Universitets sjukhuset, Stockholm
Christopher Sjöwall
Reumatologkliniken i Östergötland
Linköpings universitet
SLE är en heterogen sjukdom !!!!
KLINISKA SYMTOM
Neuropati
Akut konfusion
Myelit
BLODPROVER
Komlement
Epilepsi
Psykos
Auto antikroppar
ANA
DNA
Sm
C3
C4
Låga blodvärden
Trombocyter
Leukocyter
Lymfocyter
Hemoltisk anemi
Alopeci
Sår i näsan
Blodpropp
Fosfolipidantikroppar
Autoantikroppar vid SLE
Anti-nukleära
antikroppar (ANA)
ds DNA
Nukleosomer
Sm
Ribosomalt –P
RNP
SSA Ro60/Ro52
SSB
INTRODUKTION
Antikroppar mot dubbelsträngat (ds) DNA
• Systemisk lupus erytematosus (SLE)
• IgG har högst specificitet för SLE
• 40-80% positiva någon gång
anti-dsDNA
• Autoimmun hepatit
• Läkemedel (TNF-inhibitorer, sulfasalazin)
• Andra inflammatoriska sjukdomar?
Diagnostik och klassifikation av SLE
Systemic Lupus International
Collaborating Clinics (SLICC) 2012
”Anti-dsDNA antibody level above
laboratory reference range (or 2fold the reference range if tested
by ELISA)”
INTRODUKTION
Disease activity
Att mäta sjukdomsaktivitet vid SLE
SLEDAI-2K
Time
• Ingen enskild biomarkör/autoantikropp återspeglar
sjukdomsaktivitet/inflammation (anti-dsDNA, anti-C1q och
komplement är dock etablerade)
• SLE disease activity index (SLEDAI-2K) inkluderar kombination av
labfynd och kliniska manifestationer
INTRODUKTION
SLEDAI-2K
Anti-dsDNA
Lab
↓Komplement
C3, C4
↓LPK el TPK
SLEDAI-2K
Feber
Manifestation
Artrit
etc
Gladman DD, Ibañez D, Urowitz MB. Systemic lupus
erythematosus disease activity index 2000.
J Rheumatol 2002;29:288-91
INTRODUKTION
Anti-dsDNA
Mätmetod:
• CLIFT är/var vanligast i Sverige
• Tidskrävande och semikvantitativ
• Många nya (snabbare) metoder finns tillgängliga
• Vilken metod är bäst för att mäta anti-dsDNA?
• Vid sjukdomsdebut respektive övertid?
SYFTE
Vilken metod/teknik är bäst?
1. Sjukdomsspecificitet
2. Sensitivitet
3. Monitorering av sjukdomsaktivitet
• Tid
• Kostnad
PAPER
Enocsson H, et al. J Rheumatol 2015;42(5):817-25.
METOD
Jämförda metoder
(ALBIA)
METOD
Skillnader och likheter
CLIFT
FIDIS
EliA
EUROLINE
Antigen
DNA i
mitokondrie
Rekombinant
cirkulärt
plasmid DNA
Rekombinant
cirkulärt
plasmid DNA
DNA från
Laxtestikel
Resultat
Semikvantitativt Kvantitativt
Kvantitativt
Kvalitativt/
Semikvantitativt
1
18
Antal auto- 1
antikroppar
13
Apparatur
FIDIS system Phadia
(MLX-Booster (ThermoFisher)
software?)
Fluorescensmikroskop
EUROBlot
master
+EUROLINE
Scan
METOD
SLE - studiepopulation
• Serum från 178 SLE-patienter (Linköping)
• 9% i samband med sjukdomsdebut/diagnos
• Majoriteten i remission vid tidpunkt för provtagning
Lågt SLEDAI-2K
Kontrollgrupper:
• Tidig reumatoid artrit (RA) n=97
• Primärt Sjögrens syndrom (pSS) n=54
• Friska kontroller (HC) n=100
RESULTAT
Överensstämmelse mellan metoder
10000
1000
n=19
n=34
n=22
n=40
1000
EliA (IU/mL)
FIDIS (IU/mL)
100
100
10
10
1
1
n=116
n=9
p<0.0001
rho=0.623 (0.579)
Concordance:84% (84%)
n=103
n=13
p<0.0001
rho=0.622 (0.641)
Concordance:80% (87%)
0.1
0.1
1
10
100
CLIFT (titer)
1000
10000
1
10
100
FIDIS (IU/mL)
1000
10000
RESULTAT
Överensstämmelse mellan metoder
1000
n=20
n=33
100
10
1
n=96
n=29
p<0.0001
rho=0.411 (0.381)
Concordance:72% (80%)
0.1
EUROLINE (signal intensity)
EUROLINE (signal intensity)
1000
n=24
n=29
100
10
1
n=101
n=24
p<0.0001
rho=0.376 (0.316)
Concordance:73% (78%)
0.1
1
10
EliA (IU/mL)
100
1000
1
10
100
FIDIS (IU/mL)
1000
10000
RESULTAT
Specificitet och sensitivitet
A
Cut-off
Lab reference
Increased
Specificity
98
N/A
B
Sensitivity
24
N/A
300
200
100
Sensitivity
30
23
400
300
200
100
0
0
SLE
C
Specificity
92
98
1500
1000
500
FIDIS (IU/mL)
CLIFT (titer)
3000
2000
1000
Cut-off
Manufacturer’s
Increased
RA
Cut-off
Manufacturer’s
Increased
pSS
Specificity
95
98
HC
SLE
D
Sensitivity
35
20
RA
Cut-off
Manufacturer’s
Increased
pSS
Specificity
92
99
HC
Sensitivity
30
16
120
EUROLINE (signal intensity)
EliA (IU/mL)
400
200
150
100
50
0
SLE
RA
pSS
HC
100
80
60
40
20
0
SLE
RA
pSS
HC
RESULTAT
Vilken sensitivitet vid likvärdig
specificitet (98%)?
1.
FIDIS
CLIFT
= 24% sensitivitet
= 24% sensitivitet
2.
EliA
EUROLINE
= 19% sensitivitet
= 19% sensitivitet
RESULTAT
Positiva sjukdomskontroller?
A
Cut-off
Lab reference
Increased
Specificity
98
N/A
B
Sensitivity
24
N/A
Cut-off
Manufacturer’s
Increased
1000
1000
500
F ID IS (IU /m L )
1500
2000
C L IF T (tite r )
3000
300
200
100
10/10
Anti-CCP
300
200
100
0
SLE
RA
Specificity
95
98
HC
SLE
D
Sensitivity
35
20
E U R O L IN E (s ig n a l in te n s ity )
Cut-off
Manufacturer’s
Increased
pSS
400
200
E liA (IU /m L )
Sensitivity
30
23
400
0
C
Specificity
92
98
150
100
50
0
SLE
RA
pSS
HC
RA
Cut-off
Manufacturer’s
Increased
pSS
Specificity
92
99
HC
Sensitivity
30
16
120
100
80
60
40
20
0
SLE
RA
pSS
HC
RESULTAT
Korrelation till sjukdomsaktivitet
FIDIS
EliA
CLIFT
EUROLINE
rho
p-value
rho
p-value
rho
p-value
rho
p-value
Classical complement
function (n=169)
-0.552
<0.0005
-0.426
<0.0005
-0.333
<0.0005
-0.195
0.011
C4 (n=177)
-0.495
<0.0005
-0.362
<0.0005
-0.284
<0.0005
-0.209
0.005
C3 (n=178)
-0.371
<0.0005
-0.251
0.001
-0.218
0.003
-0.154
0.040
IFNα (n=178)
0.323
<0.0005
0.269
<0.0005
0.215
0.004
0.137
0.068
SLEDAI-2Ka (n=178)
0.148
0.048
0.121
0.109
0.096
0.203
0.034
0.657
RESULTAT
Enskilda SLE patienter över tid
20
SLEDAI
15
10
5
0
FIDIS (% av cut-off)
EliA och FIDIS
800
CLIFT (titer)
600
1 : 160
1 : 80
EliA (% av cut-off)
1 : 40
400
1 : 20
200
1 : 10
neg
0
1
2
3
4
Besök
5
6
SAMMANFATTNING
CLIFT
FIDIS
EliA
EUROLINE
Hög specificitet
Jämförbar specificitet Enkel och snabb
och sensitivitet med
metod
CLIFT vid justerad cutoff
Enkel och snabb
metod
Välbeprövad
metod
Enkel och snabb
metod (?)
Många
autoantikroppar kan
analyseras samtidigt
Bäst korrelation till
sjukdomsaktivitet
Många
autoantikroppar kan
analyseras samtidigt
Kräver mycket tid
och manuellt
arbete
FIDIS
analysinstrument
behövs
Semikvantitativ
Störs ev. av andra
autoantikroppar
Generellt något
sämre än FIDIS
Bara kvalitativ
(pos/neg)
Kan inte användas för
att följa
sjukdomsaktivitet
Slutsatser
• Det är stora skillnader mellan olika anti-dsDNA
analysmetoder
• FIDIS har jämförbar specificitet och sensitivitet med
CLIFT.
• FIDIS fungerar också bra (bäst) för att följa
sjukdomsaktivitet.
• FIDIS kan vara ett bra alternativ till CLIFT, ffa. för
klinisk monitorering.
Sjöwall C, Hjorth M, Eriksson P. Lupus 2017 Jan 1:961203317691371.
Pat 1
Pat 2
Pat 1
Pat 2
Tack till
Linköping
Helena Enocsson
Thomas Skogh
Lina Wirestam
Charlotte Dahle
Jonas Wetterö
Alf Kastbom
Ann-Marie Fornander
Carina Bergvall
Christina Olsson
Käthy Birgersson
Marianne Peterson
Uppsala
Johan Rönnelid
Azita Sohrabian
Maija-Leena Eloranta
Lars Rönnblom
Anne Trönnberg
SLE patienter har många autoantikroppar
Antikropp
B2GP1 IgG
SLE
N = 476
33.8 %
40.8 %
5.7 %
9.5 %
24.4%
16.0 %
23.3 %
28.4 %
40.2 %
21.6 %
23.9 %
21.5 %
22.3 %
Lupus antikoagulans
15.1 %
DNA>10
Nukleosomer
Ribo-P
RNP 68
RNP A
Sm
Sm RNP
Ro 52
Ro 60
SSB
aCL IgG
aCL IgM
Kontroller
N=307
1.6 %
0.3 %
0.3 %
0%
2.6 %
0.3 %
0%
1.0 %
1.6 %
2.9 %
0.9 %
3.2 %
2.9 %
?
ENA: BioRad
aPL: Organtec
Antikropparna kommer före diagnosen
ssk aPL och SSA/SSB
Diagnos
Arbuckle et al NEJM 2003
Sjögrens Syndrom
Primärt och sekundärt
Ögontorrhet
Schirmers test
Rose-Bengal färgning
Tear Break Up Time
Muntorrhet
Salivsekretionsmätning
Serologi
Hypergammaglobulinemi,
SSA 50-60%, SSB 30%, ofta RF
och ANA
Biopsi
Spottkörtelbiopsi
Torrhet i underlivet
SSA/SSB antikroppar och sekundärt
Sjögrens syndrom
A uto an tibo dies in S L E p atien ts s S S an d n o n -s S S
Fig 4B
S S A /R o 6 0 p o s itivity in S L E p atien ts s S S
100
80
80
80
40
60
40
20
20
60
51
0
0
<2
0
>6
30
21
31
40
40
31
41
50
30
21
40
20
0
0
<2
60
50
41
60
51
0
>6
0
<2
21
30
60
P ercen tage
%
100
0
40
31
50
41
60
51
0
>6
A ge in years
A ge in years
A ge in years
Fig 4D
S S A /R o 5 2 p o s itivity in S L E p atien ts n o n -s S S
Fig 4E
S S A /R o 6 0 p o s itivity in S L E p atien ts n o n -s S S
Fig 4F
S S B /L a p o s itivity in p atien ts n o n -S S
100
80
80
80
40
60
40
20
20
A ge in years
0
0
<2
40
31
A ge in years
60
51
>6
0
0
>6
41
50
50
41
21
30
40
31
51
60
0
<2
40
20
0
0
60
0
<2
30
21
31
40
60
P ercen tage
%
100
P ercen tage
%
100
21
30
P ercen tage
%
SLE – sSS
N=387
Fig 4C
S S B /L a p o s itivity in S L E p atien ts s S S
100
P ercen tage
%
P ercen tage
%
Fig 4A
S S A /R o 5 2 p o s itivity in S L E p atien ts s S S
SLE +sSS
N=117
SSB
SSA/Ro52
SSA/Ro60
50
41
60
51
0
>6
A ge in years
Kvarnström/Ruacho unpublished
Sekundärt Sjögrens syndrom vid SLE
SLE+ SS
SLE- utan SS
117(23.2 %)
387 (76.7 %)
p-värde
Ålder
54.6 +/-13.6
43.4 +/-14.7
<0.0001
Diagnosålder
40.4+/-15.6
31.9+/-14.9
<0.0001
Kvinnor
95,7 5
83,4 %
0.0007
Njurinflammation
31.9 %
42.6 %
0.03
Leukopeni
31.9%
42.6%
0.03
Antikroppar
anti-Ro52
47.9 %
21.8 %
<0.0001
anti-Ro60
59 %
35.9 %
<0.0001
anti-La/SSB
37.6 %
18.0 %
<0.0001
Rf
38.6 %
19.9%
0.0005
IgG
14.85+/-5.99
13.25+/-5.35
0.009
Kvarnström/Ruacho unpublished
Subakut kutan lupus
-associerat till SSA
antikroppar
Neonatal lupus
• Neonatal lupus, övergående
•
•
•
•
•
Överförda antikroppar (SSA/SSB) från modern
Typiska hudutslag
Cytopenier
Leverpåverkan
Läker ut på ca 6 månader
Kongenitalt hjärtblock
• Kongenitalt hjärtblock
• 1-2% hos pat som ej fött barn med hjärtblock
• 15-20% om syskon haft hjärtblock
• Utvecklas under v 18-26
• 87 % friska 13 % ”autoimmuna mödrar”
• Övervakas med regelbunden eko-doppler us???????
• Förlängd PR intevall
• Osäkert om behandling hjälper
• Mortalitet (barn)10-30 %, ofta behov permanent pacemaker
Autoantikroppar vid SLE
Anti-nukleära
antikroppar (ANA)
Anti-fosfolipid
antikroppar
(aPL)
2006 klassifikationskriterier för APS
”Sidney kriterierna”
Lab fynd:
Kliniska symtom
• + aCL IgG eller IgM
• Trombos
• Arteriell, venös, små kärl
• Graviditetskomplikationer
• 1 sent missfall (> v 10)
• 3 tidiga missfall (< v10)
• Prematur förlossning < v 34
• Havandeskapsförgiftning
• Placentainsufficiens
• Medium/hög titer
• >99 %, eller >40 GPL enheter
• + a2GP1 IgG eller IgM
• + Lupus antikoagulans (LA)
• 2 pos test 12 veckor mellan
• ”Persisterande positivitet”
1 Klinik + 1 Lab = APS
Miyakis et al J Thrombosis and Heaemostasis, 4: 295-306
Förekomst av fosfolipidantikroppar (aPL)
hos patienter med SLE,
Tvärsnittsstudier Svenska SLE nätverket
20-40 %
38 %
34
2
1
Positivt LA 19 %
Positiva dsDNA 38%
N = Antal
positiva aPL test
622 Swedish SLE patients
Någon aPL 40 %
Karolinskas SLE kohort N= 550
Nya klassifikationskriterier för SLE
17 kriterier
11 kliniska och 6 immunologiska
immunologiska kriterier
1. ANA
2. Ds DNA
3. aSM
4. aPL
1.
2.
3.
4.
+ LA
Medium/hög titer aCL (IgA, IgG eller IgM )
Positiv test β2GP1(IgA, IgG eller IgM
Falskt postivt test för syfilis
A&R augusti 2012
5. Lågt komplement
6. Positivt Coombs test i avsaknad av hemolytisk anemi
APS kan orsaka blodproppar i alla kärl
Venös
Ben
Lunga
Illustration: Nadine Hillebrant
Arteriell
Stroke
Hjärtinfarkt
Små kärl
Njurar
Hud
SLE and antifosfolipid antikroppar
712 Svenska SLE patients
Förekomst
Stroke/TIA
MI/Angina
DVT/LE
Kardiolipin IgG
17%
**
ns
***
β2GPI IgG
20%
**
ns
***
Lupus anticoagulans
N= 289 Sthlm
19%
***
ns
**
Kardiolipin IgM
21%
ns
*
ns
β2GPI IgM
14%
ns
ns
ns
Vikerfors et al Rheumatology 2013;52:501509
*P <0.05
**p <0.01
***<0.001
Två prospektiva studier mer ”hard outcomes”
Ålder
Tidigare arteriella event
Lågt GFR (Cystatin C)
hsCRP
12 år
Rökning
sVCAM-1/vWf
Antifosfolipid
antikroppar (aPL)
8 år
≈100%
followup
Kardiovaskulär
mortalitet
Första
kardiovaskulära
eventet
Gustafsson et al Arthritis Research and Therapy 2009 and 2012
Antifosfolipid antikroppar
& Organskador
ignifikant skadeökning över
5-15 år assoc.
Med” signifikant aPL profil”
Taraborelli et al Lupus 2016
aCL/LA kluster associerad
med mer SLICC skador, ssk:
Arteriell
Venös
Neurospykiatrisk
Arrtim-Esen J Rheumatol 2014
Skador ackumuleras
snabbare hos patienter med
LA, -starkare prediktor för
kardiovaskulära event än
aDNA
Petri et al A &R 2012
aPL associerade med
Neuropsykiatriskskada
Mok et al Medicine 2006
+aPL
aPL och klaffsjukdom
(HVD)
• Metaanalys SLE
• 23 studier
• 508 +HVD/ 988 -HVD
+aPL Kombinerat resultat OR 3.1 (2.3-4.2)
+LA
+LA Kombinerat resultat OR 5.9 (2.9-11.8)
Zuily et al Circulation 2011;124
Lars född -62
•
•
•
•
•
•
•
•
•
95 SLE debut med feber och nefrit
+ANA, trippelpositiva fosfolipidantkroppar, + SSA
Artriter
Leukopeni, lymfopeni och trombocytopeni
Migrän
2012 Op litet adenocarinom i ändtarmen, radikalt
2014 Retinaavlossning vänster öga kraftigt nedsatt syn
2016 Mitralstenos som tätnat, behandlad med ldASA(Trombyl)
5/4 tid för diskussion ang byte till waran, men insjuknat 1/4 med
propp i seende höger öga. Ser enbart ljus och mörker…
Antifofsolipid
antikroppar och
njurskador
Antifosfolipid associerad nefropati (APLN)
Njurbiopsier :
Akut (TMA) eller kronisk (APLN) micrangiopati
Intima hyperplasi
Thrombotiska ocklusioner
• APS nefropati i 23.2 % av 151 Njurbiopsier
• (Tektonidou et al A&R 2004)
• Histologisk APLN i 14.3 % av 112 SLE patientermed
njurengagemeng
• aPL
• (Gerhardsson et al AR&T 2015)
• Högre kreatinin
• Högt blodtryck
Graviditetskomplikationer APS
• Missfall
• Fosterdöd
• Pre eclampsi, eclampsi
• Tillväxthämning
• För tidig förlossning
• Trombos hos mamman
PROMISSE studien
SLE eller aPL+ gravida <12 veckor
följs prospektivt varje månad
Antal Något
“primärt
outcome”
Neonatal Fetal
död
död
Låg
Pre-term
födelse förlossning
vikt
Preeclampsia
SLE+/aPL+ 60
37%
2%
13%
18%
20%
17%
SLE+/aPL-
338
16%
1%
2%
8%
7%
7%
SLE-/aPL+
105
26%
0%
11%
10%
13%
12%
3%
0%
1%
3%
1%
2%
SLE-/aPL- 204
kontroller
Faktorer associerade med komplikationer
LA eller aCL >40E (p<0.0001)
SLEPDAI >4 (p=0.02)
Höga uratvärden (p=0.01)
Jane Salmon ACR 2013
Sammanfattning
• Autoantikroppsprofilen associerad med olika
symtombild och med prognos
• Pågående arbete att subgruppera SLE för att förstå
underliggande orsaker
• Skräddarsy behandlingar
• Överlapp med andra tillstånd
•
•
•
•
Primärt Sjögrens syndrom ,
Primärt APS,
Systemisk skleros,
Myosit m.fl.