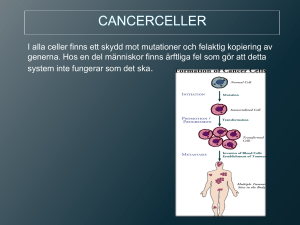
Cancer med okänd primärtumör (CUP)
advertisement

Cancer med okänd primärtumör (CUP) NATIONELLT VÅRDPROGRAM 2011 Giltighetstid 2011–2013 Nationella arbetsgruppen för Cancer utan känd primärtumör (CUP) Versionshantering Datum Beskrivning av förändring 2011- 06 - 20 Revidering av vård program från 2010 Ansvarigt stödteam/ansvarig utgivare: Regionalt cancercentrum sydöst kansli Beställningsadress: Regionalt cancercentrum sydöst kansli Universitetssjukhuset 581 85 LINKÖPING Tfn: 010 – 103 00 00 vxl E-post [email protected] Vårdprogrammet kan laddas ner från www.rccsydost.se Nationellt vårdprogram Cancer med okänd primärtumör (CUP) 2011-06-20 ISBN: 978-91-86929-01-05 Linköping juni 2011 2 Innehållsförteckning 1. INLEDNING 5 1.1 Vårdprogramgruppens sammansättning 5 1.2 Vårdprogramgruppen 5 2. MÅL MED VÅRDPROGRAMMET 7 2.1 Förändringar jämfört med tidigare version 7 2.2 Vårdprogrammets förankring 7 2.3 Evidensgradering 7 2.4 Definition av cancer med okänd primärtumör 8 2.5 Inledande sammanfattning 9 3. EPIDEMIOLOGI 12 4. PROGNOS 14 5. NATURALHISTORIA OCH ETIOLOGI 17 6. VÅRDKEDJA 17 7. SYMTOM, KLINISKA FYND SAMT DIAGNOSTIK 18 7.1 Symtom 18 7.2 Biologi, patogenes, patofysiologi 18 7.2.1 Primärtumören 18 7.2.2 Metastasering 20 7.3 Utredning 21 7.3.1 Utredning 21 7.3.2 Histopatologisk - cytologisk diagnostik 21 7.3.3 Genetisk diagnostik 27 7.3.4 Molekylärbiologisk diagnostik 27 7.3.5 Bild- och funktionsmedicinsk diagnostik 28 7.3.6 Kemiska laboratorieundersökningar 29 7.3.7 Utredningar vid andra specialiteter än onkologi 30 7.3.8 När ska utredningen avslutas 32 8. BEHANDLING 38 8.1 Kemoterapi 38 8.2 Målsökande behandling 40 8.3 Radioterapi 40 8.4 Kirurgisk behandling 42 3 8.5 Kirurgisk behandling av speciella tumörformer 46 9. PSYKOSOCIALA ASPEKTER OCH CANCERREHABILITERING 53 10. OMVÅRDNAD 55 11. NUTRITION 56 12. KVALITETSINDIKATORER OCH KVALITETSREGISTER 57 Bilaga 1 Exempel på cytostatikaregim (Cisplatin - Doxatel) vid CUP 58 Bilaga 2 Distress - termometer 63 Bilaga 3 Regionala enheter m speciell inriktning på utredningar/CUP 64 Bilaga 4 Gastrointestinala endoskopiska ultraljudsundersökningar 4 65 1. INLEDNING 1.1 Vårdprogramgruppens sammansättning En nationell multidisciplinär och multiprofessionell grupp för handläggning av cancer med okänt ursprung hos vuxna (cancer of unknown primary - CUP) bildades 2007. Medlemmarna förtecknas nedan, punkt 1.2. 1.2 Vårdprogramgruppen Gunvén Peter, (programredaktör). Överläkare. Onkologiska kliniken, Karolinska universitetssjukhuset/Solna Amptoulach Sousana, Läkare. Jubileumskliniken, Sahlgrenska universitetssjukhuset, Göteborg Berglund Åke, Överläkare. Onkologiska kliniken, Akademiska sjukhuset, Uppsala Blomqvist Lennart, Överläkare. Röntgenkliniken, Karolinska universitetssjukhuset/Solna Bozoky Béla, Överläkare. Kliniken för patologi - cytologi, Karolinska universitetssjukhuset/Solna Carlstedt Göran, Överläkare. Onkologiska kliniken, Centrallasarettet, Växjö Eberhard Jakob, Avdelningsläkare. Onkologiska kliniken, Skånes Universitetssjukhus Lund Elmberger Göran, Överläkare. Avdelningen för patologi, Karolinska universitetssjukhuset/Solna Grönros Katja, Onkologsjuksköterska. Onkologkliniken, Karolinska universitetssjukhusets mottagning på Södersjukhuset, Stockholm Hallsten Lennart, Överläkare. Onkologiska kliniken, Skånes Universitetssjukhus Malmö Helde-Frankling Maria, Specialistläkare. Onkologkliniken, Karolinska universitetssjukhuset/Solna 5 Lengstrand Gunnar, Specialistläkare. Avdelningen för onkologi, Sahlgrenska universitetssjukhuset, Göteborg Lindgren, Charlotte. Leg. Sjuksköterska, fil mag. Regionalt cancercentrum sydöst kansli Nielsen Nielshilmer, Överläkare. Onkologiska kliniken, Norrlands universitetssjukhus, Umeå Randén Margareta, Överläkare. Stockholms sjukhem, Stockholm Starkhammar Hans, Överläkare, docent, verksamhetschef. Regionalt cancercentrum sydöst kansli Sundin, Anders. Överläkare. Röntgenkliniken, Karolinska universitetssjukhuset/Solna Tot, Tibor. Överläkare. Laboratoriemedicin Dalarna, Avdelningen för klinisk patologi och cytologi, Falu lasarett Wall, Najme. Överläkare. Onkologiska kliniken, Universitetssjukhuset i Linköping Öhman, Maria. Onkologsjuksköterska. Onkologkliniken, Karolinska universitetssjukhusets mottagning på Södersjukhuset, Stockholm Adjungerade författare Barbany Bustinza Gisels, Chef. Enheten för förvärvade kromosomavvikelser, Klinisk genetik, Karolinska universitetslabotatoriet Karolinska universitetssjukhuset/Solna (Genetisk diagnostik) Dellson Pia, Specialistläkare. Onkologiska kliniken, Skånes Universitetssjukhus Lund (Psykosocial onkologi och onkologisk rehabilitering) Pettersson Christina, Dietist, Onkologiska kliniken, Akademiska sjukhuset, Uppsala (Nutrition) von Sivers Karin, Överläkare. Röntgenkliniken, Karolinska universitetssjukhuset/Solna (Gastrointestinala endoskopiska ultraljudsundersökningar) 6 2. MÅL MED VÅRDPROGRAMMET Vårdprogramgruppen har samlat aktuellt vetande i ett nationellt vårdprogram för att förbättra handläggningen av patienter med misstänkt eller klarlagd CUP-diagnos. Riktlinjerna omfattar utredningsförlopp från det att CUP är ett möjligt alternativ tills en diagnos, CUP eller mer specifik, ställts samt behandling av äkta CUP (definition – se punkt 2.3). Utredning av onormala blodprover, möjligen cancerorsakade symptom eller morfologiskt overifierade abnorma röntgenfynd faller utanför programmets ämnesområde. Vid de frågeställningarna kan dock avsnitten om diagnostiska metoder ge viss ledning. 2.1 Förändringar jämfört med tidigare version Denna version är reviderad 110620 med hänsyn tagen till nya rön och inkomna synpunkter på tidigare text i första versionen av nationellt vårdprogram Cancer med okänd primärtumör (CUP). 2.2 Vårdprogrammets förankring Det nationella vårdprogrammet framlades 090508 och godkändes efter regional förankring via onkologiska centra. 2.3 Evidensgradering Den heterogena sjukdomsgruppen CUP har sällan studerats med kontrollerade studier. En fransk programgrupp fann inga situationer som belysts med stark evidens, utan graderade sina riktlinjer efter omfattningen av enighet i gruppen (1). Med hänsyn till det stora kunskapsområdet har vår grupp låtit kapitelförfattarnas analyser väga tungt och avstått från gradering. Programmet anger därför ofta handläggningar, som inte är de enda tänkbara men används och saknar säkerställt bättre alternativ. Bevisvärdet för analyserad litteratur är i regel lågt – mycket lågt, någon gång måttligt, enligt GRADE-systemet. Följande översikter och länkar kompletterar vårdprogrammet: - Summary of the Standards, Options and Recommendations for the management of patients with carcinoma of unknown primary site (1). - Begränsa utredningen vid cancer utan känd primärtumör (2). - ESMO Guidelines Working Group, Cancers of unknown primary site: ESMO clinical recommendation for diagnosis, treatment and follow-up. (3). - Cancer of unknown primary site. (4). - USA:s National Cancer Institutes hemsida för läkare (5). 7 - Diagnostic and therapeutic management of cancer of an unknown primary (6). - Carcinoma of unknown primary (CUP) (7). - Forty years experience of treating cancer of unknown primary (8). - Management of patients with metastatic cancer of unknown primary (9). - Cancer of an unknown primary site (10). - Cancernetwork: Cancer Management Handbook, kapitel om CUP (11). 2.4 Definition av cancer med okänd primärtumör CUP är en heterogen sjukdomsgrupp med morfologiskt bekräftad metastatisk cancer där primärtumören är okänd trots adekvat utredning: utförlig anamnes och dito status, DT av thoraxbuk-bäcken och vid behov också av halsen, adekvat tumörmaterial för histologisk typning, samt symtom- och sannolikhetsstyrda övriga undersökningar (8). 8 2.5 Inledande sammanfattning Diagnosen cancer med okänd primärtumör (Cancer of unknown primary, ”CUP”) kräver noggrant anamnestagande, fullständigt status, DT eller motsvarande av thorax - buk och eventuellt hals samt morfologisk undersökning med immunfärgningar av tumörvävnad. Därtill kommer vid behov ytterligare symtom- och sannolikhetsstyrda undersökningar: endoskopier, mammografi, gynekologisk undersökning, serumtumörmarkörer med flera. Om detta inte ger ett sannolikt ursprung för en cancer eller odifferentierad malignitet föreligger äkta CUP. Melanom, sarkom, lymfom och vissa neuroendokrina tumörer räknas ibland inte in i sjukdomsgruppen även om tydlig primärtumör saknas, eftersom histogenesen styr behandlingen. Påfrestningar och möjlig nytta för den sjuke ska bedömas före och under utredningen. På medtagna sjuka underlåts utredning eller efterforskas i första hand tumörer som kan påverkas med hormon- eller cytostatikamedicinering: vissa hematologiska maligniteter, tumörer i bröst, prostata, gonader, sköldkörtel, eventuellt kolorektum. Anatomiskt begränsade, möjligen primära tumörer som ibland kan åtgärdas i botande syfte med lokala behandlingsmetoder ska beaktas. För alla sjuka betonas vikten av lindring av kroppsliga och psykiska symtom samt av förebyggande och behandling av näringsbrist.Totalt har gruppen patienter med CUP dålig prognos med median överlevnadstid något under ett halvt år. Dock finns undergrupper med förhållandevis god prognos och ibland möjlighet till bot efter antitumoral behandling: - Isolerad axillär metastasering hos kvinnor, behandlas som bröstcancer - Peritoneal carcinos med drag av ovariell cancer hos kvinnor, behandlas som ovarialcancer - Skivepitelcancermetastaser i halslymfkörtlar, behandlas som H&N-cancer - Extragonadala germinalcellstumörer (lågt differentierade, ofta i medellinjen hos män), behandlas som germinalcellstumör - Tydligt neuroendokrint differentierade tumörer, behandlas enligt riktlinjer för sådana - Metastaser som är solitära eller som har begränsat antal och utbredning, kan eventuellt behandlas i botande syfte med lokal behandlingsmetod - Män med sklerotiska skelettmetastaser eller förhöjt s-PSA eller med PSAfärgning i tumörceller kan ges hormonell behandling som vid prostatacancer - Vid möjlighet för lymfom beaktas möjligheten att prova lymfomregim - Vid inguinal - ilioinguinal lymfkörtelmetastasering kan en betydande minoritet av patienterna överleva fem år efter lokal behandling. Vid äkta CUP utanför grupperna ovan kan till sjuka i gott allmäntillstånd ges cytostatikaregimer som i första hand väljs efter sannolik primaritet. Saknas den vägledningen föreslås i första hand kombinationsbehandling med taxan och platinaförening om tillståndet tillåter. Vida spridd sjukdom, lever- eller hjärnmetastaser, dåligt allmäntillstånd, onormala nivåer av albumin och LD anger vanligen dålig prognos, dock utan att hindra antitumoral behandling i utvalda fall. 9 Flödesschema vid malignetsutredningar som leder till diagnos okänd primärtumör UTANFÖR CUP - ENHET MALIGNITETSMISSTANKE Detaljerad ANAMNES, detaljerat STATUS RIKTAD bild- och funktionsDIAGNOSTIK/ endoskopi m fl. undersökningar Om möjligt BIOPSI Vid behov rådfrågas organinriktad opererande specialitet/onkolog PALLIATION INGEN SANNOLIK PRIMÄRTUMÖR FUNNEN - CUP UTANFÖR I SAMRÅD MED ELLER PÅ CUP - ENHET 10 FULLSTÄNDIG ANAMNES, FULLSTÄNDIGT RUTINSTATUS, DATORTOMOGRAFI THORAX-BUK med ivkontrast, vid högt sittande största tumörmassa också av halsen. ÖVRIGA UNDERSÖKNINGAR styrda av sannolikhet: mammografi, endoskopier, gynekologisk undersökning, Serumtumörmarkörer mm BIOPSI om ej tidigare gjord, vb kompletterande färgningar FORTSATT PALLIATION INGEN SANNOLIK PRIMÄRTUMÖR FUNNEN – CUP VÅRDPROGRAMSTYRD INDIVIDUALISERAD HANDLÄGGNING anpassad efter patientens tillstånd, sjukdomsutbredning och ev. särdrag hos tumören. Oftast via onkologisk klinik på grund av spridd sjukdom. Vb konsulteras specialiserad CUP-enhet, se förteckning över vårdprogramgruppens medlemmar i vårdprogrammet. REFERENSER 1. Bugat R et al. för FNCLCC. Summary of the Standards, Options and Recommendations for the management of patients with carcinoma of unknown primary site (2002). Br J Cancer 2003;89 Suppl 1:S59-66 2. Berglund Å et al. Begränsa utredningen vid cancer utan känd primärtumör. Läkartidningen. 2005;102:2946-8, 2950-2, http://www.lakartidningen.se/store/articlepdf/2/2228/ LKT0541s2946_2952.pdf 3. Pavlidis N et al. for the ESMO Guidelines Working Group.Cancers of unknown primary site: ESMO clinical recommendation for diagnosis, treatment and follow-up. Ann Oncol 2010;21 (suppl 5): v228-v231.doi:10.1093/annonc/mdq193 4. Greco FA, Hainsworth JD. Cancer of unknown primary site. Kapitel 56 i Cancer, principles and practice of oncology, 8 uppl. (DeVita, Lawrence och Rosenberg, red.). Wolters Kluwer Lippincott William & Wilkins, 2008 5. http://www.cancer.gov/cancertopics/pdq/treatment/unknownprimary/ healthprofessional/ (USA:s National Cancer Institute) 6. Pavlidis N et al. Diagnostic and therapeutic management of cancer of an unknown primary. Eur J Cancer. 2003;39:1990-2005 7. Pavlidis N, Fizazi K. Carcinoma of unknown primary (CUP). Crit Rev Oncol Hematol. 2009;69:271-8. Epub 2008 Nov 1 8. Pavlidis N. Forty years experience of treating cancer of unknown primary. Acta Oncol. 2007;46:592-601 9. Ghosh L et al. Management of patients with metastatic cancer of unknown primary. Curr Probl Surg 2005;42:12-66 10. Fizazi K (red). Cancer of an unknown primary site. Taylor &Francis, New York–London 2006 11. http://www.cancernetwork.com/cancer-management-12/chapter25/article/ 10165/1537008 11 3. EPIDEMIOLOGI Cancer utan känt ursprung anges vara 3 - 5 procent av all malignitet (1, 2, 3, 4). Ålderstandardiserad årlig incidens per 100 000 personer är i USA 7 - 12 (5), i Australien 18-19 (6) och i Sverige 12 – 14 (7). Skillnaderna kan bero på definitioner, utredningsrutiner, befolkningssammansättning, obduktionsfrekvens och säkerheten i rapportering. I Sverige insjuknar årligen knappt 1500 individer, två tredjedelar mellan 50 och 79 år och en fjärdedel äldre. I Norden hade läkare lägst incidenskvot, 0,68, och servitörer, kockar, frisörer och icke yrkesarbetande högst (8). Cancer i ”Other and unspecified sites, site unknown” utgjorde i Cancerregistret 2009 drygt 2 procent av männens cancer och drygt 3 procent av kvinnornas. Diagnosen är dock dåligt definierad med risk för felrapportering. Tidigare ökade antalet fall i Sverige, mest bland äldre, men ökningen förklarades inte helt av den växande andelen äldre i befolkningen. De senaste åren har incidensen sjunkit (9). En minskning ses också för vissa andra rökningsrelaterade cancrar (7). Könsspecifik incidens av CUP per 100 000 invånare över tiden visas nedan (Randén m fl, Acta Oncologica 2009, med tidskriftens tillstånd): 2 0,0 1 8,0 1 6,0 1 4,0 1 2,0 M a le s 1 0,0 F em a l e s 8,0 6,0 4,0 20 0 5 2000 1 99 5 1990 1 9 85 19 8 0 1975 1 97 0 19 6 5 0,0 1960 2,0 Inga större regionala incidensskillnader finns i Sverige (9). Också i USA tenderar antalet fall att minska, men eftersom prognosen är dålig ligger CUP på fjärde plats som orsak till cancerdöd där (10). 12 Incidensutvecklingen för histologiska underformer av CUP (Randén m fl, Acta Oncologica 2009, med tidskriftens tillstånd): 9 8 7 A d e n o c a r c in o m a 6 S q u a m o u s c e ll c a rc i n o m a 5 U n d iffe r e n t ia t e d m a l ig n a n c y 4 B io p s y n o t p r o ve n 3 O t h e r m o r p h o l o g ic ty pes 2 2005 2000 1995 1990 1985 1980 1975 1970 1965 0 1960 1 Främst varierar adenocarcinomen i förekomst. I CUP-material överväger ofta adenocarcinom NUD, med ovanligare lågt differentierade adenocarcinom eller dito carcinom, skivepitelcancer, lågt differentierad inte typningsbar malignitet och neuroendokrina tumörer. Eftersom melanom och sarkom får specifik behandling räknas spridd sådan sjukdom utan primärtumör ofta inte till CUP (11). Initial lokalisation av CUP är i 75 procent under diafragma. Om primärtumören senare upptäcks, vilket är ovanligt, hittas den oftast i lunga eller pankreas (12). REFERENSER 1. Levi F et al. Epidemiology of unknown primary tumours. Eur J Cancer 2002;38:1810-2 2. Jemal A et al. Cancer statistics 2003, CA Cancer J Clin 2003;53:5-26 3. Parker D, Muir C, Whelan S. Cancer incidence in five continents. IARC Sci Publ Lyon: IARC, 1992, pp 45-173 4. Daugaard G. Unknown primary tumours. Cancer Treat Rev 1994;20:119-147 5. Silverberg E, Lubera J. Cancer statistics, 1987. CA, Cancer J Clin 1987;37:2-19 6. Coates M, Armstrong B. NSW Central Cancer Registry. Cancer in New South Wales, incidence and mortality. NSW Cancer Council NSW, 1995 13 7. Cancerregistret.CancerincidenceinSweden 2009. http://www.socialstyrelsen.se/Lists/Artikelkatalog/Attachments/ 18204/2010- 12-17.pdf 8. Pukkala E, et al. Occupation and cancer – follow-up of 15 million people in five Nordic countries. Acta Oncol. 2009; 48(5):646-790 9. Randén M et al. Cancer patients without a known primary:incidence and survival trends in Sweden 1960-2007. Acta Oncol 2009; 10:1-6 10. Jemal A et al. Cancer statistics, 2006. CA Cancer J Clin 2006; 56:106-30 11. Greco FA, Hainsworth JD. Cancer of unknown primary site. Kapitel 56 i Cancer, principles and practice of oncology, 8 upplagan (DeVita, Lawrence och Rosenberg, red.). Wolters Kluwer Lippincott William & Wilkins, 2008 12. Lembersky BC, Thomas LC. Metastases of unknown primary site. Med Clin North Am 1996;80:153-171 4. PROGNOS CUP medför kort median överlevnadstid, i studier 9-12 månader men befolkningsbaserat under ett halvår (1). Undergrupper har dock en potentiellt botbar sjukdom som måste identifieras och behandlas (se kapitel 8, behandling), och drygt 10 procent av patienterna långtidsöverlever (2, 3, 4, 5). Klarlagda primärtumörer har bättre prognos (6), men det kan bero på att de tumörer som låter sig upptäckas har gynnsammare biologi, eller på att gott allmäntillstånd eller gynnsamma prognosfaktorer leder till noggrannare utredningar. Relativ överlevnad för svenska CUP-patienter sedan 1960-talet visas nedan (Randén m fl, Acta Oncologica 2009, med tidskriftens tillstånd). 1,0 0,9 0,8 0,7 1 9 6 0 -6 9 0,6 1 9 7 0 -7 9 0,5 1 9 8 0 -8 9 1 9 9 0 -9 9 0,4 2 0 0 0 -2 0 0 7 0,3 0,2 0,1 0,0 0 14 1 2 3 4 5 Åldersspecifika relativa överlevnader uppvisar stora skillnader: (Randén m fl, Acta Oncologica 2009, med tidskriftens tillstånd). 1 ,0 0 ,9 0 ,8 0 ,7 Y ounger than 30 y e a rs 0 ,6 3 0 -4 9 y e a rs 0 ,5 5 0 -7 9 y e a rs 0 ,4 8 0 y e a rs a n d o ld e r 0 ,3 0 ,2 0 ,1 0 ,0 0 1 2 3 4 5 I kapitel 8 (behandling) beskrivs undergrupper med över- eller undergenomsnittlig prognos. Till de senare hör levermetastaser, carcinos med icke-papillärt adenocarcinom, multipla hjärn-, lung- eller skelettmetastaser (3). Sjuka med enstaka lymfkörtelmetastaser, papillär peritoneal metastasering eller neuroendokrina tumörer har bäst prognos (7). Andra visade att ålder, antalet metastaslokaler, värdet av laktatdehydrogenas, CRP och albumin, performance status samt fynd av levermetastaser är viktiga prognostiska faktorer (8, 9). Ett instrument finns som på gruppnivå anger prognos efter ett antal binära val (ja/nej) avseende olika tumörfaktorer. Medianöverlevnaderna för grupperna varierar mellan 5 och 40 månader (10). De prognostiska instrumenten är dock dåliga för att förutsäga en individs återstående livslängd och styra terapival (11). Svenska relativa överlevnadsdata med hänsyn till histologi visas nedan (Randén m fl, Acta Oncologica 2009, med tidskriftens tillstånd): 1 ,0 0 ,9 a d e n o c a r c in o m a 0 ,8 0 ,7 s q u a m o u s c e ll c a rc in o m a 0 ,6 0 ,5 u n d iffe r e n t ia t e d m a l ig n a n c y 0 ,4 n o t b io p s y p r o ve n 0 ,3 o t h e r m o r p h o l o g ic ty pe 0 ,2 0 ,1 0 ,0 0 1 2 3 4 5 15 REFERENSER 1. van der Wouw AJ et al. Epidemiology of unknown primary tumours; incidence and population-based survival of 1285 patients in Southeast Netherlands. 1984-1992. Eur J Cancer 2002;38:409-413 2. Greco FA et al. Carcinoma of unknown primary site. Cancer 2000; 89:2655-60 3. Pavlidis N et al. Diagnostic and therapeutic management of cancer of an unknown primary. Review. Eur J Cancer 2003;39:1990-2005 4. Randén M, Lewin F, Helde Frankling M, et al. Cancer without known primary (CUP). One year experience of implementation of clinical practice guidelines. Clin Oncol 2008;20:564. 5. Daugaard G. Unknown primary tumours. Tumour review. Cancer Treat Rev 1994:20:119-147 6. Abruzzese JL et al. Latent primary malignancies: Diagnostic evaluation, common primaries, and survival patterns of patients presenting with unknown primary tumours. In Proceedings of the American Society of Clinical Oncology, Los Angeles, 1995, p 435 7. Abbruzzese JL et al. Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients. J. Clin Oncol 1994;12:1272-1280 8. Culine S et al. Development and validation of a prognostic model to predict the length of survival in patients with carcinomas of an unknown primary site. J Clin Oncol 2002;20:4679-4683 9. Ayoub JP et al. Unknown primary tumours metastatic to liver. J Clin Oncol 1998;16:2105-12 10. Hess KR et al. Classification and regression tree analysis of 1000 consecutive patients with unknown primary carcinoma. Clin Cancer Res 1999;5:3403-10 11. Ferté C et al. Individual life expectancy estimation using validated prognostic scores for patients with cancer of umknown primar. Oncology. 2010;78:87-93 16 5. NATURALHISTORIA OCH ETIOLOGI Många antaganden finns om orsaker till CUP (1, 2, 3, 4) utan att säkra faktorer är kända. Sjukdomen tycks dock vara vanligare hos rökare. Det finns ingen familjär anhopning. Beträffande primär prevention sågs låg odds ratio för död, 0,56, under lång uppföljning efter strokeförebyggande salicylatintag. Låga patientantal medförde dock insignifikans och omöjlighet att bestämma dos och varaktighet av medicineringen (5). REFERENSER 1. Maiche, AG. Cancer of unknown primary. Am J Clin Oncol 1993;16:26-29 2. van der Wouw AJ etal. The unknown biology of the unknown primary tumour: a literature review. Ann Oncol 2003;14:191-196 3. Abbruzzese JL et al. The biology of unknown primary tumors. Semin Oncol 1993;20:238 4. Bell C et al. Unknown primary tumours: Establishment of cell lines, identification of unique chromosomal abnormalities and implications for a second type of tumour progression. Cancer Res 1989;49:4311 5. Rothwell PM et al. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. Lancet. 2011;377(9759):31-41 6. VÅRDKEDJA Vårdkedjor bestäms av lokala förhållanden. Vid möjlig CUP varierar utredande specialitet med hänsyn till fyndens lokalisation, den egna kompetensen och remitteringsmöjligheter. Vissa enheter utreder i sluten vård för snabb diagnos och behandling, andra i öppen vård eller stöder allmänläkare /annan aktör att göra mer eller mindre av den utredning som föregår diagnosen CUP. Den heterogena karaktären av CUP kräver ofta samarbete mellan flera specialiteter och yrkesgrupper. Kapitel 7 (Symtom och kliniska fynd samt diagnostik) berör samverkan mellan diagnostiska och kliniska specialiteter. För behandling utnyttjas ofta onkolog, kirurg, radiolog, geriatriker, algolog/ anestesiolog, företrädare för palliativ och psykosocial medicin och psykiater. Tidiga insatser av paramedicinare: dietist, sjukgymnast, arbetsterapeut och kurator är ofta nödvändiga. Sjuksköterskors omvårdnadsinsatser, ofta som kontakt- och stödpersoner och samordnare i vårdkedjan, behandlas i kapitel 10. 17 7 .SYMTOM, KLINISKA FYND SAMT DIAGNOSTIK 7.1 Symtom Cancer innebär ofta ett större upplevt hot än andra, ibland allvarligare, sjukdomar (1). Oro, nedstämdhet, vanmakt och hjälplöshet är vanliga (2). Ovisshet om primärtumörens läge kan påfresta patient och vårdpersonal och ge oro för att man inte kan förutse komplikationer eller styra behandlingen. Föga är känt om livskvalitet och sjukdomsupplevelse vid CUP. Vanligt är en kort sjukhistoria med symtom (3), spridd sjukdom och dåligt allmäntillstånd vid diagnos. Över hälften av CUP är multifokal, i en tredjedel i minst tre organ (4, 5, 6). Trötthet, viktnedgång, smärta och patologiska frakturer är vanliga och paramaligna symtom ses ibland. Vanligast tycks hyperkalcemi vara. 7.2 Biologi, patogenes, patofysiologi Sammanfattning: CUP omfattar många olika malignitetstyper utan gemensamma genetiska eller molekylära särdrag. Metastaser av subkliniska primärtumörer, bortopererad Anges efter gällande klassifikationer histopatologi och stadieindelning. malignitet feltolkad som benign,förovanlig primärtumör feltolkad som CUP, tumörer utgångna från aberrant vävnad och förändrad histologisk bild efter "Skriv text" tumörprogression kan förklara verklig eller skenbar CUP. Spridningsmönstret är ofta atypiskt vid tumörer som debuterat som CUP men senare får en specifik diagnos. Metastasering kan betraktas som ett spektrum mellan å ena sidan lagbunden stegvis spridning som ibland är begränsad till botbara oligometastatiska tillstånd, å andra sidan en från början generaliserad sjukdom som är obotlig med lokala behandlingsmetoder. Vid CUP torde sjukdomen oftast ligga nära det senare alternativet. Man får dock inte glömma möjligheten av botbar oligometastasering, till exempel till regionala lymfkörtlar, eller av en primärtumör som feltolkas som metastas men är botbar. 7.2.1 Primärtumören Gemensamma cytogenetiska eller molekylärbiologiska drag saknas för de heterogena tumörerna. I stället används molekylärbiologisk karakterisering försöksvis för att ge en sannolik diagnos genom att påvisa likheter med kända tumörformer (7). Flera skäl kan förklara att ett sannolikt ursprung för en malignitet inte kan fastställas. 18 En förmodad metastas kan vara primär på platsen. Ursprunget kan vara normal vävnad på platsen, t ex vid kolangiokarcinom, lågt differentierade tumörer, eller småcelliga tumörer som kan uppstå i de flesta organ (8). Fetala organanlagsrester såsom mjölklist eller Müllersk gång hos män kan ge upphov till oväntade tumörer, och gemensamt embryologiskt ursprung förklarar ovarialcancerliknande primära peritoneala carcinom. Andra avvikande vävnader är teratom, struma ovarii, extragonadala germinalceller, pankreasvävnad i ventrikeln och malignifierat skivepitel i urinblåsan. Tumöromvandlade aberranta epitelceller i lymfkörtlar har ibland trotts förklara skenbara lymfkörtelmetastaser utan primärtumör. Tumörprogression omvandlar troligen någon gång vanliga tumörer i prostata, bröst, tarm och urinblåsa till småcellig cancer (8), och recidiv av småcellig extrapulmonell cancer efter kemoterapi kan ha en icke-småcellig komponent (9). Olika uttryck av östrogen- och progesteronreceptorer samt HER2 i primär bröstcancer och senare metastaser är inte ovanliga (10), och hjärnmetastaser från skivepitelcancer i lungan hade signifikant lägre vimentinuttryck än primärtumörer (11). Vid äkta metastatisk CUP kan en avlägsnad primärtumör med förbisedd malignitet (naevi, bröstreduktioner, gi-polyper) ha metastaserat, men borde upptäckas av noggrann anamnes och eftergranskning av eventuella preparat. Oftast saknas en sådan sjukhistoria och då antas en subklinisk primärtumör växa långsamt, inte alls eller ha gått i spontan regress medan metastaserna växer snabbare. En klassisk teori om tumörers ”unit characteristics” antar att sådana, exempelvis förmåga till okontrollerad växt, invasion och metastasering, varierar oberoende av varandra (12). Metastasering utan påvisbar primärtumör skulle då förklaras av att metastaseringsförmågan överstigit primärtumörens tendens till lokal växt, som dock ökat hos metastaserna. Beskriven mikroskopisk metastasering vid bröstcancer in situ kan vara i linje med hypotesen (13). Spontan tumörregress förbinds ibland med operationstrauma eller infektion, och hypotetiskt med ändrade nivåer av hormoner, immunsvar, tillväxtfaktorer eller carcinogener men mekanismerna är okända. Rapporter om spontanregress rör ofta stora tumörer som upptäckts med föråldrad radiologi, vilket kan förklara fenomenets ovanlighet. Spontan regress av subkliniska tumörer kan tänkas förekomma vid bröstcancer, eftersom kvinnor som inte mammograferats men till sist undersöktes hade drygt 20 procent färre invasiva bröstcancrar än jämnåriga som undersökts regelbundet (14). Om fenomenet är verkligt och gäller CUP är okänt. Enstaka fall har också beskrivits av ”burned-out primary”, cancerrest invid ärr i testikel vid retroperitoneal metastasering av germinalcellstumör (15). Spontan regress beräknades tidigare inträffa i ett fall per 100 000 cancersjuka, och en översikt fann 741 troliga fall under ett knappt sekel. Njurcancer, melanom, neuroblastom och lymfom-leukemi dominerade (16). Vid melanom är metastasering utan känd primärtumör relativt vanlig. Spontan regress i cirka 5 procent har antagits (17) och dermatoskopi avslöjar ibland misstänkta regredierade primärtumörer. Vid kolorektal cancer rapporterades ett tjugotal fall under 1900-talet. De skilde sig från andra tumörer med spontanregress genom att remissionen ofta blev bestående (18). 19 7.2.2 Metastasering Tumörer som debuterar med spridning innan primärtumören upptäcks har ofta ett ovanligt metastaseringsmönster för deras histogenes (19). Prostatacancer som debuterar som CUP har ofta lung- och / eller levermetastaser och bara i 25 procent skelettmetastaser. CUP av senare funnen pankreascancer skelettmetastaserar oftare än vanlig pankreascancer (20). Någon gång kan skilda egenskaper hos metastaser och kända primärtumörer leda till tvekan om sambandet. Som nämnts ovan kan primär bröstcancer och metastaser ha skilda receptoruttryck i (10, 21). Skilda egenskaper bevisar därför inte alltid skild histogenes, utan kan bero på biologisk eller metodologisk variation. Metastasering har ansetts utgöra ett spektrum mellan två extrema modeller. ”Halstead-modellen” antar en lagbunden stegvis metastasering. Obduktionsserier tydde således på att lungmetastaser från gastrointestinal cancer oftast uppkom via levermetastasering. Metastaser i binjurar, njurar, skelett med flera ställen antogs uppkomma via lungmetastasering (22). Vid magcancer går lymfatisk spridning längs regionala artärer, och tumörläget bestämmer vilka vägar som vanligen angrips. Incidens och botbarhet av metastaser i olika körtelgrupper minskar ju längre de ligger från tumören. ”Skip metastases” som hoppat över en körtelgrupp och slagit sig ned i en avlägsnare sådan är sällsynta (23). Atypisk, till och med retrograd, spridning torde dock kunna ske om regionala körtelstationer blockeras av metastaser. Halstead-modellen förklarar att spridning till lymfkörtlar, lunga eller lever kan vara begränsad och botas med lokala behandlingsmetoder vid vissa cancerformer (24, 25). Risken för oupptäckt generalisering måste dock vägas mot påfrestningar och risker med behandling i botande syfte vilket diskuteras i kapitel 8, Behandling. Den kontrasterande ”Fisher-modellen” anser att körtelspridning påvisar stor risk för allmän spridning som kräver systemisk behandling. Teorin är fruktbar vid bröstcancer och stöds av de inte ovanliga immunkemiska fynden av tumörceller i benmärg och perifert blod (26). Likt mikrometastaser i lymfkörtlar är de cirkulerande cellerna dock inte alltid prognostiskt viktiga. Halsteadmodellen förklaras av tumörens närhet till blod- och lymfkärl med filtrerande lever, lunga och lymfkörtlar. En tumörberoende biologisk förkärlek för vissa metastaslokalisationer, ”seed and soil”, finns dessutom. Exempel är den sällsynta lymfatiska spridningen vid sarkom, och att njurcancer och melanom förhållandevis ofta metastaserar till hjärnan. Metastaseringen är ofta atypisk vid CUP som senare klarläggs. Dock antyder metastaseringsmönstret ibland en möjlig primärtumör: till hjärna, skelett, lever och binjurar vid lungcancer (27), eller till regionala lymfkörtlar från en primärtumör som sannolikt ligger nära den största metastasen. Vissa metastaslokalisationer förknippas med specifika primärtumörer om de är isolerade: adenocarcinom i axillkörtlar i 97 procent från bröst, mesenteriella lymfkörtlar i 84 procent från kolon, mediastinala lymfkörtlar respektive hjärna i cirka 2/3 vardera från lunga, och binjure i hälften av fallen från lunga (28). 20 7.3 Utredning 7.3.1 Utredning Vikten av systematisk anamnes och detaljerad kroppslig undersökning understryks. Anamnestiskt kan framkomma en ouppmärksammad tidigare tumörsjukdom eller missade symtom som föranleder en diagnosgivande endoskopi. Någon gång kan man palpera en primärtumör i exempelvis bröst eller prostata eller lättbiopserade tumörförändringar i till exempel en lymfkörtel eller perirektala implantationsmetastaser. Även om sannolikheten för sådana fynd är liten är utfrågning och undersökning snabba och komplikationsfria. Deras utelämnande är inte försvarligt. Beträffande överväganden inför utredningsstart och i fortsättningen hänvisas till summeringen av vårdprogrammet: utredningen ska ha utsikt att gynna den sjuke. 7.3.2 Histopatologisk - cytologisk diagnostik Sammanfattning: Goda remissuppgifter är väsentliga för patologens arbete. En lämplig algoritm för patologens diagnostiserande är beskrivningen av följande egenskaper hos det undersökta materialet: - Benignt / malignt? - Carcinom, sarkom, melanom, lymfom? - Närmare typning av carcinom (skivepitelcancer, urotelcellscancer, neuroendokrin cancer, germinalcellstumör, körtelbildande / inte körtelbildande adenocarcinom) - Närmare typning av adenocarcinom avseende möjliga ursprungsorgan. - Identifikation av speciella tumörformer. - Särdrag som gör riktad behandling möjlig eller upplyser om prognos (receptorer, specifika mutationer, proliferationsmarkörer). Känslighet och specificitet för vanliga immunhistokemiska markörer beskrivs. Det understryks att immunfärgningar inte är hundraprocentigt specifika, så att en sammanvägning av epidemiologiska, kliniska och morfologiska data används vid diagnostiken. Utvecklingen inom området är snabb med flera hundra antikroppar tillgängliga. Allmänt Diagnosen CUP kräver morfologiskt bekräftad malignitet. Histologisk och immunhistologisk undersökning av mellan- / grovnålsbiopsier, endoskopiska eller kirurgiska biopsier har fördelar gentemot cytologisk undersökning av finnålsaspirat, kroppsvätskor med flera material, men moderna cytologiska metoder kan ge jämförbara resultat. Risken för tumörspridning är liten vid finnålsbiopsi (29) men ökar vid större nåldiameter, flera stick och visceral tumör nära bukhinnan (30). 21 Vid provtagningen eftersträvas atraumatisk teknik och koagulationsaspekter beaktas. Samarbete mellan remittent och patolog är grund för framgångsrik primärtumörsökning. Fullgoda remissuppgifter om bakgrund, provtagningsställe, kliniska och radiologiska fynd ska ges. Patologens utlåtande ska beskriva morfologiska och immunhistokemiska fynd och deras tolkning gällande sannolika primärtumörlokalisationer. Sammanvägning av kliniska, radiologiska och histologiska / immunhistokemiska fynd väntas ge det bästa resultatet. Patologlaboratorierna ska använda kvalitetssäkrade metoder, ofta knutna till automatisering och deltagande i extern kvalitetssäkring. Användning av immunmarkörer bör begränsas till ett antal väl beprövade sådana med känd sensitivitet och specificitet. Med ökat antal använda markörer minskar sannolikheten att de kombinerade resultaten ger diagnos. I dagens läge ger ingen markör och ingen kombination av markörer helt säkra resultat, men vissa markörer är högspecifika och bör vägleda i utredning och behandling. Tolkning av immunresultat och deras betydelse för sannolikheten av primärlokalisationen kräver speciell kompetens. Många studier i ämnet är svåra att jämföra med varandra (31). Vid bedömningen vägs in epidemiologi, ålder och kön, sjukhistoria och riskfaktorer, kliniska och radiologiska fynd, vanligaste ursprung av metastaser i biopserade organ samt fenotyp av organets egna tumörer, specificitet och sensitivitet av använda markörer, intensitet och cellulär lokalisation av infärgningen, andelen färgade tumörceller och så vidare. Patologer kan variera i sin tolkning av immunpositivitet. Dock anses stark positivitet i > 50 procent av tumörcellerna regelbundet vara positivt utfall, och 10 procent är vanligast som gränsvärde för positivitet. Föreslagen algoritm Morfologisk och immunmorfologisk primärtumörsökning bör grundas på ett systematiskt närmande, exemplevis enligt följande algoritm modifierad efter Oien (32): 1. Påvisa malignitet i biopsin - hög diagnostisk säkerhet: Bevisa att biopsin är representativ, innehåller nog viabel tumörvävnad för specialfärgningar och att tumören är malign. Rutinhistologi räcker oftast. 2. Klassa tumören som melanom, lymfom, sarkom eller carcinom - hög diagnostisk säkerhet. Rutinhistologi kan upptäcka keratinisering eller körtelformationer, melanin i tumörceller m m. Flera tumörmarkörer kan stödja och bekräfta bedömningen. Markörer med brett spektrum skall användas, se nedan. Lymfom, sarkom och melanom utreds och behandlas enligt motsvarande vårdprogram, och det finns i dag inga morfologiska metoder för att spåra primärlokalisationen av dessa tumörformer. - Melanommarkörer: S-100 har 97 % sensitivitet för melanom och 75-87 % specificitet (färgar nervtumörer, fettceller, bröst och spottkörteltumörer, Langerhans-cellhistiocytos, med flera). Melan-A har 75-92 % sensitivitet, 95 % specificitet för melanom (färgar också binjurecancer). HMB45 har 75-90 % sensitivitet, 95 % specificitet för melanom, reagerar inte med lymfom och carcinom. Tyrosynase är ny markör med hög specificitet, 97-100 %. Kombination av dessa markörer verifierar de allra flesta melanom, men sarcomatoida melanom kan vara negativa. 22 - Lymfoida markörer: LCA är ett utmärkt lymfoid markör med brett spektrum och ytterst hög sensitivitet och specificitet, som reagerar med de flesta låg- och höggradiga non-Hodgkin´s lymfom men inte med carcinom, sarkom och melanom. Anaplastiskt storcelligt lymfom är dock negativt för LCA (färgas med ALK1 och CD30) liksom granulocytiskt sarkom (CD15, CD43, CD68, myeloperoxidase). Hodgkins lymfom har ofta typisk morfologi, lätt att skilja från CUP. - Sarkom: Sarkomens primärtumörer blir oftast uppenbara innan de spritt sig, och metastaser av sarkom i ett CUP-scenario är ytterst sällsynta. Oftare är en sarkomliknande metastas sarkomatoitt carcinom eller melanom. Metastatiskt sarkom är sällan positivt för pan-cytokeratin, ofta fokalt och enbart i sin epiteloida komponent. S-100 är positiv i vissa sarkom. Vimentin, som ofta används som mesenkymal markör, uttrycks av de flesta melanom och ofta av carcinom. En tumör som är negativ för LCA, pan-cytokeratin och melanommarkörer men är positiv för vimentin är dock med all sannolikhet ett sarkom. CD99 är en känslig men inte helt specifik markör för Ewingsarkomfamiljens tumörer. - Epiteliala markörer: De flesta CUP är epiteliala tumörer, carcinom. Bredspektrum cytokeratinblandningar, så kallade pan-cytokeratinmarkörer, (både typ I, acidic, low molecular weight och typ II, basiska, high molecular weight cytokeratiner), till exempel AE1/3 eller MNF116, reagerar diffust och starkt med de allra flesta carcinom med nära 100% sensitivitet och specificitet. Sarkom, lymfom och melanom reagerar sällan med dessa markörer, då oftast fokalt och svagare. 3. Om carcinom, klassa tumören som germinalcellstumör, skivepitelcancer, urotelial cancer, neuroendokrin tumör, körtelbildande / inte körtelbildande adenocarcinom - måttlig till hög diagnostisk träffsäkerhet. De flesta metastatiska germinalcellstumörer hittas hos män med ursprung i testis. Cirka 40 % av primära testistumörer är seminom, 20 % är embryonal cancer, resten är ofta blandtumörer. Tumörerna är ofta möjliga att bota, vilket gör deras diagnostiserande av största vikt. Följer man algoritmen och tar med germinalcellstumörer i den, är differentialdiagnosen relativt lätt. Skivepitelcancer utgör 5-10 % av CUP och drabbar oftast regionala lymfkörtlar. Högt differentierade varianter känns oftast igen vid rutinhistologi. Lågt differentierade, spolcelliga och basaloida skivepitelcancrar är svårare att diagnostisera. Neuroendokrina tumörer utgör cirka 5 % av CUP och har olika differentieringsgrad. Solida adenocarcinom liknar neuroendokrina tumörer men saknar diffus positivitet för deras markörer och ofta för vanliga adenocarcinommarkörer. Primära sådana tumörer i lever och binjure kan vara svåra att histologiskt skilja från metastaser. - Germinalcellstumörer: Markören OCT4 markerar seminom och embryonalt carcinom med nära 100 % sensitivitet och specificitet. Icke seminomatösa tumörer reagerar med pan-cytokeratin. Alla germinalcellstumörer med undantag av vissa yolk sac-tumörer reagerar med PLAP. Yolk sac-tumörer reagerar istället med AFP, tumörernas koriocarcinomatösa komponent med HCG. CD30 överuttrycks i embryonal cancer, men också i vissa lymfom. 23 - Skivepitelcancer och urotelial cancer: Cytokeratin 5/6 och p63 är inga högspecifika skivepitelmarkörer. De färgar 80-90 % av skivepitelcancrar, men också 90 % av mesoteliom, 20 – 60 % av spottkörteltumörer, urotelcellscancrar, bröst- (”basal-like”) cancer, ovarie-, pankreas- och lungadenocarcinom. Co-expression av CK5/6 och p63 identifierar skivepitelcancer med 77 % sensitivitet och 96 % specificitet. Skivepitelcarcinom är oftast negativa för adenocarcinommarkörer. Det finns inga pålitliga markörer för att primärlokalisera skivepitelcarcinom. Möjlighet av primär cervixcancer finns dock om HPV kan påvisas. Urotelcellscancer är vanligen CK7+ / CK20+. - Neuroendokrina tumörer: Chromogranin A och synaptophysin är högspecifika markörer, särskilt i kombination, men är mindre sensitiva eftersom de saknas i en del lågt differentierade neuroendokrina tumörer. CD56 och PGP9.5 är nyare bredspektrum neuroendokrina markörer. Carcinom kan uttrycka fokal positivitet för dessa markörer, men sannolikheten att tumören är äkta neuroendokrin ökar med ökad andel färgade celler. Endokrina tumörer kan vidare karakteriseras genom specifika produkter såsom insulin, glukagon med flera, eller andra specifika reaktioner, som CK20- uttryck i Merkelcellstumör. Primärlokalisation av högt differentierade neuroendokrina tumörer, carcinoider, kan ibland spåras med hjälp av TTF1 som finns i 43 % av lungcarcinoider och CDX2 som finns i 86 % av appendix- och coloncarcinoider, mycket sällsyntare i ventrikel- eller rektumcarcinoider. Situationen är annorlunda vid lågt differentierade neuroendokrina tumörer: TTF1 färgar 90 % av småcelliga lungcancrar, men även 50 % av småcelliga cancrar av annat ursprung. - Solida adenocarcinom: Hepatocellulär levercancer (HCC) kan innehålla gallpigment, cytoplasmatiska fettvakuoler eller Mallory hyalin; Hepar-1(hepatocytantigen) markerar dessa tumörer med 55-95 % sensitivitet och måttlig specificitet men kan hittas i ventrikelcancer med flera tumörer. AFP (alfafetoprotein) färgar bara 20-32 % av HCC. Den typiska kanalikulära positiviteten i HCC för polyklonal CEA (70-80 % av fallen), CD10 (40-60 %) och CD13 (96 %) är nära hundraprocentigt specifik. Binjurebarkcancer färgas av inhibin (70-100 %), Melan-A (50-100 %) och Calretinin (90 %) med hög specificitet. Inhibin färgar dock också ovariella stromatumörer, Melan-A också melanom och angiomyolipom, och calretinin också mesoteliom. 4. Adenocarcinom - varierande diagnostisk träffsäkerhet. De flesta CUP är lumenbildande adenocarcinom och uttrycker ”glandulära” cytokeratiner CK 8, 18, 19 och 7 till skillnad från skivepitelcancer. Vissa adenocarcinom har typisk morfologi i rutinfärgning så att erfarna patologer kan gissa sig fram till deras primaritet utan stöd av immunmarkörer i upp till cirka hälften av fallen (33). Immunfenotypning ökar träffsäkerheten och bör börja med kombination av CK20 och CK7 kompletterat med ”organspecifika” markörer (Tabell 1). Primärlokalisation i kolorektum och prostata kan bestämmas med hög sannolikhet men tumörer i pankreas eller gallgångar är svåra att identifiera; tyvärr är de bland de vanligaste CUP-tumörerna. Ventrikelcancrar har mycket varierande immunfenotyp. - Prostatacancer är i de allra flesta fall CK7-/CK20-. 95-100 % av primära prostatacancrar uttrycker PSA, vilket är högspecifikt (upp till 99 %) men i sällsynta fall uttrycks av bröst-, spottkörtel- och hudadnextumörer. Lågdifferentierade prostatacancrar kan förlora sin PSA-positivitet. I dessa fall kan PAP eller p501s användas. 24 - Lungadenocarcinom är oftast CK7+/CK20-. TTF1 är en sensitiv och specifik markör som uttrycks i 70-90 % av icke slemproducerande lungadenocarcinom och i 40-50 % av storcelliga lungcancrar. Bronkioloalveolära carcinom är ofta CK7+/CK20+ och TTF1+. Mucinösa lungcancrar är ofta CK7+/CK20+ och TTF1-. En ”enteric type tumor” är mycket ovanlig och kan inte skiljas från kolorektal metastasering. TTF1 uttrycks av småcelliga lungcancrar och lungcarcinoider men inte av skivepitelcancer. TTF1 uttrycks i mer än 50 % av thyreoideatumörer, och förekommer fokalt i ett fåtal extrapulmonella adenocarcinom så att fokal infärgning i ventrikel-, kolon- och prostatatumörer har rapporterats. - Kolorektalcancer är CK7-/CK20+ i cirka 90 % av fallen. De har stark diffus positivitet för CDX2 i mer än 90 %. Lika stark diffus CDX2 infärgning ses i 64 % av mucinösa ovariala tumörer, i 20-30 % av gastroesofageala adenocarcinom och i sällsynta adenocarcinom i urinblåsa. Ytterst sällan finns CDX2-positivitet i icke gastrointestinala tumörer. - Bröstcancer är oftast CK7+/CK20-. Cirka 70 % av dem är ER-positiva. Gynekologiska adenocarcinom (ovarium, corpus) är ofta ER-positiva, men uttrycker också Ca125 eller WT1. En liten andel adenocarcinom utanför bröst- och gynsfären är också ER-positiva (lunga, kolon, prostata, ventrikel). GCDFP (gross cystic disease fluid protein) uttrycks av 54-75 % av bröstcancrar med specificitet över 90 %, men hittas också i en del spottkörteltumörer, hudadnextumörer, prostata och lungtumörer. Mammoglobin färgar in mindre än hälften av bröstcancrarna och hittas också i ER-negativa tumörer. Spottkörteltumörer och corpuscancrar kan dock också uttrycka mammoglobin. - Thyreoideacancer: Follikulära och papillära cancrar i thyreoidea uttrycker thyreoglobulin och TTF1 i 50% av fallen. Medullär cancer är neuroendokrin och uttrycker calcitonin, chromogranin A, synaptophysin och ofta TTF1. Anaplastiska thyreoideacancrar är sällan thyreoglobulin- och TTF1-positiva. - Mucinösa ovariala adenocarcinom är oftast CK7+/CK20+ och uttrycker ER i 40-50 %, CDX2 i 64 %, Ca125 i 20 %, mesothelin i 30 %. Icke-mucinösa ovariella adenocarcinom är vanligen CK7+/CK20-, uttrycker ER i 50-83 %, Ca125 i 90 %, mesothelin i nästan 100 % och WT1. Ca125 hittas också i endocervikala adenocarcinom i 62 %, adenocarcinom från pankreas och gallvägar i 60 % och lungadenocarcinom i 25-40 %. Mesothelin ses också i pankreascancer och gallgångscancer i 80 %, gastroesofageal cancer i 10-20 %, lungadenocarcinom i 20-40 % och i hälften av maligna mesoteliom. Ovariella serösa och endometrioida tumörer uttrycker WT1, en specifik markör som också hittas i leukemier, melanom och mesoteliom, men inte i pankreas/gallgångstumörer, gastrointestinala eller brösttumörer. - Adenocarcinom i pankreas, gallblåsa och gallvägar inklusive primära kolangiocarcinom i lever har nästan identisk immunfenotyp. De är oftast CK20+/CK7+ och är regelbundet CEA-positiva. Uttrycker de CDX2 är infärgningen vanligen fokal och svag till skillnad från vid kolorektala tumörer. För mesothelin, Ca125 och WT1 se ovan. Flera markörer har testats för dessa tumörer: lysosym, Ca19-9, DPC4/SMAD4, MUC5AC med flera, men var ospecifika. 25 5. Specialfall - varierande diagnostisk träffsäkerhet. Morfologiska egenskaper hos tumörer kan möjliggöra användning av mer riktade immunhistokemiska algoritmer. Ett exempel är signetringsellscancrar, som har sitt ursprung i bröst, ventrikel och kolorectum, och sällan i andra organ. ER-positivitet och CK20-negativitet talar för ursprung i bröst, ER-/CK20+ fenotyp för gastrointestinalt ursprung (34). Vid metastaser i pleura, peritoneum och perikard skall möjligheten av mesoteliom alltid beaktas: lämpliga mesotelmarkörer är calretinin, CK5/6, mesothelin, WT1 och D2-40 och lämpliga epiteliala markörer är EP4, CEA, MOC31 med flera. (35). 6. Bestämning av prediktiva markörer proliferationsmarköre hög diagnostik träffsäkerhet Parallellt med primärtumörsökningen bör man immunhistokemiskt bestämma relevanta prediktiva markörer som ER, HER-2 och vid sarkom CD117, liksom proliferationsmarkörer, främst Ki67, för terapibeslut. Vid detta skall laboratorierna följa KVAST-dokumentens rekommendationer. De vanligast använda immunmarkörerna vid adenocarcinom: CK20 CK7 CDX2 TTF1 ER Mammo Ca125 WT1 PSA globin Kolon +++ + +++ Ventrikel + ++ + Pankreas + Ovarium, + mucinöst +++ + ++ ++ - + - Ovarium, seröst Bröst Lunga Prostata - +++ - - ++ - - +++ +++ - ++ + +++* - +++ : positivitet i > 90 % av fallen ++ : positivitet i 50 – 90 % av fallen + : positivitet i 10 – 50 % av fallen - : positivitet i < 10 % av fallen *För positivitet i andra organ än lunga, se texten 26 ++ + - - +++ +++ - + + - - + +++ 7.3.3 Genetisk diagnostik Solida tumörer har ofta cytogenetiska avvikelser, som kan vara komplexa med multipla kloner och subkloner. Kunskaperna är dock begränsade. För att kringgå problemet kan man försöka påvisa specifika förändringar med FISH- (fluorescence in situ hybridization) analys. FISH kan göras på imprintpreparat, cytospinpreparat från fin- och mellannålsbiopsier och på paraffinsnitt. Till skillnad från vid hematopoetiska maligniteter har man inte identifierat återkommande diagnosspecifika cytogenetiska förändringar som vägleder vid tumörer med okänd primär lokalisation. Det går dock ofta att söka efter deletioner som är överrepresenterade vid vissa tumörer. Exempelvis saknas material från kromosomarm 3p i över 90 % av lungcancrar, och 50 % av medulloblastom har en isokromosom 17q. Isokromosom 12p ses ofta i germinalcellstumörer och en sådan eller en deletion i 12p anges förekomma också i en fjärdedel av lågt differentierade huvudsakligen körtelmetastaserande maligniteter med okänd primaritet (36). Ewingsarkomfamiljens tumörer har så gott som alltid en translokation, oftast t(11;22) eller t(21;22) (37). För information om analyser och materialbehov hänvisas till enheter för klinisk genetik eller molekylär patologi i respektive region. En ny metod för att påvisa gendosvariationer i tumörceller, deletioner eller duplikationer, är SNP(single-nucleotide polymorphism) baserad array-CGH (comparative genomic hybridization) som också kan identifiera regioner med ”copy-neutral loss of heterozygosity”. Fördelen med metoden är att den är en ”screening” som informerar om hela genomet till skillnad från FISH som är en riktad analys. Metoden är väletablerad för konstitutionella tillstånd, men betraktas som experimentell för tumördiagnostik. 7.3.4 Molekylärbiologisk diagnostik Några kommersiella molekylärdiagnostiska tester för tumörtypning finns. De analyserar RNA, ibland mikro-RNA, och anges ha upp mot 90 procents noggrannhet vid kända tumörer av vilka de sägs identifiera 15 - 35 typer. Det måste bevisas att detta gäller också CUP/metastasering, som kan tänkas skilja sig molekylärt från diagnostiserbara primärtumörer med samma organursprung. Vid CUP med senare upptäckt primärtumör som analyserats blint med en sådan metod stämde diagnosen i 15 av 28 patienter, av vilka 8 ansågs ha behövt ändrad cytostatikaregim. Konventionell diagnostisering hade dessförinnan träffat rätt i bara fem fall (38). Dock gav metoden fel diagnos i tre av tjugo analyserade patienter. Preliminärt anses koloncancerprofil förutsäga svar på cytostatika i kolonkancerregimer med uteblivet svar på så kallade bredspektrumkombinationer (39). Avseende molekylärbiologiskt styrd kemoterapi, se kapitel 8.1 27 7.3.5 Bild- och funktionsmedicinsk diagnostik Sammanfattning: Som krav för diagnosen CUP ställs genomgången DT-undersökning av thorax och buk. Som rutin rekommenderas tillägg av DT av halsen vid tumörer på halsen eller skivepitelcancer ovan diafragma. MR-mammografi är aktuell som komplettering när mammografi och ultraljudsundersökning av brösten är negativa vid axillära adenocarcinommetastaser hos kvinnor. PET DT med fluorodeoxyglukos rekommenderas tidigt i utredningen av patienter i gott allmäntillstånd när möjlighet till behandling i botande syfte finns, exempelvis vid begränsad spridning till lymfkörtlar, lunga eller lever. Metoden avslöjar primärtumörer i upp till hälften av CUP-patienter. Ofta har patienterna genomgått flera avbildande undersökningar innan de fått diagnosen CUP. Före ytterligare utredning bör man beakta, att ytterligare utredning kan gagna patienter som klarar antitumoral behandling, men ofta inte dem med dåligt allmäntillstånd. Vid utredning av CUP-patienter är det viktigt att veta att omfattande radiologi lokaliserar primärtumören i bara 11 - 27 procent (40, 41, 19, 42). Till och med obduktion finner den i bara 30-67 procent (43, 44, 45, 46). Variationen i rapporterna är dock stor, och en nyare översiktsartikel angav 0 - 48 respektive 0 - 85 procent (47). En ytterligare översikt finns (48). Man kan vänta sig större framgång i diagnostiserandet av primärtumör med DT. Utan sådan upptäcktes primariteten i 11 - 26 procent men senare, med DT thorax - buk, i upp till 33 procent (49, 50). Multidetektor-DT torde ge högre siffror. Denna tekniks höga rumsupplösning medger reformatering av bildvolymerna i olika plan och tredimensionellt, men lika viktigt är hög tidsmässig upplösning som utnyttjar intravenösa kontrastmedel bättre än tidigare. Undersökningarna före CUP-diagnosen måste kvalitetsgranskas. Multidetektor-DT är starkt önskvärd för att ge god upplösning och utnyttja kontrastmedel optimalt, bland annat för att framställa väl kärlförsörjda leverlesioner i sen artärfas (= portavensinflödesfas) och så att tillräcklig mängd kontrastmedel kan laddas upp i levern för bästa framställning av kärlfattiga levermetastaser. Bild- och funktionsmedicinsk undersökning bör omfatta DT thorax och buk, som i Sverige också omfattar bäckenet. DT hals bör tilläggas om det finns patologiska lymfkörtlar på halsen, vid fynd av skivepitelcancer ovanför diafragma eller om huvudmassan av tumör sitter högt i thorax. Kompletterande utredningar bör göras vid vissa situationer: - Mammografi, eventuellt ultraljudsundersökning och MRT, vid adenocarcinom, axillkörtel eller lågt differentierat carcinom hos kvinna - Endoskopi av övre luftvägar vid halslymfkörtel - Gastroskopi övervägs vid supraklavikulär körtel (”Virchowkörtel”, som dock kan komma från många maligniteter i buk och thorax) - Rekto-/proktoskopi och undersökning av manliga / kvinnliga genitalia vid ilioinguinal körtelmetastasering - Gynekologisk undersökning inkluderande vaginal ultraljudsundersökning om PAD eller metastasmönster inger misstanke om gynekologisk cancer. 28 Positron-emissionstomografi (PET) med 18F-märkt deoxyglukos (FDG) används vid vissa tumörutredningar. Kombinerad PET och DT i samma utrustning (PET DT) rapporteras ytterligare förbättra stadieindelning vid maligna sjukdomar och kunna påverka behandlingsval (51, 52). FDG-PET lokaliserar i 35–60 procent av CUP primärtumörer som inte framställts med konventionella tekniker (53, 54). Ett par metaanalyser av metoden finns (55, 56). Av stor vikt är att multipel sjukdom upptäcks i cirka 40 procent när konventionella tekniker angett lokaliserad sjukdom. FDG-PET DT bör utföras vid liten tumörutbredning och gott allmäntillstånd om man överväger kurativt syftande behandling, till exempel av begränsad lever- eller lymfkörtelmetastasering, och bör då användas tidigt i utredningen för att undvika andra kostsamma och påfrestande undersökningar. Helkropps-MRT har visat sig vara snabbare och möjligen bättre för screening av metastaser än DT (57, 58, 59, 60, 61). Preliminära resultat är goda men tekniken är inte allmänt tillgänglig och diagnostiska för- och nackdelar är föga belysta (62). Däremot kompletterar MRT av brösten mammografi och ultraljud av brösten om dessa undersökningar utfaller negativt hos en kvinna med metastaser av adenocarcinom i axillen (63, 64). 7.3.6 Kemiska laboratorieundersökningar En tumörmarkör identifierar i idealfallet en viss tumörsjukdom och upplyser om prognos och terapisvar. Detta är sällsynt för markörer i serum eller andra kroppsvätskor (65, 66, 67). Beträffande vävnadsmarkörer, se avsnitt 7.3.2 om histopatologi. Vissa markörer bildas normalt i tumörernas ursprungsvävnad och kan vara vävnads- men inte tumörspecifika, som hormoner, PSA eller thyreoglobulin. Andra är tumörspecifika, såsom monoklonalt immunoglobulin vid plasmacellsproliferation. Många vanliga markörer saknar dock vävnads- och tumörspecificitet och är dåliga för diagnostik och terapivärdering (68). Serumivåer > 3 – 4 gånger övre normalgränsen är mer betydelsefulla än lägre förhöjningar (69). PSA bör analyseras hos män med skelettmetastaser eller vid annan misstanke på prostatacancer. Som nämns i avsnitt 8.1, Behandling, har det föreslagits att män med metastatisk CUP och förhöjda PSA-nivåer försöksvis kan behandlas som prostatacancer. Några lokaliserade cancrar har dock normalt PSA-värde medan benign hyperplasi och instrumentering, men inte prostatapalpation, kan förhöja värdena måttligt. Lågt differentierad prostatacancer kan trots spridning ha låga PSA-värden. Alfafetoprotein (AFP) är fosterlivets albuminersättning, förhöjt under graviditet och hos nyfödda. Hos vuxna kan höga nivåer tyda på hepatocellulär cancer, även om många sådana har normala markörnivåer, eller germinalcellscancer och besläktade tumörer. Misstanken börjar vid 20 μg/L och är hög vid 200, dock med låg sensitivitet. Måttligt förhöjda nivåer kan ses exempelvis vid kronisk leversjukdom utan malignitet eller andra tumörer. 29 Beta-HCG (HCG-specifik betakedja i koriongonadotropin) kan vid förhöjning tyda på germinalcellstumör / besläktad medellinjestumör eller mola – koriocarcinom, men också på graviditet. Monoklonalt immunglobulin kan ha oklar betydelse (monoklonal gammopathy of undetermined / unknown significance, MGUS) eller tyda på plasmacellsmalignitet. Ibland upptäcks en plasmacellsmalignitet inte av serumelektrofores utan bara genom analys av lätta kedjor i urinen. Undersökningarna är av värde vid skelettförändringar. Anti-Hu-antikroppar i serum /cerebrospinalvätska mot neuronal vävnad kan ge paraneoplastisk sensorisk, någon gång motorisk eller gastrointestinal, neuropati eller encefalomyelit. Sjuttio - 90 procent av dessa sjuka anges ha småcellig lungcancer, som dock kan vara mycket liten och utan spridning och ibland upptäckas först efter flera år (70). Antikropparna anges ha 99 procents specificitet och 82 procents sensitivitet vid paraneoplastiska neurologiska syndrom (71). Hormoner m fl ämnen som vanligen bildas i ursprungsvävnaden kan ha förhöjda nivåer vid maligniteter i motsvarande organ. Exempel är polypeptidhormoner (insulin, glukagon, gastrin med flera), prehormonet kromogranin A och transmittormetaboliten U-5-HIAA vid gastrointestinala neuroendokrina tumörer, calcitonin vid medullär thyreoideacancer, parathormon vid parathyreoideacancer, steroider eller katekolaminer vid binjuretumörer. Förhöjningen saknas om tumören förlorat förmågan att bilda hormon, och falsk positivitet ses vid ektopisk hormonbildning vid t ex ADH- eller ACTH-bildande småcellig lungcancer. Indirekta markörer för ökad cancerrisk är positiv hepatit B- och C-serologi samt fynd tydande på porfyri eller hemokromatos (hepatocellulär cancer), HIV-positivitet (Kaposisarkom, nonHodgkinlymfom, cervixcancer med flera maligniteter), och fynd av Helicobacter pylori (ventrikelcancer och –lymfom). Markörerna är dock mycket vanligare än maligniteterna. CA125, CEA, CA19-9, CA15-3, CA72-4 och neuronspecifikt enolas (NSE) har för låg noggrannhet för att vägleda vid utredning och behandling av CUP. CA125 kan vara måttligt förhöjt vid t ex benign ascites. 7.3.7 Utredningar via andra specialiteter än onkologi Sammanfattning: Lokala förhållanden påverkar vilka specialister som utnyttjas vid utredning av misstänkt CUP. De diagnostiska specialiteterna behandlas i andra kapitel. Kliniska specialiteter som kommer i fråga är exempelvis onkologer, invärtesmedicinare, gynekologer, kirurger, öronläkare, urologer, ortopeder, lungläkare och neurokirurger. Laparo-, mediastino- och thoracoskopi ger någon gång diagnostiska möjligheter vid CUP. 30 Lokala förhållanden påverkar vilka specialiteter som utreder möjlig eller misstänkt CUP. De diagnostiska specialiteterna behandlas i andra kapitel i vårdprogrammet. Av kliniska specialiteter anlitas ofta gynekologi, vilket ofta är motiverat vid misstänkt okänd primärtumör hos kvinnor. Metastaser på halsen kräver ofta otorhinologisk undersökning. Urologer kan cystoskopera vid bäcken- och ljumsklymfadenopatier, biopsera prostata, och primärutreder ibland misstänkta njurtumörer även i närvaro av spridning. Vid större sjukhus kan lungmedicinare - thoraxradiologer och neurokirurger – neuroradiologer bedöma radiologi och ev. biopsera tumörer inom respektive områden. Ofta primärutreder hematologer lymfkörtelförstoringar och vid skelettmetastasering ger ibland deras ”blinda” benmärgsprovtagning enklare och snabbare en malign diagnos än radiologiskt ledd skelettpunktion, till nytta vid t ex myelom eller om angelägen palliativ strålbehandling anses kräva morfologiskt bevisad malignitet. I grundutredningen rekommenderas symtomstyrda endoskopier, med låg tröskel för att utföra koloskopi. Esofago-gastro-duodenoskopier, prokto/rekto/sigmoideo/koloskopier, cystouretro/ureteroskopier och bronkoskopier är välkända. För fullständighetens skull omnämns här de specialiserade möjligheterna till ”mother and baby”-kolangioskopi då man via arbetskanalen i ett endoskop inför ett kolangioskop i gallvägarna, och intraduktal ultraljudsundersökning av gallvägarna. Vidare kan kapselendoskopi och dubbelballongendoskopi undersöka tunntarmen. Gastrointestinal endoskopisk ultraljudsundersökning (EUS) kan ofta initieras av en ”allmän” utredare och beskrivs i bilaga 4 i slutet av detta program. Endobronkiell ultraljudsundersökning EBUS - (bronkoskop kombinerat med ultraljud) ger möjlighet att punktera misstänkta tumörer via trachea – bronker, och kan användas vid lungtumördiagnostik. En diagnostisk möjlighet är laparoskopi, som ofta görs i dagvård, ibland i lokalbedövning med sedering, och ger mindre postoperativ smärta än laparotomi. Laparoskopi kan inspektera intraperitoneala organ och bukvägg, medge riktade biopsier och lavage för cytologi, och provta också små ascitesmängder. En tämligen stor andel av levermetastaser anges vara synliga på leverytan. Möjligheterna att palpera är dock begränsade. Vissa palliativt och ibland kurativt syftande åtgärder kan göras laparoskopiskt. Laparoskopisk ultraljudsundersökning medger undersökning av levern utan skymmande revben lungor och undviker störande tarmgas vid undersökning av retroperitoneum. Det korta avståndet ger god upplösning. Laparoskopi har hög specificitet vid utredning av oklar ascites (72) och anges karakterisera misstänkta mesenteriella tumörer bättre än perkutana punktioner. Metoden upptäcker begränsad peritoneal metastasering utan ascites bättre än radiologi. Incidensen av porthålsmetastaser är runt en procent (73). Avancerad men operabel cancer i buken stadieindelas ofta laparoskopiskt utan påtagliga nackdelar, och laparoskopiska resektioner av koloncancer ger samma överlevnad som öppna resektioner (74). Laparoskopi i tumörutredningar förefaller därför inte att försämra eventuell möjlighet till bot. Thorakoskopi kan inspektera pleura men också (”VATS”, video-assisted thoracoscopy) medge kilexcision av djupare liggande svårbiopserade tumörer i lungparenkym eller i nedre mediastinum som inte nås via mediastinoskopi eller med endoskopisk ultraljudsledning (75). 31 7.3.8 När ska utredningen avslutas Utredning av misstänkt cancer ska alltid relateras till möjlig patientnytta. Basal utredning bör ofta göras, men är allmäntillståndet så påverkat att god kirurgisk eller onkologisk behandling inte är möjlig bör man ha en pragmatisk inställning till ytterligare utredning. Också om en patient inte tål antitumoral behandling kan det dock finnas fördelar med att bekräfta en cancersjukdom. Ovissheten kan frustrera och vid bekräftad malignitet kan man fokusera på adekvat symtomlindring och kontakt med palliativ vårdenhet. REFERENSER 1. Mishel M et al. Predictors of psychosocial adjustment in patients with newly diagnosed gynaecological cancer. Cancer Nurs 1984;7:291-299 2. Zabora J et al. The prevalence of psychological distress by cancer site. Psycho-Oncol 2001;10:19-28 3. Blaszyk H et al. Cancer of unknown primary: clinicopathologic correlations. APMIS 2003;111:1089-94 4. van der Wouw A et al. Epidemiology of unknown primary tumours; incidence and population-based survival of 1285 patients in Southeast Netherlands, 1984-1992. Eur J Cancer 2002;38:409-13 5. Abbruzzese JL et al. Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients. J Clin Oncol 1994;12:1272-80 6. Culine S et al. Development and validation of a prognostic model to predict the length of survival in patients with carcinomas of an unknown primary site. J Clin Oncol 2002;20:4679-83 7. Horlings HM et al. Gene expression profiling to identify the histogenetic origin of metastatic adenocarcinomas of unknown primary. J Clin Oncol 2008;26:4435-41 8. Frazier SR et al. The pathology of extrapulmonary small cell carcinoma. Semin Oncol 2007;34:30-8 9. Lee SS. Extrapulmonary small cell carcinoma: single center experience with 61 patients. Acta Oncol 2007;46:846-51 10. Curigliano G et al. Should liver metastases of breast cancer be biopsied to improve treatment choice? Ann Oncol. 2011 Feb 22. [Epub ahead of print] 32 11. Prudkin L et al. Epithelial-to-mesenchymal transition in the development and progression of adenocarcinoma and squamous cell carcinoma of the lung Mod Pathol. 2009 May;22(5):668-78 12. Foulds L. The natural history of cancer. J Chron Dis 1958;8:2-37 13. Hüsemann Y et al. Systemic spread is an early step in breast cancer. Cancer Cell. 2008;13:58-68 14. Zahl PH et al. The natural history of invasive breast cancers detected by screening mammography. Arch Intern Med 2008;168:2311-6 15. Fabre E et al. 'Burned-out' primary testicular cancer. BJU Int 2004;94:74-8 16. Challis GB, Stam HJ. The spontaneous regression of cancer. A review of cases from 1900 to 1987. Acta Oncol 1990;29:545-50 17. Papac R. Spontaneous regression of cancer. Cancer Treat Rev 1996;22:395-423 18. Abdelrazeq AS. Spontaneous regression of colorectal cancer: a review of cases from 1900 to 2005. Int J Colorectal Dis 2007;22:727-36. Epub 2006 Dec 5 19. Le Chevalier T et al. Early metastatic cancer of unknown primary origin at presentation. A clinical study of 302 consecutive autopsied patients. Arch Intern Med 1988; 148: 2035-9 20. Nystrom JS et al. Metastatic and histologic presentations in unknown primary cancer. Semin Oncol 1977; 4:53-8 21. Simmons C et al. Does confirmatory tumor biopsy lter the management of breast cancer distant metastases? Ann Oncol. 2009 Mar 18. [Epub ahead of print] 22. Viadana E, Bross ID, Pickren JW. The metastatic spread of cancers of the digestive system in man. Oncology 1978;35:114-26 23. Maruyama K et al. Lymph node metastases of gastric cancer. General pattern in 1931 patients. Ann Surg 1989;210:596-602 24. Fong Y et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 1999;230:309-18 33 25. Anonymous. Long term results of lung metastasectomy: prognostic analyses based on 5206 cases. The international registry of lung metastases. J Thorac Cardiovasc Surg 1997;113:37-49 26. Riethdorf S, Wikman H, Pantel K. Biological relevance of disseminated tumor cells in cancer patients. Int J Cancer 2008;123:1991-2006 27. Quint LE et al. Distribution of distant metastases from newly diagnosed nonsmall cell lung cancer. Ann Thor Surgery 1996;62:246-50 28. Hess KR, et al. Metastatic patterns in adenocarcinoma. Cancer 2006;106:1624-33. 29. Smith EH. Complications of percutaneous abdominal fine-needle biopsy. Review. Radiology, 1991;178:253-8 30. Stigliano R et al. Seeding following percutaneous diagnostic and therapeutic approaches for hepatocellular carcinoma. What is the risk and outcome? Seeding risk for percutaneous approach in HCC. Cancer Treat Rev 2007;33:437-47 31. Tot T. Cytokeratins 20 and 7 as biomarkers: usefulness in discriminating primary from metastatic adenocarcinoma. Eur J Cancer 2002;38:758-63 32. Oien KA. Pathologic evaluation of unknown primary cancer. Semin Oncol 2009;36:8-37 33. Sheehan K et al. Metastatic adenocarcinoma of unknown primary site. A comparison of the relative contributions of morphology, minimal essential clonical data and CEA immunostaining status. Am J Clin Pathol 1993;99:729-35 34. Tot T. The role of cytokeratins 20 and 7 and estrogen receptor analysis in separation of metastatic lobular carcinoma of the breast and metastatic signet ring cell carcinoma of the gastrointestinal tract. APMIS 2000;08:467-72 35. Ordonez NG. The immunohistochemical diagnosis of mesothelioma: a comparative study of epithelioid mesothelioma and lung adenocarcinoma. Am J Surg Pathol 2003;27:1031-51 36. Pavlidis N, Fizazi K. Carcinoma of unknown primary (CUP). Crit Rev Oncol Hematol. 2009;69:271-8. Epub 2008 Nov 1 37. Pinto A et al. Pathobiologic markers of the ewing sarcoma family of tumors: state of the art and prediction of behaviour. Sarcoma. 2011; in press. Epub 2010 Oct 14 34 38. Greco F A et al. Molecular profiling in unknown primaty cancer: accurarcy of tissue of origin Prediction. Oncologist. 2010;15(5):500-6. Epub 2010 Apr 28. 39. Varadhachary GR et al. Molecular profiling of carcinoma of unknown primary and correlation with clinical evaluation J Clin Oncol. 2008 Sep 20;26(27):4442-8 40. Nystrom JS, et al. Metastatic and histologic presentations in unknown primary cancer. Semin Oncol 1977; 4:53-83 41. Stewart JF et al. Unknown primary adenocarcinoma: incidence of overinvestigation and natural history. Br Med J 1979;1:1530–3 42. Le Chevalier T et al. Early metastatic cancer of unknown primary origin at presentation. A clinical study of 302 consecutive autopsied patients. Arch Intern Med 1988;148:2035–9 43. Abbruzzese JL et al. Analysis of a diagnostic strategy for patients with suspected tumors of unknown origin. J Clin Oncol 1995;13:2094–10 44. Didolkar MS et al. Metastatic carcinomas from occult primary tumors. A study of 254 patients. Ann Surg 1977; 186:625–30 45. Maiche AG. Cancer of unknown primary. A retrospective study based on 109 patients. Am J Clin Oncol 1993; 16:26–9 46. Blaszyk H et al. Cancer of unknown primary: clinicopathologic correlations. APMIS 2003;111:1089–94 47. Al-Brahim N et al. The value of postmortem examination in cases of metastasis of unknown origin-20-year retrospective data from a tertiary care center. Ann Diagn Pathol 2005;9:77–80 48. Pavlidis N et al. Diagnostic and therapeutic management of cancer of an unknown primary. Eur J Cancer 2003; 39:1990–2005 49. Sundin A, Berglund Å. Radiological assessment. I Metastatic Carcinomas of Unknown Origin. (Wick, red.). Demos Medical Publishing, USA, 2008 50. Karsell PR et al. Computed tomography in search of cancer of unknown origin. JAMA 1982;248:340–3 51. McMillan JH et al. Computed tomography in the evaluation of metastatic Adenocarcinoma from an unknown primary site. A retrospective study. Radiology 1982;143:143–6 35 51. Antoch G et al. Whole-body dual-modality PET/CT and whole-body MRI for tumor staging in oncology. JAMA 2003;290:3199-206 52. Gutzeit A et al. Unknown primary tumors: detection with dual-modality PET/CT— initial experience. Radiology 2005;234:227-34 53. Alberini JL et al. Whole-body positron emission tomography using fluorodeoxyglucose in patients with metastases of unknown primary tumours (CUP syndrome). Nucl Med Commun 2003;24:1081-6 54. Jungehulsing M, et al. 2(F)-fluoro-2-deoxy-D-glucose positron emission tomography is a sensitive tool for the detection of occult primary cancer (carcinoma of unknown primary syndrome) with head and neck lymph node manifestation. Otolaryngol Head Neck Surg2000;123:294-301 55. Kwee TC, Kwee RM. Combined FDG-PET/CT for the deection of unknown primory tumors Systematic review and meta-analysis. Eur Radiol. 2008(a) Oct 17 (Epub ahead of print) 56. Dong MJ, et al. Role of fluoodeoxyglucose-PET versus fluorodeoxyglucosePET/computed Tomography in detection of unknown primary tumor: a meta-analysis of literature Nucl Med Commun. 2008;29:791-802 57. Schlemmer HP et al. Fast whole-body assessment of metastatic disease using a novel magnetic resonance imaging system: initial experiences. Invest Radiol 2005;40:64-71 58. Lauenstein TC et al. Whole-body MR imaging: evaluation of patients for metastases. Radiology 2004;233:139-48 59. Hylton N. Magnetic resonance imaging of the breast: opportunities to improve breast cancer management. J Clin Oncol 2005;23:1678-84 60. Kwee TC et al. Diffusion-weighted whole-body imaging with background body signal suppression (DWIBS): features and potential applications in oncology. Eur Radiol. 2008(b);18:1937-52. Epub 2008 Apr 30 61. Schorn C et al. MRI of the breast in patient with metastatic disease of unknown primary Eur Radiol. 1999;9:470-3 62. Blomqvist L. Magnetresonanstomografi inom onkologi. Onkologi i Sverige 2009;1:37-43 63. Schelfout K et al. Breast MR imaging in a patient with unilateral axillary lymphadenopathy and unknown primary malignancy. Eur Radiol. 2003;13:2128-32. Epub 2002 Nov 19 36 64. Orel S. Who should have breat magnetic resonance imaging evaluation? J Clin. Oncol. 2008;26:703-11 65. Pavlidis N et al. Evaluation of six tumor markers in patients with carcinoma of unknown primary. Med Pediatr Oncol. 1994;22:162-7 66. Pavlidis N. Forty years experience of treating cancer of unknown primary. Acta Oncologica 2007;46:592-601 67. Hayes D. Biomarkers. Kapitel 34 sektion 8 i Cancer, principles and practice of oncology, 8 uppl. (DeVita, Lawrence, Rosenberg, red.). Wolters Kluwer Lippincott William & Wilkins, 2008 68. http://www.tc-cancer.com/tumormarkers.html 69. Shahangian S, Fritsche HA Jr. Serum tumor markers as diagnostic aids in patients with unknown primary tumors. Cancer Bull 1989;41:152-6 70. Graus F et al. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain 2001;124:1138-48. 71. Vega-Boada F.Senties-Madrid H, Paraneoplastic syndromes associated with anti-Hu antibodies. Isr Med Assoc J. 2001;3:94-103 72. Yoon YJ et al. What is the role of diagnostic laparoscopy in a gastroenterology unit? J Gastroenterol 2007;42:881-6. Epub 2007 Nov 22 73. Zivanovic O et al. The rate of port-site metastases after 2251 laparoscopic procedures in women with underlying malignant disease. Gynecol Oncol 2008;111:431-7. Epub 2008 Oct 16 74. Kuhry E et al. Long-term results of laparoscopic colorectal cancer resection. Cochrane Database Syst Rev 2008;(2):CD003432 75. Krasna MJ. The role of thoracoscopy in the management of cancer patients. Semin Oncol 2008;35:129-33 37 8. BEHANDLING 8.1 Kemoterapi Sammanfattning: Evidensgrunden för regimval är svag. Singeldrogbehandling ger låg svarsfrekvens och kombinationer föredras. Erfarenheten tyder på att sannolik histogenes ska styra regimvalet. Saknas sådan vägledning kan man överväga kombinationsbehandling med taxan – platinaförening. Andralinjesbehandling har ännu lägre evidens, liksom målsökande behandling. Få fas III-studier finns. Oftast ger kemoterapi måttlig effekt utom i speciella situationer som beskrivs nedan (1, 2). Många studier omfattar få patienter, ofta då med de bästa resultaten, och surrogatmåttet tumörkrympning samvarierar dåligt med överlevnaden. Problemet att överföra denna information till den sjuke är stort. En undersökning visade att många sjuka ville få behandling med 10 procents dödlighet och ringa utsikt till nytta, att en tredjedel av dem trängde bort information om att behandlingen inte botar, att onkologer ofta överskattade återstående livslängd, att optimistiska sjuka inte levde längre än realister, och att över 40 procent av de sjuka ansåg att just de skulle få nytta av en behandling som hjälper hälften så många (3). Vårdprogramgruppens åsikt är att i görligaste mån styra kemoterapi efter sannolik histogenes. Strategin styrks av rapporter om att CUP med kolorektala molekylära egenskaper tycks ha större nytta av regimer för kolorektal cancer än av taxan-platinabaserade CUP-kombinationer (4, 5). Ett försök med profilstyrd kemoterapi vid CUP kunde bara genomföras i hälften av fallen, med tumörsvar i en tredjedel. Detta avviker inte säkert från konventionell behandling (6), men kontrollerade studier pågår. Profilstyrd kemoterapi vid kända primärtumörer har kommenterats med påpekande av dess låga evidensgrad (7). Singeldroger används sällan vid CUP eftersom fluorouracil- (F), cisplatin, methotrexate, doxorubicin (dox), mitomycin C och vincristin var för sig gav < 20 procents svarsfrekvens (RR) (2). Tidiga kombinationsregimer med F och / eller dox gav RR cirka 20 procent med median överlevnadstid (MST) ett drygt halvår, utan samband mellan RR och MST. Andelen kompletta remissioner var låg. Av väl kända regimer gav F-dox-mitomycin, FAM, en RR på 10 - 30 procent och en MST om 3,5 - 11 månader (8, 1). Senare identifierades flera undergrupper av CUP som var känsliga för platinaföreningar: papillär carcinos, neuroendokrina tumörer och lågt differentierade medellinjestumörer. Få fas III-studier finns. Oftast ger kemoterapi måttlig effekt utom i speciella situationer som beskrivs nedan (1, 2). (2). Tidiga kombinationsregimer med F och / eller dox gav RR cirka 20 procent med median överlevnadstid (MST) ett drygt halvår, utan samband mellan RR och MST. 38 Kombinationen taxan – platinaförening har ansetts sannolikt förbättra resultaten också vid CUP som inte ingår i de gynnsamma undergrupperna (8). I en randomiserad studie påvisades således bättre överlevnad och god tolerabilitet efter taxan-platinabaserad behandling än efter gemcitabinvinorelbin (9). För hela CUP-panoramat har därför RR ökat upp mot 40 – 50 procent med några få månaders förlängning av MST. CUP utanför nedanstående kategorier har dålig prognos. Multivariata analyser anger framför allt dåligt allmäntillstånd, levermetastasering och höga serumnivåer av LDH som negativa faktorer (2, 10). Andra tillstånd med dålig prognos är metastaser i mediastinala lymfkörtlar eller skelett, ickepapillär malign ascites och multipla hjärnmetastaser (8). För gynnsamma undergrupper finns behandlingsrekommendationer (8, 11): - Kvinnor med axillär lymfkörtelmetastasering av adenocarcinom utan annan spridning, behandlas i botande syfte som bröstcancer (12, 13). - Peritoneal carcinomatos hos kvinnor, speciellt seropapillärt adenocarcinom där primärtumören inte hittats i gyn-området, bröst eller GI-kanalen, behandlas som ovarialcancer (14, 15). Rapporter finns också om tillståndet hos män (8) med kemoterapi med långtidsremission. - Begränsad cervical lymfkörtelmetastasering av skivepitelcancancer behandlas enligt vårdprogram för ÖNH-cancer med neck-dissection och fraktionerad strålbehandling som omfattar också lokalisation för möjliga primärtumörer (16). - Lågt differentierad cancer med mediastinal och / eller paraaortal lymfkörtelmetastasering behandlas som extragonadal germinalcellscancer med platinabaserad cytostatikaregim (17). Alla dessa är dock inte germinalcellscancer (18). - Metastaser med högt differentierad neuroendokrin differentiering, exempelvis carcinoider, behandlas av läkare med erfarenhet av neuroendokrina tumörer. - Vissa fall av solitär metastas eller oligometastasering erbjuds behandling i botande syfte med kirurgi, stereotaktisk strålbehandling eller annan lokaldestruktiv metod. Vid metastasering till lymfkörtlar eller hud bör kirurgin följas av lokoregional strålbehandling (8). Möjligheten av feltolkad botbar primärtumör, utan eller med bara, begränsad spridning, ska beaktas, se avsnitten 8.3 om radioterapi respektive 8.4, kirurgi. - Män med förhöjt serum-PSA, PSA-färgning i tumörceller eller osteoblastiska skelettmetastaser föreslås få hormonbehandling som vid prostatacancer (19). - Odifferentierad malignitet som inte kan klassas immunhistokemiskt kan eventuellt behandlas som lymfom. - Vid inguinal / ilioinguinal lymfkörtelmetastasering av CUP med varierande histologi har över en tredjedel av fallen uppnått femårsöverlevnad efter behandling, oftast med strålbehandling i första linjen (20). Andra linjens behandling har inte varit framgångsrik. Kombinationen docetaxel – gemcitabine efter cisplatinbaserad förstalinjes behandling gav en RR på 28 procent och en överlevnad på 8 månader från insättandet (1). Vid CUP med ogynnsamma drag eller, oftast, som andra- eller tredjelinjesbehandling prövades bevacizumab – erlotinib med median överlevnadstid från 39 ”study entry” 7 månader och en tredjedel av de sjuka i livet efter ett år (21). Eftersom dåligt svar på cisplatin-taxan troddes kunna bero på gastrointestinalt tumörursprung har då provats oxaliplatin – capecitabin med RR 13 procent och mediantid till progression bara 2 månader (22). Ett förstalinjes behandlingsschema, Cisplatin – Docetaxel, med förslag till premediciering, profylax och övervakning återfinns i bilaga 1. 8.2 Målsökande behandling Ett fåtal rapporter om målsökande behandling (”targeted drugs”, antikroppar med flera) har inte påvisat fördelar. Bevacizumab-erlotinib gav således partiellt svar i 5 av 51 patienter, oftast i en andralinjessituation, med median överlevnadstid drygt 7 månader (21). Vårdprogramgruppen rekommenderar för närvarande inte användande utanför studier (23). 8.3 Radioterapi Sammanfattning: -Beträffande strålningspalliationen hänvisas till översikter och vårdprogram, exempelvis för hjärn- och skelettmetastaser. Vid hjärnmetastaser av CUP har korta behandlingar, exempelvis 4 Gy x 5, föreslagits men vid förväntad mycket kort överlevnad rekommenderas enbart steroidbehandling. I vissa fall av oligometastatisk intra- och extrakraniell sjukdom kan precisions- eller protonbestrålning ge en god balans mellan påfrestningar - resursåtgång och den begränsade utsikten till palliation eller bot. Möjliga indikationer för sådan lokal behandling i botande eller adjuvant syfte diskuteras i avsnitt 8.4, Kirurgi. Strålbehandling förefaller vid internationell jämförelse att vara underutnyttjad vid CUP i Sverige. Palliativ strålbehandling vid CUP används som vid annan malignitet, men dosval efter förmodad strålkänslighet är försvårat. För översikter hänvisas till temanummer av Acta Oncologica (24) och SBU-rapport (25). En internationell bedömning vid CUP, utom skivepitelcancermetastaser på halsen, uppskattade att drygt en fjärdedel av CUP-patienter per indikation behövde strålbehandling av skelett- eller lymfkörtelmetastaser och 6 procent för hjärnmetastaser. Man ansåg också strålbehandling av vissa symtomatiska metastaser till hud, lever och lunga motiverad, men de indikationerna föreföll ovanligare. Varierande incidens av skelettmetastaser i olika patientgrupper försvårade skattningen så att 53 - 70 procent av CUP-patienter ansågs behöva strålbehandling under någon fas av sjukdomen i institutionsmaterial (26). I Sverige användes radioterapi dock i bara 29 procent (27). 40 Intrakraniella metastaser Behandling av intrakraniella metastaser tas upp i andra vårdprogram (28, 29). De påpekar strålbehandlingens begränsade nytta enligt nyare prospektiva serier, ofta med kvarstående steroidbehov för symtomlindring. Cirka 10 procent med hjärnmetastaser kommer från CUP, långt fler från cancer i lunga, bröst, urinvägar och melanom. Vid begränsad metastasering står valet mellan kirurgi och precisionsbestrålning med stereotaktisk teknik (SRT) eller protoner, vid många eller stora tumörer helhjärnebestrålning, och i ogynnsamma fall enbart kortikosterioder (se nedan). SRT / protonstrålning brukar begränsas till ett tumörantal upp mot ett dussin och en tumörstorlek upp till 3 cm, delvis beroende på tumörernas distribution där supratentoriell lokalisation i regel ger mindre risk för biverkningar. Även föga strålkänsliga tumörer kan kontrolleras (Brown 2008a, Brown 2008b). Adjuvant helhjärnebestrålning efter SRT / resektion är omdiskuterad, eftersom den inte förlänger överlevnaden och den minskade recidivfrekvens den ger ibland inte anses uppväga de kognitiva biverkningarna (30, 31). Alternativet kan därför vara senarelagd helhjärnebestrålning vid recidiv som inte kan behandlas med kirurgi / SRT. Helhjärnebestrålning, utan föregående kirurgi / SRT, vid hjärnmetastaser enligt RadioTherapyOncologyGroup beskrivs i ovan nämnda vårdprogram. Recursive partitioning analysis (RPA)-klass I omfattar patienter under 65 års ålder med kontrollerad primärtumör och Karnofsky PS > 70 (klarar minst ADL) och har median överlevnadstid 7 månader (kontrollerad primärtumör anses vara 3 månaders stabilt status av extrakraniella tumörer, svar på kemoterapi eller förväntad överlevnad minst 3 - 4 månader). KPS < 70 definierar klass III med överlevnadstid drygt 2 månader, och alla övriga tillhör klass II med överlevnadstid 4 månader. I klass III väntas patienter över 65 års ålder med multipla hjärnmetastaser och okontrollerad primärtumör leva drygt 1 månad, yngre med kontrollerad primärtumör och en enda hjärnmetastas drygt 3 månader, och övriga knappt 2 månader. I Sverige gav helhjärnebestrålning av metastaser sämst resultat vid CUP och lungcancer med median överlevnadstid cirka 2 månader och ettårsöverlevnad 5 procent, mot > 3 månader resp. > 10 procent vid andra tumörformer. Andra har dock gynnsammare resultat vid hjärnmetastaser från CUP med en median överlevnadstid 4,8 månader, mot 3,4 månader vid känd primärtumör. Vid CUP i RPA-klass II var tiden 6 månader och i klass III 3 månader (32). Vid förväntad kort överlevnad då demensutveckling är mindre sannolik har fraktioneringen 4 Gy x 5 tillråtts (33). Vid mycket kort förväntad överlevnad på grund av faktorer som inte ingår i klassindelningen och i den mest ogynnsamma undergruppen i klass III, > 65 år med multipla hjärnmetastaser, okontrollerad övrig sjukdom och Karnofsky PS < 70, rekommenderar RTOG och vårdprogrammen enbart steroidbehandling. En översikt över olika behandlingsmodaliteter finns (34). Efter kirurgi eller precisionsbestrålning av 1-3 lesioner talar diffus multifokal sjukdom, genes i bröst eller lunga, kort intervall från primärdiagnos till hjärnmetastasernas upptäckt och leptomeningeal utsådd för konsoliderande helhjärnebestrålning. Mot detta tillägg talar strålresistent tumörtyp, behov av omedelbar systemisk kemoterapi, långt sjukdomsfritt intervall, ålder > 65 år, pågående kemoterapi, kognitiv nedsättning och avsaknad av PAD. 41 Extrakraniella metastaser Vid extrakraniella metastaser kan ibland SBRT (stereotactic body radiotherapy) eller protonstrålning ges i botande syfte vid oligometastatisk sjukdom, se nedan under kirurgi. Närhet till gastrointestinala organ med risk för blödning och perforation kan kontraindicera om inte operativ distansering kan göras, men strålningens påverkan på organfunktion tillåter ofta behandling vid utvalda targets i lever (35), lunga (36) och njure (37). Levermetastaser med kontrollerad primärtumör har botats (38) och tumörer i lungor (36, 39) och njurar (37) har kontrollerats lokalt under tämligen långa observationstider. Spinala tumörer har pallierats med SBRT (40). Metastaser från hepato-pankreato-biliära och kolorektala primärtumörer och stora targets var svårare att kontrollera lokalt (41). Behandlingen är poliklinisk och kan ges till äldre och när kirurgi är kontraindicerad. Den beskrivs i temanummer i Acta Oncologica (42). Binjurebestrålning är föga studerad men tycks ha effekt vid högre doser (43). Medullakompression Vid konventionell strålbehandling för medullakompression av CUP fann man ingen skillnad mellan kort (8 Gy x 1- 4 Gy x 5) och lång behandling (3 Gy x 10 – 2 Gy x 20) på grund av kort median överlevnad om 4 månader, men den längre behandlingen tycks ge bättre lokal kontroll vid begränsad sjukdom hos ambulatoriska sjuka med långsam symtomutveckling som förmodas leva längre (44). Vårdprogramgruppen tillråder därför flerfraktionsregimer i de senare fallen. 8.4 Kirurgisk behandling Sammanfattning: Diagnostiska ingrepp bör täckas av kunskapen hos cancerintresserad erfaren allmänkirurg eller gynekolog. Den mångfacetterade palliationen vid den heterogena sjukdomsgruppen CUP kan kräva speciella kunskaper, exempelvis vid neuro- och skelettkirurgi eller vid anläggande av pleuroperitoneala / peritoneovenösa shuntar. Behovet av komplikationsfri palliativ kirurgi hos cancersjuka med kort återstående livslängd är imperativt och ställer krav på indikationer och genomförande. Möjlighet att påverka sjukdomsförloppet med resektion i kurativt syfte av oligometastatisk sjukdom är diskutabel men finns kanske bland hårt sållade patienter. Kirurgi vid CUP kan ha många syften: diagnostik, potentiellt botande tumörresektion, palliativ tumörresektion eller palliation genom återställande av funktion av hålorgan, kärlaccess, frakturingrepp, dekompressionskirurgi i ryggraden, dränering av ascites/pleura-/pericardvätska med flera åtgärder. Här begränsas framställningen till diagnostik och potentiellt botande situationer. Ett temanummer av Seminars in Oncology (45) diskuterar palliativ och potentiellt botande metastaskirurgi vid olika lokalisationer. 42 Beträffande diagnostik vid laparotomi hänvisas till laparoskopiavsnittet men laparoskopisk ultraljudsundersökning ersätts av intraoperativ sådan, man kan palpera bland annat pankreas, ett vanligt ursprung för CUP, och ultraljudsledda punktioner förenklas. Detta förbättrar möjligheten till diagnostik, men efter fullgoda avbildande undersökningar troligen inte så mycket att laparotomi föredras framför laparoskopi. Potentiell bot kräver en biologiskt gynnsam oligometastatisk sjukdom. Begreppet kan definieras som < 4 lesioner i ett organ eller < 5 tumörer i hela kroppen (46); specialfallet solitära metastaser har diskuterats ingående (47) liksom CUP med en enda lokalisation (48). Ibland åtskiljs termerna singelmetastas (en i hela kroppen) och solitär metastas (avser ett organ). Oligometastatiska tillstånd varierar starkt i botbarhet beroende på cancerform, synkronicitet samt antal och lokalisation av metastaserna. CUP är dåligt karakteriserad och i det följande beskrivs främst definierade tumörformer, oftast med bättre prognos än CUP bland annat på grund av kontrollerade primärtumörer. Obehandlad ockult primärtumör utelsuter dock inte alltid bot: vid körtelmetastasering från okända melanom var resultaten de samma som vid känd primärlesion (8). Före behandling i botande syfte tillråds PET-DT, se avsnitt 7.3.5. Undersökningen ändrade terapivalet i 2/3 av till synes lokaliserad CUP, oftast genom fynd av obotlig spridning. Ett observandum var att primärtumörer som inte upptäcktes genom PET-DT inte progredierade och inte upptäcktes senare (48). Kirurgi vid levermetastaser Levermetastaser har resecerats eller behandlats med lokal destruktion / precisionsbestrålning. Randomiserade kontrollerade studier gentemot medicinsk behandling saknas, men överlevnaden efter resektion av metastaser av kolorektal cancer är så god att kirurgi anses evidensbaserad. Tumörantal, -storlek, CEA-nivå, synkronicitet och primärtumörens körtelmetastasering påverkar prognosen men också om alla faktorer var ogynnsamma sågs 10 procent femårsöverlevnad för utvalda resecerade patienter (49). Resektioner gav nära 40 procent femårsöverlevnad vid urogenitala eller mjukdelstumörer och vid hårt sållade fall av icke kolorektal gi-cancer, men kategorin ”diverse” tumörer hade inte en enda femårsöverlevare (50). Det har därför avråtts från resektion av andra tumörer än dem med kolorektalt och neuroendokrint ursprung annat än vid solitära lesioner (51). Median överlevnadstid efter radikaloperation av olika levermetastaserande cancerformer i närvaro av extrahepatisk tumör, såsom vid CUP, var 24 månader (52). Dessa två år för utvalda sjuka med begränsad tumörbörda från kända primärtumörer kan jämföras med den mediana överlevnaden 7 månader vid oselekterad, inte resecerad levermetastasering av CUP utan neuroendokrina drag (53) och är inte övertygande överlägsna med hänsyn till urvalet. Levermetastasering som led i CUP har dålig prognos (54), ses oftast med annan spridning och svarar dåligt på kemoterapi (48, 55, 56). Detta minskar utsikten att bota med lokala behandlingsmetoder och att förbättra resektionsresultat med adjuvant behandling. Av sju C(adeno-)UP-patienter med 9 leverlesioner med medeldiameter 5,4 cm (1,3 – 15) behandlades fyra med RFA och 3 resecerades. Efter en kort median uppföljning om 9 månader, 43 med median tumörfri tid 6,5 månader, fanns bara en tumörfri patient och två hade avlidit (57). Av 22 CUP-patienter med enbart levermetastaser, högst 3 lesioner, var alla döda inom 15 månader, så gott som alltid av tumörprogress (58). Resultaten är inte säkert bättre än utan behandling och leverresektion för CUP tillråds inte. Vid oligometastatisk leversjukdom och måttlig tumörstorlek kan stereotaktisk / protonstrålning ibland ge samma utsikt till lokal tumörkontroll med betydligt mindre påfrestning och resursåtgång (se ovan), och vid lesioner < 3 cm storlek kan RFA ge utsikt till lokal kontroll. Man kan överväga lokal behandling av framför allt lågproliferativa levermetastaser med neuroendokrin differentiering, eller om ursprung i kolorektum eller urogenitalsfären misstänks. Kirurgi vid lungmetastaser Lungmetastaser har resecerats med låg dödlighet och femårsöverlevnad runt 40 procent vid blandade tumörtyper (59, 60). I urvalet föredrogs solitära tumörer, sarkom och metastaser som upptäckts minst tre år efter primär diagnos. Femårsöverlevnad varierade mellan 0 (önh-cancer) och 40-50 procent (bröstcancer, ett fåtal uteruscancrar och andra carcinom) (61). Metastaser från lungcancer och melanom hade dålig prognos. Betydelsen av mediastinala körtelmetastaser var oklar. Efter uteslutande av gynnsamma germinalcells- och Wilmstumörer kunde man stratifiera efter > 3 års tumörfritt intervall och singelmetastas (drygt 50 procent femårsöverlevnad), singelmetastas med kortare intervall eller multipla lesioner med långt intervall (nära 40 procent), och multipla tidigt uppträdande metastaser (knappt 25 procent). Resektioner av metastaser som uppträtt efter tre år gav en överlevnadsfördel under de första sju åren som försvann efter tio år. Detta kan tyda på att överlevnad på kort och intermediär sikt beror mer på urval än på terapi (59, 60). På grund av möjlig urvalsbias bevisar därför inte överlevnad efter resektion att ingreppet påverkar sjukdomsförloppet (62, 63). Således har nyttan av resektioner av de mest gynnsamma tumörformerna ifrågasatts, och ingreppen bör användas restriktivt vid CUP. En stor majoritet av europeiska thoraxkirurger anser att en oåtgärdad primärtumör är en absolut kontraindikation mot metastasektomi (64). Precisions- / protonbestrålning av lungmetastaser kan dock i utvalda fall med föga påfrestning ge till synes lika god utsikt till lokal tumörkontroll (se ovan). Kirurgi vid lymfkörtelmetastaser Lymfkörtelmetastaser utan känd primärtumör har i vissa fall samma prognos efter kurativt syftande behandling som den sannolika primära cancerformen med motsvarande spridning, se kapitel 8.1. Detta gäller skivepitelcancermetastaser på halsen, adenocarcinom i axillen hos kvinnor, inguinala - ilioinguinala körtelmetastaser samt vid spontanregress av primärt melanom med körtelspridning (8, 48). Mediastinala körtelmetastaser som inte kommer från extragonadal germinalcellscancer liksom supraklavikulära metastaser har dock sämre prognos (48). Inguinala lymfkörtlar räknas i TNM-systemet som regionala vid cancer i anus, vulva-vaginas nedre tredjedel, penis, ovarium-tuba, uretra och i huden. Vid flera av dessa primärlokalisationer ses cirka 50 procent femårsöverlevnad, lägre vid melanom, högre vid peniscancer och högst vid den sällsynta ljumskmetastaseringen från testiscancer. Vid ilioinguinala körtelmetastaser från CUP var knappt hälften begränsade till ljumsken, en dryg tredjedel hade också iliacal spridning och lika många systemisk spridning. Femårsöverlevnad i hela gruppen var 27 procent och vid ilioinguinal spridning 38 procent. Behandlingen var oftast strålbehandling (20). 44 Kirurgi vid skelettmetastaser Skelettmetastaser är ofta från cancer i prostata, bröst och lunga och bara ett par procent anses vara solitära, i så fall vanligen i kotor, med bara enstaka långtidsöverlevare efter kirurgi av metastaser från njurcancer (47) eller lungcancer (65). Palliativa riktlinjer ges i vårdprogram från södra regionen 2003 och Stockholm-Gotland 2009 (66, 67). Kirurgi vid binjuremetastaser Av ett stort antal cancerfall hade 6 procent initialt binjureengagemang men ytterst sällan var tumören begränsad till binjuren, då ofta med bilaterala stora tumörer (68). Möjligheten av feokromoctyom måste beaktas (fP-metoxikatekolaminer är ett känsligt prov). Oftast är cancer i lunga och bröst primär, men tumörtypsspecifikt metastaserar melanom, lever- och njurcancer ofta hit (69). Vid isolerade binjuremetastaser anses kirurgi ge längre överlevnad än icke-kirurgisk behandling även om urvalsbias är möjlig, och laparoskopiska ingrepp, oftast för tumörer < 6 cm storlek, minskar påfrestningarna (70). I en resektionsserie, oftast med metastaser från cancer i lunga, njure eller kolon men CUP i bara 3 procent, lokalrecidiverade 17 procent och total/sjukdomsfri femårsöverlevnad var 31/24 procent. Resultaten berodde inte på ursprungstumörens typ eller syn-/metakronicitet, men binjurestorlek > 4,5 cm och R1-resektion var ogynnsamma. Långtidsöverlevnad sågs vid cancer i lunga, njure, sarkom och melanom och någon gång efter R1-resektion (70). Andra har dock haft sämre resultat, vid känd primärtumör med synkron binjuremetastas medelöverlevnad bara 8 månader trots resektion (71). Kirurgi vid mjältmetastaser Mjältmetastaser är sällan isolerade. Solitära sådana kommer i nära två tredjedelar från gynekologisk cancer och därnäst kolorektal cancer, medan multipla lesioner kan komma från många tumörformer (72). Resektion botar sällan men kan förebygga mjältruptur, smärtande splenomegali och mjältvenstrombos (72,73). Precisionsbestrålning av en lever- och en mjältmetastas från ovarialcancer gav långtidsöverlevnad i ett fall (38). Kirurgi vid hudmetastaser Hudmetastaser kommer vanligen från cancer i bröst, lunga och melanom. De var förenade med en median överlevnadstid av 6 månader, men drygt ett år vid melanom och bröstcancer, 3 månader vid lungcancer. Cancer i kolorektum, pankreas, oesofagus, samt skivepitelcancer i hud respektive H&N gav mediana överlevnadstider mellan 3 och 8 månader, cancer i ventrikel, lever och gallblåsa bara cirka en månad. (74). Botbarheten är alltså ringa men palliativ radioterapi, kirurgi eller minimalinvasiv elektrokemoterapi kan vara motiverad. Kirurgi vid peritoneala metastaser Metastaser i ovarier (”Krukenbergtumörer”) kommer vanligen från gi-cancer, därnäst bröst och i ett material i 10 procent från CUP. Av 16 fall med CUP hade en tredjedel ascites och två tredjedelar lymfkörtelmetastaser, bara en genomgick ”minimal surgery” och 19 procent femårsöverlevnad resulterade (75). I ett annat material gav R0-resektion av ovariella metastaser med olika primariteter följd av cytostatikabehandling femårsöverlevnad vid metastaser från cancer i bröst och kolorektum men inte vid ventrikelcancer. Vid spridning begränsad till ovarierna blev median överlevnadstid 31 månader jämfört med 10 månader vid samtidig annan spridning (76). 45 Peritoneal metastasering är vanlig vid gastrointestinal- och ovarialcancer. Biopsi är väsentlig. Immunhistokemisk undersökning kan ofta med relativt god säkerhet särskilja kolorektalcancer från ovarialcancer (se kapitel 7 om patologi). Peritoneal metastasering är ogynnsam vid gastrointestinal cancer och en negativ prediktiv faktor vid kemoterapi. Vid ovarialcancer i stadium 4 är standard sedan länge att göra kirurgisk minskning av tumörbördan, följd av systemisk platinumbaserad kemoterapi. På senare år har man prövat extensiv kirurgisk behandling med peritonektomi och efterföljande intraperitoneal kemoterapi också vid peritonealmetastaserande kolorektalcancer eller pseudomyxom (77, 78, 79). Behandlingen ger betydande morbiditet men i starkt utvalda patientmaterial har uppemot 45 procent femårsöverlevnad rapporterats. Det finns inga randomiserade fas III studier men resultaten är betydligt bättre än för historiska kontroller. Liknande resultat har setts efter kirurgi och intraperitoneal kemoterapi vid ovarialcancer. Differentialdiagnoserna primärt peritonealt carcinom (behandlas som ovarialcancer) och bukmesoteliom med specifik behandling ska beaktas. 8.5 Kirurgisk behandling av speciella tumörformer Småcellig cancer Vid extrapulmonell småcellig cancer med begränsad utbredning har resektion ibland gett flerårig median överlevnad, som mest nära 8 år. Också strålbehandling har lett till enstaka fall av lång överlevnad. Stor risk för generalisering har medfört förslag om adjuvant systemisk behandling och hjärnbestrålning (80). Andra fann dock nedslående resultat av adjuvantbehandling och att småcellig cancer i gi-kanalen hade sämre prognos än övriga småcelliga cancrar på grund av vanlig extensive disease; tumör i cervix hade däremot ofta limited disease med bättre prognos (81). Melanom, hematologisk malignitet och Ewingsarkomfamiljens tumörer kan övervägas som differentialdiagnoser. Papillär cancer Papillär cancer i peritoneum har beskrivits i kapitlet om kemoterapi. Sådan cancer i lymfkörtlar paraaortalt och på halsen hos en man gick i komplett remission under över tio år efter platinabaserad radiokemoterapi och kan vara en tumörtyp som vid begränsad utbredning kan ha nytta av lokal behandling (82). REFERENSER 1. Pavlidis N. Forty years experience of treating cancer of unknown primary. Acta Oncol. 2007;46:592-601 2. Greco F, Culine S. Chemotherapy for patients with metastatic carcinoma of unknown primary site. Kapitel 8 i Cancer of an unknown primary site (Fizazi K, red). Taylor &Francis, New York – London 2006 3. Harrington S, Smith TJ. The role of chemotherapy at the end of life: ”When is enough, enough?”. JAMA 2008;299:2667-78 46 4. Varadhachary GR et al. (a) Molecular profiling of carcinoma of unknown primary an Correlation with clinical evaluation. J Clin Oncol. 2008;26:4442-8 5. Varadhachary GR et al. (b) Carcinoma of unknown primary with a colon-cancer profile-changing paradigm and emerging definitions. Lancet Oncol. 2008;9:596-9 6. Hainsworth JD et al. Treatment of carcinoma of unknown primary site (CUP) directed by molecular profiling diagnosis: A prospective, phase II trial. J Clin Oncol 28:15s, 2010 (suppl; ASCO abstr 10540) 7. Garber K. Ready or not: personal tumor profiling tests take off. J Natl Cancer Inst 2011;103:84-86 8. Pavlidis N et al. Diagnostic and therapeutic management of cancer of an unknown primary. Eur J Cancer 2003; 39:1990-2005 9. Huebner G et al. (German CUP Study Group) Paclitaxel and carboplatin vs gemcitabine and Vinorlelbine in patients with adeno- or undifferentiated carcinoma of unknown primary: a randomised prospective phase II trial. Br J Cancer. 2009;100:44-9. Epub 2008 Dec 9. 10. Lenzi R, Culine S. Prognostic considerations in patients with unknown primary carcinoma. Kapitel 6, i Cancer of an unknown primary site (Fizazi K, red). Taylor &Francis, New York – London 2006 11. Hainsworth J. Treatment of patients with favorable subsets of unknown primary carcinoma. Kapitel 7 i Fizazi K (redaktör): Cancer of an unknown primary site. Taylor &Francis, New York – Lodon 2006 12. Ellerbroek N et al. Treatment of patients with isolated axillary nodal metastases from an occult primary carcinoma consistent with breast origin. Cancer 1990;66:1461-7 13. Jackson B et al. Axillary metastasis from occult breast carcinoma: diagnosis and management. Am Surg 1995; 61:431-4 14. Chen KT, Flam MS. Peritoneal papillary serous carcinoma with long-term survival. Cancer 1986; 58:1371-3 15. Ransom DT et al. Papillary serous carcinoma of the peritoneum. A review of 33 cases treated with platin-based chemotherapy. Cancer 1990;66:1091-4 47 16. Grau C et al. Cervial lymph node metastases from unknown primary tumors. Results from a national survey by the Danish society for head and neck oncology. Radiother Oncol 2000;55:121-9 17. Van der Gaast A et al. Carcinoma of unknown primary: identification of a treatable subset. Ann Oncol 1990; 1:119-22 18. Pentheroudakis G et al. Cancer of unknown primary patients with midline nodal distribation: Midway between poor and favourable prognosis? Cancer Treat Rev. 2010 Jul 28. [Epub ahead of print] 19. Greco FA, Hainsworth JD. Cancer of unknown primary site. Kapitel 56 i Cancer, principles and practice of oncology, 8 uppl. (DeVita, Lawrence och Rosenberg, red.). Wolters Kluwer Lippincott William & Wilkins, 2008 20. Guarischi A et al. Metastatic inguinal nodes from an unknown primary neoplasm. A review of 56 cases. Cancer 1987;59:572-7 21. Hainsworth JD et al. Phase II trial of bevacizumab and erlotinib in carcinomas of unknown primary site: the Minnie pearl Cancer Research Network J Clin Oncol. 2007;25:1747-52. 22. Hundahl Møller AK et al. Capecitabine and oxaliplatin as second-line treatment in patients with carcinoma of unknown primary site. Acta Oncol. 2010;49:431-5 23. Pentheroudakis G, Pavlidis N. Perspectives for targeted therapies in cancer of unknown primary site Cancer Treat Rev. 2006;32:637-44. 24. Acta Oncologica 2003;42(5-6) temanummer om strålbehandling 25. SBU-rapport nr 162. Strålbehandling vid cancer. En systematisk litteraturöversikt. http://www.sbu.se/upload/Publikationer/Content0/1/stralbehandling_2003/ stralfull.html 26. Delaney G. Estimating the optimal radiotherapy utilization for carcinoma of the central nervous system, thyroid carcinoma, and carcinoma of unknown primary origin from evidence-based clinical guidelines. Cancer 2006 15;106:453-65 27. Möller TR, et al; SBU Survey Group. A prospective survey of radiotherapy practice 2001 in Sweden. Acta Oncol 2003;42:387-410 28. Vårdprogram för hjärnmetastaser 2005. www.ocsyd.se/VP-verksamhet/Palliativ%20vard/Hjarnmetastaser2005.pdf 48 29. Regionalt vårdprogram för hjärnmetastaser 2008. www.oc.gu.se/pdf/hjarnmetslut.pdf 30. Brown PD et al. (a) Adjuvant whole brain radiotherapy: strong emotions decide but rational studies are needed. Int J Radiat Oncol Biol Phys 2008;70:1305-9. Epub 2008 Jan 30 31. Brown PD et al. (b) Stereotactic radiosurgery for patients with "radioresistant" brain metastases. Neurosurgery 2008;62 Suppl 2:790-801 32. Bartelt S, Lutterbach J. Brain metastases in patients with cancer of unknown primary. J Neurooncol 2003;64:249-53 33. Rades D et al. Whole-brain radiotherapy with 20 Gy in 5 fractions for brain metastases in patients with cancer of unknown origin. Strahlenther Onkol 2007;183:631-6 34. Ewend MG et al. Guidelines for the initial management of metastatic brain tumors: role of surgery, radiosurgery, and radiation therapy. J Natl Compreh Cancer Network 2008;6:505-14 http://cme.medscape.com/viewprogram/12682_pnt 35. Dawson LA, Ten Haken RK. Partial volume tolerance of the liver to radiation. Semin Radiat Oncol 2005;15:279-83 36. Baumann P et al. Stereotactic body radiotherapy for medically inoperable patients with stage I non-small cell lung cancer - a first report of toxicity related to COPD/CVD in a non-randomized prospective phase II study. Radiother Oncol 2008;88:359-67. Epub 2008 Sep 1 37. Svedman C et al. Stereotactic body radiotherapy of primary and metastatic Renal lesions for patients with only one functioning kidney. Acta Oncol 2008;47:1578-83 38. Gunvén P et al. Curative stereotactic body radiotherapy for liver malignancy. Med Oncol 2009;26:327-34. Epub 2008 Nov 14 39. Norihisa Y et al. Stereotactic body radiotherapy for oligometastatic lung tumors. Int J Radiat Oncol Biol Phys 2008;72:398-403 40. Swift PS et al. Radiation for spinal metastatic tumors. Orthop Clin North Am 2009;40:133-44 41. Milano MT et al. Descriptive analysis of oligometastatic lesions treated with curative-intent stereotactic body radiotherapy. Int J Radiat Oncol Biol Phys 2008;72:1516-22. Epub 2008 May 19 49 42. Acta Oncologica Symposium on Stereotactic Body Radiotherapy, June 15 – 17, 2006 Copenhagen, Denmark (2006;45 [7]) 43. Katoh N et al. Real-time tumor-tracking radiotherapy for adrenal tumors. Radiother Oncol 2008;87:418-24 44. Rades D. Functional outcome and survival after radiotherapy of metastatic spinal cord compression in patients with cancer of unknown primary. Int J Radiat Oncol Biol Phys 2007;1:67:532-7. Epub 2006 Nov 2 45. Role of surgery in the diagnosis and management of metastatic cancer. Temanummer, Seminars in Oncology 2008;35(2) 46. Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol 1995;13:8-10 47. Rubin P et al. Solitary metastases: illusion versus reality. Semin Radiat Oncol 2006;16:120-30 48. Lesimple T, Balana C. Carcinoma of unknown primary in a single site. Kapitel 12 I Fizazi K (redaktör): Cancer of an unknown primary site. Taylor &Francis, New York – London 2006. 49. Fong Y et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 1999;230:309-18 50. O'Rourke TR et al. Long-term results of liver resection for non-colorectal, non-neuroendocrine metastases.Ann Surg Oncol 2008;15:207-18. Epub 2007 Oct 26 51. Hemming AW et al. Hepatic resection of noncolorectal nonneuroendocrine metastases. Liver Transpl 2000;6:97-101 52. Lang H. (Liver resection for non-colorectal, non-neuroendocrine hepatic metastases) Chirurg 1999;70:439-46 53. Hess KR et al. Classification and regression tree analysis of 1000 consecutive patients with unknown primary carcinoma. Clin Cancer Res 1999;5:3403-10 54. Culine S et al. Development and validation of a prognostic model to predict the length of survival in patients with carcinomas of an unknown primary site. J Clin Oncol 2002;20:4679-83 55. Lazaridis G et al. Liver metastases from cancer of unknown primary (CUPL): a retrospective analysis of presentation, management and prognosis in 49 patients and systematic review of the literature. Cancer Treat Rev 2008;34:693-700. Epub 2008 Jun 26 50 56. Pouessel D et al. Hepatic metastases from carcinomas of unknown primary site. Gastroenterol Clin Biol 2005;29:1224-32 57. Hawksworth J et al. Surgical and ablative treatment for metastatic adenocarcinoma to the liver from unknown primary tumor. Am Surg 2004;70:512-7 58. Mylona S et al. Radiofrequency ablation of liver metastases from cancer of unknown primary Site. Diagn Interv Radiol. 2009;15:297-302 59. Anonym. Long term results of lung metastasectomy: prognostic analyses based on 5206 cases. The international registry of lung metastases. J Thorac Cardiovasc Surg 1997;113:37-49 60. Friedel G et al. Resection of lungmetastases: long-term results and prognostic analysis based on 5206 cases- the International registry of Lung metastases. Zentralbl Chir 1999;124:96-103 61. Koong HN et al. Is there a role for pneumonectomy in pulmonary metastases? International Registry of Lung Metastases. Ann Thorac Surg. 1999;68:2039-43 62. Treasure T. Pulmonary metastasectomy: a common practice based on weak evidence. Ann R Coll Surg Engl. 2007;89:744-8 63. Åberg T. Selection mechanisms as major determinants of survival after pulmonary metastasectomy. Ann Thor Surgery 1997;63:611-2 64. Anonym, för the ESTS Pulmonary Metastasectomy Working Group. Pulmonary metastasectomy: a survey of current practice amongst members of the European Society of Thoracic Surgeons. J Thorac Oncol. 2008;3:1257-66 65. Agarwala AK, Hanna NH.Long-term survival in a patient with stage IV non-small-cell lung Carcinoma after bone metastasectomy. Clin Lung Cancer. 2005;6:367-8 66. Vårdprogram för vuxna patienter med skelettmetastaser. http://www.ocsyd.se/VP-verksamhet/Palliativ%20vard/Skelettmet2003.pdf 67. Skelettmetastaser. Diagnostik, behandling och uppföljning i Stockholm-Gotland regionen. http://www.karolinska.se/upload/Onkologiskt%20centrum/ RegionalVardprogram/Skelettmetastaser_2009.pdf 68. Lee JE et al. Unknown primary cancer presenting as an adrenal mass: frequency and implications for diagnostic evaluation of adrenal incidentalomas. Surgery. 1998;124:1115-22 51 69. Gittens PR Jr et al. Surgical management of metastatic disease to the adrenal gland. Semin Oncol. 2008;35:172-6 70. Strong VE et al. Laparoscopic adrenalectomy for isolated adrenal metastasis. Ann Surg Oncol. 2007;14:3392-400. Epub 2007 Jul 31 71. Kapella M et al. Adrenal metastasis: survival following surgical resection (på franska). J Chir (Paris) 2008;145:346-9 72. Showalter SL et al. Metastatic disease to the pancreas and spleen. Semin Oncol. 2008;35:160-71 73. Agha-Mohammadi S, Calne RY. Solitary splenic metastasis: case report and review of the literature. Am J Clin Oncol. 2001;24:306-10 74. Schoenlaub P et al, Survival after cutaneous metastasis: a study of 200 cases (på franska). Ann Dermatol Venereol 2001;128:1310-5 75. Ayhan A et al. The role of cytoreductive surgery in nongenital cancers metastatic to the ovaries. Gynecol Oncol 2005;98:235-41 76. Jiang R et al. Surgical treatment for patients with different origins of Krukenberg tumors: Outcomes and prognostic factors. Eur J Surg Oncol. 2009;35:92-7. Epub 2008 Jul 16 77. Chu DZ et al. Peritoneal carcinomatosis in nongynecologic malignancies. A prospective study of prognostic factors. Cancer 1989; 63:364-367 78. Jayne et al. Peritoneal carcinomatosis from colorectal cancer. Br J Surg 2002; 89:1545-1550 79. Matheme et al. Improved survival with peritoneal carcinomatosis from colorectal cancer. Br J Cancer. 2004;90: 403-7 80. Lobins R, Floyd J. Small cell carcinoma of unknown primary. Review. Semin Oncol. 2007;34:39-42. 81. Lee SS et al. Extrapulmonary small cell carcinoma: single center experience with 61 patients. Acta Oncol. 2007;46:846-51 82. Jentsch-Ullrich K et al. Long-term remission in a patient with carcinoma of unknown primary site. Chemotherapy. 2006;52:12-5. Epub 2005 Dec 9 52 9. PSYKOSOCIALA ASPEKTER OCH CANCERREHABILITERING Tjugofem - 30 procent av alla cancerpatienter behöver under sjukdomsförloppet professionellt stöd för emotionella problem. Till detta kommer behov av rehabilitering för att förebygga fysiska men, åtgärder för kroniska problem, och rådgivning och samordning av socioekonomiskt stöd. Gruppen med rehabiliteringsbehov är således stor, och eftersom patienter med en spridd cancersjukdom kan leva länge ökar behovet av rehabilitering till god livskvalitet. Nordic Cancer Union (NCU) (1) de nordiska cancerfondernas gemensamma organisation (Nordic Cancer Union NCU ) har följande definition av cancerrehabilitering:”Cancerrehabilitering är en tidsbegränsad process med syfte att förebygga och reducera de fysiska, psykiska, sociala och existentiella följderna av cancersjukdomen och dess behandling. Rehabiliteringsåtgärderna ska ha tydliga mål och utfall, samt ge den enskilda patienten stöd och inspiration att ha ett så bra liv som möjligt. Den individuella behandlingsplanen ska upprättas i nära dialog mellan patient och behandlare”. Screening och bedömning av psykosociala problem och rehabiliteringsbehov Psykosociala problem vid cancersjukdom är olikartade och kan vara psykiska, som depression, krisreaktion eller ångest, men också ekonomiska, sexuella eller existentiella problem, praktiska sociala problem och relationsproblem räknas hit. Det bör finnas rutiner för att fånga upp sådana problem och rehabiliteringsbehov hos alla patienter och deras närstående. Man kan använda ett enkelt självskattningsformulär, som exempelvis ”problemtermometern” (Distress-termometer), bilaga 2. Den är enkel, snabb att fylla i och ger en god överblick över patientens problem och deras svårighet. Ofta anses remitteringsbehov finnas vid > 5 - 7 poäng på en 10-gradig skala. Remittering till rätt vårdnivå Psykosociala problem och rehabiliteringsbehov kan vara olika krävande, och det är viktigt att de handläggs på rätt vårdnivå. Alla patienter behöver inte träffa en kurator utan ofta räcker det medicinska teamets insatser med kommunikation och psykologiskt stöd. Andra behöver mer krävande insatser av kurator eller psykoonkologiskt team. Modeller för att organisera psykosocial onkologi och rehabilitering Psykosocial onkologi och rehabilitering kan bedrivas med olika grad av specialisering. Här visas en ”distress ladder” som tagits fram av International Psycho-Oncology Society (IPOS), omgjord till en pyramid för att betona att behovet av de mest specialiserade nivåerna är betydligt mindre än behovet av de basala nivåerna. 53 Svår: Psykiatrisk resurs Psykoonkologiskt team Måttlig: Psykoonkologiskt team Lätt: Medicinskt team, Konsultation av psykoonkologiskt team Normal: Medicinskt team Distress pyramid, efter IPOS (International Psycho-Oncology Society) modell. Normal problemnivå: det medicinska teamet stöder psykosocialt och rehabiliterar med hjälp av information, kunskaper om behov av fysisk rehabilitering och psykologiska reaktioner på cancer. Lätt: större stödbehov då det medicinska teamet behöver hjälp av exempelvis kurator, sjukgymnast eller dietist genom konsultation, handledning och rådgivning. Måttlig: komplexa psykosociala behov med behov av direkta insatser från det psykoonkologiska teamet. Det kan handla om bedömning och behandling av exempelvis kurator, läkare, sexolog och lymfterapeut. Svår: mycket stora behov som kräver insats också av psykiater eller samarbete med psykiatrisk klinik och/eller omfattande fysisk rehabilitering vid bestående fysiska men av sjukdom och behandling, i samarbete med specialistvård, kommunal service och/eller myndigheter. Psykosocial vård, yrkeskategorier och insatser Cancerpatienter är olika med många typer av behov, och psykoonkologiska team är därför multiprofessionella. Det kan ingå sjuksköterska, kurator, läkare, sjukgymnast, psykolog, sexolog, dietist, arbetsterapeut. Många har vidareutbildning inom olika former av psykoterapi. Samarbete finns ofta med sjukhuskyrka, präst eller annan själasörjare. Insatser är exempelvis samtalsstöd och krisbearbetning, ekonomisk rådgivning och hjälp med myndighetskontakter, behandlingar med psykoterapi, psykofarmaka eller sjukgymnastik, sexologisk rådgivning och existentiella samtal. Patientutbildningar kan upplysa patienterna utbildning om cancersjukdomars orsaker, utredning, behandling och uppföljning, psykiska reaktioner på cancer, råd om fysisk aktivitet och kost samt orientera om samhällets resurser vid sjukdomen. Närstående till cancerpatienter Cancerdiagnosen påverkar hela familjen. Närstående väntas idag inte bara närvara vid patientens sida under vården, utan också vara aktiva i själva vården. Yngre cancersjuka med barn hemma är en mycket utsatt grupp, och stödet till minderåriga närstående upplevs ofta som eftersatt av patienter och personal inom vuxenonkologin. Barn och tonåringar med svårt sjuka föräldrar löper större risk än andra barn att inte få sina behov tillgodosedda. Anställda i sjukvården är skyldiga att anmäla till socialnämnden om de får vetskap om något som kan innebära att socialnämnden 54 behöver ingripa till ett barns skydd (Socialtjänstlagen, 14 kap., 1 §). Närstående i alla åldrar behöver ofta omhändertagande och stöd – att stödja familjen är många gånger det bästa sättet att stödja patienten i rehabiliteringen. Basutbud av rehabiliteringsåtgärder Utifrån NCU:s definition bör cancerpatienter ha tillgång till ett ”basutbud” av rehabiliteringsåtgärder. Dessa innebär konkret att - Bedömning av rehabiliteringsbehov rutinmässigt och återkommande ingår i allas vård, från cancerdiagnosen och framåt i förloppet. - Rehabiliteringsbehov och -åtgärder kontinuerligt dokumenteras. Alla patienter och deras närstående erbjuds att delta i befintliga informationsoch stödprogram. - Patienter som bedöms behöva mer intensifierade rehabiliteringsinsatser hänvisas till specialistteam för sådana. - Patienter erbjuds bedömning och rehabiliteringsåtgärder utifrån individuella behov, utan särbehandling på grund av kön, ålder, etnicitet och sexuell läggning. REFERENSER Nordic Cancer Union NCU; www.ncu.nu 10. OMVÅRDNAD Vid utredning och behandling av de ofta symtomatiska okända primärtumörerna utsätts den sjuke för en ofta påfrestande väntan på utredningsresultat och får sedan besked, som i sämsta fall tolkas som att han/hon inte kan få den bästa behandlingen av en livshotande eller dödlig sjukdom. Samtidigt startar behandlingsåtgärder och förloppet kräver mångsidig omvårdnad, som kan utformas olika beroende på patientens behov och lokala resurser. För omvårdnad vid strålbehandling och cytostatikaterapi hänvisas till metodböcker och vårdprogram. Här redogörs för omvårdnadsverksamheten vid en större enhet för CUP med många års erfarenhet. Två sjuksköterskor ansvarar för mottagningen och är lätt tillgängliga på telefon under kontorstid, andra tider hänvisas de sjuka till vårdavdelning eller jourläkare. Efter besök hos läkare träffar sjuksköterskan patienten med eventuellt medföljande anhörig för samtal. Vid nybesök informeras om mottagningen för okända primärtumörer och om kommande behandlingar och undersökningar. Tidsåtgången varierar kraftigt och kan ibland vara upp emot en timme om patienten mår dåligt och har många funderingar. Vid nybesök överlämnas också en dagbok som ska underlätta information och kommunikation mellan patient och vårdinstanser. Där kan den sjuke bland annat notera symptom, vid behovsmedicinintag, planerade undersökningar och följa sin vikt. Sjuksköterskan informerar om nutrition 55 och erbjuder kontakt med dietist om patienten förlorat i vikt eller risken för viktnedgång är stor. Sjuksköterskan erbjuder alltid kontakt med kurator, också där är behovet stort. Efter varje återbesök träffar sköterskan patienten och förklarar planerade åtgärder, inklusive eventuell symtomkontroll via sköterskan, och gör upp om uppföljande kontakt vid behov. På mottagningen går en stor del av tiden åt för telefonsamtal med patienter och anhöriga, ofta samtalsstöd men också i praktiska frågor som tidsbokning, kontroll av effekten hos palliativa åtgärder och information. Också logistiken kring patienten tar stor del av arbetstiden. Omvårdnadsjournal förs enligt lokala riktlinjer med uppgift om uppgiftslämnare, kontaktsjuksköterska och patientansvarig läkare och rubrikerna omvårdnadsanamnes, omvårdnadsstatus och omvårdnadsåtgärd (1). REFRERENSER 1. Reitan A M, Schölberg T K (red). Onkologisk omvårdnad. Patient – problem – åtgärd. Liber förlag, 2003 11. NUTRITION För en undernärd, malnutrierad cancerpatient är det primärt att försöka hindra eller bromsa fortsatt viktnedgång. Vid bedömning är det lämpligt att använda variablerna viktutveckling, Body Mass Index (BMI) och förekomst av nutritionsproblem. Samband mellan viktnedgång och sämre livskvalitet vid cancer (1) liksom kort förväntad överlevnad vid CUP talar för tidiga nutritionsinsatser. Förutom anorexi och hinder i magtarmkanalen kan tand- och munstatus utgöra en ofta bortglömd orsak till svårighet att inta föda, se vårdprogram från Stockholm (2) respektive Kalmar (3) förtecknade nedan. En ofrivillig viktnedgång på 5 procent eller mer den senaste månaden eller minst 10 procent de senaste sex månaderna visar tydligt att det är en riskpatient. BMI, kg/m2, bör under 70 års ålder vara minst 20 och för äldre eller kroniskt sjuka minst 22. Nutritionsproblem identifieras med frågan ”har du svårt att äta och dricka? ” . Ofrivillig viktnedgång väger tyngst vid bedömningen, så att en patient med normalt BMI ändå kan vara en riskpatient. En patient som bedöms vara malnutrierad bör snarast få noggrann kostgenomgång och kostråd av dietist. Behandlingen syftar till en förbättrad livskvalitet med minskad oro, illamående och magtarmbesvär och ökad autonomi och ska uppehålla vätskebalans, vikt och kroppssammansättning (vävnader/vätska). För att förebygga viktnedgång rekommenderas många små måltider med energirik mat. Detta innebär fetare livsmedel som standardmjölk, matfett med 80 procent fett, flytande margarin, helfeta ostar, vispgrädde, creme fraiche, gräddglass och att maten berikas med fett eller socker. Ett stort antal näringsdrycker kan komplettera maten. I första hand väljs de kompletta dryckerna med protein, fett, kolhydrater, vitaminer och mineraler. I många landsting kan dietisten förskriva 56 näringsdrycker med kostnadsnedsättning. De kan också köpas utan förskrivning, men de flesta apotek har bara ett begränsat utbud. En patient som mår illa kan rådas att prova salt mat: kaviar, ansjovis, sill, buljong, chips, salta pinnar och oliver. Ibland kan parenteral nutrition i hemmet behövas och har visats minska oro och öka känslan av kontroll (4). REFERENSER 1. Nourissat A, et al. relationship between nutrirional status and quality of life in patients with Cancer. Eur J Cancer. 2008;44:1238-42 2. http://www.karolinska.se/upload/Onkologiskt%20centrum/ RegionalVardprogram/Munvård2007.pdf (Stockholms vårdprogram om munvård vid tumörsjukdomar) 3. http://www2.ltkalmar.se/pallvard/kapitel/10/munvard.htm (Kalmars vårdprogram om munvård vid tumörsjukdomar) 4. Orrevall Y, et al. Home parenteral nutrition: a qualitative interview study of experinces of advanced cancer patients and their families. Clin Nutr. 2005;24:961-70 12. KVALITETSINDIKATORER OCH KVALITETSREGISTER Vårdprogramgruppen planerar att under 2011 fastställa kvalitetsindikatorer och har inlett arbete med kvalitetsregister för cancer med okänd primärtumör (CUP) 57 BILAGA 1. Behandlingsschema, Cisplatin - docetaxel Indikation Cancer med okänt ursprung (Greco et al, Cancer J 7 203 2001 och Ann Oncol 11 211 2000). För palliation. Regimbeskrivning Max engångsdos Dag Substans Dos (mg/m2) Dosering Administrering 1 Docetaxel 75 1x1 iv 150 mg 1 Cisplatin 60 1x1 iv 120 mg Dag 1 22 Doc Cis Ny cykel (högre enl ök sekt-chef) Behandlingsintervall Behandling ges dag 1 med start av nästa cykel dag 21. Administrering Dag Timme -1ff Preparat Blandning och volym Infusionstid Profylax (se nedan) 1 0 Natriumklorid 9mg/ml 250 ml 1 1 0 0 Antiemetika (se nedan) Docetaxel 250-500ml ml NaCl 60 min 1 1 Natriumklorid 0,9 % +20 mmol K 1000 ml 1,5 tim 1 2:30 Natriumklorid 0,9 % 1000 ml +20 mmol K + 5 mmol Mg 1,5 tim < 400 ml diures / tim: ges Furix 20mg iv 1 4 Cisplatinum 1000 ml 60 min 1 5 Natriumklorid 0,9 % +20 mmol K+ 5 mmol Mg 1000 ml 60 min < 400 ml diures / tim: ges Furix 20 mg iv. 1 6 Natriumklorid 9mg/ml 1000 ml 60 min 1 Kl 16.00 Antiemetika (se nedan) 21 58 Omstart från dag -1 PREMEDICINERING OCH PROFYLAX Mot vätskeretention och överkänslighetsreaktioner Dagen före behandling: T betametason 0,5 mg 16x1 kl 08.00 och 16.00. På KS ges rutinmässigt två doser före docetaxelbehandling men vårdprogramgruppen har diskuterat nödvändigheten av den första. Behandlingsdagen: T betametason 0,5mg 16x1 kl 08.00 alternativt Inj betametason 8mg iv 30 min före docetaxel samt T betametason 0,5mg 16x1 kl 16.00. Förslag i vårdprogramgruppen att minska doserna men KS saknar erfarenhet av detta. Dagen efter behandling: T betametason 0,5mg 16x1 kl 08.00 och eventuellt kl 16.00. Dessa dosnivåer är rutin vid cisplatinbehandling av högriskpatienter på KS men ifrågasattes vid diskussion i vårdprogramgruppen. Mot akut illamående Serotonin (5 HT3)- receptorantagonist (iv x2 dag 1, po dag 2 och ev 3) samt steroider dag 1 och 2. Preparatval enligt rutin. Vid svårt illamående inj. betametason 8mg x2 i.v. Metoklopramid v.b. Mot fördröjt illamående Om sådant hotar uppstå, metoklopramid 10 mg 1-2 x 3 p.o. dag 6-10 samt betametason (Betapred) 0,5 mg 4-8x1 p.o. dag 3-7, betametason 0,5 mg < 4x1 dag 8-9 och betametason 0,5 mg < 2x1 dag 10. Förslag sänka dessa kortisondoser i gruppen; KS-alternativ palonosetron iv dag 1 eller i andra hand aprepritant dag 1-3 med sänkt betametasondos. Tillväxtfaktorer GCS-F ges inte i normalfall. Övervakning under behandling Akutbricka ska finnas tillgänglig! Docetaxel kan ge allergiska reaktioner, oftast snabbt efter infusionstart. Initialt oro, myrkrypningar, illamående, blodvallning, hudutslag, tryck i bröstet, ryggsmärta, dyspné, i svåra fall hypotension, bronkospasm, generellt hudutslag. Se FASS. Vid hypotension, bronkospasm eller generellt hudutslag avbryts infusionen omedelbart och ges adrenalin spätt 1:10 till 0,1 mg/ml, 3-5 ml sakta i.v. varefter betametason (Betapred) 4 mg/ml, 2 (-4-8) ml i.v. I.v. adrenalin kan upprepas efter 5 min men arytmiövervakning då önskvärd. Senare kan ges inj klemastin (Tavegyl) 1 mg/ml, 2 ml sakta i.v. eller i.m. Vid chock: höjd fotända, syrgas 5-10 l/min, i.v. Ringeracetat / NaCl, anestesijour. Vid lindrig reaktion steroider peroralt, tbl. betametason 0,5mg 6-8x1 alternativt tbl. prednison 25 mg 1x1. Ev. inj. betametason 4 mg/ml, 2 ml i.v. och inj. adrenalin 1 mg/ml i.m. (lateralt i lårmuskeln) 0,3 – 0,5 ml = 0,3-0,5 mg. Därefter tbl. klemastin 1 mg 2 st p.o. 59 Vid rodnad eller lokal hudreaktion inom de första minuterna efter start av Taxotereinfusion behöver inte behandlingen avbrytas (FDA safety labeling revision 070928). Cisplatin ges med forcerad diures! • Dryck och urin mäts var 4:e timme från timme 0. Vätskelista förs. • Diuresen ska överstiga 400ml / 4tim under behandlingsdygnet. • Vb Furix iv 10 mg/ml, 2 ml åt gången. • Daglig vikt, vid osäkerhet om ödem 2 ggr dagligen. Biverkningar och interaktioner: Docetaxel: Allergisk reaktion. Påverkan av benmärg, gi-kanal och hud/hår, asteni, mindre ofta neuropati, vätskeretention, myalgi. Interaktioner: föga kända, se FASS. Försiktighet vid medicinering med ketoconazol, erytromycin. Cisplatin: Högemetogent. Påverkan av benmärg och njurar, hörsel (riskökning vid hjärnbestrålning före eller efter), neuropatier (kumulerad risk), alopeci. Anafylaktoid reaktion. Interaktioner: med oto- / nefrotoxiska mediciner ökas biverkningsrisken, aminoglykosid skall ej ges under och en månad efter cisplatinbehandling. Sänker plasmakoncentration av antikonvulsiva mediciner och ev. litium. Dosmodifiering (se i övrigt FASS) Faktor Dos Övrig åtgärd Docetaxel Cisplatin Benmärgstoxicitet Neutrofila < 2 x 109/L (LPK < 4) eller TPK < 100 x 109/L 0 0 Uppskjuten behandling Njurfunktion Iohexolclearance 40-60 ml/min, s-kreatininökning under behandling > 25 % - nytt clearance 50 % 50 % 80 % 100% Leverfunktion Transaminaser 2,5-5 x öngr OCH ALP < 2,5 x öngr Transaminaser 1,5 – 5 x öngr OCH ALP 2,5 – 5 x öngr Transaminaser o/e ALP > 5 x öngr eller bilirubin > öngr Geriatriska synpunkter Högre risk för anemi, infektion,anorexi, ödem, mukosit 60 0 Överväg annan regim Kriterier för start av cykel Prover enligt nedan och symtomvärdering före varje cykel. Provtagning före, under och efter behandling Före första beh : - Blodstatus inkl diff/neutrofila, - Elstatus inkl Mg, - Leverstatus inkl. LD, - S-cystatin och om gränsvärde/patologiskt: iohexolclearance. - Audiometri. Efter varje behandling: Dag 7, 15 och 20: - Blodstatus inkl B-celler, - Elektrolyt- och leverstatus. - Tumörmarkörer efter ordination. - Leverprover inför varje cykel. Utvärdering - Symtom före varje cykel. CT efter 3 - 4 cykler. - Ev. positiva markörer också var tredje – fjärde cykel. - Terapikonferens vid tveksam balans mellan biverkningar och svar. Avslutning av behandling - Patientönskan, biverkningar, tumörprogress. Information till patienten - Förebered på håravfall, rekvirera peruk. Ordinera riklig dryck i hemmet dagarna efter cykeln. 61 Administreringsschema Dag Timme Klockan Ordination Dag 1 timme 0 ………. T Betapred 0,5 mg 8 st …………… timme 0 ………. Koppla inf NaCl 9mg/ml, 250 ml …………… timme 0 ………. Ge antiemetika enl ord …………… timme 0 ………. Koppla inf. Taxotere infusionshastighet 1 tim …………… timme 1 ………. Koppla inf. NaCl 9mg/ml, 1000 ml + 20 mmol K. Infusionshastighet 1.5 tim …………… timme 2:30 ………. Om diures < 400 ml/4 tim ge inj. Furix 20 mg …………… Koppla inf. NaCl 9mg/ml, 1000 ml + 20 mmol K + 5mmol Mg infusionshastighet 1.5 tim …………… Koppla inf. Cisplatin, infusionshastighet 1 tim …………… Om diures < 400 ml ge inj. Furix 20 mg …………… timme 2:30 timme 4 timme 5 ………. ………. timme 5 ………. Koppla inf NaCl 9mg/ml, 1000 ml + 20 mmol K + 5 mmol Mg infusionshastighet 1 tim …………… timme 6 ………. Koppla inf. NaCl 9mg/ml, 1000 ml infusionshastighet 2 tim …………… Ge antiemetika enligt ordination …………… 16:00 62 ………. Utfört, sign ………. BILAGA 2. DISTRESS-TERMOMETER 63 BILAGA 3. REGIONALA ENHETER MED SPECIELL INRIKTNING PÅ UTREDNINGAR / CUP Avdelningen för onkologi, Sahlgrenska universitetssjukhuset, 413 45 Göteborg Mottagningen, Onkologiska kliniken, Universitetssjukhuset, 581 85 Linköping Onkologiska kliniken, Universitetssjukhuset, 221 85 Lund Mottagningen, Onkologiska kliniken, UMAS, 205 02 Malmö Mottagningen för okända primärtumörer, Stockholms onkologiska klinik, Södersjukhuset, 118 83 Stockholm Mottagningen, Onkologiska kliniken, Norrlands universitetssjukhus, 901 85 Umeå Onkologiska kliniken, Akademiska sjukhuset, 751 85 Uppsala CUP-mottagningen, Kirurgiska kliniken, B-huset, vån ,1 Universitetssjukhuset, 701 85 Örebro 64 BILAGA 4. GASTROINTESTINALA ENDOSKOPISKA ULTRALJUDS (EUS) - UNDERSÖKNINGAR För endoskopiskt ultraljudsundersökning kombineras ett endoskop med videooptik med en högfrekvent ultraljudsgivare. Undersökningen görs polikliniskt på fastande patient. Lokal svalganestesi och intravenös sedering ges. Undersökningen tar ca 30-60 min. Det största användningsområdet är inom gastrointestinal(GI)-kanalen, transesofagealt eller transrektalt med undersökning av esofagus, ventrikel och duodenum respektive analkanal, rectum och colon. Intilliggande organ som mediastinum, närliggande lunga, hjärta, pancreas, gallvägarna, delar av levern, binjurar, mjälte, lymfkörtlar och lilla bäckenet är väl lämpade för EUS-undersökning, då man kommer nära målorganet. Högfrekvent ultraljud nära målorganet ger hög upplösning så att ultraljudsbilden av GI-kanalens vägglager liknar den histologiska bilden. ”Ultraljudsvägglager” kan urskiljas som motsvarar de histologiska lagren. Det går att upptäcka mycket små tumörer och små mängder ascites som inte kan urskiljas med andra avbildande metoder. Metoden används vid TNM-klassifiering av GI-cancer och vid bedömning av subepiteliala tumörer, till exempel metastaser, carcinoid och GIST (gastrointestinal stromacellstumör). Den skirrösa ventrikelcancern kan vara svår att diagnostisera vid vanlig endoskopi då slemhinnan oftast är normal och biopsier inte sällan är negativa. EUS vid skirrös cancer ger en typisk bild med kraftigt förtjockade djupare vägglager och infiltrativ tumörväxt. Alla förändringar synliga med EUS, i eller via GI–kanalen, kan finnålspunkteras endoskopiskt med ultraljudsledning med 0,5-0,9 millimeters nålar. Det finns också möjlighet till ultraljudsledd endoskopisk biopsi med 1,2 mm nål för histologisk bedömning. Nålen kan föras ut 8 cm. En förutsättning för punktion är att förändringen ses med ultraljud från GI-kanalen utan mellanliggande luft, tarmgas, ben eller stora kärl. EUS ökar tillgängligheten för punktion av tumörer som är svåråtkomliga med andra metoder och ökar de diagnostiska möjligheterna för tumörer i och i anslutning till GI-kanalen. 65