Magsårsbakterien Helicobacter pylori – en kameleont i magen
advertisement

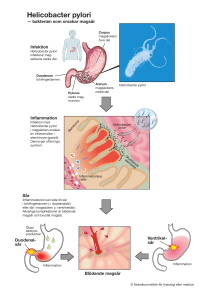
Magsårsbakterien Helicobacter pylori – en kameleont i magen Anna Arnqvist forskarassistent Thomas Borén universitetslektor Inst. för odontologi, enheten för oral mikrobiologi Anna Arnqvist: Inledningsvis ska jag berätta om magsårsbakterien Helicobacter pylori, hur den ser ut, var den infekterar och vilka sjukdomar den kan ge upphov till. Senare berättar Thomas om den forskning som vi bedriver här vid Umeå universitet innan vi avslutar med en filmvisning. Figur 1. Magsårsbakterien Helicobacter pylori i hög förstoring. De långa rörliga utskotten använder bakterien för att simma effektivt, vilket behövs i den turbulenta miljön i magen för att orsaka en ihärdig och livslång infektion. (Bild med tillstånd av Scientific American, SCIENCE & MEDICINE.) 48 Figur 1 visar vår favoritbakterie. H. pylori är avlång, spiralformad och 2–4 µm (mikrometer = tusendels mm) lång. I ena änden har den långa svansar, s k flageller. De fungerar som en propeller och gör bakterien rörlig. Om den inte kunde röra sig, skulle den svepas iväg när magen rör sig eller när cellerna i slemlagret omsätts. Förr var det vedertaget att magsår beror på stress eller psykisk obalans. För tjugo år sedan kom omvälvande forskningsrön från Australien, där två forskare – Barry Marshall och Robin Warren – visade att personer som led av kronisk magkatarr var infekterade med bakterier. Det var kontroversiellt att påstå något sådant, eftersom magen ansetts som steril och därför mötte de kraftigt motstånd. Idag är det emellertid ingen som tvivlar på deras resultat. Den som är infekterad med magsårsbakterier kan utveckla magkatarr, magsår och så småningom t.o.m. cancer. Men magsårsbakterien är ingalunda någon ”ny” bakterie. En mumie som hittades bland bergstopparna i Anderna i Figur 2. I mitten av magsäcken är det surt, dvs. pH-värdet är lågt, eftersom den delen av magsäcken har många syraproducerande parietalceller. För att det yttersta cellagret, epitelcellerna, inte skall skadas av det låga pH-värdet täcks de av ett slemlager, mucuslagret. Helicobacter koloniserar framför allt den något mindre sura nedre delen, antrum, samt tolvfingertarmen. 49 Sydamerika hade varit infekterad med Helicobacter. Hälften av världens befolkning beräknas vara infekterad av H. pylori och bland de infekterade utvecklar ungefär var tionde person sjukdom. I stort sett alla infekterade bär H. pylori livet ut. Detta faktum är utmanande för oss som forskar om den: Vad är det hos bakterien som gör oss sjuka och hur kan den här bakterien orsaka en livslång infektion som immunförsvaret inte förmår bekämpa? Inne i magsäcken varierar surhetsgraden, pH-värdet. I nedre delen, antrumregionen, är miljön något mindre sur och där trivs H. pylori bäst; se Figur 2 . Den koloniserar företrädesvis det området eller går ännu längre ner, till tolvfingertarmens mynning. Tar man en biopsi, dvs. en provbit av vävnaden, från magsäcken hos en patient som är infekterad med H. pylori och färgar in preparatet ser det ut som på Figur 3 . Hälften bär på Helicobacter En infektion med H. pylori är oftast livslång. När infektionen har etablerats uppstår en inflammation, s.k. magkatarr. Hos vissa personer fortskri- Figur 3. Helicobacterbakterier i ett prov från magslemhinnan. De mindre prickarna är bakterier. De återfinns i slemlagret och en del av dem förmår fästa direkt på cellytan. 50 Figur 4. Gastroskopibilder av magsår. De små infällda bilderna visar var slangen med kameran befinner sig. Det kanske inte ser så väldigt sårlikt ut, men det beror på att själva såret ligger djupare och täcks av annan vävnad. der processen och det bildas ett ”magsår”, ett begrepp som inbegriper sår i både magsäcken och tolvfingertarmen. Om doktorn anar att det kan vara frågan om magsår får patienten genomgå en gastroskopi, vilket innebär att en slang med en liten kamera förs ned i magen för att undersöka hur där ser ut. Figur 4 visar hur det kan se ut. Av alla magsår beror ungefär hälften av dem i magsäcken på Helicobacter-infektion medan flertalet av dem i tolvfingertarmen är relaterade till Helicobacter. Det finns i vissa organ ett allmänt samband mellan en inflammation som pågått under en lång tid och risken för att cancer utvecklas– detta gäller också vid en Helicobacterorsakad inflammation. Världshälsoorganisationen, WHO, har därför klassificerat H. pylori som en typ 1-carcinogen, dvs. en cancerorsak av samma dignitet som tobaksrökning. Vilka är det då som får helicobacterinfektion? Det vet vi inte riktigt, men vi vet att svaret till en del beror på var i världen man bor. Redan i unga år är en stor del av befolkningen i u-länderna infekterade. Sverige och andra industriländer har däremot inte alls lika många infekterade. Lite grovt kan man säga att 25% av 25-åringarna är infekterade och andelen ökar till närmare hälften av 50-åringarna. 51 Behovet av alternativ behandling ”Livslång infektion” låter förstås förfärligt dystert, men eftersom orsaken är en bakterieinfektion finns det behandling att få. Läkemedelsverket rekommenderar idag en s.k. trippelbehandling. Det innebär Losec® eller en motsvarande protonpumpshämmare (som minskar produktionen av syra i magen) kombinerat med två olika antibiotika under en veckas tid. De flesta blir friska av det, men eftersom antibiotikaresistensen ökar hos de flesta bakterier är målet att finna alternativa behandlingsmetoder. För att utveckla en alternativ behandling måste man veta vad som orsakar sjukdomen – och vi Helicobacterforskare försöker kartlägga de egenskaper hos magsårsbakterien som gör oss sjuka. Några sjukdomsframkallande egenskaper hos H. pylori är kända: En viktig faktor är att den kan producera ett enzym som heter ureas och som i sin tur kan spjälka ett ämne i magen som heter urea. Vid den spjälkningen produceras bl.a. ammoniak, som är basiskt. Ureas har därför en syraskyddande effekt som gör att bakterien kan överleva i den sura magmiljön. Som vi sagt tidigare är också rörligheten viktig för bakterien. Man har gjort experiment där man har tagit bort flagellerna från magsårsbakterier med följden att de inte längre kan röra sig. Sådana bakterier kan inte kolonisera, inte växa och inte överleva i magen. Den viktiga vidhäftningen En annan viktig faktor för sjukdomsutvecklingen är bakteriens förmåga att vidhäfta, dvs. sätta sig fast på cellerna, och vi är särskilt intresserade av dessa mekanismer. Vad är det som gör att bakterien fastnar på magslemhinnan? Vad finns på bakterieytan som gör att den kan fästa? Titeln på föredraget är ”en kameleont i magen” och det är precis så lurigt vi tror att bakterien uppför sig: Att den byter skepnad och på så sätt lurar immunförsvaret. Förvisso är den inte ensam om den här typen av beteende, det finns många andra sjukdomsframkallande bakterier som också gör detta. Men det som är unikt för H. pylori är dess förmåga att orsaka en livslång infektion. Bakterien har vidhäftningsproteiner på sin yta, s.k. adhesiner, och på magens slemhinna finns förankringsmolekyler, strukturer som bakterierna vid- 52 Figur 5. Helicobacterbakterien har vidhäftningsproteiner på sin yta, här illustrerade som kulor. På magens slemhinna finns förankringsmolekyler, illustrerade som ”Y:n”. Bakterien kan anpassa sina adhesiner så att de passar för de förankringmolekyler som är tillgängliga. häftar till, se figur 5. Vi vet att bakterien kan ha flera olika typer av adhesiner. Kopplingen mellan ett givet vidhäftningsprotein och en viss förankringsmolekyl är specifik och bakterien kan anpassa sina vidhäftningsproteiner efter vilka förankringsmolekyler som är tillgängliga. Dessutom kan bakterien producera och klä sig i molekyler som är identiska med förankringsmolekylerna. Det kan lura immunförsvaret att tro att bakterien är något kroppseget och därmed inte behöver bekämpas. Thomas Borén: Jag tänkte fortsätta berätta om hur det går till när bakterien vidhäftar i magen. Numera vet vi mer om hur dess vidhäftningegenskaper ser ut. Den delen av projektet påbörjades när jag för tio år sedan forskade vid Washington University i St. Louis, USA, tillsammans med Staffan Normark som tidigare var professor i mikrobiologi här i Umeå. Vi tänkte oss då att om man försöker förstå bakteriens vidhäftningsapparat, kanske man med den kunskapen kan lista ut något sätt att förhindra att bakterierna klamrar sig fast på cellerna i magen och därigenom skulle man kunna utveckla 53 Figur 6. Principskiss av de sockerklädda blodgruppsantigenerna H och Lewis B, till vilka H. Pylori binder med hjälp av Blodgruppsantigenbindande Adhesineet (BabA). alternativ till antibiotikabehandling. Som Anna nämnde är väldigt många personer runt om i världen infekterade av dessa bakterier, och i Sverige är det ju inte realistiskt att behöva behandla halva befolkningen med antibiotika. Slutsatsen är att någonting annat måste till, och tanken går onekligen till möjligheten att utveckla ett vaccin. När vi började med det här forskningsprojektet lyckades vi identifiera ”de fukosylerade blodgruppsantigenerna”, dvs. de kolhydrat-/sockerstrukturer som bakterien först binder till för att därigenom kunna vidhäfta till cellytorna i magen. Just de sockerstrukturer som bakterien binder bäst till är samma som visar att man hör till blodgrupp 0 (noll) i det vanliga AB0-blodgruppssystemet, se Figur 6. Personer med blodgrupp 0 har också mer av de här sockerstrukturerna i magen, det framgår av Figur 7. Det finns en intressant klinisk koppling här, eftersom man ända sedan 1950-talet har känt till att människor med blodgrupp 0 löper större risk än andra för magsår. Vi föreslog därför att orsaken skulle kunna vara att dessa personer har fler av de här blodgruppsantigenerna i magen än dem med blodgrupperna A och B. Därför binder bakterierna hårdare i magen hos individer med blodgrupp O och deras infektioner kommer därigenom att i högre grad utvecklas mot kronisk inflammation och magsår. 54 Figur 7. I verkligheten ser vidhäftningen ut på det här sättet, bilden visar ett prov från magslemhinnan där blodgruppsantigenerna färgats. På områdena med blodgruppsantigener ser man dessutom ett antal små ljusa fläckar. Det är Helicobacterbakterier som sitter där, eftersom de dras till områdena med blodgruppsantigener. Vidhäftningsproteiner identifierade Det är en lockande tanke att kunna förhindra magsår genom att störa bakteriens olika sätt att vidhäfta. När jag kom tillbaka till Sverige och flyttade till Umeå, tänkte jag först försöka identifiera vidhäftningsproteinerna på bakterieytan via blodgrupp 0-sockret som vi hade identifierat. Med elektronmikroskopi lyckades vi också identifiera vidhäftningsproteinet, som vi kallar ”Blodgruppsantigen- bindande Adhesin” (BabA). I samarbete med en tysk grupp undersökte vi en mängd kliniska stammar, dvs. Helicobacterbakterier som tagits från olika patienter. Intressant är att man hittar de BabA-positiva bakterierna framför allt i de prover som kom ifrån patienter med magsår och cancer! Hos en person som saknar vidhäftningsproteinet är utsikterna väsentligt större för att sjukdomen stannar vid magkatarr. Ju hårdare bakterien binder till magen, desto mer inflammation retar den upp. Apropå inflammation blev vi uppmärksammade för de resultat vi publicerade i somras, figur 8, då kvällstidningarna skrev att det skulle kunna leda 55 Figur 8. Umeå-forskning på löpsedeln (sommaren 2002). till ett vaccin mot magsår. Det vi hade gjort var helt enkelt att ta bort BabAproteinet för visa hur viktigt det är. Det gör man genom att med molekylärbiologiska metoder eliminera BabA-genen hos bakterien. Då får man en s.k. mutant utan vidhäftningsprotein. Inte desto mindre framgår av figur 9 att de muterade bakterierna (de lysande prickarna) fortfarande binder bra till inflammerad magslemhinna – faktiskt lika bra som föräldrabakterierna, som brukar kallas ”vildtypsbakterier”. Men om man jämför med frisk magslemhinna i nedre delen av bilden (provet kommer från en patient som opererat magen pga. problem med övervikt) binder inte mutantbakterien. Det betyder att bakterierna uppenbarligen har två olika vidhäftningsmekanismer, dels BabA som binder till blodgrupp 0-sockren, dels något ytterligare som är kopplat just till att magslemhinnan är inflammerad. Det visade sig att det socker som bakterien binder till (det rör sig fortfarande om ett socker), är ett s.k. inflammationsassocierat socker: sialyl-Lewis x (sLex). Det påminner lite om det förra blodgrupp 0-sockret men har också en laddad grupp, sialinsyra, längst ut på molekylen. För att visa på hur dessa processer går till i levande livet använde vi en Rhesusapa, en liten apa som normalt är infekterad med samma Helicobacter pylori som människan. Apan hade en etablerad helicobacterinfektion i 56 Figur 9. Helicobacterbakterien har två vidhäftningsmekanismer, dels BabA som binder till blodgrupp 0-sockren, dels något ytterligare som är kopplat just till att magslemhinnan är inflammerad. Därför binder inte de muterade bakterier som befriats från BabA till den friska slemhinnan nederst t.h. magen och antibiotikabehandlades med samma typ av antibiotikakur som en människa skulle ha fått på läkarrecept. Ett litet vävnadsprov som togs 6 månader senare visade att apan nu saknade sialyl-Lewis-sockren på sina celler i magen. Till den här vävnaden binder inte bakterierna och apan var således frisk. Sedan fick apan tillbaka sin Helicobacter, dvs. den infekterades på nytt. Ett halvår senare var magen återigen lika inflammerad som när vi började. Nu fanns det nya sLex-sockret på cellytorna och nu kunde bakterierna binda igen. Senare renade vi fram det här nya vidhäftningsproteinet med en metod som vi själva utvecklat, Retagging. Den är egentligen inte komplicerad utan snarare listig: man kopplar de nya sockren som vi hade identifierat, sialylsockren, till ett bärarprotein. Sedan blandar man något som kallas crosslinkers med bakterierna så att sockren kommer att kunna bindas kemiskt till vidhäftningsproteinerna. När blandningen därefter sätts under en lampa med UV-ljus aktiveras crosslinkern, blir väldigt klibbig och fastnar på vidhäftningsproteinet. När man slutligen tvättar och skakar loss vidhäftnings- 57 Figur 10. Retagging, en metod för att rena vidhäftningsproteinerna hos Helicobacterbakterier. proteinet bryter man isär hela komplexet i sina molekylära beståndsdelar och har då fått en liten kemisk ”adresslapp” på vidhäftningsproteinet. Detta kan man sedan attrahera med små magnetkulor, vilka man i sin tur fångar upp med en riktig magnet på utsidan av provröret. När man slutligen häller ut de övriga proteinerna blir bara vidhäftningsproteinet kvar i röret, se Figur 10. Det finns sedan metoder för att hitta genen och med den gjorde vi på samma sätt som tidigare, dvs. tog bort först det ena vidhäftningsproteinet från föräldrabakterien, sedan det andra och slutligen båda typerna. Det visar sig då att med båda generna borttagna kan bakterierna inte alls vidhäfta till magens celler! Men bakterierna är som sagt listiga. Anna ska nu berätta lite om vad som händer sedan. Men vissa förmår vidhäfta ändå... Anna Arnqvist: Det luriga är att H. pylori förmår ändra sina vidhäftningsegenskaper som klär dess yta. För att testa våra aningar om att så är fallet bestämde vi oss för att studera vidhäftningsproteinet BabA som känner igen 58 Figur 11. Genom att arvsanlaget byter plats på kromosomen kan en bakterie ändra sin vidhäftningsförmåga. förankringsmolekylen Lewis b. Vi gjorde så att bakterierna blev grönlysande och blandade därefter dem med förankringsmolekylen (Lewis b) som fått en röd lysande färg. I mikroskopet kunde vi då se om en viss H. pylori -stam förmådde binda till förankringsmolekylen eller inte. Det som gjorde oss extra intresserade var då att vi bland alla ickebindande bakterier hittade några som ändrat sin bindningsförmåga. Som molekylärbiolog blev jag förstås nyfiken vad som hänt på molekylärnivå: Vad särskilde de bakterier som plötsligt fått förmågan att binda från de ursprungliga ickebindande? Vi bestämde oss för att försöka isolera de enskilda bakterier som kunde binda. Det var ungefär 1 per 100 000, så vi förstod att det inte skulle vara tekniskt möjligt med sedvanliga metoder. Vi valde därför att anrika de bindande varianterna och lyckades med hjälp av förankringsmolekyler som kopplats till magnetkulor. När vi isolerat de bindande varianterna jämförde vi dem med de ursprungliga, ickebindande bakterierna. Vi har konstaterat att anledningen till att de förmår binda till förankringsmolekylen är att arvsanlaget som kodar för vidhäftningsproteinet bytt plats på kromosomen. Genom att flytta arvsan- 59 laget till en annan miljö, en annan plats på kromosomen, kan bakterien uttrycka, dvs. producera, vidhäftningsproteinet, se figur 11. Det som skiljer en ickebindare från en bindare är att genen för vidhäftningsproteinet BabA har bytt plats. Figur 12. Helicobacter-bakteriernas förmåga att genetiskt modifiera och anpassa sig kan leda till att infektionen blir ihärdig. A) Bakterien kommer simmande och sätter sig på cellytan med hjälp av vidhäftningsproteinerna BabA, ritade som Y:n. B) Cellerna irriteras så att de inflammationsassocierade sockren (sialyl-Lewis x; ritade som svarta koner) kommer upp till cellytan som försvarsmekanismer, men de utnyttjas istället av bakterien för att få ytterligare fäste. C) Cellerna blir ännu mer irriterade och området inflammerat. Nu kommer vita blodkroppar till undsättning, och eftersom de har samma socker (sialyl-Lewis x; mörka koner) på sin yta måste bakterien retirera för att inte fångas och förstöras. D) När bakterien på det sättet tvingas iväg läker området ut efter ett tag, medan bakterien simmar till nästa område. Nu ska ni få se på film…… Thomas Borén: Filmen (stillbilder finns på figur 12 A-D) försöker illustrera hur Helicobacter-bakteriernas förmåga att genetiskt modifiera och an- 60 passa sig kan leda till infektionen blir ihärdiga. De kulformade strukturerna är de s.k. fukosylerade blodgruppsantigenerna, och som sitter på cellerna i magens nedre del. Bakterien kommer simmande och har vidhäftningsproteinerna BabA på sin yta. I det här fallet binder blodgrupp 0-sockren och bakterien sätter sig på cellen; vi har kanske inte nämnt varför den gör så men det är framför allt för att fiska olika näringsämnen från cellerna i magen, att få mat helt enkelt. Cellerna gillar ju inte det här utan blir irriterade och då kommer de inflammationsassocierade sockren sialyl-Lewis x upp till cellytan. De är egentligen ett slags försvar för kroppen och därför illustrerade som lite spetsiga för att dra till sig vita blodkroppar, bl.a. alltså ska komma till undsättning. Thomas Borén Men bakterierna har ju vidhäftningsproteinet SabA, som binder just till de här försvarssockren. Därmed kan bakterien tanka över aminosyror och allt den behöver i tät kontakt med cellytan. Cellerna blir nu givetvis ännu mer irriterade. Det blir rent ut sagt rodnat och inflammerat. I det här läget börjar patienterna ofta dricka buffrande och syrablockerande medicin, t.ex. Novalucol® . Nu är det hög tid för en vit blodkropp att komma till undsätt- 61 ning, och eftersom vita blodkroppar har samma socker (sialyl-Lewis x) på sin yta, måste bakterien retirera för att inte fångas och förstöras av blodkroppen. Bakterien backar alltså och återvänder till de mer ofarliga kulformiga blodgrupp 0-sockren. När bakterien på det sättet tvingas iväg av kroppen läker området ut efter ett tag, medan bakterien simmar till nästa område. Det här är typiskt för kroniska inflammationer, då de karaktäriseras av att de går upp och ner i skov. Anna Arnqvist Sverker Olofsson: Tiden går fort men jag ska bara fråga: När kommer vaccinet? Thomas Borén: Vi jobbar på det. Realistiskt sett är det här inte helt lätt och ett antal stora företag har redan har gått bet på uppgiften. Jag skulle tro att idag är tio år en ganska rimlig gissning. Sverker Olofsson: Jag har ända fram till för ett tag sedan visserligen insett att magsår är otäckt men ändå en statussjukdom för att man har det stressigt och allt det där. Nu är det bara en äcklig bakterie. Har jag problem med hjärtat kan det också vara ett tecken på att jag borstar tänderna dåligt. Vad vi nu ska få veta om åderförkalkning kan man ju bara ana... 62