Förekomst av Helicobacter pylori, Hepatit B-antikroppar samt
advertisement

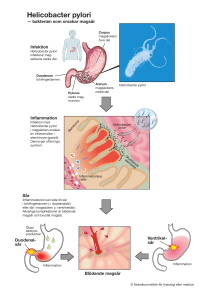
Institutionen för läkarutbildning Medicin C, 15 högskolepoäng Maj 2014 Förekomst av Helicobacter pylori, Hepatit B-antikroppar samt ABOtillhörighet hos en högriskpopulation för ventrikelcancer i Nicaragua ____________________________________________________________________ Författare Maja Grundell Handledare Kaisa Thorell, doktorand Göteborgs Universitet SAMMANFATTNING Bakgrund: Ventrikelcancer är den fjärde vanligaste cancerrelaterade dödsorsaken i världen. Utvecklingsländer har i snitt högre incidens än mer utvecklade länder. År 1994 klassificerade International Agency for Cancer Research (IARC) Helicobacter pylori som det främsta carcinogenet för distal ventrikelcancer. Andra konstaterade riskfaktorer är rökning, kronisk gastrit, hereditet, manligt kön och diet. Viss forskning har även visat på högre incidens av ventrikelcancer hos individer som tillhör blodgrupp A och 0. Hypoteser finns även kring koppling mellan hepatit B (HBs) och cancer i ventrikeln. Nicaragua är ett land med låg socioekonomi som är hårt drabbat av ventrikelcancer. Att angripa carcinogenesen och finna fler riskfaktorer samt markörer i ett tidigt stadium av sjukdomen skulle kunna öka överlevnaden. Syfte med studien är att undersöka förekomst av antikroppar mot H.pylori, hepatit B samt ABO-tillhörighet i en högriskpopulation för ventrikelcancer i Nicaragua. Projektet utgör en pilotstudie i ett större forskningsarbete mellan Göteborgs Universitet och Hospital Salud Integral i Managua, Nicaragua. Metod och material: Experimentell studie. Studiepopulationen bestod av 68 volontära individer på Hospital Jacinto Hernandez i staden Nueva Guinea, Nicaragua. Resultat: 88 % av studiedeltagarna var positiva för H.pylori och drygt 1 % var positiva för Hbs. Gällande ABO-tillhörighet var 0 positiv den största blodgruppen (56 %) följt av A positiv (21 % ). Konklusion Förekomsten av H. pylori hos befolkningen i Nicaragua är mycket hög vilket kan vara en bidragande orsak till den höga incidensen av ventrikelcancer. Övriga studerade faktorer är mer osäkra. 2 INNEHÅLLSFÖRTECKNING 1.BAKGRUND…………………………………………………………….. 4 1.1 Ventrikelcancer………………………………………………………. 4 1.2 Helicobacter pylori ………………………………………………….. 5 1.3 Ventrikelcancer och hepatit B antikroppar…………………………... 7 1.4 ABO- Blodgrupp och ventrikelcancer………………………………. 8 1.5 Infektionsorsakad cancersjukdom…………………………………….8 1.6 Ventrikelcancer i Nicaragua…………………………………………..9 2. SYFTE……………………………………………………………………10 3. METOD OCH MATERIAL…………………………………………….. 11 3.1 Metod………………………………………………………………… 11 3.2 Etiska överväganden…………………………………………………. 11 3.3 Material……………………………………………………………….12 4. RESULTAT……………………………………………………………... 13 5. DISKUSSION……………………………………………………………17 6. KONKLUSION…………………………………………………………. 20 7. FÖRFATTARENS TACK………………………………………………. 20 8. REFERENSER………………………………………………………….. 21 BILAGA 1-Frågeformulär…………………………………………………. 24 BILAGA 2-Samtycke……………………………………………………… 26 3 1.BAKGRUND 1.1 Ventrikelcancer Globalt insjuknar 952 000 människor i ventrikelcancer varje år vilket gör den till den femte- respektive sjätte vanligaste cancersjukdomen hos män respektive kvinnor (1). Incidensen av ventrikelcancer varierar globalt och mellan enskilda länder. Högst incidens (>20 per 100 000 hos män) finns i Japan, Kina, Östeuropa och Sydamerika, medan lägst incidens (<10 per 100 000 män) finns i Nordamerika, vissa områden i Afrika och Sydasien (2). Det finns indikationer på att ventrikelcancer är mer utbrett på landsbygden än i storstäder (3). Förhållandet mellan insjuknade män och kvinnor är 2:1(4). En möjlig anledning till att kvinnor drabbas i lägre utsträckning än män kan vara att reproduktionshormoner såsom östrogen och progesteron har en skyddande effekt mot cancerutveckling i magsäcken (5). Ventrikelcancer upptäcks ofta i ett sent stadium vilket gör att mortaliteten är hög (6). Femårsöverlevnaden är 25,7 % (7). Detta gör sjukdomen till den tredje vanligaste cancerrelaterade dödsorsaken i världen (1). Magsäcken delas anatomiskt in i, proximalt till distalt; kardia (övre magmunnen), fundus, corpus, antrum och pylorussfinketern (nedre magmunnen). Det finns två subtyper av ventrikelcancer beroende på lokalisation i magsäcken; proximal/kardiell cancer och distal/icke kardiell cancer(6). 85 % av ventrikelcancer är adenocarcinom. Resterande är främst lymfom och stromala tumörer. Adenocarcinom delas histologiskt in i diffus – och intestinal form. Diffus är o- eller lågt differentierad medan intestinal är högt differentierad. Ventrikeltumörer med en blandform av dessa histologiska typer förekommer också. Cancercellerna sprids i huvudsak på två sätt; lokalt samt lymfogent. Lokal spridning sker till vävnad i perigastriet och omentet samt till pankreas, kolon och lever. Lymfogen spridning sker främst till intraabdominella och supraklavikulära lymfnoder samt lymfnoder kring ovarier, peritoneum och periumbilikalt. Hematogen spridning förekommer också (8). Ventrikelcancer är en multifaktoriell tumörsjukdom associerad med ett flertal riskfakorer såsom; H. Pylori-infektion, kronisk gastrit, magsäckspolyper, hög ålder, hereditet, manligt kön, rökning, högt intag av salt och rökt mat samt lågt intag av frukt och grönsaker (9). 4 1.2 Helicobacter pylori Helicobacter pylori är en gramnegativ mikroaerofil bakterie som koloniserar ventrikelväggens mukosa. Bakterien når ventrikeln främst via fekal-oral transmission och smittar vanligen vid personkontakt eller via kontaminerad föda och vatten (4). H. pylori är mycket väl anpassad till att kunna överleva i den sura miljön som råder i ventrikeln. Detta beror på dess förmåga att omvandla urea till ammoniak och koldioxid och därmed höja pH värdet. Denna omvandling är möjlig på grund av att H. pylori utsöndrar enzymet ureas. Ureasaktiviteten är reglerad av en protonpump vid namn Ure 1. Ure 1 aktiveras vid lågt pH och är helt inaktiverad vid neutralt pH för att förhindra alkalisering (10). Att H. pylori överlever i magslemhinnan beror också på dess höga motilitet, tack vare flaggellerna som är kopplade till bakteriens ena ände. Det råder en pH gradient i mukuslagret. På epitelväggsytan är pH neutralt medan närmare ventrikellumen sjunker pH. På grund av den snabba mukusomsättningen krävs det att H .pylori ständigt lossnar från sitt fäste till cellerna när det blir för surt och förflyttar sig inåt mot epitelcellerna där det är mer neutralt. H. pylori har speciella receptorer på sin yta som känner av pH-värdet och gör att den rör sig i gynnsam riktningen (11). Andelen av befolkningen som är infekterad av H. pylori varierar över världen. I utvecklingsländer såsom Asien och Latinamerika är ca 80 % infekterade, i rikare delare av världen såsom USA, Storbritannien och Australien ca 40 %. Prevalensen av H. pylori beror generellt på; ålder, socioekonomisk status, ursprungsland och hygien. Helicobacter pylori-infektion leder alltid till gastrit men majoriteten förblir asymptomatiska. 10-15% utvecklar duodenala- och gastriska ulcerationer medan 1-2 % utvecklar ventrikelcancer. Infektionen i mucosan finns kvar livet om man ej blir behandlad med antibiotikum (4). År 1994 klassificerade International Agency for Cancer Research (IACR) Helicobacter Pylori som det främsta carcinogenet för icke kardiell magsäckscancer(12). Bakterien är samtidigt den främsta bakomliggande orsaken till gastrit, peptiskt ulkus och MALT lymfom (mucosa associated lymphoid tissue) (13). Vidare har studier visat på korrelation mellan H. pylori-infektion och endotelial dysfunktion vilket kan bidra till vaskulär sjukdom(14). Bakterien visar hög heterogenitet vilket gör att trots dess höga prevalens är det endast en mindre andel som utvecklar sjukdom. Följden av infektionen beror främst på 5 tre faktorer; stammens virulens, värdresponsen och miljöfaktorer. Som miljöfaktorer har tobaksanvändning, stress, levnadsstandard, kost, alkohol och användning av NSAID (non steroid anti-inflammatory drugs) konstaterats förvärra infektionen(13). H. pylori-infektion är främst kopplat till utveckling av intestinalt icke kardiellt adenocarcinom i ventrikeln. Processen från debutinfektion av H. pylori till cancer in situ följer ett histologiskt mönster. Första steget är kronisk aktiv, ickeatrofisk gastrit, följt av multifokal atrofisk gastrit. Vidare sker utveckling till intestinal metaplasi, följt av dysplasi, till att slutligen övergå till invasivt adenocarcinom(15). Diffus ventrikelcancer är istället en följd av defekta intracellulära adhesionsmolekyler såsom försvunnet E-cadherin uttryck. E-cadherin är ett transmembranprotein som är viktigt vid celladhesion. Proteinet kodas av CDH1 genen. Denna gen kan få försämrad funktion genom germline- eller somatisk mutation eller via epigenetiska mekanismer såsom metylering av CDH1 promotorn(5). H. pyloris virulensfaktorer har studerats intensivt sedan man lyckades kultivera bakterien för första gången under 80-talet. De främsta virulensfaktorerna som har visat spela roll i inflammationsutveckling och carcinogenes är; cag patogena öar (PAI), vakuoliserande cytotoxin (Vac A) och det blodgruppsbindande adhesinet BabA(16). Cag patogena öar (PAI) finns hos vissa stammar av H. pylori och är ett fragment av det kromosomala DNA som kodar för CagA (cytotoxin-associated gene A) protein. Cag Aproteinet injiceras in i epitelcellerna i ventrikeln via bakteriell sekretion. Cag A fungerar intracellulärt som ett onkoprotein som kan inducera neoplastisk malignitet i värdcellen genom ökad MAP-kinas aktivitet. Cag A kan också skapa obalans i IL-6 signaleringen vilket kan leda till ökad inflammatorisk reaktion(17). En studie visade att 96,1% av Östasiatiska H. pylori stammar var Cag-PAI positiva i jämförelse med 60 % av stammarna i västvärlden(18). Vac A toxinet är ett cytotoxin som sekreras från H. pylori. Det finns, till skillnad från Cag patogena öar, uttryckt hos samtliga stammar av H. pylori. Det finns en hög genetisk diversitet hos vac-allelerna vilket resulterar i varierande virulens. Sekretion av Vac A inducerar en rad cellulära förändringar hos epitelceller i ventrikeln såsom mitokondriella 6 skador, cytokrom c-utfällning och cellapoptos(19-21). Det har även visats att Vac A inhiberar proliferation av T-celler i immunförsvaret(22). BabA är ett adhesionsprotein som sitter på ytan på H.pylori. BabA binder med hög affinitet till blodgruppsantigenerna H1 och Lewis b (Leb ). H1 är en kolhydratstruktur som definierar blodgrupp 0 i ABO-systemet. Lewis antigen är ett humant blodgruppssystem som huvudsakligen finns uttryckt på erytrocyter, endotel och gastrointestinalt epitel. Lewis-antigen delas in i Lewis a (Lea) och Lewis b (Leb). En studie har visat att vissa stammar av H. pylori enbart binder H1 och Lewis b-antigener som finns hos blodgrupp 0, men saknar förmåga att binda till A-lewis b-antigen som finns hos blodgrupp A, så kallade specialist-stammar(23). Andra stammar, så kallade generalister, har ett mindre restriktivt bindningsmönster och kan binda till flera blodgruppsantigen. Adhesion mellan BabA och gastrointestinalt epitel underlättar kolonisering av H. pylori och inducerar mukosal inflammation. Dessutom ökar adhesionen transport av Vac A och Cag A in i värdcellen. (21). 1.3 Cancer och hepatit B virus Hepatit B (HBV) är ett dubbelsträngat, cirkulärt DNA-virus som tillhör familjen hepadnavirus. HBV klassificeras in i sju stycken kategorier; A-G(24). HBV smittas perinatalt och via kroppskontakt med infekterat blod eller andra kroppsvätskor(25). Prevalensen i världen för kronisk hepatit B är 350 miljoner och varje år avlider 600 000 människor i världen till följd av sjukdomen eller hepatit B-relaterade-sjukdomar såsom levercirros och hepatocellulärt carcinom (HCC) (26). Upp till 80 % av HCC orsakas av hepatit B infektion. Det gör HBV till det näst största kända carcinogenet i världen(25) efter tobak. Sambandet mellan förekomst av Hepatit B antikroppar och ventrikelcancer är inte klarlagd. En studie som gjordes i Norra Iran visade inte på någon korrelation(27). 1.4 ABO-blodgrupp och ventrikelcancer 7 Ett antal studier har visat att individer som tillhör blodgrupp A löper större risk att utveckla ventrikelcancer än de som tillhör grupp AB, B eller 0 (28,29). En större andel individer med blodgrupp A är dessutom infekterade med H. pylori, vilket kan vara en bakomliggande faktor till den ökade cancerincidensen hos denna population. Samma studie visade att immunförsvaret mot tumörbildning var sämre hos individer med grupp A (30). En annan studie visade istället att blodgrupp 0 hade högst korrelation med utveckling av ventrikelcancer. Resultatet av denna studie visade följande; av de 301 undersökta patienterna med ventrikelcancer hade 40 % blodgrupp A, 9 % grupp B, 6 % grupp AB och 45 % grupp 0(31). Forskning har också visat att blodgrupp 0 bidrar till en ökad risk att utveckla peptiska ulcerationer i ventriklen och duodenum jämfört med de andra blodgrupperna(29). Sambandet mellan ABO blodgrupp och ventrikelcancer är således inte fullt kartlagd utan kräver mer forskning(28). 1.5 Infektionsorsakad cancersjukdom År 2012 insjuknade uppskattningsvis totalt 14 miljoner människor i cancersjukdom i världen(1). Drygt två miljoner av dessa fall anses bero på infektion. H. pylori, hepatit B och C samt Humant Papillomvirus (HPV) är de infektiösa agens som hittills konstaterat ligga bakom flest fall av infektiöst orsakad tumörsjukdom. H. pylori är främst kopplat till ventrikelcancer men även till Non Hodgkins lymfom, Hepatit B och C till hepatocellulärt carcinom och HPV till cervix uteri- och anogenital cancer. Fler konstaterade samband mellan infektiösa agens och cancer är; Epstein Barr virus (EBV ) kopplat till nasopharynxcancer, Hodgkins lymfom och Non Hodgkins lymfom samt Humant herpes virus kopplat till Kaposis sarkom. Låginkomstländer är mer drabbade av infektiöst orsakad cancer än höginkomstländer(32). Detta beror troligtvis på sämre hygieniska förhållanden parallellt med sämre livsmedelshantering, vilket ger högre infektionsfrekvens(33). 1.6 Ventrikelcancer i Nicaragua 8 Nicaragua är det fattigaste landet (US$ 3200 i BNP/capita) i Centralamerika och 46,2 % av befolkningen lever under fattigdomsgränsen(34). Landet utgör ett högriskområde för ventrikelcancer. Sjukdomen är den andra ledande cancerrelaterade dödsorsaken för män respektive fjärde vanligaste cancerrelaterade dödsorsaken för kvinnor. Incidensen uppskattades år 2012 till 274 per 100 000 män respektive 189 per 100 000 kvinnor(1). 79,6 % av kvinnorna respektive 83, 2 % av männen är smittade med H. pylori i landet. En stor faktor till de den höga prevalensen är att Nicaragua är ett land med låg socioekonomisk nivå. Studier har visat att nicaraguaner med 0-6 års utbildning i större grad är smittade än de med 12 års utbildning eller mer. Likaså är prevalensen högre hos de individer som arbetar i hemmet, än de som arbetar utanför hemmet. Enklare levnadsförhållanden under barndomen såsom jordgolv i bostaden samt trångboddhet (mer än två personer per sovrum) är också faktorer som ökar incidensen av H. pylori infektion (35). En studie visade att prevalensen av Hepatit B i provinsen León i nordvästra Nicaragua är 6,5 %. Enligt studien var prevalensen av HBs högre hos människor som delade bostad med många andra människor än de som levde ensamma (36). Liksom ventrikelcancer är incidensen av hepatocellulärt carcinom (HCC) också hög i landet (225 per 100 000). Det gör HCC till den tredje vanligaste cancerformen i Nicaragua(1). Då hepatit är det största carcinogenet för HCC valde vi att även titta på prevalensen av Hbs hos vår studiepopulation. Det finns indikationer på en korrelation mellan HBs och ventrikelcancer men för att säkerställa detta krävs mer forskning. Statistik gällande ABO-tillhörighet från befolkning på tre olika platser i Nicaragua visade enligt en studie på följande; 0 positiv (53 %-73% ), A positiv (18-23 %), B positiv (2-11 %), 0 negativ (0-6 % ), AB positiv (0,2-2 % ) och A negativ (0,3-4 % ). Blodgrupp B negativ och AB negativ förekom hos mindre än 1 % av befolkningen (34). 2. Syfte 9 Tidig diagnos ökar markant chansen till överlevnad i ventrikelcancer. För att hitta en tidig markör krävs mer kunskap om sjukdomens tidiga stadier och riskfaktorer. Som en del av ett större projekt, är syftet med denna pilotstudie att undersöka förekomst av antikroppar mot Helicobacter pylori, Hepatit B och blodgruppstillhörighet i serum hos en högriskpopulation för ventrikelcancer i Nicaragua. Projektet är ett samarbete mellan Göteborgs Universitet och Hospital Salud Integral i Managua, Nicaragua. 3. METOD OCH MATERIAL 3.1. Metod 10 Frågeformulär (bilaga 1) samt medgivandeblankett (bilaga 2) fylldes i av studiedeltagarna i mån av skriv- och läskunnighet alternativt av testledare i samband med provtagningen. Via ven- och kapillärprov samlades blod in i serumrör, Vacuette Serum Clot Activator, respektive kapillärblod till Rhesus faktor D och ABO-klassificering. Rhesus faktor D och ABO-testning gjordes på sjukhuset i Nueva Guinea enligt medföljande protokoll till Serafol ABO+D monoclonal. Serumrör för HBs och H. pylori-serologi stod i rumstemperatur i 3060 minuter varefter de förvarades i kylbox med is i 8-10 timmar under transport till laboratoriet på Hospital Salud Integral i Managua. På laboratoriet centrifugerades serumrören i 1500 RPM under 10 minuter. Därefter aliquoterades rören in i mindre rör (0,5-1 ml/rör ), varefter de frystes in. Det frysta serumet packades in i en frigolitlåda med frysta kylklampar och skickades till avdelningen för Immunologi och Mikrobiologi vid Sahlgrenska Akademin. Denna transport tog 4 dygn. På laboratoriet vid Sahlgrenska Akademin gjordes analyser för att detektera förekomst av HBs antigen och antikroppar mot H. pylori. För analys av HBs antigen i serum användes MonolisaTM HBs Ag ULTRA från BioRad som utfördes enligt medföljande protokoll. För detektion av IgA antikroppar mot H. pylori användes ELISA. Coating gjordes med membranprotein från H. pylori stam Hel305. För att blocka användes 0,1 % BSA (Bovine Serum Albumin) från Sigma. Som sekundär antikropp användes en kaninantikropp mot humant IgA konjugerad till HRP (Horse radish peroxidase) från Jackson Laboratories. Framkallning skedde med H202 – TMB (tetramethylbenzidine). Vid absorbansmätning användes Biotek ELx-800 spektrofotometer, 450 nm. 3.2 Etiska överväganden Min pilotstudie är godkänd av regionala etikprövningsnämnden i Göteborg, nummer T290-14. Den ingår i professor Samuel Lundins forskargrupps arbeten i Nicaragua. Studiedeltagarna fick information angående studien och gav skriftlig medgivande att de ville medverka. De kunde när som helst avbryta sitt deltagande. 3.2 Material Blod togs från 68 stycken volontära personer som befann sig på mottagningsavdelningen på sjukhuset Hospital Jacinto Hernandez i Nueva Guinea den 28e april 2014. Staden 11 Nueva Guinea ligger i distriktet Chontales som är beläget ca 300 km sydost om huvudstaden Managua i Nicaragua. Nueva Guinea är en mindre stad på landsbygden som tros vara ett högriskområde för ventrikelcancer. Enda exklusionskriteriet var att studiedeltagarna ej fick ha diagnostiserad ventrikelcancer. Av den 68-personer stora populationen var 83 % kvinnor respektive 17 % män (figur 1). Åldersfördelningen var 15 – 72 år (figur 2). Könsfördelning 60 50 Antal 40 30 20 10 0 Kvinnor Män Figur 1: Visar antal kvinnor respektive män som deltog i studien. Den totala studiepopulationen var 68 individer. Åldersfördelning Antal 25 20 15 10 5 0 10 -20 21-30 31-40 41-50 51-60 61-70 71-80 år år år år år år år Figur 2: Visar antal studiedeltagare ( män och kvinnor) som ingick i varje åldersgrupp. 4. RESULTAT 88 % var IgA-positiva för H. pylori, varav 36 % var svagt positiva (figur 3 ). Utifrån frågeformulären svarade 6 % av de som medverkade i studien att de tidigare blivit 12 Kommentar [KT1]: Diskuterade du hur med Samuel om hur du skulle göra här? Detekterbara antikroppar kan man ju säga att alla had (de var ju mer än bakgrund) men det är ju bara de som ligger i samma nivå som de positiva kontrollerna som ska räknas som positiva. Fick du svar från Samuel om man skulle göra när vi bara hade en positiv kontroll? diagnostiserade med H. pylori, medan 9 % av alla deltagare angav att de fått antibiotikabehandling för bakterien. För de som tidigare fått behandling var alla utom en individ re-infekterad med H. pylori. Helicobacter pylori 100 90 80 88 % 70 60 50 40 30 20 10 0 positiv 2% negativ Figur 3: Visar i procent andel av den totala studiepopulationen som var IgA-positiva för H.pylori (blå stapel) respektive negativa för H.pylori (röd stapel) En av 68 studiedeltagare var en individ positiv för HBs (drygt 1 % ). Resultatet för ABO och Rhesus faktor D i studiepopulationen var att 56 % var 0 positiva, 21 % A positiva, 7 % B positiva respektive 0 negativa. För fullständigt resultatet gällande blodgrupp se figur 4. 13 ABO och Rh 07% AB0% AB+ 2% A+ 21% A4% B+ 7% 0+ 56% B3% Figur 4: Visar i procent vilken blodgrupp studiedeltagarna tillhörde (Med blodgrupp menas ABO.tillhörighet samt Rhesus faktor D positiv/negativ ) 4.2 Socioekonomi och sjukdomshistorik Av studiematerialet bodde majoriteten i hushåll med två, tre eller fyra personer. 3,6 % av studiedelatagarna var rökare. 27, 9 % hade jordgolv i sin bostad. 67,6 % hade toalett i bostaden, 82,4 % hade elektricitet, 80,9 % hade tillgång till rent vatten i sitt hem och 36,2 % åt frukt och grönsaker dagligen. Studerade resultat gällande livsstil- och socioekonomiska faktorer visas i figur 5. För de individer som var negativa för H. pylori hade samtliga svarande rent vatten och elektricitet i bostaden, ingen hade jordgolv (figur 6). Levnadsförhållanden för hela studiepopulationen 14 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Ej svarat Nej Ja Figur 5: Visar i procent hur levnadsförhållandena såg ut hos samtliga studiedeltagare. Blå stapel visar att studiedeltagaren svarat ja, röd stapel för nej samt grön stapel för inget svar. Levnadsförhållanden för H. Pylori-negativa 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Ej svarat Nej Ja Figur 6: Visar i procent hur levnadsförhållandena såg ut för de individer i studiepopulationen som var Iganegativa för H.pylori. Blå stapel visar att studiedeltagaren svarat ja, röd stapel för nej samt grön stapel för inget svar. 15 21 % av deltagarna hade någon i familjen som led av- eller hade avlidit till följd av cancersjukdom. 4 stycken av studiedeltagarna (6 %) hade en familjemedlem som var diagnostiserad med ventrikelcancer. 76 % svarade att de hade dyspepsi. 16 5. DISKUSSION Studiepopulationen bestod av 68 stycken individer som befann sig på mottagningsavdelningen på Hospital Jacinto Hernandez i Nueva Guinea. Drygt 80 % av studiedeltagarna var kvinnor. Den yngsta studiedeltagaren var 15 år och den äldsta 72 år. Åldersfördelningen var inte representativ, majoriteten var 21-30 år. Den ojämna köns- och åldersfördelningen samt att studiedeltagarna rekryterades på en sjukhusmottagning gör att det inte helt representerar ett genomsnitt av befolkningen i Nueva Guinea. 88 % av studiepopulationen var positiva för H. pylori. Det visar att vår studiepopulation var infekterade i något högre grad än genomsnittet av den Nicaraguanska befolkningen (35). Det skulle kunna bero på att proverna samlades in hos människor som bor på landsbygden. Många av dem delade bostad med ett flertal personer vilket ger en ökad incidens av H .pylori. Dessutom levde ett antal av studiedeltagarna i bostäder med jordgolv utan rent vatten, kylskåp och elektricitet vilket underlättar smittspridning. Endast en minoritet åt frukt och grönsaker dagligen vilket är en skyddsfaktor (35). Anmärkningsvärt är att bland de 8 individer som var negativa för H. pylori hade samtliga rent vatten, elektricitet och saknade jordgolv i bostaden. Dessa faktorer skulle kunna tyda på att den negativa populationen levde med en något högre levnadsstandard. Forskning har under lång tid visat på tydlig korrelation mellan levnadsförhållanden och H. pylori-smitta (4,13,35), vilket stämmer väl överens med våra resultat . Bland de 8 personer som var negativa var det dock 2-3 av dem som ej hade svarat på frågorna gällande levnadsstandard. Det gör att den negativa populationen blev ytterligare mindre i sin storlek och minskar resultatets styrka. 9 % angav att de tidigare fått behandling för H. pylori. Alla utom en av dessa individer var åter igen positiva för H.pylori vid den tidpunkt då vi samlade in blodproverna. Den höga andelen re-infekterade beror troligen på ständig kontakt med andra smittade, trångboddhet och kontaminerat vatten och föda. Endast en av de 68 individerna som ingick i studien visade positivt serologi för Hbs. En tidigare studie som gjordes i provinsen León i Nicaragua visade prevalensen 6 % (36). Hepatit B finns troligen i relativt liten utsträckning i Nicaragua. Det krävs dock mer forskning med en större studiepopulation för att få en prevalens som bättre speglar nicaraguaner som bor på landsbygden. 17 Vår analys visade att 56 % tillhörde blodgrupp 0 positiv och den näst största blodgruppstillhörigheten var A positiv. A positiv har i majoriteten av utförda studier visat på högst korrelation med utveckling av ventrikelcancer (28,29). En studie som jag har tagit del av visade dock att vissa stammar av H. pylori binder med högst affinitet till 0 positiva epitelceller(31). Vårt höga resultat av andel smittade med H. pylori skulle kunna innebära att många bär på just stammar som dessa i Nicaragua. Under vårt analysarbete definierades dock inte olika stammar av H. pylori eftersom det kräver gastroskopisk undersökning. Som tidigare nämnt har studier visat på att individer med blodgrupp 0 har högre risk att utveckla peptiska ulcerationer (29). Ett symptom på peptiska ulcerartioner kan vara dyspepsi som 76 % av studiepopulationen angav att de hade. Begreppet dyspepsi är dock svårtolkat och borde ha definierats bättre i frågeformuläret. Att avgöra vilka som var negativa respektive positiva för Rh var ibland problematiskt. Koagulationsgraden med vår testmetod var i vissa fall svårtolkad. Dessutom var vi två olika testledare som läste av testet. Vi var även två testledare som avgjorde ABOtillhörighet. Att tolka ABO-tillhörighet var lättare då denna testmetod inte hade några mellanlägen i koagulationsgrad. För att hålla optimal temperatur under transporten mellan Managua och Göteborg skulle serumrören transporteras med koldioxidis (torris). Då transportbolaget i Nicaragua inte hade möjlighet att hantera koldioxidis, transporterades serumrören i något högre temperatur än de skulle. Detta kan möjligen ha påverkat våra resultat. Vi ställde frågor till studiedeltagarna om någon i deras familj har/hade ventrikelcancer eller någon annan form av cancer. Då Nicaragua är ett land som varken har resurser eller möjlighet att diagnosticera eller obducera patienter i lika stor utsträckning som vi har i Sverige är mörkertalet för cancer troligen stort. Dessutom berättade nicaraguanska läkare för oss att det inte finns något fungerande journalsystem eller cancerregister där sjukdomar registreras i landet. Studiedeltagarna har utifrån sin egen vetskap och förmåga försökt att besvara denna fråga. Det är därmed svårt för oss att värdera hur utbredd ventrikelcancer är i Nueva Guinea med omnejd. Frågeformuläret innehöll exklusionsfrågor såsom dyspepsi och symptom från magsäcken. Vi valde att ej ta hänsyn till dessa exklusionskriterier då det visade sig att majoriteten av 18 studiedeltagarna angav att de hade dyspepsi. Vi ansåg därmed att det tidsmässigt och praktiskt inte var möjligt att exkludera dessa från studien. 6. KONKLUSION Att hitta individer med ventrikelcancer i ett tidigt skede genom att finna viktiga riskfaktorer och cancerkopplade markörer skulle reducera den höga mortaliteten. H. pylori är det främsta kända carcinogenet för ventrikelcancer. Vår studie visar att prevalensen av H. pylori är mycket hög i Nicaragua vilket kan vara en bidragande orsak till den höga 19 incidensen av ventrikelcancer i landet. Dessutom visar vårt resultat att H. pylori troligen är något högre bland befolkning på landsbygden än det statistiska genomsnittet i Nicaragua. Det kan vara en av anledningarna till att människor som lever på landsbygden i något högre utsträckning drabbas av ventrikelcancer. I studien hade de individer som inte var smittade med H .pylori rent vatten och elektricitet i sin bostad. Detta resultat stämmer väl överens med tidigare forskning som gjorts på korrelation mellan låg socioekonomi och högre prevalens av H. pylori. 76 % av studiedeltagarna angav att de hade dyspepsi vilket är ett symptom vid gastrit, som kan ha orsakats av H.pylori-infektion. Drygt 1 % var positiva för HBs vilket visar att prevalensen av hepatit B i området troligen är låg. Dess koppling till ventrikelcancer är osäker. Drygt hälften av studiedeltagana hade 0 positiv blodgrupp. Blodgrupp A positiv var den näst största gruppen. Båda dessa blodgrupper har kopplats till högre incidens av ventrikelcancer men mer forskning behövs för att säkerställa sambandet. 7. FÖRFATTARENS TACK Jag vill tacka Dr Paolo Moreno, Dr Erick Fonseca och Dr Reyna Palacios för ett bra samarbete, enorm gästvänlighet och ett stort kunskapsutbyte under vår tid i Nicaragua. Jag vill också tacka min handledare Kaisa Thorell, doktorand vid Göteborgs Universitet, och Professor Samuel Lundin vid Göteborgs Universitet för god handledning och engagemang. Till sist vill jag tacka våra sponsorer; Karl Erik Levins stiftelse, Olai Petri församling i Örebro samt Equmeniakyrkan och Rotary i Anderstorp som gjorde det ekonomiskt möjligt att genomföra resan till Nicaragua. 8. REFERENSER (1) GLOBOCAN Cancer Fact Sheets: stomach Cancers. Available at: http://globocan.iarc.fr/old/FactSheets/cancers/stomach-new.asp. Accessed 5/16/2014, 2014. (2) Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005 Mar-Apr;55(2):74-108. 20 (3) Cheng L, Tan L, Zhang L, Wei S, Liu L, Long L, et al. Chronic disease mortality in rural and urban residents in Hubei Province, China, 2008-2010. BMC Public Health 2013 Aug 2;13:713-2458-13-713. (4) Konturek PC, Konturek SJ, Brzozowski T. Helicobacter pylori infection in gastric cancerogenesis. J Physiol Pharmacol 2009 Sep;60(3):3-21. (5) MD Anderson Manual of Medical Oncology - Hagop M. Kantarjian,Robert A. Wolff,Charles A. Koller - McGraw-Hill Education. Available at: http://www.mcgraw-hill.co.uk/html/0071701060.html. Accessed 4/23/2014, 2014. (6) Lochhead P, M El-Omar E. Helicobacter pylori infection and gastric cancer. 2007;21(2). (7) Lazar D. Gastric Carcinoma- New Insights into Current Management. 2013. (8) Longo DL, Fauci AS, Dennis L. Kasper, Hauser SL, Loscalzo J. Harrison's Principles of Internal Medicine, 18th Edition. : McGraw-Hill Professional. (9) Stomach cancer Risk factors - Diseases and Conditions - Mayo Clinic. Available at: http://www.mayoclinic.org/diseases-conditions/stomach-cancer/basics/riskfactors/con-20038197. Accessed 5/16/2014, 2014. (10) Athmann C, Zeng N, Kang T, Marcus EA, Scott DR, Rektorschek M, et al. Local pH elevation mediated by the intrabacterial urease of Helicobacter pylori cocultured with gastric cells. J Clin Invest 2000 Aug;106(3):339-347. (11) Schreiber S, Bucker R, Groll C, Azevedo-Vethacke M, Garten D, Scheid P, et al. Rapid loss of motility of Helicobacter pylori in the gastric lumen in vivo. Infect Immun 2005 Mar;73(3):1584-1589. (12) Park SH, Kangwan N, Park JM, Kim EH, Hahm KB. Non-microbial approach for Helicobacter pylori as faster track to prevent gastric cancer than simple eradication. World J Gastroenterol 2013 Dec 21;19(47):8986-8995. (13) Mascellino MT, Margani M, Oliva A. Helicobacter pylori: determinant and markers of virulence. Dis Markers 2009;27(3):137-156. (14) ANDO T, MINAMI M, ISHIGURO K, MAEDA O, WATANABE O, MIZUNO T, et al. Changes in biochemical parameters related to atherosclerosis after Helicobacter pylori eradication. Aliment Pharmacol Ther 2007;24:58 <last_page> 64. (15) Correa P. Human gastric carcinogenesis: a multistep and multifactorial process-First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992 Dec 15;52(24):6735-6740. (16) Wen S, Moss SF. Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett 2009 Sep 8;282(1):1-8. (17) Backert S, Clyne M. Pathogenesis of Helicobacter pylori infection. Helicobacter 2011 Sep;16 Suppl 1:19-25. 21 (18) Mizushima T, Sugiyama T, Komatsu Y, Ishizuka J, Kato M, Asaka M. Clinical relevance of the babA2 genotype of Helicobacter pylori in Japanese clinical isolates. J Clin Microbiol 2001 Jul;39(7):2463-2465. (19) Atherton JC, Peek RM,Jr, Tham KT, Cover TL, Blaser MJ. Clinical and pathological importance of heterogeneity in vacA, the vacuolating cytotoxin gene of Helicobacter pylori. Gastroenterology 1997 Jan;112(1):92-99. (20) Cover TL, Blanke SR. Helicobacter pylori VacA, a paradigm for toxin multifunctionality. Nat Rev Microbiol 2005 Apr;3(4):320-332. (21) Wen S, Moss SF. Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett 2009 Sep 8;282(1):1-8. (22) Sundrud MS, Torres VJ, Unutmaz D, Cover TL. Inhibition of primary human T cell proliferation by Helicobacter pylori vacuolating toxin (VacA) is independent of VacA effects on IL-2 secretion. Proc Natl Acad Sci U S A 2004 May 18;101(20):7727-7732. (23) Ilver D, Arnqvist A, Ogren J, Frick IM, Kersulyte D, Incecik ET, et al. Helicobacter pylori adhesin binding fucosylated histo-blood group antigens revealed by retagging. Science 1998 Jan 16;279(5349):373-377. (24) Arauz-Ruiz P, Norder H, Robertson BH, Magnius LO. Genotype H: a new Amerindian genotype of hepatitis B virus revealed in Central America. J Gen Virol 2002 Aug;83(Pt 8):2059-2073. (25) WHO | Hepatitis B. Available at: http://www.who.int/mediacentre/factsheets/fs204/en/. Accessed 5/20/2014, 2014. (26) Sunbul M. Hepatitis B virus genotypes: Global distribution and clinical importance. World J Gastroenterol 2014 May 14;20(18):5427-5434. (27) Ghasemi M, Vahedi Larijani L, Abediankenari S. Investigation of Relationship between Hepatitis B Virus and Gastric Adenocarcinoma. Iran Red Crescent Med J 2012 Jul;14(7):453-454. (28) Wang Z, Liu L, Ji J, Zhang J, Yan M, Zhang J, et al. ABO Blood Group System and Gastric Cancer: A Case-Control Study and Meta-Analysis. Int J Mol Sci 2012 Oct 17;13(10):13308-13321. (29) Edgren G, Hjalgrim H, Rostgaard K, Norda R, Wikman A, Melbye M, et al. Risk of gastric cancer and peptic ulcers in relation to ABO blood type: a cohort study. Am J Epidemiol 2010 Dec 1;172(11):1280-1285. (30) Henderson J, Seagroatt V, Goldacre M. Ovarian cancer and ABO blood groups. J Epidemiol Community Health 1993 Aug;47(4):287-289. (31) Iodice S, Maisonneuve P, Botteri E, Sandri MT, Lowenfels AB. ABO blood group and cancer. Eur J Cancer 2010 Dec;46(18):3345-3350. 22 (32) de Martel C, Ferlay J, Franceschi S, Vignat J, Bray F, Forman D, et al. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis. The Lancet Oncology 2012;13(6):607 <last_page> 615. (33) Bornschein J, Kandulski A, Selgrad M, Malfertheiner P. From gastric inflammation to gastric cancer. Dig Dis 2010;28(4-5):609-614. (34) Berrios R, Gonzalez A, Cruz JR. Achieving self-sufficiency of red blood cells based on universal voluntary blood donation in Latin America. The case of Nicaragua. Transfus Apher Sci 2013 Dec;49(3):387-396. (35) Porras C, Nodora J, Sexton R, Ferreccio C, Jimenez S, Dominguez RL, et al. Epidemiology of Helicobacter pylori infection in six Latin American countries (SWOG Trial S0701). Cancer Causes Control 2013 Feb;24(2):209-215. (36) Perez OM, Morales W, Paniagua M, Strannegard O. Prevalence of antibodies to hepatitis A, B, C, and E viruses in a healthy population in Leon, Nicaragua. Am J Trop Med Hyg 1996 Jul;55(1):17-21. Bilaga 1: Frågeformulär Studien kommer att undersöka riskfaktorer för utveckling av magsäckscancer. Följande personliga uppgifter kommer endast att användas till studien. Tilltalsnamn Andra namn Förnamn 23 Efternamn från fader Efternamn från moder Efternamn Kön Födelseort Födelsedatum Yrke: ___________________________________________________________ Bostadsort:______________________________________________________ Antal medlemmar i familjen:________________________________________ Har du någonsin blivit diagnostiserad med Helicobacter pylori? Ja / Nej Har du fått behandling för Helicobacter pylori? Ja / Nej Har du- eller har du haft dyspepsi? Ja / Nej Är- eller har du varit rökare? Ja / Nej Antal år som rökare: ______________________________________________ Har- eller har du/någon i din familj haft någon cancersjukdom? Vilken typ av cancersjukd________________________________________________ 24 Antal personer/rum i din bostad :_______________________ Tack så mycket för din medverkan! Levnadsstandard Ja Nej Jordgolv Glasfönster Ej förslutbara öppningar/hål i väggen Elektrisk spis Skorsten Dagligt intag av frukt och grönsaker Diskbänk Toalett Rent vatten Elektricitet Kylskåp Studien Bilaga 2: Samtycke för studiedeltagare till studien gällande riskfaktorer för magsäckscancer Introduktion: - För att delta i studien krävs att du inte har någon sjukdom kopplad till magsäcken. Inte heller några tecken på sjukdom eller symptom från magsäcken. 25 - Om du deltar i studien kommer en medicinstudent att ta ett blodprov på dig a´20 ml. - Provet tar ca 10 minuter. Direkt efter provtagningen kan du fortsätta med din dag som planerat utan några restriktioner. Studiens syfte Befolkningen i Nicaragua har stora problem med sjukdomar som är kopplade till magsäcken. En bakomliggande orsak till detta är den stora mängden nicaraguaner som är infekterade med bakterien Helicbacter pylori. Helicobacter pylori orsakar lokal inflammation i magsäcken och 2-3 % av de som är infekterade av bakterien drabbas av magsäckscancer. Människor som bor i de centrala delarna av Nicaragua är värst drabbade av magsäckscancer. Studiens syfte är att undersöka vilka riskfaktorer som spelar roll i utvecklingen av magsäckscancer. Följande riskfaktorer kommer att analyseras i blod; H. Pylori, hepatit B, blodgruppstillhörighet och ett mögeltoxin vid namn aflatoxin. För att kunna genomföra studien på ett korrekt vis krävs att både blod från friska individer respektive blod från individer med magsäckscancer analyseras. Deltagandet i studien är frivilligt Om du beslutar dig för att inte deltaga i studien kommer varken din relation till ditt sjukhus/vårdcentral eller din relation till din läkare att påverkas. Om du beslutar dig för att deltaga i studien kommer du att få ett antal frågor om ditt nuvarande, samt tidigare hälsotillstånd, din familjs hälsotillstånd samt frågor gällande dina bostadsförhållanden. All din personliga information kommer att behandlas konfidentiellt och kommer endast att vara tillgängliga för de personer som arbetar med studien. Blodet som vi tar från dig kommer att frysas in i form av serum. Serum är resultatet som uppstår då man låtit blod koagulera och sedan avlägsnar blodkroppar och koagulationsproteiner från det. Det frysta serumet kommer sedan att skickas till ett laboratorium vid Göteborgs Universitet i Sverige för vidare analys. Studiedeltagarens nummer __________ Ditt medverkande är helt frivilligt och du kan ändra ditt beslut när som helst under studien. Om du beslutar dig för att inte vara med i studien har du alltid rätt att be om att alla dina prover samt all insamlad infromation om dig destrueras. 26 Jag ____________________________________ vill delta i studien gällande riskfaktorer för utveckling av magsäckscancer i Nicaragua. Jag är införstådd med att mitt deltagande innebär att jag både ska svara på ett frågeformulär samt att ta ett blodprov. Jag är också införstådd med att jag när som helst under studien kan välja att avbryta och få informationen om mig, samt mina biologiska prover destruerade. Om jag väljer att avbryta kommer varken min personliga vård på sjukhus/vårdcentral eller min relation till min läkare att påverkas. Underskrift ____________________________ Datum __________________________ En underskriven kopia behålls av studieansvarig. Den andra kopian behålls av studiedeltagaren själv. Tack för din medverkan! Om du behöver komma i kontakt med personer som är ansvariga för studien, kontakta Kaisa Thorell, Göteborgs Universitet, Svreige. Telefon: 0046 31 786 62 33 27