Amplified IDEIA Hp StAR - Thermo Fisher Scientific
advertisement

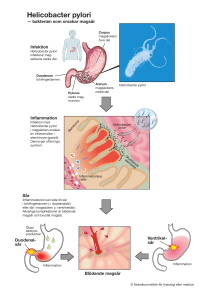
4. DEFINITIONER Följande symboler produktinformationen. Europe + 800 135 79 135 CA 1 855 805 8539 + – CONTROL Key Code TSMX9398 www.oxoid.com/ifu CONTROL US 1 855 236 0910 ROW +31 20 794 7071 har använts genomgående i Positiv kontroll Negativ kontroll Katalognummer Amplified IDEIA Hp StAR Medicinsk utrustning för diagnostik in vitro Se bruksanvisning Temperaturbegränsning K663011-2������������������������������������96 Utsätt inte för direkt sol l jus SV 1. AVSEDD ANVÄNDNING Amplified IDEIA Hp StAR enzymimmunoanalys (EIA) är ett kvalitativt in vitro test för påvisande av Helicobacter pylori antigen i humant faecesprov. Testresultaten syftar till att stödja diagnosen H. pylori hos vuxna och barn samt att kontrollera att en behandling lyckats. 2. SAMMANFATTNING År 1984 beskrev Marshall och Warren förekomsten av en campylobacter-liknande organism i antrum- och corpusslemhinnan hos patienter med histologiskt fastställd gastrit och peptiska duodenalsår 1. I våra dagar är det allmänt bekant att H. pylori är en av de viktigaste orsakerna till uppkomst av gastrointestinala sjukdomar2. Infektioner orsakade av H. pylori leder till inflammationer, som kan öka benägenheten för kronisk gastrit, sår i magsäck och tolvfingertarm samt magkarcinom3, 4. Detta bekräftas ofta genom att gastrit och sår mestadels läks ut efter eradikeringsbehandling. H. pylori har utvecklat olika skyddsmekanismer för att överleva i sur, baktericid magmiljö. Enzymet ureas spjälkar urinämne till ammoniak och koldioxid, härvid neutraliseras magsyran. Produktion av katalas och superoxiddismutas skyddar bakterien mot angrepp av neutrofiler i magens slemhinna3. Många H. pylori positiva patienter utvecklar en gastrit och ca. 10% av patienterna får magsår. 90% av patienter med tunntarms- resp. magsår är oavsett ålder H. pylori positiva. Orsakerna till dessa fenomen och bakteriens smittväg är föremål för forskning över hela världen5. Man har två huvudsakliga metoder att tillgå för att diagnostisera H. pylori infektion: direkt påvisande av organismen respektive indirekt bestämning genom påvisande av antikroppar, som patienter bildat mot H. pylori 1, 6, 7. Till de direkta men invasiva metoderna att upptäcka en infektion räknas ureas-snabbtest, histologi eller odling av organismen från biopsi-material 8. Odling av H. pylori med hjälp av biopsi-material är komplicerad och tidskrävande. De tekniska svårigheterna kan leda till falskt negativa resultat, och därför nedsatt sensitivitet. Dessutom visar H. pylori benägenhet att bilda kolonier i magslemhinnan i form av öar och kan därför förbises vid endoskopi 9. Andningstest är ytterligare en direkt metod att undersöka förekomst av H. pylori. Testet går ut på att påvisa koldioxid, som bildats av det bakteriella enzymet ureas. Andningstestet har hög sensitivitet och specificitet, men kräver speciella mätinstrument och patienterna måste inta isotopmarkerat urinämne 8, 10. En ofta tillämpad metod är att göra serologisk bestämning av H. pylori-specifika antikroppar. Detta är en indirekt påvisningsmetod, med vilken man kan upptäcka antikroppar som patienter har bildat mot H. pylori10. Sensitivitet och specificitet varierar i hög grad mellan testerna från olika tillverkare. Dessutom ger serologiska undersökningsmetoder inte tillfredsställande resultat när det gäller att kontrollera om en eradikeringsbehandling varit effektiv, eftersom antikroppstitern sjunker långsamt under flera månader. Amplified IDEIA Hp StAR är en enzymimmunoassay (EIA) i mikrotiterplatt-format för direkt, icke-invasivt påvisande av H. pylori-antigen i human faeces. Genom direkt påvisning av antigen hjälper testet både till att ställa en första diagnos och att kontrollera om en behandling lyckats. Detta kan konstateras 4 till 6 veckor efter avslutad eradikeringsbehandling eller för att konstatera att en ny infektion uppstått. 3. TESTPRINCIP Amplified IDEIA Hp StAR är en enzymimmunoanalys där en så kallad sandwichtyp förstärkningsteknik tillämpas för bestämning av H. pylori antigen i faecesprov. Mikrotiterplattans brunnar är belagda med monoklonala antikroppar mot H. pylori antigen. Supernatant av en faecessuspension och väteperoxidas-markerade monoklonala antikroppar (enzymkonjugat) pipetteras i brunnarna. Under inkubationen binds närvarande H. pylori antigen ur faecessuspensionen både till antikropparna på testplattan och till de väteperoxidaskonjugerade antikropparna och bildar ett ‘sandwich-komplex’. Enzymkonjugat som inte bundits tvättas bort från testplattan. Därefter pipetteras ett färglöst enkomponentssubstrat (tetrametylbensidin-TMB) i brunnarna. Bunden väteperoxidas oxiderar substratet till en blåfärgad produkt. Vid tillsats av stopplösning skiftar färgen om till gult. Färgens intensitet avläses med spektrofotometer. Schematiskt diagram av analysprincipen för Amplified IDEIA Hp StAR N Innehåller tillräckligt för 'N' prov Lotnummer Använd före Tillverkare 5. MEDFÖLJANDE REAGENSER 96 – Varje sats innehåller tillräckligt mycket material för - Satsens hållbarhet står på etiketten på 96 bestämningar. ytterförpackningen. 5.1. INNEHÅLL I AMPLIFIED IDEIA Hp StAR En bruksanvisning. 1 X Täckfolie för mikrotiterstrips 100 X Provtagningsstickor (trästickor) En mikrotiterplatta med 96 brunnar med tolv avbrytbara strips om 8 mikrobrunnar belagda med H. pylori specifik monoklonal antigen. En förseglingsbar foliepåse för förvaring av oanvända mikrobrunnar. En flaska av var och en av följande, om inget annat anges: 55mL provspädningsbuffert: 75mM fosfatbuffertlösning, pH 7,4 med antimikrobiella tillsatser 2mL positiv kontroll: inaktiverat, fraktionerat H. pylori lysat i 75mM fosfatbuffert, pH 7,4, med antimikrobiella tillsatser, rödfärgad lösning 2mL Negativ kontroll: 75mM fosfatbuffert, pH 7,4 med antimikrobiella tillsatser, blåfärgad lösning 7mL antikroppskonjugat: monoklonala antikroppar specifika för H. pylori antigen, pepparrotsperoxidas-konjugerade i 75mM fosfatbuffert, pH 7,4 med antimikrobiella tillsatser, grönfärgad lösning 100mL tvättbuffertkoncentrat (x10): 250mM fosfatbuffert, pH 7,4 med detergent och antimikrobiella tillsatser 12mL substrat: Vattenhaltig lösning med TMB och väteperoxid 5.2. 12mL stopplösning: 0,5mol/L svavelsyra. FÖRBEREDELSE, FÖRVARING OCH ÅTERANVÄNDNING AV SATSENS INNEHÅLL Alla oanvända komponenter i satsen bör förvaras i enlighet med nedanstående instruktioner för att säkerställa optimal prestanda. 5.2.1 Antikroppsbelagda mikrobrunnar Öppna förpackningen med plattorna genom att klippa längs förseglingen. Bryt av det antal mikrobrunnar som krävs och placera dem i ramen. Lägg tillbaka alla oanvända mikrobrunnar och strips i den förseglingsbara foliepåsen med torkmedel. Försegla foliepåsen noggrant och förvara vid 28°C. 5.2.2 Provspädningsbuffert Klar för användning. Förvara oanvänd provspädningsbuffert vid 28°C. 5.2.3 Positiv kontroll Klar för användning. Förvara oanvänd positiv kontroll vid 28°C. 5.2.4 Negativ kontroll Klar för användning. Förvara oanvänd negativ kontroll vid 28°C. 5.2.5 Konjugat Klar för användning. Förvara oanvänt konjugat vid 28°C. 5.2.6 Tvättbuffertkoncentrat Levereras som x10 koncentrat. Förbered bruksfärdig tvättbuffert genom att tillsätta 1 del tvättbuffertkoncentrat till 9 delar färskt avjoniserat eller destillerat vatten. Den bruksfärdiga tvättbufferten håller sig i tre månader vid en lagringstemperatur på 2 till 8°C i stängd flaska. I tvättbuffertkoncentratet kan ett obetydligt Substrate Substrat precipitat förekomma. Låt tvättbuffertkoncentratet värmas upp Colour Färg till rumstemperatur före användningen och skaka det lätt tills Solid precipitatet löses upp. Förvara oanvänt koncentrat vid 2-8∞C. phase Extra tvättbuffertkoncentrat, produktkod S6126, finns hos din lokala Oxoid-filial eller distributör. 5.2.7 Plate Substrat coating Klar för användning. Förvara oanvänt substrat Substrat Färg Colour Substrate antibody vid 28°C, skydda mot ljus. 5.2.8 H. pylori Stopplösning Substrate Colour Substrate Colour Klar förantigen användning. Förvara oanvänd stopplösning vid 2-8∞C. Solid Solid phase på Polymer Based onBaserad label amplification 6. YTTERLIGARE REAGENSER märkningsamplifiering phase Substrate Plate 6.1. molecule REAGENSER Colour coating Solid Substrate Colour Plate Substrate Colour antibody Colour Färg Färskt HRP avjoniserat eller destillerat vatten för beredning av phase coating H. pylori Solid Colour Substrate Substrate Substrat antibody bruksfärdig tvättbuffert. antigen phase Plate Substrate Colour Polymer H. pylori Based on label amplification 7. Conjugated UTRUSTNING coating molecule antigen Solid Colour Substrate antibody Plate phase Colour Följande utrustning krävs: Polymer Based on labelcoating amplification HRP H. pylori Substrate molecule Colour Substrate Colour antibody antigen Provrör. Plate antibody Conjugated Solid Colour Polymer coating Based on label amplification H. pylori HRP phase Colour Substrate Vortexblandare. molecule Substrate antibody antibody antigen Colour H. pylori Conjugated Destillerat eller avjoniserat vatten. Solid fas Substrate Platt- täckande H. pylori PolymerPolymer- HRP HRP Konjugerad Based on label amplification Plate antigen coating antikropp antigen moleculemolekyl antikropp Polymer d on label amplification Colour Rent absorberande papper (på vilket mikrobrunnarna kan knackas antibody Conjugated antibody Colour molecule HRP H. pylori torra). bstrateColour antibody HRP antigen Precisionsmikropipetter och engångsspetsar för tillsättning av Conjugated Polymer on Conjugated molecule volymerna 50µL, 100µL och 500µL (valfritt). antibody HRP antibody Centrifug (minst 5000 rpm). Conjugated Mikrotitreringsplattskak med en minimihastighet på 500rpm antibody med en orbitaldiameter på 1-3 mm. För information om olika plattskakars lämplighet kontakta det lokala Oxoid bolaget eller distributören. Automatiska plattvättar (tillval) eller lämplig utrustning för tvättning av strippar med 8 mikrobrunnar (se avsnitt 10.4.4). > > > > > > > Obs! Vid tvättning av färre än 8 testmikrobrunnar i en stripp med en automatisk tvätt med huvud för 8 mikrobrunnar, är det viktigt att helt fylla strippen med blanka mikrobrunnar. Spektrofotometer eller EIA-plattläsare som kan läsa av en platta med 96 mikrobrunnar i strips om 8 mikrobrunnar vid en absorbans på 450nm med en referens på 620-650nm. (avsnitt 10.3, Avläsning av testresultat.) Tillämpningsanvisningar för användning på öppna, automatiska system finns för denna analys. Kontakta Oxoid lokala dotterbolag eller distributör. 8. FÖRSIKTIGHETSÅTGÄRDER - För in vitro-diagnostik. Den som utför en analys med denna produkt måste vara utbildad i dess användning och ha erfarenhet av laboratorieprocedurer. 8.1. SÄKERHETSÅTGÄRDER 8.1.1 Stopplösningen innehåller svavelsyra (0,5mol/L). Undvik kontakt med hud och ögon genom att bära skyddskläder och skyddsglasögon. 8.1.2 Reagenserna i detta testkit innehåller antimikrobiella ämnen och substratlösningen innehåller tetrametylbenzidin. Undvik kontakt med hud eller slemhinnor/ögon. Vid kontakt skölj omedelbart med rikligt med vatten. 8.1.3 Du bör inte äta, dricka, röka, förvara eller laga mat eller sminka dig inom arbetsområdet. 8.1.4 Pipettera inte material med munnen. 8.1.5 Använd engångshandskar vid hanteringen av kliniska prov och reagenser. Tvätta alltid händerna när du har arbetat med smittsamma ämnen. 8.1.6 Kasta alla kliniska prov i enlighet med lokal lagstiftning. 8.1.7 Ett datablad om säkerhet finns för professionella användare. 8.2. TEKNISKA FÖRSIKTIGHETSÅTGÄRDER 8.2.1 Komponenter får inte användas efter det Använd föredatum som står på etiketterna. Blanda/Byt inte ut olika reagenssatser mot varandra. 8.2.2 Frys INTE kitkomponenterna. 8.2.3 Reagenserna tillhandahålls med fasta arbetskoncentrationer. Testprestanda påverkas om reagenser modifieras eller förvaras under andra förhållanden än de som anges i avsnitt 5.2. 8.2.4 Kontrollerna är avsedda att pröva om reagensernas tillförlitlighet försämrats. Den positiva kontrollen säkerställer inte exakt resultat i närheten av cut-off. 8.2.5 Granska kitkomponenterna med avseende på kontamination, försämring eller otäthet. Blåfärgad substratlösning får inte längre användas. 8.2.6 Visar den negativa kontrollen absorbansvärden > 0,10 (450/620-650nm), or > 0,14 (450nm), kan detta tyda på otillräcklig tvättning. Då rekommenderas att upprepa testet med grundligare tvättning. 8.2.7 Undvik kontaminering av reagenser. 8.2.8 Använd olika engångspipetter eller pipettspetsar för varje prov, kontroll eller reagens för att undvika korskontaminering av proven, kontrollerna eller reagenserna, vilket kan leda till felaktiga resultat. 8.2.9 Förvara avjoniserat eller destillerat vatten för spädning av koncentrerad reagens i rena behållare för att förhindra mikrobiell kontaminering. 8.2.10 Undvik kontaminering med metalljoner och oxiderande ämnen. 8.2.11 Skydda substratet mot ljus. 8.2.12 Använd inte substrat som har en blå färg innan det tillsätts mikrobrunnarna. 8.2.13 Mikrobrunnar kan inte återanvändas. 8.2.14 Manuell eller automatisk tvättutrustning måste vara fri från mikrobiell kontaminering, rätt kalibrerad och underhållen enligt tillverkarens instruktioner. 9. PROVTAGNING OCH FÖRBEREDELSE AV AVFÖRINGSPROV 9.1. PROVTAGNING Testet utförs med färskt eller fryst faecesprov. Färska faecesprov kan transporteras utan kylning upp till två dagar. När faecesproverna inkommit till laboratoriet fryses de ned och lagras vid 20°C eller kallare. Utförs testet inom 3 dagar efter ankomst till laboratoriet, kan provet förvaras vid 2 till 8°C utan att analysresultatet påverkas. Upprepad infrysning och upptining av proverna bör undvikas. Faecesprov i transportmedium eller andra konserveringsmedel är inte lämpliga för testet. 9.2. FÖRBEREDELSE AV FAECESPROV Fyll först 500µL provbuffert i ett märkt provrör. Blanda faecesprovet och tillsätt med hjälp av den medföljande trästickan ca. 0,1g (mängden av en ärtas storlek) av patientens faeces till provbufferten. Om faecesprovet är flytande, tillsätt 100µL faeces. Slamma upp provet med Vortexmixer (15 sekunder) och centrifugera det sedan i 5 minuter med ≥ 5000 rpm (2500g). Använd en ny trästicka för varje prov. Faecessuspensionen är hållbar 24 timmar vid 2 till 8°C, men den får inte frysas igen. 10. TESTPROCEDUR SE AVSNITT 8.2 TEKNISKA FÖRSIKTIGHETSÅTGÄRDER INNAN DU UTFÖR TESTPROCEDUREN. Reagenser och prov skall värmas upp till rumstemperatur (1530°C) före användning. 10.1. FÖRBEREDELSE AV KONTROLLER Blanda försiktigt före användning. Minst en Amplified IDEIA Hp StAR negativ kontroll och en positiv kontroll måste inkluderas i varje sats av prov som testas (se avsnitt 10.2.1). 10.2. ANALYSPROCEDUR 10.2.1 Tillsättning av prov Pipettera 50µL av faecesprovets supernatant, 50µL av den positiva kontrollen och 50µL av den negativa kontrollen i en brunn vardera. Undvik att störa eller ta prov från sedimentet i flaskan. Vid dispensering av prov, håll överföringspipetten vertikalt med spetsen direkt ovanför mikrobrunnen och se till att provet tillsätts utan att vidröra mikrobrunnens sidor. Se till att inte korskontaminera prov och kontrollmikrobrunnar eftersom detta kan orsaka felaktiga resultat. 10.2.2 Tillsättning av konjugat Tillsätt 50µL per brunn av det bruksfärdiga konjugatet direkt till provet och kontrollerna. 10.2.3 Första inkuberingen Inkubera plattan i 60 ± 5 minuter vid 18 till 27°C på skakapparat. Täck över brunnarna med bifogad folie tillklippt till lagom format. 10.2.4 Tvättning av mikrobrunnarna Tvättekniken är av yttersta vikt för testprestandan (se avsnitt 8.2.12) och bör utföras så att fullständig fyllning (med minst 250300µL bruksfärdig tvättbuffert) och tömning av mikrobrunnarna säkerställs. Fem tvättcykler är nödvändiga, antingen med automatiska eller manuella tekniker. Ta försiktigt bort plattförseglingen före tvättningen. Manuell tvättning Om mikrobrunnarna tvättas manuellt, ska deras innehåll aspireras eller skakas ut. Använd ny tvättbuffert och se till att mikrobrunnarna fylls och töms helt. Mellan varje tvätt ska all kvarvarande tvättbuffert avlägsnas genom att knacka mikrobrunnarna mot rent, absorberande papper. Effektiviteten av manuell tvätt kan förstärkas ytterligare om tvättbuffert tillsätts i vinkel så att en virvel bildas i mikrobrunnarna. Efter den sista tvätten ska plattan vändas och knackas mot absorberande papper för att avlägsna de sista spåren av tvättbuffert. Automatisk tvättning Automatiska tvättapparater bör programmeras att genomföra 5 tvättcykler. Tvättapparaten måste vara rätt kalibrerad så att den fyller och tömmer mikrobrunnarna helt mellan varje tvätt. Efter den sista tvätten bör plattan vändas och knackas mot absorberande papper för att avlägsna de sista spåren av tvättbuffert. 10.2.5 Tillsättning av substrat Tillsätt 100µL substrat i varje mikrobrunn. 10.2.6 Andra inkuberingen Inkubera vid 20-30°C i 10 minuter. 10.2.7 Stoppa reaktionen Stoppa substratreaktionen genom att tillsätta 100µL stopplösning. 10.3. AVLÄSNING AV TESTRESULTAT 10.3.1 Fotometrisk avläsning Mikrobrunnarna bör avläsas fotometriskt inom 15 minuter efter tillsättning av stopplösning. Blanda innehållet i mikrobrunnarna och läs av absorbansen för varje mikrobrunn med en lämplig spektrofotometer eller EIA-plattläsare inställd på 450nm. Se till att mikrobrunnarnas bottnar är rena före avläsning och kontrollera att inget främmande material finns i mikrobrunnarna. Läsaren bör blankinställas på luft (d.v.s. utan platta i hållaren) innan plattan avläses. Om spektrofotometern eller EIA-plattläsaren medger användning av referensvåglängd (vid 620-650nm), kan avläsning med dubbla våglängder göras. Detta eliminerar potentiell interferens orsakad av aberrationer, t.ex. smuts eller fläckar på mikrobrunnarnas optiska yta. 10.4. SaMMANFATTNING AV ANALYSPROCEDUR FÖR Amplified IDEIA Hp StAR-TEST Se till att alla reagenser uppnår rumstemperatur (15-30∞C) innan de används Tillsätt 50µL kontroll eller prov Tillsätt 50µL konjugat Inkubera vid 18-27°C i 60 minuter. med skakning Tvätta (x5) Tillsätt 100µL substrat Inkubera vid 20-30°C i 10 minuter. Tillsätt 100µL stopplösning Läs av absorbans i spektrofotometer vid 450nm (gult) (referens 620-650nm) 11. TOLKNING AV TESTRESULTAT 11.1. POSITIV KONTROLL OCH NEGATIV KONTROLL Enligt anvisningarna i avsnitt 10.1 (Förberedelse av kontroller) måste minst en negativ kontroll och en positiv kontroll utföras i varje analyskörning. Följande kvalitetskriterier måste vara uppfyllda: Positiv kontroll: OD450 / 620 to 650nm > 1.00 (OD450nm > 1.04) Negativ kontroll: OD450 / 620 to 650nm < 0.10 (OD450nm < 0.14) 11.2. PROV Testresultaten tolkas enligt följande: Dubbel våglängd (450/620 till 650nm) Prov med absorbansvärden ≥ 0,150 bedöms som positiva. Prov med absorbansvärden < 0,150 bedöms som negativa. Avläsning vid en våglängd (450nm) Används en mikroplattsläsare utan möjlighet att avläsa mot en referensvåglängd mellan 620 och 650nm , är cut-off fastslagen enligt följande: Prov med absorbansvärden ≥ 0,190 bedöms som positiva. Prov med absorbansvärden < 0,190 bedöms som negativa. Ett positivt testresultat tyder på närvaro av H. pylori antigen i faecesprovet. Ett negativt testresultat tyder på att H. pylori antigen saknas eller på en antigenkoncentration under detektionsgränsen. Om innehållet i en mikrobrunn blir mörkblått och bildar ett blått/ svart precipitat efter tillsättning av substrat, bör provet tolkas som positivt. 12. PRESTANDABEGRÄNSNINGAR 12.1. Amplified IDEIA Hp StAR är ett kvalitativt test och kan inte användas till kvantitativa utvärderingar. Testresultaten bör tolkas av klinikern tillsammans med kliniska data och/eller andra diagnostiska procedurer. 12.2. Antibiotika, protonpumphämmare och vismutpreparat hämmar tillväxt av H. pylori. Faecesprov får tas tidigast 2 veckor efter det att medicinering med protonpumphämmare eller vismutpreparat satts ut resp. 4 veckor efter avslutad antibiotikabehandling. 12.3. Ett negativt resultat utesluter inte möjligheten av H. pylori infektion hos patienten. Att icke kunna upptäcka H. pylori kan vara ett resultat av sådan faktorer som felaktig provtagning eller felaktig hantering av prover. 12.4. Ett positivt testresultat är inte tillräckligt för att föranleda eradikeringsbehandling. Det kan visa sig nödvändigt att tillämpa andra metoder för verifikation av H. pyloriinfektion. För att fastställa ulcera, autoimmun gastrit eller tumörer fordras en differentialdiagnos med invasiv endoskopisk metod. 12.5. Testresultat inom 0,020 absorptionsenheter omkring cutoff värdet skall tolkas med försiktighet. 13. FÖRVÄNTADE VÄRDEN Förväntade värden är beroende av det geografiska läget och till vilket folkslag patienterna hör. Andelen positiva testresultat kan variera på grund av vilken påvisningsmetod man använder sig av samt hur proven insamlas och hanteras. Epidemiologiska studier visar att infektioner med H. pylori är utbredda över hela världen. 2550% av befolkningen i Europa och Nordamerika är infekterade. Studier i Asien, Afrika och Latinamerika har resulterat i ännu högre prevalens, d.v.s. 70-90%1, 11. Förekomst av H. pylori infektion korrelerar med ålder, etnisk härkomst och levnadsstandard. I Förenta Staterna stiger t.ex. infektionens prevalens för varje levnadsår med ca. 1%12. 14. SPECIFIK PRESTANDAKARAKTERISTIK 14.1. KLINISKA STUDIER Studie 1: Primärdiagnos vuxna patienter Amplified IDEIA Hp StAR har utvärderats i 10 tyska centra på 356 patienter (201 kvinnor, 155 män, ålder 18-82 år), vilka genomgått endoskopi på grund av abdominal smärta och dyspepsi. Testerna på faeces utfördes som blindprov i oberoende laboratorier. Patienterna visade olika patologiska fynd: lindrig gastrit (n=61), C-gastrit (n=98), B-gastrit (n=144) (H. pylori), erosion i antrum (n=11), Agastrit (n=2), ulcus ventriculi (n=5), ulcus duodeni (n=3), adenokarcinom (n=2), submukös tumör (n=1), Schatzki’s Ring (n=1), Crohn gastritis (n=1), asymptomatiska (n=27). Resultaten av testerna med Amplified IDEIA Hp StAR jämfördes med de histologiska undersökningsresultaten. Av denna utredning framgick att testerna med Amplified IDEIA Hp StAR hade en diagnostisk sensitivitet på 95.3% och en diagnostisk specificitet på 97,1%. Konfidensintervall (CI) beräknades med hjälp av den exakta binominalmetoden. Resultaten är sammanfattade i tabell 1. Tabell 1:Primärdiagnos hos vuxna patienter med Amplified IDEIA Hp StAR och histologi som referenstest Hp StAR + - Sensitivitet Histologi + 141 7 ± 95% CI 6 202 Specificitet ± 95% CI 95,3% (141/148) 97,1% (202/208) 93,8 –98,9% Hp StAR + - Sensitivitet + 70 1 ± 95% CI 1 167 Specificitet ± 95% CI 98,6% (70/71) Studie 3: Uppföljning av respons på eradikeringsbehandling hos pediatriska patienter. I denna studie ingick 40 H. pylori-infekterade barn med återkommande abdominal smärta (ålder 3 till 15 år) från två gastroenterologiska centra (13). H. pylori -infektionen påvisades med ureaandningstest och serologi. Alla 40 faecesproven identifierades med Amplified IDEIA Hp StAR som H. pyloripositiva. Eradikering utfördes i form av en 7 dagars trippelterapi. Eradikeringskontroll gjordes med andningstest 4 veckor efter avslutad behandling. Amplified IDEIA Hp StAR visade i jämförelse med resultaten av andningstestet en sensitivitet på 100% och en specificitet på 98,9%. Konfidensintervall bestämdes enligt den exakta binominalmetoden. Tabell 3:Amplified IDEIA Hp StAR kontra UBT för uppföljning av respons på eradikeringsbehandling hos pediatriska patienter. Hp StAR + - Andningstest + 8 0 1 31 Sensitivitet 100% (8/8) ± 95% CI 63,1 – 100% Specificitet ± 95% CI + - Utandningsprov (UBT) + 8 2 2 81 Sensitivitet 80% (8/10) ± 95% CI 44,4 – 97,5% Specificitet ± 95% CI 97,6% (81/83) 91,6 – 99,7% 14.2. REPRODUCERBARHET Intra- och Inter-Assay-varians utreddes genom test av negativa (n=2), svagt positiva (n=2), medelstarkt positiva (n=2) och starkt positiva prov (n=2). Avläsningarna gjordes i 3 oberoende laboratorier i Europa. Varje prov testades i tio brunnar i vart och ett av dessa laboratorier. Intra- och Inter-Assay-varianskoefficienter (CV) beräknades och visas i tabell 4. För de olika faecesprovens OD-värden och Intra- och Interassay-varians är de lägsta och högsta värdena för vardera angivna. Tabell 5:Amplified IDEIA Hp StAR faecesprovernas Intra- och Inter-Assay-varians OD 450/630nm negativa svagt positiva 0,024 – 0.070 0,495–0,897 1,306 – 2,656 3,00 – 3,776 Intra-Assay 5,9 – 17.4% CV Inter-Assay 41,2– 46.1% CV 2,7 – 10,1% Pseudomonas fluorescens Campylobacter fetus Pseudomonas putida Campylobacter jejuni Salmonella agona Citrobacter freundii Salmonella choleraesuis Enterobacter cloacae Salmonella infantis Enterococcus faecalis Salmonella ohio Enterococcus faecium Salmonella typhimurium Escherichia coli Serratia proteamaculans Escherichia hermannii Shigella flexneri Lactoccocus lactis Shigella sonnei Listeria innocua Staphylococcus aureus Proteus mirabilis Streptococcus agalactiae Proteus vulgaris Streptococcus dysgalactiae 16. 1. LITTERATUR Marshall, B.J., Warren, J.R. (1984). 2. Dunn, B.E., Cohen, H., Blaser, M.J. (1997). 3. D’Elios, M.M., Andersen, L.P., Del Prete, G. (1998). 4. Delchier, J.-C., Ebert, M., Malfertheiner, P. (1998). 5. Feldman, R.A., Eccersley, A.J.P., Hardie, J.M. (1997). 6. Graham, D.Y., Klein, P.D., Evans, Jr., D.J., Evans, D.G., Alpert, L.C., Opekun, A.R., Boutton, T.W. (1987). Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet 1 (8390): 1311-1314. Helicobacter pylori. Clinical Microbiology Reveiw 10: 720-741. Inflammation and host response. Current Opinion in Gastroenterology 14 (suppl. 1): 15-19. Helicobacter pylori in gastric lymphoma and carcinoma. Current Opinion in Gastroenterology 14 (suppl. 1): 41-45 Transmission of Helicobacter pylori. Current Opinion in Gastroenterology 8: 8-12. Campylobacter pylori detected noninvasively by the 13C-urea breath test. Lancet 1 (8543): 1174-1177. 7. Graham, D.Y., Klein, P.D., Opekun, A.R., Boutton, T.W. (1988). 8. Barthel, J.S., Everett, E.D. (1990). 9. Kokkola A., Rautelin H., Puolakkainen P., Sipponen P., Farkkila M., Haapiainen R., Kosunen T.U. (2000). Effect of age on the frequency of active Campylobacter pylori infection diagnosed by the [13C] Urea breath test in normal subjects and patients with peptic ulcer disease.Journal of Infectious Diseases 157: 777-780. Diagnosis of Campylobacter pylori infections: the "Gold Standard” and the alternatives. Review of Infectious Diseases 12 (suppl.1): S107-S114. Diagnosis of Helicobacter pylori infection in patients with atrophic gastritis: comparison of histology, 13C-urea breath test, and serology. Scand J Gastroenterol 35 (2): 138-141 10. Vaira, D., Holton, J., Menegatti., M., Ricci, C., Landi, F., Ali, A., Gatta, L., Acciardi, C., Farinelli, S., Crosatti, M., Berardi, S., Miglioli, M. (1999). New immunological assays for the diagnosis of Helicobacter pylori infection. Gut 45 (suppl. 1): I23-I27. 11. Vaira D., Miglioli M., Mule P., Holton J., Menegatti M., Vergura M., Biasco G., Conte R., Logan R.P., Barbara L. (1994). Prevalence of peptic ulcer in Helicobacter pylori positive blood donors. Gut 35: 309-312. 12. Graham D.Y., Malaty H.M., Evans Evans D.J. Jr., Klein P.D., Adam E. (1991). medelstarkt positiva 2,1 – 4,0% starkt positiva 1,1 – 3,1% 23,0 – 25,8% 24,1 – 25,4% 8,1 – 10,2% 15. KORSREAKTIVITET Amplified IDEIA Hp StAR faecestest är högspecifik för H. pylori antigen. Varje stam testades i en koncentration på > 1◊108 organismer/ml provbuffert. Korsreaktivitet har inte kunnat påvisas för någon av de nedan angivna mikroorganismerna. I motsats därtill visade H. pylori positivt testresultat. D.G., Epidemiology of Helicobacter pylori in an asymptomatic population in the United States. Effect of age, race, and socioeconomic status. Gastroenterology 100: 1495-1501. 13. Makristathis A., Barousch W., Pasching E., Binder C., Kuderna C., Apfalter P., Rotter M.L., Hirschl A.M. (2000). Two enzyme immunoassays and PCR for detection of Helicobacter pylori in stool specimens from pediatric patients before and after eradication therapy. Journal of Clinical Microbiology 38 (10): 3710-3714 96,9% (31/32) 83,8 – 99,9% Studie 4: Uppföljning av respons på eradikeringsbehandling hos vuxna patienter Stolprov togs från 93 patienter i nordöstra Spanien (64 män och 29 kvinnor mellan 21 och 80 år) som genomgått eradikeringsbehandling för bekräftad H. pylori-infektion. Patienterna uppmanades att ta prov från faeces samma dag som utandningsprovet (UBT – urea breath test) gjordes för att kontrollera resultatet av eradikeringsbehandlingen (minst 4 veckor efter behandlingen). Proven frystes omedelbart ned och hölls nedfrusna vid -80°C. De tinades därefter upp och testades med Amplified IDEIA Hp StAR. Tabell 4 visar de resultat som erhållits med Amplified IDEIA Hp StAR i jämförelse med referensmetoden (UBT). Amplified IDEIA Hp StAR uppvisade en känslighet och specificitet på 80% (8/10) respektive 97,6% (81/83) och en total överensstämmelse på 95,7% (89/93) med UBT. Tabell 4:Amplified IDEIA Hp StAR kontra UBT för uppföljning av respons på eradikeringsbehandling hos vuxna patienter Hp StAR Aeromonas hydrophila hydrophila 92,4 – 100% 99,4% (167/168) 96,7 – 100% Providencia stuartii Aeromonas hydrophila anaerogenes Pseudomonas aeruginosa 90,5 – 98,1% Studie 2: Primärdiagnos hos pedriatiska patienter Amplified IDEIA Hp StAR har testats i en studie med faecesprov från barn, vilka genomgått endoskopi på grund av abdominal smärta och/eller andra intestinala besvär. Undersökningen omfattade 239 barn (124 pojkar, 115 flickor; ålder 6 månader - 18 år) från 3 pediatriska gastroenterologicentra i Europa. Histologi och odling användes som referenstest. Patienterna definierades som H. pylori-positiva, när histologi och/eller kultur utföll positivt och som H. pylori-negativa, när båda testerna var negativa. Amplified IDEIA Hp StAR visade en sensitivitet på 98,6% och en specificitet på 99,4%. Konfidensintervall (CI) beräknades enligt den exakta binominalmetoden. Tabell 2:Primärdiagnos hos pediatriska patienter med Amplified IDEIA Hp StAR och referenstesterna histologi/odling Histologi Odling Acinetobacter lwoffii IFU X9398 Augusti 2015 OXOID Limited, Wade Road, Basingstoke, Hampshire, RG24 8PW, UK Ställ alla frågor till Oxoid lokala dotterbolag eller distributör.