Organisk Kemi Erik Cederberg
advertisement

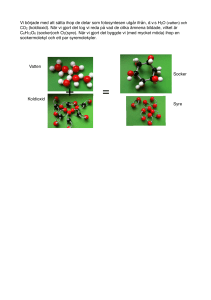
Organisk Kemi Årskurs 9 Organisk Kemi Erik Cederberg Nov-Dec 2004 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Årstidernas Kemi Vintern: Naturen är död och färglös, solståndet är lågt och luften är kall och klar. Det blåser kalla nordanvindar men dom flesta är relativt stillsamma. På vattnet ligger det is och under isen är cirkulationen låg. Bara växternas ”skelett” finns kvar, det är uppbyggt av kolinnehållande cellulosa, växternas aktivitet begränsar sig till dom sockerhaltiga rötterna där den kommande skottskjutningen förbereds. Våren: Solståndet är högt luften är klar och det blåser friska vårvindar, vattnet värms upp ovanifrån vilket skapar en total cirkulation så fort det blåser. Mycket syre kommer även till växternas rötter, i knoppen och stängeln produceras stärkelse och cellulosa. Snart slår det ut massor av blommor i klara vårfärger. Sommaren: Solen står som allra högst och luften är varm, fuktig och ofta kvav. Sydliga sommarfläktar blåser och i vattnet finns ett språngskikt mellan det varma utvattnet och det kallare djupvattnet som inte vill blanda sig. I växten produceras socker som kan lagras som stärkelse eller cellulosa. Vätet spelar en betydande roll i denna process. Sommaren är mångfaldens tid, färgerna är många men inte så klara. Hösten: Solen står åter lägre, det är klart och fuktigt i luften och höststormen viner. Vattnet kyls ner och cirkulationen är total. Innan växten vissnar så når den fullkomlighet i sin frukt. Den är ofta söt men innehåller även mycket fett och protein. De vissnande bladen bryts så småningom ner av jordens nedbrytare. Frukt som ej äts jäser ofta. Höstens färger är klara och varma. Mån 29/11 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Fotosyntes Experiment 1: Vi stoppade ner en upp&ner vänd tratt i en burk med vatten och satte ett provrör över öppningen. Där efter stoppade vi ner en grön vattenväxt (sådan som man har i akvarium) i tratten. När den hade stått ett tag så lyfte vi upp provröret och provade att sätta ner en glödande trästicka i röret,Trästickan började glöda mera. Slutsats: Gasen som bildades i provröret var syre. Experiment 2: Vi hade en glasburk som det låg lite fuktad bommul och bönor i, lät den stå en natt i totalt mörker och öppnade sedan locket för att prova vilken gas som var i. När vi förde ner vår brinnande trästicka så slocknade den med en liten rökstrimma. Slutsats: Gasen som bildades i burken var koldioxid. Efter dessa två experiment kan vi komma fram till denna slutsats: Gröna växter upptar koldioxid och avger syre, Ickegröna växter upptar syre och avger koldioxid På dagen är det så att med hjälp av syret så omvandlas koldioxid och vatten till kolhydrater och syre. På natten blir dock omsättningen omvänd, denna omvända process kallas cellandning. Detta är motsatsen till fotosyntesen. Delar av ovanstående bevisades redan år 1772 av Joseph Pristley. Han stängde in en mus och en krukväxt i ett slutet system där musen hade en glascylinder och växten en annan. Det fanns ett glasrör mellan dom båda cylindrarna med en kran. Så länge det var fri passage emellan så levde både växt och blomma. När han stängde kranen dog dom båda. Detta var dock inte ett riktigt ekosystem eftersom det saknade nedbrytare. Fotosyntesen är jordens viktigaste process, om den inte fanns skulle luftens syre snart vara förbrukat. Stora delar av jorden upptas av öknar där ingen skog växer, dom skogarna vi har kvar måste vi spara på. Man kan se samspelet mellan gröna och ickegröna växter men även mellan gröna växter och oss. Fotosyntetens formel: H2O + CO2 -> COH + O2 6H2O + 6CO2 -> C6O6H12 + 6O2 Tis 30/11 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Kolhydrater: Vattenlöslighet: Socker Löser sig Stärkelse Blandning -> fällning Cellulosa Bibehållen struktur Struktur: Socker Stärkelse Cellulosa Kristallint Pulveraktigt Fiberstruktur Brännbarhet: Socker Stärkelse Cellulosa Smälter -> blir brunt -> svart -> tar eld. Ytan brinner lungt med blå-gul låga, slocknar snart, allt är kvar under ytan . Brinner på ytan med orange låga, omsluts av eld. I alla kolhydrater ingår väte, kol och syre, vi ska nu titta närmare på dessa gundämnen. Ons 31/11 - 04 © Erik Cederberg 2004 Experiment med syre: Ingredienser: Brunstenspulver Kaliumklorat Organisk Kemi Årskurs 9 Kolhydraternas grundämnen Material: Provrör Brinnande trästicka Vi tog ett provrör och fyllde med en knivsudd brunstenspulver och 3cm kaliumklorat. Pulvret blandas om försiktigt och provöret, som är genomstucket av ett s-format glasrör, korkas igen. Anordningen fästs med ett stativ så att glasrörets mynning är under vattnet med ett provrör över sig som vi använder för att samla upp gasen.Vi provar att föra ner en brinnnande trästicka i provröret, resultatet blev att lågan ökade i storlek. Slutsats: Gasen var syre Experiment med vätgas: Ingredienser: Zink Svavelsyra Material 2st Provrör Tändstickor Vi blandar ingredienserna som reagerar exotermt och fräser, ångorna som bildas samlar vi upp i ett annat provrör som vi håller upp&ner vänt över öppningen. Efter detta så håller vi för öppningen på provrör nr 2, vänder det och håller en brinnande tändsticka framför mynningen och släpper ut gasen. Det hörs nu en ljudlig knall och sen är gasen uppbrunnen. Slutsats: Gasen var väte Vätgas är jordens lättaste gas och i ren, flytande form är den det mest energirika ämnet på jorden. Den kan bildas genom att man delar upp vatten, som är syre och väte i sina beståndsdelar. Jag tycker att det är rätt speciellt att vatten är samma blanding som knallgas då vatten inte brinner men knallgas är mycket explosiv. Vätgas uppstår även vid överladdning av batterier och finns också i stora mängder i rymden. Det är faktist ett av universums vanligaste ämnen, dock förekommer det mest i föreningar. Just eftersom vätet är så engergirikt som det är så har intresset ökat för att använda det som drivmedel. Det är även ett mycket miljövänligt bränsle eftersom restprodukten vid förbränning blir vatten. När man ska framställa vätgas industriellt för att just driva bilar eller liknande så låter man vatten rinna över glödgat järn och sönderdelar det på så sätt eller alternativt igenom elektrolys. Experiment med kol: Ingredienser: Magnesium Material: Provrör Tändstickor Vi brände magnesium i ett provrör, detta experiment var ju lysande :=) Det bildades hur som helst en beläggning av kol och magnesiumoxid och eftersom inte magnesium innehåller kol så bevisar detta att det finns kol i luften runtomkring oss och det frigörs när luftens syre förbränns. Magnesium har en viktig roll i växternas gröna pigment som heter klorofyll, magnesiumet har till uppgift att ta in koldioxid. Detta kan jämföras med hemoglobinet i vårat röda blodpigement som har till uppgift att ta upp syre. Tors 01/12 - 04 © Erik Cederberg 2004 Experiment med Bomullskrut: Organisk Kemi Årskurs 9 Bomullskrut och Socker Material: Mätglas, Mätcylinder, Våg Ingredienser: 60 ml Salpetersyra (95-99%) 100 ml Svavelsyra (98%) 5 gram bomull Gör så här: Blanda 60 ml konc. svavelsyra med 100 ml konc. salpetersyra under avkylning (då det är en exoterm reaktion). Tänk på att hälla ner den mer koncentrerade syran i den med lägre koncentration, då SIV-regeln gäller även här. När syrablandningen svalnat, lägg då 5 gram bomull i blandningen och låt den ligga i denna vätska i ca 15 minuter. Skölj sedan bomullen under rinnande vatten noga. Undvik att hantera bomullen med metallföremål under hela processen. Låt din nitrocellulosa torka. Kommentarer: Bomull är ju bara ett exempel på cellulosa. Processen ovan innebär ju endast nitrering av just cellulosa. Det betyder i sin tur att man skulle kunna göra om ett par jeans (som är gjorda av bomull) till ett sprängämne. Kom även ihåg att i lös form brinner nitrocellulosa bara relativt sakta under bildandet av stora kvantiteter gaser. Det är först vid packning eller inneslutning som den nitrerade cellulosan visar sitt sanna jag i en rätt kraftig explosion. Nitrocellulosa dekompositerar sakta under lagring. Dekompositionen är autokatalyserande, och kan leda till spontan explosion om det lagras instängt under en längre tid. Processen går mycket snabbare om man efter tillverkning inte har tvättat ur restsyran ur produkten (du kan ta hjälp av utspädd NaOH eller koka i bikarbonat). Ju renare syror du använder desto större del av cellulosan kommer att genomgå full nitreringoch därför höja kvaliteten. Det finns tre former av cellulosanitrat varav endast en är användbar för pyrotekniska ändamål, cellulosatrinitrat. Mono- och dinitraten är inte explosiva och är produkter av ofullständig nitrering. Expriment: Socker och Svavelsyra. Vi blandar socker med lite vatten i ett provrör och tillsätter sedan svavelsyra. Sockret blir brunt och sen skiftar det till svart, där efter bildas ett svart skum bestående av kol, detta kan bäst liknas vid när det kokar över i en kastrull. Allt detta sker under en temperaturhöjning. Svavelsyran som vi tillsatte reagerade med sockret i en exoterm reaktion, en reaktion som utvecklar värme. Motsatsen heter endoterm reaktion då reaktionen kyler av i stället. Om man blandar syra och vatten på detta sätt måste man se till att hälla syran i vattnet, inte tvärtom. Syra - I - Vatten regeln. Fre 02/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Socker Växtens kolhydrater: En växt kan omvandla stärkelse till socker och tillbaka (reversibel reaktion). En växt kan också omvandla stärkelse till cellulosa men denna process är inte reversiblel, det är en irreversibel process. Människan kan bryta ner stärkelse till socker men cellulosa kan inte våra kroppar bryta ner. Experiment med Fehlings lösning: Fehlings I: 7g kopparsulfat i 100ml vatten Fehlings II: 35g kaliumnatriumtartrat och 10g natriumhydroxid i 100ml vatten. Blandas dessa får man Fehlings lösning, en reagens som reagerar på vissa sockerarter. Fehlings lösning reagerar enbart på monosacarider, inte disacarider eller polysacarider. Man undersöker ett ämne med fehlings genom att man fyller ett provrör med 2cm fehlings och 2cm vatten och lägger ner materialet man ska analysera däri och värmer försiktigt. Den från början blåa lösningen kommer då ändra färg åt det röda hållet på färgskalan om materialet innehåller socker. Innehåller det inte socker så kommer ingenting hända och lösningen kommer att förbli blå. Vi provade med dessa olika material: Äpple: Reaktionen blev att Lösningen blev Orange (rätt mycket socker) Potatis: Grönbrun (inte så mycket) Apelsin: Ljusorange (rätt mycket) Fruktos: Mörkgul (mycket) Experiment med amylas. Vi rör ihop en blandning av Maizena och vatten och häller upp det i två små bägare. Den ena burken låter vi bara vara, den andra burken får Ringo spotta i först och sen ställer vi den också åt sidan. Denna ska vi undersöka i morgon. Experiment med Bomull: Vi löste upp bomull i svavelsyra och när bomullen är upplöst så späder vi ut blandningen med vatten. Efter detta så neutraliserar vi syran med natriumhydroxid Denna blandning testar vi nu med Fehlings lösning, resultatet blev att det blev rödaktigt vilket betyder att det finns mycket socker i den. Detta är ett bra exempel på ett av dom enda sätten männsikan kan bryta ner cellulosa till socker, med en syra. Mån 05/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Sacarider del 1 Fortsättning på ”Experiment med amylas”: Efter att burkarna har stått en dag är den som bara har fått stå en gele. Den som Ringo spottade i däremot är bara som en lite tjockare mjölk. När vi testade dessa två med fehlings lösning så fick vi detta resultat: Prov #1 (den utan spott): Nästan ingen reaktion alls. Prov #2 (den med): Här blev det orange. Prov #3 (spott): Denna hände inget med. Då har vi alltså bevisat att varken spott eller blandningen med spott innehåller socker. Men varför är det då socker i den som har båda i sig? Jo, det är för att stärkelsen bryts ner till socker av saliv-enzymet amylas. När vi provade att spotta i den burken som var som gele så tog det inte många timmar innan den också var nedbruten till socker och i samma konsistens som den andra. Namn: Cellulosa Stärkelse Blodgruppsubstanser Laktos, Sacaros, Maltos, Mjölksocker, Rörsocker, Maltsocker Galaktos, Fruktos, Glukos, Fruktsocker, Druvsocker Antal monosacarider > 1000 100-tals 3-8 2 Grupp Polysacarid Polysacarid Ogliosacarid Disacarid 1 Monosacarid Tis 06/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Sacarider del 2 Antal Sacarider: > 1000 3-8 2 1 Kemisk Beteckning: Polysacarid Ogliosacarid Disacarid Monosacarid Kolhydrater är ett gemensamt namn för sockerarter (sackarider) och polymerer av sådana. Namnet kommer av att många sackarider har formeln Cn(H2O)n och därför skulle kunna betraktas som hydrater av kol. Sackarider finns i form av monosackarider (enkla sockerarter), disackarider och polysackarider. Till monosackariderna hör bland annat glukos disackarider, till exempel rörsocker och mjölksocker, består av två sammansatta monosackarider. Polysackarider är bland annat stärkelse och”kostfiber” (till exempel cellulosa). Polysackarider består av ett stort antal glukosmolekyler (> 1000). Människans enzymer kan bara spjälka stärkelse. Stärkelse är antingen vattenlösligt eller vattenolösligt. Den långa cellulosamolekylen kan människan bara bryta ner med tillexempel svavelsyra till dom kortare molekylerna maltos eller glukos. Glukos (blodsocker) är den sockerart som alla djur kan ta upp, finns det för mycket glukos i blodet börjar bukspottkörteln att producera insulin som omvandlar glukos till glukogen (leverstärkelse) som kan lagras i levern och i musklerna för senare behov. Blodsockerhalten minskar då när glukogenet tas upp i levern och i muskelcellerna, när halten är för låg så kan kroppen producera glukagon eller om det behövs snabbt adrenalin som omvandlar glukogenet till glukos. Dom som är diabetiker har problem med just produktionen av insuilin och får för högt blodsocker. Tis 06/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Jäsning Jäsning av russin till russinvin: Vi fyllde en e-kolv med vatten och hällde i så mycket russin att det täckte botten och lite till. Vi korkade igen kolven med en glasrörsförsedd kork som hade glasrörets mynning under vattnet så det blev ett vattenlås. Vi lät den stå i rumstempereratur i ett par dagar, det hände inte så mycket så vi tillsatte jäst och socker. Nästa dag hade det bildats bubblor av koldioxid som lyfte russinen upp till ytan. Bubblorna ”lossnade” och försvann ut genom vattenlåset och russinen sjönk igen. Detta förklaras genom att när jästsvamparna (som även finns på russinens skal) är i en syrefri miljö så börjar dom omvandla socker till koldioxid och alkohol. I våra kroppar sker en liknande process, då med bakterier i stället för jästsvampar. När det blir lite luft så omvandlar bakterier glukos till koldioxid och alkohol, sedan bryts dock alkoholen ner till koldioxid och vatten av ett enzym. När syre finns tillgängligt så bryts glukosen i stället ner till koldioxid, vatten och energi. När musklerna arbetar hårt så får dom syrebrist, alkoholen oxiderar och blir den mjölksyra som man kan känna av på gympan i bland (kortintervall-träning någon ?). Hur gör man öl: Man låter sädeslaget korn gro på en bädd av bomull. När groddarna är 2mm så innehåller kornen som mest maltos och då är det dags att koka dom med vatten och sedan mäskas (dvs. röras ut i varmt vatten så att enzymerna i malten får verka). Till den så kallade vörten tillsätter man jäst och låter det jäsa till en förutbestämd alkoholhalt. När man har uppnått denna halt så tillsätter man vatten och humle och låter det sedan jäsa kallt. När det slutar utvecklas koldioxid så dekanterar man bottensatsen och sötar eventuellt ölet lite till innnan det fylls upp på flaskor eller fat. Det extra sockret gör så att det utvecklas ytterligare koldioxid som löses i vattnet som kolsyra. Andra användningsområden för jäsningsprocessen: Människor har i alla tider utnyttjat jäsning till drycker, bak och konservering. När vi bakar så används jästsvamparnas koldioxid till att lyfta degen. Innan vi hade jäst tillverkade man vandringsjäst i en surdegskultur. Surdegen tillverkas med honung, vatten och grahamsmjöl som får stå och jäsa ett par dagar. Samma process utnyttjar man när man tillverkar mjöd eftersom honungens jästsvampar bildar alkohol och koldioxid. Om man vill konservera grönsaker kan man mjölksyra dom (vilket alla på Kristofferskolan vet). Detta sker genom att man river gönsakerna, pressa in dom i en burk och täcker med vatten, därefter låter man dom stå svalt. Nu är det mjölksyrebakterier som tar över jäsningen. Grönsakernas laktos bryts ner till glukos och galaktos. Det bildas alkohol och koldioxid. När alkoholen kommer i kontakt med vatttnets syre så oxiderar den till mjölksyra. © Erik Cederberg 2004 Ons 07/12 - 04 Organisk Kemi Årskurs 9 Alkohol En Etanol-molekyl Etanol har som vi vet formeln C2H5OH (C = kol och H = väte, O = Syre) Denna modell kallas i dagligt tal för ”fyllehunden” (speciellt bland kemilärare) Here is what the Encyclopaedia Galactica has to say about alcohol. It says that alcohol is a colourless colatile liquid formed by the fermentation of sugars and also notes the intoxicating effect on certain carbon-based lifeforms. The Hitch-Hikers Guide to the Galaxy also mentions alcohol: It says that the best drink in the universe is the Pan Galactic Gargle Blaster. It also says that the effect of drinking a Pan Galactic Gargle Blaster is like having your brains smashed out by a slice of lemon wrapped around a large gold brick. The guide also tells you on wich planets the best Pan Galactic Gargle Blaster are mixed, how much you can ecpect to pay for one end what voluntary organizations exist to help you rehabilitate afterwards... [lots of more text here] ... The Hitch-Hikers Guide to the Galaxy sells rather better than the Encyclopaedia Galactica. Alkohol(-er): Ordet kommer via franskans alcoolisme som betyder alkolism från arabiskans al-khul som betyder ”fint pulver av blyglans”. Alla alkohler är giftiga, dock så är inte etanol lika giftigt för människan som andra sorter, tillexempel metanol som kan orsaka blindhet eller leda till döden. Alkoholer med få kolatomer är flyktiga och vattenlösliga, ju fler kolatomer det finns i en alkohol desto sämre löser den sig i vatten. Alkoholer med 12-18 kolatomer kallas fettalkoholer eftersom dom är besläktade med fettsyror. Experiment: Alkoholers löslighet i vatten och olja. Namn Metanol Etanol Propanol Butanol Hexanol Löslighet i vatten ja ja ja nej nej Löslighet i olja nej nej ja ja ja Kokpunkt 65 78 87 117 ? Tors 08/12 - 04 Kemisk formel: C3H7OH C4H9OH C5H11OH C6H13OH C7H15OH © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Ölets Histora Ölets Historia: Konsten att brygga öl är lika gammal som konsten att baka bröd. Exakt hur gammal ölet är vet man inte men det är minst 7 000 år. I Kina blev ölet en allmän dryck ungefär 2 300 år f Kr. Inkaindianerna drack majsöl långt innan spanjorerna steg iland på den amerikanska kontinenten. Hos våra egna förfäder hade ölet en mycket stark ställning då man bland annat trodde att ruset från alkoholen var en gudagåva. Tron på gudar och gudinnor levde länge kvar. Den hedniska bloten var en företeelse som hade en stark förankring i folks medvetande. När de första apostlarna började sprida sina kristna läror insåg de att det inte var någon idé att försöka bryta dessa seder, istället övertog kyrkan de hedniska dryckesriterna för att på så vis underlätta övergången till den kristna läran. Kyrkan ansåg till och med att det var allas plikt att samlas vid vissa tillfällen och dricka öl. Det fornnordiska ölet var smaksatt med pors och därför mycket beskt. Till fest drack man mjöd, en exklusiv variant av öl som bryggdes på enbart honung. 1100-talet är en milstolpe i ölets historia, man började nämligen att använda humle då och både smaken och hållbarheten förändrades markant till det bättre. Efterfrågan översteg vida tillgången och man började importera humle i allt större omfattning. Det gick så långt att myndigheterna ansåg sig tvungna att lagstifta om humleodlingar i landet. Alla som bedrev någon form av jordbruk ålades att anlägga en humlegård. Öl var rena hårdvalutan och användes som betalning för utförda tjänster i bältaresvennernas skråordning. År 1437 stadgas till exempel: ”Ho som spyr eller skiter på väg till gillet böte halv tunna öl, sker det i gillestugan, böte han en hel tunna”. Vid Solberga kloster utanför Visby skulle en nunna ha 14 tunnor öl om året i tilldelning vilket motsvarar ca 5 liter öl om dagen! Även vid hovet låg dagsransonen kring 5 liter. I slutet av 1700-talet och under halva 1800-talet dominerade brännvinet fullständigt i Sverige. Fylleriet var förödande, öl framstod plötsligt som rena hälsodrycken. Den svenska nykterhetsrörelsen som på allvar organiserades på 1830-talet, uppmanade alla, med läkare och präster i spetsen, att återvända till ”förfädrens dryck”, det sunda och välsmakande ölet. Nästa milstolpe i svensk ölhistoria var år 1843, då introducerades det Bayerska ölet i Sverige. Det Bayerska ölets intåg kom att på nytt föra fram ölet som den stora folkdrycken och brännvinskonsumtionen minskade igen. Att brygga det underjästa Bayerska ölet krävde en mer avancerad teknik och ölbryggandet övergick då från rent hantverk till att ske industriellt. Bryggerierna växte upp som svampar ur jorden under perioden 1850 till 1900, inte bara i de stora städerna, utan även på landsbygden. Många av dem kallades för ”Münchenbryggerier” efter den bayerska huvudstaden Munchen. År 1880 hade vi 374 st bryggerier i landet och bara tio år senare hade vi 554 st ! Så småningom utkonkurerades lagerölet av pilsnern som från första världskriget blev det helt dominerande i Sverige. Under de senaste 40 åren har den svenska bryggerinäringen genomgått en kraftig strukturomvandling. När starkölet började säljas i Systembutikerna 1955 fanns det 120 st bryggerier i landet, år 1985 fanns det endast 5 stycken. Idag har det vänt och fler och fler bryggerier startar nu återigen upp i landet. Tors 08/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Alkohol del 2 Kroppens reaktion på alkohol: (etanol) Mängd: Tillfälliga Drickare 100 mg/100 ml (0.10%) Påverkade 200-250 mg/100 ml Dålig reaktionförmåga, slöhet (0.20-0.25%) 300-350 mg/100 ml (0.30-0.35%) >500 mg/100 ml (>0.50%) Omtöcknad eller i koma Kronisk Drickare Minimal påverkan Kräver ansträngning för att upprätthålla känslomässig och motorisk kontroll Dåsig och långsam Risk för ”Game Over” Koma Dessa siffror är ungerfärliga och beror dessutom på om man är kvinna eller man (kvinnor tål mindre alkohol än vad män gör). Personer med mer eller mindre kroppsmassa tål olika mycket. På grund av sin giftverkan kan alkoholer användas som desinfektionsmedel. Alkoholer är också bra lösningsmedel, det är ibland möjligt att byta ut svårnedbrytbara (miljöfarliga) och/eller hälsovådliga organiska lösningsmedel som används inom industrin mot mindre skadliga alkoholer. De är också goda rengöringsmedel, speciellt i avfettningssammanhang. Eftersom alkoholer är brännbara forskas det på hur man kan använda i första hand etanol och metanol som energikälla. Detta är intressant eftersom etanol är ett förnyelsebart biobränsle som är lätt och billigt att producera. Storskaliga försök görs redan med etanoldrivna fordon. Experiment: Destillation av russinvinet: Vi hällde vårat russinvin i en kolv som var igensatt med en kork med ett glasrör igenom. Vi började försiktigt värma upp kolven och sedan försökte vi hålla temperaturen runt 80 grader. Alkoholångorna leddes ut genom röret, genom ett vattenkylt kylrör där det kondenserades och rann ner i en liten kolv. Dom första dropparna innehåller giftiga biämnen och ska hällas ut sen är det bara att köra. Dock så är inte spriten ogiftig efter denna första destillation, den innehåller bland annat finkeloljor och kanske lite metanol som kan orsaka blindhet. Om man vill ha spriten ren ska man nu blanda destillatet med vatten till ungefär 40% alkoholhalt. Efter detta destillerar man vätskan två gånger genom ett aktivt kolfilter och vips så har man helt och fullt drickbar starksprit. Fre 09/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Oxidering av Alkoholer Frukt blir syra: Druvor som jäser i en anareob miljö blir vin som har en alkoholhalt på runt 12%. Vin som utsätts för syre oxiderar och blir Vinäger som är smakrikt. Vinäger som utsätts för mera syre blir Ättikssyra som är frätande och brandfarligt, med mera syre blir den Oxalsyra. Oxidation av alkoholer: Etanol -> Ättiksyra -> Etansyra Metanol -> Myrsyra -> Metansyra Myrsyra bildas av myrorna genom att dom först äter trä som dom i kroppen omvandlar till den giftiga alkoholen metanol, när dom sedan andas så oxiderar den till myrsyra. Framställning av estrar: Vi gjorde nu olika estrar genom att blanda en organisk syra med en alkohol tillsammans med svavelsyra som katalysator. (svavelsyra) Ättiksyra + Pentanol ----> Päronessens + vatten Denna essens luktade ungefär som en päronsplit men mycket starkare... (svavelsyra) Ättiksyra + Etanol ----> Salubrin + vatten Detta blev sådant dära man har på bistick på sommaren och sånt... (svavelsyra) Etanol + Smörsyra ----> Ananasessens + vatten Denna luktade verkligen syntetisk ananas, typ som i ananas-godis, däremot smörsyran luktade inte allt för gott. DAGENS SLUTSATS: Alkohol + Organisk syra (svavelsyra) ----> Ester + vatten Estrar är färglösa vätskor med starka , fruktiga, lukter och smaker, dock måste man rena dom från svavelsyran innan man kan använda dom praktiskt. Tis 13/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Kolväten Vi vet nu att både kol och väte brinner bra, nu ska vi titta på en kolatoms uppbyggnad: Kolatomen har fyra fria elektroner som vill binda sig till andra atomer. I kolväten så är dom bundna till mer kol eller väte. Väteatomen har däremot bara 1 fri elektron som kan binda sig till kolet väldigt enkelt. För att bilda det enklaste kolvätet, metan, så kopplar en kolatom ihop sig med fyra st väteatomer.Den kemiska formeln för metan är CH4 (C = kol H4 = 4st väte). Om två kolatomer förenas och binder till sig 6st väte så blir det C2H6, etan, en annan sorts gas. Tre kolatomer kan binda till sig 8st väteatomer och det blir då propan som man har i gasol. Gaser: metan etan propan butan pentan Råbensin hexan heptan oktan nonan Råfotogen dekan Brännoljor hexadekan Smörjoljor heptadekan Den allmäna formeln för ett kolväte är: CnH(2n+2) = Kol <siffra> Väte(2<siffra>+2) Experiment: Torrdestilation av trä. Vi värmer trä utan syre (pyrolys) i ett provrör som är igenkorkat och har ett glasrör ut genom korken. Gaserna som kommer ut är brännbara och det droppar tjära ur röret. Det som blir produkterna av att värma trä på detta sätt är: 1) Kol (brinner utan låga med varm glöd, bra att grilla med). 2) Gengas (vit starkt luktande rök med innehåll av kolmonoxid oxh koloxid, brinner bra). 3) Tjära (luktar gott, kan användas till att täta eller imprengiera saker med). Gengas: är en vit, starkt luktande gas med stort innehåll av kolmonoxid och en del vätgas som framställs genom pyrolys av ved. Gengas användes mycket under krigsåren för att driva bilar och har sedan fallit i glömska som drivmedel för bilar, det försöker dock entusiaterna på www.gengas.nu ändra på, de driver sina bilar på gengas. Det är svårt att få tillstånd att köra på gengas med en nyare bil så dom flesta kör bilar tillverkade före -85 som inte innefattas av samma lagar. Den brännbara delen i gasen bildas igenom att: Kolmonoxid: kol förbränns med luftens syre och då bildas koldioxid och värme varefter koldioxiden reduceras till kolmonoxid genom att ledas genom mera kol. Vätgas: vattengasreaktion = vattenånga reagerar med kol och bildar vätgas och kolmonoxid. Övriga lätta kolväten: bildas genom crackning av tjäran i veden. Ons 14/12 - 04 © Erik Cederberg 2004 Organisk Kemi Årskurs 9 Oljeraffinering I detta fraktioneringstorn får vi vid dom olika kondenseringstemperaturerna ut olika fraktioner av oljeprodukter, t.ex bensin, fotogen och eldningsolja som kondenseras och tappas vid olika temperaturer. I dom stora haven så dör djur och växter hela tiden. Dessa växt och djurrester som sjunker till botten täcks snart med lera, sand och annat material som spolats ut i havet. Dessa lerlager växer snabbast nära kontinenterna och efter ett par miljoner år så kan dom vara flera hundra meter i tjocklek. Då utsätts växt och djurresterna som ligger längst ner för ett tryck som är enormt. Det är då som djurresterna blir olja och naturgas, lagren ovanför dom av sand och lera omvandlas samtidigt till till exempel bergarterna sandsten och lerskiffer. Sandsten och andra porösa bergarter innehåller massa mikroskopiska hålrum, härigenom letar oljan sig uppåt mot ytan. Däremot lerskiffern är mera massiv och släpper inte igenom oljan, det blir stopp. Under lerskiffern finns det också vatten som oljan tränger sig igenom och lägger sig ovanpå. Olja och naturgas kan man alltså bara hitta där den inte har lyckats ta sig upp, ”fickorna” som oljan och gasen kan samlas i har bildats genom spänningar i jordskorpan. Oljan man utvinner ur berggrunden kallas råolja, det är liksom naturgas en blandning av många olika kolväten, olika kolväten kokar vid olika temperaturer, i detta sammanhang är det ”fler kolatomer -> högre kokpunkt”. Detta förhållande utnyttjar man när man rafinerar oljan. Man utvinner olika oljeprodukter genom destillation av råolja, under destillationsprocessen kyler man succesivt ner gasen och tappar dom kondenserade oljeprodukterna. Olja kan man även hitta på land, detta beror på att rörelser i jordskorpan har orsakat att det som tidigare var havsbotten har höjt sig och med tiden höjts över havsytan och blivit land i stället för sjöbotten. När man öppnar en oljekälla är trycket mycket högt och det kan spruta upp olja. När trycket sjunker pumpar man ner vatten för att öka trycket och därmed driva upp mera olja. All olja får man dock aldrig upp, men med nya tekniker får man upp mer och mera ur oljekällorna. Den mesta olja som Sverige importerar kommer från vårat grannland i väster, från Norges oljekällor i Atlanten. I Nordsjön däremot finns det många ställen där man har hittat gasfält utan någon olja, denna gas pumpar Danskarna upp och den köps av bland annat Sverige. Gasen pumpas genom gasledningar runt i sydvästra Sverige och används i huvusak till att värma saker i inustrier och att värma upp hus. Tors 15/12 - 04 © Erik Cederberg 2004