Föreläsning 5 Molekylers rymdgeometri, Dipolmoment, VSEPR
advertisement

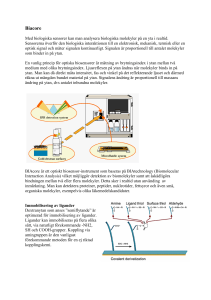
Föreläsning 5 Molekylers rymdgeometri, Dipolmoment, VSEPR-teori och hybridisering Fleratomiga molekylers geometri. (Kap. 8.1 - 4) Molekyler eller joner av typ XYn, där X = centralatom, Y = ligand Alla Y binder till X. Symmetriska molekyler. Större molekyler byggs upp genom att koppla ihop fragment. Geometrier för olika koordinationstal. n = 2, 3, 4, 5, och 6 Bindningslängder Diskussionen gäller kovalent bundna avgränsade molekyler. (Jongitter, salter, antar den rymdstruktur jonradier och stökiometri kräver enligt tidigare.) Viktiga parametrar • Kovalenta radier hos inblandade atomer (se fig. 8.2 och 8.3) • Bindningstal. Enkelb. > dubbelb. > trippelb. mellan samma par atomer. Arbetsgång vid bestämning av rymdstruktur. • Rita upp atomerna med valens- e-. • Skapa Lewis-strukturer med alla ickebindande e--par utsatta enligt oktettregeln. • Tag med ev. mesomera (alternativa, ”resonans-”) strukturer vid behov. (Ex. SO2 längre fram.) • Tillämpa VSEPR-metoden (se nedan). Valens-skal-elektron-par-repulsions-modellen (VSEPR). Tar hänsyn till icke-bindande elektronpar (lp = lone pair) på centralatomen. Repulsion: (lp – lp) > (lp – bp) > (bp – bp) (bp = bindande par) Exempel CH4, NH3 och H2O. Obs. att bindningsvinkeln minskar med större andel icke-bindande elektronpar. Ex: Svaveldioxid, linjär eller vinklad? Antal valens-e−: 3 ⋅ 6 = 18 st. Linjär skulle varit 2 icke-bind. e−-par per syreatom + dubbelbindningar O=S=O engagerar endast 16 e− (jmf. CO2). Ett extra par på S-atomen gör att molekylen vinklas. Ritas: S O O + + S O S O O O - Lewis-strukturer Bilden visar tre st. mesomerer = resonansstrukturer. Den första följer inte oktettregeln för S, de övriga ger polära bindningar. Ingen ger linjär molekyl. Formell laddning (FC) hos atom: Alla bind. e--par delas. FC = Z – (antal e- inkl. lp.) En O får -1 och S får +1 i två av alt. ovan. Dipolmoment. Uppstår när centrum för positiva laddningar för molekylen inte sammanfaller med centrum för negativa laddningar. µ = r ⋅δ ⋅ e µ = dipolmomentet (SI-enh. m⋅⋅As, 1 Debye = 3,336⋅⋅10−30 m⋅⋅As) e = elementarladdn. r = avstånd mellan laddningscentra Bindning i polyatomära molekyler. (Kap. 8.4) Diskuteras i termer av VB-teori (valensbindning). Lokaliserade e− . Oktettregeln vägledande. Koordinationstal för en atom = det antal extra e− som behövs för full oktett. Räknas ut från plats i periodiska systemet (s- och p-grupper, 1+2 och 13 – 17) Formell laddning kan behövas (jmf. SO2 tidigare). Expansion av oktetten, hypervalenta föreningar. Tyngre atomer: Även d-orbitaler kan ingå i bindningar. Ex. SF6, 6 bindn. S-F. S har ox. talet VI. Resonansstrukt. avvikande från oktettregeln eller med fria joner. VB-teori och hybridisering. Förklarar rymdgeometri. Hybridisering = omvandling av centralatomens AO:s genom linjärkomb. av valens-AO:s. Ex. H2O. O har elektronkonfigurationen (1s)2(2s)2(2p)2. Två halvfyllda 2p. Bindningsvinkeln borde bli 90o. Stämmer ej med VSEPR och experiment. Lösning på problemet: Hybridisera O-AO:s, så att orbitaler utsträckta i bindningsriktn. erhålls. Kombinera sedan med 2 st. (1s)H. Hybridorbitaler (HO:s) är fiktiva AO:s som används för att rationalisera bindningsvinklar m.m. • sp-hybrider. 2 st. AO:s ger 2 st. HO:s Linjär konfiguration. • • sp2-hybrider 3 st AO:s ger 3 st HO:s Plant, 120o bindningsvinkel • sp3-hybrider Tetraedrisk konfiguration 4 st AO:s – 4 st HO:s (Se äv. fig. 8.12+13.) • sp3d2-hybrider Oktaedrisk konfiguration 6 st AO:s – 6 st HO:s (Jmf. SF6 ovan) Exempel på hybridisering i molekyler. I ammoniak (NH3) är N-atomen sp3-hybridiserad. 3 HO:s binder till var sin H-atom och den fjärde fylls av det icke-bindande elektronparet. I koldioxid är kolet sp-hybridiserat (en σ-bindning/syreatom) och de två övriga p-orbitalerna bildar varsin π-bindning med resp. syre. Syrena är sp2-hybridiserade, och här fylls de återstående sp2-HO:erna med varsitt ickebindande elektronpar (ett/syreatom). Kolatomer i organiska molekyler. • I metan är kolatomen sp3-hybridiserad. Fyra st. σ-bindningar till vätena. • I eten (C2H4) är kolatomerna sp2-hybridiserade. Molekylen är plan. De tre sp2-hybriderna bildar σ-bindningar med vardera två väten och med det andra kolet. Bindningsvinklarna blir ca. 120 o. En återstående p-orbital på vardera kolet bildar tillsammans en π-bindning mellan kolatomerna. Se nästa sida. I acetylen (etyn, C2H2) är kolatomerna sp-hybridiserade. De två återstående p-orbitalerna på vardera kolet bildar tillsammans två πbindningar mellan kolatomerna med nodplan vinkelrätt mot varandra. Molekylen är linjär. •