Real gas - Atomic Physics
advertisement

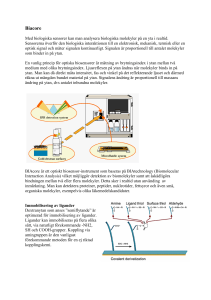
Real gas: Kraftverkan mellan molekyler Molekylers egenvolym kan inte försummas Real gaslag:van der Waals ekvation a ⋅ n 2 p+ ⋅ V − n ⋅b = nRT 2 V a och b materialkonstanter, från tabell pVT-ytor: Kritiska punkten: över en viss kritisk temperatur är det ingen skillnad mellan gas och vätska Kraft mellan molekyler, Potentiell energi I gas dominerar kinetisk (translations) energi =3/2 kT I vätska dominerar negativ potentiell energi Trippelpunkten: alla tre faser i jämvikt För vatten: 610 Pa, 273,16 K (0.01 oC) TERMODYNAMIK Tryck och temperatur mikroskopiskt: p=2/3 . no . <Wkin>en <Wkin>en = 3/2 .kT <Wkin>en : genomsnittliga kinetiska energin (translation) hos en partikel 3 vinkelräta riktningar i rummet (3 frihetsgrader). ½ kT per frihetsgrad Molekyler (t.ex. O2) kan även vibrera och rotera vilket ger ytterligare frihetsgrader. Ekvipartitionsprincipen: Genomsnittsenergin hos varje frihetsgrad är ½ kT. Ädelgaser (en-atomiga) molekyler har 3 frihetsgrader Tillståndsändring (termodynamisk process) Reversibel process: En tillståndsändring är reversibel om den är omvändbar. Volym, tryck och temperarur är definierade för varje del av tillståndsändringen ( och kan plottas i t.ex. p-V diagram) Irreversibel process: t.ex. fri expansion Termodynamikens första huvudsats: Q = ΔU + W Tillförd värme Ändring Utfört arbete av inre energi Teckenkonvention (utifrån systemet, arbetsgasen) Q positiv : systemet tillförs värme ΔU: slutenergi-begynnelseenergi (Inre energin U svår att beräkna absolut) W positiv: systemet utför arbete Arbete: dW = p . dV Värme: Q=m.c.ΔT=m/M . c.M ΔT=n.C ΔT C= c.M molar specifik värmekapacitet (för gaser används oftast Q= n.C ΔT) Två olika C CV: om volymen hålls konstant, W=0 Cp: omtrycket hålls konstant, W>0 Cp> CV (om p hålls konstant blir en del tillförd värme arbete) Inre energiändring: ∆U = 3 N ⋅ k ⋅ ∆T =n ⋅ 3 R ⋅ ∆T 2 2 (sant för enatomig gas, ädelgaser) Inre energi beror bara på temperatur (ideal gas) f Allmänt ∆U = n ⋅ R ⋅ ∆T , f=frihetsgrader 2 Cp f f C = ⋅R , C p = ⋅R + R , γ = V 2 2 C V O2 , N2 : f=5 om 50 K< T < 2000 K Poissons ekvation: (för adiabater) T ⋅V γ −1 = T ⋅V γ −1 1 1 2 2 med flera Polytrop process: p ⋅V k = konst ,1<k<γ Adiabatiska processer är svåra att åstadkomma i praktiken. För vätskor och fast fas använder vi c. cp och cv skiljer sig obetydligt pga liten volymutvidgning. I fasta ämnen blir C=3R (Dulong-Petit)