Monoclonal Mouse
advertisement

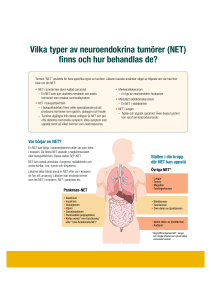
FLEX Monoclonal Mouse Anti-Human Inhibin α Klon R1 Ready-to-Use (Link) Kod IR058 Avsedd användning För in vitro-diagnostik. FLEX Monoclonal Anti-Human Inhibin α, Clone R1 (1), Ready-to-Use, (Link), är avsedd att användas i immunhistokemi tillsammans med Autostainer Link-instrument. Antikroppen är användbar för att identifiera tumörer i äggstockarna, t ex könsbundna navelsträngsstromala tumörer (SCST). Den kliniska tolkningen av all färgning eller frånvaro av färgning måste göras genom morfologiska studier med hjälp av lämpliga kontroller, och måste utvärderas av en kvalificerad patolog inom ramen för patientens anamnes och andra diagnostiska tester. Sammanfattning och förklaring Inhibin är ett dimeriskt glykoproteinhormon bestående av en α- och ß-underenhet. Det är ett led i den transformerande tillväxtfaktor-ßs (TGF-ß) superfamiljen och hämmar produktionen eller sekretionen av hypofysära gonadotropiner, företrädelsevis follikelstimulerande hormon (FSH) (2, 3). Inhibin skapar tillsammans med aktivin - ett närbesläktat dimeriskt glykoproteinhormon bestående av två ß-underenheter - en finjusterad endokrin återkopplingskrets. Inhibin minskar och aktivin ökar biosyntesen och frigörandet av FSH. Inhibin och aktivin har visat sig förekomma i en mängd olika gonadala och icke-gonadala vävnader, vilket tyder på att dessa peptider har andra funktioner förutom att reglera sekretionen av FSH. Inhibin motverkar aktiviteten av aktivin i många system, en egenskap som finns i tumorgenes. Allmänt tror man att inhibin kan fungera som en suppressor av gonadala tumörer, medan aktivin kan främja tumörtillväxt via en autokrin slinga (2). Se Dakos Allmänna instruktioner för immunhistokemisk färgning eller detektionssystemets instruktioner om IHC-procedurer för: 1) Procedurprincip, 2) Material som behövs men inte medföljer, 3) Förvaring, 4) Provberedning, 5) Färgningsprocedur, 6) Kvalitetskontroll, 7) Felsökning, 8) Tolkning av färgningen, 9) Allmänna begränsningar. Medföljande reagens Bruksfärdig monoklonal antikropp medföljer i flytande form i en buffert som innehåller stabiliserande protein och 0,015 mol/L NaN3. Klon: R1 Isotyp: IgG2a, kappa Specificitet Anti-inhibin α, klon R1 riktas mot 1–32 aminosyrasekvensen i underenheten human inhibin α. Klon R1 visar enligt inhibitionsresultat från radioimmunanalyser på en mycket större preferens för humanpeptid 1–32 än för nötkreaturspeptid (73-faldig) eller grispeptid (23-faldig). Antikroppen reagerar också ihop med en del av de mångmolekylära former av inhibin som påträffas i såväl nötkreaturs- som humanfollikulära vätskor (1). Försiktighetsåtgärder 1. 2. 3. 4. 5. Förvaring (115467-001) För yrkesanvändning. Denna produkt innehåller natriumazid (NaN3), en kemikalie som är mycket giftig i ren form. I produktkoncentrationer kan natriumazid, trots att det inte klassificeras som farligt, reagera med bly- och kopparrör och bilda successiv uppbyggnad av högexplosiva metallazider. Skölj med stora mängder vatten vid kassering, så att inte metallazider ansamlas i avloppet. I likhet med alla produkter av biologiskt ursprung måste korrekta procedurer användas vid hanteringen. Använd lämplig personlig skyddsutrustning för att undvika kontakt med ögon och hud. Oanvänd lösning måste kasseras i enlighet med lokala och statliga föreskrifter. Förvaras vid 2–8 °C. Får inte användas efter det utgångsdatum som anges på flaskan. Användaren måste validera alla förvaringsförhållanden som avviker från dem som anges i produktbladet. Det finns inga tydliga tecken som indikerar instabilitet hos denna produkt. Därför bör positiva och negativa kontroller analyseras samtidigt med patientprov. Kontakta Dako Teknisk Support, om oväntad färgning observeras, men inte kan förklaras med variationer i laboratorieprocedurerna och om du misstänker att det kan finnas problem med antikroppen. 307131SE_001 sid. 1/3 Provberedning inklusive material som behövs, men inte medföljer Antikroppen kan användas för märkning av formalinfixerade, paraffininbäddade vävnadssnitt. Vävnadsprov ska skäras i cirka 4 µm tjocka snitt. Förbehandling med värmeinducerad epitopåtervinning (HIER) krävs. Optimala resultat erhålls, om vävnaderna förbehandlas med EnVision FLEX Target Retrieval Solution, High pH (10x) (Link) (kod K8000/K8004). Avparaffiniserade snitt: Förbehandling av avparaffiniserade formalinfixerade, paraffininbäddade vävnadssnitt rekommenderas. Använd Dako PT Link (kod PT100/PT101). Bruksanvisningen PT Link ger mer information. Följ den förbehandlingsprocedur som skildrats i stora drag i bipacksedeln till EnVision FLEX Target Retrieval Solution, High pH (10x) (Link) (kod K8000/K8004). Använd följande parametrar för PT Link: Förvärmningstemperatur: 65 °C; epitopåtervinningstemperatur och tid: 97 °C under 20 (±1) minuter; kyl ned till 65 °C. Skölj snitt med spädd rumstemperatur EnVision FLEX Wash Buffer (10x) (Link) (kod K8000). Paraffininbäddade snitt: Som en alternativ provberedning kan såväl avparaffinering som epitopåtervinning utföras i PT Link med hjälp av en modifierad procedur. Se PT Link-bruksanvisning för instruktioner. När färgningsproceduren har utförts, måste snitten dehydreras, klaras och monteras med hjälp av ett permanent monteringsmedium. Låt inte vävnadssnitten torka ut under behandlingen eller under den påföljande immunhistokemiska färgningsproceduren. För bättre vidhäftning av vävnadssnitten till objektglasen rekommenderas användning av Dako Silanized Slides (kod S3003). Färgningsprocedur inklusive material som behövs, men inte medföljer Rekommenderat visualiseringssystem är EnVision FLEX+, Mouse, High pH, (Link) (kod K8002). Färgningsstegen och inkubationstiderna är förprogrammerade i programvaran Autostainer Link. Se vederbörlig bruksanvisning Autostainer Link för mer information om laddning av objektglas och reagenser. Kontakta Dakos tekniska support, om det inte finns några protokoll på den Autostainer-plattform som används. Alla inkubationssteg ska utföras vid rumstemperatur. Optimala förhållanden kan variera beroende på prov- och beredningsmetoder och bör bestämmas av varje enskilt laboratorium. Om den utvärderande patologen vill ha en annan färgningsitensitet, kan en Dakoappliceringsspecialist/teknisk servicespecialist kontaktas för information om omprogrammering av protokollet. Bekräfta att resultatet för det justerade protokollet fortfarande är giltigt genom att utvärdera att färgningsmönstret är identiskt med det färgningsmönster som beskrivs i ”Prestandaegenskaper”. Kontrastfärgning i hematoxylin rekommenderas med EnVision FLEX Hematoxylin (Link) (kod K8008). Icke vattenhaltigt, permanent monteringsmedium rekommenderas. Positiva och negativa kontroller ska köras samtidigt med hjälp av samma protokoll som för patientprov. Den positiva kontrollvävnaden ska innehålla såväl Leydig-celler som Sertoli-celler, och cellerna/strukturerna ska visa reaktionsmönster i likhet med dem som beskrivs för denna vävnad i ”Prestandaegenskaper” i alla positiva prov. Rekommenderad negativ kontrollreagens är FLEX Negative Control, Mouse (Link) (kod IR750). Tolkning av färgningen Det cellulära färgningsmönstret är cytoplasmiskt. Prestandaegenskaper Normala vävnader: Inhibin α-expression fastställd av immunhistokemi påträffas i de flesta gonadala könsbundna navelsträngsstromala beståndsdelar. Immunreaktiva beståndsdelar omfattar follikulära granulosaceller och teka interna i äggstocken, testikulära Sertoli- och Leydig-celler samt luteiniserade teka- och hilumceller (2). Antiinhibin α, klon R1 påvisade stark immunreaktivitet i zona reticularis (nätbältet) i den normala binjurebarken, svagare immunreaktivitet i zona fasciculata (strängbältet) och reagerade inte alls på celler i zona glomerulosa (nätbältet) (4). I normal bröstvävnad observerades inhibin α-expression i duktala och lobulära epitelceller, men inte i myoepitelceller (5). Somatrofa celler i hypofysen (6) påträffades också positiva med immunhistokemi. Ingen positiv immunfärgning har observerats i några endokrina celler i bukspottskörteln eller mag-/tarmkanalen, inklusive celler i fundus, antrum, duodenum, jejunum, os ilium, appendix eller rektum (6). Onormala vävnader: Inhibin α-expression i hyperplastisk binjurebark var starkt positiv i zona reticularis (nätbältet), svagt positiv i zona fasciculata (strängbältet) och negativ i zona glomerulosa (nätbältet) samt i binjuremärgceller. I adrenokortikala adenomer var inhibin α–expressionen svag och fokal, men stark i alla viriliserande tumörer. Inhibin α-expression varierade i adrenokortikala karcinomer oavsett hormonell aktivitet, de var antingen starkt positiva eller helt negativa. På det hela taget var den zonspecifika expressionen av inhibin α hög i androgenproducerande adrenokortikala celler (4). I abnorma bröstvävnader påvisade anti-inhibin α måttlig till starkt positiv immunreaktivitet i de epitelcellerna i godartade neoplasmer, kraftigt positiv immunreaktivitet i apokrina epitelceller vid fibrocystisk sjukdom och svag till måttligt positiv immunreaktivitet i epitelneoplastiska celler såväl som positiv immunreaktivitet i endotelceller vid elakartade lesioner (5). Ett fall av granulosacelltumör i centrala nervsystemet (CNS) påvisade positiv reaktivitet med anti-inhibin α, klon R1. I sjuttio endokrina tumörer från olika ställen i det gastroenteropankreatiska systemet påträffades positiv immunreaktivitet med anti-inhibin α, klon R1 i sällsynta celler i sju av de sjuttio tumörerna. Positiv immunreaktivitet påvisades i en av en G-cellsgastinom i duodenum, i en av två G-cellsgastinomer i bukspottskörteln, i två av tre VIP-omer i bukspottskörteln, i en av en odefinierad celltumör i jejunum och bukspottskörteln och i en av en A/D-celltumör i bukspottskörteln. För övrigt påvisade anti-inhibin α negativ immunreaktivitet i resterande tumörer av varierande celltyper som testats i duodendum och bukspottskörteln, såväl som i blindtarmen, os ileum, rektum, höger kolon och mage (6). I abnorma äggstocksvävnader har inhibin α påvisats som en känslig markör för majoriteten av navelsträngsstromala tumörer (SCST). Baserat på en enkät i aktuell litteratur (2) förekommer immunreaktiv inhibin α i nästan 100 % av tumörcellerna i granulosacelltumörer, Leydig celltumörer, Sertoli-Leydig celltumörer, Sertoli celltumörer, steroida celltumörer, könsbundna navelsträngstumörer och gynadroblastomer. Anti-inhibin α (115467-001) 307131SE_001 sid. 2/3 färgar de könsbundna navelsträngarna i gonadoblastomer och oklassificerade könsbundna navelsträngsstromala tumörerna med ett par undantag. Sertoli-cellbeståndsdelen i SCST har ibland emellertid rapporterats reagera negativt på inhibin α-expression. Inhibin α uttrycks också i majoriteten av luteiniserade stromala celler eller tekaluteinliknande celler i tekoman, fibrotekoman, stromala luteomer, fibromer, sklerosstromala tumörer, stromala hyperplasier och hyperteokos. Expression av inhibin α har även observerats i luteiniserade stromala eller lekaluteinliknande celler inuti stroman i ovariala epiteltumörer och ovariala metastaskarcinomer (2). Vid tester av olika ovariala abnorma vävnader med anti-inhibin α, klon R1, påvisades immunreaktivitet hos sjuttiosju av åttio granulosa celltumörer, alla tolv Sertoli-Leydig-tumörer, båda retiforma undertyper av Sertoli-Leydig-celltumörer, båda Sertoli-tumörer, båda gynadroblastomer, nio av arton tekoman och alla sex steroidcellstumörer (3, 7). Femton av arton fall av testikulär könsbunden navelsträngsstromal tumör testades med inhibin α R1 och påvisade positiv immunreaktivitet (2). Alla fibromer, myxomer, skleroserande stromala tumörer, olika karcinomer, könscellkarcinomer, småcelliga karcinomer, lymfoner och malign vävnad i lågt differentierad prostatacancer påvisade negativ tumörimmunreaktivitet med anti-inhibin α-antikroppar (3, 7, 8). Litteraturhänvisningar 1. 2. 3. 4. 5. 6. 7. 8. Groome N, Hancock J, Betteridge A, Lawrence M, Craven R. Monoclonal and polyclonal antibodies reactive with the 1–32 amino terminal sequence of the alpha subunit of human 32K inhibin. Hybridoma 1990; 9(1):31 Zheng W, Lauchlan SC. Inhibin and activin: their roles in ovarian tumorigenesis and their diagnostic utility in surgical pathology practice. Applied Immuno & Mol Morph 1999; 7(1):29 Costa MJ, Ames PF, Walls J, Roth LM. Inhibin immunohistochemistry applied to ovarian neoplasms: a novel, effective, diagnostic tool. Human Path 1997; 28(11):1247 Arola J, Liu J, Heikkilä P, Voutilainen R, Kahri A. Expression of inhibin α in the human adrenal gland and adrenocortical tumors. Endo Res 1998; 24(3&4):865 Di Loreto C, Reis FM, Cataldi P, Zuiani C, Luisi S, Beltrami CA, Petraglia F. Human mammary gland and breast carcinoma contain immunoreactive inhibin/activin subunits: evidence for a secretion into cystic fluid. European J of Endo 1999; 141:190 La Rosa S, Uccella S, Billo P, Facco C, Fausto S, Capella C. Immunohistochemical localization of α- and ßA-subunits of inhibin/activin in human normal endocrine cells and related tumors of the digestive system. Virchows Arch 1999; 434:29 Matias-Guiu X, Pons C, Prat J. Mullerian inhibiting substance, alpha-inhibin, and CD99 expression in sex cord-stromal tumors and endometrioid ovarian carcinomas resembling sex cord-stromal tumors. Human Path 1998; 29(8):840 Mellor SL, Richards MG, Pedersen JS, Robertson DM, Risbridger GP. Loss of the expression and localization of inhibin α-subunit in high grade prostate cancer. J of Clin Endocrinol and Metab 1998; 83(3):969 Upplaga 09/07 (115467-001) 307131SE_001 sid. 3/3