1 Omeprazol Actavis 10 mg enterokapsel, hård Omeprazol
advertisement

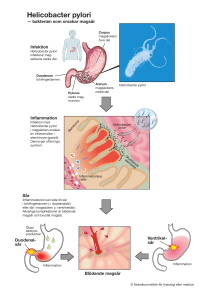
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Omeprazol Actavis 10 mg enterokapsel, hård Omeprazol Actavis 20 mg enterokapsel, hård Omeprazol Actavis 40 mg enterokapsel, hård 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING Varje kapsel innehåller 10 mg, 20 mg eller 40 mg omeprazol. Hjälpämnen: sackaros För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM Enterokapsel, hård 10 mg: opak gul kapsel 20 mg: opak gul kapsel 40 mg: opak blå och vit kapsel 4 KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer - Duodenalsår - Benigna ventrikelsår - Refluxesofagit - Profylaktisk behandling av refluxesofagit. - Zollinger-Ellisons syndrom - Behandling av NSAID-relaterade ventrikelsår och duodenalsår - Profylaktisk behandling av NSAID-relaterade ventrikelsår och duodenalsår. - Symtomatisk behandling av gastroesofageal refluxsjukdom. - I kombination med antibiotika för eradikering av Helicobacter pylori hos patienter med peptiska sår orsakade av Helicobacter pylori (se avsnitt 4.2) 4.2 Dosering och administreringssätt Duodenalsår: Vanlig dos är 20 mg en gång dagligen under 2-4 veckor. Benigna ventrikelsår: Vanlig dos är 20 mg en gång dagligen under 4-(6)-8 veckor. Refluxesofagit: Vanlig dos är 20 mg en gång dagligen under 4-8 veckor. Notera att duodenalsår, benigna ventrikelsår och refluxesofagit i enstaka fall kan behandlas med 40 mg omeprazol en gång dagligen. Duodenalsår och benigna ventrikelsår ska endast behandlas med omeprazol i monoterapi om Helicobacter pylori-eradikering inte är indicerat eller har misslyckats. Profylaktisk behandling av refluxesofagit: Vanlig dos är 10-20 mg beroende på det kliniska svaret. Zollinger-Ellisons syndrom: Dosen bör avpassas individuellt och behandlingen bör fortsätta så länge behov kvarstår. Rekommenderad initial dos är 60 mg en gång dagligen. Vid doseringar över 80 mg dagligen bör dosen fördelas på två doseringstillfällen. Hos patienter med Zollinger-Ellisons syndrom är behandlingen inte tidsbegränsad. Behandling av NSAID-relaterade ventrikelsår och duodenalsår: Vanlig dos är 20 mg dagligen under 4-8 veckor. Profylaktisk behandling av NSAID-relaterade ventrikelsår och duodenalsår: Vanlig dos är 20 mg dagligen. Symtomatisk behandling av gastroesofageal refluxsjukdom: Vanlig dos är 10-20 mg dagligen beroende på det kliniska svaret. Behandlingstiden är 2-4 veckor. Om symtomen inte gått tillbaka efter 2 veckors behandling ska patienten undersökas vidare. Eradikering av Helicobacter pylori: Patienter med peptiska sår orsakade av Helicobacter pylori ska behandlas med antibiotika för att eradikera Helicobacter pylori. Valet av behandlingsregim bör baseras på patientens tolerabilitet och terapeutiska rekommendationer. Följande kombinationer har studerats: - Omeprazol 20 mg, amoxicillin 1000 mg och klaritromycin 500 mg tas tillsammans två gånger dagligen. - Omeprazol 20 mg, klaritromycin 250 mg och metronidazol 400-500 mg tas tillsammans två gånger dagligen. Behandlingstiden för eradikering är som regel 1 vecka. För att undvika resistensutveckling ska behandlingstiden inte förkortas. Hos patienter med aktiva sår kan behandlingen fortsättas med omeprazol i monoterapi i enlighet med doseringsangivelserna ovan. Nedsatt njurfunktion: Dosjustering är inte nödvändig för patienter med nedsatt njurfunktion. Nedsatt leverfunktion: Den dagliga dosen bör inte överstiga 20 mg hos patienter med nedsatt leverfunktion. Äldre: Dosjustering är inte nödvändig för äldre patienter. Administreringssätt: Kapslarna sväljes med ett glas vätska. Kapslarna intas före måltid (t ex frukost eller middag) eller på fastande mage. Kapslarna får inte tuggas eller krossas. Till patienter med sväljningssvårigheter som kan svälja halvfast föda Kapslarna kan öppnas och innehållet kan suspenderas i en matsked juice. Suspensionen ska intas direkt. 4.3 Kontraindikationer Överkänslighet mot det aktiva innehållsämnet eller mot något hjälpämne. Hos patienter med nedsatt leverfunktion är kombinationsbehandling med klaritromycin kontraindicerat. Omeprazol är kontraindicerat hos patienter som tar atazanavir (se avsnitt 4.5) 4.4 Varningar och försiktighet Patienter med peptiska sår bör utredas för Helicobacter pylori. Patienter som är Helicobacter pylori positiva ska om möjligt behandlas för att eradikera bakterien. Vid misstänkt ventrikelsår ska malignitet uteslutas innan behandling med omeprazol påbörjas eftersom behandling kan dölja symtom och fördröja diagnosen. Diagnosen refluxesofagit ska bekräftas endoskopiskt. Misstänkt ulcussjukdom ska tidigt i sjukhistorien objektivt verifieras med röntgen eller endoskopi för undvikande av inadekvat behandling. Eftersom remissionsfrekvensen vid långtidsbehandling av endoskopiskt verifierade esofagiter är lägre hos patienter behandlade med omeprazol 10 mg än hos dem som behandlats med 20 mg dagligen, bör patienter som behandlas med 10 mg dagligen följas regelbundet med endoskopi. Sänkt surhetsgrad i magsäcken, även orsakat av protonpumpshämmare, ökar det normala bakterieantalet i mag-tarmkanalen. Behandling med syrareducerande läkemedel kan leda till en något ökad risk för gastrointestinala infektioner såsom Salmonella och Campylobacter. Hos patienter med gravt nedsatt leverfunktion ska leverenzymvärdena kontrolleras regelbundet under behandlingen med omeprazol. Detta läkemedel innehåller sackaros. Patienter med de sällsynta ärftliga sjukdomarna fruktosintolerans, glukos-galaktosmalabsorption eller sukras-isomaltasinsufficiens ska inte använda detta läkemedel. För att förbättra effekten av behandling av NSAID-relaterade peptiska sår bör möjligheten att avsluta behandlingen med den orsakande substansen starkt övervägas. Profylaktisk behandling av NSAID-relaterade peptiska sår bör begränsas till högriskpatienter. Säkerhetsdata för behandlingstider över ett år är begränsad. En nytta-/riskutvärdering bör därför genomföras regelbundet av läkare när behandlingstiden överstiger ett år. Vid kombinationsbehandling (NSAID-relaterade peptiska sår eller eradikering av Helicobacter pylori) krävs försiktighet eftersom administrering av ytterligare läkemedel kan addera eller potentiera antalet interaktioner (se 4.5 Interaktioner med andra läkemedel och övriga interaktioner). Försiktighet krävs vid kombinationsbehandling hos patienter med nedsatt lever- eller njurfunktion (se 4.2 Dosering och administreringssätt). Omeprazol ska inte användas till barn under 2 år. Enstaka fall av blindhet och dövhet har rapporterats när omeprazol injicerats, detta har dock aldrig setts för oralt administrerat omeprazol. Hos svårt sjuka patienter rekommenderas därför kontroll av syn och hörsel. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Läkemedel med pH-beroende absorption Atazanavir Samtidig administrering av omeprazol (40 mg 1 gång dagligen) och atazanavir 300 mg/ritonavir 100 mg till friska frivilliga resulterade i en påtaglig minskning i total exponering av atazanavir (cirka 75 % minskning av AUC, Cmax och Cmin). En ökning av atazanavirdosen till 400 mg kompenserade inte för den effekt som omeprazol hade på exponeringen av atazanavir. Protonpumpshämmare inklusive omeprazol ska därför inte administreras samtidigt med atazanavir (se avsnitt 4.3). Ketokonazol och itrakonazol Ketokonazols och itrakonazols absorption från mag-tarmkanalen ökar i närvaro av magsyra. Medicinering med omeprazol kan leda till att ketokonazol- och itrakonazolnivåerna minskar till under terapeutisk nivå. Kombinationen bör därför undvikas. Digoxin Samtidig behandling med omeprazol och digoxin hos friska frivilliga, ledde till en tioprocentig ökning av digoxins biotillgänglighet. Läkemedel som metaboliseras av CYP2C19 och CYP2C9 (inklusive warfarin och fenytoin) Omeprazol hämmar CYP2C19 och CYP2C9 och kan därför ge ökade plasmakoncentrationer för andra läkemedel som metaboliseras av dessa enzymer tex diazepam, fenytoin, warfarin (R-warfarin, den mindre aktiva formen). Monitorering rekommenderas vid vid in- eller utsättning av omeprazol till patienter som behandlas med fenytoin, warfarin eller andra kumarin-derivat. Andra läkemedel som kan vara berörda är hexobarbital, citalopram, escitalopram, imipramin, klomipramin m.fl. Vorikonazol Omeprazol (40 mg dagligen) ökade Cmax och AUC för voriconazol (CYP2C19-substrat) med 15% respektive 41%. Voriconazol ökade AUC för omeprazol med 280%. Vid samtidig behandling bör dosjustering av omeprazol övervägas för patienter med väsentligt nedsatt leverfunktion och vid långtidsbehandling. Disulfiram Omeprazol kan hämma disulfirams hepatiska metabolism. Ett fåtal isolerade fall av muskelrigiditet, som möjligen kan relateras till detta, har rapporterats. Ciklosporin Det finns motstridiga uppgifter om interaktion mellan omeprazol och ciklosporin. Ciklosporinnivåerna i plasma bör därför kontrolleras hos de patienter som också behandlas med omeprazol, på grund av en möjlig ökning av ciklosporinnivåerna. Klaritromycin Omeprazols och klaritromycins plasmakoncentrationer ökar vid samtidig administrering. Omeprazol kan sänka den orala absorptionen av vitamin B12. Detta bör beaktas vid långvarig omeprazolbehandling hos patienter med en låg normalnivå av B12. Det finns inga tecken på interaktioner mellan omeprazol och koffein, propranolol, teofyllin, metoprolol, lidokain, kinidin, fenacetin, östradiol, amoxicillin, budesonid, diklofenak, metronidazol, naproxen, piroxikam eller antacida. Omeprazolabsorptionen påverkas inte av alkohol. 4.6 Graviditet och amning Begränsade epidemiologiska studier indikerar inga negativa effekter under graviditet eller ökad allmän missbildningsfrekvens. Informationen om specifika missbildningar är dock otillräcklig. Hos råtta passerar omeprazol och dess metaboliter över i bröstmjölk. Erfarenheten av exponering till barn via bröstmjölk är begränsad. Omeprazolkoncentrationen i bröstmjölk hos människa når ca 6 % av moderns maximala koncentrationer. Användning av omeprazol under graviditet och amning kräver en noggrann nytta/riskavvägning. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Inga studier har utförts. Biverkningar som dåsighet, trötthet och synstörningar kan dock förekomma (se avsnitt 4.8). Vid dessa tillstånd kan förmågan att köra bil och använda maskiner vara nedsatt. 4.8 Biverkningar Biverkningsfrekvens definieras: Mycket vanliga (>1/10) Vanliga (>1/100, <1/10) Mindre vanliga (>1/1000, <1/100) Sällsynta (>1/10000, <1/1000) Mycket sällsynta (<1/10000 inklusive enstaka fall) Blod och lymfsystemet Sällsynta: Hypokrom mikrocytisk anemi hos barn Mycket sällsynta: Förändrade blodvärden, reversibel trombocytopeni, reversibel leukopeni eller reversibel pancytopeni och agranulocytos. Immunsystemet Mycket sällsynta: Urtikaria, förhöjd kroppstemperatur, angioödem, bronkokonstriktion eller anafylaktisk chock, allergisk vaskulit, feber Centrala och perifera nervsystemet Vanliga: Somnolens, sömnstörningar (insomnia), vertigo, huvudvärk, trötthet. Dessa symtom minskar normalt under behandlingens gång. Sällsynta: Parestesi, yrsel, förvirring, hallucinationer. DE två sistnämnda förekommer främst hos svårt sjuka eller äldre patienter. Mycket sällsynta: Agitation, depression. Dessa reaktioner förekommer främst hos svårt sjuka eller äldre patienter. Ögon Mindre vanliga: Synstörningar (dimsyn, förlorad synskärpa, minskat synfält). Dessa tillstånd försvinner normalt efter att behandlingen avslutats. Öron och balansorgan Mindre vanliga: Hörselpåverkan (t ex tinnitus). Dessa tillstånd försvinner normalt efter att behandlingen avslutats Magtarmkanalen Vanliga: Diarré, förstoppning, flatulens (eventuellt med magsmärtor), illamående, kräkningar. I flertalet fall förbättras symtomen efterhand som behandlingen fortskrider. Mindre vanliga: Smakförändringar. Dessa tillstånd försvinner normalt efter att behandlingen avslutats. Sällsynta: Brunsvart missfärgning av tungan vid samtidig administrering av klaritromycin, benigna glandulära cystor. Båda biverkningarna är reversibla efter att behandlingen avslutats. Mycket sällsynta: Muntorrhet, stomatit, candidiasis, pankreatit. Lever och gallvägar Mindre vanliga: Förändrade leverenzymvärden. Värdena normaliserades efter att behandlingen avslutats. Mycket sällsynta: Hepatit med eller utan gulsot, leversvikt, encefalopati hos patienter med existerande leversjukdom. Hud och subkutan vävnad Mindre vanliga: Pruritus, hudsprickor, alopeci, erythema multiforme, fotosensibilitet, ökad svettning, dermatit. Mycket sällsynta: Stevens-Johnsons syndrom, toxisk epidermal nekrolys. Muskuloskeletala systemet och bindväv Sällsynta: Muskelsvaghet, myalgi, ledsmärta. Njurar och urinvägar Mycket sällsynt: Nefrit (interstitiell nefrit). Allmänna symtom Mindre vanliga: Perifert ödem. Symtomen försvann efter att behandlingen avslutats. Mycket sällsynta: Hyponatremi, gynekomasti. 4.9 Överdosering Inga fall av överdosering har rapporterats. Enstaka höga orala doser, upp till 160 mg/dag, dagliga doser upp till 400 mg, enstaka intravenösa doser upp till 80 mg, dagliga intravenösa doser upp till 200 mg eller 520 mg under 3 dagar har tolererats utan negativa effekter. 5 FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Protonpumpshämmare ATC-kod: A02BC01 Omeprazol (substituerad benzimidazol) är en protonpumpshämmare, d.v.s. omeprazol har en direkt dosberoende hämmande effekt på enzymet H+, K+-ATPas som reglerar magsyrasekretionen i magsäckens parietalceller. På grund av denna selektiva intracellulära verkningsmekanism och den låga affiniteten för andra membranbundna receptorer (som histamin-H2, muskarin-M1 eller gastrinreceptorer) har omeprazol definierats som en egen typ av syrahämmande läkemedel som blockerar det sista steget i syraproduktionen. Omeprazols verkningsmekanism orsakar hämning av både basal och stimulerbar syrasekretion, oberoende av stimuleringstyp. Omeprazol ökar därmed pH-värde och reducerar magsyrasekretion. Prodrugen omeprazol är en svag bas som ackumuleras i den sura miljön i parietalcellerna. Prodrugen aktiveras först efter att ha protoniserats och rearrangerats och hämmar sedan H+ , K+-ATPas. I en sur miljö med pH <4 konverteras den protoniserade omeprazolmolekylen till den aktiva substansen omeprazolsulfenamid. Omeprazolsulfenamiden stannar längre i cellerna jämfört med omeprazolbasens halveringstid i plasma (se 5.2 Farmakokinetiska uppgifter). Omeprazols höga specificitet förklaras av att ett tillräckligt lågt pH-värde bara återfinns i magsäckens parietalceller. Det är omeprazolsulfenamid som binder till enzymet och hämmar dess aktivitet. Om enzymsystemet hämmas ökar pH-värdet och mindre omeprazol ackumuleras, därmed kommer mindre omeprazol att konverteras i parietalcellerna. Ackumulering av omeprazol är på detta sätt reglerad av en återkopplingsmekanism. Vid långvarig användning orsakar omeprazol en måttlig gastrinökning på grund av syrahämningen. En liten till måttlig ökning av ECL-celler ses vid långvarig behandling. Karcinoider har setts i djurexperiment (se 5.3 Prekliniska säkerhetsuppgifter) men inte ännu i människa. Flertalet kontrollerade kliniska studier indikerar att omeprazol 20 mg två gånger dagligen i kombination med två antibiotika under en vecka åstadkommer en >80 % eradikering av Helicobacter pylori hos patienter med peptiska sår. Som väntat sågs signifikant lägre eradikeringsgrad i patienter med metronidazolresistent Helicobacter pylori. Lokal information om resistensprevalens och lokala terapeutiska rekommendationer bör beaktas vid valet av kombinationsbehandling. I de fall där infektionen inte läker ut bör risken för att patienten utvecklat sekundär resistens (hos primärt känsliga stammar) beaktas när fortsatt behandling bedöms. Klinisk erfarenhet indikerar att återfallsfrekvensen i duodenalsår och troligen även ventrikelsår efter en lyckad eradikering av Helicobacter pylori är exceptionellt låg jämfört med det normala sjukdomsförloppet. 5.2 Farmakokinetiska egenskaper Absorption Omeprazol är inte syrastabilt och administreras oralt som enterodragerade granulat i en hård gelatinkapsel. Absorptionen sker i tunntarmen. Maximal plasmakoncentration nås inom 1-3 timmar efter administrering av omeprazol. Distribution Omeprazols distributionsvolym är relativt låg (0,3 l/kg kroppsvikt), vilket motsvarar extracellulärvätskans volym. Proteinbindningsgraden är ca 95 %. Elimination Omeprazol metaboliseras fullständigt, huvudsakligen av CYP2C19 i levern. Efter intravenös administrering av 40 mg omeprazol under 5 dagar ökade den absoluta biotillgängligheten med 50 %. Det kan förklaras med nedsatt hepatisk clearance på grund av att CYP2C19-enzymet mättas. Sulfon-, sulfid- och hydroxiomeprazol har hittats i plasma. Dessa metaboliter har ingen signifikant effekt på syrasekretionen. Omkring 20 % av given dos utsöndras i faeces och 80 % utsöndras i urin som metaboliter. De två huvudsakliga metaboliterna i urin är hydroxiomeprazol och dess korresponderande karboxylsyra. Halveringstiden i plasma är ca 40 minuter och totalt plasmaclearance 0,3-0,6 l/min. Förhållandet mellan plasmakoncentration och effekt Omeprazol ackumuleras som en svag bas i den sura miljön i parietalcellernas intracellulära kanalsystem. I den sura miljön protoniseras omeprazol och konverteras till den aktiva substansen omeprazolsulfenamid. Den aktiva substansen binder kovalent till protonpumpen (H+, K+-ATPas) på parietalcellernas yta och hämmar dess aktivitet. Hämningen består därför väsentligt längre än den tiden omeprazolbasen är närvarande i plasma. Graden av hämning av syrasekretionen är direkt korrelerad till AUC men inte vid någon tidpunkt till plasmakoncentrationen. Särskilda patientgrupper Äldre Biotillgängligheten är något förhöjd och eliminationshastigheten något sänkt för omeprazol hos äldre. De individuella värdena är dock nästan identiska med unga friska personers värden. Det finns inga tecken på att tolerabiliteten hos äldre personer är reducerad vid normala doser. Barn När barn från två års ålder behandlas med rekommenderad dos, är plasmakoncentrationerna i nivå med dem hos vuxna. Hos barn under sex månaders ålder är omeprazolclearence lägre på grund av dålig förmåga att metabolisera omeprazol. Nedsatt njurfunktion Hos patienter med nedsatt njurfunktion är kinetiken mycket lik den hos friska personer. Den renala eliminationen är dock den huvudsakliga eliminationsvägen för metaboliserad omeprazol och eliminationshastigheten är därmed reducerad i motsvarande grad som njurfunktionen är nedsatt. Om omeprazol ges en gång dagligen kan ackumulering undvikas. Nedsatt leverfunktion Hos patienter med kronisk leversjukdom reduceras omeprazols clearance, varvid halveringstiden i plasma kan ökas till ca 3 timmar. Biotillgängligheten kan då vara över 90 %. 20 mg omeprazol två gånger dagligen under 4 veckor tolereras väl och ingen ackumulering av omeprazol eller dess metaboliter sågs. Långsamma metaboliserare – CYP2C19 Hos en liten grupp patienter (långsamma metaboliserare med avseende på CYP2C19) har en reducerad eliminationshastighet setts. Halveringstiden för den slutgiltiga eliminationen kan i dessa fall vara omkring tre gånger längre än normalt och arean under plasmakoncentrationskurvan (AUC) kan öka upp till tio gånger. 5.3 Prekliniska säkerhetsuppgifter Gängse studier avseende allmäntoxicitet visade inte några risker för okända biverkningar hos människa. ECL-cellshyperplasi och karcinoider har observerats vid långtidsstudier på råtta som behandlats med omeprazol eller som utsatts för partiell fundektomi. Dessa avvikelser orsakas av sekundär hypergastrinemi som följer efter syrahämning. I mutagena studier (in vitro och in vivo) sågs inga kliniskt relevanta effekter. 6 FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Kapselinnehåll: sockersfärer (sackaros, majsstärkelse, vatten) Metakrylsyra-etylakrylatsampolymer (1:1) dispersion hypromellos talk mannitol makrogol titandioxid (E171) polysorbat dinatriumfosfat, vattenfritt natriumlaurylsulfat Kapselskal (10 mg och 20 mg): gelatin vatten titandioxid (E171) kinolingul (E104) Kapselskal (40 mg): gelatin vatten titandioxid (E171) indigokarmin (E132) 6.2 Inkompatibiliteter Ej relevant. 6.3 Hållbarhet HDPE-burk: 3 år Blisterförpackning (10 mg): 18 månader Blisterförpackning (20 mg och 40 mg): 3 år 6.4 Särskilda förvaringsanvisningar HDPE-burk: Förvaras i originalförpackningen. Förvaras vid högst 30ºC. Blisterförpackning: Förvaras i originalförpackningen. Förvaras vid högst 25ºC. 6.5 Förpackningstyp och innehåll Aluminium/aluminiumblister (med PVC-film): 7, 14, 15, 28, 30, 50, 56, 60, 90, 98, 100, 140, 280, och 500 kapslar HDPE-burk med PP-lock (innehållande kiselgel som torkmedel): 7, 14, 28, 30, 56, 60, 90, 100 och 500 kapslar Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras. 6.6 Särskilda anvisningar för destruktion och övrig hantering Inga särskilda anvisningar. 7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Actavis Group hf. Reykjavikurvegi 76-78 IS-220 Hafnarfjordur Island 8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 10 mg: 21834 20 mg: 21835 40 mg: 21836 9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE 2008-05-30 10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 2008-11-26