Svar till instuderingsfrågor kap 14
advertisement

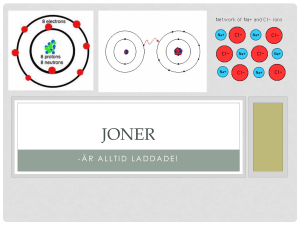
Svar till instuderingsfragor kap 14 14.1 Atomens delar 1. 2. 3. 4. 5. Kärnan: Proton och Neutron, Skal: Elektroner Antal protoner Proton (+), Neutron (0) och Elektron (-) Lika många protoner som elektroner Olika laddningar dras mot varande och elektronernas rörelse runt kärnan förhindrar att elektronerna inte dras mot kärnan 6. Likheter: Cykliska omloppsbanor och skillnader: Laddningar 14.2 Periodiska systemet 1. 2. 3. 4. 5. 6. 7. 8. Dimitrij Medelejev (1834-1907) Anger positionen i PS samt antalet protoner PERIOD (vågrät) och GRUPP (lodrät) Elektronskal omger atomkärnan och innehåller elektronerna och de yttersta elektronerna kallas för valenselektroner Samma antal valenselektroner och reagerar därför likartat med andra ämnen De 20 första grundämnesbeteckningarna skall kunnas! Se HISTORIA på sid. 292! Samma antal skal 14.3 Molekylbindning 1. Ämnen som gärna delar sina valenselektroner med ett annat ämne för att få fulla skal, t ex delas två elektroner i en H2 –molekyl 2. När en atom fått sitt yttersta skal fullt av elektroner, då liknar den en ädelgas 3. Två eller flera ämnen delar på elektroner för att få fullt yttersta skal 4. En syreatom saknar två elektroner (GRUPP 16) i sitt yttersta skal och vill därför dela dessa två med en annan syreatom och bildar på så sätt en dubbelbindning 14.4 Jonbindning och metallbindning 1. Laddad atom 2. Jonbindningen är en svagare bindning, de bildar sk. kristaller och leder elektrisk ström 3. I en metallbindning släpper all atomer ifrån sig sina valenselektroner som delas av alla atomer i ett metallföremål 4. Metaller och väte (till vänster i PS) har få valenselektroner och bildar därför positiva joner medan icke-metallerna (till höger i PS) gärna ta till sig någon extra elektron och bildar negativa joner 5. Hur bra atomen är på att dra till sig elektroner 6. AlCl3, MgCl2 och MgO 7. Socker är en molekyl och avger inga fria joner i en vattenlösning 14.5 Neutroner, isotoper och atommassor 1. 2. 3. 4. 5. Neutroner Samma grundämne fast med olika antal neutroner i sin kärna Isolera och hålla samman de positiva protonerna i kärnan En viss given mängd, 6*1023 st, av ett visst ämne C + 4H CH4 n = 1 mol C MC = 12,0 g/mol m = 1 mol *12 g/mol = 12 g n = 4 mol H MH = 1 g/mol m = 4 mol *1 g/mol = 4 g