Coldyx citron lozenge SmPC
advertisement

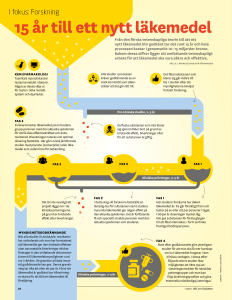
PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Coldyx citron 3 mg sugtablett. 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En sugtablett innehåller 3 mg bensydaminhydroklorid motsvarande 2,68 mg bensydamin. Hjälpämnen med känd effekt: 2,46 g isomalt (E 953) och 3,4 mg aspartam (E 951). För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3 LÄKEMEDELSFORM Sugtablett. Storlek: cirka 18-20 mm x 7,1–7,9 mm. Gula, runda sugtabletter. 4 KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Coldyx citron är indicerat för korttidsbehandling av lokala smärttillstånd i munhåla och svalg hos vuxna och barn över 6 år. Om ingen effekt uppnås eller om symtomen förvärras bör läkare rådfrågas efter 3 dagar. 4.2 Dosering och administreringssätt Dosering Vuxna och barn från 6 år: En sugtablett 3 gånger dagligen. Behandlingen ska inte pågå under mer än 7 dagar. Pediatrisk population Barn 6-11 år: Läkemedlet ska ges under överinseende av en vuxen person. Rekommenderas ej till barn under 6 år. Läkemedlet inte ges till barn under 6 år på grund av dess läkemedelsform. Administreringssätt För orofaryngeal användning. Sugtabletten ska smälta långsamt i munnen. Ska inte sväljas hel eller tuggas. 4.3 Kontraindikationer Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1. 4.4 Varningar och försiktighet Bensydamin bör inte användas av patienter som er överkänsliga mot acetylsalicylsyra eller andra NSAID. Bronkospasm kan uppkomma hos patienter som har eller har haft bronkialastma. Därför ska försiktighet iakttas hos dessa patienter. Hos et fåtal patienter, kan sårbildning i mun/svalg för orsakas av allvarliga sjukdomar. Patienter, vars symtom försämras eller inte förbättras inom 3 dagar, har feber eller andra symptom måste därför rådfråga läkare eller tandläkare. Läkemedlet innehåller aspartam, som är en fenylalaninkälla, och kan vara skadligt för personer med fenylketonuri. Läkemedlet innehåller isomalt. Patienter som lider av det sällsynta, ärftliga tillståndet fruktosintolerans bör därför inte ta detta läkemedel. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Inga interaktionsstudier har utförts på människa. 4.6 Graviditet och amning Adekvat data från behandling av gravida och ammande kvinnor med bensydamin saknas. Utsöndring i bröstmjölk har inte studerats. Djurstudier är ofullständiga gällande effekter under graviditet och amning (se avsnitt 5.3). Den potentiella risken för människa är okänd. Coldyx citron ska inte användas under graviditet eller amning såvida det inte är absolut nödvändigt. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Coldyx citron har ingen effekt på förmågan att framföra fordon och använda maskiner. 4.8 Biverkningar Biverkningarna är listade enligt MedDRA organsystem klassificering och anges i minskande allvarlighetsgrad. Bedömning av biverkningar baseras på följande frekvensgrupper: Mindre vanliga (1/1 000, <1/100) Sällsynta (1/10 000, <1/1 000)´ Mycket sällsynta (<1/10 000) Ingen känd frekvens (kan inte beräknas från tillgängliga data) Immunsystemet Ingen känd frekvens: Andningsvägar, bröstkorg och mediastinum Mycket sällsynta: Magtarmkanalen Sällsynta: Anafylaktiska reaktioner. Överkänslighetsreaktioner. Laryngospasm. Brännande känsla i munnen, muntorrhet. Ingen känd frekvens: Hud och subkutan vävnad Mindre vanliga: Oral hypoestesi och en stickande känsla i munnen. Mycket sällsynta: Angioödem. Fotosensitivitet. Rapportering av misstänkta biverkningar Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till (se detaljer nedan). Läkemedelsverket Box 26 751 03 Uppsala www.lakemedelsverket.se 4.9 Överdosering Inga fall av överdosering har förekommit vid användning av sugtabletterna. Det finns dock mycket sällsynta rapporter om barn som drabbats av excitation, kramper, svettning, ataxi, tremor och kräkningar efter oral administrering av bensydamindoser ca 100 gånger högre än 1 sugtablett. Vid akut överdosering är endast symtomatisk behandling möjlig. Magen ska tömmas genom att framkalla kräkning eller genom magpumpning. Patienten ska sedan hållas under noggrann observation och ges stödjande behandling. Adekvat hydrering måste upprätthållas. 5 FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: andra medel för lokal behandling i munhålan. ATC-kod: A01AD02. Kliniska studier visar att bensydamin är effektiv för att lindra irritationsprocesser i mun och svalg. Dessutom har bensydamin en lätt lokalbedövande effekt. 5.2 Farmakokinetiska egenskaper Absorption och distribution Absorption av bensydamin genom slemhinnorna i mun och svalg har påvisats genom mätbara koncentrationer i plasma. Cirka 2 timmar efter intag av en tablett à 3 mg, observerades ett Cmax på 37,8 ng/ml och ett AUC på 367 ng/ml*tim. Dessa nivåer är emellertid inte tillräckliga för att ge farmakologiska systemeffekter. Eliminering Utsöndringen sker främst i urin, till största delen som inaktiva metaboliter eller konjugat. När bensydamin appliceras lokalt sker ackumulering i de inflammerade vävnaderna, och effektiva koncentrationer uppnås på grund av substansens förmåga att penetrera epitel. 5.3 Prekliniska säkerhetsuppgifter Utvecklingstoxicitet och peripostnatal toxicitet har observerats i reproduktionstoxikologiska studier i råtta och kanin vid plasmakoncentrationer som är mycket högre (upp till 40 gånger) än de som uppmätts efter en enkel terapeutisk dos. Inga teratogena effekter sågs i dessa studier. Tillgängliga kinetiska data tillåter ej bedömning av den kliniska relevansen av de reproduktionstoxikologiska studierna. Eftersom de prekliniska studierna har brister och därför är av begränsat värde, ger de ingen ytterligare information utöver den som redan återfinns i övriga delar av produktresumén. 6 FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Isomalt (E 953) Citronsyramonohydrat (E 330) Aspartam (E 951) Kinolingult (E 104) Citronarom Pepparmyntolja 6.2 Inkompatibiliteter Ej relevant 6.3 Hållbarhet 30 månader. 6.4 Särskilda förvaringsanvisningar Inga särskilda förvaringsanvisningar. 6.5 Förpackningstyp och innehåll PVC/PVDC/ Aluminium blisterförpackning. Förpackning: 10, 12, 20, 24, 30 och 36 sugtabletter. Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras. 6.6 Särskilda anvisningar för destruktion och övrig hantering Inga särskilda anvisningar. 7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Orifarm Generics A/S Energivej 15 5260 Odense S Danmark 8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 53204 9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE Datum för det första godkännandet: 2016-09-29 10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 2017-01-20