Atomen - Periodiska systemet
advertisement

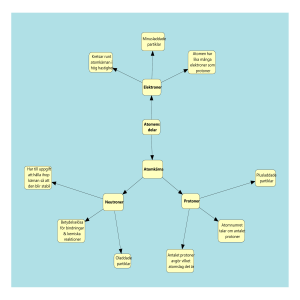
Atomen - Periodiska systemet Kap 3 Att ordna materian Av vad består materian? 400fKr (före år noll) Empedokles: fyra element, jord, eld, luft, vatten Demokritos: små odelbara partiklar ! ------------------------Slutet 1700-talet Det finns olika sorters atomer (15 olika grundämnen kända). -------------------------Början 1800-talet Dalton : små odelbara partiklar. Atomer (atomos – odelbar på grekiska) ------------------------------------ Början 1900-talet Rutherford atomkärna omgiven av elektroner Atommodellens utveckling 1803 1909 1913 1926 Atomen (Tre elementarpartiklar) Partikel Elektron (e) Proton (p) Neutron (n) Laddning (e) massa (kg) massa (u) -1 +1 0 9,11 .10-31 1,673.10-27 1,675.10-27 0,00055 1,0073 1,0087 Atomen (Tre elementarpartiklar) Partikel Elektron (e) Proton (p) Neutron (n) Laddning (e) massa (kg) massa (u) -1 +1 0 9,11 .10-31 1,673.10-27 1,675.10-27 0,00055 1,0073 1,0087 Atomens byggnad - atomkärnan Atomkärnan består av protoner och neutroner Atomnummer Antalet protoner i kärnan atomens atomnummer Atomer med samma atomnummer (antal protoner) tillhör samma grundämne Antalet protoner ger kärnans laddning Masstal En atoms masstal anger antalet partiklar(protoner/neutroner) i atomkärnan. →Masstalet = antalet protoner + antalet neutroner Masstal - exempel Namn Tecken antal neutroner masstal H antal protoner (atomnummer) 1 Väte 0 1 Helium He 2 2 4 Litium Li 3 4 7 Kol C 6 6 12 Masstal Tecken Atomnummer Periodiska systemet 1869 Mendelejev (ryss) Han ordnade grundämnen efter ökande atommassa (periodiska systemet) Mendelejevs tabell Periodiska systemet – grupper och perioder http://www.ptable.com/ Isotoper – samma atomnummer men olika masstal Atom atomnummer Antal protoner antal neutroner masstal väte, 1 1 0 1 deuterium, 1 1 1 2 tritium, 1 1 2 3 helium, 2 2 2 4 kol-12, 6 6 6 12 kol-13, 6 6 7 13 kol-14, 6 6 8 14 klor-35, 17 17 18 35 klor-37, 17 17 20 37 Olika isotoper Kol-12, kol-13, kol-14 Klor-35, klor-37 37 atommassa Atommassa Ett grundämnes ”medelatomsmassa” (medelvärdet av alla isotopers atommassa) Atommassan är siffran under det kemiskatecknet i periodiskasystemet Enhet: u Förekomst av isotoper: Väte-1 (99,9%) , väte-2 / väte-3 (0,1%) Kol-12 (98,9%) , kol-13 (1,1%) och kol-14 (spår) Klor-35 (75,8%) och klor-37 (24,2%) Atommassa: 1.00 u Atommassas: 12,01u Atommassa: 35,45u Atomen: masstal, atomnummer, isotop • Uppgifter sid 39-40 (teori sid 25-31). 301, 306,308-309, 314,315 (fel svar i facit uppgift 301c) • Övningsstencil: atomens byggnad -isotoper Elektronerna Elektronerna Atomen är oladdad → lika många elektroner runt atomkärnan som protoner i kärnan atomkärnan runt kärnan summa laddning Väte: en proton (+1) en elektron (-1) 0 Kol: sex protoner (+6) sex elektroner (-6) 0 Natrium: elva protoner (+11) elva elektroner (-11) 0 Elektronerna i ständig rörelse runt kärnan → ”elektronmoln” Elektronerna befinner sig på bestämda avstånd från kärnan → energinivåer (läs om Bohrs försök s32) Energinivåerna kallas förenklat för → ”elektronskal” ”Elektronskalsmodellen” fungerar fint att använda som modell på gymnasienivå Sammanfattning av Bohrs atommodell och modern atomteori: • Elektronskalen, som kan liknas vid ”skalen på en lök”, numreras inifrån atomkärnan och utåt. ( 1, 2, 3, 4 os v eller ges bokstavsbeteckningarna K, L, M, N osv) • Elektronerna i de olika energinivåerna är olika starkt bundna i atomen. • Starkast bundna är elektronerna i de lägsta energinivåerna (närmast kärnan) Varje ”elektronskal” har bara plats för ett visst antal elektroner Elektronskal K L M N antal e2e8e18e32e- Elektronskalen ”fylls på ” inifrån och ut med ökande atomnummer(antal protoner) Elektronkonfigurationen – elektronernas fördelning runt atomkärnan - ”elektronskalen” har i sin tur egna energinivåer (undernivåer) - K-skalet en energinivå, L-skalet två energinivåer, M-skalet tre energinivåer osv Elektronkonfiguration • Energinivåerna fylls med elektroner, närmast kärnan och utåt, (nerifrån och uppåt) • Den högsta energinivån (yttersta elektronskalet) innehåller valenselektroner som ger ämnet dess kemiska egenskaper • Ädelgaserna har fullt yttre skal eller åtta elektroner i yttre skalet en så kallad oktett. Max 8 st elektroner i det yttersta skalet. • Denna elektronkonfiguration kallas ädelgasstruktur. (Ädelgaserna är reaktionströga-reagerar inte med andra atomer) • Atomradien ökar med antalet skal som innehåller elektroner. Elektronfördelning (elektronkonfiguration) Periodiska systemet – grupper och perioder Ämnen i samma grupp - samma antal valenselektroner Ämnen i samma period -samma antal energinivåer (elektronskal) Grupp antal valenselektroner 1 (Alkalimetaller) 2 (Alkaliska jordartsmetaller) 1 2 17 (Halogener) 18 (Ädelgaser) 7 8 http://www.ptable.com/ Ämnets kemiska egenskaper. Ämnen i samma grupp i det Periodiska systemet har liknade egenskaper (liknade elektronkonfiguration - samma antal valenselektroner) Titta på Na och K i grupp 1 och Mg i grupp 2 hur de reagerar olika med vatten. Demo: www.periodicvideos.com Fortsättning Elektronfördelning(elektronkonfiguration) Max 8 elektroner i det yttersta skalet- varför? Elektronfördelningen….forts Energinivåer i atomen. Lägg märke till att den lägsta energinivån i N-skalet ligger lägre än den högsta energinivån i M-skalet. Därför fylls N-skalets lägsta energinivå med 2 elektroner innan M-skalet fylls helt Elektronkonfiguration 1. Övningsstencil: Periodiska systemet 2. Övningsuppgifter sid 40 i boken: 306,308,309, 311,314,315, 317,318, 319, 322 Uppgift grundämnen Välj två grundämnen nr 1-36 ur det periodiska systemet. Använd dig av följande rubriker. 1.Grundämnets namn, kemiska tecken och byggnad (atomnummer, masstal, elektronkonfiguration, antal valenselektroner) 2.Grundämnets plats i periodiska systemet, Grupp / Period samt grundämnesfamilj 3.Förekomst (var finns ämnet i naturen) 4.Ngn speciell egenskap? (allmänna/kemiska) 5.Ev. biologisk roll (funktion i en levande organism) / annan användning 6.Någon kemiskförening ämnet ingår i. → Sammanfatta fakta om ämnena på ca en halv A4 sida ”ordbehandlad” text. (Skriv inte något ni inte förstår) Dela dokumentet med mig (One drive) Exciterad atom - olika atomer får olika färg • Excitation betyder att energi tillförs en atom så att en elektron "hoppar upp" till ett skal som innehåller mer energi • Energin tillförs genom att en elektron exempelvis absorberar en foton (ljus) , eller krockar med en närliggande atom eller partikel. • Exciterade atomer är mycket instabila. Efter en bråkdel av en sekund hoppar elektronen tillbaka till sitt ”grundskal” varvid den extra energin avges i form av elektromagnetisk strålning (ljus). • Beroende på atomslaget (elektronkofigurationen)så kommer olika våglängder att utsändas (olika färger på ljuset). • Används : identifiera olika ämnen, lysrör, fyrverkeri • Varför sker kemiska reaktioner? • Hur hålls materian ihop? Drivkraften bakom kemiska reaktioner är atomernas strävan att bli stabila → få ”ädelgasskal” d v s en elektronkonfiguration som liknar ädelgaserna (8 valenselektroner) 8 valenselektroner är atomens mest stabila tillstånd (lägst energinivå) (Ädelgaser reagerar inte med andra ämnen – har redan 8 elektroner i yttersta skalet) Atomer strävar efter att få ”ädelgasstruktur” dvs 8 elektroner i det yttersta elektronskalet Hur får ett ämne ädelgasstruktur ? → Genom att reagera med andra atomer Två olika sätt: 1. Atomen ger /får elektroner från en annan atom. Atomerna blir laddade (joner) och bildar jonföreningar. 2. Atomen delar valenselektroner med en annan atom och bildar molekylföreningar. 1. Atomen ger /får elektroner från en annan atom. Atomerna blir laddade (joner) och bildar jonföreningar. Exempel på hur två olika atomer bildar joner och får ädelgasstruktur Elektronformel (Na + Cl → NaCl) Skal: Natriumjon Kloridjon KLM KLM KLM KLM Antal : 2 8 1 287 280 288 Natriumjon + Na+ Kloridjon + Cl - → Natriumklorid → NaCl En positiv jon och en negativ jon dras till varandra och bildar en jonförening. Jonföreningar kallas salter. (saltkristall) 2. Atomen delar valenselektroner med en annan atom och bildar molekylföreningar. Molekylföreningar -atomen delar på valenselektronerna Väte uppnår ädelgasstruktur (Fullt K-skal, 2 valenselektroner, precis som Helium) Molekylförening Kovalent bindning (elektronparbindning) F F2 Elektronformel – valenselektronerna ritas som prickar Grundämnen i samma grupp har liknande egenskaper. Jämför reaktionen mellan alkalimetaller och vatten nedåt i grupp 1: Li, Na, K ( se periodic videos, länk hemsidan) Varför reagerar K kraftigare jmf med Na? Kap 3 ( s 22 - 38); Uppgifter: 305, 311,312, 317, 318, 313,316,322 Extrauppgifter på hemsidan • Fler övningsuppgifter