Uro-Tainer® Polihexanid
advertisement

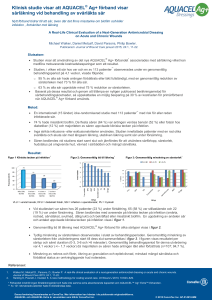
Uro-Tainer® Polihexanid Catheter Maintenance with Uro-Tainer® PHMB Improving Patient Quality of Life A NEW DISCOVERY IN FÖREBYGGER KATETERASSOCIERAD URINARY INFECTION PREVENTION URINVÄGSINFEKTION Edition March 2015 Bakteriekolonisation och kateterassocierade komplikationer Bakteriekolonisation på urinkatetrar beror på biofilmsbildning, som skyddar mikroorganismerna och gör dem svåra att få bort från katetern..28-30 Biofilm har stor inverkan vid kateterassocierade komplikationer. Vad är biofilm? Biofilm uppstår när bakterier fäster till en yta i fuktig miljö genom att utsöndra en tjock, slem- och klisteraktig substans.28 Substansen skapar ett skyddande lager och bakterier kan inte längre lämna ytan; nya bakterier produceras och kolonin växer.28 Biofilmen gör det svårt att få bort bakterierna genom rengöring och den skyddar också bakterierna från yttre påverkan som t ex antibiotika.28,29 En biofilm består vanligtvis av en mix av flera bakteriearter och även andra mikroorganismer (t ex svamp) och skräp.28 Biofilm förekommer i naturlig miljö, i industrimiljö och är vanligt förekommande i sjukhusmiljö, där de fungerar som en källa för infektioner.30 2 Konklusion Polihexanid-lösningen reducerade signifikant grundkoncentrationen av biofilm med 87 % efter 24 timmar. Isotonisk NaCl och Ringers lösning hade ingen reducerande effekt alls på biofilmen. REDUCERAD KONCENTRATION 87% efter 24 timmar Nyckelpunkter: Biofilmsbildning är ett stort bekymmer för patienter som bär kvarliggande kateter då den kan: –fungera som källa till infektioner och ofta är resistent mot antibiotikabehandling och svår att få bort –orsaka enkrustationer och blockering av katetern, vilket kan resultera i kateterbyte Bild 5: Jämförelse mellan olika spollösningars effektivitet på bakteriekolonier (biofilm) Mekanisk spolning är bästa metoden att avlägsna biofilm och regelbunden spolning är nödvändig för att motverka återväxt Biofilm-ekvivalent [EU / ml] 1750 1500 1250 - 87 % 1000 750 500 Lokala antimikrobiella substanser med bredspektra som avdödar hellre än hämmar mikroorganismer bör vara mest lämpliga att använda för mekanisk spolning Polihexanid-lösning har i studier visat sig att signifikant reducera bakteriefylld biofilm jämfört med andra typer av spollösningar, t ex isotonisk NaCl (koksalt) eller Ringers lösning 250 0 Load Taget från: Seipp HM et al.49 Isotonisk NaCl Ringers lösning Polihexanidlösning Exponeringtid 24 timmar Pseudomonas aeruginosa 3 Öppna ytterpåsen och ta ur Uro-Tainer®. Bruksanvisning Uro-Tainer® Polihexanid 100 ml Uro-Tainer® Polihexanid levereras steril och bör inte öppnas och tas ur ytterförpackningen förrän den ska användas. Om så önskas, värm upp till kroppstemperatur genom att sänka ner den i varmt vatten innan ytterförpackningen tas bort. Steg 1 Anslut konnektorn till urinkatetern. Steg 5 Håll Uro-Tainer® ovan urinblåsans nivå, öppna klämman och låt vätskan flöda in av gravitationen. Stäng Uro-Tainer®- slangen med plastklämman. Om vätska rinner ur uretra vid inspolning är det möjligt att katetern inte längre sitter uppe i blåsan och att patienten kan behöva en ny kateter. Om vätskan inte flödar kan katetern vara böjd i blåsan eller blockerad och kan behöva bytas. Steg 2 Administrera med hjälp av gravitation och undvik att kraftigt klämma på påsen. Steg 6 När vätskan har slutat att rinna in (detta tar några minuter), sänk UroTainer® och håll den under urinblåsans nivå för att samla upp vätskan tillbaka i påsen. Ta bort förseglingsringen. Administrera genom aseptisk teknik. Steg 3 Kontraindikationer: Använd inte Uro-Tainer® vid hypersensitivitet för någon av substanserna i lösningen; vid cystit eller andra uro-genitala tillstånd som kan orsaka hematuri (blod i urinen) och ett antal dagar efter kirurgi i blåsan eller urinvägarna. Stäng klämman och ta bort konnektorn från katetern genom att försiktigt vrida loss den. Anslut katetern tll en steril urinpåse. Kassera Uro-Tainer®-påsen och tvätta händerna. Vrid och ta loss locket utan att röra den sterila konnektorn. Steg 4 4 Steg 7 Steg 8 Vad är Polihexanid? Polihexanid är aktivt mot gram- och gram+ bakterier, svamp och jäst inklusive MRSA, pseudomonas aeruginosa, VRE etc. Polihexanid har använts i över 60 år utan någon visad resistens, t ex i linsvätska och vid sårbehandling. Den uppvisar god säkerhet utan påvisad resistens och med minimal toxicitet. Polihexanid varken adsorberas eller absorberas av celler och vävnad och kan därmed inte störa kroppens metabolism. Fördelar med Uro-Tainer® Polihexanid: - Vävnadstolerant - Hypoallergen - Ingen känd resistens - Lämplig för långtidsanvändning, absorberas ej systemiskt 5 Uro-Tainer® Polihexanid Mekanisk spolning PVC-FRI B. Braun Uro-Tainer® Polihexanid Indikation: Uro-Tainer® Polihexanid 0.02 % används för rutinmässig dekolonisation (avlägsning av bakterier) av katetern. Rekommenderad spolfrekvens: Frekvensen varierar beroende på användare och behov. Uro-Tainer® Polihexanid är så pass tolerant att spolning upp till max 2 gånger per dag kan utföras om behovet finns. Sammansättning: 100 ml: Polihexanid 0,02 g, Sorbitol 5,0 g 6 Storlek 100 ml Artikelnummer FB99965 Antal/fp 10 st Referenser 20.Costerton JW, Lewandowski Z, Caldwell DE, Korber DR, Lappin-Scott HM. Microbial biofilms. Annu Rev Microbiol 1995; 49: 711-745. 21.Goldsworthy MJH. Gene expression of Pseudomonas aeruginosa and MRSA with a catheter-associated urinary tract infection biofilm model. Bioscience Horizons 2008; 1(1): 28-37. 22.Cools HJ, van der Meer JW. Restriction of long-term indwelling urethral catheterisation in the elderly. Br J Urol 1986; 58(6): 683-688. 23.Stickler DJ. Bacterial biofilms and the encrustation of urethral catheters. Biofouling 1996; 9(4): 293-305. 24.Kunin CM. Detection, prevention and management of urinary tract infections. 4th Ed, 1987. Lea & Febiger, Philadelphia, USA. 25.Getliffe K.A. The characteristics and management of patients with recurrent blockage of long-term urinary catheters. J Adv Nurs 1994; 20(1):140-149. 26.Kunin CM. The blockage of urinary catheters: role of microorganisms and constituents of the urine on formation of encrustations. J Clin Epidemiol 1989; 42: 835-842. 27.Rew M, Woodward S. Troubleshooting common problems associated with long-term catheters. Br J Nurs 2001; 10(12): 764-774. 28.Phillips L, Wolcott RD, Fletcher J, Schultz GS. Biofilms made easy. www.woundsinternational.com 2010; 1(3): 1-6. 29.Stoodley P, Stoodley P, Sauer K, Davies DG, Costerton JW. Biofilms as complex differentiated communities. Annu Rev Microbiol 2002; 56: 187-209. 30.Hall-Stoodley J, Costerton JW, Stoodley P. Bacterial biofilms: from the natural environment to infectious diseases. Nat Rev Microbiol 2004; 2(2): 95-108. 31.James GA, Swogger E, Wolcott R, et al. Biofilms in chronic wounds. Wound Repair Regen 2008; 16(1): 37-44. 32.Hall-Stoodley L, Stoodley P. Evolving concepts in biofilm infections. Cell Microbiol 2009; 11(7): 1034-43. 33.Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science 1999; 284(5418): 1318-1322. 34.Wolcott RD, Rhoads DD, Bennett ME, et al. Chronic wounds and the medical biofilm paradigm. J Wound Care 2010; 19(2): 45-50, 52-53. 35.Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev 2002; 15(2): 167-93. 36.Costerton JW. The etiology and persistence of cryptic bacterial infections: a hypothesis. Rev Infect Dis 1984; 6 Suppl 3: S608-16. 37.Bester E, Kroukamp O, Wolfaardt GM, et al. Metabolic differentiation in biofilms as indicated by carbon dioxide production rates. Appl Environ Microbiol 2010; 76(4): 1189-1197. 38.Bradbury S, Fletcher J. Prontosan® made easy. www.woundsinternational.com 2011; 2(2): 1-6. 39.Gulot E, Georges P, Brun A, et al. Heterogeneity of diffusion inside microbial biofilms determined by fluorescence correlation spectroscopy under two-photon excitation. Photochem Photobiol 2002; 75(6): 570-579. 40.Weigel LM, Donlan RM, Shin DH, et al. High-level vancomycin-resistant Staphylococcu aureus isolates associated with a polymicrobial biofilm. Antimicrob Agents Chemother 2007; 51(1): 231-38. 41.Liu Y, Li J. Role of Pseudomonas aeruginosa biofilm in the initial adhesion, growth and detachment of Escherichia coli in porous media. Environ Sci Technol 2008; 42(2): 443-449. 42.Davies DG, Parsek MR, Pearson JP, et al. The involvement of cell-to-cell signals in the development of a bacterial biofilm. Science 1998; 280(5361): 295-298. 43.Lewis K. Persister cells, dormancy and infectious disease. Nat Rev Microbiol 2007; 5(1): 48-56. 44.Brooun A, Liu S, Lewis K. A dose response study of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob Agents Chemother 2000; 44(3): 640-646. 45.Stickler DJ. Bacterial biofilms in patients with indwelling urinary catheters. Nat Clin Pract Urol 2008; 5(11): 598-608. 46.Koseoglu H, Aslan G, Esen N, et al. Ultrastructural stages of biofilm development of Escherichia coli on urethral catheters and effects of antibiotics on biofilm formation. Urology 2006; 68(5): 942-946. 47.Olson ME, Ceri H, Morck DW, et al. Biofilm bacteria: formation and comparative susceptibility to antibiotics. Can J Vet Res 2002; 66(2): 86-92. 48.Conley J, Olson ME, Cook LS, et al. Biofilm formation by group a streptococci: is there a relationship with treatment failure? J Clin Microbiol 2003; 41(9): 4043-4048. 49.Seipp HM, Hofmann S, Hack A, Skowronsky A, Hauri A. Efficacy of various wound irrigants against biofilms: Zeitschrift für Wundheilung 2005; 4: 160-164. 50.Gilliver S. PHMB a well-tolerated antiseptic with no reported toxic effects. J Wound Care 2009; Activa Healthcare Supplement: 9-14. 51.Moore K, Gray D. Using PHMB antimicrobial to prevent wound infection. Wounds UK 2007; 3(2): 96-102. 52.Gilbert P. Avoiding the resistance pitfall in infection control. Ostomy Wound Manage 2006; 52 (10A Suppl): 1S-3S. 53.Horrocks A. Prontosan wound irrigation and gel: management of chronic wounds. Br J Nurs 2006; 15(22): 1222–1228. 54.Moller A, Kaehn K, Nolte A. Experiences with the use of polyhexanide-containing wound products in the management of chronic wounds — results of a methodical and retrospective analysis of 953 patients. Wund Management, 2008; 3: 112-117. 55.Valenzuela AR, Perucho NS. The effectiveness of a 0.1% polyhexanide gel. Rev ROL Enf 2008; 31(4): 247-252. 56.Andriessen AE, Eberlein T. Assessment of a wound cleansing solution in the treatment of problem wounds. Assessment of Wounds 2008; 20(6): 171-175. 57.Kaehn K, Eberlein T. In-vitro test for comparing the efficacy of wound rinsing solutions. Br J Nurs 2009; 18(11) S4-S10. 58.Perez R, Davies SC, Kaehn K. Effect of different wound rinsing solutions on MRSA biofilm in a porcine wound model. Wund Management 2010; 4(2): 44-48. 59.Romanelli M, Dini V, Barbanera S, Bertone MS. Evaluation of the efficacy and tolerability of a solution containing propyl betaine and polihexanide for wound irrigation. Skin Pharmacol Physiol 2010; 7 B. Braun Medical AB Svärdvägen 21 182 33 DANDERYD 08-634 34 00 www.bbraun.se [email protected] 8