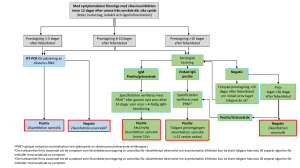
referensmetodik - Mikrobiologi.net
advertisement

REFERENSMETODIK för laboratoriediagnostik vid kliniskt mikrobiologiska laboratorier I. Infektionsdiagnostik I 6. Sexuellt överförbara infektioner (STI) 2:a upplagan 2009 Referensmetodik för laboratoriediagnostik vid kliniskt mikrobiologiska laboratorier Redaktion: Ingvar Eliasson Lars Engstrand Björn Herrmann Kari Johansen Magnus Thore - Ordförande Magnus Unemo 1 2 Innehållsförteckning Förord ............................................................................................................. 7 Gula böcker – ett konsensusprojekt................................................................ 9 Redaktion ....................................................................................................... 9 Författare (enskilda agens) ............................................................................. 9 Faktagranskning (utvalda sektioner) .............................................................. 9 Gula böckernas status som referensmetodik/jämförelsemetodik.................. 11 ALLMÄN OCH KLINISK DEL................................... 13 Anatomi........................................................................................................ 15 Vaginal mikroflora ....................................................................................... 18 Uretraflora .................................................................................................... 19 Sexuellt överförbara infektioner................................................................... 21 Definition ..................................................................................................... 21 Bakteriell vaginos (N76.8) ........................................................................... 21 Balanoposthitis (balanit, inflammation av glans penis och preputium) (N48.1) ......................................................................................................... 24 Candidiasis, genital (B37.3), (se också vulvovaginit) .................................. 24 Chancroid (alt. beteckningar ulcus molle eller mjuk schanker) (A57) ......... 25 Donovanos (granuloma inguinale) (A58)..................................................... 27 Genital herpes simplex-infektion (A60) ....................................................... 30 Genital papillomvirus-infektion (A63.0) ...................................................... 34 Gonorré (A54) .............................................................................................. 38 Hepatiter ....................................................................................................... 41 Hepatit B (B16, B18.1)................................................................................. 42 Hepatit C (B17.1 och B18.2)........................................................................ 46 HIV-infektion (B20-B24)............................................................................. 48 HTLV-infektion (B33.3) .............................................................................. 51 Klamydia (A56)............................................................................................ 53 Lymfogranuloma venereum (A55)............................................................... 55 Molluscum contagiosum (Mollusker) (B08.1) ............................................. 57 Mycoplasma genitalium (tilläggskod B96.8)................................................ 60 Mycoplasma hominis (tilläggskod B96.8) .................................................... 62 Pelvic inflammatory disease (PID; N70, N71, N73) .................................... 64 Syfilis (A50-53)............................................................................................ 66 Treponematoser, icke veneriska (A65-A67)................................................. 69 3 Trikomoniasis (A59) .................................................................................... 70 Ureaplasma species (tilläggskod B96.8)...................................................... 72 Uretrit - ospecificerad hos män och ospecificerad genital infektion hos kvinnor (N34.1) ............................................................................................ 74 Vulvovaginit (kolpit; N76.0) ........................................................................ 75 Epidemiologi ................................................................................................ 77 Smittskyddslagen och dess tillämpningar..................................................... 77 SmiNet.......................................................................................................... 78 Speciell epidemiologi för STI som omfattas av smittskyddslagen ............... 80 Övrig epidemiologi....................................................................................... 91 Blodgivarscreening....................................................................................... 93 SPECIELL DEL ........................................................... 97 P. Provtagning .............................................................. 99 Märkning av remisser och prover............................................................... 100 Transport .................................................................................................... 100 P.1. Bakteriell vaginos och vulvovaginit.................................................... 101 P.2. Cervicit och uretrit hos kvinnor........................................................... 103 P.3. Uretrit hos män.................................................................................... 104 P.4. Gonorré (Neisseria gonorrhoeae, gonokocker)................................... 107 P.5. Klamydia (Chlamydia trachomatis) .................................................... 111 P.6. Mycoplasma genitalium ...................................................................... 118 P.7. Ureaplasma species/Mycoplasma hominis.......................................... 120 P.8. Syfilis (Treponema pallidum) ............................................................. 123 P.9. Treponematoser, icke veneriska (endemisk syfilis, yaws, pinta) ........ 125 P.10. Chancroid (Haemophilus ducreyi) .................................................... 125 P.11. Donovanos (Klebsiella granulomatis)............................................... 127 P.12. Pelvic inflammatory disease (PID).................................................... 128 P.13. Genital herpes simplex-infektion ...................................................... 128 P.14. Genital papillomvirus-infektion ........................................................ 133 P.15. Molluscum contagiosum ................................................................... 134 P.16. Hepatit B ........................................................................................... 134 P.17. Hepatit C ........................................................................................... 137 P.18. HIV.................................................................................................... 140 P.19. HTLV–1 och 2 .................................................................................. 142 P.20. Trichomonas vaginalis ...................................................................... 143 4 D. Laboratoriemetoder ............................................... 147 Ankomstkontroll på laboratoriet................................................................. 148 D.1. Bakteriell vaginos och vulvovaginit (kolpit) ...................................... 149 D.2. Cervicit och uretrit hos kvinnor.......................................................... 149 D.3. Uretrit hos män ................................................................................... 149 D.4. Neisseria gonorrhoeae ....................................................................... 149 D.5. Chlamydia trachomatis....................................................................... 157 D.6. Mycoplasma genitalium...................................................................... 163 D.7. Ureaplasma species/Mycoplasma hominis......................................... 165 D.8. Treponema pallidum........................................................................... 167 D.9. Treponematoser, icke veneriska ......................................................... 171 D.10. Chancroid - Haemophilus ducreyi .................................................... 171 D.11. Donovanos - Klebsiella granulomatis .............................................. 173 D.12. Pelvic inflammatory disease (PID) ................................................... 174 D.13. Herpes simplex ................................................................................. 175 D.14. Humana papillomvirus ..................................................................... 180 D.15. Molluscum contagiosumvirus........................................................... 182 D.16. Hepatit B........................................................................................... 182 D.17. Hepatit C........................................................................................... 185 D.18. HIV................................................................................................... 186 D.19. HTLV ............................................................................................... 189 D.20. Trichomonas vaginalis ..................................................................... 191 D.21. Candida ............................................................................................ 192 BILAGOR.................................................................... 195 BILAGA 1 ................................................................... 197 Substrat för odlingsdiagnostik av Neisseria gonorrhoeae ......................... 197 BILAGA 2 ................................................................... 205 Cellodling Chlamydia trachomatis............................................................. 205 BILAGA 3 ................................................................... 211 Nukleinsyrabaserad metod för påvisning av Mycoplasma genitalium ....... 211 5 BILAGA 4 ................................................................... 217 Substrat för isolering och identifiering av Mycoplasma hominis och Ureaplasma species.................................................................................... 217 BILAGA 5 ................................................................... 221 Metoder för diagnostik av Treponema pallidum ........................................ 221 5.1. Metodbeskrivning för PCR-detektion av Treponema pallidum (ej referensmetod)............................................................................................ 223 5.2. Serologisk diagnostik av syfilis (referensmetoder) ............................. 224 5.2.1. VDRL/RPR ...................................................................................... 225 5.2.2. Wassermanreaktion (WR) ................................................................ 227 5.2.3 TPPA ................................................................................................. 229 5.2.4. Specifik syfilisserologi utförd med ELISA-teknik ........................... 230 5.2.5. Specifik syfilisserologi utförd på kommersiella analysinstrument ... 231 BILAGA 6 ................................................................... 233 Substrat för diagnostik av Haemophilus ducreyi........................................ 233 BILAGA 7 ................................................................... 237 Trichomonas vaginalis ............................................................................... 237 BILAGA 8 ................................................................... 241 Nukleinsyrabaserad metod för påvisning av Herpes simplexvirus............. 241 6 Förord Föreliggande volym om referensmetodik för mikrobiologisk diagnostik av sexuellt överförbara infektioner (STI) i serien ”gula böckerna”, är en uppdatering och omarbetning av första upplagan från 1994. Volymen omfattar bakterie-, virus-, och parasitdiagnostik. För fullständighetens skull berörs också översiktligt svampdiagnostik, eftersom svampinfektioner i sammanhanget kan utgöra differentialdiagnostiska problem samt ses som likartade men endogent orsakade infektioner. Liksom övriga böcker i skriftserien är den utarbetad i samverkan mellan Smittskyddsinstitutet (SMI) och Föreningen för medicinsk mikrobiologi (FMM). Uppdateringen har motiverats av den snabba utvecklingen av metodik för påvisning av agens, särskilt teknik baserad på nukleinsyraamplifiering. Den aktuella reviderade volymen är primärt tänkt att fungera som nätupplaga åtkomlig från SMIs hemsida http://www.smi.se och FMMs hemsida http://www.mikrobiologi.net. Boken kommer också på särskild beställning att tryckas som vanlig ”gul bok”. Bokens första del, ”Allmän och klinisk del”, ger en ingående översikt av aktuella sjukdomar/agens och deras epidemiologi. Ett nyskrivet avsnitt om blodgivarscreening finns också inlagt i detta avsnitt. Det följande avsnittet, ”Speciell del”, beskriver provtagning med anvisningar för kliniken och sist detaljerat laboratoriediagnostiken, ofta med hänvisningar till beskrivningar av använda substrat och metoder i bilagorna. I den allmänna delen finns för varje sjukdom/agens klickbara länkar till respektive fördjupningsavsnitt (epidemiologi, provtagning och laboratoriediagnostik). Alla bokens avsnitt går givetvis också att nå via klickbara länkar i registret i bokens inledningen. Aktuell STI-volym vänder sig som tidigare i första hand till personalen på landets mikrobiologiska laboratorier, och det fylliga innehållet gör att den också lämpar sig som kursmaterial och läsning för ST-läkare inom professionen och andra intresserade kolleger, exempelvis infektionsläkare, gynekologer och venerologer. Boken ansluter i huvudsak till Socialstyrelsens Falldefinitioner vid anmälan enligt Smittskyddslagen, 2008-130-11, juni 2008. Liksom i de senast föregående böckerna i serien finns inledande avsnitt om gula böckernas status som referensmetodik, i princip gemensamt för hela serien. Av principiell betydelse är att den laborativa referensmetodiken beslutas genom ett konsensusförfarande via professionen för att användas som allmän referens och 7 jämförelsemetod för validering av alternativa metoder. Det är redaktionens förhoppning att denna volym skall vara till nytta på det enskilda laboratoriet både som komprimerat uppslagsverk och som vägledning vid det fortlöpande kvalitetssäkringsarbetet. Till sist vill vi framföra vårt varma tack till alla författarna och faktagranskare, och också till alla andra inom professionen som har lämnat värdefulla synpunkter och förslag och därigenom bidragit konstruktivt till denna uppdatering. Ett särskilt tack till Carola Karlsson för hennes insatser i arbetet med bokens layout. Solna mars 2009 Ingvar Eliasson, Lars Engstrand, Björn Herrmann, Kari Johansen, Magnus Thore, Magnus Unemo 8 I 6 Allmän och klinisk deIi Gula böcker – ett konsensusprojekt Underlaget för de gula böckerna tas fram av informellt utsedda författare och sammanställs av en redaktion utsedd gemensamt av FMM och SMI. Från och med denna utgåva remissbehandlades materialet inom professionen via diskussionsforum på www.mikrobiologi.net. Synpunkterna där togs tillvara och inarbetades av redaktionen. Den nya upplagan diskuterades också som en konsensuskonferens på en SMI-dag i september 2008. Denna avslutades med en protokollförd konsensusdiskussion under ledning av neutral ordförande. En slutversion underställs traditionellt ordföranden i FMM och Generaldirektören vid SMI. Dessa avgör om konsensusdiskussionens slutsatser uppfylls och upprättar därefter ett gemensamt konsensusprokotoll vilket samtidigt är ett klartecken för publicering. Redaktion Ingvar Eliasson Lars Engstrand Björn Herrmann Kari Johansen Magnus Thore - Ordförande Magnus Unemo Författare (enskilda agens) Jan Albert (HIV), Sören Andersson (HTLV, blodgivarscreening), Tomas Bergström (HSV), Joakim Dillner (HPV), Björn Herrmann (klamydia), Elisabet Holst (Trichomonas), Bertil Kaijser (syfilis), Teresa Lagergård (chancroid), Britta Loré (Mycoplasma genitalium), Kari Johansen (molluscum contagiosum), Magnus Thore (revision av avsnitten donovanos, bakteriell vaginos, PID, Ureaplasma, Mycoplasma hominis), Christina Welinder-Olsson (syfilis), Anders Widell (hepatit B och C), Magnus Unemo (gonorré). Faktagranskning (utvalda sektioner) Malin Arneborn Anders Blaxhult Maria Brytting Dan Danielsson Lars Falk Urban Forsum Frida Hansdotter Jörgen Skov Jensen Anders Johansson Teresa Lagergård Per-Göran Larsson Inger Ljungström Heléne Norder Madeleine von Sydow Magnus Unemo 9 I 6 Allmän och klinisk deI 10 I 6 Allmän och klinisk deIi Gula böckernas status som referensmetodik/jämförelsemetodik I samband med att nya metoder, oavsett om dessa är laboratoriets egna eller kommersiella, introduceras i rutinverksamheten är ett minimikrav att man förvissar sig om att metoderna fungerar som avsett. Detta kan ske genom direkt jämförelse med någon annan känd eller utvärderad metod eller genom att undersöka definierade paneler med positiva och negativa prov. Inom mikrobiologin saknas oftast metodik och material som genom sitt odiskutabla status förtjänar beteckningen gold standard. Det finns ändå uttalade behov av fasta jämförelsepunkter. I gula bokenserien presenteras metodik som genom konsensusförfarande inom professionen beslutats vara allmän referens vid upprättande av ny/alternativ diagnostik eller andra lokala varianter och vid validering av nya metoder. Begreppet jämförelsemetodik kan användas synonymt med referensmetodik eftersom det senare begreppet associeras till standarder som gäller kvantitativa mätningar på en ratioskala (tillämpligt för mätningar av exempelvis antibiotikakoncentration, mg/L, eller antikroppskoncentrationer, IU/mL), en typ av mätningar som inte är dominerande i klinisk mikrobiologi (Reference measurement procedures enligt SS/EN/ISO nr 12286 och ”Reference measurement materials” SS/EN/ISO nr 12287). Mikrobiologiska undersökningar anger istället oftast resultat på en nominalskala (exempelvis typ av mikroorganism) eller som kvantitet på en ordinalskala (exempelvis positiv/negativ). Skalbegreppen definieras i SJCLI 1989 , suppl 194, 69-76. För en närmare presentation av begreppen hänvisas ockå till gula boken Referensmetodik I 2, 2:a upplagan 2005, sid 12. Diagnostisk referensmetodik för ett agens omfattar ofta flera delar, var och en med sitt speciella syfte; 1) påvisning/identifiering av en organism, 2) indirekt, ofta serologisk infektionsdiagnostik och 3) epidemiologisk typning. Metodiken skall vara så väldokumenterad att den är kvalitativt och kvantitativt reproducerbar inom ett definierat användningsområde. Referensmetodik är inte att betrakta som föreskrifter eller ”konsensusmetodik” rekommenderad för rutinbruk vid det enskilda laboratoriet – även om den i många fall kan vara högst användbar. Den är inte statisk utan kan ändras med den tekniska utvecklingen. För att uppnå spårbarhet krävs också ett definierat referensmaterial som kan bestå av typstammar för spårbarhet på en nominalskala eller standardiserade reagens eventuellt med kända mätvärden för kvantitering på en ordinal- (eller ratio-) skala. Som referensmaterial räknas också paneler som avser att avslöja brister i diagnostisk sensitivitet och specificitet. 11 I 6 Allmän och klinisk deI Referenslaboratorium Begreppet referenslaboratorium styrs formellt av ISO 15195 “Laboratory medicine-requirements for reference measurements”. Där definieras reference measurement laboratory som: “Laboratory that performs a reference measurement procedure and provides results with stated uncertainty”. Tillämpliga standarder saknas emellertid i de flesta fall för potentiella referenslaboratorier inom konventionell klinisk mikrobiologi. Det är inte heller möjligt att nå utvidgad ackreditering som referenslaboratorium, men väl för sådana metoder som kan identifieras som delar av en referensfunktion. Med referensfunktion avses då att det på ett visst laboratorium finns specialkompetens kring ett eller flera humana smittämnen vilken saknas på övriga laboratorier, och att laboratoriet kan diagnosticera, upprätthålla referensmetoder/motsvarande, hålla eller anvisa referensmaterial, bedriva forskning/utvecklingsarbete och kunna förmedla internationella kontakter rörande samma agens. Funktionen skall kunna utnyttjas av övriga laboratorier och administreras och finansieras genom centrala avtal. Det finns ett uttalat behov i landet att inrätta och också genom avtal formalisera referensfunktioner för sådan diagnostik som inte utförs av alla, utgående från traditionella ”riksdiagnostiska listor” (R-listor), inte minst för organismer som omfattas av smittskyddslagen. I praktiken kan begreppet referenslaboratorium informellt användas för laboratorier som tillhandahåller sådana referensfunktioner. 12 I 6 Allmän och klinisk deIi ALLMÄN OCH KLINISK DEL 13 I 6 Allmän och klinisk deI 14 I 6 Allmän och klinisk deIi Anatomi Kvinnans könsorgan Figur 1. Kvinnans könsorgan (bild Wikimedia commons: GNU Free Documentation License). 1. Äggledare (tuba uterina), 2. Urinblåsan (vesica urinaria), 3. Blygdbenet (os pubis), 4. Slidan (vagina), 5. Klitoris, 6. Små blygdläppar (labia minora), 7. Förgården (vestibulum vaginae med två Bartholinska körtlar), 8. Äggstock (ovarium), 9. Colon sigmoideum, 10. Livmodern (uterus), 11. Fornix vaginae, 12. Cervix, den del som mynnar i slidan kallas portio vaginae eller bara portio, 13. Rektum 14. Anus Äggcellerna bildas i de båda äggstockarna (singularis ovarium) och förs via äggledarna ut i livmodern. Varje ovarium är en oval tillplattad kropp vars främre rand är fäst i ett bukhinneveck (”breda livmoderbandet”). Vecket löper från livmoderns sidor på tvären till lilla bäckenets sidobegränsning. I ovarierna finns talrika upp till centimeterstora vätskefyllda blåsor (Graafska folliklar). I varje blåsvägg sitter en äggcell. Vid ägglossningen brister en av blåsorna och ägget töms ut i bukhålan. Där fångas det upp av en av de två äggledarna (singularis tuba uterina). Dessa består vardera av ett cirka 15 cm långt rör som 15 I 6 Allmän och klinisk deI med ena änden mynnar i livmodern (uterus) och med den andra änden omsluter ovariet med fransliknande utskott. Innerst består väggen av veckad cilieförsedd slemhinna och ytterst av glatt muskulatur. I äggledaren sker eventuell befruktning. Uterus är ett päronformat organ, stor som ett litet hönsägg. Den ligger i lilla bäckenet mellan urinblåsan och ändtarmen. Dess övre del kallas kroppen (corpus uteri) och dess nedre del halsen (cervix uteri). Uterus har i sitt inre ett tillplattat hålrum (cavum uteri) i vars övre hörn äggledarna mynnar. Cervix uteri buktar som en tapp in i övre delen av slidans (vagina) främre vägg, och via cervix mynnar livmoderhålan i yttre modermunnen. Innerst består livmodern av en slemhinna som förändras och sedan avstöts vid menstruationen. Utanför slemhinnan består väggen av tjock glatt muskulatur. Slidan är ett 8-10 cm långt tänjbart rör som löper mellan urinröret och rektum. Innerst, ovanför mynningen av modermunnen, bildar slidan ett valv (fornix vaginae) som bara har en tunn vägg mot bukhålan. Mellan vagina och rektum finns en ficka i bukhinnan som kallas ”fossa Douglasii”. Slidans vägg består av veckad slemhinna av skivepitel, sedan glatt muskulatur och ytterst bindväv. Utåt mynnar slidan med en oval öppning i förgården (vestibulum vaginae) som begränsas av de små blygdläpparna (labia minora). Dessa består av slemhinneliknande hudveck. Utanför dessa ligger de stora blygdläpparna (labia majora) som är fettfyllda hudveck som framåt och bakåt begränsar blygdspringan (rima pudendi). I den främre delen av vestibulum mynnar urinröret och framför de små blygdläpparna sitter klitoris. Mannens könsorgan De två testiklarna är normalt belägna i pungen (scrotum). I testiklarna bildas sädescellerna, som förs till kroppsytan via bistestiklarna, sädesledarna, utsprutningskanalerna och slutligen urinröret. Vardera testikel omges av en fast bindvävskapsel. Inne i testikeln finns starkt vindlade sädesbildande kanaler (pluralis tubuli seminiferi) som fortsätter i utförande gångar (pluralis ductuli efferentis) som löper in i bitestikeln (epididymis), belägen vid testikelns övre pol. Bitestikelns starkt vindlade gångsystem övergår i dess nedre ända med en skarp krök i sädesledaren (ductus deferens). Denna består av ett tjockväggigt, muskulöst rör som passerar genom ljumskkanalen, fortsätter ner i lilla bäckenet mot urinblåsans botten. Här har sädesledaren en spolformad ”ampull” som står i förbindelse med sädesblåsan (vesicula seminalis) med ett inre körtelskikt. Sädesblåsan är belägen bakom urinblåsans nedre parti, framför rektum. Utsprutningskanalen (ductus ejaculatorius) bildar fortsättningen på sädesledaren nedanför ampullen och löper som en fin gång nedåt framåt genom prostatakörteln, för att till sist mynna i urinröret (uretra). Prostata omsluter urinrörets första del. Den består av körtelvävnad och glatt muskulatur och har många små öppningar till urinröret. Prostatas bakre yta vetter mot ändtarmen. 16 I 6 Allmän och klinisk deIi Urinröret löper via bäckenbotten och genom penis där den öppnar sig utåt i en springa på ollonet (glans penis). Urinrörets penisdel omsluts av en svällkropp som slutar med en ansvällning (ollonet). Penis har ytterligare två svällkroppar som löper utefter övre delen av urinrörets svällkropp. Ytterst är penis omgiven av en tänjbar hud runt ollonet som kallas förhuden (preputium). Figur 2. Mannens könsorgan (bild Wikimedia Commons: GNU Free Documentation License). 1. Urinblåsan (vesica urinaria), 2. Blygdbenet (os pubis), 3. Penis, 4. Svällkropp (corpus cavernosum), 5. Ollonet (glans penis), 6. Förhuden (preputium), 7. Urinrörets (uretra) mynning, 8. Colon sigmoideum, 9. Rektum, 10. Sädesblåsa (vesicula seminalis), 11. Utsprutningskanal (ductus ejaculatorius), 12. Prostata, 13. Parauretrala körtlar (Cowpers körtlar), 14. Anus, 15. Sädesledare (ductus deferens), 16. Bitestikel (epididymis), 17. Testikel (testis), 18. Pungen (scrotum). 17 I 6 Allmän och klinisk deI Vaginal mikroflora Hos den nyfödda flickan är vagina steril, men koloniseras inom några timmar med laktobaciller och med fakultativa bakterier från födelsekanalen. Under den första levnadsmånaden då det vaginala epitelet står under inflytande av kvarvarande cirkulerande östrogen från modern får den lilla flickan en vaginal flora som liknar den fertila kvinnans (1). Östrogeneffekten försvinner därefter och hos flickor före puberteten är vaginalt pH-värde neutralt och inga laktobaciller kan odlas fram men finns kvar i små mängder. Floran utgörs då huvudsakligen av koagulasnegativa stafylokocker, korynebakterier, alfastreptokocker och olika gramnegativa stavar. Anaerob vaginalflora hos denna åldersgrupp är otillräckligt studerad. De vanligaste patologiska fynden är Haemophilus influenzae, pneumokocker och grupp A, C och G streptokocker. Dominans av Enterobacteriaceae, anaeroba gramnegativa bakterier eller jästsvamp tyder på störning i floran. Hos friska kvinnor i fertil ålder bildar laktobaciller en nästan kontinuerlig ”biofilm” i vagina. Närvaron av dessa organismer spelar en avgörande roll i försvaret mot andra potentiellt patogena mikroorganismer. Kolonisation med laktobaciller sammanfaller med östrogenberoende ackumulering av glykogen i det vaginala epitelet. Vid avstötning av epitelceller frisätts glykogen som spjälkas till glukos. Vissa av mikroflorans laktobacillarter metaboliserar glykogen till mjölksyra, medan andra endast kan metabolisera glukos till mjölksyra. Vaginala laktobaciller bidrar på det sättet till att etablera och bibehålla ett pH-värde som i flesta fall ligger mellan 3,8-4,0. Detta medför att vaginalfloran begränsas till att omfatta mikroorganismer som trivs i denna sura miljö. Glykogeninnehållet i vaginalepitelet, mängden laktobaciller, liksom det vaginala pH-värdet varierar med östrogennivåerna under menstruationscykeln. Många fakultativa laktobaciller producerar väteperoxid, H2O2, som är toxiskt för olika bakterier. Den baktericida effekten av H2O2 ökas dessutom av peroxidas, som finns naturligt i cervixsekret. Cervixsekretet utgör en infektionsbarriär även genom komponenter som komplementfaktorer, IgA, lysozym och laktoferrin, som kan binda och lysera bakterier och hindrar dem från att adherera till och penetrera epitelet. Förutom mjölksyra och H2O2, producerar laktobaciller andra antibakteriella substanser såsom lactacin B. Vilka arter av laktobaciller som dominerar eller är essentiella på den vaginala slemhinnan för att upprätthålla en effektiv försvarsbarriär har på senare år klarnat. Tidigare nomenklatur har byggt på fenoklassifikation men värderat med nyare genoklassifikation tycks de vanligaste arterna vara Lactobacillus crispatus, L. jensinii och L. gasseri (2, 3). Däremot är det oklart om Lactobacillus iners är en del av den normala vaginalfloran eller om den restituerar vaginalfloran till en mer gynnsam miljö efter bakteriell vaginos där andra laktobacillarter kan ta över (4). 18 I 6 Allmän och klinisk deIi I den normalt laktobacilldominerade vaginalfloran kan även många andra fakultativa och anaeroba bakteriearter, liksom jästsvampar, ingå i små mängder. Bland fakultativa bakteriearter dominerar de grampositiva; vanliga isolat är koagulasnegativa stafylokocker, enterokocker, alfastreptokocker, grupp B streptokocker och arter tillhörande Enterobacteriaceae, främst Escherichia coli, men även Klebsiella- och Proteus-arter. Gardnerella vaginalis är vanligt förekommande. Mycoplasma hominis och Ureaplasma urealyticum kan ingå i vaginalfloran hos sexuellt aktiva friska kvinnor. Hos friska kvinnor i fertil ålder förekommer också obligat anaeroba arter vanligen i små mängder. Sammansättningen av vaginalfloran varierar mellan individer och hos samma kvinna vid olika tider under menstruationscykeln. Fakultativa bakterier minskar något i antal före mens, medan antalet anaeroba organismer tycks vara mer konstant. Efter menopausen – med minskad östrogenproduktion – minskar glykogeninnehållet i det vaginala epitelet med ett neutralt pH-värde som resultat. Laktobacillerna minskar i antal och ersätts av en flora liknande den före puberteten. Äldre kvinnor med flytning har ofta en gramnegativ flora. Detta kan bidra till den höga frekvensen av urinvägsinfektioner hos kvinnor efter menopausen. Östrogenbehandling kan återställa en laktobacilldominerad vaginal flora. Uretraflora Det finns få studier avseende normal uretraflora. Endogen mikroflora i främre uretra är influerad av ålder och till mindre del av kön. Hos barn upp till 5 års ålder är E. coli, Klebsiella- och Enterobacter-arter liksom enterokocker vanliga isolat som kan förekomma i rikliga mängder, men senare i livet förekommer dessa mer sällsynt och i små mängder. Ett anmärkningsvärt stort antal olika arter kan isoleras i små mängder från främre uretra hos vuxna individer av båda könen, exempelvis koagulasnegativa stafylokocker, enterokocker, apatogena Neisseria-arter, korynebakterier, alfastreptokocker, gramnegativa stavar (inkluderande Enterobacteriaceae), Mycoplasma-arter och jästsvampar. Av anaeroba organismer förekommer peptostreptokocker, olika gramnegativa stavar – Prevotella- och Fusobacterium-arter, liksom bifidobakterier, laktobaciller, propionibakterier och Veillonella. Stora individuella skillnader föreligger. 19 I 6 Allmän och klinisk deI REFERENSER 1. Hammerschlag, M. R., S. Alpert, I. Rosner, P. Thurston, D. Semine, D. McComb, and W. M. McCormack. Microbiology of the vagina in children: normal and potentially pathogenic organisms. Pediatrics. 1978; 62:57-62. 2. Vasquez, A., T. Jakobsson, S. Ahrne, U. Forsum, and G. Molin. Vaginal lactobacillus flora of healthy Swedish women. J. Clin. Microbiol. 2002; 40:27462749. 3. Verhelst, R., H. Verstraelen, G. Claeys, G. Verschraegen, J. Delanghe, L. Van Simaey, C. De Ganck, M. Temmerman, and M. Vaneechoutte. Cloning of 16S rRNA genes amplified from normal and disturbed vaginal microflora suggests a strong association between Atopobium vaginae, Gardnerella vaginalis and bacterial vaginosis. BMC. Microbiol. 2004; 4:16. 4. Jakobsson, Tell (2008). Lactobacillus iners and the normal vaginal flora. Akademisk avhandling Linköpings universitet (2008-09-08) 20 I 6 Allmän och klinisk deIi Sexuellt överförbara infektioner Definition Till begreppet sexuellt överförbara infektioner (STI) hänförs ett antal sjukdomar orsakade av olika bakterier, virus och protozoer där sexuell kontakt är huvudsaklig faktor för smittöverföring, även om andra smittvägar också förekommer. Betydande alternativa smittvägar är via blod och mor- till barnsmitta. Blandinfektioner med flera agens förekommer. Infektioner i genitalorganen som ej klassificeras som sexuellt överförbara infektioner beskrivs i volymen Referensmetodik I 11 (2003), sidorna 60-67. Några av dem finns också upptagna i denna volym, bland annat av differentialdiagnostiska skäl. Begrepp enligt SoS Klassifikation av sjukdomar och hälsoproblem 1997 (reviderad 2002), svensk version av ICD-10. Länk till laboratoriediagnostiska kriterier enligt SoS Falldefinitioner enligt smittskyddslagen, 2008-130-11, juni 2008. I det följande används begreppen cervicit (N72 + tilläggskod avseende etiologiskt agens B95 - B97) och uretrit (N34 eller om STI A50–A64) i betydelsen inflammation i respektive organ. Bakteriell vaginos (N76.8) Etiologi: Vid bakteriell vaginos (BV) ses en störning i den normala vaginalfloran. Den kvantitativt dominerande laktobacillfloran har gett vika för en rikhaltig blandning av bakteriesläkten/arter som exempelvis Gardnerella vaginalis, Mobiluncus, Mycoplasma hominis, Prevotella, Bacteroides och Peptostreptococcus spp. Nyligen har också flera andra släkten/arter som Leptotrichia/Sneathia, Atopobium vaginae, Megasphaera spp, och olika Clostridiales blivit identifierade i prover från BV (1). Smittämnen: Det skall betonas att mycket kunskap fortfarande saknas avseende etiologi vid BV. Många olika bakteriearter kan vara betydelsefulla. Här beskrivs två av de hittills mest studerade. Gardnerella vaginalis (elementkod ATCC 14018 inom NPU-kodsystemet) är en gramlabil orörlig stav. som hör till den normala anorektala floran hos båda könen och till vaginalfloran. Den är också när den förekommer i höga tal associerad med BV och isoleras ibland postpartum i blod och i material från endometrium. Den kan orsaka infektioner efter abort. Den växer på många standardsubstrat i 5 % CO2 och kommersiella 21 I 6 Allmän och klinisk deI brickor för diagnostik av korynebakterier fungerar bra för eventuell laboratoriediagnostik. Mobiluncus (elementkod MSHD017904, två species har identifierats) är gramlabila eller gramnegativa anaeroba, rörliga bakterier som när de gramfärgas ses som svagt krökta stavar, och som växer på vanliga fasta odlingsmedia i anaerob miljö inom 5 dygn med små kolonier, cirka 2-3 mm i diameter. De är oxidas-, katalas- och indol-negativa. Mycoplasma hominis beskrivs på annat ställe i boken. Patogenes: Det saknas avgörande kunskap om det patofysiologiska förloppet vid bakteriell vaginos. Avsaknad av ett av de klassiska tecknen på infektion, dvs. ökad mängd polymorfnukleära leukocyter, gör det tveksamt om BV är en infektion i traditionell mening. Vissa studier stödjer dock antagandet att BV är en sexuellt överförd infektion, vars orsak man ännu inte känner till. Cirka tio procent av gravida kvinnor i Sverige beräknas ha bakteriell vaginos. Klinik: Det dominerande symtomet vid bakteriell vaginos är en illaluktande flytning där lukten kan karakteriseras som ”rutten fisk” eller ”räkskal”. Särskilt uttalad blir lukten i samband med samlag eller menstruation. Flytningen kan vara sparsam till riklig, vitaktig till färgen och tunn. Klåda och sveda kan förekomma. Symtomen kan vara mer uttalade hos gravida. Förekomst av pelvic inflammatory disease (PID) förekommer ofta parallellt med BV, men det finns inga prospektiva studier som visar att risken att utveckla PID minskar i samband med behandling av BV. Stöd föreligger för antagandet att bakteriell vaginos kan vara bidragande orsak till för tidig födsel samt postpartum endometrit. Däremot finns inga hållpunkter för direkt smittöverföring till barnet. Samband mellan BV och ospecifik uretrit hos manlig partner har diskuterats (2). Provtagning: Se P1 speciell del. Laboratoriediagnostik: Se D1 speciell del. Diagnosen BV ställs av klinikern genom fysikalisk och mikroskopisk undersökning av vaginalt sekret. Indikation för odling för påvisande av BV saknas. Förekomst av tunn vitaktig homogen flytning, clue cells, förhöjt pH (>4,5) och positiv amintest utgör ”Amsels kriterier”, och tre av dessa kriterier skall vara uppfyllda för diagnosen BV (3). Varianter på dessa kriterier används dock på vissa kliniker och i forskningssammanhang. Amsels kriterier utgör således basen för BV-diagnostik, men gramfärgade vaginalutstryk bedömda enligt Nugents kriterier har god överensstämmelse med Amsels kriterier. Bedömning enligt Nugent är robust och reproducerbar om den utförs av van personal (4, 5). Tyvärr är det inte många mikrobiologiska laboratorier som erbjuder gramfärgning av vaginalsekret i Sverige men det används mycket i framför allt USA. Det har 22 I 6 Allmän och klinisk deIi även lanserats ett flertal snabbmetoder för diagnos av BV utifrån Amsels kriterier men ingen av dessa tester har uppvisat tillräckligt goda resultat. Möjligen kan någon DNA-hybridiseringstest komma att lanseras. Senaste året har flera artiklar publicerats som visar att dessa metoder har god överensstämmelse med Nugents kriterier men ingen finns ännu som kommersiell test (6). Som differentialdiagnos till BV bör trikomonasinfektion has i åtanke, men också främmande kropp och cervixcancer bör uteslutas. Behandling: Bakteriell vaginos behandlas med 2 % klindamycin i vaginalkräm eller vagitorier under 3-7 dagar. Alternativ är vaginal eller peroral behandling med metronidazol. Den kliniska utläkningen efter ett behandlingstillfälle är dock inte mycket bättre än 50 % varför upprepad behandling rekommenderas (7). Prevention: Specifika preventiva åtgärder finns inte. REFERENSER 1. Fredricks, D. N., T. L. Fiedler, K. K. Thomas, B. B. Oakley, and J. M. Marrazzo. Targeted PCR for detection of vaginal bacteria associated with bacterial vaginosis. J. Clin. Microbiol. 2007; 45:3270-3276. 2. Larsson, P. G., M. Bergström, U. Forsum, B. Jacobsson, A. Strand, and P. WolnerHanssen. Bacterial vaginosis. Transmission, role in genital tract infection and pregnancy outcome: an enigma. APMIS. 2005; 113:233-245. 3. Amsel, R., P. A. Totten, C. A. Spiegel, K. C. Chen, D. Eschenbach, and K. K. Holmes. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am. J. Med. 1983; 74:14-22. 4. Nugent, R. P., M. A. Krohn, and S. L Hillier. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J. Clin. Microbiol. 1991; 29:297-301. 5. Forsum U, Jakobsson T, Larsson PG, Schmidt H, Beverly A, Bjørnerem A, Carlsson B, Csango P, Donders G, Hay P, Ison C, Keane F, Mc Donald H, Moi H, Platz-Christensen JJ, Schwebke J. An international study of the interobserver variation between interpretations of vaginal smear criteria of bacterial vaginosis. APMIS. 2002; 110: 811-818. 6. Trama, J. P., K. E. Pascal, J. Zimmerman, M. J. Self, E. Mordechai, and M. E. Adelson. Rapid detection of Atopobium vaginae and association with organisms implicated in bacterial vaginosis. Mol. Cell Probes. 2007; 22:96-102. 7. Larsson, P. G., and U. Forsum. Bacterial vaginosis--a disturbed bacterial flora and treatment enigma. APMIS 2005; 113:305-316. 23 I 6 Allmän och klinisk deI Balanoposthitis (balanit, inflammation av glans penis och preputium) (N48.1) Etiologi: Vaginalflora, Candida albicans, Trichomonas vaginalis eller Chlamydia trachomatis. Patogenes: Vanligen uppstår balanit hos sexuellt aktiva män i form av en toxisk dermatit efter samlag som en reaktion på den vaginala mikrofloran, särskilt vid förhöjd förekomst av Candida. Balanit orsakad av jästsvamp är däremot inte särskilt vanlig och bör föranleda misstanke om bakomliggande allmänsjukdom som immunsuppression, diabetes eller malignitet. Långdragna balaniter bör för övrigt föranleda partnerundersökning för bakteriell vaginos och andra STIsjukdomar. Svårbehandlad så kallad circinat balanit är ofta orsakad av Chlamydia. Balanit hos vuxna kan också orsakas av överkänslighet mot hygienpreparat, glidmedel eller kondomer. Huvudorsak till balanit hos barn är förhudsförträngning. Klinik: Balanit kännetecknas av en inflammation av slemhinnan på glans penis med rodnad och ibland också med små fina papler eller ytliga gulaktiga ulcerationer. Klåda och sveda är vanliga symtom. Circinat balanit är en kragformad brunröd dermatit runt ollonet. Så kallad plasmacellsbalanit hos äldre män uppvisar rodnade skarpt avgränsade något glansiga områden på ollonet, men ger i övrigt inga symtom. Orsaken till detta tillstånd är okänd och balaniten har tendens att kronisera. Provtagning, laboratoriediagnostik, behandling och prevention: Se under respektive agens. Candidiasis, genital (B37.3), (se också vulvovaginit) Svampinfektioner i genitalorganen klassificeras inte som sann STI, men beskrivs i denna upplaga av differentialdiagnostiska skäl samt då dessa kan ses som likartade men endogent orsakade infektioner. Etiologi: Candida albicans (80-90 %), Candida glabrata och andra Candida species (cirka 15 %). Smittämnen och patogenes: Predisponerande faktorer för genital candidiasis är behandling med bredspekrumantibiotika. Vid graviditet är incidensen förhöjd 24 I 6 Allmän och klinisk deIi beroende på höga östrogenvärden. Besvären är särskilt vanliga under tredje trimestern och drabbar då upp till 55 % av gravida. Även icke gravida kvinnor får ibland symtom i samband med menstruationen. Samband mellan vulvovaginal candidiasis och tätt åtsittande kläder i området har konstaterats och orsakas då sannolikt av värme och fukt i området. För en närmare beskrivning av smittämnen och patogenes hänvisas till Referensmetodik I.10, Svampinfektioner2004, upplaga 2. Klinik: Genital candidiasis ger sig typiskt till känna som en akut, ibland recidiverande eller kronisk, vulvovaginit (synonymt med kolpit). Lokala symtom i form av sveda och klåda, ofta med ringa eller ingen sekretion. Obehag vid miktion i form av uretral sveda och smärta är vanlig. Blygdläpparna är bleka eller rodnade, ofta syns ytliga linjära ulcerationer framförallt i bakre delarna av introitus. Vaginalslemhinnan kan vara rodnad och inflammationen är ofta, men inte alltid, förenad med vitaktiga gryniga (”ostiga”) flytningar. Provtagning: Se P1 speciell del. Laboratoriediagnostik: Se D1 speciell del. Diagnosen anses säkerställd om de typiska symtomen är kombinerade med fynd av jästsvampceller med eller utan hyfbildning vid direkt mikroskopi eller positiv odling för jästsvamp. Behandling: Klotrimazol/ekonazol som vagitorier/kräm är vanligtvis effektiv behandling som vid recidiv kan upprepas. Vid uttalade eller kroniska besvär kan peroral långtidsbehandling med flukonazol prövas. Partnerbehandling är sällan indicerad. Differentialdiagnos är trikomonasinfektion. Chancroid (alternativa beteckningar ulcus molle eller mjuk schanker) (A57) Chancroid är en av de klassiska sexuellt överförbara infektionerna men som numera är mycket ovanlig i Sverige. De enstaka fall som förekommer är alla smittade utomlands, framför allt i Afrika där sjukdomen fortfarande förekommer (1). Etiologi: Haemophilus ducreyi, elementkod ATCC 33940 Smittämnet: Bakterien är en liten, 0,5 × 1,5-2 µm, gramnegativ orörlig stav med varierande mikroskopiskt utseende. Den förekommer ofta i korta parallella 25 I 6 Allmän och klinisk deI kedjor, i litteraturen beskrivna som ”shoal of fish” (fiskstim). Bakterien är oxidaspositiv, kräver hemin (”X-faktor”) för växt och hydrolyserar inte kolhydrater. Tillsammans med H. aphrophilus och vissa stammar av H. paraphrophilus är bakterien den enda bland de tio definierade arterna inom genus Haemophilus som inte kräver V-faktor för växt. Patogenes: Patogenitetsmekanismer och virulensmekanismer är inte väl kända. Bakterien producerar två toxiner, cytoletalt distenderande toxin (CDT) och hemolysin. Det cytoletala toxinet hör till en familj av toxiner som klyver DNA. Som konsekvens stoppas cellcykeln vilket leder till apoptos (programmerad celldöd) av eukaryota celler. Andra karakteristiska egenskaper hos H. ducreyi är resistens mot bakteriolytisk aktivitet av komplement och mot fagocytos. Utan antibiotikabehandling orsakar den kroniska, svårläkta infektioner. Klinik: Bakterien orsakar genitala eller anala sår. Överföringen sker sexuellt och inkubationstiden är 3-4 dagar. Patienten söker ofta för ett starkt smärtande sår, ibland för ömmande inguinalkörtlar. Hos män är såret oftast lokaliserat till förhuden, hos kvinnor på labierna eller på klitoris. Såret börjar som en ömmande papel på rodnad botten, vilken under loppet av 1-2 dagar utvecklas till en pustel som rupturerar. Sårkanterna är skarpt avgränsade, på botten ses ofta ett grågult nekrotiskt exsudat. Blödning uppstår lätt om man försöker avlägsna granulomatös vävnad. I cirka hälften av fallen finns flera sår och inguinal adenit (bubo). Smältning och spontan ruptur av denna är inte ovanlig. Utan behandling kvarstår såret länge (upp till två månader) för att därefter långsamt läka. Risken för återfall är sannolikt stor. Preliminär diagnos ställs på typisk klinik, men differentialdiagnostiska svårigheter föreligger framför allt mot syfilis, herpes genitalis och donovanos. Extragenitala sår är ovanliga men nyligen har hudinfektioner orsakade av H. ducreyi rapporterats från söderhavsområdet. I endemiska populationer har chancroid visats underlätta transmission av HIV. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 10 speciell del Laboratoriediagnostik: Se D 10 speciell del. Chancroid diagnostiseras genom odling, men presumtiv diagnos kan erhållas genom mikroskopi av gramfärgat direktpreparat från sår. Transport av odlingsprov till laboratoriet bör ske omgående om inte bedsideodling kan göras. Odling av prov från ulcer har högre känslighet än odling av prov från aspirerat pus från inguinala adeniter. Bakterien 26 I 6 Allmän och klinisk deIi kan också påvisas med PCR på material från såret (2), men kommersiella metoder finns inte tillgängliga. Resistensbestämning kan göra med E-test (3), men referensmetod för resistensbestämning kan inte anges. Behandling: H. ducreyi var före 1960-talet känslig för tetracyklin, streptomycin, kloramfenikol, sulfa och penicillin. Resistensutveckling har rapporterats sedan dess. Bland annat förekommer penicillinrestens som orsakas av plasmidmedierad beta-laktamasproduktion. Känslighet föreligger oftast in vitro för makrolider, kinoloner, trimsulfa och nyare cefalosporiner. Rekommenderad behandling är azitromycin 1 g engångsdos, erytromycin 500 mg×4×7 eller ciprofloxacin 500 mg×2×3. Prevention: Som alla sexuellt överförbara infektioner kan man erhålla gott skydd med kondom. Handläggningen av chancroid är numera inte reglerad genom smittskyddslagen, men för varje diagnostiserat fall bör ändå kontaktspårning utföras för att behandla eventuella andra smittade personer. REFERENSER 1. Trees, D. L., and S. A. Morse. Chancroid and Haemophilus ducreyi: an update. Clin. Microbiol. Rev. 1995; 8:357-375. 2. Ahmed, H, Mbwana J, Gunnarsson E, Ahlman K, Guerino Ch, Svensson L, Mhalu F, and T Lagergård. Etiology of genital ulcers disease and association of human immunodeficiency virus infection in two Tanzanian cities. Sex. Transm. Dis. 2003; 30:114-119. 3. Lagergård T, A. Frisk and B Trollfors. Comparison of the E Test and agar dilution for testing antimicrobial susceptibility of Haemophilus ducreyi. J. Antimicrob. Chemother. 1996; 38:849-852. Donovanos (granuloma inguinale) (A58) Etiologi: Donovanos orsakas av bakterien Klebsiella granulomatis (tidigare beteckning Calymmatobacterium granulomatis eller Donovania granulomatis), elementkod QU66151 Smittämnet: Etiologiskt agens till Donovanos har nyligen hänförts till familjen Enterobacteriaceae genus Klebsiella, eftersom bakterien baserat på data från 16S rRNA gensekvensering uppvisar mycket stor fylogenetisk släktskap (9599 %) med bakterier inom detta genus (1). Närmast är bakterien besläktad med Klebsiella rhinoscleromatis, som orsakar nasala infektioner som företer likheter 27 I 6 Allmän och klinisk deI med donovanos. K. granulomatis är en kapselförsedd orörlig pleomorf gramnegativ stav, som i likhet med K. rhinoscleromatis huvudsakligen förekommer i tropiska och subtropiska områden. Bakterierna förekommer i human fecesflora. Särskilt vanlig är bakterien i Papua Nya Guinea, Sydafrika, delar av Indien, Brasilien och Australien, mestadels i aboriginala områden. Organismen är svårodlad och växer inte på bakteriologiska substrat avsedda för Enterobacteriaceae. Däremot kan bakterien växa i monocytbaserade odlingssystem och på Hep-2 celler. Patogenes: Sjukdomen överförs huvudsakligen sexuellt, men den förekommer också hos mindre barn och sexuellt inaktiva vuxna. Sannolik smittväg i de senare fallen är fekal smitta och autoinokulation. Smittsamheten är låg, upprepad exponering tycks nödvändig. Smitta till barnet har visats kunna överföras under förlossning. Bakterierna tenderar vid infektion att ansamlas i stora histiocyter (bindvävsmakrofager) där de är påvisbara som bipolärt färgade kapslade kockobaciller, så kallade ”Donovankroppar”. Specifika virulensmekanismer har inte identifierats. Klinik: Inkubationstiden är okänd, men antas variera mellan (1 dag)-14 dagar och 1 år. Vid experimentella studier på människa, har lesioner inducerats cirka 2 månader efter smittotillfället. Infektionen debuterar som en eller flera fasta kutana eller subkutana noduli som ulcererar. Såren är vanligen djupröda (”biffärgade”), lättblödande och oömma (ulcerogranulomatös form). Obehandlade ökar de succesivt i storlek. Hypertrofa, torra oregelbundna sår förekommer, liksom nekrotiska illaluktande med destruktion av omgivande vävnad. I sent skede kan spontanläkning förekomma, ofta med ärrvävnad och strikturer som följd. Såren är i 90 % av fallen lokaliserade till yttre genitalia, hos män oftast subpreputialt eller kring anus. Hos kvinnor angrips i första hand de små blygdläpparna, och mer sällan cervix eller uterusslemhinnan. Cirka 10 % av såren är lokaliserade till ljumskarna. Spridning till regionala lymfkörtlar förekommer, från vilka infektionen kan spridas i omkringliggande vävnad, vilket kan resultera i abscessbildning (pseudobubo) och ulceration av huden. Donovanos kan också förekomma extragenitalt i exempelvis läppar, haka, gom, hals, näsa och larynx. Disseminerad infektion kan spridas till ben och lever, och är oftast associerad med graviditet eller cervikal infektion. Genital donovanos ökar sannolikt mottaglighet för HIV och andra STI. 28 I 6 Allmän och klinisk deIi Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 11 speciell del Laboratoriediagnostik: Se D 11 speciell del. Den kliniska diagnosen bör om möjligt verifieras med laboratoriediagnostik innan antibiotikabehandling initieras. Mikroskopi av färgade utstryk med påvisande av ”Donovankroppar” är referensmetod för påvisande av infektionen. Känsligheten anges till 60-80 % jämfört med klinisk diagnos. Specificiteten är i sig inte definierad, men förekomst av intracellulära Donovankroppar är diagnostiskt för donovanos. Serologi kan användas som komplement för påvisande av infektionen. PCR är alternativ metod för påvisande av bakterien. Behandling: För behandling av laboratorieverifierad donovanos, där andra orsaker till tillståndet kunnat uteslutas, rekommenderas i första hand azitromycin 1 g initialt, därefter 500 mg dagligen tills effekt erhålles. Andra också effektiva doseringsregimer av azitromycin finns utprövade. Alternativa medel är ciprofloxacin, ceftriaxon, trim-sulfa, doxycyklin och gentamicin. Vid graviditet rekommenderas erytromycin som förstahandsval. Behandling av partner kan vara aktuell. Donovanos har god prognos vid adekvat antibiotikabehandling, även vid långvariga sjukdomstillstånd. Prevention: Inget vaccin finns tillgängligt. Preventionen i endemiska och epidemiska områden, som exempelvis Papua Nya Guinea, har genomförts framgångsrikt genom årlig undersökning av hela populationer. Målet har varit att utrota sjukdomen, vilket lyckats inom vissa geografiska områden. Ett lyckat resultat tycks vara särskilt associerat med generellt ökad hygienstandard. REFERENSER 1. Kharsany, A, B, M et al. Phylogenetic analysis of Calymmatobacterium granulomatis based on rRNA gene sequensis. J. Med. Microbiol. 1999; 48:841-847. 2. N O´Farrell, Donovanosis. Tropical Medicine Series. Sex Transm Infect. 2002; 78:452-457. 3. National guideline for the management of donovanosis (granuloma inguinale). Clinical Effectiveness Group (Associiation for Genitourinary Medicine and the Medical Society for the Study of Veneral Diseases). 2001 4. Carter, J.S., F.J. Bowden, I.Bastian, G.M. Myers, K.S. Sriprakash, and D.J.Kemp. 1999. Phylogenetic evidence for reclassification of Calymmatobacterium granulomatis as Klebsiella granulomatis comb. Nov. Int. J. Syst. Bacteriol. 49:1695-1700. 29 I 6 Allmän och klinisk deI Genital herpes simplex-infektion (A60) Etiologi: Herpes simplex virus (HSV) typ 1 och typ 2, elementkod QU60990 (typ 1) och QU60991 (typ 2) Smittämnet: Herpes simplex virus (HSV) är stora, höljeförsedda komplexa DNA-virus som indelas i två subtyper, typ 1 och typ 2. Stora delar av genomen uppvisar likheter de båda typerna emellan. Identifiering av herpes simplex virus kan alltså riktas mot gemensamma antigen eller nukleinsyrasekvenser under det att typbestämning, som idag är rutin, inriktas på typspecifika sekvenser eller antigena epitoper. Herpes simplex virus är labilt, känsligt för intorkning och värme och en rad olika vanliga desinfektionsmedel liksom för tvål och vatten. Även frysning är ogynnsamt för virus infektiositet. Figur 3. Herpes simplex-virus. Foto; Kjell-Olof Hedlund, Smittskyddsinstitutet 30 I 6 Allmän och klinisk deIi Patogenes: HSV smittar vid närkontakt och överförs sexuellt med infekterat blås/sår- eller slemhinnesekret genitalt/genitalt, oralt/genitalt eller mera sällan genitalt/oralt. Båda typerna kan infektera de flesta av kroppens lokalisationer och båda kan orsaka genitala infektioner. Numera dominerar HSV-1 som agens vid förstagångsinsjuknande i genital herpes, särskilt hos kvinnor (1). Båda ger upphov till latent infektion i de sensoriska nervganglierna varifrån aktivering sker. Frekvensen reaktiveringar är däremot beroende av virustyp; sålunda aktiveras typ 2 betydligt oftare genitalt än typ 1 (2). Virusutsöndringen är mest höggradig och långvarig (veckor) vid en primär infektion, dvs om patienten varken haft HSV-1 eller HSV-2 tidigare. Vid primär infektion hos en kvinna kan virus utsöndras från cervix under flera månader. En tidigare infektion med typ 1 modifierar förloppet av en senare typ 2; utsöndringstid och grad är då något lägre. Vid en recidivinfektion är utsöndringen kortvarig (några dagar) och låggradig och hos kvinnan är cervix mer sällan involverad (några procent av fallen). Smittreservoaren för genital herpes är virus i sekret från blåsor/ulcerationer eller andra herpesförändringar, ofta förbisedda. Asymtomatisk utsöndring, vilken troligen är den vanligaste källan till smitta, sker mellan skoven även hos helt symtomfria, infekterade personer. Virusmängden är dock något lägre vid tyst utsöndring än vid apparenta lesioner. Det är därför sannolikt att smittöverföring sker mer effektivt under symtomatiska än asymtomatiska perioder. Genitala herpeslesioner utgör en riskfaktor i samband med smittöverföring av HIV. Klinik: Inkubationstiden anges från 2-26 dagar (vanligen 6-8 dagar). Subkliniska eller lågsymtomatiska infektioner är mångfaldigt vanligare än kliniskt manifesta primärinfektioner. Infektioner med svåra lokala symtom och allmänreaktioner, som ses ffa hos kvinnor, är endast toppen av ett isberg. Vid primär infektion är lesionerna som regel utbredda, på båda sidor om medellinjen. Latenta infektioner reaktiveras upprepade gånger och kan ge upphov till såväl kliniska (vanligen ensidiga) som subkliniska infektionstillstånd. Intervallen mellan kliniska recidiv kan variera från veckor till år och varierar liksom svårighetsgraden avsevärt hos olika individer. Herpesdiagnos som enbart baseras på anamanes och kliniska symtom är inte sällan fel, och en säker diagnos kräver laboratoriediagnostik. En negativ anamnes är mycket opålitlig; bland gravida i Stockholm som var seropositiva mot herpes typ 2 angav endast 1 av 5 symtom motsvarande genital herpes. Recidiverande genital herpes är i svenska material till 95-98 % orsakade av herpes simplex typ 2, andelen typ 1 infektioner bland primära infektioner är 31 I 6 Allmän och klinisk deI högre, upp till 80 % (1). Herpesförändringar kan ibland vara svåra att känna igen kliniskt. Systematisk herpesdiagnotik på STI-klientel avslöjar herpesinfektioner med små atypiska manifestationer som sprickbildningar etc, som annars skulle undgå upptäkt. Komplikationer förekommer i form av neurologiska manifestationer; neuropati, i enstaka fall blåspares eller meningit samtidigt eller i efterförloppet till genital infektion (med eller utan genitala symtom). Meningit orsakad av herpes typ 2 kan recidivera. Enstaka fall av nekrotiserande cervicit kan inträffa. Genital herpesinfektion kan via förlossningskanalen överföras från mor till barn vid födelsen. Neonatal herpes-infektion kan ha ett mycket svårartat förlopp med encefalit och resttillstånd. En primär infektion hos modern strax före eller vid tidpunkten för partus utgör mycket stor risk men även vid en recidivinfektion kan överföring ske och orsaka encefalit. Den prospektiva risken i Stockholm är liten eller cirka 1:15000 födda barn (cirka 1:6000 mödrar med genital herpes) (3). Intrauterina infektioner är sällsynta men förekommer ibland vid primär genital HSV-infektion under graviditet, med svåra skador på t. ex. nervsystemet som följd. Det är därför av stor vikt att sådana infektioner behandlas, särskilt under tidig graviditet. Hos immunsupprimerade, exempelvis transplanterade och aidspatienter, kan genitala herpesrecidiv vara svårläkta och progrediera lokalt. Centrala nervsystemet kan invaderas av en eller flera herpesstammar. Klinisk differentialdiagnos är genitalt lokaliserad herpes zoster som kan ha en med herpes simplex-infektion identisk klinisk bild. Slemhinnelesioner av annan orsak kan vara omöjliga att skilja från genital herpes. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 13 speciell del Laboratoriediagnostik: Se D 13 speciell del. Genital herpes är en underdiagnostiserad infektion av både läkare och patient. Vid recidiverande besvär är det önskvärt att minst en gång fastställa herpesdiagnosen virologiskt hos individ med misstänkt genital HSV-infektion, tex med PCR. Därigenom erhålls möjlighet att ge adekvat behandling och att vidta smittförebyggande åtgärder. I samband med förlossning och vid misstanke på herpesinfektion under ett barns första 4-6 levnadsveckor bör en snabb aktiv diagnostik genomföras för att förebygga/behandla en svår sjukdom hos barnet. Svår sjukdom, speciellt hos 32 I 6 Allmän och klinisk deIi immunsupprimerade individer, kräver snabb diagnos för adekvat behandling. Specifik virologisk diagnostik bör användas eftersom resultaten är överlägsna dem som erhållits med tidigare använda histopatologiska färgningsmetoder (t ex. Papanicolau). Diagnostiken bygger främst på identifiering av HSV genom DNA-påvisning, antigenpåvisning eller med virusodling (4). Tillfredsställande diagnosmetoder för användning bedside finns ej tillgängliga. Behandling: Effektiva antivirala medel finns tillgängliga i form av nukleosidanaloger som hindrar herpesvirusreplikation (t ex. acykloguanosin – Zovirax® och Geavir®, famciclovir - Famvir®, samt fosfonomyrsyraFoscarnet®) och har god klinisk effekt vid tidigt insatt behandling (4). Eliminering av den latenta infektionen är ännu ej möjlig, men långtidsbehandling undertrycker effektivt skov hos patienter med hög frekvens herpesrecidiv . Bland naturligt förekommande herpesstammar kan känsligheten för ett antiviralt medel variera mer än 100 gånger. Även inom en viruspopulation kan finnas en ansenlig spännvidd i preparatkänslighet. Resistenta stammar selekteras lätt vid in vitro försök. I den kliniska situationen är resistensutveckling betydligt ovanligare och har uppkommit främst vid långtidsbehandling av starkt immunsupprimerade patienter. Byte av terapi från Zovirax®, Geavir® och Famvir® till Foscarnet® är vanligen effektivt eftersom korsresistens ej föreligger mellan nukleosidanaloger och fosfonomyrsyra. REFERENSER: 1. Löwhagen, G-B, Tunbäck P, Andersson C, Bergström T, Johannisson G. First episode of genital herpes in a Swedish STD population: a study of epidemiology and transmission by the use of herpes simplex virus (HSV) typing and specific serology. Sex Transm Dis 2000; 76:179-182. 2. Lafferty WE, Coombs RW, Beneditti J, Critchlow C, Coerey L. Recurrences after oral and genital herpes simplex virus infection. Influence of site of infection and viral type. N Engl J Med. 1987; 316:1444-1449. 3. Forsgren M, Malm, G. Herpes simplex virus and pregnancy. Scand J Infect Dis Suppl. 1996; 100:14-19. 4. Gupta R, Warren T, Wald A. Genital herpes. Lancet. 2007; 370:2127-2137. 33 I 6 Allmän och klinisk deI Genital papillomvirus-infektion (A63.0) Etiologi: Humana papillomvirus (HPV), elementkod MSHD10213 Smittämnet: Humana papillomvirus är små, stabila, icke-höljebärande DNAvirus inom familjen Papillomaviridae. Genomet är en dubbelsträngad cirkulär DNA-molekyl som är uppbyggd av cirka 7.900 nukleotider. All kodande information är lagrad på en av DNA-strängarna. Sex tidiga gener, El, E2 och E4-E7, kodar för regler- och replikationsfunktioner och två sena gener, L1 och L2, kodar för viruskapsidbyggstenar. Hittills har 113 humana papillomvirustyper identifierats och fullständigt sekvensbestämts. Dessutom föreligger ytterligare ett hundratal identifierade men ännu inte klassificerade papillomvirussekvenser. De olika typerna kan klassificeras i olika genetiskt besläktade species. Typer inom samma species har påtagliga likheter beträffande sin tropism (hud eller slemhinna), väsentlig överföringsväg (indirekt kontaktsmitta eller sexuellt överförda) samt vilka sjukdomar de orsakar och deras onkogena potential (vårtor, kondylom eller cancer). Figur 4. Humana papillomvirus. Foto; Kjell- Olof Hedlund, Smittskyddsinstituetet. 34 I 6 Allmän och klinisk deIi HPV-typer som infekterar huden Flertalet kutanta HPV-infektioner är helt asymtomatiska. För etablering av infektion krävs att virus infekterar delande celler i basalcellslagret. I synnerhet de virus som orsakar vårtor sprids lättare till skadat epitel som t.ex. hudsprickor vid handbollsspel eller uppblött epitel i simhallar. En stor grupp virus, som vanligen ger asymtomatiska infektioner, kan dock nå basalclellslagret i intakt hud via hårsäckar. HPV-typ 1 är den dominerande orsaken till fotvårtor, medan HPV typ 2 är den vanligaste orsaken till hudvårtor på andra ställen på kroppen. HPV-typer som infekterar slemhinnor. Dessa virus indelas i två kategorier, lågrisktyper och högrisktyper, med avseende på samband med malignitet. Lågrisktyperna som orsakar kondylom (könsvårtor) är sinsemellan nära besläktade, HPV-typerna i species A6 i synnerhet HPV 6 och 11 är dominerande orsak till kondylom. Högrisktyperna som orsakar cancer finns huvudsakligen i 2 sinsemellan avlägset besläktade grupper: HPV 16 och dess släktingar HPV 35, 31, 33,58 och 52 i species A9 samt HPV 18 och dess släktingar HPV45 och 68 i species A7. HPV 16 är den dominerande orsaken till cervixcancer och andra HPV-orsakade cancerformer. HPV16s släktingar i species A9 kan också orsaka cervixcancer, men inte med lika hög risk som HPV16. HPV18 och dess släktingar orsakar i synnerhet adenocarcinom i cervix, medan HPV16 och A9-species i första hand orsakar skivepitelcancer. Klinik: Kutana HPV kan orsaka vårtor på huden. Det finns ännu inte ett enda fall beskrivet av malignifiering av sådana varför hudvårtor är ett begränsat medicinskt problem. Hudcancer är HPV-associerad hos patienter med den mycket sällsynta immunbristsjukdomen epidermodysplasia verruciformis. En tredjedel av dessa patienter får skivepitelcancer på solbelyst hud. I lesionerna påvisas HPV 5 eller HPV 8. HPV kan även påvisas i hudcancer som uppstår hos njurtransplanterade som står på livslång immunsuppression. Kondylom (sexuellt överförda s.k. könsvårtor) återfinns i larynx, i munhålan och anogenitalt. Respiratorisk papillomatos innebär kondylom i luftvägarna. Detta är en mycket sällsynt sjukdom, men den är av medicinsk betydelse eftersom stämbanden engageras och sjukdomen har ett recidiverande, progredierande förlopp som allvarligt kan hota andningen. Anogenitala kondylom är mycket vanliga. Årlig incidens i Sverige är uppskattad till cirka 40000 behandlingskrävande fall, Kondylom innebär därför ett påtagligt medicinskt problem av både somatisk och psykosocial natur. 35 I 6 Allmän och klinisk deI Kondylom läker ofta spontant utan terapi men det är inte ovanligt med långvariga problem i form av förhårdnader och smärtsamma fissurer. Recidiv efter behandling är vanligt. I enstaka fall kan malignifiering förekomma. Så kallade Buschke-Löwenstein-tumörer eller jättekondylom är maligna tumörer som uppstår ur ohämmat tillväxande kondylom. Både cervikal skivepitelcancer och adenocarcinom i cervix uteri hos kvinnor och analcancer är regelmässigt orsakade av högrisk HPV, vanligen HPV16. Vulvacancer är HPV-orsakad i cirka 30 % av fallen. Vaginalcancer, peniscancer och tonsillcancer är HPV-orsakade i cirka 50 % av fallen. HPV-associerad tonsillcancer skiljer sig från HPV-negativ tonsillcancer genom att inte ha rökning och alkoholkonsumtion som riskfaktor, men förekommer företrädesvis hos yngre och har munsex som riskfaktor. HPV-associerad tonsillcancer är mer känslig för radioterapi än den HPV-negativa formen. Incidensen av HPV-positiv tonsillcancer är i stigande, medan incidensen för HPV-negativ tonsillcancer förefaller att minska. Cervixcancer hos kvinnor förekommer över hela jorden men den geografiska fördelningen är mycket ojämn. I vissa delar av latinamerika och Afrika söder om Sahara förekommer livstidsrisker för cervixcancer på uppemot 10 %. De lägsta cervixcancertalen förekommer i Kuwait samt hos ortodoxa judar i Israel. Livstidsrisken för cervixcancer i Sverige var cirka 2 % innan införande av det allmänna gynekologiska cellprovtagningsprogrammet och har idag sjunkit till cirka 0,5 %. Skillnaden i förekomst av cervixcancer kan till allra största delen förklaras med skillnader i sexualvanor, med medianantalet sexualpartner över livstiden hos männen som den viktigaste faktorn. Väl organiserade screeningprogram förklarar den ytterligare skillnad i förekomst som ses. Det finns otvetydiga både experimentella och epidemiologiska belägg för att högriskpapillomvirustyper orsakar invasiv cervixcancer. Nästan samtliga fall av cervixcancer innehåller någon typ av HPV. I samtliga cellinjer som har etablerats från kvinnor med cervixcancer kan HPV påvisas, även om cellinjerna odlats in vitro under lång tid. Papillomvirusgenomet kodar för två tidiga genomprodukter, E6 och E7, som förmår immortalisera keratinocyter. E6 binder till p53-proteinet och aktiverar ett p53-specifikt proteas som bryter ned detta. I cervixcancer ser man vanligen en icke-muterad p53 gen samt transkription av p53, men inget p53 protein kan påvisas. E7 binder till Rb och inaktiverar den funktionellt genom att förhindra att transkriptionsfaktorn E2F binder till Rb. Genomet innehåller också en genprodukt E2, som utövar en kontroll av expressionen av E6 och E7. 36 I 6 Allmän och klinisk deIi Vid invasiv cancer återfinns HPV -genomet oftare integrerat i det mänskliga genomet än episomalt. Integrationsstället drabbar regelmässigt E2-regionen så att dess roll som repressivt element med effekt på E6 och E7 avblockeras. Epidemiologi: Epidemiologi beskrivs ovan under klinik. Provtagning: Se P 14 speciell del Laboratoriediagnostik:. Se D 14 speciell del. Identifiering och klassificering av humana papillomvirus bygger på molekylärbiologisk metodik. Mikrobiologisk diagnostik av HPV–infektion är känsligare än cytologisk diagnostik avseende förekomst av förstadier till cervixcancer. I Sverige rekommenderas HPV-diagnostik av Svensk Förening för Obstetrik och Gynekologi som ett diagnostiskt hjälpmedel vid fynd av lätt cellförändring eller eljest oklar cytologi. Eftersom nästan samtliga cervixcancrar är HPVassocierade behöver HPV-negativa cytologiska fynd inte närmare utredas. Användning av HPV-test som kontroll efter behandling rekommenderas för att förutsäga recidivrisk. I synnerhet i USA används HPV-test som ett primärt screeningtest i stället för cytologi. Även om testet är mera känsligt, så har det lägre specificietet än cytologi och om och hur HPV-test kan komma att användas inom allmän screening i Sverige är ännu oklart. Behandling: Det finns ännu ingen specifik antiviral behandling. Mot vårtor används olika former av destruktiva eller cytolytiska behandlingar. Mot kondylom kan antingen ett cytotoxiskt medel (podofyllotoxin), ett immunstimulernade medel (imikvimod), kirurgi, frysning eller bränning användas. HPV-orsakade cellförändringar behandlas vanligen kirurgiskt, men frysning och bränning förekommer också. Prevention: Vaccination med virus-lika partiklar är godkänt i Sverige sedan 2006. Dessa vaccin ger ett huvudsakligen typ-specifikt skydd, dvs de fungerar i huvudsak endast mot de virus som finns i vaccinet. I Sverige finns idag två vacciner godkända, ett mot HPV16 och 18 samt ett mot HPV6, 11, 16 och 18. Bägge skyddar bra mot infektion med de viktigaste cancerframkallande HPVtyperna. Kondylom och respiratorisk papillomatos som orsakas av HPV6 eller 11 förebyggs dock endast om vaccinet innehåller HPV6 /11. Vaccination har ingen terapeutisk effekt för redan infekterad individ och det är därför viktigt att vaccination ges tidigt i livet- bäst effekt nås om de ges före eller strax efter sexualdebuten. Socialstyrelsen har föreslagit allmän vaccination av 11-12-åriga 37 I 6 Allmän och klinisk deI flickor i skolan i Sverige och vaccination av flickor i åldrarna 13-17 år ingår i läkemedelsförmånen. REFERENSER 1. Swedish National Board of Health and Welfare. Background to a vaccination program against Human Papillomavirus in Sweden. SoS-rapport 2008. 2. Arbyn, M., Dillner, J., Schenck, U., Nieminen, P., Weiderpass, E., Da Silva, J.D., Jordan, J., Ronco, G., McGoogan, E., Patnick, J., Sparen, P., Herbert, A. and Bergeron, C. Methods for screening and diagnosis. In: “European guidelines for quality assurance in cervical cancer screening - Second edition”. Luxembourg: Office for Official Publications of the European Communities. Kapitel 3, 69-152. 2008. 3. Dillner, J., Arbyn, M. and Dillner, L. Monitoring of Human Papillomavirus vaccination. Clinical and Experimental Immunology. 2007; 148:199-207. 4. Bistoletti, P., Ellström, A., Dillner, J., Sennfält, K., Sparén, P. and Strander, B. Cervix cancer screening can be cost-effective. Combination of vaginal smears and the HPV test should be even more beneficial. Läkartidningen 2005; 24:1874-1879. 5. Arbyn, M., Sasieni, P., Meijer, C.J., Clavel, C., Koliopoulos, G. and Dillner, J. Clinical applications of HPV testing: A summary of meta-analyses. Vaccine. 2006; 24 (Suppl 3):S78-89. Gonorré (A54) Etiologi: Neisseria gonorrhoeae, elementkod ATCC 19424 Smittämnet: Genus Neisseria inom bakteriefamiljen Neisseriaceae innehåller två genetiskt och morfologiskt närbesläktade humanpatogena arter, N. gonorrhoeae (gonokocker, GC) som orsakar gonorré och N. meningitidis (meningokocker, MC) som orsakar meningokockinfektion t.ex. septikemi/meningit. Till genus Neisseria hör även ”apatogena” arter som t.ex. N. lactamica, N. sicca, N. subflava, N. mucosa, N. flavescens och N. cinerea. Flertalet av dessa hör till normalfloran i framförallt övre luftvägarna och orsakar sjukdom endast i undantagsfall, t.ex. hos immunosupprimerade. N. gonorrhoeae identifierades redan 1879 av Albert Neisser och odlades 1882 (Leistikow och Loeffler). De är gramnegativa diplokocker (1,25-1,6 μm långa och 0,7-0,8 μm breda) med konkava ytor riktade mot varandra, så att de i mikroskop är snarlika njurar/kaffebönor. Bakterierna är obligat patogena, aeroba, näringskrävande, saknar flageller, producerar oxidas och katalas men ej 38 I 6 Allmän och klinisk deIi endosporer. N. gonorrhoeae kräver för växt CO2 (4-6 % är optimalt), cystein, och en energikälla (t.ex. glukos). Genomet hos referensstammen N. gonorrhoeae FA 1090 består av en cirkulär kromosom innehållande cirka 2,15 miljoner baspar. Majoriteten av kliniska isolat innehåller en kryptisk plasmid och plasmider som kodar för β-laktamas (TEM-1) är relativt vanliga. Bakterien kan även innehålla en överförbar konjugativ plasmid som dessutom kan överföra β-laktamas plasmider. Viktiga kromosomalt kodade molekyler är pili (typ IV), IgA1 proteas samt yttermembranstrukturer som lipooligosackarider (LOS), transferrin bindande proteiner, Opa proteiner och porinet PorB. Patogenes: N. gonorrhoeae har människan som enda naturliga värd. Bakterien överlever kort tid utanför värden på grund av hög känslighet för extrema temperaturer, uttorkning, oxidering, toxiska substanser och krävande näringsbehov. Bakterien smittar primärt under sexuell aktivitet genom direktkontakt mellan slemhinnorna urogenitalt, analt, eller orofaryngealt. Nyfödda kan smittas i samband med födseln. Patogenesen är relaterad till initial adhesion huvudsakligen till icke-cilierat cylinderepitel i uretraslemhinnan hos män och endocervikala slemhinnan hos kvinnor via bakteriernas pili. Sekundärt sker en intim adhesion med hjälp av pili, Opa-proteiner, iC3b, PorB och LOS (även endotoxinaktivitet) med efterföljande endocytos i cylinderepitel och penetration av slemhinnan samt interaktion med immunsystemet, framförallt polymorfnukleära leukocyter (PMNL) men även andra leukocyter och celltyper. Klinik: Inkubationstiden är vanligen 1-10 dagar. Gonorré hos män uttrycks ofta som akut uretrit associerad med purulent, mukös flytning från uretra, dysuri, och miktionssveda. Infektionen ska alltid behandlas, även om den kan läka ut spontant, då den kan orsaka komplikationer som uretrastriktur, prostatit och epididymit, vilka kan leda till infertilitet. Kvinnor får framförallt en okomplicerad cervicit, ofta med samtidig uretrit, karakteriserad av cervikovaginal flytning, sveda och ibland blödning. Allvarliga komplikationer inkluderar pelvic inflammatory disease (PID) manifesterad som salpingit, endometrit, tubo-ovariala abscesser, etc. Senkomplikationer som extrauterin graviditet och infertilitet kan förekomma men är numera relativt sällsynta i Sverige. Asymtomatisk infektion förekommer hos 5-20 % av infekterade män och 30-50 % av kvinnor, siffrorna varierar beroende av studie och population. Anorektal och orofaryngeal gonorré, ofta asymtomatiska, är vanligt förekommande hos män som har sex med män (MSM) men förekommer även hos heterosexuella individer. N. gonorrhoeae kan också orsaka konjunktivit, framförallt hos nyfödda 39 I 6 Allmän och klinisk deI (ophthalmia neonatorum) som smittas av modern i samband med förlossningen men även hos vuxna. Disseminerad gonokockinfektion (DGI) förekommer sällsynt. DGI är ofta associerad med obehandlad asymtomatisk infektion och eventuellt brist på komplementfaktorerna C7, C8 och C9. Kliniska manifestationer vid DGI är feberepisoder i kombination med septikemi, diskreta hudutslag (dermatit) och artrit samt i sällsynta fall endokardit och meningit. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 4 speciell del Laboratoriediagnostik: Se D 4 speciell del. Isolering av N. gonorrhoeae genom odling är referensmetodik. Se vidare under speciell del. Behandling: Traditionell behandling av okomplicerad genital gonorré sker som en- eller tvådosbehandling (numera framförallt endos) med krav på utläkning i >95 % av fallen när isolatet är känsligt för medlet ifråga. På grund av den snabbt ökande och utbredda antibiotikaresistensen, bristen på aktuella kliniska studier och att empirisk behandling ofta initieras innan resultat från resistensundersökning erhållits så används numera ofta en modifierad riktlinje, dvs. när resistensen mot ett individuellt antibiotikum är ≥5 % så ska antibiotikumet exkluderas från de rekommenderade förstahandspreparaten. I möjligaste mån bör även farmakodynamiska och farmakokinetiska parametrar vägas in i bedömningen. Rekommenderade förstahandspreparat är ceftriaxon (250 mg intramuskulärt ×1), cefixim (400 mg per os ×1, ej optimalt vid extragenital gonorré), spektinomycin (2 g intramuskulärt ×1; t.ex. vid allvarlig allergi mot β-laktam antibiotika men ej idealt vid extragenital, framförallt oropharyngeal, gonorré) och i undantagsfall, efter resistensundersökning, azitromycin (2 g per os ×1) eller ciprofloxacin (500 mg per os ×1). Patienten kan förklaras smittfri efter kontrollodling, cirka 7-10 dagar efter avslutad behandling, om isolerad bakteriestam är känslig för administrerat antibiotikum, patienten är symtomfri och inga indikationer på reinfektion föreligger. I annat fall, överväg kompletterande antibiotikabehandling, specialistkonsultation, eller ett andra kontrollprov. Infektion i orofarynx och rektum kan vara mer svårbehandlad och vid DGI ges alltid parenteral behandling. Prevention: Inget effektivt vaccin mot gonorré finns ännu tillgängligt trots intensiv forskning framförallt under tidigare decennier. Preventionen är således baserad på användning av kondom, tillgänglig och effektiv diagnostik, 40 I 6 Allmän och klinisk deIi antibiotikabehandling och övervakning av epidemiologiska karakteristika och antibiotikakänslighet hos bakterien. Viktigt är snabb och högkvalitativ kontaktspårning, information, utbildning, och rådgivning liksom kontrollåtgärder och interventioner riktade mot hela eller delar av populationen som exempelvis högriskgrupper som MSM och yngre heterosexuella. REFERENSER 1. Janda W. M., and C. A. Gaydos. 2007. Neisseria, p. 601-620. In Murray PR, Baron EJ, Jorgensen JH, Landry ML, and Pfaller MA (eds.). Manual of clinical microbiology, 9th ed., vol. 1. ASM Press, Washington, D.C., USA. 2. Savicheva, A., E. Sokolovsky, N. Frigo, T. Priputnevich, T. Brilene, J. Deák, R. Ballard, C. Ison, A. Hallén, M. Domeika, and M. Unemo. Guidelines for laboratory diagnosis of Neisseria gonorrhoeae in East-European countries. Part 1: Gonorrhoea, sampling, and microscopy for diagnosis. Acta. Medica Lituanica. 2007; 14:65-74. 3. Sparling, P. F., and H. H. Handsfield. 2000. Neisseria gonorrhoeae, p. 2242-2258. In G. L. Mandell, J. E. Bennett, and R. Dolin (ed.), Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 5th ed. Churchill Livingstone, Inc., Philadelphia, Pa. 4. Van Dyck, E., A. Z. Meheus, and P. Piot. Gonorrhoea. In: Laboratory diagnosis of sexually transmitted diseases. World Health Organization (WHO), Geneva; 1999:121. 5. Sexually Transmitted Diseases. 4th edition, Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH (eds.). McGraw-Hill Professional, New York, USA. 2007. Hepatiter Smittämnen vid hepatiter: Akut hepatit kan förorsakas av ett flertal virus som infekterar levern. Fem typer, hepatit A, B, C, D, E virus, har karakteriserats och tycks kunna förklara nästan alla fall av virushepatit. Alla fem tillhör olika virusfamiljer och är vitt spridda i världen med var för sig unik epidemiologi. Den dominerande smittvägen för hepatit A och E är fekal-oral och för B och C, och D parenteral. Det kliniska förloppet vid akut hepatit är snarlikt oberoende av vilken typ som är etiologiskt agens. Även om vissa särdrag kan urskiljas, och det epidemiologiska mönstret kan vara vägledande, kan etiologisk diagnos oftast inte säkert ställas utan laboratorietester i det enskilda fallet. REFERENSER Viral Hepatitis, third edition, editors: Thomas. HC, Lemon S and Zuckerman AJ. Blackwell Publishing Ldt 2005 41 I 6 Allmän och klinisk deI Hepatit B (B16, B18.1) Etiologi: Hepatit B virus (HBV), elementkod MSHD006515. Smittämnet: HBV är ett höljeförsett DNA-virus i familjen Hepadnaviridae. HBV går inte att odla in vitro. Den fullständiga viruspartikeln, Danepartikeln, består av ett delvis dubbelsträngat DNA, omslutet av en nukleokapsid, kallad HBcore antigen (HBcAg) mot vilket antikroppar (anti-HBc) uppkommer tidigt under en infektion och kvarstår livslångt. Nukleokapsiden är innesluten i höljeproteinet HBsAg, som utöver virionen dessutom produceras i stort överskott utan DNA-innehåll (figur 5). Ett lösligt protein, HBeAg, bildas även och markerar hög smittsamhet. När motsvarande antikropp, anti-HBe, uppkommer brukar smittsamheten minska hos många men inte alla. Figur 5: Hepatit B-virus partiklar och antigen. Dessutom finns ett i plasman lösligt virusprotein HbeAg. Bild; Anders Widell Patogenes: Hepatit B virus infekterar hepatocyter men är i sig inte cytolytiskt. HBV utnyttjar genomiskt RNA och reverst transkriptas vid ett steg i replikationen och liknar därvid retrovirus. Leverskadan uppkommer först flera månader efter smitta som ett resultat av T-cellsförsvar. Infiltrationen av inflammatoriska celler kan leda till fibros och bindvävssepta i levern med upkomst av levernoduli, cirrhos och ibland primär levercancer. Hepatit B virus integrerar ofta i värdcellen men integrerat HBV DNA kan inte underhålla 42 I 6 Allmän och klinisk deIi replikationen vilken i stället säkras i så kallad ”covalently closed circular cDNA” vilka utgör en viktig infektiosreservoar i levercellerna. Klinik: Efter smitta följer en lång inkubationsfas med tilltagande viremi, länge utan symtom men ofta övergående i ospecifika prodromalsymtom som trötthet, matleda, ledvärk. Tre till 6 månader efter smittotillfället, debuterar hos cirka 60 % av de smittade kliniska symtom med gulsot, kittfärgad feces, mörk urin, klåda, ikteriska sklerae samt ikterus i huden. Oftast räcker det cellulära och humorala svaret till för att kontrollera och efter någon eller några månader eliminera de infekterade levercellerna så att viremin minskar och infektionen avbryts. I de flesta fall utvecklas immunitet mot förnyad smitta utifrån, även om mycket låga virusnivåer kan finnas kvar i decennier. Dessa låga nivåer saknar i regel klinisk betydelse frånsett att det någon gång kan ske aktivering i samband med immunsuppression. Läkning sker i cirka 90 –95 % av de som smittats i vuxen ålder. Någon enstaka gång blir den immunologiska läkningsmekanismen alltför kraftig och patienten får akut fulminant hepatit och riskerar att avlida. Motsatsen är långt vanligare, i synnerhet hos barn, och innebär att HBV- infektionen passerar subkliniskt. En stor del av jordens befolkning, framför allt Asien och Afrika, har genomgått hepatit B-infektion utan att veta om det. Hos cirka 5 % av akut hepatit B-infekterade individer sker emellertid inte denna läkning utan infektionen blir kronisk. Man brukar sätta gränsen för kronisk HBV-infektion när HBsAg-positivitet kvarstått mer än 6 månader. Kroniskt HBsAg-bärarskap kan vara förenat med höggradig eller lägre grad av smittsamhet, och ofta gå symtomfritt under många år eller resten av livet. Ibland föreligger immuntolerans under ett antal år utan påtaglig leverskada. Sådan uppkommer däremot under eliminationsfasen då immunsvaret blir mer aktivt. Vissa kroniskt HBV- infekterade individer utvecklar mer eller mindre snabbt accelererande leverskada, cirrhos eller levercancer. Kronisk HBV-infektion är liksom kronisk HCV- infektion globalt viktiga orsaker till levercancer. Man räknar med att cirka 360 miljoner människor är kroniskt HBV infekterade. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 16 speciell del 43 I 6 Allmän och klinisk deI Tabell 1. De vanligaste mönstren av HBV markörer HBsAg HBeAg antiHBe antiHBc antiHBc IgM antiHBs HBV Diagnos DNA - - - - - - - Ej HBV-inf - - - - - - + Tidig inkubationfas + + - - - - +++ Akut HBV-inf, inkubationfas + + - + + - ++++ Akut HBV-infektion + + + + + - +++ Akut HBV- infektion + - + + + - ++ Akut HBV- infektion - - + + + - (+) ”Fönsterfas” läkande akut HBV- infektion + + - + - - +++ Kron HBV-bärare, höggradigt smittsam + - + + - - +/- Kron HBV-bärare, mindre smittsam - - + + - + - Utläkt HBV-inf - - - - - + - Vaccinerad, immun Diagnostik: Se under laboratoriediagnostik, avsnitt D.16. Under hepatit B - infektionen uppträder i cirkulationen efter hand en rad virusmarkörer vilka kan utnyttjas vid HBV diagnostik. Markörerna är såväl DNA som antigen och motsvarande antikroppar. Höga nivåer av anti-HBc av 44 I 6 Allmän och klinisk deIi IgM klass i serum föreligger under akutfasen och används för att vid nyupptäckta HBsAg positiva fall skilja ut individer med färsk infektion. När antikroppar mot HBsAg (anti-HBs) uppträder uppkommer immunitet. Sådan kan även erhållas med vaccination (tillfört HBsAg), som ger upphov till antiHBs i serum. Förekomst av enbart anti- HBs > 10 IU/mL talar för vaccineffekt. Finns även anti-HBc har individen haft en HBV- infektion som läkt. Laboratoriediagnostiska kriterier: För akut hepatit B-infektion gäller minst ett av följande fynd: Påvisande av hepatit B ytantigen (HBsAg), påvisande av hepatit B virus-nukleinsyra (HBV DNA) och påvisande av hepatit B anti-core IgM (anti HBc IgM) antikroppar i serum eller påvisande av enbart HBV-DNA, med/utan HBsAg och utan antiHBc (under tidig inkubationstid/fönsterfas). För kronisk hepatit B-infektion gäller: Påvisande av heptatit B ytantigen (HBsAg) i serum och påvisande av hepatit B anti-core IgG (anti-HBc IgG) i serum och ej påvisbar eller låg nivå av hepatit B anti-core IgM (anti-HBc IgM) virus i serum. Behandling: 6-12 månaders interferonbehandling med depå-interferon (pegylerat IFN) kan ge läkning i upp till 10 % och har bäst effekt mot genotyperna A och B men sämre mot genotyp C. Pegylerat IFN är dyrt och orsakar biverkningar. En rad medel, varav flera även används mot HIV och dess reverst transkriptas, vinner nu starkt ökad användning mot hepatit B. Exempel är Lamuvidin som är atoxiskt men som alltid ger resistens efter något eller några års behandling. Nyare medel är Adefovir och Tenefovir. En sammanställning av de senaste behandlingsrekommendationerna finns på Läkemedelsverkets hemsida (http://www.lakemedelsverket.se). Prevention: Vaccin finns sedan 25 år och ges i tre doser. I Sverige rekommenderas vaccinet till olika riskgrupper såsom sjukvårdspersonal, dialys och hemofilipatienter, intravenösa missbrukare och intagna i kriminalvården med missbruksanamnes, män som har sex med män (MSM), sexualpartners till känt HBV-smittade. Familje- och dagiskontakter kring smittade barn vaccineras. Gravida kvinnor screenas avseende HBsAg för att förhindra vertikal smitta. Barn till HBV-infekterade mödrar vaccineras. Generell barnvaccination finns i nästan alla världens länder medan Sverige utreder frågan. Blodsmittescreening vidmakthåller blodsäkerheten vid transfusion. 45 I 6 Allmän och klinisk deI REFERENSER 1. Kao JH. Diagnosis of hepatitis B virus infection through serological and virological markers. Expert Rev Gastroenterol Hepatol. 2:553-62; 2008 2. Alazawi W, Foster GR. Advances in the diagnosis and treatment of hepatitis B. Curr Opin Infect Dis. ;21:508-15; 2008 Hepatit C (B17.1 och B18.2) Etiologi: Hepatit C virus (HCV), elementkod MSHD016174. Smittämnet: Hepatit C virus (HCV) är ett höljeförsett enkelsträngat RNA virus och tillhör genus Hepacivirus inom familjen Flaviviridae och finns i 6 genotyper, 1-6, som vardera är indelade i ett stort antal subtyper benämnda med små bokstäver 1a, 1b, 1c osv. Liksom HBV infekterar HCV endast människa och schimpans. Hepatit C upptäcktes så sent som 1989. Patogenes: HCV infekterar i första hand hepatocyter men även i viss mån perifera mononukleära blodceller. Liksom HBV orsakar inte HCV i sig cytopatiska förändringar i levern utan denna är immunologiskt betingad. Viremi uppkommer någon vecka efter smittillfället och viremin når snabbt hög nivå. Viremin inleds med cirka 2 månaders symtomfri period utan antikroppar. Under denna viremiska fönsterfas märks ingen nämnvärd leverskada. När leverskadan kommer brukar virus minska eller rentav försvinna från cirkulationen, antingen för gott eller bara för en tid . I cirka 80 % återkommer viremin för att sedan bli kronisk och spontanläker i regel inte. Klinik:. Till skillnad mot HBV sprids HCV bara sällan genom heteosexuell kontakt eller från modern till det nyfödda barnet. Huvudgruppen av smittade i samhället är intravenösa missbrukare, som ofta smittas tidigt efter injektionsdebuten. Herpes simplex-infektion hos den HCV-smittade bäraren tycks inte ha betydelse, däremot kan herpesleisoner hos den exponerade öka mottagligheten för sexuell HCV smitta. Till skillnad från hepatit B är själva det akuta hepatitskovet oftast lindrigt och bara i 10-20 % förenat med ikterus. Fulminant akut hepatit C är mycket ovanlig. Trots den lindriga akuta bilden utvecklar mellan 50-80 % kronisk HCV infektion. Merparten av såväl akut som kroniskt HCV-smittade är ovetande om sin infektion.. Epidemiologi: Se separat avsnitt i allmän och klinisk del. 46 I 6 Allmän och klinisk deIi Provtagning: Se P 17 speciell del Laboratoriediagnostik: Se under laboratoriediagnostik, avsnitt D.17. Laboratoriediagnostiska kriterier: För akut hepatit C-infektion gäller: I motsats till hepatit A och B saknas helt användbara IgM-test för diagnostik av hepatit C vilket försvårar fastställandet av just akut hepatit C, en infektion som dessutom ofta är subklinisk. Om man har tillgång till tidigare provresultat är serokonversion från negativ anti-HCV-reaktion till positiv i två prov med högst 6 månaders intervall ett starkt indicium för akut infektion vilket kan stärkas av patologiska leverprover visande akut leverskada. Andra indicier är tillkomst av antikroppsrelaterade antikroppsband i immunoblot eller nytillkommen hepatit C viremi. HCV–antigentest kommer i en snar framtid men har lägre känslighet än RNA- påvisande metoder. För kronisk hepatit C-infektion gäller: Påvisande av heptatit C virus-specifikt antikroppssvar och påvisande av hepatit C virus-nukleinsyra (HCV RNA) under mer än 6 månader. Behandling: 6-12 månaders kombinationsbehandling med depå-interferon (pegylerat IFN) tillsammans med peroralt ribavirin är numera standard. Vid genotyp 1a och 1b ses en 40-50 procentig bestående läkning efter 12 månaders behandling, medan man vid genotyp 2 och 3 uppnår en betydligt bättre läkning, cirka 80 %, redan efter 6 månader eller mindre. Båda läkemedlen är mycket dyra och förenade med biverkningar. Hopp knyts nu till nya antivirala medel som är utformade som hämmare till HCV-proteas och polymeras. Utvärdering av dylika medel pågår. Resistenproblematik mot dessa medel är redan känd. En sammanställning av de senaste behandlingsrekommendationerna finns på Läkemedelsverkets hemsida (http://www.lakemedelsverket.se). Det är av värde att under behandling följa virustitrar. Målsättningen är snabb nedgång och icke mätbara virus RNA-nivåer 6 månader efter avslutad behandling. Prevention: Vaccin saknas och ter sig i dag lika avlägset som ett HIV-vaccin. Blodsmittescreening vidmakthåller blodsäkerheten vid transfusion. HCV-studier med molekylär epidemiologisk analys har avslöjat missförhållanden och smittkedjor inom vården, vilka sedan har kunnat åtgärdas. För huvudsmittvägen, intravenöst missbruk, fungerar sprutbytesprogram klart sämre som HCVprevention än som HIV- prevention. Fram till 1990-2 fanns ingen testteknik att förhindra smitta av hepatithepatit C 47 I 6 Allmän och klinisk deI som tidigare kallades non-A, non-B. Risken att smittas med HCV via blod har från 1991-2 upphört i Sverige med införandet av anti-HCV-test av alla blodgivare. Faktorkoncentrat till blödarsjuka var i princip HCV-smittade fram till 1985-6 då pasteurisering riktad mot HIV eliminerade även HCV. REFERENSER 1. Fabris P, Fleming VM, Giordani MT, Barnes E. Acute hepatitis C: clinical aspects, diagnosis, and outcome of acute HCV infection. Curr Pharm Des. 2008;14(17):1661-5. 2. Simmonds P, Bukh J, Combet C, Deléage G, Enomoto N, Feinstone S, Halfon P, Inchauspé G, Kuiken C, Maertens G, Mizokami M, Murphy DG, Okamoto H, Pawlotsky JM, Penin F, Sablon E, Shin-I T, Stuyver LJ, Thiel HJ, Viazov S, Weiner AJ, Widell A. Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology. 42:962-73; 2005 3. McGarvey MJ and Houghton M. Hepatitis C virus structure and molecular virology. Viral Hepatitis, third edition, editors: Thomas. HC, Lemon S and Zuckerman AJ. Blackwell Publishing Ldt pp 381-406; 2005 HIV-infektion (B20-B24) Etiologi: Humant immunbrist virus (HIV-1, elementkod QU63236 och HIV-2, elementkod QU63237) Smittämnet: HIV-1 beskrevs första gången 1983 och HIV-2 några år senare. Båda tillhör släkte (genus) Lentivirus inom retrovirusfamiljen (Retroviridae). Patogenes: Både HIV-1 och HIV-2 infekterar CD4+ lymfocyter (hjälparceller) och andra celler i immunsystemet. CD4-cellerna förstörs gradvis via en process som ännu är ofullständigt känd, men vars hastighet är starkt beroende av virusnivån i plasma hos den infekterade individen. CD4-cellsdestruktionen leder till utveckling av förvärvat immunbristsyndrom (AIDS). HIV-1 och HIV-2 sprids framförallt sexuellt, men även från mor till barn och via blod och blodprodukter, inklusive kontaminerade instrument. HIV smittar inte via alldagliga sociala kontakter såsom handslag eller toalettbesök. Klinik: Några veckor efter smittotillfället utvecklar vissa patienter övergående symtom såsom feber, lymfkörtelförstoring och utslag, d.v.s. en symtomatisk primär HIV-infektion, men cirka 50 % av patienterna har inga sådana symtom. Vanligen följer sedan en asymtomatisk period som kan vara många år. 48 I 6 Allmän och klinisk deIi Figur 6. HIV. Foto; Kjell-Olof Hedlund, Smittskyddsinstitutet En HIV-1-infekterad person som inte får antiretroviral behandling utvecklar AIDS (förvärvat immunbristsyndrom) i medeltal efter cirka 10 år, medan många HIV-2-infekterade personer inte alls utvecklar AIDS. AIDS innebär att en HIVinfekterad patient diagnostiseras med någon av de opportunistiska infektioner eller tumörer som finns listade i de europeiska AIDS diagnoskriterierna (http://www.eurohiv.org). Många patienter uppvisar mer diffusa symtom som trötthet, feber och avmagring en tid innan de utvecklar AIDS. 49 I 6 Allmän och klinisk deI Epidemiologi: Se separat avsnitt i allmän och klinisk del. Provtagning: Se P 18 speciell del Laboratoriediagnostik: Se D 18 speciell del för detaljerad information. Den vanligaste och mest kostnadseffektiva principen för sållningstestning av HIV-1- eller HIV-2-infektion är påvisande av antikroppar med EIA-teknik. S.k. 4:e generationstester (kombotester) som även påvisar HIV p24 antigen rekommenderas eftersom de förkortar den diagnostiska fönsterperioden. Positiva resultat i sållningstest ska konfirmeras med kompletterade antikroppstest och verifieras med uppföljande provtagning. HIV-testning bör utföras på breda indikationer eftersom HIV-infektionen är potentiellt dödlig, men behandlingsbar och eftersom många HIV-infekterade individer inte har några eller bara diffusa symtom. Serologisk testning för HIV bör således utföras bl.a. vid misstänkt exposition eller symtom förenliga med HIV infektion. Dessutom ska alla gravida kvinnor i Sverige erbjudas HIV-test och varje blod- och plasmadonation ska också testas. Behandling: Modern antiretroviral terapi (ART) innebär kombinationsbehandling med minst tre HIV-läkemedel (www.rav.nu). Behandlingen har lett till en dramatisk minskning av antalet AIDS-dödsfall bland HIV-patienter i den industrialiserade delen av världen. Framgångsrik ART leder till mycket låga nivåer av fritt virus i blodet (<50 HIV RNA kopior/mL) och sänkt smittsamhet. Behandlingen botar dock inte patienterna. Behandlingseffekten följs med kvantifiering av HIV RNA i plasma och genotypisk resistenstest används inför behandling och vid behandlingssvikt. Prevention: Ett verksamt HIV-vaccin saknas. REFERENSER 1. Constantine NT, HIV antibody testing. In: Cohen PT, Sande MA, Volberding PA (Eds), The AIDS Knowledge Base, third ed, Lippincott-Williams & Wilkings, Philadelphia, PA, USA, 2003:105-112. 2. Lindbäck S, Thorstensson R, Karlsson AC, von Sydow M, Flamholc L, Blaxhult A, Sönnerborg A, Biberfeld G, Gaines H. Diagnosis of primary HIV-1 infection and duration of follow-up after HIV exposure. Karolinska Institute Primary HIV Infection Study Group. AIDS 2000;14:2333-9. 50 I 6 Allmän och klinisk deIi HTLV-infektion (B33.3) Etiologi: Humant T-lymfotropt virus typ 1 (HTLV-1, elementkod QU63203) och typ 2 (HTLV-2, elementkod QU63229) Smittämnet: HTLV-1 beskrevs första gången 1980 och HTLV-2 några år senare. De tillhör familjen Retroviridae, som HIV, men klassificeras inom släkte (genus) Deltaretrovirus och har andra egenskaper. Sjukdomsförlopp och klinisk bild skiljer sig jämfört med HIV och även den globala epidemiologiska situationen är annorlunda. Patogenes: De patogenetiska mekanismerna för HTLV-associerad sjukdom är inte fullständigt kartlagda. Då de primära målcellerna för HTLV-1/2 är lymfocyter är det logiskt att man får en påverkan på den normala funktionen i immunsystemet, med åtföljande autoimmunitet och malignitet. Vissa virusproteiner, t ex tax, transaktiverar ett stort antal humana gener vilka är aktiva i bl a virusreplikation och cellproliferation. Detta kan ha betydelse för de onkogena effekterna av HTLV. Paressjukdomen HAM/TSP (se klinik, nedan) karaktäriseras av en kronisk inflammation i ryggmärgen associerad med ökad lymfocytinfiltration i anslutning till lesionerna. HTLV sprids i likhet med HIV via blod och kroppsvätskor, men inte via alldagliga sociala kontakter. Klinik: HTLV-1 kan orsaka olika typer av sjukdomstillstånd inkluderande relativt aggressiva blodmaligniteter (adult T-cellsleukemi eller lymfom, ATL), kronisk degenerativ neurologisk sjukdom (HTLV-associerad myelopati, även kallad tropisk spastisk parapares, HAM/TSP) och autoimmuna manifestationer såsom uveit, polymyosit, artrit och Sjögrens syndrom. Totalt beräknas att cirka 10 % av de infekterade drabbas av någon form av symtomatisk sjukdom, medan de övriga blir asymtomatiska bärare livet ut. Inga säkra prognostiska markörer är ännu kända. ATL tycks företrädesvis drabba individer efter mycket lång infektionstid, inte sällan personer som infekterats i barndomen. HAM/TSP uppträder vanligen betydligt tidigare i förloppet. HTLV-2 isolerades först från en patient med hårcellsleukemi. Vidare studier har dock inte styrkt sambandet mellan denna sjukdom och HTLV-2. Detta virus tycks vara mindre benäget att orsaka sjukdom även om ett stigande antal fallrapporter med bl a HAM/TSP-liknande sjukdomsbild, leukemier och autoimmuna manifestationer har kommit. Samtidig HIV-1 och HTLV-2 – 51 I 6 Allmän och klinisk deI infektion har rapporterats ge polyneuropatier hos i v missbrukare. Epidmiologi: Se separat avsnitt i allmän och klinisk del. Provtagning: Se P 19 speciell del Laboratoriediagnostik: Se D 19 speciell del. Alla nya blod- och plasmagivare i Sverige ska testas för HTLV-1/2 – infektion (se också avsnitt om blodgivarscreening). Även par som genomgår utredning för assisterad befruktning (in vitro – fertilisering) ska HTLV-testas. Den vanligaste och mest kostnadseffektiva principen för sållningstestning av HTLV-1/2 är påvisande av antikroppar i serum eller plasma. Serologisk metodik används även för typning mellan HTLV-1 och –2. Behandling: Någon effektiv behandling finns ännu inte. Olika antivirala medel, interferon och kortison har prövats utan långsiktig effekt. Vid ATL har även aggressiv kemoterapi och benmärgstransplantation försökts men ännu inte lett till något genombrott. Prevention: Inriktas i första hand på att undvika smitta vid blodtransfusioner genom att testa nya blodgivare. Infekterade mödrar bör i så stor utsträckning som möjligt undvika att amma sina barn. Sexuell smitta undviks i stor utsträckning med hjälp av kondom. REFERENSER 1. Verdonc K, et al. Human T-lynphotropic virus 1: recent knowledge about an ancient infection. Lancet Inf Dis 2007;7:266-81. 2. Roucoux D, Murphy E. The epidemiology and disease outcomes of human Tlymphotropic virus type II. AIDS Rev. 2004;6:144-54. Review. 3. Tynell E, Andersson S, Lithander E, Arneborn M, Blomberg J, Hansson HB, Krook A, Nomberg M, Ramstedt K, Shanwell A, Bjorkman A. Screening for human T cell leukaemia/lymphoma virus among blood donors in Sweden: cost effectiveness analysis. BMJ. 1998;316:1417-22. 52 I 6 Allmän och klinisk deIi Klamydia (A56) Etiologi: Chlamydia trachomatis, elementkod ATCCVR571 Smittämnet: C. trachomatis tillhör genus Chlamydia inom familjen Chlamydiaceae som omfattar nio arter där även humanpatogenen Chlamydophila pneumoniae (tidigare Chlamydia pneumoniae) och zoonosorsakande Chlamydophila psittaci ingår. De två senare bakterierna orsakar luftvägsinfektioner och avhandlas i Referensmetodik I2, 2:a upplagan. C. trachomatis är en obligat intracellulär bakterie med en unik utvecklingscykel. C. trachomatis indelas i minst 15 olika serotyper baserat på antigena egenskaper hos det dominerande yttermembranproteinet, major outer membrane protein (MOMP). Serotyperna A-C orsakar ögonsjukdomen trakom och typerna L1-L3 orsakar lymfogranuloma venereum. Övriga serotyper D-K överförs sexuellt och är de som normalt diagnosticeras inom mikrobiologisk rutindiagnostik. Bland heterosexuella personer dominerar serotyp E följt av D och F. Hos män som har sex med män (MSM) dominerar serotyperna D, G och J. Patogenes: C. trachomatis alternerar mellan två former; en extracellulär elementarkropp som infekterar mottagliga värdceller och sen omvandlas till en metabolt aktiv förökningsform benämnd retikularkropp. Dessa omvandlas i sin tur till elementarkroppar som frisätts extracellulärt och infekterar nya värdceller. Trots omfattande studier saknas ännu övertygande data om att enskilda MOMPserotyper kan kopplas till vissa typer av symtom eller sjukdom. I en studie har serotyp G ansetts vara associerat till cervixcancer. Sedan flera C. trachomatis-genom sekvenserats pågår nu studier av andra geners betydelse för patogenes. Tryptofansyntetas (1) och typ III sekretionssystem (2) verkar ha stor betydelse för överlevnad och etablering i värdceller. Förmågan att persistera utan symtom leder till tysta komplikationer i form av infertilitet (3). Klinik: Genital klamydiainfektion är symtomlös i 50-70 % av infektionerna och självläker i stor utsträckning (4). Detta innebär att klinisk bedömning är otillräcklig för diagnostik. Uretrit och cervicit är vanliga vid symtomgivande okomplicerad infektion och orsakar miktionssveda och diskret flytning. Hos kvinnor kan oregelbundna småblödningar och blödning vid samlag förekomma. Kvinnor drabbas oftare av komplikationer än män. Komplikationerna omfattar salpingit, inte sällan symtomlös, som kan orskaka ektopisk graviditet eller infertilitet. Klamydia kan även ge infektioner i uterus och bäckenet samt undantagsvis orsaka periappendicit och perihepatit. Vid uppåtstigande infektion 53 I 6 Allmän och klinisk deI är diskreta lågt sittande buksmärtor klassiskt symtom, men symtomfria infektioner är vanliga även vid engagemang av endometriet och tubor. Genomgången klamydiasalpingit är den vanligaste orsaken till tubarfaktorinfertilitet och extrauterin graviditet. Infektioner hos män kan kompliceras av proktit (främst inom gruppen MSM) och epididymit. Klamydia har också associerats med endokardit, reaktiv artrit, astma och pneumoni. Klamydiakonjunktivit ger ofta rejäl rodnad, men ingen påtaglig varig sekretion. Vissa serotyper av C. trachomatis (se ovan) orsakar ögonsjukdomen trakom som kan leda till blindhet. Den sexuellt överförbara och invasiva infektionen lymfogranuloma venereum (se separat avsnitt) som under decennier betraktades som sporadisk importsmitta, har sedan 2004 rapporterats vid utbrott bland MSM. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 5 speciell del Laboratoriediagnostik: Se D 5 speciell del. Sedan mitten av 1990-talet utförs nästan all diagnostik i Sverige med kommersiella metoder baserade på amplifiering av nukleinsyra. Kompletterande metoder är odling, antigenpåvisning med immunofluorescens och olika tekniker för antikroppspåvisning. Odling är fortfarande referensmetod utifrån att den har 100 % specificitet. Den har dock begränsningar för utvärdering av nukleinsyrabaserade metoder, vilka i regel är känsligare än odling. Behandling: Standardbehandling vid okomplicerad genital klamydiainfektion är doxycyklin 100 mg, 2 tabletter första dygnet, därefter 1×1 i 8 dagar. Alternativ är azitromycin, ofloxacin och erytromycin. Okomplicerad klamydiainfektion hos gravid kvinna kan behandlas med amoxicillin under hela graviditeten. Alternativt används doxycyklin under första trimestern och erytromycin i andra och tredje trimestern. Kontrolltest för klamydia ska göras 6 veckor efter behandling av gravida pga att behandlingseffekt kan vara nedsatt. Prevention: Information och rådgivning för att åstadkomma minskat riskbeteende och därmed minska antalet klamydiainfektioner har visat sig vara svårt. Viktiga preventiva åtgärder är därför omfattande diagnostik och behandling kombinerat med obligatorisk smittspårning. Eftersom klamydiainfektioner övervägande är asymtomatiska syftar åtgärder främst till att förebygga infektionskomplikationer hos individen och att hindra smittspridningen i populationen. 54 I 6 Allmän och klinisk deIi Lymfogranuloma venereum (A55) Etiologi: Chlamydia trachomatis serotyper (serovars) L1, L2, och L3, elementkod ATCCVR571 Smittämnen: Lymfogranuloma venereum (LGV) orskas av C. trachomatis av serotyperna L1-L3, vilka är mer invasiva och virulenta än övriga serotyper. Serotyp L2 är vanligast. Se för övrigt under Klamydia. Patogenes: Vid klassisk LGV-infektion förs bakterierna från genitalia via lymfkärl till i första hand inguinala lymkörtlar, där de förökar sig inne i makrofagerna. Men vid LGV-infektioner bland män som har sex med män (MSM) är proktit vanligare och ofta utan förstorade lymfkörtlar. Klinik: LGV debuterar efter en inkubationstid från 3 dagar - 6 veckor med en icke ömmande papel eller ett litet sår på ollonet eller i vaginalslemhinnan. Dessa primära infektionstecken försvinner inom några dagar och är ofta så diskreta att de passerar oförmärkt för den smittade. Uretrit och cervicit kan dock uppträda samtidigt. Efter en latensperiod på cirka 2 - 6 veckor uppträder hos män en, som regel ensidig, inguinal lymfkörtelsvullnad, ofta med abscessbildning, som sjukdomens andra stadium. Samtidigt kan feber, muskel- och ledsmärtor förekomma. Cirka 1/3 av de affekterade körtlarna smälter och rupturerar utåt, medan resterande körtlar kan defektläka till en hård inguinal massa. Hos kvinnor förekommer inguinal körtelsvullnad bara hos cirka 20 %, medan symtom som vid pelvic inflammatory disease (PID) kan förekomma beroende på engagemang av lymfkörtlar i nedre delen av bukhålan och i lilla bäckenet. Artrit, pneumoni, hepatit eller perihepatit förekommer men är ovanliga komplikationer till LGV. Efter en latensperiod, som kan vara i flera år, kan ett tredje stadium av sjukdomen uppträda. Detta kallas ”genitoanorektalt syndrom” och karakteriseras av proktokolit, perirektala abscesser, fistlar, strikturer och hyperplasi av lokal lymfoid vävnad. I slutstadiet kan genital elefantiasis uppstå hos båda könen. LGV-infektioner hos MSM kännetecknas av proktit, förstorade lymfkärl, anorektala sår och förhöjda värden av vita blodkroppar i utstryk från rektum. Kan förväxlas med Crohns sjukdom (5). Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 5 speciell del 55 I 6 Allmän och klinisk deI Laboratoriediagnostik: Se D 5 speciell del. Konventionella rutindiagnostiska metoder för C. trachomatis detekterar även LGV. För att specifikt differentiera LGV från andra klamydiaserotyper krävs en specifik nukleinsyreamplifieringsmetod (realtids-PCR [6]) eller sekvensbaserad typning [7]. Sådan metodik kan användas på prov som använts i rutindiagnostik för klamydia. Hänvisningslaboratorium för LGV-diagnostik är Sektionen för klinisk mikrobiologi, Akademiska sjukhuset, Uppsala. Kontaktperson: Björn Herrmann. Antikroppspåvisning kan ge diagnostiskt stöd vid kliniska symtom som är förenliga med LGV-infektion, men anses inte vara tillräckligt för att konfirmera LGV-fall (8, 9). Behandling: Behandlingstiden är 21 dagar. Förstahandsval vid antimikrobiell behandling är doxycyklin 100 mg två gånger per dag. Alternativt tetracyklin 500 mg 1×4 per dag eller erytromycin 500 mg 4×1 per dag (10). Vid klassisk LGV-infektion är prognosen god i de tidigare stadierna, i tredje stadiet måste behandlingen också omfatta åtgärder mot komplikationerna. Prevention: Starkaste riskfaktorerna är HIV-infektion, samtidig herpes/syfilisinfektion med genitalt sår och tidigare genomgången klamydiainfektion. Högt riskbeteende kännetecknar LGV-infekterade personer. Preventiva åtgärder som vid andra klamydiainfektioner. Riktad information till MSM. REFERENSER 1. McClarty G, Caldwell HD, Nelson DE. Chlamydial interferon gamma immune evasion influences infection tropism. Current opinion in microbiology. 2007 Feb;10(1):47-51. 2. Peters J, Wilson DP, Myers G, Timms P, Bavoil PM. Type III secretion a la Chlamydia. Trends in microbiology. 2007 Jun;15(6):241-51. 3. Hartog JE, Morre SA, Land JA. Chlamydia trachomatis associated tubal factor subfertility: immunogenetic aspects and serological screening. Human Reproductin Update. 2006;12:719-30. 4. Molano M, Meijer CJ, Weiderpass E, Arslan A, Posso H, Franceschi S, et al. The natural course of Chlamydia trachomatis infection in asymptomatic Colombian women: a 5-year follow-up study. J Infect Dis. 2005 Mar 15;191(6):907-16. 5. Van der Bij AK, Spaargaren J, Morre SA, Fennema HS, Mindel A, Coutinho RA, et al. Diagnostic and clinical implications of anorectal lymphogranuloma venereum in men who have sex with men: a retrospective case-control study. Clin Infect Dis. 2006;42:186-94. 56 I 6 Allmän och klinisk deIi 6. Morre SA, Ouburg S, van Agtmael MA, de Vries HJ. Lymphogranuloma venereum diagnostics: from culture to real-time quadriplex polymerase chain reaction. Sex Transm Infect. 2008 Aug;84(4):252-3. 7. Klint M, Lofdahl M, Ek C, Airell A, Berglund T, Herrmann B. Lymphogranuloma venereum prevalence in Sweden among men who have sex with men and characterization of Chlamydia trachomatis ompA genotypes. J Clin Microbiol. 2006;44:4066-71. 8. Ison C. Commentary on Forrester B, Pawade J, Horner P. The potential role of serology in diagnosing chronic lymphogranuloma venereum (LGV): a case of LGV mimicking Crohn’s disease. Sex Transm Infect 2006;82:139–40. Sex Transm Infect. 2006;82:141. 9. Smelov V, Morre SA, de Vries H. Are serological chlamydia-specific markers useful to detect asymtomatic cases of lymphogranuloma venereum proctitis? Sex Transm Infect. 2008 Feb;84(1):77-8; author reply. 10. Macmillan A, van Voorst Vader PC, de Vries HJ. 2007 European guideline (IUSTI/WHO) on the management of proctitis, proctocolitis and enteritis caused by sexually transmissible pathogenst. Int J STD & AIDS. 2007;18:514-20. Molluscum contagiosum (Mollusker) (B08.1) Etiologi: Molluscum contagiosum virus (MOCV, elementkod MSHD008976) Smittämnet: Molluscum contagiosum virus (MOCV) är ett DNA-virus som tillhör virusfamiljen Poxvirinae (1). Fyra subtyper förekommer (2). MOCV 1 är generellt sett vanligast (75-90 %), men geografiska och åldersmässiga skillnader har rapporterats. Ingen skillnad i vilken del av kroppen som infekteras förekommer mellan de olika subtyperna (3). Virusgenomet är uppbyggt av 190.000 nukleotider som kodar för ca 160 gener. Genomet innehåller gener som kodar för dess unika förmåga att undvika immunsystemet som ett IL-18-bindande protein, apoptos- och kemokininhibitorer. MOCV förekommer endast hos människan. MOCV kan inte odlas i konventionella cellkulturer. Identifiering bygger därför på elektronmikroskopi eller molekylärbiologisk metodik. Patogenes: Molluscum contagiosum är en virusinfektion i epidermis som leder till en eller multipla förändringar. Till skillnad från övriga poxvirus som hos människa orsakar allvarlig systemisk sjukdom, orsakar MOCV hos 57 I 6 Allmän och klinisk deI immunkompetenta individer en benign men ofta långdragen kronisk infektion endast i huden, som ibland kan pågå i månader till åratal, då virus utövar en lokal immunosuppressiv effekt. Infektion kan vara extra besvärlig vid lesioner genitalt. Figur 7. Molluscum contagiosum virus. Foto; Kjell-Olof Hedlund, Smittskyddsinstitutet. Infektionen uppkommer efter att MOCV överförs från infekterad hud i nära barn-barn relationer, sportsammanhang där nära fysisk kontakt förekommer (t ex brottare), sexuell kontakt eller via kontaminerade objekt (t ex handdukar). Sannolikt smittas man bara en gång i livet och utvecklar därefter immunitet. Återfall kan förekomma under något/några år. Smittsamheten kvarstår så länge man har utslag. Ett antikroppsmedierat och ett cell-medierad immunsvar utvecklas ofta efter en genomgången infektion. Cell-medierad immunitet tros vara av vikt för utläkning av infektionen (4), då det visat sig att individer med nedsatt cell-medierad immunitet utvecklar en besvärligare sjukdomsbild. 58 I 6 Allmän och klinisk deIi Klinik: Inkubationstiden är varierande. Infektionen börjar som en liten papel som mognar till en 2- 5 mm slät, kupolliknande, hudfärgad och navlad nodulus. Vanligen förekommer 1-20 lesioner hos en individ men hos vissa kan mer än hundratalet lesioner uppkomma. Hos barn förekommer lesionerna främst i ansikte, i nacke, på bålen och övre delen av extremiteterna, medan hos vuxna ses lesioner vanligen på nedre delen av bålen, låren och genitalt (5). Lesioner i slemhinna, t ex mun- och vaginalslemhinna, förekommer. Ingen generell systemisk spridning förekommer. Däremot kan autoinokulation med spridning till andra delar av huden ske. Molloscum contagiosum förekommer genitalt hos immunkompetenta sexuellt aktiva individer (5,6). Störst problem har dock MOCV orsakat genitalt hos HIVinfekterade individer som kan utveckla ett stort antal lesioner (4). Svårigheter kan föreligga att skilja mellan genitala lesioner orsakade av herpes simplex virus, humana papillomvirus, varicella zoster virus och Cryptococcus neoformans. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 15 speciell del. Laboratoriediagnostik: Se D 15 speciell del. Molluscum contagiosum har en typisk klinisk bild, varför laboratoriediagnostik ofta är överflödig. Svårigheter att bedöma utslaget kan dock föreligga särskilt vid genitala lesioner. Vid behov av laboratoriediagnostik rekommenderas analys av blåsskrap, blåsinnehåll med elektronmikroskopi. MOCV har en karaktäristisk rektangulär morfologi. PCR-metoder finns publicerade men använts inte rutinmässigt i Sverige. Typning av MOCV utförs ej då ingen skillnad i klinisk betydelse visats mellan de olika genotyperna. Behandling: Enstaka lesioner läker vanligen ut utan åtgärd. Hos immun kompetenta barn och vuxna används vid behov curettage (skrapning) av lesionerna. Vid många lesioner hos små barn måste detta utföras under anestesi. Traditionell behandling fungerar ej hos immunsupprimerade individer, varför antiviral behandling med 3 % Cidofovir kräm har prövats med gott resultat. Vid underliggande HIV infektion har behandling av grundsjukdomen med förbättrade CD4 - värden lett till att infektionen kunnat läka ut. Prevention: Allmän god hygien vid gymnastik och lekar förebygger smitta. 59 I 6 Allmän och klinisk deI Undvik nära fysisk hudkontakt med individ som har mollusker. Undvik att dela handduk med individ som har mollusker. Inget vaccin finns tillgängligt eller är under utveckling. REFERENSER 1. Fields Virology, 5th edition, 2007, Editors DM Knipe and PM Howley Chapter 75, 2963-2965. 2. Porter CD Blake NW, Archard LC, Muhlemann MF, Rosedale N, Cream JJ, Molluscum contagiosum virus types in genital and non-genital lesions. Br J Dermatology 1989; 120 (1): 37-41. 3. Koopman RJJ, Van Merrien Boer FCJ, Vreden SGS, Dolmans WMV. Molluscum contagiosum: a marker for advanced HIV infection Br J Dermatol 1992;126:528529. 4. Birthistle K, Carrington . Molluscum contagiosum virus J Infect Dis 1997;34:21-28 5. Tyring SK. Molluscum contagiosum: the importance of early diagnosis and treatment Am J Obstet Gynecol 2003 189 (3 Suppl): S12-16. Mycoplasma genitalium (tilläggskod B96.8) Etiologi: Mycoplasma genitalium, elementkod QU66494 Smittämnet: Mycoplasma genitalium tillhör genus Mycoplasma med idag mer än 100 kända species. Mykoplasmor är de minsta självreplikerande prokaryota organismer som identifierats. De saknar cellvägg och har ett trelagrat cellmembran innehållande steroler. Genomet hos M. genitalium på endast 580 kb begränsar förmågan att syntetisera näringsämnen. M. genitalium är genetiskt mycket närbesläktad med Mycoplasma pneumoniae. Patogenes: Mycoplasma genitalium uttrycker ett adhesionsprotein. Det har visats att den adhererar till epitelceller, erytrocyter, celler från äggledare samt spermier. Adhesionsproteinet är immunogent men samtidigt variabelt, vilket hjälper bakterierna att undkomma immunförsvaret. Vävnadsskada vid infektion med M. genitalium orsakas huvudsakligen av immunförsvaret och i endast mindre omfattning av bakteriemetaboliter, i första hand väteperoxid. M. genitalium är fakultativt intracellulär. Klinik: M. genitalium orsakar uretrit hos båda könen och hos kvinnor dessutom cervicit. Hittills genomförda epidemiologiska studier talar för att genitala 60 I 6 Allmän och klinisk deIi infektioner med M. genitalium är drygt hälften så vanliga som Chlamydia trachomatis i STI-population. Studier i ”allmän population” visar prevalens av 1-2 %. Vanliga symtom vid infektion med M. genitalium är sveda och klåda i urinröret, flytning och blödningsrubbning. Förekomst av flytning är en stark markör för M. genitalium. Direktmikroskopi på prover från uretra hos män med M. genitalium visar så gott som alltid uretritbild. Hos kvinnor ses ofta motsvarande inflammation i utstryk från uretra, cervix och vagina. Infektion med M. genitalium kan, åtminstone hos män, oftare vara symtomgivande än klamydia. Sambanden mellan M. genitalium och tänkbara komplikationer är ej helt säkerställda. Studier talar för att M. genitalium kan orsaka endometrit, salpingit och tubarfaktorinfertilitet. M. genitalium har påvisats i samband med epididymit, i prostata vid prostatit, i ledvätska från patienter med artrit och vid konjunktivit. Provtagning av partner till patienter infekterade med M. genitalium har tillsammans med DNA-studier säkerställt att M. genitalium kan överföras sexuellt. Provtagning: Se P 6 speciell del. Laboratoriediagnostik: Se D 6 speciell del. M. genitalium isolerades via odling första gången 1980 från två män med icke gonorroisk uretrit. Växt framträdde dock först efter cirka två månader. Initial odling på Veroceller har senare visat sig användbar vilket är till stor tillgång i forskningen även om denne metod inte kan användas för rutindiagnostik. Det var inte förrän efter 1991, då den första PCR-metoden för detektion av M. genitalium publicerats som det blev möjligt att göra kliniska studier. Organismerna påvisas i dag rutinmässigt i första hand med PCR i urinprov från män och urinprov kompletterat med cervix/vaginalprov från kvinnor. Behandling: Hitintills har få studier publicerade avseende optimal behandling av Mycoplasma genitalium. Tetracyklin i klamydiados är inte effektiv behandling av M. genitalium, endast cirka 30 % läker ut. Azitromycin har hittills visat bästa behandlingsresultat. Optimal dos är sannolikt azitromycin 500 mg × 1 dag 1 följt av 250 mg × 1 dag 2-5. Azitromycin 1000 mg som engångsdos har något lägre eradikeringsgrad och medför risk för resistensutveckling. Mutationer som ger azitromycinresistens har identifierats. Vid behandlingssvikt med azitromycin kan moxifloxacin 400 mg x 1 i 7-10 dagar vara ett alternativ. Erfarenhet av denna behandling är dock relativt begränsad och ett fall av resistens har rapporterats. 61 I 6 Allmän och klinisk deI Prevention: Som andra STI-agens. REFERENSER 1. Taylor-Robinson D. Mycoplasma genitalium – an up-date. Int J STD AIDS. 2002;13:145-151. Review 2. Jensen JS. Mycoplasma genitalium infections. Diagnosis, clinical aspects and pathogenesis. Dan Med Bul. 2006 Feb; 53(1):1-27. Review 3. Björnelius E, Anagrius C, Bojs G, Carlberg H, Johannisson G, Johansson E, Moi H, Jensen JS, Lidbrink P. Antibiotic treatment of symptomatic Mycoplasma genitalium infection in Scandinavia. Sex Transm Inf 2008;84:72-76 4. Falk L, Fredlund H, Jensen JS. Tetracycline treatment does not eradicate Mycoplasma genitalium. Sex Transm Inf 2003;79:318-319 Mycoplasma hominis (tilläggskod B96.8) Etiologi: Mycoplasma hominis, elementkod ATCC 23114 Smittämnet: M. hominis är en av fyra arter inom genus Mycoplasma som är associerad med infektioner hos människa. Bakteriecellerna är mycket små, 0,20,3 μm i diameter och saknar, liksom övriga mykoplasmor, cellvägg. M. hominis växer på fasta odlingsmedier med typiska kolonier med utseende som ”stekt ägg”, det vill säga med en distinkt central upphöjd förtätning. Patogenes: Mycket litet är känt om virulensfaktorer hos M. hominis. Liksom övriga mykoplasmor är den beroende av att adherera till epiteliala celler. Bakterierna återfinns i första hand i orofarynx och urogenitalt. Liksom M. genitalium och Ureaplasma species sker överföring mellan människor framförallt via sexuella kontakter inklusive oralsex, och mor - till barnsmitta kan förekomma i samband med förlossningen. Klinik: M. hominis kan ofta isoleras från urogenitalslemhinnan hos friska sexuellt aktiva kvinnor, men mindre frekvent än Ureaplasma. Den är starkt associerad med bakteriell vaginos. M. hominis orsakar inte uretrit hos män och kan endast sällan påvisas som enda organism i prov från kvinnliga patienter med uretrit eller cervicit (1). Däremot isoleras de ofta tillsammans med andra organismer, som Ureaplasma och Chlamydia trachomatis, vid sådana tillstånd. M. hominis har associerats med febrila urinvägsinfektioner med engagemang av njurarna liksom salpingit. Påvisbart antikroppssvar har gett stöd för detta även 62 I 6 Allmän och klinisk deIi om publicerade studier inte har korrigerats för BV. Liksom Ureaplasma har M. hominis isolerats från blod från febrila kvinnor som genomgått normal förlossning eller abort. Bakteriemi kan uppstå i samband med njurtransplantation, och bakterierna har också isolerats från sårinfektioner, särskilt kirurgiska sår i samband med gynekologiska och urologiska operationer, hjärt-lungtransplantation, hjärnabscesser och osteomyeliter. Vertikal transmission från mor till barn i samband med förlossning förekommer och bakterierna har påvisats såväl i navelsträngsblod som i det nyfödda barnets blod. Ofta blir barnen asymtomatiskt koloniserade, men neonatal meningit kan uppstå i enstaka fall. Provtagning: Se P 7 speciell del. Laboratoriediagnostik: Se D 7 speciell del. Provtagning för mikrobiologisk diagnostik är sällan aktuell vid ospecifik uretrit hos män eller cervicit hos kvinnor. Eventuella indikationer för provtagning är i första hand svåra sårinfektioner efter urogenitala ingrepp där andra mikrober inte påvisats samt hos immundefekta patienter, särskilt vid antikroppsbrist. M. hominis kan dock liksom Ureaplasma isoleras i alla typer av odlingsprov, förutsatt att transporten till laboratoriet sker korrekt. Prov för odling och PCR transporteras exempelvis i 2-SP-medium. För PCR-diagnostik används huvudsakligen genen för 16S rRNA (1, 2). Odling är dock fortfarande den mest utbredda tekniken för påvisande av M. hominis, och bakterierna växer bra på speciella selektiva medier. Till skillnad från övriga humanpatogena mykoplasmor växer M. hominis också inom en vecka med mycket små kolonier på ordinära bakteriologiska substrat som hematinagar och blodagar. De anrikas dock inte i vanliga system för blododling. Ett flertal kommersiella system för isolering av M. hominis finns tillgängliga. Vissa av dessa tillåter också kvantifiering av organismerna men överlag har dessa sämre känslighet än optimerade kvalitetssäkrade odlingssystem. Standardiserade antikroppstester finns inte tillgängliga. Behandling: Resistens mot erytromycin och pristinamycin förekommer naturligt hos alla M. hominis - isolat. Till skillnad mot Ureaplasma anses majoriteten av isolaten vara fullt känsliga för tetracyklin, även om resistensgener har påvisats. Känsligheten för kinoloner är god, men även för denna grupp av antibiotika förekommer resistens. Vid invasiva infektioner eller hos immunsupprimerade bör en kombination av doxycyklin och moxifloxacin användas. Klindamycin är eventuellt ett alternativ i kombinationsbehandling. Prevention: Undersökning av partner är sällan relevant. 63 I 6 Allmän och klinisk deI REFERENSER 1. Maeda, S., et al. 2004. Detection of Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma parvum (biovar 1) and Ureaplasma urealyticum (biovar 2) in patients with non-gonococcal urethritis using polymerase chain reaction-microtiter plate hybridization. Int. J. Urol. 11:750-754. 2. Baczynska, A., H.F. Svendstrup, J. Fedder, S. Birkelund, and G. Christiansen. 2004. Development of real-time PCR for detection of Mycoplasma hominis. BMC Microbiol, 4:35 Pelvic inflammatory disease (PID; N70, N71, N73) PID/salpingit är den vanligaste och allvarligaste komplikationen till obehandlad STI. Begreppen PID och salpingit används ofta synonymt och är i detta sammanhang avgränsade till uppåtstigande mikrobiell infektion från cervix eller vagina. Från svenskt håll har som alternativ till begreppet PID föreslagits cervicit/vaginit med inflammation i lilla bäckenet De utesluter blodburen infektion som tuberkulos. Infektion efter förlossning eller inducerad abort brukar betecknas som puerperal respektive postabortiell infektion. I kliniskt avseende är PID en syndromdiagnos och kan innefatta någondera eller kombination av endometrit, salpingit och/eller tuboovariell abscess. I cirka två trededelar av fallen med klinisk PID-diagnos föreligger salpingit, en diagnos som idealt bör vara konfirmerad objektivt med laparoskopi. I den återstående tredjedelen föreligger antingen endometrit eller lymfangit/vaskulit i lymf/blodkärl i uterus eller adnexa till reproduktionsorganen, alternativt andra tillstånd i angränsande vävnader/organ. I sistnämnda fall saknas som regel objektiva fynd av cervicit eller andra påvisbara infektiösa tillstånd i vagina. Ett viktigt led i diagnostik och behandling av alla fall av misstänkt PID/salpingit är provtagning från cervix, uretra och rektum för sexuellt överförbara bakteriella infektioner. Sexualpartner(s) bör även underkastas undersökning och provtagning. Vad gäller utförlig beskrivning av etiologi, patogenes och patofysiologi, komplexet av kliniska symtom och klinisk diagnostik, samt behandling hänvisas till textböcker såsom Sexually Transmitted Diseases av King K Holmes et al. (1). Etiologi: Chlamydia trachomatis dominerar, Neisseria gonorrhoeae, och sannolikt några Mycoplasma species, framförallt Mycoplasma genitalium. 64 I 6 Allmän och klinisk deIi Möjliga men inte klarlagda etiologiska agens/tillstånd är bakteriell vaginos, Mycoplasma hominis och Ureaplasma species. Vid laparoskopisk odling från äggledarna kan ibland också olika anaeroba bakterier isoleras, liksom alfasteptokocker, Escherichia coli och luftvägspatogener. Smittämnen: Se under respektive mikroorganism och även i Referensmetodik I 11, 1:a upplagan 2003. Patogenes: Ursprunget till PID är en cervicit, där mikroorganismerna sprids uppåt till uterus, äggledare, ovarier och i vissa fall vidare in i bukhålan. Den vanligaste orsaken till PID hos unga kvinnor är sexuellt överförd smitta, men PID kan också vara associerad med överdriven underlivshygien, särskilt vid användande av dusch, intrauterina preventivmedel eller till följd av gynekologiska ingrepp. Klinik: Symtom kan vara diskreta eller saknas helt. Låggradig feber är inte ovanlig, medan symtom kan yttra sig som lätt smärta i nedre delen av buken. Vaginal flytning liksom oregelbunden menstruation kan förekomma. Smärta vid samlag kan vara ett av få symtom. I svåra fall kan hög feber tillstöta ofta förenad med svår smärta i bäckenet, påminnande om appendicit. Detta är särskilt vanligt vid gonorré-etiologi. PID är den ledande orsaken till infertilitet på grund av ärrbildning och blockering av äggledarna. PID är också förenad med ökad risk för utomkvedshavandeskap. Provtagning: Se P 12 speciell del. Laboratoriediagnostik: Se D 12 speciell del. Klinisk undersökning innefattar bedömning av vaginal flytning inklusive mikroskopi av wet smear och metylenblå- eller gramfärgat smear från cervix samt gynekologisk undersökning. Förhårdnader runt äggledare och ovarier inger misstanke om PID. Typiskt är också ömhet över inre genitalia. Laboratorieundersökningar omfattar i första hand klamydia, gonorré, eventuellt Mycoplasma species men också urinvägsinfektion. Testning för övriga tänkbara agens kan vara aktuellt. I oklara fall kan den kliniska undersökningen kompletteras med endometriebiopsi eller laparoskopi för att utesluta annan orsak till besvären eller för att säkerställa diagnosen. Behandling: Behandling är alltid indicerad, dels kan uttalade infektionstillstånd vara potentiellt livshotande och dels på grund av risken för infertilitet. Antibiotika riktade mot etiologiskt agens i kombination med vila är grunden för 65 I 6 Allmän och klinisk deI terapi vid PID. Sjukhusbehandling är aktuell för gravida kvinnor med uttalade symtom, vid terapisvikt eller vid komplicerat förlopp såsom abscessbildning etc. I vissa fall kan kirurgisk dränering vara aktuell. Sexpartner skall alltid behandlas. Prevention: Information om risker till ungdomar. Bruk av kondom reducerar risken för STI och i förlängningen PID. REFERENSER 1. Sexually Transmitted Diseases. 2007. 4th edition, Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH (eds.). McGraw-Hill Professional, New York, USA. Syfilis (A50-53) Etiologi: Treponema pallidum subsp. pallidum, elementkod MSHD014210 Smittämnet: Genus Treponema hänförs till gruppen spiroketer, som är en heterogen grupp bakterier med spiralformat utseende. Till humanpatogena Treponema räknas förutom T. pallidum subsp. pallidum som orsakar venerisk syfilis också T. pallidum subsp. endemicum (orsakar bejel som definieras som endemisk icke venerisk syfilis), T. pallidum subsp. pertenue (orsakar yaws) och T. carateum (orsakar pinta). De olika bakterierna är mycket nära släkt och uppvisar >95 % total DNAhomologi med stor sekvensöverensstämmelse i identifierade individuella gener. Vissa skillnader har påvisats i tpr och arp-generna, vilket kan utnyttjas vid epidemiologisk kartläggning. Bakterierna hänförs i praktiken till sin respektive art beroende på klinisk diagnos, eftersom de uppvisar samma serologiska reaktivitet. De går inte morfologiskt eller antigenmässigt att skilja från varandra. Cellväggen hos spiroketer är flexibel med ett flertal fibriller virade i längdriktningen. Bakterierna är rörliga genom rotation kring längdaxeln. 66 I 6 Allmän och klinisk deIi Figur 8. Elektronmikroskopisk bild av Treponema pallidum (Wikimedia Commons, CDC, public domain) T. pallidum är 5-20 μm långa och är påfallande slanka (0,15 μm). De har 4-14 spiraler. Bakterien kan odlas på speciallaboratorier, men har ännu inte kunnat odlas på konstgjorda medier i rutinlaboratorier. Genomet hos Treponema pallidum (Nichols stam) består av en cirkulär kromosom innehållande cirka 1,14 miljoner baspar (1). Nedan avses med T. pallidum enbart den veneriska formen. Patogenes: T. pallidum är specifikt humanpatogen och sprids vanligen sexuellt via sår på hud och slemhinnor. Generationstiden är lång, ofta längre än ett dygn. Detta medför lång inkubationstid. Mekanismerna bakom den sjukdomsframkallande förmågan hos T. pallidum är föga kända. Ingen enskild virulensfaktor har ännu identifierats. Klinik: Syfilis: Syfilis manifesterar sig i regel efter en inkubationstid på cirka tre veckor (10-90 dagar), i sitt primärstadium med sår (ibland benämnda schanker) och svullnad av regionala lymfkörtlar och eventuellt huduslag t.ex. i handflatorna. Infektionen går sedan över i det sekundära stadiet med mukokutana lesioner och lymfadenopati och eventuellt med engagemang av andra organsystem. Dessa symtom försvinner inom ett år och sjukdomen går därefter över i ett latent stadium utan kliniska symtom. Latenta stadiet brukar indelas i tidigt latent stadium (mindre än två år efter smittotillfället), då den sjuke fortfarande är smittsam, och sent latent stadium (mer än två år efter smittotillfället). Om 67 I 6 Allmän och klinisk deI patienten inte behandlas utvecklas hos 40 % tertiärsyfilis vilken kan yttra sig som kardiovaskulär syfilis, cerebral syfilis eller benign tertiär syfilis (gummata). Syfilis kan spontanläka med eller utan bestående skador. Neurosyfilis: Centrala nervsystemet kan engageras tidigt i sjukdomsförloppet av syfilis. Vid primär och sekundär syfilis har cirka 30 % likvorförändringar som vid en meningit. En viss andel av patienter med tidigt CNS-engagemang utvecklar, om behandling inte ges, senare neurosyfilis. Olika typer av neurosyfilis brukar särskiljas: asymtomatisk, meningeal, vaskulär, parenkymatös och gummatös. Neurosyfilis är ovanlig i Sverige. Tyvärr saknas strikta laboratoriemässiga kriterier för diagnosen. Neurologiska symtom som uppträder hos en person med positiv syfilisserologi ska inte tolkas som neurosyfilis, om man inte i likvor har förändringar som styrker diagnosen. Kongenital syfilis: Under graviditet kan spiroketer överföras från modern och infektera fostret. Infektionsrisken är störst under primär- och sekundärstadiet, medan vid sen latent syfilis hos modern förblir 70 % av barnen friska. Fostret anses inte smittas före femte graviditetsmånaden. Praktisk erfarenhet visar att om behandling insätts före femte graviditetsmånaden får fostret inga syfilisskador. Kliniskt indelas kongenital syfilis i tidig, med symtom inom tre månader, och sen kongenital syfilis där det tidiga stadiet passerat oupptäckt. Sen kongenital syfilis motsvarar tertiärstadiet vid förvärvad lues. Kongenital syfilis var under många år en raritet i Sverige, men under senare år har enstaka fall rapporterats, huvudsakligen hos adoptivbarn från u-länder. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 8 speciell del. Laboratoriediagnostik: Se D 8 speciell del. Behandling: Primär syfilis behandlas med intramuskulär injektion av bensylpenicillin. Trots många år av behandlingar syns ingen tendens till resistensutveckling. Vid överkänslighet kan alternativa antibiotika som doxycyklin och ceftriaxon prövas (5). Prevention: Information om sjukdomens smittvägar är bra prevention. Kondom ger ett bra skydd mot syfilis såväl som mot andra könssjukdomar. Trots flera försök finns ännu inget fungerande, kommersiellt vaccin. 68 I 6 Allmän och klinisk deIi REFERENSER 1. Fraser, CM, et al Complete genome sequence of Treponema pallidum, the syphilis spirochete. Science 1998; 281 (5375): 324-5. 2. G. Koek, S. M. Bruisten, M. Dierdorp, A. P. van Dam and K. Templeton. Specific and sensitive diagnosis of syphilis using a real-time PCR for Treponema pallidum Clin Microbiol Infect 2006; 12: 1233-1236 3. S. M. Bruisten, I. Cairo, H. Fennema, A. Pijl, M. Buimer, P. G. H. Peerbooms, E. Van Dyck, A. Meijer, J. M. Ossewaarde, and G. J. J. van Doornum. Diagnosing Genital Ulcer Disease in a Clinic for Sexually Transmitted Diseases in Amsterdam, The Netherlands J. Clin. Microbiol. 2001 39: 601-605. 4. KA Orle, CA Gates, DH Martin, BA Body, and JB Weiss. Simultaneous PCR detection of Haemophilus ducreyi, Treponema pallidum, and herpes simplex virus types 1 and 2 from genital ulcers J. Clin. Microbiol. 1996 34: 49-54. 5. Sexually transmitted diseases treatment guidelines 2002. Centers for Disease Control and Prevention. MMWR Morb Mortal Wkly Rep 2002:51(RR-6):18-25,2830. Treponematoser, icke veneriska (A65-A67) Etiologi: Med humana icke veneriska treponematoser avses en grupp infektioner som orsakas av Treponema pallidum subsp. endemicus (bejel eller endemisk icke venerisk syfilis), T pallidum subsp. pertenue (yaws) och T. carateum (pinta). Smittämnen: Se under syfilis Patogenes: Icke veneriska treponematoser är vanligast i åldersgrupperna 2-10 år men kan också förekomma bland ungdomar, mer sällan vuxna. Pinta kan dock förekomma även hos äldre. Kongenitala infektioner är sällsynta. Organismerna invaderar från början traumatiserad hud eller slemhinna genom direkt kontaktsmitta mellan barnen. Klinik: Initialt ses ett lokalt sår som kan läka spontant. Treponematosen kan disseminera initialt eller efter en latensperiod av varierande längd. Seneffekterna kan vara multipla hudlesioner och inkludera infektiösa destruktioner av brosk och ben. Endemisk syfilis (bejel, dichuchwa, A65) överförs sannolikt vid mun-mun69 I 6 Allmän och klinisk deI kontakt eller via glas och bestick i samband med måltider. Den debuterar med oömma vitaktiga sår i munslemhinnan som ofta förbises. Senkomplikationer kan typiskt innefatta destruktion av näsbrosket, men även ögonen kan angripas. Yaws (frambesia, pian, buba, A66) debuterar efter en inkubationstid på några veckor upp till ett halvår med en enstaka pustel på huden som sedan blir större. Infektionen kan spontanläka efter flera månader, ofta med ärrbildning. I sekundärstadiet kan multipla hudlesioner uppstå liksom ömmande adeniter. Ben och broskdestruktioner kan förekomma och drabbar upp till 10 % av de infekterade. Hyperkeratos i handflatorna och fotsulor är andra senkomplikationer. Pinta (carate, mal de pinto, cute, A67) tycks minska i förekomst. Sjukdomen yttrar sig kliniskt ungefär som yaws med hudlesioner. Dessa är initialt hyperkeratotiska ofta blåpigmenterade. Även vid disseminerad sjukdom är pinta lokaliserad till huden med engagemang av regionala lymfkörtlar. I senstadier uppträder hyper- eller hypopigmenterade hudförändringar. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 9 speciell del. Laboratoriediagnostik: Se D 9 speciell del. Diagnostiken av icke veneriska treponematoser är huvudsakligen klinisk. Mörkfältsmikroskopisk undersökning av sårsekret kan användas och serologiska tester är för övrigt desamma som för venerisk syfilis. Behandling: Man räknar med att mellan 95-97 % av fallen kan behandlas effektivt med penicillin. Trikomoniasis (A59) Etiologi: Trichomonas vaginalis , elementkod MSHD04246 Smittämnet: Genus Trichomonas består av över 100 arter varav tre kan förekomma hos människa: T. hominis (synonym Pentatrichomonas hominis) i gastro-intestinalkanalen, T. tenax i munhålan och T. vaginalis i genital- och urinvägar. De två förstnämnda betraktas som apatogena. T. vaginalis är en päronformad anaerob flagellat 10-20 μm stor. T. vaginalis har fem flageller, fyra 70 I 6 Allmän och klinisk deIi är placerade i främre ändan medan den femte är införlivad i protozons vågformade membran. Även om celldelning hos T. vaginalis har beskrivits ingående så är parasitens livscykel fortfarande ofullständigt förstådd. T. vaginalis är extracellulär och existerar endast som trofozoit. Under olika förutsättningar ändras trofozoiters utseende; vid vidhäftning till vaginala epitelceller antas en amöboid form, men i axenisk odling (kultur som innehåller endast denna organism) tenderar trofozoiterna att bli mer päronformade och ovala. Skillnader mellan olika stammar av T. vaginalis existerar, hos vilka bland annat egna och gemensamma antigen har beskrivits. Patogenes: T. vaginalis smittar vid samlag och kan isoleras från 70 % av män som haft samlag med en infekterad kvinna under de senaste två dygnen. Med längre intervall från smittotillfället sjunker isoleringsfrekvensen till 30-40 %. Hos kvinnliga partner till infekterade män har T. vaginalis påvisats i ca 85 %. Möjligheterna till icke-sexuell överföring av T. vaginalis-infektion har diskuterats. Organismen dör snabbt i torr miljö men kan överleva i vaginalsekret upp till 48 timmar, i urin i tre timmar, i kranvatten och på våt textil upp till 24 timmar. Även om dessa in vitro fynd kan tyda på en möjlighet för icke-sexuell överföring har sådan aldrig dokumenterats. Neonatala infektioner representerar specialfall och finns beskrivna hos upp till 5 % av nyfödda flickor med infekterade mödrar. Trikomonasinfektion har associerats med förtidig födsel, låg födelsevikt och ökad spädbarnsmortalitet. Infektion associeras även med en signifikant ökad risk för HIV-transmission (1). Klinik: Inkubationstiden har angivits till 4-28 dagar. Infektionen är asymtomatisk hos 10-50 % av kvinnor och oftast hos män. Vid symtom hos kvinnor dominerar illaluktande ofta riklig gulgrön, gasbubblig ibland blodtillblandad flytning. Slemhinnorna är ofta rodnade och svullna med små punktformade blödningar. Vulvairritation, klåda, sveda och miktionssvårigheter är vanliga symtom. Distala buksmärtor kan förekomma. Försämring ses vid menstruation och graviditet. Hos män kan T. vaginalis orsaka uretritsymtom, men har även rapporterats som orsak till epididymit och prostatit. Epidemiologi: Se särskilt avsnitt i allmän och klinisk del. Provtagning: Se P 20 speciell del. Laboratoriediagnostik:. Se D 20 speciell del. Kliniska tecken är ofta diagnostiskt otillförlitliga. Trikomonasinfektion diagnostiseras hos kvinnor enklast genom påvisning av parasiten i våtpreparat av vaginalsekret. 71 I 6 Allmän och klinisk deI Känsligheten varierar 40 – 80 %. Eftersom det hos män är svårt att diagnostisera T. vaginalis i direktpreparat av uretrasekret och urin, är odling referensmetod för båda könen. Rutinmässig resistensbestämning utförs inte i Sverige. Behandling: Metronidazol är generellt effektivt mot T. vaginalis. Dock har det visats att minst 5 % av kliniska fall av trikomonasinfektion orsakas av parasiter som är resistenta mot metronidazol. Ett alternativ kan då vara tinidazol. Prevention: Som för övriga STI. Effekten av olika preventiva åtgärder på T. vaginalis är dock studerad endast i mycket liten omfattning. REFERENSER 1. Jackson, DJ, Rakwar, JP, Bwayo, et al. Urethral Trichomonas vaginalis infection and HIV-1 transmission. Lancet. 1997;350:1076. 2. Johnston, VC and Mabey, DC. Global epidemiology and control of Trichomonas vaginalis. Curr Opin Infect Dis 2008; 21:56-64 3. Cudmore S L et al. Treatment of Infections Caused by Metronidazole-Resistant Trichomonas vaginalis. Clin Microbiol Rev. 2004;17: 783-793. 4. Hobbs M M et al. Methods for Detection of Trichomonas vaginalis in the Male Partners of Infected Women: Implications for Control of Trichomoniasis. J Clin Microbiol 2006; 44:3994-3999. 5. Seña A C et al. Trichomonas vaginalis infection in male sexual partners: implications for diagnosis, treatment, and. prevention. Clin Infect Dis 2007; 44:13– 22. Ureaplasma species (tilläggskod B96.8) Etiologi: Ureaplasma urealyticum, Ureaplasma parvum, tidigare benämning U. urealyticum biovar. 1 och 2. Elementkod ATCC 27618 (avser U. urealyticum) Smittämnet: Ureaplasma species, totalt 7 har hittills identifierats, klassificeras tillsammans med Mycoplasma inom familjen Mycoplasmataceae. Liksom hos Mycoplasma är ureaplasmagenomet mycket litet och kodar för endast drygt 700 proteiner. Storleken på genomet hos U. urealyticum biovar. 1 ligger mittemellan de hos M. genitalium och M. pneumoniae. Endast U. urealyticum och U. parvum har isolerats från människa. De är fakultativt anaeroba och liksom alla Ureaplasma species producerar de ureas. Det är möjligt att skilja de båda arterna med molekylärbiologiska metoder, men 72 I 6 Allmän och klinisk deIi i flesta kliniska sammanhang har det inte säkerställts om detta har någon betydelse. Det är därför praktiskt att sammanföra arterna inom begreppet Ureaplasma species. Bakterierna återfinns i första hand i orofarynx och urogenitalt. Patogenes: Överföring mellan människor sker förmodligen via sexuella kontakter, även via oralsex. Smitta till barnet kan också förekomma vid förlossningen. Virulensmekanismer är inte kartlagda. Liksom Mycoplasma species har de en förmåga att adherera till epitel. De producerar ett IgA-proteas som antas vara en virulensfaktor. De frisätter också stora mängder ammoniak genom sin urealytiska aktivitet. Klinik: Ureaplasma kan isoleras från urogenitalslemhinna hos mellan 40-80 % av friska sexuellt aktiva individer. Det anses klarlagt genom inokulationsstudier på friska försökspersoner att de i vissa fall kan framkalla uretrit hos män (se också avsnitt ospecifik uretrit). Bakterien har i enstaka fall påvisats i samband med epididymit och en association med kronisk prostatit diskuteras. Som andra ureasproducerande bakterier kan de sannolikt också orsaka njurstenar av infektionstyp. Det är däremot tveksamt om de kan orsaka pelvic inflammatory disease (PID) och eventuellt samband med senare infertilitet är ännu endast spekulativt (1). Spridning till blodbanorna har observerats i samband med abort men även efter normala förlossningar. Ureaplasma kan kolonisera det nyfödda barnet genom vertikal transmission och ge upphov till kongenital pneumoni och meningit. Sekundärt till spridning till blodbanorna kan osteomyelit och purulent artrit uppstå hos barn och speciellt hos individer med hypogammaglobulinemi (2). Sårinfektion efter ingrepp i urogenitaltrakten ses också, men är inte så ofta rapporterad då Ureaplasma inte påvisas på konventionella bakteriologiska substrat. Provtagning: Se P 7 speciell del. Laboratoriediagnostik: Se D 7 speciell del. Provtagning för mikrobiologisk diagnostik kan i enstaka fall vara aktuell vid ospecifik uretrit hos män, men utförs i praktiken sällan. M. genitalium bör uteslutas innan diagnostik kommer på tal. Ureaplasma kan isoleras från alla typer av odlingsprov, förutsatt att transporten till laboratoriet sker korrekt. Pinnprov för odling och PCR kan med fördel transporteras i 2-SP-medium. Förutom 16S rRNA-genen används genen för ureas för påvisande av organismen med molekylärbiologisk diagnostik. Ureaplasma är dock förhållandevis lättodlad men kräver specialmedium för växt. Den växer inte i gängse blododlingssystem. 73 I 6 Allmän och klinisk deI Behandling: Genitala infektioner med Ureaplasma species behandlas med klaritromycin som har den bästa MIC-profilen in vitro. Tetracyklin var tidigare ”the drug of choice” men resistensutveckling är inte ovanlig. Fluorokinoloner kan vara effektiva vid generaliserad spridning av bakterierna. Kinoloner kan vara aktuella som förstahandsmedel vid samtidig förekomst av M. hominis. Behandling av allvarliga infektioner, särskilt vid immundefekt bör ske i samarbete med specialist. Prevention: Undersökning av partner(s) är sällan relevant. REFERENSER 1. Abele-Horn, M. C., et al. Association of Ureaplasma urealyticum biovars with clinical outcome in neonates obstetric patients and gynecological patients with pelvic inflammatory disease. J. Clin Microbiol. 1997; 35: 1199-1202. 2. Waites, K.B., B Katz and R.L Schelonka. Mycoplasmas and ureplasmas as neonatal pathogens. Clin. Microbiol. Rev. 2005; 18: 757-789. Uretrit - ospecificerad hos män och ospecificerad genital infektion hos kvinnor (N34.1) Kliniken omfattar uretrit hos män och cervicit/uretrit hos kvinnor och diagnosen förutsätter att gonokocker och klamydia uteslutits. Etiologi: Mycoplasma genitalium, Ureaplasma species, Mycoplasma hominis, Trichomonas vaginalis, jästsvamp, herpes simplex och adenovirus. Anaeroba bakterier, Gardnerella vaginalis, Corynebacterium genitalium, Haemophilus spp har också associerats med non-gonorrhoisk non-chlamydia uretrit (NGNCU). Smittämnen och patogenes: Beskrivs under respektive agens. Klinik: Efter en inkubationstid på några få dagar upp till en dryg månad kan symtom uppstå i form av obehagskänsla som sveda vid miktion (dysuri). Initialt minimal senare tilltagande flytning från urinröret eller vagina förekommer hos upp till 30 % av drabbade. Flytningen är oftast klar, men kan också vara purulent. Sjukdomssymtomen är vanligen självbegränsande och upp till 70 % av patienterna blir symtomfria inom några månader medan andra kan ha ett 74 I 6 Allmän och klinisk deIi intermittent förlopp. Det är inte ovanligt att kvinnor rapporterar mellanblödning och samlagsblödning, men själva tolkat detta som orsakat av ex. p-piller. Många av dessa infektioner är dock asymtomatiska, men upptäcks oftast vid undersökning som lättblödande livmodertapp vid provtagning och varig flytning från yttre livmodermunnen. Många män har en klar flytning som upptäcks vid provtagning för mikroskopi, utan att de själva egentligen uppfattat detta som onormalt. Provtagning: Se P 2 och 3 speciell del. Laboratoriediagnostik: Se D 2 och 3 speciell del. Mikroskopi av metylenblåfärgat torkat utstryk från uretra/cervixsekret utgör grund för diagnostiken. Mer sällan i Sverige används gramfärgning. För kvinnor tas också wet smear (slidsekret) för faskontrastmikroskopi. För specifik agensdiagnostik hänvisas till respektive avsnitt. Behandling och prevention: Empirisk terapi utgörs av tetracyklinpreparat och tidigare men numera sällan även erytromycin i 10 dagar. Denna behandling har dock ofta dålig effekt vid M. genitalium-etiologi. Azitromycin är då ofta effektiv. Sexualpartners kan ofta komma ifråga för behandling. Se för övrigt under respektive organism. Vulvovaginit (kolpit; N76.0) Etiologi: Candida albicans, elementkod MSHD002176 och Trichomonas vaginalis är vanligaste orsaker. Mindre vanligt är vulvovaginit orsakad av STIagens som gonokocker, klamydia och herpes simplex. Streptokocker, stafylokocker och E. coli förekommer framförallt hos barn. Patogenes: Graviditet, dåligt kontrollerad diabetes och antibiotikaterapi är predisponerande faktorer, men merparten av alla infektioner är att finna utanför dessa grupper. Klinik: Det har beräknats att 3/4 av alla kvinnor någon gång under livet drabbas av vulvovaginit, varvid C. albicans är etiologiskt agens i 80-90 % av fallen. Klåda är kardinalsymtom. Slemhinnan är rodnad och på huden finns ofta ett eksem sekundärt till klådrivningen. Papler eller papulopustler utanför det rodnade området är typiskt. Flytning, om den förekommer, är vit och tjock med normalt pH, oftast under 4. Provtagning: Se P 1 speciell del. 75 I 6 Allmän och klinisk deI Laboratoriediagnostik: Se D 1 speciell del. Diagnosen ställs på anamnes, klinisk undersökning, mikroskopi av våtpreparat (svamp ses i drygt hälften av alla fall), negativt amintest och normalt pH. Svampodling är indikerad i oklara fall och vid recidiverande besvär, om insatt långtidsbehandling inte hjälper, för att upptäcka eventuell resistens mot antimykotika. Se också Genital candidiasis och Trichomonas. Behandling: Se under respektive agens Prevention: Se under respektive agens 76 I 6 Allmän och klinisk deI - Epidemiologi Epidemiologi Smittskyddslagen och dess tillämpningar Anmälningspliktiga sjukdomar. Enligt Smittskyddslagen (SFS 2004:168) och Smittskyddsförordningen (SFS 2004:255) som trädde i kraft 2004-07-01 skall både behandlande läkare och mikrobiologiska laboratorier anmäla inträffade liksom misstänkta fall av vissa listade smittsamma sjukdomar till lokal smittskyddsläkare och Smittskyddsinstitutet (SMI). Anmälningsförfarandet ger en hög känslighet i övervakningssystemet. Med undantag av sexuellt överförbara infektioner (STI) anmäls samtliga listade sjukdomar med full patientidentitet. Vid STI-diagnos (dock ej hepatiter eller HTLV-infektion) skall anmälan i stället göras med så kallad rikskod (födelseårtal + fyra sista siffror i personnumret, se vidare nedan under SmiNet). Anmälan ska ske inom en vecka från diagnosen. Tabell 2. Sjukdomar och agens med speciell anknytning till STI enligt smittskyddslagens bilaga 1 (2006-07-01). Allmänfarliga sjukdomar Etiologi Gonorré Neisseria gonorrhoeae Hepatiter HBV, HCV HIV-infektion HIV HTLV 1 eller 2 - infektion HTLV 1/2 Klamydia Chlamydia trachomatis Syfilis Treponema pallidum 77 I 6 Allmän och klinisk deI - Epidemiologi SmiNet SmiNet är ett samprojekt mellan SMI och landstingens smittskyddsläkare för datorstödd nationell och lokal övervakning enligt smittskyddslagen. Ett 60-tal sjukdomar är anmälningspliktiga enligt smittskyddslagen. Detta innebär att en person som misstänker att han eller hon är smittad av en anmälningspliktig sjukdom är skyldig att söka läkare för undersökning. Anmälan genom SmiNet görs både av behandlande läkare (klinisk anmälan) och av den laboratorieläkare (laboratorieanmälan) som diagnostiserar det smittämne som orsakat en anmälningspliktig sjukdom. Den kliniska anmälan görs på fördefinierade elektroniska formulär i SmiNet. Anmälan går parallellt till smittskyddsläkaren och SMI. För anmälan behövs en klinikinloggning som erhålls av smittskyddsläkaren i respektive landsting. Anmälan kan också ske på anmälningsblankett för utskrift i de fall anmälaren inte är anslutna till SmiNet. Denna tjänst kräver inte klinikinloggning. Alla svenska mikrobiologiska laboratorier är anslutna till SmiNet. Hälften av dessa laboratorier har automatisk överföring till SmiNet via laboratoriedatasystemen. Övriga anmäler till SmiNet via nätet. Anmälan skall enligt smittskyddslagen innehålla uppgifter om den smittades namn, personnummer (vid STI rikskod) och adress, samt sannolik smittkälla och/eller smittväg. Dessutom skall den kliniska anmälan innehålla uppgifter om de åtgärder som läkaren vidtagit för att hindra smittspridning och andra uppgifter av betydelse för smittskyddet. Sammanställning av inrapporterade data På SMI registreras uppgifterna som inkommit till SmiNet varefter de kliniska anmälningarna och laboratorieanmälningarna sammanlänkas med hjälp av person-id-uppgifterna. För klamydia och gonorré lämnar laboratorierna också särskilda numeriska hel- eller halvårsrapporter med uppgift om antalet undersökta (och därav positiva) personer indelat i kön och femårsåldersklass. Rapporterna och anmälningarna från smittskyddsläkare, behandlande läkare och mikrobiologiska laboratorier sammanställs och analyseras. Trendanalyser görs med utgångspunkt från förändringar i sjukdomsförekomst mellan olika landsting, åldersgrupper och kön. På detta sätt får SMI en bild av det epidemiologiska läget i landet. Statistiska uppgifter måste alltid ställas i relation till den yttre kontexten. Allt från ny metodik, varierande eller ändrade laboratorierutiner och skiftande befolkningsstrukturer till glidande indikationer för provtagning påverkar den 78 I 6 Allmän och klinisk deI - Epidemiologi statistiska verkligheten. Av denna anledning är analysen ett viktigt instrument för att tolka siffrorna på rätt sätt. All övervakning syftar till att förse de personer som arbetar aktivt med smittskyddsfrågor med den information de behöver i sitt dagliga arbete. Sådan information kan bestå av såväl snabb återrapportering och okommenterad aktuell statistik, som en grundligare analys av olika trender. Den snabba återrapporteringen sker via SMI:s webbplats, där all statistik finns tillgänglig, och det elektroniska veckobrevet EPI-aktuellt. En mer ingående trendanalys förmedlas via skriften Epidemiologisk årsrapport, samt i artiklar i tidningen Smittskydd och annan svensk och utländsk medicinsk litteratur. Hemsidor och kontakter SmiNet http://www.sminet.se/ Frågor om SmiNet; [email protected]. SMIs hemsida http://www.smittskyddsinstitutet.se 79 I 6 Allmän och klinisk deI - Epidemiologi Speciell epidemiologi för STI som omfattas av smittskyddslagen Gonorré Gonorré är globalt sett mycket prevalent, framförallt i utvecklingsländer. I Sverige finns förhållandevis pålitlig statistik för gonorré (liksom för syfilis) från och med 1912 (Fig. 9). 45000 40000 Totalt 35000 Män Kvinnor Antal fall 30000 25000 20000 15000 10000 5000 20 00 19 90 19 80 19 70 19 60 19 50 19 40 19 30 19 20 19 12 0 År Figur 9. Rapporterade fall av gonorré i Sverige 1912-2007 Antalet fall av gonorré visade toppar ungefär vid första och andra världskriget samt ”sexuella revolutionen” under andra delen av 1960-talet och början av 1970-talet. År 1970 rapporterades den högsta totalincidensen någonsin, 487 fall per 100 000 invånare (1). Incidensen sjönk sedan i det närmaste årligen troligtvis på grund av en minskad storlek på 18-24 års åldergruppen av populationen, utbredd utbildning resulterande i förändrade sexualbeteenden, förbättrad diagnostik, effektiv antibiotikabehandling och kontaktspårning samt vida spridd information och rädsla för HIV infektion/AIDS (1). År 1996 rapporterades den lägsta incidensen någonsin, dvs. 2,4 (2). Incidensen har sedan ökat under 1997-2007 (2007, incidens 6.99). Framförallt har noterats en ökning av inhemskt smittade fall, som numera är i majoritet, och speciellt bland män som har sex med män (MSM) och yngre heterosexuella. Liknande incidensökningar har identifierats i andra västeuropeiska länder från mitten eller slutet av 1990-talet. Ökningen kan spegla bl.a. ökat antal sexualpartners, minskad kondomanvändning framförallt vid första träffen, och överhuvudtaget förändrat sexualbeteende exempelvis pga. minskad rädsla för HIV/AIDS etc. Många framförallt heterosexuella män smittas även i Asien, majoriteten i 80 I 6 Allmän och klinisk deI - Epidemiologi Thailand och Filippinerna, där också höggradig antibiotikaresistens och stor risk för exponering av även andra STI är vanlig (Smittskyddsinstitutet (SMI); http://www.smittskyddsinstitutet.se). Under 2007 anmäldes i Sverige 642 gonorréfall (126 kvinnor och 516 män; 6,99 i incidens). Detta är en minskning av antalet fall med 5 % jämfört med 2006 men en ökning med 204 % sedan 1996. Av gonorréfallen 2007 var 60 % heterosexuellt smittade, 31 % homosexuellt smittade och för 9 % fanns ej tillgänglig uppgift alternativt var annan smittväg angiven. Andelen med känd utlandssmitta var 31 % och Thailand var vanligaste smittland. Utförligare information avseende gonorréepidemiologi kan erhållas av SMI (http://www.smittskyddsinstitutet.se) och Nationella referenslaboratoriet för patogena Neisseria, Kliniskt mikrobiologiska kliniken, Universitetssjukhuset Örebro. Fr.o.m. 2005 redovisar Nationella referenslaboratoriet i Örebro även data från Karolinska sjukhuset, Huddinge, vilket ger en mer heltäckande nationell bild. Under 2007 beskrevs N. gonorrhoeae stammar från 63 % av de anmälda fallen. Majoriteten, 88 %, tillhörde serogrupp WII/III och 12 % tillhörde serogrupp WI. Serovar Bropyst (27 %), Arst (11 %) och Bpyust (9 %) var vanligast enligt Pharmaciapanelen med monoklonala antikroppar som numera saluförs under namnet Phadebact GC Serovar Test (Bactus AB). Mer detaljerad fenotypisk och genetisk karakterisering av gonokocker utföres på referenslaboratoriet regelbundet i olika nationella och internationella forskningsprojekt (3-8). Under 2007 var 30 % av gonokockerna β-laktamasproducerande och nedsatt känslighet eller full resistens mot ampicillin och ciprofloxacin förekom hos 82 % respektive 71 %. Tjugotre (5,7 %) av stammarna uppvisade nedsatt känslighet eller resistens mot azitromycin. Enstaka (0,7 %) stammar hade nedsatt känslighet (ingen resistens) för cefixim. Samtliga stammar var känsliga för ceftriaxon och spektinomycin (9). Resistensutvecklingen för N. gonorrhoeae isolerade i Sverige 1998-2007 finns beskriven i referenslaboratoriets årsrapporter och av Referensgruppen för antibiotikafrågor (RAF; http://www.srga.org). REFERENSER 1. Danielsson, D. Gonorrhoea and syphilis in Sweden-past and present. Scand. J. Infect. Dis. 1990; Suppl. 69:69-76. 2. Berglund, T., H. Fredlund, and J. Giesecke. Epidemiology of the reemergence of gonorrhea in Sweden. Sex. Transm. Dis. 2001; 28:111-114. 3. Berglund, T., M. Unemo, P. Olcén, J. Giesecke, and H. Fredlund. One year of Neisseria gonorrhoeae isolates in Sweden: the prevalence study of antibiotic 81 I 6 Allmän och klinisk deI - Epidemiologi susceptibility shows relation to the geographic area of exposure. Int. J. STD. AIDS. 2002; 13:109-114. 4. Unemo, M., T. Berglund, P. Olcén, and H. Fredlund. Pulsed-field gel electrophoresis as an epidemiologic tool for Neisseria gonorrhoeae; Identification of clusters within serovars. Sex. Transm. Dis. 2002; 29:25-31. 5. Unemo, M., P. Olcén, T. Berglund, J. Albert, and H. Fredlund. Molecular epidemiology of Neisseria gonorrhoeae: sequence analysis of the porB gene confirms presence of two circulating strains. J. Clin. Microbiol. 2002; 40:37413749. 6. Olsen, B., R. Hadad, H. Fredlund, and M. Unemo. The Neisseria gonorrhoeae population in Sweden during 2005–phenotypes, genotypes and antibiotic resistance. APMIS. 2008; 116:181-189. 7. Unemo, M., H. M. Palmer, T. Blackmore, G. Herrera, H. Fredlund, A. Limnios, N. Nguyen, and J. Tapsall. Global transmission of prolyliminopeptidase (PIP)-negative Neisseria gonorrhoeae strains – implications for changes in diagnostic strategies? Sex. Transm. Infect. 2007; 83:47-51. 8. Lindberg, R., H. Fredlund, R. Nicholas, and M. Unemo. Neisseria gonorrhoeae isolates with reduced susceptibility to cefixime and ceftriaxone: association with genetic polymorphisms in penA, mtrR, porB1b, and ponA. Antimicrob. Agents Chemother. 2007; 51:2117-2122. 9. Unemo, M., P. Olcén, H. Fredlund, P. Mölling, B. Wretlind, och B. Colucci. Neisseria gonorrhoeae 2007. Årsrapport avseende serologisk karakterisering (serogrupp och serovar) samt antibiotikakänslighet hos insända svenska Neisseria gonorrhoeae stammar. Distribuerad årligen från Nationella Referenslaboratoriet för Patogena Neisseria, Kliniskt mikrobiologiska kliniken, Universitetssjukhuset Örebro. Hepatit B Hepatit B virus (HBV) kan ge upphov till kroniskt virusbärarskap. Totala antalet kroniska bärare av HBV i världen har beräknats till 360 miljoner medan kanske 6 gånger fler har läkt infektionen. Frekvensen av kroniska hepatit B bärare skiljer sig mycket i olika delar på jorden. Den lägsta frekvensen, ca 0,1 - 0,5 % föreligger i Nordamerika och Västeuropa, medan den högsta 6 – 20 % ses i Afrika och Sydostasien. Frekvenssiffror däremellan finner man i Sydeuropa, Sydamerika och Östeuropa. Huvudvägarna för hepatit B smitta är sexuell (homo- och heterosexuell), morbarnsmitta vid födelsen samt blodkontakt av alla slag. Fram till ca 1970 var 82 I 6 Allmän och klinisk deI - Epidemiologi transfusionssmitta vanlig, men kunde i stort sett elimineras i industrivälden med testning av blodgivare. Smittrisker har också funnits inom dialys och hemofilivård. Hepatit B är ett stort problem globalt eftersom osäkra injektioner är vanliga liksom återanvända sprutor/nålar. Betydande smittrisker föreligger bland intravenösa injektionsmissbrukare som ofta även kan ha sexuella riskfaktorer som prostitution. Många HBV-smittade, i regel med låggradig smittsamhet, har tillkommit med stora migrationsströmningar till Sverige de senaste decennierna. Sverige tillhör en liten grupp länder som hittills avvaktat med att införa generell småbarnsvaccination mot hepatit B. I Sverige är idag sexuell kontakt (huvudsakligen heterosexuell) orsak till ungefär hälften av alla akuta HBV-infektioner hos vuxna. Hepatit C Totalt anmäldes i Sverige under 2007 2 134 fall av hepatit C, varav drygt 75 % var smittade inom landet. Många nyanmälda är bärare som har varit smittade sedan länge. Det totala antalet kroniska bärare av HCV i världen har beräknats till ca 170 miljoner och frekvensen ligger mellan 0,2 - 15 % i olika delar av världen. Den lägre frekvensen finns i Norden och Västeuropa, den högsta i Egypten. Lokalt i Sydeuropa ses höga nivåer på grund av tidigare utbrett bruk av injektioner med osäkert steriliserade sprutor/nålar. Man brukar räkna med att 2-3 % av svenska HCV-fall smittats sexuellt medan majoriteten av de smittade i samhället är intravenösa missbrukare. Före detta missbrukare utgör en betydande andel av de som senare blir aktuella för antiviral behandling. Män som har sex med män (MSM) drabbas i samma omfattning som heterosexuella och således klart mindre av HCV än av HBV och HIV. Undantag kan vara mindre grupper där sex utföres direkt traumatiskt till exempel under inflytande av droger. Smitta från mor till det nyfödda barnet är lågfrekvent och förekommer i högst ett par procent i svensk population. Maternella antikroppar överförs transplacentärt och kvarstår drygt ett år, varför man bör undvika anti-HCV testa barn till HCV- positiva mödrar före18 månaders ålder. För personer som transfunderats från 1965 fram till 1991-2 fanns ett par procents risk per vårdtillfälle att smittas av HCV. Nosokomial smitta med HCV har setts inom dialysvård, onkologi och har också förekommit med andra slag av osäkra injektioner. Slutligen är smittvägen oklar för en stor grupp (10-20 %). Från amerikanskt håll hävdas att många av dessa fall kan vara sexuell smitta men svenska erfarenheter 83 I 6 Allmän och klinisk deI - Epidemiologi talar för att det kan finnas ett icke medgivet övergående narkotikamissbruk som den HCV-smittade ej gärna vill tillstå. HIV-infektion HIV-1 har en global spridning och UNAIDS uppskattade att det i slutet av 2007 fanns cirka 33 miljoner HIV-infekterade människor i världen. Prevalensen av HIV-1 är speciellt hög i södra Afrika. I bl.a. Botswana och Zimbabwe beräknas > 20 % av den vuxna befolkningen bära på HIV. HIV prevalensen är låg i Sverige och de skandinaviska grannländerna (< 0,1 %), men flera Östeuropeiska länder, bl.a. Ryssland och Estland, har en HIV prevalens på mer än 1 %. Totalt har till och med 2007 8 014 personer rapporterats som HIV-smittade i Sverige. Av dessa är 5 617 (70 %) män. Under 2007 rapporterades 71 fall av aids i landet. HIV-2 förekommer framför allt i Västafrika, där Guinea-Bissau hade en prevalens på > 5 % redan i slutet på 1980-talet. HIV-2 har i måttlig omfattning spritts till länder med koloniala band till Västafrika. I Sverige finns det endast cirka 25 HIV-2 infekterade personer. HTLV-1/2 HTLV-1 har en global spridning med vissa högendemiska foci. Dessa återfinns i delar av centrala och västra Afrika, några områden i mellanöstern, södra Japan, Melanesien samt vissa delar av Latinamerika och Karibien. I dessa områden ses prevalenssiffror generellt i befolkningen på över en procent HTLV-1 – positiva och i vissa delar över 10 %. Totalt beräknas 10-20 miljoner människor vara infekterade i världen. HTLV-2 förekommer framför allt bland gamla befolkningsgrupper i centrala Afrika, Nord- och Sydamerika samt hos intravenösa missbrukare i Nordamerika och Europa inklusive Sverige. Nyligen har även HTLV-3 och –4 beskrivits i några relativt isolerade folkgrupper i Afrika. Spridningsvägarna för HTLV-1 och -2 är i princip desamma som för HIV: via blod och blodprodukter inklusive kontaminerade instrument, från mor till barn och sexuellt. Vid överföring av HTLV från mor till barn är amning den viktigaste faktorn. HTLV smittar inte via alldagliga icke-penetrativa kontakter. Under 2007 anmäldes 10 fall av HTLV-infektion (2 män och 8 kvinnor). Upptäckten skedde i 4 fall genom screening, 3 fall vid sjukdomsutredning och ett fall vid kontaktspårning. 84 I 6 Allmän och klinisk deI - Epidemiologi Klamydia inklusive lymfogranuloma venereum Nationell klamydiadiagnostik och allmänt utbredd diagnostik har i Sverige förekommit sedan mitten av 1980-talet. Alla C. trachomatis-infektioner är anmälningspliktiga enligt smittskyddslagen sedan 1988 och innebär bland annat att undersökning och behandling är kostnadsfri samt att smittspårning är obligatorisk. Ungefär samtidigt etablerades lättillgängliga ungdomsmottagningar över hela landet och omfattande provtagning infördes på asymtomatiska personer, främst kvinnor. 600000 50000 500000 40000 35000 400000 30000 300000 25000 20000 200000 15000 Antal påviade fall Antal undersökta personer 45000 10000 100000 5000 0 0 1991 1993 1995 1997 1999 2001 2003 2005 2007 Undersökta personer Påvisade fall Figur 10: Chlamydia trachomatis i Sverige 1991 - 2007: Antal undersökta personer och påvisade fall. Antalet rapporterade fall för 2005 och 2006 påverkas av förekomsten av den muterade varianten som ej kunnat påvisas med gängse metodik i 13 landsting under dessa två år. Trots ökande provtagning under 1980-talets slut minskade antalet klamydiafall och den minskande förekomsten in på 1990-talet tolkades som att de massiva 85 I 6 Allmän och klinisk deI - Epidemiologi insatserna gett önskat resultat. Sedan 1997 har dock antalet påvisade klamydiafall ökat oavbrutet. (Fig.10) Denna ökning tillskrivs huvudsakligen ett ökat riskbeteende, speciellt hos unga människor (1) och kan till viss del förklaras av minskad respekt för HIV-infektioner. En alternativ förklaringsmodell till ned/uppgång av klamydiainfektioner har framförts (2). Ökningen av klamydiainfektioner i Sverige är likartad med flera andra europeiska länder, som satsat mindre resurser mot klamydiainfektioner (3). Därför har den ”svenska modellen” ifrågasatts och nya strategier är nödvändiga. Av de cirka 500 000 årliga klamydiatesterna kommer cirka en fjärdedel från män, dvs det är svårt att nå denna grupp. Männen utgör dock drygt 40 % av alla påvisade fall, vilket beror på den obligatoriska smittspårningen som är orsak till provtagning i cirka 45 % av alla påvisade klamydiafall hos män. Provtagning av kvinnor är omfattande och beräknas i många län nå en täckningsgrad av >30 % av alla kvinnor/år i åldersgruppen 15-29 år (rapport till Socialstyrelsen, Löfdahl, Blaxhult, Herrmann 2007). I Sverige och utomlands diskuteras ”screening” för klamydia. Något organiserat screeningprogram där människor kallas till provtagning i likhet med cancerscreening har dock aldrig funnits. Provtagningens omfattning har därför varit otillräcklig för att åstadkomma en minskning av antalet fall. Mer riktad provtagning till riskgrupper har även diskuterats. En avgörande anledning till att klamydiainfektioner anses vara samhällsfarlig är risken för komplikationssjukdomar som salpingit, ektopisk graviditet och infertilitet. Antalet registrerade komplikationssjukdomar har dock inte ökat de senaste åren som man förväntat. År 2006 upptäcktes en ny genetisk variant av C. trachomatis som undgått detektion med vanligen förekommande detektionssystem (4). Detta orsakade en falsk nedgång i antalet påvisade klamydiafall under 2005 och 2006 då flera tusen falskt negativa tester utfördes (5). Bland män som har sex med män (MSM) upptäcktes ett utbrott av LGV i Holland 2004. Denna variant av C. trachomatis ger invasiva infektioner som obehandlad kan ge allvarliga komplikationer. I Sverige påträffades fyra fall under 2004-2005 och en retrospektiv studie visade att de endast utgjorde enstaka importfall (6). Under 2006 påvisades ett LGV-fall, men 2007 upptäcktes 16 fall, flera utan internationella kontakter. LGV kan därför befaras vara endemisk i Sverige, men är hitttills begränsad till en mindre grupp av MSM med högt riskbeteende. 86 I 6 Allmän och klinisk deI - Epidemiologi REFERENSER 1. Herlitz C. HIV och AIDS i Sverige. Kunskaper, attityder och beteenden hos allmänheten 1987-2007. Stockholm: Socialstyrelsen; 2008. 2. Brunham RC, Pourbohloul B, Mak S, White R, Rekart ML. The unexpected impact of a Chlamydia trachomatis infection control program on susceptibility to reinfection. J Infect Dis. 2005 Nov 15;192(10):1836-44. 3. Low N, Cassell JA, Spencer B, Bender N, Martin Hilber A, van Bergen J, Andersen B, Dubois-Arber F, Herrmann B, Stepenson J. Screening for Chlamydia. Review in Europe, project SCREen: final report. Stockholm: European Centre for Disease Prevention and Control 2008. 4. Ripa T, Nilsson PA. A Chlamydia trachomatis strain with a 377-bp deletion in the cryptic plasmid causing false-negative nucleic acid amplification tests. Sex Transm Dis. 2007 May;34(5):255-6. 5. Herrmann B, Törner A, Low N, Klint M, Nilsson A, Velicko I, Söderblom T, Blaxhult A. Emergence and spread of Chlamydia trachomatis variant, Sweden Emerg Infect Dis 2008 14: 1462-1465. 6. Klint M, Lofdahl M, Ek C, Airell A, Berglund T, Herrmann B. Lymphogranuloma venereum prevalence in Sweden among men who have sex with men and characterization of Chlamydia trachomatis ompA genotypes. J Clin Microbiol. 2006 Nov;44(11):4066-71. Syfilis I Sverige rapporterades 1920 den högsta syfilisincidensen någonsin, 150 och 75 fall per 100 000 män och kvinnor respektive. Incidensen minskade sedan snabbt troligtvis på grund av en tillgänglighet av effektiv diagnostik, introduktion av systemisk behandling med Salvarsan och effektiv kontaktspårning och den följande introduktionen av penicillin (mitten av 1940-talet). Incidensökningar identifierades dock under andra delen av 1920-talet och tidigt 1930-tal (framförallt bland män som har sex med män, MSM), senare delen av andra världskriget, och mitten av 1960-talet (framförallt bland MSM) som sedan toppade 1982 (13 fall per 100 000 invånare). Efter 1982 sjönk incidensen snabbt vilket sammanfaller väl med HIV infektion/AIDS epidemins upptäckt. Den har sedan dess varit fortsatt låg (1). Under de sista två decennierna av 1900-talet minskade incidensen men har ökat igen sedan 2000. Ökningen de senaste åren speglar framförallt en ökad inhemsk smittspridning, speciellt bland MSM men även mer sällsynt heterosexuell inhemsk smittspridning förekommer. År 2007 rapporterades en 87 I 6 Allmän och klinisk deI - Epidemiologi syfilisincidens på 2,6 per 100 000 invånare (240 fall), vilket är en klar ökning i jämförelse med 2006 (incidens, 1,9). Av dessa var 47 % MSM. Medelåldern för kvinnor, heterosexuella män och MSM var 33 år, 39 år och 39 år respektive. Flest fall rapporterades liksom tidigare år i storstadslänen, dvs. Stockholm, Skåne och Västra Götaland men Blekinge hade både högst incidens (8,6 fall per 100 000 invånare) och incidensökning (incidens 2006, 4,0) (Smittskyddsinstitutet, SMI; http://www.smi.se). REFERENSER 1. Danielsson, D. 1990. Gonorrhoea and syphilis in Sweden-past and present. Scand. J. Infect. Dis. Suppl. 69:69-76. Speciell epidemiologi för STI som ej omfattas av smittskyddslagen Chancroid Chancroid var en vanlig orsak till genitala sår i Afrika, Sydostasien, Karibien och Latinamerika. I dessa länder underlättar chancroid också spridning av HIV. Den senaste tiden har en minskning av chancroid och bakterieorsakade genitala sår observerats i u-länder. I Dar es Salaam, Tanzania rapporterades 2007 att endast cirka 5 % av genitala ulcers orsakades av Haemophilus ducreyi. En ökning av genitala sår orsakade av Herpes simplex virus har rapporterats från vissa länder i Afrika. Inga fall av chancroid anmäldes under 2003. I Sverige noteras enstaka importfall, och inhemskt smittspridning av H. ducreyi har inte förekommit på flera decennier. Smittan är inte längre anmälningspliktig, vilket gör epidemiologiska data osäkra. Donovanos Donovanos förekommer endemiskt i relativt snävt avgränsade områden (”hotspots”) i Papua Nya Guinea, KwaZulu-Natal, östra Transvaal i Sydafrika, delar av Indien och Brasilien och i aboriginala områden i Australien. Den hittills största epidemien inträffade i Papua Nya Guinea under perioden 1922-52 där två tredjedelar av befolkningen var infekterad. På senare år har prevalensen sjunkit drastiskt i det området efter omfattande åtgärder för att begränsa vidare smittspridning. I södra Indien rapporterades under 1990-talet att 14 % av genitala ulcerationer orsakas av donovanos. I Durban uppstod en epidemi under 88 I 6 Allmän och klinisk deI - Epidemiologi sent 1980-tal med flera tusen smittade individer. I Australien har myndigheterna fått kontroll över situationen och prevalensen av donovanos har drastiskt sjunkit under det första årtiondet av 2000-talet. Genital herpes simplex-infektion Genital herpes simplexvirus (HSV)-infektion rapporteras varken från laboratorier eller från klinik. Diagnosen torde i de flesta fall vara enbart klinisk och den epidemiologiska kunskapen härrör enbart från vetenskapliga studier. Spridning av HSV-1 sker främst intrafamiljärt och är starkt beroende av hygienisk miljö. Seroepidemiologiska data från Sverige visar att spridningen av HSV-1 är snabb upp till 2 års ålder (då var tredje barn uppvisar antikroppar) för att sedan öka relativt långsam under barnaåren. Under tonåren och ungdomen sker åter en ökning, troligen till följd av såväl oral-oral som oral-genital spridning, och i vuxen ålder har cirka 65 % genomgått infektion med HSV-1. Infektion med HSV-2 föreligger sällan före sexuell debut (1, 2). I Sverige visar undersökningar av HSV-2-prevalens hos gravida en ökning från 1960-talet till början av 1980-talet. Senare har ingen vidare ökning registrerats och numera uppvisar cirka 20-30 % av kvinnor i fertil ålder antikroppar mot HSV-2. (3) Cirka en fjärdedel av vuxen befolkning har inte genomgått infektion varken med herpes simplex typ 1 eller 2. Bland kvinnor med ett stort antal sexualpartner, t.ex. prostituerade från olika delar av världen, har prevalenser av herpes typ 2 rapporterats på upp till 90 %. Provtagning för genital herpes sker ej systematiskt utan är starkt influerad av den enskilde läkarens intresse och tillgång till diagnostiska möjligheter. Allmän rapportering av genital herpes, såväl primär infektion som recidivinfektion, ger därför ingen rättvisande bild av det epidemiologiska läget. Det är emellertid otillfredsställande att frekvensen genital herpes är dåligt känd. En longitudinell uppföljning av seroprevalensen mot HSV-1 och HSV-2 inom några väl definierade befolkningsgrupper i olika åldersintervall vore av stort värde. Kunskap om spridningen av genital herpes speciellt hos unga individer utgör därtill ett indirekt mått på förändringar i sexualbeteende. Som exempel på en sådan förändring är att HSV-1 idag är helt dominerande som agens vid förstagångsinsjuknande i genital herpes (4). REFERENSER: 1. Tunbäck E, Bergström T, Claesson BA, Carlsson R-M, Löwhagen G-B. Early acquisition of herpes simplex virus type 1 antibodies in children-A longitudinal serological study. J Clin Virol. 2007; 40:26-30. 89 I 6 Allmän och klinisk deI - Epidemiologi 2. Tunbäck P, Bergström T, Andersson AS, Nordin P, Krantz I, Löwhagen GB. Prevalence of herpes simplex virus antibodies in childhood and adolescence – a cross-sectional study. Scand J Infect Dis 2003, 35: 498-502. 3. Forsgren M, Skoog E, Jeansson S, Olofsson S, Giesecke J. Prevalence of antibodies to herpes simplex virus in pregnant women in Stockholm in 1969, 1983 and 1989: implications for STD epidemiology. Int J STD AIDS. 1994 Mar-Apr;5(2):113-6. 4. Löwhagen, G-B, Tunbäck P, Andersson C, Bergström T, Johannisson G. First episode of genital herpes in a Swedish STD population: a study of epidemiology and transmission by the use of herpes simplex virus (HSV) typing and specific serology. Sex Transm Dis 2000; 76:179-182. Genital papillomvirus-infektion (GPVI) Epidemiologisk information fokuserar på kompikationer i form av bland annat cervixcancer och beskrivs under Genital papillomvirus-infektion, avsnittet om klinik. Molluscum contagiosum (mollusker) är över hela världen en vanlig virusinfektion, som främst drabbar barn, men som också är en inte helt ovanlig sexuellt överförbar sjukdom hos vuxna. Seroepidemiologiska studier från Australien visar att ca 20 % av befolkningen har påvisbara antikroppar mot MOVC som tecken på en genomgången infektion (1). Immunsupprimerade individer i alla åldrar kan utveckla en besvärlig infektion. REFERENSER 1. Konya J, Thompson CH Molluscum contagiosum virus: antibody responses in patients with clinical lesions and its sero-epidemiology in a representative Australian population. J Infect Dis 1999; 179:701-704 Trikomoniasis Incidensen av trikomonas har minskat dramatiskt i Skandinavien beroende på användningen av metronidazol och konsekvent partnerbehandling. Globalt är trikomonasinfektion den vanligaste nonvirala sexuellt överförda infektionen med uppskattningsvis 180 miljoner fall per år. Med drygt 7 miljoner fall per år 90 I 6 Allmän och klinisk deI - Epidemiologi är det den vanligaste parasitinfektionen i Nordamerika (1). REFERENSER 1. Weinstock, HS, Berman, S and Cates, W Jr. Sexually transmitted diseases among American youth:incidence and prevalence estimates. Perspect Sex Reprod Health 2004; 36:6-10. Övrig epidemiologi Icke-veneriska treponematoser Endemisk syfilis (bejel, dichuchwa) förekommer vid dags dato framförallt i ökenområden och tempererade områden i Nord- och Central-Afrika men en del foci i Mellersta Östern finns kvar. Yaws (frambesia, pian, buba) förekommer primärt i varma, fuktiga, tropiska områden i sub-Sahara Afrika, Sydamerika, Karibiska övärlden, Sydost Asien samt på vissa Stilla havsöar. Pinta (carate, mal de pinto, cute) förekommer framförallt hos ursprungsbefolkning i avlägsna, lantliga tropiska områden i Central- och Sydamerika (1, 2). Yaws och endemisk syfilis sprids oftast mellan barn (2-15 år) medan pinta vanligtvis har en sjukdomsdebut senare (15-30 års ålder) (1). Numera beräknas cirka 34 miljoner (nyfödda och barn men även till mindre grad tonåringar och vuxna) riskera att bli infekterade globalt. Alla dessa lever i utvecklingsländer, mestadels i avlägsna områden med låg hygienstandard och avsaknad av effektiv hälsovård (2). Prevalensen av de icke-veneriska treponematoserna är dock osäker på grund av brist på pålitlig rapportering och övervakning men WHO estimerade 1998 att det var 2,6 miljoner fall (infektiösa, latenta och gamla) globalt och 460 000 nya fall, av vilka 400 000 var i Afrika, per år (3). Sjukdomarna var tidigare vanliga, exempelvis i början av 1950-talet estimerades att 200 miljoner individer exponerades enbart för yaws under sina livstider (4). WHO inledde dock 1948 ett program för utrotning av de icke-veneriska treponematoserna i sina endemiska områden. Förekomsten av alla dessa infektioner minskade betydligt under 1900-talets senare del, men åtminstone yaws tycks nu åter öka i de endemiska områdena (5, 6). REFERENSER 1. Pope, V., S. J. Norris, and R. E. Johnson. 2007. Treponema and other human hostassociated Spirochetes, p. 987-1003. In Murray PR, Baron EJ, Jorgensen JH, Landry 91 I 6 Allmän och klinisk deI - Epidemiologi ML, and Pfaller MA (eds.). Manual of clinical microbiology, 9th ed., vol. 1. ASM Press, Washington, D.C., USA. 2. Meheus, A., and F. J. Ndowa. 2008. Endemic treponematoses, p. 685-688. In: Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, and Watts DH (eds.). Sexually Transmitted Diseases. 4th edition. McGraw-Hill Professional, New York, USA. 3. World Health Organization. 1998. The health report 1998 – life in the 21st century; a vision for all. World Health Organization, Geneva, Switzerland. 4. Perine, P. L., D. R. Hopkins, P. L. A. Niemel, R. K. St. John, G. Causse, and G. M. Antal. 1984. Handbook of endemic trepanematoses: yaws, endemic syphilis, and pinta. World Health Organization, Geneva, Switzerland. 5. Meheus, A., and G. M. Antal. 1992. The endemic trepanematoses: not yet eradicated. World Health Stat. Q;45:228-237. 6. Antal, G. M., S. A. Lukehart, and A. Z. Meheus. 2002. The endemic treponematoses. Microbes Infect. 4:83-94. 92 I 6 Allmän och klinisk deI – Blodgivarscreening Blodgivarscreening I det obligatoriska screeningprogram som gäller vid transfusioner av blod och blodprodukter och organdonation ingår flera av våra vanliga STI. Vid varje donationstillfälle ska givare i Sverige testas för HIV, hepatit B (HBsAg) och hepatit C. Dessutom ska varje ny givare och person som inte donerat de senaste fem åren testas för HTLV-1 och –2, syfilis och anti-HBc (hepatit B). Detta regleras via Socialstyrelsens föreskrifter om blodverksamhet (SOSFS 2007:20), transfusion av blodkomponenter (SOSFS 2007:21) och biobanker (SOSFS 2007:22 och 2002:11). Lagen om blodsäkerhet började gälla 1 juli 2006 och bygger i sin tur på EU-direktiv om blodsäkerhet. Socialstyrelsen utfärdar tillstånd för blodverksamhet och bedriver också tillsyn med föreskrifterna som grund. Screeningtester och analyssystem ska uppfylla kraven i Läkemedelsverkets föreskrifter om medicintekniska produkter för in vitro diagnostik (LVFS 2001:7). Kraven på hela hanteringen av blod, blodkomponenter, prover och provsvar framgår i Socialstyrelsens föreskrifter. I praktiken föreskrivs en reglering av hanteringen i nivå med ackrediterad verksamhet. I Sverige tillämpas s k serologisk diagnostik för denna screening i klinisk verksamhet, dvs testerna baseras på detektion av antikroppar och/eller antigen. Ett undantag är dock plasma som tappas för industriellt bruk, där industrin själva genomför s k NAT-testning (Nucleic Acid Technology, nukleinsyratestning, t ex PCR) som tillägg till den sedvanliga serologiska screeningen. I många länder har NAT-testning införts, i första hand för HIV och hepatit C, men i en del fall även för hepatit B. För HIV har de senaste åren kombinationstester för samtidig detektion av antikroppar och antigen (s k fjärde generationens tester eller ”kombotester”) successivt vunnit mark och tillämpas nu för screening (sållningstestning) av en majoritet av de testande laboratorierna. Flera publicerade studier visar också att de är signifikant känsligare än rena antikroppstester utan att kompromissa med specificiteten, dvs den s k fönsterfasen mellan infektion och möjlig detektion förkortas med flera dagar. Även för hepatit C finns nu serologiska kombinationstester. För hepatit B tillämpas separat detektion av antigen (HBsAg) och antikroppar (i första hand anti-HBc). Om ett sållningstest utfaller reaktivt ska det upprepas två gånger med samma testmetod. Om reaktiviteten upprepas i någon av dessa analyser ska provet analyseras med bekräftande tester (SOSFS 2007:20). I dessa fall får blod eller blodkomponenter från den aktuella tappningen inte användas för transfusion. 93 I 6 Allmän och klinisk deI – Blodgivarscreening Hanteringen av s k ”indeterminanta resultat”, dvs prover som efter konfirmerande testning inte befunnits vara infekterade med det agens man testat för (falskt reaktiva) är inte specifikt reglerat i SOSFS. I praktiken används dock inte dessa tappningar för donation. Detta gäller tills testresultaten har normaliserats. Godkännande av en person för blodgivning är omgärdat av en rad säkerhetsbestämmelser som förutom den aktuella laboratoriediagnostiken, intervjuer och information också innefattar en minimering av vistelse i riskmiljöer och risksituationer. Vad gäller STI så innebär detta att personer som har eller har haft infektion med hepatit C, HIV, HTLV eller hepatit B inte får bli blodgivare. Undantaget är dock utläkt hepatit B där man är HBsAg-negativ och har påvisad immunitet. Man får heller inte donera blod om man haft sexuellt umgänge med personer med dessa infektioner eller med personer som injicerat droger samt i de fall där det sexuella umgänget ägt rum mot ersättning. Vistelse i områden med hög förekomst av dessa infektioner medför att man får lämna blod tidigast sex månader efter hemkomst. Person som haft syfilis får lämna blod ett år efter styrkt tillfrisknande. För närvarande (våren 2009) pågår en översyn av detta regelverk. Bland annat kan män som har sex med män (MSM) , som hittills varit undantagna, att under vissa kriterier komma att ges möjlighet att lämna blod. Slutligen krävs i samband med utredningar för assisterad befruktning, sållningstestning för HIV, HTLV, hepatit B, hepatit C och syfilis. Både ägg- och spermadonatorer testas och vid positivt resultat får donation inte ske. Testningen ska ha varit invändningsfri vid två tillfällen med sex månaders mellanrum; för män fryses sperman och används efter sex månader om infektionsscreening är negativ. För kvinnor görs testningen sex månader innan donation eller behandling och vid behandlingstillfället; hon får då inte ha utsatt sig för dessa smittämnen i perioden mellan testningstillfällena (SOSFS 2006:10). REFERENSER 1. Socialstyrelsens och Läkemedelsverkets författningssamlingar (se text). 2. Tynell E, Norda R, Ekermo B, Sanner M, Andersson S, Björkman A. False-reactive microbiologic screening test results in Swedish blood donors-how big is the problem? A survey among blood centers and deferred donors. Transfusion 2007;47:80-9. 3. Watson R. EU tightens rules on blood safety. BMJ 2005;331:800. 4. Robinson EA. The European Union Blood Safety Directive and its implications for blood services. Review. Vox Sang 2007;93:122-30. 94 I 6 Allmän och klinisk deI – Blodgivarscreening 5. Tynell E, Andersson S, Lithander E, Arneborn M, Blomberg J, Hansson HB, Krook A, Nomberg M, Ramstedt K, Shanwell A, Bjorkman A. Screening for human T cell leukaemia/lymphoma virus among blood donors in Sweden: cost effectiveness analysis. BMJ. 1998;316:1417-22. 6. Weber B. Screening of HIV infection: role of molecular and immunological assays. Expert Rev Mol Diagn. 2006;6:399-411. Review. 95 96 SPECIELL DEL 97 I 6 Speciell del – Provtagning 98 I 6 Speciell del – Provtagning P. Provtagning (indikation, provtagning, bedömning och svarsrutiner) Allmänt Diagnostik av STI omfattar flera steg. I många fall söker patienten för specifika symtom, i andra fall kan det vara fråga om smittspårning hos asymtomatisk individ eller att man utsatt sig för risk att få en STI på grund av oskyddade sexuella kontakter med ny partner. Den inledande kliniska undersökningen kompletteras i de flesta fall med provtagning och undersökning av provet på mottagningen. Diagnosen bakteriell vaginos ställs enligt vissa kriterier (oftast Amsels) och trikomonas, numera mycket ovanlig i Sverige syns ofta tydligt i wet smear från vaginalsekret. Trikomonas är en STI och därför bör en sådan diagnos föranleda provtagning för andra STI som klamydia och eventuellt även Mycoplasma genitalium och gonorré. Vid klamydia och gonorré finns det en signifikant ökad förekomst av bakteriell vaginos . Candidiasis är ingen sann STI, men kan ge en mikroskopisk cervicit och uretritbild och om det inte finns någon anamnestisk misstanke om STI behövs som regel inte ytterligare provtagning för laboratoriediagnostik. Uretrit eller cervicit ska annars betraktas som en preliminär diagnos och föranleda kompletterande provtagning för riktad laboratoriediagnostik av i första hand någon eller några av STI-agensen klamydia, M. genitalium eller om anamnestisk misstanke gonorré. Ett antal STI med olika etiologier karakteriseras av genitala sår eller andra lokala förändringar. Exempel på sådana infektioner är syfilis och herpes simplex-infektioner. Differentialdiagnostiska överväganden föranleder ofta riktad provtagning vid dessa tillstånd. 99 I 6 Speciell del – Provtagning Märkning av remisser och prover Enligt Socialstyrelsens föreskrift SOSFS 2005:9 15 september 2005 avskaffades möjligheten att märka remisser och prov med kod istället för med säkra identitetsuppgifter om patienten. I stället hänvisas till gällande regler i SOSFS 1989:1 (M) om åtgärder för att förhindra förväxlingar inom hälso- och sjukvården (1). Trots att den föreskriften undantar prover till klinisk kemisk och bakteriologisk verksamhet, förutsätts att provhanteringen även inom dessa verksamheter sker på ett sådant sätt att förväxlingsrisker elimineras. Mot den bakgrunden rekommenderar Socialstyrelsen att alla prover och remisser för klinisk kemisk eller bakteriologisk analys skall märkas med säkra identitetsuppgifter (personnummer och namn) för att förhindra förväxlingsrisker (1). Rikskod skall undvikas även för enligt smittskyddslagen anmälningspliktiga STI-sjukdomar. Lokala föreskrifter finns ofta utarbetade som reglerar detta. Observera att den följande anmälan till smittskyddsläkare och SMI av upptäckt STI sker med rikskod, undantag är hepatiter och HTLVinfektion (se under avsnitt Epidemiologi). REFERENS: 1. Socialstyrelsen. Märkning av remisser och prover vid allmänfarliga sjukdomar som är sexuellt överförbara. Anders Alexandersson. Meddelandeblad, Juni 2008. Transport Beträffande transportlådor lämnar arbetsgruppen inga generella rekommendationer. I övrigt hänvisas till Packa provet rätt (se www.smittskyddsinstitutet.se). 100 I 6 Speciell del – Provtagning P.1. Bakteriell vaginos och vulvovaginit Indikation Prov tas vid klinisk misstanke om bakteriell vaginos (BV) eller vulvovaginit (kolpit), men bör göras vid varje gynekologisk undersökning där STI misstänks. Provet undersöks i normalfallet direkt på plats av behandlande läkare utan att skickas till mikrobiologiskt laboratorium. Provtagning För att diagnostisera bakteriell vaginos undersöks och bedöms våtpreparat (wet smear) från vagina vanligen enligt Amsels kriterier från 1983 (1). Dessa inkluderar makroskopisk och mikroskopisk bedömning av sekret, pH-bestämning och eventuell amintestning. Kommersiella kit finns tillgängliga för BV-diagnostik, men deras plats i diagnostiken är oklar. Det skall observeras att diagnosen BV enligt Amsels kriterier inte utesluter samtidig förekomst av cervicit eller uretrit. Diagnosen candidiasis ställs också genom mikroskopi av våtpreparat från vaginalsekret och bekräftas genom förekomst av svampstrukturer. Trichomonas diagnosticeras presumtivt på samma sätt. För provtagning för diagnostik av Trichomonas och Candida, se P.20. och P.21. Provtagningsförfarande Provtagning och bedömning sker i undersökningsrummet. Våtpreparat. I praktiken bedöms vaginalsekret först med hänsyn till mängd, färg och lukt. pH i sekretet bestäms med pH-sticka. Prov på vaginalsekret tas därefter från vaginas sidovägg med en steril plastinös med 10 µL ögla. Två droppar sekret överförs till objektglas, den ena späds med fysiologisk koksaltlösning och den andra eventuellt med 10-20 % kaliumhydroxid (KOH). Alkalisering med KOH medför ibland frisättning av illaluktande aminer vilket accentuerar odören vid BV. Mikroskopi. Preparatet undersöks i ljusmikroskop i låg förstoring med objektiv ×10-×40 (dvs. 100-400 gångers förstoring). I koksaltpreparatet bedömer man förekomst av ökad mängd inflammatoriska 101 I 6 Speciell del – Provtagning celler (polymorfnukleära vita blodkroppar) (fler än epitelcellerna), ev. Trichomonas (rörlig päronformad flagellat), clue celler, normalflora med laktobaciller eller blandflora med kocker. I KOH-droppen slås cellväggar sönder och man kan lättare hitta eventuella pseudohyfer vid akut candidavaginit (ser ut som "trädgrenar"). Kriterier för diagnosen BV. Om minst tre av följande av Amsels kriterier är uppfyllda anses bakteriell vaginos föreligga: 1. 2. 3. 4. Tunn, vit homogen flytning Clue celler synliga vid mikroskopering av wet smear (ökad mängd bakterier såsom kockobaciller och G. vaginalis adhererade till vaginalepitelcellernas yta, med störst koncentration i cellernas periferi). Förekomst av clue celler och avsaknad av inflammatoriska celler är det enskilt viktigaste kriteriet för diagnosen BV. pH i flytning >4,5 Odör påminnande om ”rutten fisk” eller “räkskal”, accentuerad vid “amintestning”. Vid en bakteriell vaginos kan dock ökning av vita blodkroppar förekomma och andra STI bör då beaktas. Vid kopparspiralanvändning är bakteriell vaginos vanlig och då förekommer ofta ökat antal vita blodkroppar. Alternativ till bedömning enligt Amsels kriterier är att gramfärga vaginalprovet och bedöma detta mikroskopiskt enligt Nugent´s kriterier från 1991 (2) enligt proportionen GardnerellaMobiluncus/laktobaciller och ge vaginalprovet ett score 0-10. Därvid är score <4 normalflora, 4-6 intermediärt och >6 är liktydigt med BV. I de fall där undersökning enligt Amsels uppfyller kriterierna för diagnosen BV, men där clue cells inte identifierats, kan bedömningen kompletteras med klassificering enligt Nugent om diagnosen är viktig att säkerställa. 102 I 6 Speciell del – Provtagning P.2. Cervicit och uretrit hos kvinnor Indikation Prov tas vid misstanke om cervicit eller uretrit oavsett vilket etiologiskt agens som kan vara aktuellt. Provet undersöks direkt på plats med färgning och mikroskopering av behandlande läkare utan att skickas till mikrobiologiskt laboratorium. Vid anamnestisk misstanke på STI (t.ex. oskyddad sexuell kontakt med ny partner) tas kompletterande prov för riktad mikrobiologisk laboratoriediagnostik. Denna direktdiagnostik på mottagningen är viktig för ställningstagande till antibiotikabehandling och i så fall även provtagning för relevanta STI samt eventuell behandling av aktuell partner. Provtagning Provtagningsförfarande Patienten skall inte ha kastat vatten de två närmast föregående timmarna. Med hjälp av spekulum inställs portio som avtorkas om det föreligger mycket sekret. Prov tas från cervixkanalen med rayontopsförsedd provtagningspinne som förs upp i cervixkanalen och roteras och tas ut utan att komma i kontakt med vaginalslemhinnan. Provet stryks tunt ut på objektglas inför mikroskopering. Uretraprov tas med 1 µL platinös eller med rännsond som förs upp i uretra 1-2 cm och sätts till samma objektglas bredvid det första stryket. Färgning. Färgning med 4 % metylenblålösning i vatten under 5-10 sekunder, därefter sköljning med kranvatten. Alternativt görs gramfärgning, vilken dock sällan används på STI-mottagningarna i Sverige. Mikroskopi. Tyvärr saknas tillräckligt med vetenskapligt underlag för att säkert fastställa vilka kriterier för cervicit som är bäst. Antalet vita blodkroppar kan variera beroende på preventivmetod. Utan hormonell antikonception finns en normal variation av antalet vita blodkroppar i cervix och slidsekret under menstruationscykeln (3). Enligt amerikanska studier är lättblödande portio eller varig flytning och samtidig förekomst av >10 polymorfkärniga neutrofiler/synfält i minst 5 synfält vid 1000 ggrs förstoring korrelerat med cervicit (4, 5). Av hävd används kriteriet >30 polymorfkärniga neutrofiler som ett cervicitkriterium, men detta har bristande vetenskapligt underlag. 103 I 6 Speciell del – Provtagning I Sverige har man använt kriteriet fler polymorfnukleära neutrofiler än epitelceller i wet smear som ett cervicitkriterium grundat på undersökningar av unga kvinnor vårdade på grund av PID (pelvic inflammatory disease) (6). Förekomst av >5 polymorfkärniga neutrofiler/synfält i minst 5 synfält vid 1000 ggrs förstoring indikerar uretrit. Det finns dock en gråzon och även för uretrit saknas tillräckligt vetenskapligt underlag för säkert fastställande av kriteriet. Kompletterande provtagning Vid symtom som pollakisuri (frekventa urineringar) och trängningar till urinering bör bakteriell cystit uteslutas med urinodling. I förekommande fall tas prov för diagnostik av Neisseria gonorrhoeae, Chlamydia trachomatis och Mycoplasma genitalium. Eventuellt tas prov också för odlingsdiagnostik av Ureaplasma species/Mycoplasma hominis. P.3. Uretrit hos män Indikation Prov tas för preliminär diagnostik vid misstanke om uretrit och görs rutinmässigt på alla män som söker vid en STI-mottagning, eftersom det vid klamydia, Mycoplasma genitalium, Neisseria gonorrhoeae och sannolikt även andra icke upptäckta agens ofta inte finns symtom, men nästan alltid en mikroskopisk uretrit (>90 %) (7). Undersökningen av provet avser att bekräfta diagnosen uretrit oavsett vilket etiologiskt agens som misstänks. Provet undersöks i normalfallet med färgning och mikroskopering direkt på plats av behandlande läkare utan att skickas till mikrobiologiskt laboratorium. Vid misstanke antingen grundad på mikroskopiska fynd av uretrit eller anamnes talande för STI-risk (t.ex. oskyddat sex med ny partner) tas kompletterande prov för riktad mikrobiologisk laboratoriediagnostik. Ses en mikroskopisk uretrit antibiotikabehandlas som regel patienten redan vid besöket och aktuell partner uppmanas att testa sig samt i de flesta fall därefter få antibiotikabehandling. 104 I 6 Speciell del – Provtagning Provtagning Provtagningsförfarande Patienten bör inte ha kastat vatten de två närmast föregående timmarna. En steril 1 µL platinös eller en rännsond förs upp i uretra cirka två cm för provtagning av flytning och slemhinna. Om uretra är mycket torr kan öglan fuktas med steril NaCl. Materialet överförs till objektglas och färgas inför mikroskopi. Färgning görs med 4 % metylenblålösning i vatten under 5-10 sekunder, därefter sköljning med kranvatten. Alternativt utförs gramfärgning, vilken dock sällan används på STI-mottagningarna i Sverige. Mikroskopi. Förekomst av >5 polymorfkärniga neutrofiler/synfält i minst 5 synfält vid hög förstoring (1000 ggr) indikerar uretrit (8). Intracellulära gonokocker iakttages också säkrast i 1000 ggrs förstoring. Diagnosen uretrit anses bekräftad om patienten har positiv mikroskopi. Det finns dock en gråzon med 5-10 vita per synfält där samtidig förekomst av undersökaren definierad flytning (droppe i urinrörsmynningen när denna kläms åt eller ökat utbyte vid provtagning) (8, 9). Kriterierna för uretrit ställdes 1978 och senare erfarenhet och studier har visat att dessa kriterier hittar för många som sannolikt inte har någon uretrit. Fler studier behövs dock. Enbart positiv mikroskopi är i sig ett tillräckligt kriterium för att gå vidare med ytterligare mikrobiologisk provtagning enligt nedan. Granulocytesterastest (testremsa) på första portionsurin kan komplettera uretritdiagnostiken. Neutrofila granulocyter bildar esteraser som kan detekteras i urin med en testremsa. Flera sådana finns på marknaden. Testet detekterar pyuri (vita blodkroppar i urinen, som inte behöver vara intakta) och används i första hand för UVI-diagnostik med sensitivitet 70-99 %. Specificiteten avseende påvisande av pyuri är hög, 91-100 %. Däremot är specificiteten avseende bakteriuri bara 4-62 % eftersom urintestning kan bli positiv också vid uretrit, kolpit, atrofiska slemhinnor och feber (Läkemedelsverket 2007). Positiv granulocytesterastest stärker mikroskopisk uretritdiagnos. 105 I 6 Speciell del – Provtagning Kompletterande provtagning I förekommande fall tas därefter odlingsprov från uretra för diagnostik av Neisseria gonorrhoeae eller urinprov för diagnostik av Chlamydia trachomatis och Mycoplasma genitalium. Eventuell provtagning för odlingsdiagnostik av Ureaplasma species/Mycoplasma hominis. REFERENSER: 1. Amsel R, Totten PA, Spiegel CA, et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med 1983;74:14-22. 2. Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation. J Clin Microbiol. 1991;29:297-301. 3. Larsson PG, Platz-Christensen JJ. The vaginal pH and leucocyte/epithelial ratio vary during normal menstrual cycles. Eur J Obstet Gynecol Reprod Biol 1990;38:39-41. 4. Brunham RC, Paavonen J, Stevens CE, et al. Mucopurulent cervicitisthe ignored counterpart in women of urethritis in men. N Engl J Med 1984;311:1-6. 5. Lindner L, Geerling S, Nettum J, Miller S and Altman K. Clinical characteristics of women with chlamydial cervicitis. J Reprod Med 1988;33:684-90. 6. Weström L. Mårdh PA. Acute pelvic inflammatory disease (PID). Holmes K, Sparling F, Mårdh PA et al. editors. Sexually Transmitted Diseases. 2nd ed. McGraw-Hill;1990.p. 593-613. 7. Falk L, Fredlund H, Jensen JS. Symptomatic urethritis is more prevalent in men infected with Mycoplasma genitalium than with Chlamydia trachomatis. Sex Transm Inf 2004;80:289-93. 8. Swartz SL, Kraus SJ, Herrmann KL, et al. Diagnosis and etiology of nongonococcal urethritis. J Infect Dis 1978;138:445-54. 9. Horner PJ, Thomas B, Gilroy CB, Egger M, Taylor-Robinson D. Do all men attending departments of genitourinary medicine need to be screened for non-gc urethritis? Int J STD AIDS 2002;13:667-73. 106 I 6 Speciell del – Provtagning P.4. Gonorré (Neisseria gonorrhoeae, gonokocker) P.4.1. Prov för odlingsdiagnostik av gonokocker Indikation Misstanke om gonorré eller screening av gonorré. Provtagningen är beroende av anamnes och klinik samt patientens kön, ålder och sexuella praktik. Vid misstanke om urogenital gonorré är det som regel tillräckligt att ta prov från uretra hos män, medan hos kvinnor bör prov tas från både cervix och uretra för optimal sensitivitet. Kompletterande prover från rektum och farynx kan tas från män som har sex med män (MSM), från kvinnor vid misstanke om eller verifierad genital gonorré eller då det för övrigt finns epidemiologiska/kliniska/anamnestiska skäl. Beskrivningen nedan omfattar även provtagning på prepubertala flickor och speciell provtagning från ovanligare extragenitala lokaler inkluderande konjunktiva, prostata, bartholinska körtlar, led och blod. Provtagning Provtagningsmateriel 1. Okolad provtagningspinne (exempelvis rayonarmerad aluminiumpinne Copan (CP116C) för uretra och konjunktiva; och rayonarmerad plastpinne (Copan CP114C) för cervix, rektum, vagina och farynx). Alternativt kan motsvarande kolade provtagningspinnar användas, dock inte för konjunktiva. 2. Amies kolade transportmedium (Copan, Brescia, Italien). Alternativt: Amies okolade transportmedium (Copan, Brescia, Italien) om kolade provtagningspinnar används. 3. Steril tork 4. Vaginalspekulum 5. Proktoskop 6. Steril slev för rektumprov 7. Sterilt plaströr 8. Aerob och anaerob blododlingsflaska Provtagningsförfarande Vid samtidig provtagning för N. gonorrhoeae och Chlamydia trachomatis diagnostik skall klamydiaprovet tas först om kolad pinne användes. Vid användning av okolad pinne tas N. gonorrhoeae 107 I 6 Speciell del – Provtagning provet först. Vid provtagningen bör man vänta några sekunder innan provtagningspinnen dras ut (så att sekret hinner sugas upp) och omedelbart överförs till transportmediet. Män Uretra: Patienten bör ej ha kastat vatten de senaste 1-2 timmarna. Provtagningspinnen (vid behov fuktad från ytan av transportmedium) förs in 1-2 cm i uretra och roteras försiktigt. Kvinnor Cervix: Vaginalspekulum användes och portio avtorkas med steril tork. Provtagningspinnen förs in cirka 2 cm i cervixkanalen och roteras. Undvik kontakt med vaginalslemhinnan. Glidmedel/analgetika innehållande konserverings- eller bakteriehämmande medel bör undvikas. Uretra: Patienten bör ej ha kastat vatten de senaste 1-2 timmarna. Uretramynningen avtorkas med steril tork. Provtagningspinnen (vid behov fuktad från ytan av transportmedium) förs in 1-2 cm i uretra och roteras försiktigt. Prepubertala flickor Vagina: Vaginalsekret provtagningspinnen. från bakre fornix uppsamlas med Övriga provtagningslokaler Rektum: Provtagningspinnen förs in 3-4 cm i analkanalen och roteras mot rektalslemhinnan. Prover med tydlig kontamination av feces kasseras. Alternativt kan prov tas genom att försiktigt skrapa slemhinnan med en steril slev. Material överförs därefter till provtagningspinnen som omedelbart förs ned i transportmediet. Farynx: Provtagningspinnen roteras mot tonsillerna och bakre svalgväggen. Se till att pressa provtagningspinnen mot tonsillerna och deras kryptor. Bartholinska körtlar: provtagningspinne. Sekret 108 från körtel uppsamlas med I 6 Speciell del – Provtagning Prostata: Patienten skall kasta vatten omedelbart före provtagningen för att reducera mikrobiell kontamination från uretra. Kontamination med gonokocker från uretra kan aldrig säkert uteslutas vid positiv prostataodling. Prostata masseras systematiskt från periferin i riktning mot centrum, varefter prostatasekret från uretramynningen uppsamlas med provtagningspinnen. Konjunktiva: Sekret från konjunktivalsäcken uppsamlas med okolad provtagningspinne. Man bör undvika att föra ned pinnen i konjunktivalsäcken. Ledvätska: Leden punkteras och minst två mL av punktatet nedföres i sterilt plaströr. Idealt kan sekret/pus också överföras till provtagningspinnen, vilket är speciellt viktigt vid ringa utbyte. Vid rikligt utbyte bör dessutom två mL sprutas ner i vardera aerob och anaerob blododlingsflaska. Prioritera aerob flaska. Blod: Prov tas i perifer ven. Fördela minst 20 mL blod i aerob och anaerob blododlingsflaska. Provförvaring och transport Provet förvaras kylt i avvaktan på transport och skall vara laboratoriet tillhanda helst samma dag som provet togs och senast inom 24 timmar. Kort transporttid är kritisk. Laboratoriediagnostik Odling i aerob, CO2-anrikad atmosfär på selektiva och icke-selektiva agarmedier är referensmetodik. Undantag är prover från rektum och farynx som odlas enbart på selektiva medier. I förekommande fall sänds isolerad gonokockstam till referenslaboratoriet för resistensbestämning och epidemiologisk typning. Bedömning och svarsrutiner Fynd av N. gonorrhoeae i kliniskt prov skall betraktas som gonorré och skall rapporteras till kliniken och anmälas enligt smittskyddslagen. 109 I 6 Speciell del – Provtagning P.4.2. Prov för nukleinsyrabaserad diagnostik av gonokocker Indikation Många av de nukleinsyrabaserade diagnostiska metoderna för N. gonorrhoeae har suboptimal specificitet och saknar effektiva, godkända protokoll för extragenitala prover. Inte heller kan undersökning av antibiotikaresistens utföras. I ett svenskt perspektiv, med relativt låg gonorréprevalens och optimerad odlingsdiagnostik, rekommenderas ej rutindiagnostik baserad enbart på DNA/RNAbaserade metoder. För screening av vissa riskgrupper och populationer med hög prevalens av N. gonorrhoeae eller i geografiska områden med problem avseende provtransport och/eller odling kan dock DNA/RNA-baserade metoder vara användbara (1-6). P.4.3. Prov för serologisk diagnostik av gonokocker Indikation Indikation för rutinmässig provtagning föreligger ej. REFERENSER 1. Cook, R. L., S. L. Hutchison, L. Ostergaard, R. S. Braithwaite, and R. B. Ness. Systematic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Ann. Intern Med. 2005; 142:914-925. 2. Fredlund, H., L. Falk, M. Jurstrand, and M. Unemo. Molecular genetic methods for diagnosis and characterisation of Chlamydia trachomatis and Neisseria gonorrhoeae: impact on epidemiological surveillance and interventions. APMIS. 2004; 112:771-784. 3. Palmer, H. M., H. Mallinson, R. L. Wood, and A. J. Herring. Evaluation of the specificities of five DNA amplification methods for the detection of Neisseria gonorrhoeae. J. Clin. Microbiol. 2003; 41:835-837. 4. Savicheva, A., E. Sokolovsky, N. Frigo, T. Priputnevich, T. Brilene, J. Deák, R. Ballard, C. Ison, A. Hallén, M. Domeika, and M. Unemo. Guidelines for laboratory diagnosis of Neisseria gonorrhoeae in EastEuropean countries. Part 1: Gonorrhoea, sampling, and microscopy for diagnosis. Acta. Medica Lituanica. 2007; 14:65-74. 110 I 6 Speciell del – Provtagning 5. Savicheva, A., E. Sokolovsky, N. Frigo, T. Priputnevich, T. Brilene, J. Deák, R. Ballard, C. Ison, A. Hallén, M. Domeika, and M. Unemo. Guidelines for laboratory diagnosis of Neisseria gonorrhoeae in EastEuropean countries. Part 2. Culture, non-culture methods, determination of antibiotic resistance, and quality assurance. Acta. Medica Lituanica. 2007; 14:123-134. 6. Whiley, D. M., J. W. Tapsall, and T. P. Sloots. Nucleic acid amplification testing for Neisseria gonorrhoeae: an ongoing challenge. J. Mol. Diagn. 2006; 8:3-15. 7. Bignell, C. J.; European branch of the International Union against Sexually Transmitted Infection and the European Office of the World Health Organization. European guideline for the management of gonorrhoea. Int. J. STD. AIDS. 2001; 12(suppl 3):27-29. 8. Janda W. M., and C. A. Gaydos. 2007. Neisseria, p. 601-620. In Murray PR, Baron EJ, Jorgensen JH, Landry ML, and Pfaller MA (eds.). Manual of clinical microbiology, 9th ed., vol. 1. ASM Press, Washington, D.C., USA. 9. Sexually Transmitted Diseases. 2007. 4th edition, Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH (eds.). McGraw-Hill Professional, New York, USA. 10. Van Dyck, E., A. Z. Meheus, and P. Piot. Gonorrhoea. In: Laboratory diagnosis of sexually transmitted diseases. World Health Organization (WHO), Geneva; 1999:1-21. P.5. Klamydia (Chlamydia trachomatis) P.5.1. Prov för odlingsdiagnostik av C. trachomatis Indikation Numera är indikationerna för odling av klamydia få och i rutindiagnostik aldrig tvingande. Vid utredning av sexuella övergrepp har odling ett något högre värde än nukleinsyraamplifiering genom att viabla klamydiaorganismer påvisas. Vid frågeställning om terapisvikt/antibiotikaresistens kan odling göras. För att påvisa klamydiabakterier bör man vänta en vecka efter smittotillfället, vid sexuella övergrepp dock två veckor. 111 I 6 Speciell del – Provtagning Provtagning Provtagningsmateriel Provtagningspinne Referenspinne kan inte anges men lämplig sådan är Copan (Brescia, Italien) med aluminiumskaft och rayon- (art. nr 170KS01) eller dacron-topp (art. nr 175KS01). Andra pinnar måste testas då vissa visat sig vara toxiska för C. trachomatis och ej användbara för ändamålet. Provtagningsmedium 2-SP buffert med fetalt kalvserum och antibiotika 1,5-2,0 mL på sterila plaströr (bilaga 2). Förvaring före provtagning: 1 mån vid 4 °C, 4 mån vid –20 °C. Provtagningsförfarande Män Uretra: Prov tas 1-2 cm upp i uretra där pinnen roteras. Vid ”torr uretrit” kan pinnen fuktas med steril NaCl, men inte med provtagningsmedium som innehåller serum och antibiotika. Purulent sekret från urinrörsmynningen undviks. Det kan underlätta provtagningen om patienten ligger på rygg. Kvinnor Uretra: Prov tas cirka 2 cm upp i uretra. Uretra masseras samtidigt från vagina för att tömma uretrala och parauretrala körtlar. Cervix: Cervixmynningen rengörs ordentligt med steril tork före provtagningen. Mukopurulent sekret i cervixkanalen avlägsnas med steril bomullspinne. Prov skall tas från cylinder/övergångsepitelet i cervixkanalen där pinnen roteras samt från eventuella synliga förändringar på cervix. OBSERVERA! Provet skall innehålla epitelceller och inte enbart utgöras av pus! Prov från kvinna bör tas både från uretra och cervix vilket kan öka utbytet med 5-20 % om proven odlas var för sig (Danielsson, Kihlström, Persson och Ripa, pers. medd.) Rektum: Provtagning med pinne sker med fördel via proktoskop. 112 I 6 Speciell del – Provtagning Nasofarynx: Prov tas från nasofarynx med pinne. Prov kan också tas med ”baby-feeding” kateter införd via näsan, det senare kan ge större utbyte [5]. Ögon: Pinnen stryks kraftigt över insidan av undre ögonlocket efter rengöring – pus måste torkas bort. Vid konjunktivit hos spädbarn bör prov även tas från nasofarynx. Se även Rapport från Referensgruppen för diagnostik av ögoninfektioner (SMI-tryck nr 102-1994). Provtagningspinnen (eller eventuellt nasofarynxsekret) överförs till röret med provtagningsmedium och kvarlämnas där. Provförvaring och transport Prov transporteras i kyla och bör anlända till laboratoriet inom 24 tim. I väntan på transport förvaras proven i kyla. På laboratoriet förvaras proven vid 4 °C om provsättning kan ske ett dygn, annars fryses de vid –70 °C. Optimalt förfarande är förvaring vid 4 °C efter provtagning och provsättning snarast. Frys/tining innebär en viss förlust av viabla klamydiaorganismer. Laboratoriediagnostik Odling i cellkultur med avläsning i fluorescensmikroskop är referensmetodik och har åtminstone tidigare ansetts ha 100 % specificitet. Odling har i bästa fall motsvarande sensitivitet som metoder för nukleinsyraamplifiering, men har ofta lägre känslighet och kan vara mindre reproducerbart över tid. Bedömning och svarsrutiner Analysen innebär växt av Chlamydia (fluorescenspositiv) eller icke växt (fluorescensnegativ). Bedömningen är subjektiv och kräver viss erfarenhet för att inte förväxla Chlamydia specifik fluorescens med artefakter. Ibland är resultatet ej bedömbart på grund av provets cytopatogena effekt på värdcellerna. Nukleinsyraamplifiering är då alternativ metod. 113 I 6 Speciell del – Provtagning P.5.2. Prov för nukleinsyrabaserad diagnostik av C. trachomatis inklusive lymfogranuloma venereum Indikation Tester baserade på nukleinsyraamplifiering är numera standard för detektion av C. trachomatis. Prestanda beskrivs i avsnittet om bakteriologisk diagnostik på laboratoriet. Amplifieringstester har generellt en högre känslighet än odling och möjliggör icke-invasiv provtagning hos både kvinnor och män. Urinprov kan användas för klamydiadiagnostik hos män och kvinnor (1). Flera studier visar dock att analys av enbart urin från kvinnor har lägre känslighet än vaginalprover som är den bästa icke-invasiva provtypen för kvinnor. Den enskilt känsligaste metoden är dock cervixprov (2-4). För att ytterligare öka känsligheten kan ett cervixprov kombineras med urinprov. Flera kommersiella metoder för nukleinsyraamplifiering är inte FDA-godkända i USA för provtagningslokaler utanför genitalia (rektum, svalg, nasofarynx, konjunktiva), men används i praktiken med goda resultat. Provtagning Provtagningsmateriel Urin: Fabriksren provtagningsbägare Cervix, uretra, svalg, rektum, konjunktiva: Provtagningspinne och transportrör enligt testtillverkarens anvisningar eller alternativt system som är validerat (tomma transportrör alternativt innehållande lämpligt transportmedium). Flockade pinnar, där rayontoppen applicerats med speciell teknik så att fibrerna strålar ut perpendikuklärt mot ytan har nyligen introducerats på marknaden. Dessa ger sannolikt ökat utbyte för PCR och virusodling. Dokumentationen är dock ännu inte tillräcklig. Nasofarynx: Trakeal-sugset. Prov tas med ”baby-feeding” kateter införd via näsan (rekommenderas), alternativt med en 20 mL steril spruta, sugkateter och sterilt rör (5). Provtagningsförfarande Kvinnor Vagina: Avlägsna överflödigt sekret med hjälp av rengöringspinne. För in provtagningspinnen cirka 4 cm i vagina. Rotera pinnen utmed 114 I 6 Speciell del – Provtagning vaginalväggen i 15-30 sekunder. Urin: Första portion urin (3-12 mL beroende på minimal förbrukningsvolym i respektive testmetod) samlas i en ren bägare och överförs till det sterila transportröret, eller till rör med cervixprov enligt nedan. Cervix (vagina) i urin (högre känslighet än bara urin): Avlägsna överflödigt sekret från cervix (vagina) med hjälp av rengöringspinne. Rotera provtagningspinnen i cervixkanalen 15 sekunder. För ner provtagningspinnen i det tomma sterila plaströret. Överför 312 mL av urinprovet (volym avgörs av minimal förbrukningsvolym i respektive testmetod) till plaströret. Cervix: Prov från cervix enligt ovan, men utan urin (i sterilt transportrör, tomt eller innehållande lämpligt transportmedium). Uretra: Provtagningspinnen införs 1-2 cm in i uretra och roteras 3-5 sekunder. För ner provtagningspinnen i transportröret och se till att det sluter tätt. Män Urin: Första portion urin, cirka 10 mL samlas i en ren bägare och överförs till det sterila transportröret. Övriga provlokaler för klamydiadiagnostik Svalg, rektum, genitala sår (LGV): Prov tas på sedvanligt sätt. Se också P4.1. Provtagningspinnar skall placeras i transportrör, Konjunktiva: Salvor eller liknande bör ej ha applicerats i ögat innan provtagning. Avlägsna försiktigt pus och sekret i ögat. Provtagningspinnen strykes därefter kraftigt över insidan av det nedre ögonlocket, därefter strykes på samma sätt med samma pinne även det övre ögonlockets insida. Placera provtagningspinnen i transportröret. Nasofarynx: Aspirat. 1. Till det ena munstycket kopplas sugkateter och till det andra en vakuumsug. 115 I 6 Speciell del – Provtagning 2. 3. 4. 5. 6. Ställ in sugen på 1-2 bar (kp/cm2). För in sugkatetern genom ena näsborren bakåt utefter gomtaket till nasofarynx där sekret aspireras. Upprepa i andra näsborren. Sug upp 2-3 mL steril fysiologisk koksalt. Om vätskan blir grumlig är det ett tecken på gott utbyte. Byt till steril skruvkork på slemsamlaren. Prov från nasofarynx kan också tas med aspiration med en 20 mL spruta kopplad till slemsamlare. Pinnprov är ett alternativ, men analys av ett sådant prov har inte samma känslighet som ett aspirat. Provförvaring och transport Prover förvaras kylt eller i rumstemperatur utifrån tillverkarens anvisningar. Stora variationer förekommer och lagringstiden har förbättrats under senare år. Torra pinnprover innebär generellt en robust lagring av DNA och kan användas om kommersiella metoders provtagningsmaterial ej är tillgängligt. Kan skickas i rumstemperatur (6). Särskilt gäller att nasofarynxaspirat kan förvaras kylt (+4 °C) i högst två dygn. Laboratoriediagnostik Nukleinsyraamplifiering på mikrobiologiskt laboratorium. Bedömning och svarsrutiner Förekomst av C. trachomatis DNA/RNA indikerar klamydiainfektion och svaras ut med kommentar att klamydia är anmälningspliktig enligt smittskyddslagen. Efter antibiotikabehandling kan DNA kvarstå viss tid och om uppföljningsprov är aktuellt ska det inte tas tidigare än 3 veckor efter avslutad behandling (7, 8). I kliniska prover (speciellt urin och feces) kan inhibitorer förekomma som hindrar nukleinsyraamplifieringen. I kommersiella testsystem ingår inhibitionskontroll (internkontroll) för varje prov. Om prov visar inhibition kan det spädas 5-10 gånger och analyseras på nytt. 116 I 6 Speciell del – Provtagning Sådant förfarande kan ta bort inhibitionen, men i någon mån även minska metodens känslighet. För uriner kan nedfrysning över natt påtagligt minska inhibitionen i vissa detektionssystem (9). Positiva fynd konfirmeras genom förnyad analys av primärprovet. Nödvändigheten av konfirmationstest har dock ifrågasatts på grund av att svagt positiva prover kan bli falskt negativa vid omtestning (10). P.5.3. Prov för serologisk diagnostik av C. trachomatis Indikation Indikation för rutinmässig Se även avsnitt D5. provtagning föreligger ej. REFERENSER 1. Cook RL, Hutchison SL, Ostergaard L, Braithwaite RS, Ness RB. Systematic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Annals of internal medicine. 2005 Jun 7;142(11):914-25. 2. Michel CC-E, Sonnex C, Carne CA, White JA, Magbanua JPV, Nadala ECB, et al. Chlamydia trachomatis load at matched anatomic sites: Implications for screening strategies. J Clin Microbiol. 2007;45(5):1395-402. 3. Schachter J, Chernesky MA, Willis DE, Fine PM, Martin DH, Fuller D, et al. Vaginal swabs are the specimens of choice when screening for Chlamydia trachomatis and Neisseria gonorrhoeae: results from a multicenter evaluation of the APTIMA assays for both infections. Sex Transm Dis. 2005 Dec;32(12):725-8. 4. Wiesenfeld HC, Heine RP, Rideout A, Macio I, DiBiasi F, Sweet RL. The vaginal introitus: a novel site for Chlamydia trachomatis testing in women. Am J Obstet Gynecol. 1996 May;174(5):1542-6. 5. Harrison HR, English MG, Lee CK, Alexander ER. Chlamydia trachomatis infant pneumonitis: comparison with matched controls and other infant pneumonitis. N Engl J Med. 1978 Mar 30;298(13):702-8. 6. Herrmann B, Nystrom T, Wessel H. Detection of Neisseria gonorrhoeae from air-dried genital samples by single-tube nested PCR. J Clin Microbiol. 1996 Oct;34(10):2548-51. 7. CenterforDiseaseControlandPrevention. Screening tests to detect 117 I 6 Speciell del – Provtagning Chlamydia trachomatis and Neisseria gonorrhoaeae infections - 2002. Atlanta: Center for Disease Control and Prevention; 2002 October 18. 8. InternationalUnionagainstSexuallyTransmittedInfectionsStaryA. European STD Guidelines. Internat J STD AIDS. 2001;12(Suppl 3):303. 9. Mahony J, Chong S, Jang D, Luinstra K, Faught M, Dalby D, et al. Urine specimens from pregnant and nonpregnant women inhibitory to amplification of Chlamydia trachomatis nucleic acid by PCR, ligase chain reaction, and transcription-mediated amplification: identification of urinary substances associated with inhibition and removal of inhibitory activity. J Clin Microbiol. 1998 Nov;36(11):3122-6. 10. Schachter J, Chow JM, Howard H, Bolan G, Moncada J. Detection of Chlamydia trachomatis by nucleic acid amplification testing: our evaluation suggests that CDC-recommended approaches for confirmatory testing are ill-advised. J Clin Microbiol. 2006 Jul;44(7):2512-7. P.6. Mycoplasma genitalium P.6.1. Prov för odlingsdiagnostik av M. genitalium Indikation Rutinmässig odlingsdiagnostik av M. genitalium är inte aktuell. Odling kan dock utföras på forskningsmässig basis och provtagning sker då enligt särskilt studieprotokoll. P.6.2. Prov för nukleinsyrabaserad diagnostik av M. genitalium Indikation Indikation för laboratoriediagnostik av M. genitalium är i första hand tecken på uretrit/cervicit och kvarstående symtom efter klamydiabehandling. Partner till patient med M. genitalium bör också provtas. Organismen bör också vara i åtanke vid utredning av salpingit, epididymit, prostatit och möjligen vid infertilitet. Frikostig provtagning är också lämplig vid artrit, konjunktivit, upprepade odlingsnegativa ”UVI”, persisterande genital flytning, blödningsrubbning, låg buksmärta eller andra långdragna 118 I 6 Speciell del – Provtagning underlivsbesvär liksom terapiresistenta “svampbesvär”. Provtagning Provtagningsmateriel Provtagningspinnar: som för klamydia, Se P. 5. 2. Sannolikt kommer flockad pinne att rekommenderas framöver. Provtagningsförfarande Se P.5. 2. avseende: - Urin - Cervix/vagina - Cervixprov i urin - Konjuktivalprov Provförvaring och transport Behöver ej kyltransporteras. Urinprov får ej frysas före analys. Laboratoriediagnostik Nukleinsyraamplifiering på mikrobiologiskt laboratorium. Det finns dock ej ännu någon tillräckligt standardiserad metod som kan anses vara referensmetod. Bedömning och svarsrutiner Positiv test för M. genitalium indikerar infektion och rapporteras till kliniken. Bakterien är inte anmälningspliktig. REFERENSER 1. Jensen JS, Björnelius E, Dohn B, Lidbrink P. Comparison of first void urine and urogenital swab specimens for detection of Mycoplasma genitalium and Chlamydia trachomatis by PCR in patients attending a Sexually transmitted disease clinic. Sex Transm Dis 2004;31:499-507 119 I 6 Speciell del – Provtagning P.7. Ureaplasma species/Mycoplasma hominis P.7.1. Prov för odlingsdiagnostik av Ureaplasma species/M. hominis Indikation Indikation för mikrobiologisk diagnostik av dessa organismer kan vara enstaka fall av ospecifika STI som inte svarat på gängse behandling. Observera att okomplicerad bakteriell vaginos bör uteslutas innan provtagning för M. hominis. Hos män kan Ureaplasma infektion möjligen kompliceras av epididymit och prostatit. Båda bakterierna kan orsaka urinvägsinfektion, Ureaplasma dessutom njursten. Bakterierna kan också ge septiska tillstånd i samband med förlossning och komplikationer i form av sårinfektion, abscesser, osteiter och artriter, särskilt hos immunsupprimerade, speciellt vid hypogammaglobulinemi. Smitta kan överföras till det nyfödda barnet i samband med förlossning och ge sepsis, pneumoni och meningit. Man bör ha bakterierna i åtanke vid dessa tillstånd, särskilt i de fall diagnostik av mer frekventa organismer utfallit negativt. Bakterierna är lättodlade och alla slags provtyper är lämpade. Särskilda substrat krävs dock. I vårt land tillhandahåller för närvarande endast ett fåtal laboratorier odlings/PCR-diagnostik av dessa organismer. Rådgivning avseende diagnostik, mer komplicerade fall samt antibiotikaresistensundersökning kan även erhållas från Mykoplasma-laboratoriet på Statens Serum Institut, Köpenhamn, Danmark. Provtagning Provtagningsmateriel Dacron-försedda provtagningspinnar 2-SP-medium utan antibiotika Sterilt polypropylenrör för transport Provtagningsförfarande Det kan vara fördelaktigt men är inte nödvändigt att ta separata prover för organismerna eftersom de på laboratoriet hanteras separat. 120 I 6 Speciell del – Provtagning Kvinnor Cervix- och uretra-prover (rekommenderas); se P.5.1. Män Uretra (rekommenderas); se P.5.1. Övriga provlokaler Barn Vid misstanke om pneumoni kan prov tas från larynx eller trakea. Nasofarynx; se P.5.1. Prover från andra lokaler Prover som sperma, prostatasekret, urinstenar, svalg, likvor, benfragment, blod, ledvätska och dylikt; hör med specialistlaboratorium för provtagningsanvisningar. Observera att blod skall samlas i Na-citratrör och inte skall fördelas i gängse blododlingsflaskor eftersom bakterierna inte kan växa i dessa medier. Provförvaring och transport Prov för odling skall utan dröjsmål tillställas laboratoriet för omedelbar utodling. Transporteras i rumstemperatur. Laboratoriediagnostik Odling på agarbaserade selektiva specialmedia är referensmetod för påvisande av organismerna. Bedömning och svarsrutiner Svar kan som regel erhållas inom 2-5 dygn. Observera att isolering av dessa organismer i genitala prov inte är liktydigt med infektion orsakad av dessa, eftersom de frekvent förekommer hos friska, sexuellt aktiva personer. Isolering från andra provlokaler, exempelvis blod, sår eller urinsten är däremot med stor sannolikhet kopplad till infektion. 121 I 6 Speciell del – Provtagning P7.2. Prov för nukleinsyrabaserad diagnostik av Ureaplasma species/M. hominis Indikation Indikationerna för PCR-diagnostik av bakterierna är i princip desamma som för odlingsdiagnostik, men analysen är validerad i huvudsak för urin, cervix/uretra, njurstenar, nedre luftvägar och likvor. Prov från spädbarn med symtom korrelerade till förlossningen kan också vara aktuella. Diagnostiken utförs på några av de större laboratorierna i landet. Referenslaboratorium är inte utsett. Provtagning Provtagningsmateriel Sterilt polypropylenrör för transport Fabriksren bägare för urin Provtagningsförfarande Kvinnor Cervix- och uretra-prov (rekommenderas); se P.5.2. Män Uretra: se P.5.2. Urin: Uppsamla första portion av minst 2 mL urin och överför till sterilt rör som skickas till laboratoriet. Njurstenar: Skickas i sterilt rör. Prover från spädbarn: Sekret från nedre luftvägar eller minst 200 uL likvor kan analyseras. Provförvaring och transport Prov förvaras i kyl inför transport till laboratoriet. Laboratoriediagnostik PCR utförs på insänt material. Bedömning och svarsrutiner Se under odling P.7.1. 122 I 6 Speciell del – Provtagning P.8. Syfilis (Treponema pallidum) Serologisk diagnostik utgör grunden för diagnostik av venerisk syfilis. Bakterierna går inte att odla på konstgjorda medier, men med PCR-teknik kan bakterierna påvisas i bland annat genitala sår. Nukleinsyrabaserad metodik ersätter tidigare använd direktmikroskopi. P.8.1. Prov för odlingsdiagnostik av syfilis Bakterierna kan inte odlas på konstgjorda mikrobiologiska medier. P.8.2. Prov för nukleinsyrabaserad diagnostik av syfilis Indikation T. pallidum-DNA kan detekteras från genitala sår, från cerebrospinalvätska, fostervatten, sera från foster och nyfödda men PCR är validerad bara vid genitala sår. Metoden kan användas för diagnostik av syfilis under sjukdomens 1-2 första veckor, innan antikroppssvar erhållits. Metoden ersätter traditionell direktmikroskopi som inte beskrivs i denna upplaga. PCR för diagnostik av T. pallidum utförs endast på ett fåtal svenska laboratorier. Provtagning Beskrivs i bilaga 5. P.8.3. Prov för serologisk diagnostik av syfilis Indikation Serologisk diagnostik är fortfarande grunden för laboratoriediagnostik av syfilis och erbjuder fullständig diagnostik av olika sjukdomsstadier, inklusive neurosyfilis. Serologisk analys är referensmetodik vid syfilisdiagnostik. Dagens specifika syfilistester utförs framförallt på analysinstrument och har god prestanda, men fortfarande har de klassiska ospecifika testerna en plats i diagnostiken, eftersom de är billiga och enkla att utföra. De är fortfarande centrala vid diagnostik av neurosyfilis. Indikationerna för serologisk provtagning omfattar screening av blodgivare och gravida och klinisk misstanke om syfilis. Vid misstänkt neurosyfilis skall 123 I 6 Speciell del – Provtagning också likvorprov tas tillsammans med blodprov för serologisk analys. Provtagning Provtagningsmateriel Vacuumrör: Gelrör, rör utan tillsats eller två kapillärrör/sterilt plaströr. Rör innehållande citrat eller EDTA är också acceptabla. Sterilt plaströr för likvor. Provtagningsförfarande Venöst helblod tas i vacuumrör med eller utan gel eller i två kapillärrör. Alternativt kan serum i sterilt plaströr användas (minst 500 µL). Även plasma kan användas. Minst 1 mL likvor nedföres i sterilt plaströr. Provförvaring och transport Prov bör skickas snarast möjligt till laboratoriet, men akuttransport är ej nödvändig. Rumstemperatur under kortare tid är acceptabelt. Laboratoriediagnostik Serologisk analys utförs med olika testbatterier beroende på frågeställning. För screening börjar man ofta med testning mot ospecifika antigen (exempelvis VDRL). Alternativt utförs testning mot specifika antigen även primärt exempelvis med TTPA eller på någon kommersiell analysutrustning. Bedömning och svarsrutiner Laboratoriet svarar ut resultatet av både ospecifika och specifika testningar och bifogar också tolkning av respektive fynd. Om den ospecifika testningen (VDRL, RPR eller WR) utfallit negativt, brukar man inte gå vidare med specifika tester (TTPA, IgM-ELISA eller annan kommersiell test). På likvor utförs alltid både ospecifika och specifika tester. Syfilis är anmälningspliktig enligt smittskyddslagen. 124 I 6 Speciell del – Provtagning P.9. Treponematoser, icke veneriska (endemisk syfilis, yaws, pinta) Laboratoriediagnostiken baseras på samma serologiska tester som beskrivs för syfilis, varför provtagningen är densamma. Liksom för syfilis kan mörkfältsmikroskopisk undersökning av sårsekret utföras (beskrivs ej i denna upplaga). Rutindiagnostik kan inte skilja aktuella agens från varandra, vilket medför att den slutliga diagnosen är en sammanvägning av klinik och laboratorietester. P.10. Chancroid (Haemophilus ducreyi) Odling är referensmetod för påvisande av Haemophilus ducreyi och erbjuder tillsammans med direktmikroskopi av infektiöst material diagnos med hög känslighet och specificitet. Molekylärbiologiska och serologiska metoder finns inte kommersiellt tillgängliga. Molekylärbiologisk diagnostik erbjuds dock på vissa laboratorier i landet samtidigt med analys av Treponema pallidum (exemplevis på Sahlgrenska sjukhuset). P.10.1. Prov för odlingsdiagnostik av Haemophilus ducreyi Indikation För mikrobiologisk diagnostik av chancroid är odling för påvisande av etiologiskt agens referensmetod. Bakterien är mycket känslig och omgående transport av provet bör ske till laboratoriet om inte ”bedsideodling” kan utföras. Odling av material från sår har högre känslighet än odling av prov från aspirerat pus från inguinala adeniter. Mikroskopi av gramfärgat direktpreparat kan ge presumtiv diagnos. Samtidig provtagning för syfilis och Herpes simplex virus kan vara aktuellt. Provtagning Provtagningsmateriel Kolad provtagningspinne (rayon-spunnen cellulosa, Copan, Brescia, Italien). Tioglykollat-buljong för transport 125 I 6 Speciell del – Provtagning Sterilt plaströr 10 mL spruta för aspirat Objektglas för grampreparat Provtagningsförfarande Pinnprov tas från sårbotten som först försiktigt gjorts rent med koksalt. Undvik blödning. Pinnen nedförs i tioglykollatröret. Aspirerat pus tas från bubo. Det är viktigt att insticksstället genom huden placeras över frisk vävnad skiljt från inflammerad vävnad. Aspirat nedföres i sterilt provrör alternativt transporteras i försluten provtagningsspruta. Prov för direktmikroskopi stryks på objektglas. Provförvaring och transport Idealt inokuleras provmaterialet bedside på angivet substrat (bilaga 6). Pinnprov i tioglykollatbuljong sänds annars omedelbart, helst inom några få timmar kylt till laboratoriet. Aspirat sänds omgående. Laboratoriediagnostik Odling för påvisande av H. ducreyi utförs på specialmedia. Direktmikroskopi av insänt utstryk som gramfärgas. Se diagnostiskt avsnitt D.10. Bedömning och svarsrutiner Påvisande av H. ducreyi är liktydigt med infektion och svaras ut. Infektionen är inte anmälningspliktig enligt smittskyddslagen. P.10.2. Prov för nukleinsyrabaserad diagnostik av Haemophilus ducreyi Kontakta laboratoriet för anvisningar 126 I 6 Speciell del – Provtagning P.11. Donovanos (Klebsiella granulomatis) P.11.1 Prov donovanos. för mikrobiologisk diagnostik av Indikation Vid klinisk misstanke om donovanos skall diagnosen verifieras genom direktmikroskopi av färgade smears eller biopsier från såren. Metoden utgör referensmetod för säkerställande av diagnosen. Mikroskopi har hög känslighet, men falskt negativa resultat kan förekomma, oftast beroende på att proven tagits på fel sätt, exempelvis efter det att smear tagits för annan diagnostik. Såret kan då ha hunnit torka ut, varvid adekvat material inte kan erhållas. Molekylärbiologiska metoder för påvisande av bakterien liksom serologi för att verifiera diagnosen används inte i rutindiagnostiken av donovanos. Dessa metoder beskrivs inte i detalj i denna upplaga (se också D.11.). Provtagning Provtagningsmateriel Okolad fiberarmerad provtagningspinne (rayon/spunnen cellulosa, Copan, Brescia, Italien). Objektglas för utstryk Provexcisionstång Tomt sterilt plaströr för transport av px. Provtagningsförfarande Prov för mikroskopi tas försiktigt som smear med fiberarmerad pinne som rullas över såret. Undvik blödning! Smearprov överförs till objektglas genom att rulla pinnen över glasytan. Lufttorka. Prov bör helst tas från flera lesioner om möjligt. Biopsi kan också tas och nedföras i tomt plaströr för transport. Provförvaring och transport Prov skickas till laboratoriet för analys i särskilda lådor avsedda för transport av objektglas. Laboratoriediagnostik Mikroskopi av metanolfixerat Giemsafärgat material med påvisande av ”Donovankroppar”. Se också D.11. 127 I 6 Speciell del – Provtagning Bedömning och svarsrutiner Påvisande av Donovankroppar i direktpreparat är diagnostiskt för sjukdomen och rapporteras. Vid negativt resultat kan upprepad provtagning vara aktuell, liksom kompletterande undersökning för i första hand syfilis, Herpes simplex virus och chancroid. Donovanos är inte anmälningspliktig enligt smittskyddslagen. P.12. Pelvic inflammatory disease (PID) Hänvisas till Referensmetodik I. 11. 1:a upplagan 2003 P.13. Genital herpes simplex-infektion Numera rekommenderas generellt för rutindiagnostik av genital herpes analys med nukleinsyrabaserade metoder som har högre känslighet än odling och hög specificitet. Serologisk diagnostik är aktuell vid täta recidiv där annan metodik utfallit negativt för bekräftande av diagnosen och vid utredning av primärinfektion. Vid akuta frågeställningar kan också antigenpåvisning i blåssekret vara aktuell. P.13.1. Prov för odlingsdiagnostik av genital herpes Indikation Vissa större viruslaboratorier erbjuder fortfarande virusodling från blåssekret för diagnostik av genital herpes. För optimal känslighet krävs adekvat provtagning och transport. Metoden kräver ett laboratorium med möjlighet att arbeta med cellkulturer och vana att hantera höginfektiöst material. Sådan diagnostik utförs på de virologiska laboratorierna samt vissa mikrobiologiska laboratorier i landet. Provtagning Provtagningsmateriel Vid förvaring i rumstemperatur förlorar HSV snabbt sin infektiositet, ofta inom ett dygn. Viruset tål ej heller intorkning. Transportmedier 128 I 6 Speciell del – Provtagning kan motverka detta och tillhandahålls därför för transport av patientprov till laboratoriet. Provtagningsförfarande Största mängden virus finns i färska blåsor/sår. Ta därför prov från blåsor eller sår i tidigt stadium. Bäst resultat får man inom tre dagar efter sjukdomsdebut men det kan löna sig att ta prov fram till tidpunkten för krustabeläggning. Vid provtagningen används provtagningspinne av beprövad kvalitet, exempelvis med bomull/rayonarmering eller flockad pinne. Blåsor: Välj färskast möjliga blåsa/or. Ta bort ev. blåstak eller krusta med steril armerad pinne/kanyl eller sprutspets. För provtagningspinnen med lätt tryck över blås-/sårbotten, varvid så mycket sekret som möjligt sugs upp och cellmaterial från blåsbotten medföljer. Sår: Torka försiktigt bort sekret med steril koksaltlösning. Provtagningspinnen gnuggas med ett visst tryck mot sårbotten så att cellmaterial medföljer. Cervix: Cervixmynningen rengörs ordentligt med steril tork före provtagningen för att minska svamp-/bakteriekontamination. Prov skall tas från cylinder-/övergångsepitelet i cervixkanalen där provtagningspinnen roteras samt från eventuella lesioner på cervix så att sekret och cellmaterial medföljer. Indikationer för provtagning från cervix föreligger vid cervicit på misstänkt herpesbasis samt för att spåra cervixutsöndring vid vissa frågeställningar hos gravida kvinnor. Uretra: Rotera provtagningspinne i uretramynningen. Prov tas vid klinisk misstanke om herpesinfektion i denna lokalisation. Efter provtagning förs provtagningspinnen ned i transportröret (om virocultpinne används, förs den ned i plaströret varefter nederdelen av röret pressa ihop så att bomullen fuktas med transportvätskan). Prov förvaras i väntan på transport vid 4 °C - fryses ej 129 I 6 Speciell del – Provtagning Provförvaring och transport Prov bör ej frysas, bäst sker förvaring i kylskåp tills transport sker. Såväl egentillverkade som kommersiella transportmedier tillåter förvaring och transport i rumstemperatur under flera dagar utan större förlust av infektiositet. Laboratoriediagnostik Odling på cellkultur. Cytopatogen effekt bedöms i mikroskop. Verifiering med immunofluorescens eller PCR. Bedömning och svarsrutiner Positiv odling besvaras Herpesvirus påvisat med angivande av typ. Ej anmälningspliktig enligt smittskyddslagen. P.13.2. Prov för nukleinsyrabaserad diagnostik av genital herpes Indikation Diagnostik av genital herpes utföres numera rutinmässigt med PCR för påvisande av HSV 1/HSV 2 i material från genitala sår. Metoden har högre känslighet än traditionell odling eller antigenpåvisning och utgör referensmetodik. Provtagning Provtagningsmateriel Kommersiellt provtagningsset för virus. Cytobrush och rör med PCR-buffert eller fysiologisk koksaltlösning. Provtagningsförfarande Blåsor: Välj färskast möjliga blåsa/or. Ta bort ev. blåstak eller krusta med steril armerad pinne/kanyl eller sprutspets. För den provatgningspinnen med lätt tryck över blås-/sårbotten, varvid så mycket sekret som möjligt sugs upp och cellmaterial från blåsbotten medföljer. Sår: Torka försiktigt bort sekret med steril koksaltlösning. Provtagningspinnen gnuggas med ett visst tryck mot sårbotten så att cellmaterial medföljer. 130 I 6 Speciell del – Provtagning Cervix: Cervixmynningen rengörs ordentligt med steril tork före provtagningen för att minska svamp-/bakteriekontamination. Prov skall tas från cylinder/övergångsepitelet i cervixkanalen där provtagningspinnen roteras samt från eventuella lesioner på cervix så att sekret och cellmaterial medföljer. Indikationer för provtagning från cervix föreligger vid cervicit på misstänkt herpesbasis samt för att spåra cervixutsöndring vid vissa frågeställningar hos gravida kvinnor. Uretra: Rotera provtagningspinne i uretramynningen. Prov tas vid klinisk misstanke om herpesinfektion i denna lokalisation. Provförvaring och transport Proverna kan förvaras i rumstemperatur, kyl eller frys. Transport kan ske i rumstemperatur. Laboratoriediagnostik Påvisande av virus med PCR. Vid positivt utfall samtidig typning av virus. Bedömning och svarsrutiner Vid positivt utfall svaras Herpesvirus (typ) påvisat. Ej anmälningspliktig enligt smittskyddslagen. P.13.3. Prov för serologisk diagnostik av genital herpes Indikation Serologisk diagnostik av genital herpes simplex kan vara aktuell vid frågeställning primär eller recidiverade HSV-infektion. Kongenital/neonatal HSV-infektion. Viral meningit/encefalit. Antikroppspåvisning (IgG, IgM). Provtagning Provtagningsmateriel och provtagningsförfarande Helblod utan tillsats (rör för 7 mL) 131 I 6 Speciell del – Provtagning Provförvaring och transport Proverna kan förvaras i rumstemperatur eller kyl. Transporten kan ske i rumstemperatur. Laboratoriediagnostik Antikroppsanalys med ELISA-teknik. Western blot-teknik utgör referensteknik för typspecifik antikroppsanalys. Typspecifika antikroppsanalyser avseende HSV finns tillgängliga på de flesta virologiska laboratorier. Bedömning och svarsrutiner Svaren anges antigen som positivt eller negativt med angivande av typ, men kan också anges som högsta positiva spädningstiter. Ej anmälningspliktig enligt smittskyddslagen. P.13.4. Prov för antigendetektion vid diagnostik av genital herpes Indikation Aktuellt vid akuta frågeställningar. Kontakta alltid aktuellt laboratorium inför provtagning. Provtagning Provtagningsmateriel Objektglas Lancett, kanyl eller fiberarmerad provtagningspinne. Provtagningsförfarande Blåsmaterial och kornealskrap: Skrapa material från blåsbotten med baksidan av ett lancettblad, en kanyl eller fiberarmerad provtagningspinne. Använd objektglas, helst etsad ring eller maskering, markera annars med spritpenna en 50-öringstor ring runt provet. Rulla provtagningspinnen mot objektglaset inom markerat område i en droppe fysiologisk koksaltlösning. Ta minst 2, gärna flera objektglas. Låt preparaten lufttorka. Provförvaring och transport Glasen märks med patientidentitet och provtagningsdatum, och 132 I 6 Speciell del – Provtagning placeras i objektglastransportrör. Glasen får inte läggas ihop mot varandra. Proverna kan förvaras i rumstemperatur eller kyl. Transporten kan ske i rumstemperatur. Laboratoriediagnostik Avläsning i fluorescensmikroskop Bedömning och svarsrutiner Vid positiv bedömning (en enda typisk fluorescerande cell räcker) svaras ut: Herpesvirus påvisat. Ej anmälningspliktig enligt smittskyddslagen. P.14. Genital papillomvirus-infektion HPV-diagnostik finns idag vid flertalet virologiska laboratorier samt även vid flera patologisk/cytologiska laboratorier. Provtagning Provtagningsförfarande Rekommenderat provtagningsmaterial är s.k. borstprover där celler från slemhinnan tas med en borste. Tekniken är densamma som för gynekologisk cellprovtagning. Annat material som t.ex. färskfrusna biopsier eller formalinfixerad vävnad kan också användas. Provförvaring och transport Samma transportmedium som används för s.k. vätskebaserad cytologi är rekommenderat, men transport i vanlig steril fysiologisk koksaltlösning kan användas om provet når laboratoriet inom något dygn. Laboratoriediagnostik. Påvisningsteknink är antingen hybridisering med specifika prober 133 I 6 Speciell del – Provtagning eller PCR, vanligen följt av typning med hybridisering. S.k. realtidsPCR har fördelen att den även uppmäter virusmängd, där hög virusmängd visats ge större risk för cancer i prospektiva studier. Den kliniska betydelsen av att uppmäta virusmängd är dock ännu ej helt klarlagd. HPV-serologi och neutralisationstester utförs i Sverige endast vid WHOs referenslaboratorium för HPV-diagnostik vid UMAS i Malmö och vanligen endast inom klinsk forskning. P.15. Molluscum contagiosum Viruset utgör problem i huvudsak för differentialdiagnostiska överväganden mot andra STI, främst HPV. Sekundärinfekterade genitala mollusker kan imitera andra tillstånd som exempelvis genital herpes simplex. Virus kan inte odlas in vitro, elektronmikroskopi är mikrobiologisk referensmetodik. Vid behov av laboratoriediagnostik rekommenderas analys av blåsskrap, blåsinnehåll med elektronmikroskopi. MOCV har en karaktäristisk rektangulär morfologi. PCR-metoder finns publicerade men använts inte rutinmässigt i Sverige. Provtagning för elektronmikroskopi Blåsinnehåll hålls fuktigt med 2-3 droppar koksaltlösning (ca 100 mikroliter) i sterilt rör. Kan skickas med vanlig postgång. P.16. Hepatit B Diagnostiken av hepatit B baseras i första hand på påvisande av virusantigen och motsvarande antikroppar i blod. Påvisat mönster av hepatitmarkörerna tillåter ofta att man kan dra slutsatser beträffande skede av infektionen och ofta också att göra bedömning av smittsamhet. En mera exakt mätning av virusförekomst och virusnivåer sker via påvisande av HBV-DNA med nukleinsyraamplifieringsmetoder (NAT) varvid man kan bedöma smittsamhet i utvalda fall och dessutom monitorera behandlingseffekt. 134 I 6 Speciell del – Provtagning P.16.1. Prov för nukleinsyrabaserad diagnostik av hepatit B Indikation Provet kan användas för skärpt smittsamhetsbedömning hos vissa personer, exempelvis kroniska HBsAg-bärare. Det kan också användas som led i utredning vid vissa andra frågeställningar, t.ex. oklarhet om specificitet av serologiska markörer, HBsAg positiva personer med profilen HBeAg-/anti-HBe-. Hos vissa individer kan HBeAg inte påvisas trots höggradig viremi. En mutation i HBVs precoreregion kan då föreligga vilken är påvisbar med PCR. Kvantitativ PCR används också för att monitorera behandlingseffekter och för att upptäcka eventuella återfall efter eller under terapi. I speciella fall fastställs med PCR teknik och sekvensering viral genotyp eller resistensmutationer. Tekniken används också vid analys av smittkedjor. Provtagning Provtagningsmateriel och provtagning Helblod eller EDTA plasma minst 7 mL, gärna gelrör (exempel PPT-rör, Becton and Dickinson) lämpar sig för PCR-underökning av HBV-DNA. Heparinrör skall ej användas då heparin inhiberar PCR reaktionen. Provförvaring och transport Provet kan förvaras i rumstemperatur vid snabb transport till laboratoriet. Kan för övrigt kylförvaras upp till 72 timmar från provtagningstillfället. Observera att provet bör centrifugeras inom ett dygn från provtagningstillfället för avskiljande av serum. Vid långtidsförvaring bör serum frysas i -20 oC. Laboratoriediagnostik Molekylärbiologiska metoder Bedömning och svarsrutiner Svaret utformat för att besvara särskild frågeställning. Hepatit B är anmälningspliktig enligt smittskyddslagen. 135 I 6 Speciell del – Provtagning P.16.2. Prov för serologisk diagnostik av hepatit B Indikation Den kliniska bilden av akuta virala hepatiter är likartad och säker diagnos kan endast erhållas genom virologisk diagnostik. Provtagning för HBV-diagnostik med serologiska analysmetoder är indicerad vid av akut hepatit eller uppföljande kontroll vid känd hepatit B och som screening av vissa patientgrupper. Testning av blodgivare och organdonatorer avseende HBsAg är obligatorisk enligt lag. Prov kan också tas för kontroll av anslag vid vaccination mot hepatit B. Provtagning Provtagningsmateriel och provtagningsförfarande Helblod utan tillsats (7 mL) eller serum. Mindre provvolym och plasma kan också användas. Provförvaring och transport Prov bör skickas snabbast möjligt till laboratoriet, men akuttransport är inte nödvändig. Rumstemperatur under kortare tid är acceptabelt, eljest kyl. Serum kan frysas vid långtidsförvaring. Laboratoriediagnostik Serologi för hepatit B utförs i normalfallet med EIA, ofta med kemoluminescensteknologi. Härvid kan HBsAg, HBeAg/ anti-HBe anti-HBs, anti-HBc IgM och anti-HBc-IgG analyseras. Bedömning och svarsrutiner Prov besvaras inom 1-5 dagar. På särskild begäran brukar också akutanalys av HBsAg kunna utföras. Svaret anger resultat av aktuell antigen/antikroppsprofil åtföljd av tolkning avseende stadium av hepatit B-infektion. I förekommande fall bifogas rekommendationer för kompletterande analyser, eventuell bifogas också kommentar om smittsamhet. Hepatit B är anmälningspliktig enligt smittskyddslagen. Vid immunitetskontroll efter vaccination svaras anti-HBs kvantitativt 136 I 6 Speciell del – Provtagning med angivande av internationella enheter (IU/mL) referensintervall. Mätvärden på >10 IU/mL betyder immunitet. och P.17. Hepatit C Den basala diagnostiken av Hepatit C baseras på antikroppsdetektion vilket hos immunkompetenta individer i de flesta fall är tillfyllest. Reaktivitet i anti-HCV screeningtest undersökes därefter vidare antingen med konfirmation av antikroppar med immunoblotundersökning där antikroppar mot 4 eller flera virala proteiner analyseras samtidigt men i separata reaktioner. Antikroppsreaktion mot två eller fler virala rekombinanta proteiner bekräftar att patienten verkligen har exponerats för HCV. Vid reaktivitet mot endast ett viralt protein kallas reaktionen indeterminant (gränsvärde). Personer som uppvisar positiv eller indeterminant immunoblot för HCV skall testas vidare avseende HCV RNA med PCR vilket tillför informationen huruvida HCV infektionen pågår eller ej. I regel sker detta på ett nytt optimalt taget plasmaprov. Det andra sättet att vidareanalysera prover som är positiva i antiHCV screeningtest är att direkt ta prover till RNA-påvisning med PCR för att snabbt få information om HCV infektionen pågår eller ej. Vissa tekniska problem som begränsad preanalytisk hållbarhet tillkommer men fördelen är att merparten smittsamma individer identifieras direkt. Antigentester har varit under utvärdering sedan många år men har inte nått samma känslighet som HIV antigentester – sannolikt kommer framöver någon typ av känsliga kombinerade HCV antigen/antikroppstester på marknaden. P.17.1. Prov för nukleinsyrabaserad diagnostik av Hepatit C Indikation PCR rekommenderas för alla anti-HCV positiva individer i första hand för att påvisa pågående smitta. En annan viktig anledning är att minska oron hos personer med indeterminant antikroppsreaktion. 137 I 6 Speciell del – Provtagning HCV RNA-testning är normalt inte ett förstahandsval vid hepatit C misstanke men bör starkt övervägas hos immunsupprimerade som transplantationspatienter, cancerpatienter, dialyspatienter och patienter med agammaglobulinemi. PCR är den enda metoden som kan användas i tidigt skede av smitta eftersom HCV-RNA uppträder i plasma/serum redan en vecka efter smittotillfället, under den ca två månader långa viremiska fönsterfasen före detekterbart antikroppssvar. Realtids PCR med Taqmanteknik ger utöver uppgift om HCV RNA förekommer eller ej, även virusmängden. Dylika kvantitiva PCR tester används numera rutinmässigt i stället för kvalitativa PCRtester. Kvantifiering av HCV RNA görs för att monitorera effekten av antiviral terapi. Vid genotypning används antingen PCR följt av revers hybridisering (Line probe assay) eller sekvensering. Typning kan även göras med varianter av realtids PCR. Genotypning är av avgörande betydelse för att prognosticera behandlingsutfall. Sekvensering av olika HCV- gener används vid analys av misstänkta smittkedjor. Provtagning Provtagningsmateriel och provtagningsförfarande Helblod , minst 7 mL, skickat i rör utan EDTA-tillsats lämpar sig för PCR-underökning av HCV. Vissa laboratorier använder i stället serum eftersom skillnaden mellan virus i plasma och serum är ringa. Provförvaring och transport Provet kan förvaras i rumstemperatur vid snabb transport till laboratoriet. Kan för övrigt kylförvaras upp till 72 timmar från provtagningstillfället. Observera att provet bör centrifugeras inom ett dygn från provtagningstillfället för avskiljande av serum. Vid långtidsförvaring bör serum frysas i -20 oC. Laboratoriediagnostik Molekylärbiologiska metoder efter frågeställning. Bedömning och svarsrutiner Svaret anger påvisat/ej påvisat HCV RNA med eventuellt angivande av nivåer av nukleinsyra. 138 I 6 Speciell del – Provtagning Hepatit C är anmälningspliktig enligt smittskyddslagen. P.17.2. Prov för serologisk diagnostik av Hepatit C Indikation Antikroppar mot hepatit C-virus påvisas vanligen 2 månader efter smittillfället och kan med dagens antikroppstester i regel detekteras vid tidpunkten för kliniskt insjuknandet om sådant föreligger. Hos immunsupprimerade kan svaret utebli helt, vilket också gäller dialyspatienter, cancerpatienter, transplanterade och agammaglobulinemiker. Provtagning är indicerad vid utredning av akut hepatit och som screening av vissa patientgrupper. Provtagning är obligatorisk för blodgivare och organdonatorer. Vid hepatit C kompletteras serologisk hepatitdiagnostik oftast med nukleinsyrabaserade metoder. Några laboratorier erbjuder akut analys av hepatit C. Provtagning Provtagningsmateriel och provtagningsförfarande Helblod utan tillsats (7 mL) eller serum. Mindre provvolym och plasma kan också användas. Provförvaring och transport Provet kan förvaras i rumstemperatur vid snabb transport till laboratoriet. Kan för övrigt kylförvaras upp till 72 timmar från provtagningstillfället. Observera att provet bör centrifugeras inom ett dygn från provtagningstillfället för avskiljande av serum. Vid långtidsförvaring bör serum frysas i -20 oC. Laboratoriediagnostik Serologisk diagnostik av hepatit C. Bedömning och svarsrutiner Förekomst av antikroppar i blod mot hepatit C i screeningtest kan tala för infektion. Test för konfirmering av HCV-antikroppar eller PCR avseende HCV RNA görs på alla nyupptäckta fall där inte immunoblot eller viremi klarlagts i tidigare prov. I svaret ges en tolkning av fyndet och i förekommande fall ges också rekommendationer för vidare/kompletterande analys. Nyupptäckta fall (positiva fynd i immunoblot eller för HCV RNA) 139 I 6 Speciell del – Provtagning åtföljs av kommentaren att hepatit C är anmälningspliktig enligt smittskyddslagen. P.18. HIV P.18.1 Prov för nukleinsyrabaserad diagnostik av infektion med HIV-1/HIV-2 Indikation Indikationen är fr.a. utredning av misstänkt primär HIV infektion och uppföljning av barn som fötts av HIV-infekterade kvinnor. Andra nukleinsyrabaserade analyser (kvantifiering av HIV RNA i plasma, genotypisk HIV resistenstest och molekylära typningar) används vid uppföljning och utredning av redan diagnostiserade HIV-infektioner. Provtagning Provtagningsmateriel För HIV RNA-PCR används i första hand plasma som separeras från EDTA-helblod (7 mL). För HIV DNA-PCR används i stället vita blodkroppar som renats fram ur EDTA-blod. Provtagningsförfarande Samma rör kan användas för både RNA- och DNA-påvisning. Mindre provvolym kan också användas om nödvändigt, t.ex. hos små barn. Provförvaring och transport Prov bör skickas snabbast möjligt till laboratoriet, men akuttransport är inte nödvändig. Transport i rumstemperatur ska efterstävas. Laboratoriediagnostik HIV diagnostiseras vanligtvis med serologiska metoder (se ovan). Nukleinsyrabaserade tester används som komplement i speciella fall (se D 18 speciell del). 140 I 6 Speciell del – Provtagning Bedömning och svarsrutiner HIV RNA test utförs vanligtvis med en kommersiell kvantitativ testmetod. I svaret anges mängd HIV RNA per mL plasma. HIV DNA test utförs vanligtvis med en kvalitativ ”in-house test” och i svaret anges om HIV DNA påvisats eller ej. Förekomst av HIV nukleinsyra måste verifieras med annan (vanligtvis serologisk) testmetod och verifiering i ett nytt prov innan en person betraktas som HIV-infekterad. HIV är anmälningspliktig enligt smittskyddslagen. P.18.2. Prov för serologisk diagnostik av infektion med HIV-1/HIV-2 Indikation Utredning vid misstänkt HIV-infektion/exposition. Screening av olika grupper som exempelvis blodgivare och gravida kvinnor. Basanalysen utförs med i första hand med 4:e generationens EIA sållningstest. Upprepat reaktivt prov i sållningstest verifieras med konfirmerande testmetod. HIV p24 antigentest kan användas vid misstänkt primär HIV infektion. Provtagning Provtagningsmateriel och provtagningsförfarande Serum d.v.s. helblod utan tillsats (7 mL). Mindre provvolym och plasma kan också användas. Provförvaring och transport Prov bör skickas snabbast möjligt till laboratoriet, men akuttransport är inte nödvändig. Rumstemperatur under kortare tid är acceptabelt. Laboratoriediagnostik Prov analyseras primärt med HIV sållningstest. Positivt fynd verifieras med konfirmerande testning och upprepad provtagning. Bedömning och svarsrutiner Förekomst av antikroppar mot HIV och/eller HIV p24 antigen svaras ut när konfirmerande test utförts. I förekommande fall begärs nytt ett prov för verifiering. HIV är anmälningspliktig enligt smittskyddslagen. 141 I 6 Speciell del – Provtagning P.19. HTLV–1 och 2 P.19.1. Prov för nukleinsyrabaserad diagnostik av infektion med HTLV-1/HTLV-2 Indikation Nukleinsyrabaserad diagnostik används framför allt i de fall då serologiska metoder inte lett till konklusiva resultat. Vid uppföljning av barn till HTLV-infekterade kvinnor kan man få en tidigare diagnos med hjälp av DNA-PCR än av antikroppsdiagnostik pga av de maternella antikroppar som barnet bär med sig till ca 18 månaders ålder. I speciella fall kan sekvensering av virus arvsmassa vara intressant för att få en mer detaljerad information om aktuella virusstammar. Viruskoncentrationsanalyser används inte rutinmässigt för klinisk uppföljning av HTLV-infektion. Provtagning Provtagningsmeteriel och provtagningsförfarande För HTLV DNA - PCR används vita blodkroppar som renats fram ur EDTA-helblod (7 mL). Mindre provvolym kan också användas om nödvändigt, t.ex. hos små barn. Provförvaring och transport Prov bör skickas snabbast möjligt till laboratoriet, men akuttransport är inte nödvändig. Transport i rumstemperatur ska efterstävas. Laboratoriediagnostik HTLV diagnostiseras vanligtvis med serologiska metoder (se ovan). Nukleinsyrabaserade tester används som komplement i speciella fall (se D 19 speciell del). Bedömning och svarsrutiner HTLV DNA PCR- test utförs med en kvalitativ ”in-house test” och i svaret anges om HTLV DNA påvisats eller ej. Förekomst av HTLV nukleinsyra måste verifieras med annan (vanligtvis serologisk) testmetod och verifiering i ett nytt prov innan en person betraktas som HTLV-infekterad. HTLV är anmälningspliktig enligt smittskyddslagen. 142 I 6 Speciell del – Provtagning P.19.2. Prov för serologisk diagnostik av infektion med HTLV-1 och 2 Indikation Utredning eller kontroll vid misstänkt HTLV-infektion/exposition. Misstanke om HTLV-infektion är aktuell särskilt vid Tcellsleukemi/lymfom, oklara spastiska förlamningstillstånd och i en del autoimmunitetsutredningar. Screening av (nya) blodgivare och par som genomgår utredning för assisterad befruktning. Bärarskap är sannolikt livslångt och förekomst av antikroppar indikerar smittsamhet. Provtagning Provtagningsmateriel och provtagningsförfarande Serum d.v.s. helblod utan tillsats ( 7 mL). Mindre provvolym och plasma kan också användas. Provförvaring och transport Prov bör skickas snabbast möjligt till laboratoriet, men akuttransport är inte nödvändig. Rumstemperatur under kortare tid är acceptabelt. Laboratoriediagnostik För detaljer, se D 19, speciell del. Prov analyseras primärt med sållningstest för HTLV-1/2. Positivt fynd verifieras med konfirmerande testning och upprepad provtagning. Bedömning och svarsrutiner Förekomst av antikroppar mot HTLV svaras ut när konfirmerande test utförts. I förekommande fall begärs nytt ett prov för verifiering. HTLV är anmälningspliktig enligt smittskyddslagen. P.20. Trichomonas vaginalis Trikomonasinfektion diagnostiseras hos kvinnor enklast genom påvisning av parasiten i våtpreparat av vaginalsekret (se P.1. och bilaga 7). Trikomonader kan dock bara detekteras i 40-80 % av 143 I 6 Speciell del – Provtagning fallen med den metoden. Även Papanicolau (Pap)– tester kan ibland avslöja förekomst av trikomonader i cervix, men känslighet (6070 % jämfört med våtpreparat) och specificitet är låg med denna metod. Detta beror på att parasiten ofta inte förekommer i sin karakteristiska form i färgade preparat, utan kan påminna om polymorfnukleära leukocyter. Eftersom det även hos män är svårt att diagnosticera trikomonas med direktpreparat, är odling referensmetodik. PCR-diagnostik finns beskriven med används inte i Sverige. Serologiska tester finns kommersiellt tillgängliga, men deras roll i diagnostiken är inte klarlagd. Antikroppssvar kvarstår länge, varför det är svårt att skilja på aktuell eller genomgången infektion. Snabbtester för påvisande av flagellantigen finns utvecklade, men deras plats i diagnostiken är ännu oklar. P.20.1 Prov för odlingsdiagnostik av Trichomonas vaginalis Indikation Odling är referensmetod även om diagnostiken i första hand sker med direktpreparat (se P.1.). Om parasiten inte påvisats i våtpreparat föreligger odlingsindikation om symtom och objektiva fynd överensstämmer med trikomonasinfektion. Indikation för odling gäller även vid misstanke om terapisvikt. Provtagning Provtagningsmateriel Prov tas med Copanpinne som direktinokuleras i rumstempererad odlingsbuljong alternativt transporteras i transportmediet (Copan, Brescia, Italien). Kommersiella transportsystem för trikomonas finns utvecklade som InPouchTV (BioMed Diagnostics, Kalifornien) men används inte i vårt land. Provtagningsförfarande Kvinnor: Prov tas från bakre vaginalfornix Män: Uretraprov minst 2 tim efter senaste urinering. Första portionsurin (10 mL), gärna efter massage av prostata. 144 I 6 Speciell del – Provtagning Provförvaring och transport Prov i transportmedium sänds snarast och inom ett dygn till laboratoriet inför utodling. På laboratoriet förvaras proven i kylskåp före provsättning. Laboratoriediagnostik Odling på selektiv buljong upp till en vecka. Regelbunden mikroskopisk granskning. Bedömning och svarsrutiner Fynd av typiska flagellater i direktpreparat eller i odlingsbuljong anges i svaret. REFERENSER 1. Radonjic I V et al. Diagnosis of Trichomonas vaginalis infection: The sensitivities and specificities of microscopy, culture and PCR assay. Eur J Obstet Gynecol Reprod Biol 2006; 126:116-120. 145 146 I 6 Speciell del – Laboratoriemetoder D. Laboratoriemetoder 147 I 6 – Speciell del –Laboratoriemetoder Ankomstkontroll på laboratoriet Kontrollera; Att provkärlens/objektglasens märkning överensstämmer med remiss. Att beställare finns angiven. Att rekommenderat provmaterial tagits till undersökningen. Att rekommenderad transporttid ej överskridits. Avvikelser från ovanstående bör föranleda diskussion med beställaren. Om behandlande läkare anser att nytt prov inte kan tas och att analysen skall utföras och rapporters trots felaktigheter på det inkommande provet, ska felkällorna kommenteras i laboratorierapporten. 148 I 6 – Speciell del –Laboratoriemetoder D.1. Bakteriell vaginos och vulvovaginit (kolpit) Diagnostiken utförs bedside enligt metodik som beskrivs i provtagningsdelen under P.1. Indikation för laboratoriediagnostik av bakteriell vaginos för övrigt saknas. Beträffande laboratoriediagnostik av Trichomonas vaginalis, se D.20. Laboratoriediagnostik av Candida beskrivs under D.21. D.2. Cervicit och uretrit hos kvinnor Diagnostik utförs bedside enligt metodik som beskrivs i provtagningsdelen under P.2. Prov tas i förekommande fall för mikrobiologisk laboratoriediagnostik av relevanta STI-agens. D.3. Uretrit hos män Diagnostik utförs bedside enligt metodik som beskrivs i provtagningsdelen under P.3. Prov tas i förekommande fall för mikrobiologisk laboratoriediagnostik av relevanta STI-agens. D.4. Neisseria gonorrhoeae Allmänt Gonorré (såväl symtomatisk som asymtomatisk) måste för definitiv laboratoriediagnos konfirmeras genom isolering av N. gonorrhoeae (gonokocker, GC) genom odling (referensmetod), detektion av specifikt antigen eller specifik nukleinsyra i kliniska prov alternativt mikroskopisk identifiering av karakteristiska gramnegativa intracellulära diplokocker i polymorfnukleära leukocyter (PMNL) i utstryk av kliniska prover. Observera dock att mikroskopisk identifiering bara kan ge definitiv laboratoriediagnos för uretrautstryk från symtomatiska män på grund av, för andra provtyper, suboptimal sensitivitet och även i många fall suboptimal specificitet. Sålunda har metoden >90 % sensitivitet för uretrautstryk från symtomatiska män men endast 50-75 % sensitivitet hos asymtomatiska män och 30-50 % sensitivitet (80-95 % specificitet) för cervikala utstryk från kvinnor. Korrekt provtyp, provtagning, färgning och undersökning, inklusive tolkning av erfaren 149 I 6 – Speciell del –Laboratoriemetoder mikroskopist är kritiskt. Odling är referensmetod på grund av dess höga specificitet och sensitivitet, möjlighet att analysera alla provtyper samt utföra resistensbestämning och annan karakterisering. Optimerade provtagnings-, transport- och odlingsbetingelser är nödvändiga. I ett svenskt perspektiv, med relativt låg gonorréprevalens, är rutindiagnostik baserad enbart på direktmikroskopi eller DNA/RNA-baserade metoder ej tillfyllest. För screening av vissa riskgrupper, användning i högprevalenta populationer eller i utvecklingsländer med problem avseende provtransport och/eller odling kan dock DNA/RNA-baserade metoder vara användbara. Referensmetodik Odling Odling är referensmetod för isolering av N. gonorrhoeae från alla typer av kliniska prov. Referenssubstrat Primärisolering av gonokocker från kliniska prov görs på två identiska substrat där det ena gjorts selektivt genom antibiotikatillsats (se bilaga 1). Prover från uretra, cervix och extragenitala mer sterila lokaler som konjunktiva, led, blod etc. inokuleras på både selektivt och icke-selektivt odlingsmedium. Prover från rektum och farynx inokuleras enbart på selektivt substrat. Isolering Inokulerade plattor inkuberas snarast i CO2-termostat (5±1 % CO2-anrikad fuktig atmosfär, 36±1 °C) i 2 dygn, med granskning efter 1 dygn. Identifiering och minimikriterier Inkubering 1 dygn: Karakteristiska gonokockkolonier, vilka kan variera i färg, storlek och morfologi, analyseras för produktion av oxidas. Material från snabbt oxidas-positiva kolonier gramfärgas och renodlas idealt på selektivt och ickeselektivt substrat. Inkubering av renodlingsplattor och primärplattan ytterligare 24 timmar. Inkubering 2 dygn: Eventuella nyidentifierade gonokockkolonier analyseras som ovan. Utför analyser av renodlade gonokocker för definitiv specieskonfirmering (biokemisk karakterisering och antigendetektion enligt nedan) och bestämning av antibiotikakänslighet. Negativa odlingar kan svaras ut. 150 I 6 – Speciell del –Laboratoriemetoder Presumtiv diagnos Typiska gonokockkolonier är snabbt oxidas-positiva, växer på selektivt odlingsmedium, och består av karakteristiska gramnegativa diplokocker. Definitiv diagnos Presumtiv diagnos (se ovan) samt utförd specieskonfirmering är nödvändig för att kunna förse med en definitiv laboratoriediagnos. Optimalt används åtminstone två metoder baserade på skilda principer för en hög sensitivitet och specificitet (1, 2). Problemstammar bör sändas till referenslaboratoriet för utförlig specieskonfirmering och vidare karakterisering. Biokemisk karakterisering Referenspanel för biokemisk specieskonfirmering anges i Tabell 3 och omfattar glukos (nedbrytning genererar syraproduktion), maltos, fruktos eller sackaros, och laktos (t.ex. ONPG-test). Denna diagnostik kompletteras med kommersiell metod för påvisande av gonokockantigen (Phadebact Monoclonal GC Test (Bactus AB)), vilken också ger isolatets serogrupp (WI [PorB1a] eller WII/III [PorB1b]). Kolhydratnedbrytning kan analyseras med tillväxt-beroende (på odlingsplatta; 1 dygn) eller tillväxt-oberoende metod (i buljong; 4 h). Inokulation med rena, färska kolonier från renodlingsplatta (utan andra organismer eller inhiberande kontaminanter) och användning av höggradigt renat kolhydrat är kritiskt. Referensmedium och rekommenderade kvalitetskontroller enligt bilaga 1. 151 I 6 – Speciell del –Laboratoriemetoder Tabell 3. Kolhydratnedbrytning av Neisseria och andra oxidas-positiva species Biokemisk aktivitet Glukos Maltos Laktos Fruktos (Levulos) Sackaros (Sukros)a ONPGb N. gonorrhoeae + - - - - - N. meningitidis + + - - - - N. lactamica + + + - - + N. cinerea - - - - - - N. polysaccharea + + - - +/- - N. sicca + + - + + - + + - + + - + + - +/- +/- - - - - - - - N. elongata - - - - - - M. catarrhalis - - - - - - K. denitrificansd + - - - - - Species N. mucosa c N. subflava N. flavescens d a Kan ersätta fruktos; b ONPG, o-nitrophenyl-β-galaktosidas; c Inkluderar biovaren subflava, flava och perflava som skiljer i deras aktivitet mot fruktos och sackaros; d Kockobacillär i mikroskopi. Observera att det förekommer N. gonorrhoeae- och N. meningitidis-stammar med ej detekterbar nedbrytning av glukos. N. meningitidis stammar med ej detekterbar nedbrytning av maltos och N. cinerea stammar med detekterad glukosnedbrytning (framförallt i snabbtester) kan även förekomma. Kingella denitrificans, som är kockobacillär, kan förväxlas med gonokocker. Testning för påvisande av gonokockantigen bör därför också utföras. 152 I 6 – Speciell del –Laboratoriemetoder Antigendetektion Phadebact Monoclonal GC Test påvisar antigen baserat på coagglutination med specifika monoklonala antikroppar riktade mot PorB hos gonokocker. Metoden har mycket hög sensitivitet och specificitet, men enstaka falskt negativa gonokockisolat samt falskt positiva isolat av N. meningitidis, N. lactamica, N. cinerea, och K. denitrificans har rapporterats internationellt, framförallt med tidigare versioner av metoden. Strikt följsamhet till tillverkarens anvisningar är kritiskt. Kommersiella och alternativa specieskonfirmerande tester Flera kommersiella tester finns tillgängliga för analys av kolhydratnedbrytning och annan biokemisk aktivitet för specieskonfirmering inom genus Neisseria. Exempel på sådana är API-NH, RapID NH liksom identifiering med hjälp av kromogena substrat och andra tester som identifierar aktivitet hos specifika enzymer med diskar/tabletter (Neisseria PET). Metoderna har varierande sensitivitet och specificitet varför specieskonfirmering baserad enbart på dessa inte rekommenderas (1, 2). Flera av metoderna förutsätter att alla gonokockstammar uttrycker enzymet prolyliminopeptidas (PIP). Senaste åren har en global spriding av minst en PIP-negativ gonokockstam identifierats (2), med resulterande svårighet att specieskonfirmera med dessa tester (1, 2). Kommersiella immunologiska tester baserade på fluorescens-märkta antikroppar liksom DNA/RNA-baserade metoder för specieskonfirmering finns tillgängliga. Dessa har varierande sensitivitet och specificitet. Information om tillgängliga produkters prestanda och kvalitet kan lämnas av referenslaboratoriet. Alternativa diagnostiska metoder Nukleinsyrabaserade metoder Många kommersiella DNA/RNA-baserade metoder för diagnostik av N. gonorrhoeae har utvecklats under de senaste decennierna. Dessa är baserade på probe-hybridisering med specifika N. gonorrhoeae sekvenser, t.ex. Pace 2 (GenProbe) och Digene Hybrid Capture 2 (HC2) CT/NG (Digene Corporation), eller amplifiering av specifika nukleinsyrasekvenser, t.ex. Cobas Amplicor eller Cobas TaqMan48 (Roche Diagnostics), BD ProbeTec ET (Becton Dickinson), Aptima Combo 2 (Gen-Probe), Abbott m2000 (Abbott Laboratories) etc. Framförallt de amplifierande metoderna har hög sensitivitet och i flera fall relativt hög specificitet samt ger fördelar som möjlighet till icke-invasiv provtagning (t.ex. urin), snabbare diagnos, automatisering, ej behov av viabla bakterier, och samtidig detektion av både N. gonorrhoeae och Chlamydia trachomatis. Bland nackdelarna märks speciellt att de flesta av metoderna har 153 I 6 – Speciell del –Laboratoriemetoder suboptimal specificitet (sekvenslikheter med framförallt apatogena Neisseria arter i normalfloran och hög grad av inter-species genetisk överföring), effektiva och godkända protokoll för extragenitala prover saknas och undersökning av antibiotikaresistens kan inte utföras (3-9). Aptima Combo 2 (Gen-Probe) och Abbott m2000 (Abbott Laboratories) utmärker sig dock genom att dessa system har en avsevärt högre specifitet. Genetiska analyser för att identifiera alla viktiga antibiotikaresistens mekanismer existerar ej. Flera in-house diagnostiska metoder har också utvecklats och två metoder baserade på detektion av porA pseudogenen hos N. gonorrhoeae har också hittills visat 100 % specificitet (68). Vid användning av amplifierande tester som ej har 100 % specificitet i ett lågprevalent land som Sverige bör man konfirmera alla positiva prover med annan test, dvs. idealt odling eller åtminstone genetisk test med annan målgen. Exempelvis, vid en prevalens av 2 % (fortfarande hög) och med en sensitivitet på 99 % och en specificitet på 99 % blir det positiva prediktiva värdet (PPV) endast 66,9 % (6, 9). Sålunda, i Sverige med mycket lägre gonorréprevalens, blir PPV ännu lägre. Serologi (antikroppsbestämning) Komplementbindnings reaktion (KBR) med helcellsantigen av värmebehandlade N. gonorrhoeae samt hemagglutination eller ELISA med piliantigen är utvecklade in-house metoder för att påvisa antikroppar mot gonokocker. Effektiva, kommersiella metoder saknas dock. Påvisande av antikroppar mot gonokocker i serum är av tveksamt diagnostiskt värde vid okomplicerad gonorré på grund av suboptimal sensitivitet och specificitet samt oförmåga att skilja aktiv från tidigare genomgången infektion. Vid kvarstående misstanke om djup komplikation eller disseminerad gonokockinfektion (DGI), som ej kunnat konfirmeras genom odling, kan den dock vara av värde framförallt om man kan påvisa signifikant titerförändring (~2 titersteg) vid analys av parade sera. Antigendetektion med immunofluorescens eller enzymimmunologisk metodik (EIA/ELISA) För diagnostiskt bruk har dessa metoder ej tillräckligt hög prestanda. Resistensbestämning Resistensbestämning av gonokocker erbjuder särskilda problem i val av medier, standardisering, kvalitetskontroll och tolkning av resultat. Endast laboratorier med särskilt intresse för N. gonorrhoeae bör utföra grundlig resistensbestämning. Agarspädningsmetod för MIC-bestämning är fortfarande internationell referensmetod. Metoden är dock mindre väl lämpad som rutinmetod. Etest (Biodisk AB) kan användas som alternativ för rutinmässig 154 I 6 – Speciell del –Laboratoriemetoder resistensbestämning och har visats ha jämförbara prestanda med referensmetoden. På referenslaboratoriet utförs rutinmässigt resistensbestämning (Etest) mot ampicillin, cefixim, ceftriaxon, azitromycin, ciprofloxacin samt spektinomycin. Vid behov analyseras även andra antibiotika. β-laktamas produktion identifieras med nitrocefin disk. Ökande resistens mot de flesta tillgängliga antibiotika är ett globalt problem och resistensen visar på geografiska samt temporala variationer, varför det är nödvändigt att samtliga isolat i Sverige resistensbestäms. Den aktuella resistenssituationen för N. gonorrhoeae i Sverige, beskrivning av substratrecept och metodik för resistensbestämning liksom MIC-brytpunkter för SIR-klassifikation beskrivs av referenslaboratoriet och svenska Referensgruppen för antibiotikafrågor metodgruppen (RAF-M; http://www.srga.org). Epidemiologisk typning N. gonorrhoeae har traditionellt karakteriserats med fenotypiska metoder som auxotypning (baserad på skilda näringsbehov), antibiogram, samt serogruppering och serovarbestämning (skilda antigena epitoper hos PorB). De serologiska metoderna för epidemiologisk typning är snabba, praktiskt enkla och kostnadseffektiva. Metoderna har dock svagheter som subjektivitet, suboptimal diskriminerande förmåga och tveksam reproducerbarhet. Därför har genetiska metoder utvecklats som kan identifiera skillnader i olika enzymer eller plasmider, enstaka eller multipla genetiska lokus (genom exempelvis sekvensering av framförallt specifika högvariabla gener), eller potentiellt indexera hela genomet hos gonokockstammar (med exempelvis pulsfält gelelektrofores, PFGE). Serovarbestämning som primär epidemiologisk markör med efterföljande sekvensering av väl valda högvariabla gener, exempelvis med metoden N. gonorrhoeae multiantigen sequence typing (NG-MAST), ger utmärkt information avseende korttidsepidemiologi. NG-MAST sekvenserar variabla delar av generna för två skilda yttermembranproteiner, PorB och TbpB, och metoden har en hög diskriminerande förmåga, objektivitet, reproducerbarhet, typningsbarhet samt generar data som kan användas för jämförelser mellan laboratorier (2, 4). På referenslaboratoriet används rutinmässigt serologisk karakterisering och vid specifika epidemiologiska frågeställningar eller i forskningssyften, många olika genetiska typningsmetoder. De specifika epidemiologiska frågeställningarna vägleder valet av typningsmetod(er). Kvalitetskontroll Se Bilaga 1 155 I 6 – Speciell del –Laboratoriemetoder Svarsrutiner Isolat som det enskilda laboratoriet identifierat som N. gonorrhoeae svaras växt av Neisseria gonorrhoeae, med tillägg att isolatet har skickats till referenslaboratoriet för definitiv diagnos och/eller vidare karakterisering och resistensbestämning. Slutligt svar ges i förekommande fall efter verifiering, vidare karakterisering (serovarbestäming) och resistensbestämning på referenslaboratoriet. I svaret bör anges att gonorré är anmälningspliktigt enligt smittskyddslagen. Laboratorierapportering Gonorré är anmälningspliktig enligt smittskyddslagen. Anmälan av varje fall görs till lokal smittskyddsläkare samt till SMI via SmiNet (http://www.sminet.se). Av behandlande läkare görs också en klinisk anmälan av varje enskilt fall till smittskyddsläkare och SMI. Referenslaboratorium Nationella referenslaboratoriet för patogena Neisseria, Kliniskt mikrobiologiska kliniken, Universitetssjukhuset Örebro, 701 85 Örebro. Kontaktpersoner: Docent Magnus Unemo och docent Hans Fredlund. REFERENSER 1. Alexander, S., and C. Ison. Evaluation of commercial kits for the identification of Neisseria gonorrhoeae. J. Med. Microbiol. 2005; 54:827-831. 2. Unemo, M., H. M. Palmer, T. Blackmore, G. Herrera, H. Fredlund, A. Limnios, N. Nguyen, and J. Tapsall. Global transmission of prolyliminopeptidase (PIP)-negative Neisseria gonorrhoeae strains – implications for changes in diagnostic strategies? Sex. Transm. Infect. 2007; 83:47-51. 3. Cook, R. L., S. L. Hutchison, L. Ostergaard, R. S. Braithwaite, and R. B. Ness. Systematic review: noninvasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Ann. Intern Med. 2005; 142:914-925. 4. Fredlund, H., L. Falk, M. Jurstrand, and M. Unemo. Molecular genetic methods for diagnosis and characterisation of Chlamydia trachomatis and Neisseria gonorrhoeae: impact on epidemiological surveillance and interventions. APMIS. 2004; 112:771-784. 5. Palmer, H. M., H. Mallinson, R. L. Wood, and A. J. Herring. Evaluation of the specificities of five DNA amplification methods for the detection of Neisseria gonorrhoeae. J. Clin. Microbiol. 2003; 41:835-837. 6. Whiley, D. M., J. W. Tapsall, and T. P. Sloots. Nucleic acid amplification testing 156 I 6 – Speciell del –Laboratoriemetoder for Neisseria gonorrhoeae: an ongoing challenge. J. Mol. Diagn. 2006; 8:3-15. 7. Hjelmevoll, S. O., M. E. Olsen, J. U. Sollid, H. Haaheim, M. Unemo, and V. Skogen. A fast real-time polymerase chain reaction method for sensitive and specific detection of the Neisseria gonorrhoeae porA pseudogene. J. Mol. Diagn. 2006; 8:574-581. 8. Hjelmevoll, S. O., M. E. Olsen, J. U. Ericson Sollid, H. Haaheim, K. K. Melby, H. Moi, M. Unemo, and V. Skogen. 2008. Clinical validation of a real-time polymerase chain reaction detection of Neisseria gonorrhoeae porA pseudogene versus culture technique. Sex. Transm. Dis. 2008; 35:517-520. 9. Savicheva, A., E. Sokolovsky, N. Frigo, T. Priputnevich, T. Brilene, J. Deák, R. Ballard, C. Ison, A. Hallén, M. Domeika, and M. Unemo. Guidelines for laboratory diagnosis of Neisseria gonorrhoeae in East-European countries. Part 2. Culture, non-culture methods, determination of antibiotic resistance, and quality assurance. Acta. Medica Lituanica. 2007; 14:123-134. 10. Bignell, C. J.; European branch of the International Union against Sexually Transmitted Infection and the European Office of the World Health Organization. European guideline for the management of gonorrhoea. Int. J. STD. AIDS. 2001; 12 (suppl 3):P27-29. 11. Janda W. M., and C. A. Gaydos. 2007. Neisseria, p. 601-620. In Murray PR, Baron EJ, Jorgensen JH, Landry ML, and Pfaller MA (eds.). Manual of clinical microbiology, 9th ed., vol. 1. ASM Press, Washington, D.C., USA. 12. Sexually Transmitted Diseases. 2007. 4th edition, Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, Cohen MS, Watts DH (eds.). McGraw-Hill Professional, New York, USA. 13. Van Dyck, E., A. Z. Meheus, and P. Piot. Gonorrhoea. In: Laboratory diagnosis of sexually transmitted diseases. World Health Organization (WHO), Geneva; 1999:121. D.5. Chlamydia trachomatis Allmänt Traditionell referensmetod för C. trachomatis diagnostik är odling, som dock endast utförs vid enstaka laboratorier i landet som komplement till den numera dominerande nukleinsyrabaserade diagnostiken. Kompletterande diagnostiska metoder är antigenpåvisning med immunofluroescensmikroskopi och antikroppspåvisning med olika tekniker. DNA-sekvensering har visst utrymme vid speciella frågeställningar. Snabbtester har lanserats i Sverige, även för egendiagnostik, men har hittills prestandamässigt varit undermåliga och har utgått från marknaden. Det är oklart 157 I 6 – Speciell del –Laboratoriemetoder vilken roll sådana tester kan ha som komplement till väletablerad rutindiagnostik. Snabbtester tas för närvarande ej närmare upp i detta avsnitt. Tabell 4: Översikt för laboratoriediagnostik av klamydia Metod Detektionsgräns Känslighet % Specificitet % Nukleinsyraamplifiering (PCR, SDA, TMA) 1-10 celler per prov >90 >98 Odling 5-100 80-95 100 Antigenpåvisning med direkt 10-200 immunofluorescens 60-90 80-99 Snabbtester * (antigenpåvisning) 25-70 Varierande *Ännu ej tillräckligt känsliga för rutindiagnostik Nukleinsyrabaserad diagnostik i Sverige utförs med kommersiella metoder och detaljerade anvisningar för provtagning, transport, detektion och resultattolkning tillhandahålls av respektive tillverkare. Vid användning av egentillverkade metoder för rutinmässig nukleinsyradiagnostik måste omfattande validering göras mot referensmetod. För kvalitetssäkring av både kommersiella och egenutvecklade metoder hänvisas till manualen Molecular diagnostic methods for infectious diseases; Approved guideline – Second Edition 2006, Clinical and Laboratory Standards Institute (http://www.clsi.org). Referensmetodik Odling Beskrivning av odlingsförfarandet ges i bilaga 2. Alternativa diagnostiska metoder Nukleinsyrabaserade metoder Flera kommersiella detektionssystem finns och olika amplifieringstekniker för nukleinsyra används. Alla detektionssystemen fungerar tillfredställande jämfört med odling. Vissa skillnader i analytisk och klinisk känslighet finns dock mellan de olika 158 I 6 – Speciell del –Laboratoriemetoder metoderna (1-3). Metodval avgörs även av det egna laboratoriets infrastruktur och behov. Inget specifikt system kan förordas. Tabell 5. Översikt av några kommersiella nukleinsyrabaserade diagnostiska metoder för C. trachomatis Metod Nukleinsyra Målgen(er) Tillverkare DNA plasmid/ompA plasmid/ompA plasmid/plasmid Roche Diagnostics Artus; TIB MolBiol Abbott Laboratories SDA DNA (Strand displacement amplification) plasmid Becton Dickinson TMA (Transcriptionmediated amplification) 23S RNA 16S RNA (konfirm. test) GenProbe PCR (Polymerase chain reaction) RNA Positiva fynd konfirmeras genom förnyad analys av primärprovet. För uriner omfattar det även nukleinsyraextraktionssteget. Nödvändigheten av konfirmationstest har ifrågasatts på grund av att svagt positiva prover kan bli falskt negativa vid omtestning (2). Ett bristfälligt undersökt problem är kontamination vid provtagningen, vilket kan ge falskt positiva resultat (4). Utbildning av provtagande personal är därför viktig. Antikroppspåvisning Konventionell metod för antikroppspåvisning är mikroimmunofluorescens (MIF)-test mot C. trachomatis elementarkroppar (5). Kommersiella ELISAtester som är mer standardiserade är också tillgängliga (6). Antikroppsdetektion har dock begränsat utrymme för klamydiadiagnostik hos enskilda patienter, men är användbara vid spädbarnspneumoni, infertilitetsutredningar och epidemiologiska prevalensstudier. Vid spädbarnspneumoni kan C. trachomatis-IgM påvisas. Prov från nasofarynx för samtidig nukleinsyradetektion rekommenderas. Andra indikationer för antikroppspåvisning är reaktiv artrit och perihepatit. 159 I 6 – Speciell del –Laboratoriemetoder Tubarinfertilitet orsakas till stor del av persisterande klamydiainfektioner som inte ger immunsvar. Det positiva prediktiva värdet för en C. trachomatis-IgG test är därför lågt (30-65 %) medan det negativa prediktiva värdet är 75-90 % och kan användas för att avfärda klamydia som trolig orsak till infertilitet. Kombination med högkänslighets test för CRP höjer det positiva prediktiva värdet till 86 % enligt en översikt (7). Antikroppar för klamydiaspecifikt hspprotein används också vid komplikationsutredningar (8). C. trachomatis-IgG kan även användas för att påvisa genomgången infektion i epidemiologiska undersökningar. Antikroppsundersökning för C. trachomatis är otillräcklig för att påvisa aktuell infektion och kan inte ligga till grund för smittskyddsanmälan. Antigentester ELISA metoder användes tidigare i stor skala som alternativ till odling. Dess låga känslighet gör att de inte har något utrymme när nukleinsyrabaserade metoder är tillgängliga. Direkt fluorescerande antikroppstest (DFA). Direkt påvisning av chlamydiaorganismer i utstryk på objektglas med fluorescerande monoklonala antikroppar är en snabbmetod för fåtalsdiagnostik. Metoden kan i bästa fall prestandamässigt vara i nivå med odling, men kräver bedömningserfarenhet och har numera en mycket begränsad användning. Snabbtester har lanserats på marknaden, men har hitintills visat alltför bristfälliga prestanda för att ha en plats i Sverige. Bättre metoder är på väg och användning och kvalitetssäkring behöver utredas bättre. Resistensbestämning Den kliniska och mikrobiologiska utläkningen av C. trachomatis-infektioner vid antibiotikabehandling är väldokumenterad. Trots enstaka rapporter om nedsatt känslighet/resistens (9), finns ingen anledning att resistensbestämma C. trachomatis-isolat, utom vid väl dokumenterad terapisvikt. Referensmetodik för resistensbestämning saknas för närvarande. Epidemiologisk typning Sekvensbaserad genotypning används inte rutinmässigt, men kan göras för att undersöka om personer i ett sexuellt nätverk har samma genetiska klamydiavariant. För övrigt utförs genotypning huvudsakligen för forskningsändamål. Mest omfattande erfarenhet finns av typning baserad på 160 I 6 – Speciell del –Laboratoriemetoder ompA genen (10, 11), men multilokusbaserad sekvenstypning ger högre upplösning och utföres vid mikrobiologiska laboratoriet i Uppsala (12). Kvalitetskontroll I kommersiella metoder ingår positiv och negativ kontroll. Positiv kontroll kan vara starkt positiv och blir då robust, men kan samtidigt maskera förändringar i metodens prestanda. Egentillverkade kontroller bör användas regelbundet för att se att metoden inte driver i känslighet. För ackreditering av diagnostisk metodik följs riktlinjer från SWEDAC. I detta ingår analys av svenska provpaneler som distribueras av EQUALIS. Internationella provpaneler tillhandahålls av UK-NEQAS (http://www.ukneqas.org.uk) och QCMD (http://www.qcmd.org) som via EQUALIS distribueras till svenska laboratorier. Svarsrutiner Prover med påvisad nukleinsyra eller isolat av C. trachomatis betraktas som konfirmerat fall av klamydiainfektion och besvaras. I svaret bör anges att klamydia är anmälningspliktig enligt smittskyddslagen. Laboratorierapportering Klamydia är anmälningspliktig enligt smittskyddslagen. Anmälan av varje fall görs till lokal smittskyddsläkare samt till SMI via SmiNet (http://www.sminet.se). Av behandlande läkare görs också en klinisk anmälan av varje enskilt fall till smittskyddsläkare och SMI. Lymphogranuloma venereum Odling Isolering av Chlamydia trachomatis LGV från prov från ano-genitalområdet. Beskrivning av odlingsförfarandet som för övriga serotyper, se bilaga 2. Nukleinsyrapåvisning och antikroppspåvisning Se avsnittet under klamydia. REFERENSER 1. http://www.qcmd.org/Index2.htm. 2. Schachter J, Chow JM, Howard H, Bolan G, Moncada J. Detection of Chlamydia 161 I 6 – Speciell del –Laboratoriemetoder trachomatis by nucleic acid amplification testing: our evaluation suggests that CDC-recommended approaches for confirmatory testing are ill-advised. J Clin Microbiol. 2006 Jul;44(7):2512-7. 3. Schachter J, Hook EW, Martin DH, Willis D, Fine P, Fuller D, et al. Confirming positive results of nucleic acid amplification tests (NAATs) for Chlamydia trachomatis: all NAATs are not created equal. J Clin Microbiol. 2005 Mar;43(3):1372-3. 4. Meader E, Waters J, Sillis M. Chlamydia trachomatis RNA in the environment: is there potential for false-positive nucleic acid amplification test results? Sex Transm Infect. 2008 Apr;84(2):107-10. 5. Wang SP, Grayston JT, Alexander ER, Holmes KK. Simplified microimmunofluorescence test with trachoma-lymphogranuloma venereum (Chlamydia trachomatis) antigens for use as a screening test for antibody. J Clin Microbiol. 1975;1(3):250-5. 6. Morre SA, Munk C, Persson K, Kruger-Kjaer S, van Dijk R, Meijer CJ, et al. Comparison of three commercially available peptide-based immunoglobulin G (IgG) and IgA assays to microimmunofluorescence assay for detection of Chlamydia trachomatis antibodies. J Clin Microbiol. 2002 Feb;40(2):584-7. 7. Hartog JE, Morre SA, Land JA. Chlamydia trachomatis associated tubal factor subfertility: immunogenetic aspects and serological screening. Human Reproductin Update. 2006;12:719-30. 8. Persson K. The role of serology, antibiotic susceptibility testing and serovar determination in genital chlamydial infections. Best practice & research. 2002 Dec;16(6):801-14. 9. Wang SA, Papp JR, Stamm WE, Peeling RW, Martin DH, Holmes KK. Evaluation of antimicrobial resistance and treatment failures for Chlamydia trachomatis: a meeting report. J Infect Dis. 2005;191(6):917-23. 10. Jurstrand M, Falk L, Fredlund H, Lindberg M, Olcen P, Andersson S, et al. Characterization of Chlamydia trachomatis omp1 genotypes among sexually transmitted disease patients in Sweden. J Clin Microbiol. 2001 Nov;39(11):3915-9. 11. Lysen M, Osterlund A, Rubin CJ, Persson T, Persson I, Herrmann B. Characterization of ompA genotypes by sequence analysis of DNA from all detected cases of Chlamydia trachomatis infections during 1 year of contact tracing in a Swedish County. J Clin Microbiol. 2004 Apr;42(4):1641-7. 12. Klint M, Fuxelius HH, Goldkuhl RR, Skarin H, Rutemark C, Andersson SG, et al. High-Resolution Genotyping of Chlamydia trachomatis Strains by Multilocus Sequence Analysis. J Clin Microbiol. 2007 Feb 28. 13. Socialstyrelsen. Märkning av remisser och prover vid allmänfarliga sjukdomar som är sexuellt överförbara. Meddelandeblad, Juni 2008. 162 I 6 – Speciell del –Laboratoriemetoder D.6. Mycoplasma genitalium Allmänt Endast nukleinsyrabaserade metoder finns tillgängliga för rutindiagnostiken av M. genitalium. Idag finns inte tillgång till kommersiella kit, varför några väl utprovade molekylärbiologiska metoder redovisas. Odling används enbart för forskningsändamål. Serologiska metoder finns ännu inte allmänt tillgängliga. Referensmetodik Metodik som är tillräckligt standardiserad för att förtjäna beteckningen referensmetodik finns ännu ej definierad. Alternativa diagnostiska metoder Odling Odling kan utföras med initial odling på veroceller och därefter på fast odlingsmedium men är inte aktuell för rutindiagnostik. Generationstiden är extremt lång vilket innebär att en odling kan ta flera månader. Nukleinsyrapåvisning Den första PCR-metoden för detektion av Mycoplasma genitalium beskrevs 1991. Denna detekterar sekvenser i adhesionsgenen MgPa. Det finns områden i MgPa som är variabla men MgPa1 och MgPa3 som används som primers i denna PCR har visat sig ligga i konserverade sekvenser. Hög känslighet och specificitet har även en 16S-baserad PCR med primers MG16-45F och MG16447R. Flera realtids-PCR för detektion av Mycoplasma genitalium har publicerats. Den metod som flera laboratorier i Sverige använder är en Taqman PCR med primers och probe för MgPa-genen. Metoden är något känsligare än de traditionella metoderna ovan . Vid Seruminstitutet i Köpenhamn, liksom i Falun fram till 2007 används den 16S-baserade PCR-metoden för en första analys av alla kliniska prover. Positiva prover verifieras sedan med med MgPa1 och MgPa3 Som för alla PCR-metoder är DNA-extraktionen en väsentlig del av analysen för att få optimal känslighet. Därför måste urinen koncentreras före extraktion. För extraktion i robot, exempelvis Magna Pure, centrifugeras 2 mL urin. Supernatanten sugs av men ca 300 μliter av urinen lämnas kvar i röret. Pelleten slammas upp i kvarvarande urin och provet hanteras sedan enligt anvisning. Urinprover har visat sig känsliga för frysning och PCR-påvisning kan bli falskt negativ efter frysning. För en närmare beskrivning av PCR-metodiken, se Bilaga 3. 163 I 6 – Speciell del –Laboratoriemetoder Serologi Kommersiell serologi finns idag inte tillgänglig. Serologi för Mycoplasma genitalium är svår på grund av korsreaktion med Mycoplasma pneumoniae. Serologi med Triton X-114 extraherat lipidassocierat membranprotein (LAMP) har dock visats inte korsreagera med Mycoplasma pneumoniae. En in-house ELISA med detta antigen har utvecklats i Örebro. Resistensbestämning Resistensbestämning för framförallt azitromycin har utförts i enstaka forskningsprojekt på Statens Serum Institut i Köpenhamn. Epidemiologisk typning DNA-sekvenseringsbaserat typningssystem har utvecklats för forksningsändamål. Kvalitetskontroll Inga kommersiella externa ”quality assurance” (EQA) program finns tillgängliga. Laboratorierna bör därför tills sådana program blir tillgängliga upprätta scheman för flerlabsjämförelser. Laboratorierapportering M. genitalium är inte anmälningspliktig. REFERENSER 1. Jensen JS, Uldum SA, SØndergård-Andersen J et al. Polymerase chain reaction for detection of Mycoplasma genitalium in clinical samples. J Clin Microbiol 1991;29:46-50 2. Jensen JS, Borre MB, Dohn B. Detection of Mycoplasma genitalium by PCR Amplification of the 16S rRNA Gene. J Clin Microbiol 2003;41:261-266 3. Jensen JS, Björnelius E, Dohn B et al. Use of Taqman 5´ nuclease real-time PCR for quantitative detection of Mycoplasma genitalium DNA in males with and without urethritis who were attendees at a sexually transmitted disease clinic. J Clin Microbiol 2004;42:683-692 4. Jurstrand M, Jensen JS, Magnusson A et al. A serological study of the role of Mycoplasma genitalium in pelvic inflammatory disease and ectopic pregnancy. Sex Transm Inf 2007;83:319-323 164 I 6 – Speciell del –Laboratoriemetoder D.7. Ureaplasma species/Mycoplasma hominis Allmänt Både Ureaplasma och M. hominis är förhållandevis lätta att påvisa med odling på fasta eller i flytande substrat. De kräver dock specialsubstrat för optimal växt, och ingen av dem växer signifikant på traditionella mikrobiologiska substrat, inkluderande blododlingsflaskor. M. hominis kan ibland isoleras på hematinagar eller blodagar. Organismerna kan isoleras i alla typer av odlingsprov, förutsatt att transporten till laboratoriet sker korrekt. För PCR-diagnostik (ej kommersiellt tillgänglig) används huvudsakligen genen för 16S rRNA. Förutom 16S rRNA-genen används vid diagnostiken av Ureaplasma även genen för ureas. Referensmetodik Metodik som är tillräckligt standardiserad för att förtjäna beteckningen referensmetodik finns ännu ej definierad men en viss expertis kan erhållas från Statens Serum Institut i Köpenhamn, Danmark. Alternativa diagnostiska metoder Odling Odling är standardmetod för isolering av Ureaplasma species/M. hominis från alla typer av kliniska prov. Odlingssubstrat: Till anrikning av bakterierna används initialt två flytande medier, ett för M. hominis och ett för Ureaplasma. Dessa har gjorts relativt selektiva för målbakterierna genom tillsats av bensylpenicillin. Växt indikeras genom färgomslag av indikatorn fenolrött och indikerar pH-förändring orsakad av metabolisering av arginin till ammoniak (M. hominis) och urea till ammoniak (Ureaplasma). Samma medier används med agartillsats som fasta substrat efter anrikning i buljongerna (bilaga 4). Isolering: Pinnproven från uretra (män) eller uretra/cervix inokuleras i vardera anrikningsbuljong som inkuberas i 36±0,5ºC. Buljongerna inspekteras därefter dagligen efter färgomslag som indikerar växt av någon av organismerna. Positiv buljong sås därefter rikligt på fast agarmedium (eventuellt sugs överflödig vätska bort efter ett dygn). Plattan inkuberas i 5-10 % CO2-miljö i 36±0,5ºC och inspekteras dagligen i upp till en vecka för kolonier med typisk morfologi. Mikroaerofil inkubation är optimal men ej nödvändig. Identifiering och minimikriterier Kolonier av M. hominis växer ut på 2-6 dagar och är 200-300 µm i diameter 165 I 6 – Speciell del –Laboratoriemetoder med ett typiskt och i det närmaste specifikt ”stekt ägg-utseende” (växer nere i agarn centralt och på ytan i periferin). Växt kan också förekomma med diffusa kolonier nedgröpta i agarn. Ureaplasma växer ut på 1-4 dagar med mycket små distinkta kolonier. Ureasproduktion kan påvisas genom att droppa 1-2 droppar CaCl2-urea-lösning över plattan. Målbakterierna färgas bruna inom 5 minuter. Kolonimorfologi och metabolisering av arginin är inte tillräckligt för speciesidentifikation av M. hominis i prov från luftvägar där M. orale och M. salivarium ofta koloniserar och inte kan särskiljas med dessa metoder. Nukleinsyrapåvisning Metoder validerade mot odling används på några laboratorier i landet och kan utföras på olika typer av provmaterial. Vid önskemål om molekylärbiologisk påvisning av organismerna kontaktas lokalt mikrobiologiskt laboratorium. Serologi Ingen kommersiell metod finns tillgänglig. Resistensbestämning Resistensbestämning mot doxycyklin, josamycin, ofloxacin, erytromycin, tetracyklin, ciprofloxacin, azitromycin, klaritromycin och pristinamycin kan utföras och finns tillgänglig i diagnostiska kit. Denna metod är dock ganska grov. Utförligare resistensbestäming mot nämnda och även andra antibiotika är tillgänglig på Statens Serum Institut i Köpenhamn där en buljongspädningsmetod används. Epidemiologisk typning Har ingen relevans i klinisk verksamhet. DNA typningssystem har utvecklats för forksningsändamål. Kvalitetskontroll Inga kommersiella externa ”quality assurance” (EQA) program finns tillgängliga. Svarsrutiner Växt av M. hominis eller Ureaplasma species rapporteras semikvantitativt till kliniken (enstaka, sparsam, riklig växt). Laboratorierapportering M. hominis eller Ureaplasma species är inte anmälningspliktiga. 166 I 6 – Speciell del –Laboratoriemetoder D.8. Treponema pallidum Allmänt Serologiska metoder utgör fortfarande referensmetodik vid laboratoriediagnostik av syfilis. Eftersom serologiska tester förblir negativa under sjukdomens första 1-2 veckor efter det att primärlesionen uppkommit, kan diagnostiken i primärstadiet grundas på förekomsten av T. pallidum i primärsår och körtlar. Tabell 6. Översikt för laboratoriediagnostik av syfilis Användningsområden Screening av blodgivare och gravida Referensmetod Blodprov: VDRL alternativt RPR eller Analysinstrument t.ex. Architect™ Om resultatet blir positivt görs fullständig syfilisdiagnostik som nedan. Blodprov: Alternativ 1: VDRL och eventuellt WR. Om resultatet blir positivt görs TPPA och eventuellt IgM-ELISA. Misstänkt syfilis Misstänkt neurosyfilis Alternativ 2: Analysinstrument t.ex. Architect™. Om resultatet blir positivt görs TPPA och eventuellt IgM-ELISA samt titrering av VDRL om det inte redan gjorts. Blodprov: som ovan vid misstänkt syfilis. Cerebrospinalvätska: VDRL eller RPR och eventuellt WR. 167 Tilläggsmetod (alternativmetod) Pinnprov från sår: Direktmikroskopi och/eller PCR I 6 – Speciell del –Laboratoriemetoder Traditionellt har man utfört direktmikroskopi på material från lesionen. Metoden är föga standardiserad och kräver erfarenhet både vid provtagning och avläsning och utförs i praktiken sällan eller aldrig. I sjukdomsstadierna 1 och 2 kan också metod för nukleinsyrapåvisning (PCR) användas för påvisande av T. pallidum i prov från sår. Den diagnostiken finns dock bara vid speciallaboratorier i Sverige idag. Referensmetodik Serologi En kombination av olika serologiska tester utgör referensmetodik. Ett antal sådana finns tillgängliga för diagnostiken och kan indelas i Ospecifika tester (där icke-treponema antigen användes): WR (Wasserman reaktion), VDRL (Veneral Disease Research Laboratory) test, RPR (Rapid plasma reagin) test. Specifika tester (där antigen från T. pallidum användes): TPPA/TPHA (T. pallidum passive particle agglutination/T. pallidum hemagglutination test), ELISA (Enzyme-linked immunosorbent assay). På senare år erbjuder även en del analysinstrument syfilistester av specifik natur t.ex. Architect™ (Abbott) och Liaison™ (DiaSorin). Med dessa tester påvisas specifika antikroppar mot T. pallidum. Under senare tid har också ett antal ”snabbtester” marknadsförts (ej referensmetodik). De flesta av dessa baseras på immunkromatografi och påvisar specifika antikroppar. Dess plats i diagnostiken är inte definierad, men sensitivitet och specificitet för dessa rapporteras av WHO ligga mellan 92,5-98,4 %. Snabbtester som påvisar både icke-treponema och treponema antikroppar är under utveckling och kommer att finnas kommersiellt tillgängliga inom enstaka år. Den mest specifika testen, förutom PCR, är fortfarande TPPA. Vanligen görs de ospecifika testerna först. Om den/dessa är negativ svaras detta och man nöjer sig vanligen med det. Om ospecifika testerna blir positiva utföres full serologisk analys med specifik(a) test(er). Testerna beskrivs mer i detalj i bilaga 5. 168 I 6 – Speciell del –Laboratoriemetoder Alternativa diagnostiska metoder Odling Man har inte lyckats odla organismerna på konstgjorda mikrobiologiska medier. I vävnadskulturer kan organismerna föröka sig, men metoderna är inte användbara för rutindiagnostik av syfilis. Direktmikroskopi Detta kan göras genom påvisande av bakterierna i pinnprov från primärlesionen med våtpreparat i mörkfälts- eller faskontrastmikroskop. Bakterierna är föga färgbara med gängse mikrobiologiska metoder som gramfärgning eller med metylenblått. De kan däremot visualiseras med silverfärgning eller med immunoflourescensmetodik. Metoden används numera sällan i Sverige. Utförandet beskrivs inte i denna bok, men ytterligare information kan erhållas från speciallaboratorier. Nukleinsyrapåvisning Molekylärbiologisk diagnostik baseras på att med PCR påvisa T. pallidum specifik gen, vanligen bmp (basic membrane protein), genen för 47-kDa lipoproteinet eller polA genen som kodar för DNA polymerase I. Med PCR detekteras själva patogenen och diagnostiken underlättas av att den inte störs av tidigare genomgången eller obehandlad syfilisinfektion som kan vara fallet vid serologisk diagnostik. PCR är också särskilt användbar vid tidiga kliniska tecken på syfilisinfektion innan serologiskt svar kan påvisas. T. pallidum-DNA har kunnat detekteras från genitala sår men också från till exempel cerebrospinalvätska samt fostervatten och sera från foster och nyfödda. PCR är dock endast validerad vid genitala sår. Metodbeskrivning för påvisning med PCR, som tillämpas vid Bakteriologiska laboratoriet, Sahlgrenska Universitetssjukhuset, Göteborg: se bilaga 5. Resistensbestämning Kan ej utföras på rutinlaboratorium. Epidemiologisk typning Utföres ej på något svenskt laboratorium men metoder finns utvecklade. Kvalitetskontroll Referensserum kan erhållas från Statens Serum Institut, Köpenhamn eller NIBSC i England. Externt kontrollprogram för kvalitetssäkring av syfilisdiagnostik kan erhållas 169 I 6 – Speciell del –Laboratoriemetoder från EQUALIS, Uppsala eller UKNEQAS, England. Svarsrutiner I svaren skall resultatet av de olika testerna anges. Vid positivt utfall skall en kommentar rörande tolkning lämnas. Laboratorierapportering Syfilis är anmälningspliktig enligt smittskyddslagen. Endast nya fall skall anmälas. Speciallaboratorier Göteborg: Bakteriologiska laboratoriet, Guldhedsgatan 10, 413 46 Göteborg. Kontaktperson: Bertil Kaijser. För PCR-baserad diagnostik: Christina WelinderOlsson, Box 7193, 402 34 Göteborg. Stockholm/Solna: Mikrobiologiska laboratoriet, KS/HS (serologi) REFERENSER 1. J. Portony, J. H. Brewer, A. Harris: Rapid plasma regain card test for syphilis and other treponematoses. Public health Rep., 1962; 77:645-652 2. M. Deguchi, H. Hosotsubo, A. Asari, N. Yamashita, T. Ohmine, N. Amino: Measurerment of anti-Treponema pallidum antibodies by the indirect agglutination reaction and clinical applications. JARMAN 1963; 5:55-61 3. M. Notgard et al.: Sensitivity and specificity of monoclonal antibodies against antigenic determinants of Treponema pallidum Nichols in the diagnosis of syphilis. J Clin Microbiol 1984; 20:711 4. G. Koek, S. M. Bruisten, M. Dierdorp, A. P. van Dam and K. Templeton. Specific and sensitive diagnosis of syphilis using a real-time PCR for Treponema pallidumClin Microbiol Infect 2006; 12:1233-1236 5. S. M. Bruisten, I. Cairo, H. Fennema, A. Pijl, M. Buimer, P. G. H. Peerbooms, E. Van Dyck, A. Meijer, J. M. Ossewaarde, and G. J. J. van Doornum Diagnosing Genital Ulcer Disease in a Clinic for Sexually Transmitted Diseases in Amsterdam, The Netherlands J. Clin. Microbiol. 2001; 39: 601-605. 6. KA Orle, CA Gates, DH Martin, BA Body, and JB Weiss Simultaneous PCR detection of Haemophilus ducreyi, Treponema pallidum, and herpes simplex virus types 1 and 2 from genital ulcers J. Clin. Microbiol. 1996; 34: 49-54. 7. Wassermann, A., Neisser, A. and Bruck, C. Eine serodiagnostische Reaktion bei Syphilis. Dtsch. med. Wschr. 1906; 32:745. 170 I 6 – Speciell del –Laboratoriemetoder D.9. Treponematoser, icke veneriska Allmänt Laboratoriediagnostiken utgörs primärt av serologisk testning som för venerisk syfilis. Komplettering med mörkfältsmikroskopering av material från sår kan göras. Eftersom rutindiagnostiken inte kan skilja aktuella agens, är den slutliga diagnosen en sammanvägning av klinik och laboratorietester. De ospecifika syfilistesterna tenderar dock att endast bli svagt positiva. D.10. Chancroid - Haemophilus ducreyi Allmänt Odling är referensmetod för påvisande av H. ducreyi. Bakterien är känslig och det är viktigt med snabb transport till laboratoriet inför odling. Den kan växa på vanliga odlingsmedier som GC-agar, men optimal växt kräver specialsubstrat. PCR-metoder finns utvecklade, men är inte kommersiellt tillgängliga. Serologi har låg känslighet och används inte för rutindiagnostik. I gramfärgat direktutstryk kan ofta typiskt anordnade gramnegativa kockoida stavar identifieras. Referensmetodik Odling Odling är referensmetod. Referenssubstrat: GLV-3-agar med vankomycin 3 mg/L (bilaga 6). Tillsatt fetalt kalvserum kan ge ökat utbyte. Primärisolering: Pinnprov inokuleras på GLV-3-agar och icke selektiv GCagar. Inkubering i 33-35 ºC med 5 % CO2 och hög fuktighet. Viktigt att temperaturen inte överstiger 35 ºC. Inkuberas i tre dygn. Identifiering och minimikriterier Presumtiv diagnos: Misstänkta kolonier är gul-grå, välvda och granulerade, ibland med α-hemolys. Kolonin kan förskjutas intakt över agarytan och varierar i storlek, vilket ofta ger falskt intryck av blandflora. Definitiv diagnos: Gramnegativa korta stavar i typisk anordning, oxidaspositiva, katalasnegativa, nitratreducerande. X-faktorkrav kan bäst demonstreras med porfyrintest enligt Kilian (2) och PCR. 171 I 6 – Speciell del –Laboratoriemetoder Alternativa diagnostiska metoder Nukleinsyrabaserade metoder finns utvecklade av bland annat Roche (multiplex PCR för H. ducreyi, T. pallidum och HSV). Metoden är sannolikt känsligare än odling, men finns ännu ej kommeriellt tillgänglig. Serologi. Humoralt immunsvar har påvisats hos patienter med chancroid och serologiska tester baserade på renade eller rekombinanta antigen (yttre membranproteiner och LOS) finns. Problem föreligger dock med korsreaktivitet mot andra Haemophilus-arter. Testerna har begränsat värde vid primärdiagnostiken men kan användas för epidemiologiska studier. Känsligheten varierar 55-100 % (1). Resistensbestämning Referensmetod och referensmedium för resistensbestämning saknas för närvarande. Antibiotikaresistens har studerats mest med agarspädningsmetod, men diskdiffusionsmetoder har också använts. I referenslaboratorier har diskdiffusionsmetod och Etest utförts på anrikad gc-resistensplatta med relativt bra resultat. Epidemiologisk typning Ingen rutinmässig typning utförs. Kvalitetskontroll Referensstammar: CCUG 7470 (CIP 76118; ATCC 35000) (toxinproducerande) och CCUG 4438 (CIP 542; ATCC 33940) (ej toxinproducerande). Laboratorierapportering H. ducreyi är inte anmälningspliktig enligt smittskyddslagen. Speciallaboratorium Bakteriologiska laboratoriet, Guldhedsgatan 10A, 413 46 Göteborg. REFERENSER 1. Elkins, C., Kyunjgcheol, Y., Olsen, B., Thomas,C., Morse, S. 2000. Development of a serological test for H. ducreyi for seroprevalence studies. J. Clin. Microbiol 38:1520-6. 172 I 6 – Speciell del –Laboratoriemetoder 2. Kilian, M. 1974. A rapid method for the differentiation of Haemophilus strains. The porphyrin test. Acta Pathol. Microbiol. Scand. Sect B 82:835-842. D.11. Donovanos - Klebsiella granulomatis Allmänt Tabell 7. Översikt för laboratoriediagnostik av donovanos Primär diagnostik Referensmetod Mikroskopi av smear eller biopsi Alternativ metod(er) PCR Populationsscreening Serologi Forskning Odling Referensmetodik Mikroskopi Verifiering av den kliniska diagnosen sker i första hand genom mikroskopi av metanolfixerat långsamt (över natt) Giemsafärgat material på objektglas. Alternativt kan materialet färgas enligt Wright eller Leishman. Snittade Giemsaeller silverfärgade biopsier används med fördel för att verifiera diagnosen i nekrotiska eller skleroserande sår. Identifiering av ”Donovankroppar” i preparatet, det vill säga stora mononukleära celler (25-90 μm i diameter) fyllda med svarta bipolärt färgade kapslade eller okapslade kockobaciller (0,5-1,5 μm stora), ofta i stora vakuoler, är diagnostiskt för donovanos. Donovankroppar kan också iakttas i material från rutinmässigt tagen cervixcytologi (ej referensmetod). Alternativa diagnostiska metoder Odling Används bara i forskningssyfte. Nukleinsyrabaserad metod En kolorimetrisk PCR-test med ett EIA-slutsteg beskrevs 2000 av de australiska forskarna Jenny Carter och David Kemp. Den baseras på påvisandet av Klebsiella-specifika sekvenser på phoE-genen (reglerar porinproteiner). Två unika basskillnader föreligger som skiljer K. granulomatis från övriga Klebsiellae. Metoden är ännu inte tillräckligt standardiserad för att utgöra 173 I 6 – Speciell del –Laboratoriemetoder referensmetodik. Serologi En indirekt immunofluorescens-metod finns utvecklad för påvisande av antikroppar mot K. granulomatis. Man använder tunt snittat biopsimaterial som antigenkälla. Känsligheten är dock låg, särskilt i tidigt skede av infektionen. Metoden används huvudsakligen för populationsstudier i endemiska områden. Resistensbestämning Utförs ej. Epidemiologisk typning Inte aktuell Kvalitetskontroll Referensstam: Saknas Svarsrutiner Mikroskopi: Donovankroppar påvisade/inte påvisade i smear/biopsimaterial. Förekomst är liktydigt med infektion. Laboratorierapportering Donovanos är inte anmälningspliktig enligt smittskyddslagen. REFERENSER 1. Carter, JS., Kemp, DJ. A colorimetric detection system for Calymmatobacterium granulomatis. Sex Transm Infect. 2000; 76:134-136. D.12. Pelvic inflammatory disease (PID) Laboratoriediagnostik utförs vid denna frågeställning enligt remittentens önskemål. Aktuella agens är klamydia och gonokocker, eventuellt M. genitalium, M. hominis och Ureaplasma. Andra organismer, exempelvis anaeroba bakterier, E. coli och till och med luftvägspatogener förekommer också. Diagnostiken av dessa beskrivs närmare i Referensmetodik I 11, 1:a upplagan 2003. Beträffande diagnostiken av STI-agens, se under respektive organism. 174 I 6 – Speciell del –Laboratoriemetoder D.13. Herpes simplex Referensmetodik HSV-DNA –påvisning med realtids-PCR DNA-analys med PCR-teknik är en väl utvärderad metod såväl för mukokutan HSV som för HSV-infektioner i centrala nervsystemet, och analysen bestämmer HSV-typ direkt under körningen (1). Realtids-PCR bör numera betraktas som standard- och referensmetod för HSV-diagnostik avseende genital herpes på grund av sin robusta metodik, sin oöverträffade sensitivitet och höggradiga specificitet. Metoden ställer lägre krav på snabb och kyld transport jämfört med virusisolering, eftersom virus här ej behöver vara viabelt för analys. PCRdetektion av HSV utförs vid samtliga av landets virologiska laboratorier. Provtagningsmaterial och utförande HSV-DNA i blåssekret kan detekteras direkt med PCR utan föregående DNAextraktion, medan t.ex. vävnadsprover lämpligen extraheras före detektion. Kvantitativ PCR för HSV är en PCR-metod med hög sensitivitet där små mängder HSV-DNA kan detekteras utan korsreaktion med andra virus i herpesgruppen eller humant DNA (1). Ett TaqMan-instrument används för att logaritmiskt replikera (amplifiera) korta segment av genen för HSV-1 och HSV-2 glykoprotein B. Denna gen är väl konserverad, men innehåller även kortare typ-specifika sekvenser. Vid denna realtids-PCR med hjälp av s.k. TaqMan-teknik används primrar där reverseprimern är gemensam medan forwardprimers är typspecifika. Vidare används två korta probe-sekvenser som är typspecifika och inmärkta med olika fluorescensfärger. Om HSV-1 eller HSV-2 DNA 2 amplifieras kan respektive probe hybridisera (binda) och emittera (sända ut) fluorescens vars intensitet avspeglar PCR-reaktionens förlopp och vars färg avgör provets HSV-typ. Cykeltalet vid positiv reaktion (det s.k. CT-värdet) är omvänt proportionellt mot DNA-mängden i provet och kan därför användas för att beräkna HSV-DNAmängden i provet. I STI-diagnostisk praxis är sådan kvantifiering dock ej nödvändig i nuläget. Påvisande av HSV-DNA oavsett mängd leder till att provet besvaras positivt för aktuell HSV-typ. Som positivt kontrollmaterial används antingen HSV-infekterat cellmaterial, eller plasmider där genen för glykoprotein B är inklonad. Positiva kontroller i spädning skall köras vid varje analystillfälle för att säkerställa korrekt DNAamplifiering. 175 I 6 – Speciell del –Laboratoriemetoder Prestanda Specificiteten hos analysen är 100 %. Korsreaktion mellan HSV-1 och HSV-2 har inte noterats ens vid mycket höga viruskoncentrationer. Inte heller har korsreaktion med andra herpesvirus observerats. Sensitiviteten är högre än virusisolering: cirka 15-20 % av prover som är negativa vid virusisolering är positiva med realtids-PCR. Prestanda för varje körning kontrolleras och dokumenteras genom att Ct-värde för positivkontroller samt andel positiva prover i procent anges på kontrollista. I bilaga 8 ges ytterligare ett exempel på PCR-metod för diagnostik av HSV. Metoden används på avdelningen för virologi vid Smittskyddsinstitutet. Alternativa diagnostiska metoder Virusisolering (odling) Virusisolering, som tidigare var standardmetod, har fortfarande ett berättigande när man senare behöver ha tillgång till en virusstam, t.ex. vid resistensprövning eller vid patogenicitetsstudier. Det är vidare av vikt av epidemiologiska skäl att ha en virusbank för att följa evolutionära förändringar hos HSV. Isoleringsteknik Det insända provmaterialet slammas upp och inokuleras i vävnadskulturer med dokumenterat hög känslighet för ett spektrum av herpes-stammar tillhörande typ l och 2. Ett flertal känsliga cellinjer finns (2); vanligast i Sverige är GMK-AHl celler. Avläsningen av kulturerna sker dagligen med avseende på cytopatogen effekt. Fyndet skall säkerställas med hjälp av identifiering av herpes simplexantigen i celler (immunofluorescens) eller överskiktsvätska (vanligen ELISA) innan definitivt svar lämnas. Identifieringen kombineras lämpligen med typning med hjälp av specifika antikroppar eller PCR. En ständig övervakning av använda cellers känslighet är en god kvalitetskontrollerande åtgärd. Svarstid: 50-70 % av virusstammarna kan identifieras inom 1-2 dygn. Negativt svar ges som regel efter en vecka. Karakterisering av herpesstammar Typning är ofta av intresse t.ex. för att bedöma risk för kommande recidivfrekvens efter en primärinfektion: herpes typ l genitalt recidiverar mer sällan än typ 2. Vid vissa frågeställningar är typningen av största värde för bedömningen tex vid neonatal herpes; typ l har avsevärt bättre prognos än typ 2. Typning av herpesstammar har vidare epidemiologiskt intresse. 176 I 6 – Speciell del –Laboratoriemetoder Typning utförs på laboratorier som arbetar med isolering av herpesvirus i vävnadskulturer. Epidemiologiska samband, d.v.s. definierad smittoöverföring, kan inte fastställas genom genotypning eller sekvensering av HSV-amplifikat eller isolat. Ett hinder är förekomst av betydande sekvensvariabilitet inom varje patient. Resistensbestämning är aktuell främst vid behandling av immunsupprimerade patienter. Utförs i vävnadskultur eller med molekylärvirologisk teknik genom sekvensbestämning av identifierade regioner i genomet med PCR-teknik. Utförs rutinmässigt på Smittskyddsinstitutet samt klin. virologiska laboratoriet vid Sahlgrenska sjukhuset i Göteborg. Antigenpåvisning med immunofluorescens Immunofluorescensmetoden är vid sidan av PCR den snabbaste för påvisning av HSV-infektioner. Denna metodik används alltmer sällan i rutindiagnostik till förmån för PCR-metodik. Resultatet är mycket avhängigt av provtagningen. Mindre tillfredsställande provtagning leder till obedömbara preparat. Metodens känslighet ligger kring 80 % eller ännu lägre vid smärre genitala förändringar. En ganska stor provvolym utgör förutsättning för att tillräcklig erfarenhet att bedöma preparaten skall uppnås på laboratoriet. Stor risk för felbedömning föreligger vid bristande vana. En fördel med denna teknik är att man genom direktinspektionen får en uppfattning om det insända provets representativitet. En fortlöpande kontroll genom direktkontakt med klinisk virolog och möjlighet till kompletterande utredning med herpes virus-odling (isolering) i vävnadskultur är förutsättning för god kvalitet på undersökningen. Vid viktiga ställningstaganden bör alltid prov för virusisolering insändas samtidigt! Immunofluorescensteknik lämpar sig bäst för herpesdiagnostik från blåsa/sår under tidsperioden före krustabeläggning däremot ej från exempelvis cervix. Förutsättning för god träffsäkerhet är en noggrann provtagning som ger representativt material av basalceller från botten av färskast möjliga blåsa/sår utan tillblandning av slem (2). Provtagningen kräver därför viss vana och eftertanke. 177 I 6 – Speciell del –Laboratoriemetoder Färgning på laboratoriet. På laboratoriet färgas insända objektglas med intorkat provmaterial. Ett flertal monoklonaler och polyklonala sera av god kvalitet finns på marknaden. Direktkonjugerade reagens är att föredra eftersom bakgrundsfärgning utgör mindre problem och metoden blir mindre tidskrävande. En enda typisk fluorescerande cell räcker för positiv bedömning. Minst 50 negativa karakteristiska basalceller bör krävas för att ge ut ett negativt svar. Tidsåtgång för färgning (1/2-l tim), bedömningstid varierar beroende på preparatets kvalitet. Svar kan som regel ges inom 1 - 2 timmar efter det provet anlänt till laboratoriet. Serologisk undersökning Diagnosen primär infektion kan ställas med serologisk undersökning (analys av HSV specifik aktivitet av olika antikroppsklasser mot typ 1 - 2 gemensamma antigen eller typspecifika antigen). Antikroppssvar av klass IgG och IgM kan påvisas efter 7 - 10 dagar; IgM klingar av inom loppet av någon till några månader. IgG-aktivitet mot HSV kvarstår däremot sannolikt livslångt. Antikroppsstegring kan påvisas mellan akut (snarast möjligt efter insjuknandet) och konvalescensfas (2-3 veckor efter insjuknandet). Vid recidivinfektion däremot har patienten som regel en hög stationär HSV-IgG-aktivitet och antikroppsstegring kan ej påvisas. HSV-diagnosen vid en recidivinfektion måste därför baseras på viruspåvisning. Serologisk undersökning av prov taget samtidigt med blåsdebut är alltså ett utmärkt komplement till HSV-PCR och isolering om man vill fastställa om HSV-infektionen är av primär eller recidiverande natur. Analys av HSV-typspecifik IgG-aktivitet kan särskilja mellan infektion med HSV-1 eller HSV-2, och kan även ange samtidig HSV-1/HSV-2-infektion. Särskilt värdefull är serologi när man i lugnt skede saknar viruslesioner men behöver information om infekterande virustyp. Metoden användes exempelvis för att fastställa tidigare genomgången HSV-2-infektion hos individen, eller för att diagnostisera en primär HSV-2-infektion hos en patient som tidigare infekterats med HSV-1. Den typspecifika serologin är vidare användbar för prevalensstudier av såväl HSV-2 som HSV-1 (3). För patienten är serologisk diagnos av genital herpes viktig då det föreligger större recidivrisk vid genital HSV-2-infektion jämfört med vid infektion med HSV-1, samt större risk för överföring till fostret vid förlossning (neonatal herpes, se ref. 4). 178 I 6 – Speciell del –Laboratoriemetoder För båda virustyperna gäller att glykoprotein G (gG) som enda höljeprotein (av totalt elva stycken) från respektive virus inducerar typspecifika antikroppssvar och därför kan användas som antigen för serologiska analyser (5). Antigenen framställs vanligen med rekombinantteknik men kan också renas fram med lektinrening (gäller gG-2). Epitoperna hos gG-1 och gG-2 är kartlagda och har visats vara väl konserverade (6). Antikroppsanalyserna, som finns kommersiellt tillgängliga, eller som in-house test, utförs som regel med ELISA-teknik. Typspecifika test kräver mycket noggrann standardisering mot kända paneler. Svaren anges antigen som positivt eller negativt, men kan också anges som högsta positiva spädningstiter. Western blot-teknik utgör referensteknik för typspecifik antikroppsanalys. Typspecifika antikroppsanalyser avseende HSV finns tillgängliga på de flesta virologiska laboratorier. Laboratorierapportering Ej anmälningspliktig infektion. Hänvisningslaboratorium enligt gällande virologisk R-lista Smittskyddsinstitutet; 105 21 Stockholm (Maria Brytting) Virologiska laboratoriet, Guldhedsgatan 10, 413 46 Göteborg (Tomas Bergström). REFERENSER 1. Namvar L, Olofsson S, Bergström T, Lind M. Detection and typing of herpes simplex virus (HSV) in mucocutaneous samples by TaqMan PCR targeting a gB segment homologous for types 1 and 2. J Clin Microbiol 2005; 43:1-7. 2. Herpes Simplex Viruses. In Diagnostic Procedures for Viral, Rikettsiai and Chlamydial Infections. Eds. N J Schmidt and R W Emmonds. 6th edition, 265317, 1989. 3. Sexually transmitted infections. Eds. Dan Danielsson and Erik Lycke: Nahmias A J, Lee F K and Beckman-Nahmias S. Sero-epidemiological and sociological pattems of herpes simplex virus infection in the world. Scand J Infect Dis. Suppl 69:19-36, 1990. 4. Forsgren M. Genital herpes simplex virus infection and incidence of neonataldisease in Sweden.Scand J Infect Dis. Suppl 69: 37-41, 1990. 5. Bergström T, Trybala E. Antigenic differences between HSV-1 and HSV-2 glycoproteins and their importance for type-specific serology. Intervirology 1996;39:176-184. 179 I 6 – Speciell del –Laboratoriemetoder 6. Tunbäck P, Bergström T, Löwhagen G-B, Hoebeke J, Liljeqvist J-Å. Type-specific reactivity of anti-glycoprotein G antibodies from herpes simplex virus infected patients is maintained by single or dual type-specific residues. J Gen Virol 2005; 86:247-251. D.14. Humana papillomvirus Allmänt Klinisk diagnostik av HPV är baserad på påvisning av virus med molekylärbiologisk metodik. Referensmetod PCR med efterföljande typning genom hybridisering av PCR-amplimer till typspecifika prober får anses vara referensmetod idag. PCR-metodologi: Nukleotidsekvenser som är gemensamma för samtliga kända humana papillomvirus har identifierats i Ll-regionen. Oligonukleotider från dessa regioner kan användas som konsensus- eller generella primers för påvisande av alla genitala HPV -typer med hjälp av PCR. Denna strategi har fått stor spridning. De mest använda systemen är Manos primerpar MYll och MY09 inom L1-regionen som genererar ett 448bp stort fragment (1) samt de generella primers som utvecklats i Amsterdam - GP5/GP6 (2). Oligonukleotidsekvenserna är här bättre konserverade och amplimeren är endast 140bp. Flera kommersiella system är baserade på liknande princip. Alternativa diagnostiska metoder Hybridisering till HPV-typspecifika prober utan föregående amplifiering är ett vanligt och av FDA godkänt test, med väl dokumenetrad klinisk användbarhet men något sämre sensitivitet än PCR. Påvisning av HPV mRNA är ett sätt att mäta transkriptionell aktivitet, vilket troligen innebär ökad progressionsrisk. Realtids PCR för att mäta virusmängd har också visats innebära ökad progressionsrisk. "Hybrid capture ": Den kommersiella "Hybrid capture"-metodiken är en direkt hybridisering till typ-specifika prober. Den har hög specificitet, ett enkelt förfaringssätt samt förmågan att utföra reaktionen med orena kliniska prov. Denna metod har varit i kliniskt bruk i många år över hela världen. (3) 180 I 6 – Speciell del –Laboratoriemetoder Typning Amplimererna kan fungera som "template" vid hybridisering med typspecifika prober. Proberna kan antingen var fixerade på membran (reverse line blot eller ”linear array”), på fluroescenta kulor där hybridisering på visas med Luminexteknik (4),eller på s.k. mikrochip. High-through-put teknik baserad på massspektrometri är också beskriven (5). Laboratorierapportering Ej anmälningspliktig infektion. Referenslaboratorium WHO global reference labrotory for HPV diagnosis, UMAS, Malmö (Joakim Dillner) REFERENSER 1. Manos MM, Ting Y, Wright DK, Lewis Al, Broker JR, Wolinsky SM. Use of polymerase chain reaction amplification for the detection of genital human papillomavirus. Cancer Cells 1989; 7:209-214. 2. Snijders PJF, van den Brule AJF, Schrijnemakers HJF, Snow G, Meijer OLM, Walboomers JMM. The use of general primers in the polymerase chain reaction permits the detection of a broad spectrum of human papillomavirus genotypes. J Gen Virol 1990; 71:173-181. 3. Wahlström, C., Iftner, T., Dillner, J. and Dillner L. for the Swedescreen study group. Population-based study of screening test performance indices of three Human Papillomavirus DNA tests. Journal of Medical Virology. 79. 1169-1175. 2007 . 4. Schmitt M, Bravo IG, Snijders PJ, Gissmann L, Pawlita M, Waterboer T.Beadbased multiplex genotyping of human papillomaviruses. J Clin Microbiol. 2006 Feb;44(2):504-12. 5. Söderlund-Strand, A., Dillner, J., Carlson, J. High-through put genotyping of oncogenic human papilloma viruses with MALDI-TOF mass spectrometry. Clinical Chemistry. 54. 86-92. 2008. 181 I 6 – Speciell del –Laboratoriemetoder D.15. Molluscum contagiosumvirus Referensmetod MOCV har en karaktäristisk ultrastrukturell morfologi som kan ses vid negativ kontrastering och elektronmikroskopi. Typisk morfologi för MOCV är rektangulära partiklar med starkt rundade hörn, i form mellan orto- och parapoxvirus. Alternativa metoder PCR-metoder finns publicerade men använts inte rutinmässigt i Sverige. Epidemiologisk typning Typning av MOCV utförs ej då ingen skillnad i klinisk betydelse visats mellan de olika genotyperna. Laboratorierapportering Ej anmälningspliktig infektion. D.16. Hepatit B Allmänt Man kan i perifert blod påvisa flera HBV-specifika antigen och antikroppar. Hepatit B-DNA kan också påvisas i serum/plasma. Det typiska förloppet och sambanden mellan olika antigen och antikroppar vid akut hepatit B framgår i tabell 1 i allmän och klinisk del. Några veckor efter smittotillfället ses långsamt stigande HBV DNA-nivåer i blod vilket kan påvisas med PCR. Diagnostiska metoder Serologi Ett antal EIA-tester finns kommersiellt tillgängliga. HBsAg uppträder i serum upp till ca 6 veckor före det kliniska insjuknandet och försvinner vanligen 6 veckor efter detta. Antikroppar mot core (den innersta delen av viruspartikeln, anti-HBc) uppträder under inkubationsfasens andra del och kan ofta ha nått maximala titrar redan vid det kliniska insjuknandet. Påvisande av anti-HBc av IgM-typ är av stor betydelse för diagnostiken akut hepatit B och bör göras i alla fall av tidigare inte känd HBsAg positivitet. När infektionen läkt kan anti-HBs, dvs antikroppar mot virushöljet påvisas i de flesta fall, men först flera veckor efter det att HBsAg försvunnit. Oftast är då anti-HBc IgM fortfarande påvisbart. HBeAg kan påvisas kort efter HBsAg och är i regel uttryck för höga virusnivåer. HBeAg anses ha betydelse för immuntolerans och höga virusnivåer. 182 I 6 – Speciell del –Laboratoriemetoder HBeAg ersätts så småningom i blodet av motsvarande antikropp anti-HBe vilket brukar innebära att virusnivåerna sjunker. De markörer som rutinmässigt bör följas vid akut hepatit B är HBsAg och HBeAg. HBeAg kan användas som prognostisk markör. Om detta antigen snabbt försvinner är prognosen god. Om emellertid HBeAg kvarstår längre än 8 veckor, blir utläkningen långsam och risken för utveckling av kronisk hepatit stor. Personer positiva för HBsAg upptäcks oftast i andra sammanhang än vid akut hepatit, t ex vid blodgivarscreening, hälsoundersökning av t.ex invandrare eller gravida. Vid ett dylikt positivt fynd blir den primära frågeställningen om patienten har en akut hepatit under utveckling eller om personen är kronisk bärare. Oftast kan detta lösas med anti-HBc-IgM test men någon gång kan upprepad provtagning behöva göras. Två typer av kroniska bärare kan diagnostiseras med bestämning av HBeAg/anti-HBe. Frekvens och typ av bärarskap skiljer sig i olika delar av världen, vilket har praktisk betydelse för bedömning av smittsamhet. Patient med HBeAg har HBV DNA i blodet och är mycket smittsam i blod och sekret. Samma patient har ofta biokemiska tecken på kronisk hepatit med transferasstegringar och leverbiopsi visar kronisk hepatit. Biopsin avslöjar dels graden och naturen av inflammation men därutöver fibrosstadium, dvs om cirrhos håller på att utvecklas. Fortsatt provtagning för kontroll motiveras av att man ibland efter flera år ser antingen en partiell utläkning med övergång till anti-HBe med fortsatt bärarskap av HBsAg, medan fullständig, sen utläkning med samtidig förlust av HBeAg och HBsAg är ovanligt. Anti-HBe ansågs länge som ett klart tecken på låggradig smittsamhet hos HBsAg bärare men detta synsätt har nu modifierats när varianter av HBV med mutation i den delen av genomet (pre-core- eller core promotor) som styr produktion av HBeAg har upptäckts hos vissa individer. Dessa mutationer leder till att HBeAg - produktionen upphör, och att anti-HBe bildas, trots att det föreligger höggradig virusreplikation. En misstanke på att mutation föreligger kan man få om patienten har anti-HBe men förhöjt ALAT (alaninaminitransferas, ett cytoplasmatiskt leverenzym). Nukleinsyrabaserade metoder HBV DNA kvantifiering är numera en rutinmetod för bedömning av smittsamhet och utförs på regionala viruslaboratorier. Sekvensering av PCRprodukter används för att avslöja pre-core /core-promotormutationer. Andra applikationer för DNA tekniken är analys av resistens mot en rad antivirala medel exempelvis Lamuvidin (YMDDmutationer) samt vid sekvensering av HBV´s hölje och coregener för molekylär epidemiologi att användas vid smittspårning i situationer där smittkedjorna är osäkra. 183 I 6 – Speciell del –Laboratoriemetoder Genotypning Det finns två olika typningssystem för hepatit B. Det urspungliga systemet som hänförde virus till subtyperna ad/ay med suffixen w och r baserades på antikroppsbaserad metodik. Senare kunde de olika typerna direkt påvisas genom vissa aminosyror i S genen som kodar för HBsAg. Dessa fastställs enklast med DNA sekvensering och translation till motsvarande aminosyror. Det andra systemet är baserat på sekvensering varvid humana HBV stammar indelas i 8 genotyper A-H, vilka inbördes är uppdelade i subgenotyper. Det finns en viss men ingalunda fullständig överensstämmelse mellan genotyp/subgenotyp å ena sidan och klassiska subtyper å andra. Genotypning vinner nu viss klinisk användning som prognostisk markör vid antiviral behandling och för smittspårning. Svarsrutiner Resultat av serologisk analays rapporteras tillsammans med resultat av verifierande test och tolkning av resultatet. Svar på nukleinsyrabaserad test anges som förekomst/ej förekomst av HBV–nukleinsyra eventuellt med angivande av nivåer och i övrigt anpassad till andra utförda analyser (t ex påvisande av resistensgener). Laboratorierapportering Hepatit B-infektion är anmälningspliktig enligt smittskyddslagen. Hänvisningslaboratorium enligt gällande virologisk R-lista Smittskyddsinstitutet; 105 21 Stockholm (Heléne Norder). Virologiska laboratoriet, Guldhedsgatan 10, 413 46 Göteborg (Magnus Lind). REFERENSER 1. Norder H, Couroucé AM, Coursaget P, Echevarria JM, Lee SD, Mushahwar IK, Robertson BH, Locarnini S, Magnius LO. Genetic diversity of hepatitis B virus strains derived worldwide: genotypes, subgenotypes, and HBsAg subtypes. Intervirology. 47:289-309, 2004. 2. Hollinger FB. Hepatitis B virus genetic diversity and its impact on diagnostic assays. J Viral Hepat. Suppl 1:11-5. 2007 184 I 6 – Speciell del –Laboratoriemetoder D.17. Hepatit C Diagnostiska metoder Serologi Diagnostiken av HCV baseras på påvisande av antikroppar i serum mot rekombinanta virusproteiner med kommersiella tester. De rekombinanta proteinerna avspeglar 3-4 olika områden på virus (core, proteas/helikas, membranförankrande protein och RNA-polymeras). Vid upprepad reaktion i screeningtest blir nästa steg oftast att konfirmera antikropparna i ett oberoende teknikformat – oftast immunoblot/RIBA. Vid oberoende antikroppsreaktivitet mot 2 eller fler HCV proteiner anses därmed antikroppsnärvaron vara bekräftad – cirka 80 % av sådana patienter är viremiska. Förhöjt ALAT (alaninaminitransferas, ett cytoplasmatiskt leverenzym) kan peka på viremi, men viremi kan förekomma även vid normalt ALAT. Nukleinsyrabaserade metoder HCV viremi påvisas via förekomst av HCV-RNA i blodet med någon PCR test. Sådana tester är numera kvantitativa med realtids-PCR-teknik. Vissa laboratorier väljer att från det positiva screeningresultatet göra immunoblot, andra väljer PCR direkt på det prov som passerat analysroboten. Det finns för och nackdelar med båda förfaringssätten och det är viktigt att man beaktar både överföringsrisker i instrumentet och snabb tillgänglighet av svaret. Under den ca 2 månader långa inkubationstiden fram till det att antikropparna dyker upp är det bara PCR som kan ge svar om smitta. När antikropparna börjar stiga är de första ofta riktade endast mot ett protein som proteas/helikas eller core varför immunoblot kan bli indeterminant på det första akutfas-positiva provet. Man löser detta med att dels utföra av RNA-test och samtidigt beställa ny antikroppsbestämning om en månad. Genotypning Hepatit C genotypning har blivit en viktig metod för att förutsäga hur antiviral behandling skall bedrivas för den enskilda patienten. Genotypning utförs som en modifikation av vanlig PCR med hybridisering eller sekvensering. I smittkedjor behåller virus genotyp och subtyp. Analys av olika virusgener kan sedan användas för att kartlägga en smittkedja. Om smittan ligger nära i tiden används ofta den snabbt muterande hypervariabla regionen (HVR) av höljeproteinet E2, medan man vid analys av smitta som ligger längre tillbaka i tiden ofta använder den långsamt muterande virala polymerasgenen kallad NS5B. Svarsrutiner Resultat av serologisk analays rapporteras tillsammans med resultat av 185 I 6 – Speciell del –Laboratoriemetoder verifierande test och tolkning av resultatet. Svar på nukleinsyrabaserad test anges som förekomst/ej förekomst av HCV RNA med angivande av nivåer. Laboratorierapportering Hepatit C-infektion är anmälningspliktig enligt smittskyddslagen. Hänvisningslaboratorium enligt gällande virologisk R-lista Smittskyddsinstitutet; 105 21 Stockholm (Heléne Norder). Karolinska Universitetssjukhuset (Johan Lennerstrand), 141 86 Huddinge. Karolinska instutet, Institutionen för laboratoriemedicin (Matti Sällberg), 171 77 Stockholm. REFERENSER 1. Liang SL. An overview of current practice in hepatitis C testing. MLO Med Lab Obs. 40:14-16, 18-19; 2008 D.18. HIV Diagnostiska metoder Serologi Den vanligaste och mest kostnadseffektiva principen för diagnostik av HIV-1eller HIV-2-infektion är påvisande av antikroppar i serum eller plasma med sållningstestning baserad på EIA-teknik (1-4). Ett negativt testutfall har ett mycket högt prediktivt värde. Numera rekommenderas s.k. 4:e generations EIAtester som även påvisar HIV p24 antigen (s.k. kombotester) eftersom dessa tester förkortar den diagnostiska fönsterperioden utan att förlora sensitivitet eller specificitet för antikroppsdetektion (4). För att öka den diagnostiska säkerheten innehåller moderna HIV EIA-tester dessutom peptider för ovanliga HIVvarianter (HIV-1 grupp O och HIV-2). Ett positivt resultat i HIVsållningstestning ska bekräftas med konfirmerande testning (Western blot eller annan immunoblot), som endast bör utföras på laboratorier med särskild erfarenhet av denna typ av diagnostik. Det finns ett mycket stort antal kommersiella HIV-tester. Val av testmetod för laboratorier som utför sållningstestning och konfirmering bör ske efter samråd med ett regionalt viruslaboratorium eller SMI, vilka har tillgång till aktuella resultat av utvärderingar av olika kommersiella HIV-test. På grund av den 186 I 6 – Speciell del –Laboratoriemetoder snabba utvecklingen av dessa tester är det inte meningsfullt att anvisa referensmetodik. Snabbtester Många snabbtester för HIV-1/HIV-2 finns också kommersiellt tillgängliga. Deras kvalitet varierar, men vissa har förhållandevis hög specificitet och sensitivitet. Emellertid saknas ännu snabbtester som samtidigt detekterar HIV antikroppar och HIV p24 antigen, varför snabbtester bör användas med stor restriktivitet och endast inom sjukvården. Resultaten bör omgående verifieras med konventionella sållningstester. Nukleinsyrabaserad diagnostik och HIV p24 antigentest Viruspåvisning kan ske med nukleinsyrabaserade tester (HIV DNA PCR, HIV RNA PCR) och med HIV p24 antigentest. HIV isolering betraktas inte längre som referensmetodik, men kan användas i specialfall. Viruspåvisning är indicerad vid misstanke om primär HIV infektion och vid uppföljning av barn som fötts av HIV-infekterade kvinnor (www.rav.nu). Med dessa tester kan ofta HIV- infektion påvisas inom två veckor efter infektion. För HIV RNA och HIV p24 antigen påvisning används kommersiella tester, för HIV DNA PCR används ”in-house” tester. Viruspåvisning bör endast utföras på laboratorier med särskild erfarenhet av denna typ av diagnostik. På grund av den snabba utvecklingen av dessa tester är det inte meningsfullt att anvisa referensmetodik. Nukleinsyrebaserade analyser används även vid uppföljning och utredning vid redan diagnostiserad HIV-infektion. Kvantifiering av HIV RNA i plasma används för att följa sjukdomsaktivitet och behandlingseffekt. Genotypisk HIV resistenstest används inför behandling och vid behandlingssvikt. Molekylära typningar används för att i epidemiologiskt syfte bestämma genetisk subtyp och kartlägga smittvägar. Laboratoriekriterier för diagnos av HIV-infektion Diagnosen kräver positivt resultat med två olika metoder och måste bekräftas med uppföljande testning på ett nytt prov. 187 I 6 – Speciell del –Laboratoriemetoder För HIV-diagnos gäller: A. Vuxna och barn >18 månaders ålder: Positiv HIV-antikroppstest, inklusive konfirmerande test, som bekräftats genom uppföljande prov eller Minst två av följande fynd, som bekräftats genom uppföljande prov: Påvisande av HIV-RNA Påvisande av HIV-DNA Påvisande av HIV p24 antigen, inkl. neutralisationstest HIV isolering B. Barn under 18 månaders ålder: Minst två av följande fynd, som bekräftats genom uppföljande prov: Påvisande av HIV-RNA Påvisande av HIV-DNA Påvisande av HIV p24 antigen, inkl. neutralisationstest HIV isolering Laboratorierapportering Det laboratorium som primärt handhaft provet skall, efter utförd konfirmering, via SmiNet rapportera positivt testresultat för varje icke tidigare rapporterad individ till Epidemiologiska enheten, Smittskyddsinstitutet samt till Smittskyddsläkaren i respektive län. Hänvisningslaboratorium enligt gällande virologisk R-lista Smittskyddsinstitutet, Avdelningen för Virologi (Sören Andersson och Jan Albert), 171 82 Solna. Karolinska Universitetssjukhuset (Anders Sönnerborg), 141 86 Huddinge. REFERENSER 1. Andersson S, Åsjö B, Jenum PA, Manner I, Njolstad G, Ragnhildstveit E, Skaug K, Söderquist B, von Sydow M. Relevance of a combined HIV antigen/antibody assay to detect early HIV infections in a low prevalence population: case reports. Clin Lab 2004;50:409-13. 2. Weber B. Screening of HIV infection: role of molecular and immunological assays. Expert Rev Mol Diagn. 2006;6:399-411. 3. Ly TD, Ebel A, Faucher V, Fihman V, Laperche S. Could the new HIV combined p24 antigen and antibody assays replace p24 antigen specific assays? J Virol Methods 2007;143:86-94. 188 I 6 – Speciell del –Laboratoriemetoder D.19. HTLV Allmänt Den vanligaste och mest kostnadseffektiva principen för diagnostik av HTLV-1eller HTLV-2-infektion är påvisande av antikroppar i serum eller plasma med sållningstestning baserad på enzymimmunologisk metodik (EIA, 1-2). Ett negativt testutfall har ett mycket högt prediktivt värde. Ett positivt resultat i HIV-sållningstestning ska bekräftas med konfirmerande testning (Western blot eller annan immunoblot). Diagnostiska metoder Serologi Antalet kommersiellt tillgängliga tester för antikroppsdiagnostik av HTLV är begränsat. Val av testmetod för laboratorier som utför sållningstestning bör ske efter samråd med ett regionalt viruslaboratorium eller SMI, vilka har tillgång till aktuella resultat av utvärderingar av olika kommersiella HTLV-test. Konfirmering av HTLV-infektion bör för närvarande bara ske på regionalt viruslaboratorium eller SMI pga det begränsade antalet prover. Snabbtester för HTLV finns inte tillgängliga. Nukleinsyrabaserad diagnostik Nukleinsyrabaserad diagnostik av HTLV har för närvarande begränsat värde i den diagnostiska rutinen. I speciella fall där serologiska metoder inte ger konklusivt resultat kan t ex PCR vara av värde. Detta gäller också vid diagnostik av barn till HTLV-infekterade mödrar där maternella antikroppar kan kvarstå i ca 18 månader. Några kommersiella tester (PCR etc) finns inte utan man är hänvisad till s k ”in house”-metodik. Laboratoriekriterier för diagnos av HTLV-infektion Diagnosen kräver positivt resultat med två olika metoder och måste bekräftas med uppföljande testning på ett nytt prov. 189 I 6 – Speciell del –Laboratoriemetoder För HTLV-diagnos gäller: A. Vuxna och barn över 18 månaders ålder I första hand ställs diagnosen genom påvisande av HTLV-specifika antikroppar. Ett positivt resultat i en HTLV-antikroppstest (EIA) bekräftas med en annan konfirmerande HTLV-antikroppstest (Western blot, Inno-LIA etc). Även typning av HTLV-1 resp HTLV-2 utförs i första hand med antikroppsanalyser. På SMI används kommersiella serologiska tester och de av tillverkaren rekommenderade kriterierna följs. I speciella fall utförs även påvisande av HTLV-nukleinsyra (DNAPCR). Slutlig diagnos ska då även stödjas av antikroppsanalyser. B. Barn under 18 månaders ålder Påvisande av HTLV-nukleinsyra (DNA-PCR). Vid 18 månaders ålder ska ett HTLV-antikroppstest göras för att slutgiltigt bekräfta eller utesluta diagnosen. Laboratorierapportering Det laboratorium som primärt handhaft provet skall, efter utförd konfirmering, via SmiNet rapportera positivt testresultat för varje icke tidigare rapporterad individ till Epidemiologiska enheten, Smittskyddsinstitutet samt till Smittskyddsläkaren i resp län. Hänvisningslaboratorium enligt gällande virologisk R-lista Smittskyddsinstitutet, Avdelningen för Virologi (Sören Andersson och Jan Albert), 171 82 Solna. REFERENSER 1. Thorstensson R, Albert J, Andersson S. Strategies for diagnosis of HTLV-1 and –II. Tranfusion 2002;42:780-91. 2. Andersson S, Thorstensson R, Godoy Ramirez K, Krook A, von Sydow M, Dias F, Biberfeld G. Comparative evaluation of 14 immunoassays for detection of antibodies to the human T-cell lymphotropic virus types I and II (HTLV-I/II) using panels of sera from Sweden and West Africa. Transfusion 1999;39:845-51. 190 I 6 – Speciell del –Laboratoriemetoder D.20. Trichomonas vaginalis Allmänt Kliniska tecken är ofta diagnostiskt otillförlitliga. Detsamma gäller direktmikroskopi av våtpreparat som har endast måttlig känslighet. Odling av sekret från vagina eller uretra hos män är referensmetod för påvisande av organismen. I odling av manligt uretrasekret kan parasiten diagnostiseras i ca 80 % av fallen. Resterande fall kan detekteras med odling av urinsediment, speciellt efter prostatamassage. Referensmetod Odling Referenssubstrat: Flera olika odlingsmedier finns angivna i litteraturen. Diamonds medium modifierat enligt Fouts och Kraus med netilmicin istället för streptomycin rekommenderas som referensmedium. Eftersom trikomonader växer bäst under anaeroba förhållanden rekommenderas tillsats av agar för att reducera O2-diffusion (recept, bilaga 7). Isolering: Odlingsmediet rumstempereras före inokulering. Rören inkuberas vid 37 0C upp till 7 dagar. På dag 2, 3, 6 och 7 tas en droppe av bottensedimentet till mikroskopi med samma teknik som för våtpreparat (bilaga 7). Med Diamonds medium kan < 10 T. vaginalis-organismer/prov detekteras. Observera att odlingen måste läsas av angivna dagar eftersom T. vaginalis kan dö snabbt och endast rörliga organismer kan påvisas vid mikroskopi. Alternativa diagnostiska metoder Nukleinsyrabaserade metoder PCR detektion har visat hög specificitet och sensitivitet men utförs inte rutinmässigt i Sverige (1). Serologi Antikroppsdetektering har hittills endast utförts som forskning. Standardiserade metoder saknas liksom utvärdering av den kliniska betydelsen av undersökningen. Antigendetektion Metoderna, däribland immunkromatografi, används sällan. En immunkromatografisk test (OSOM TV Rapid Test, Genzyme Diagnostics) har visats ha en sensitivitet på 83 % och specificitet på 98,8 % jämfört med odling av vaginalsekret (2). 191 I 6 – Speciell del –Laboratoriemetoder Resistensbestämning Rutinmässig resistensbestämning utförs inte i Sverige. Epidemiologisk typning Görs inte i Sverige Kvalitetskontroll Kontrollstammar saknas Svarsrutiner Odlingsresultatet besvaras med Trichomonas vaginalis påvisats/ej påvisats. Laboratorierapportering Trikomonasinfektion är inte anmälningspliktig enligt smittskyddslagen. REFERENSER 1. Radonjic I V et al. Diagnosis of Trichomonas vaginalis infection: The sensitivities and specificities of microscopy, culture and PCR assay. Eur J Obstet Gynecol Reprod Biol 2006; 126:116-120. 2. Huppert, JS., Byron E., Batteiger P et al Use of an Immunochromatographic Assay for Rapid Detection of Trichomonas vaginalis in Vaginal Specimens. J Clin Microbiol. 2005;43: 684–687. 3. Mayta H et al. 18S Ribosomal DNA-Based PCR for Diagnosis of Trichomonas vaginalis. J Clin Microbiol. 2000; 38: 2683-26 D.21. Candida Allmänt Vid mer kroniska besvär är ofta förändringar i vagina så små att det kan vara svårt att finna hyfer vid direktmikroskopi på utstryk. Om det föreligger en klar inflammation i vulva kan man i stället odla från vaginalsekret eller ta px som antingen skickas till ett kliniskt mikrobiologiskt laboratorium eller för cytodiagnostik (väsentligt att på remissen fråga efter jästsvamp eftersom särskilda färgningstekniker används) ref läkemedelsverket (Läkemedelsverket;Vulvovaginit, 2000:(11)5. Majoriteten av Candida-kolpiter orsakas av stammar känsliga för de vanligen använda azolpreparaten. C. glabrata och C. krusei, har dock naturligt nedsatt känslighet för flukonazol, som används i ökande omfattning. Vid terapiresistent Candida-kolpit är det därför befogat med svampodling inkl. artbestämning, och i vissa fall resistensbestämning för de azoler som kommer i fråga för generell 192 I 6 – Speciell del –Laboratoriemetoder behandling (I. Infektionsdiagnostik, I 10. Svampinfektioner, 2:a reviderade upplagan anpassad för elektronisk tillgänglighet). För primär odling kan med fördel Chromagar användas. Chromagar ger möjlighet att dels lättare kunna påvisa blandinfektion med olika candidaarter samt att direkt kunna påvisa C. albicans. I övrigt när det gäller odlingsdiagnostik hänvisas till: (Infektionsdiagnostik, I 10. Svampinfektioner, 2:a reviderade upplagan anpassad för elektronisk tillgänglighet) samt till NRMM:s hemsida se länk på http://www.srga.org. 193 I 6 – Speciell del –Laboratoriemetoder 194 I 6 Bilagor BILAGOR 195 I 6 Bilagor 196 I 6 Bilagor BILAGA 1 Substrat för odlingsdiagnostik av Neisseria gonorrhoeae 197 I 6 Bilagor 198 I 6 Bilagor 1. Transportmedium för odlingsdiagnostik av N. gonorrhoeae 1. 2. Okolad provtagningspinne (exempelvis rayonarmerad aluminiumpinne (CP116C) för uretra och konjunktiva; och rayonarmerad plastpinne (CP114C) för cervix, rektum, vagina och farynx). Alternativt kan motsvarande kolade provtagningspinnar användas. Amies kolade transportmedium (Copan, Brescia, Italien). Alternativt: Amies okolade transportmedium (Copan, Brescia, Italien) om kolade provtagningspinnen (se ovan) användes. 2. Fasta odlingssubstrat för isolering av N. gonorrhoeae 2.A. Icke-selektivt odlingsmedium för N. gonorrhoeae Användningsområde Näringsrikt medium för isolering av näringskrävande bakterier, speciellt patogena Neisseria (gonokocker och meningokocker) och Haemophilus species, från kliniska prov. Antibiotikaresistensundersökning av gonokocker om hästserum ej inkluderas i mediumet. Princip GC-agar baserat medium som ytterligare näringsberikas med hemoglobin (från nötblod), hästserum och Isovitalex Enrichment. GC-agarbas utnyttjar som många andra blod-agarbaser kaseinhydrolysat och köttextrakt (peptoner) som kväve-, vitamin-, aminosyra- och kolhydratkälla. Kornstärkelse neutraliserar toxiska fettsyror och toxiska metaboliter. Reducerad agarmängd och fosfatbuffring bidrar till bättre och snabbare växt av framförallt gonokocker. Natriumklorid bibehåller osmotiska balansen. Hemoglobin tillför mediet bland annat X-faktor (hemin) som krävs för tillväxt av vissa mer krävande GCstammar. Hästserumtillsats neutraliserar ev. variation av GC-agarbasen. IsoVitaleX tillför V-faktor (nicotinamide adenine dinucleotide, NAD), en förutsättning för växt av H. influenzae, men som tillsammans med extra vitaminer, aminosyror, coenzym, glukos, järnjoner, mm. också ökar tillväxten av patogena Neisseria. 199 I 6 Bilagor Icke-selektivt odlingsmedium för N. gonorrhoeae (deklaration per liter) Difco GC Medium Base (Becton, Dickinson and Company (BD))* Reverse osmosis (RO)-vatten BBL Hemoglobin Powder; Bovine, Freeze-dried (BD) Hästserum (inaktiverat; Statens veterinärmedicinska anstalt (SVA)) BBL IsoVitaleX Enrichment (BD)** * Proteose Peptone No. 3 Corn Starch Dipotassium phosphate Monopotassium phosphate Sodium chloride Agar ** Vitamin B12 L-Glutamine Adenine Guanine hydrochloride p-aminobenzoic acid Nicotinamide adenine dinucleotide (NAD) Thiamine pyrophosphate Ferric nitrate Thiamine hydrochloride L-Cysteine hydrochloride L-Cysteine Dextrose (Glucose) 36,0 g 900 mL 10,0 g 100 mL 10 mL 15,0 g 1,0 g 4,0 g 1,0 g 5,0 g 10,0 g 0,1 mg 100 mg 10 mg 0,3 mg 0,13 mg 2,5 mg 1,0 mg 0,2 mg 0,03 mg 259 mg 11 mg 1000 mg pH 7,2±0,2 vid 25 °C Dispensering: 20 mL per 9 cm petriskål. Hållbarhet: 2 veckor, 4 veckor i plastad vagn och 8 veckor i sluten plastpåse vid +2-8 ºC. Rekommenderad kontrollstam Tillväxtskontroll: N. gonorrhoeae CCUG 10130 (långsamt växande). 2.B. Selektivt odlingsmedium för N. gonorrhoeae (Modifierat ThayerMartin medium, MTM) Användningsområde Näringsberikat medium för selektiv isolering av patogena Neisseria (gonokocker och meningokocker) från kliniska prov. 200 I 6 Bilagor Princip Selektiva odlingsmediumet för patogena Neisseria (modifierat Thayer-Martin medium (MTM)) motsvarar icke-selektiva mediumet (se ovan) med tillsats av VCNT Inhibitor. Denna innehåller vankomycin (hämmar grampositiva bakterier), kolistin (hämmar andra gramnegativa bakterier inkluderande apatogena Neisseria tillhörande normalfloran), nystatin (hämmar svamp) samt trimetoprim (hämmar gramnegativa bakterier inkl. Proteus). Selektivt odlingsmedium för N. gonorrhoeae (deklaration per liter) Difco GC Medium Base (BD)* Reverse osmosis (RO)-vatten BBL Hemoglobin Powder; Bovine, Freeze-dried (BD) Hästserum (inaktiverat; SVA) BBL IsoVitaleX Enrichment (BD)* BBL V-C-N-T Inhibitor (BD)** * Se icke-selektivt odlingsmedium ovan för deklaration ** Vankomycin Kolistin Nystatin Trimetoprimlaktat 36,0 g 900 mL 10,0 g 100 mL 10 mL 10,0 mL 3,0 mg 7,5 mg 12 500 enheter 5,0 mg pH 7,2±0,2 vid 25 °C Dispensering: 20 mL per 9 cm petriskål. Hållbarhet: 4 veckor i sluten plastpåse vid +2-8 ºC. Kommentar: N. lactamica (kolistinresistent), och vissa stammar av N. subflava, N. cinerea, M. catarrhalis, K. denitrificans samt vankomycinresistenta Staphylococcus epidermidis, kan även växa. Enstaka gonokockstammar kan hämmas av inkluderade koncentrationer av vankomycin eller trimetoprim. Detta problem är försumbart i flesta geografiska områden, inklusive Sverige, och framförallt om både selektivt och icke-selektivt odlingssubstrat användes för flera av provtyperna. Rekommenderade kontrollstammar Tillväxtskontroll: N. gonorrhoeae CCUG 10130 (långsamt växande) alternativt N. gonorrhoeae CCUG 33979. Inhibitionskontroll: S. aureus ATCC 29213 (eventuellt även E. coli, N. sicca och C. albicans). 201 I 6 Bilagor 3. Fast substrat för tillväxtberoende biokemisk (kolhydratnedbrytning) specieskonfirmering av patogena Neisseria Användningsområde Medium för specieskonfirmering inom Neisseria genus. N. gonorrhoeae bryter ej ner maltos eller fruktos utan endast glukos, vilket resulterar i bildandet av sura nedbrytningsprodukter, sänkt pH, och således färgomslag i plattan innehållande glukos. Fenolrött ingår i mediumet som pH-indikator. Likvärdig tillväxt-oberoende snabbmetod för specieskonfirmering finns. Basagar (deklaration per liter) Starch (Merck) Sodium alginate (BDH) K2HPO4 (Merck) NaCl (Riedel de Haen) Agar No 2 (Lab M) Bacto Peptone (BD) Lösning av: Fenolrött (BDH) 0,5 % och NaOH 1 M (Bie & Berntsen A-S) 2 % Lösning av: Hemin crystalline (bovine) (USB) 0,05 % och NaOH 1 M (Bie & Berntsen A-S) 1 % L-Histidine hydrochloride (SIGMA)-lösning 0,02 % Triethanolamine (Merck)-lösning 10 % RO-vatten 1,0 g 1,6 g 4,0 g 5,0 g 14,0 g 15,0 g 10,0 mL 4,0 mL 10,0 mL 0,8 mL 1000 mL pH 7,8±0,1 vid 25 °C (pH=8,1 innan sterilisering) GC kolhydratnedbrytningsplattor (deklaration per liter) Basagar enligt ovan Jästextrakt* Lösning av: L-Glutamine (Merck) 2,5 % och β-NAD (SIGMA) 0,1 % L-Cysteine hydrochloride H2O (BDH)-lösning 1,58 % Humanserum (inaktiverat) Kolhydratlösning (Dextrose, Fruktose eller Maltose; J.T. Baker) 20 % * Bacto Yeast Extract (BD) Thiamine hydrochloride (SIGMA) 202 1000 mL 100,0 mL 2,0 mL 3,5 mL 100,0 mL 60,0 mL 10 g 2,0 mg I 6 Bilagor Choline chloride (SIGMA) Sodium D-pantothenate (SIGMA) Myo-Inositol (Merck) Thiamine pyrophosphate chloride (ICN) L-cystine (SIGMA) HCl 1 M (Bie & Berntsen A-S) 1,4 mg 2,0 mg 0,36 mg 0,46 mg 36 mg 3,0 mL Enligt ovan framställes en omgång av plattor innehållande glukos, maltos respektive fruktos. pH=7,8±0,1 vid 25 ºC Dispensering: 20 mL per 9 cm petriskål. Hållbarhet: 3 månader i sluten plastpåse vid +2-8 ºC. Rekommenderade kontrollstammar Funktionskontroll vid ny batch samt vid varje analystillfälle: N. gonorrhoeae CCUG 33979, N. lactamica CCUG 5853 (alternativt N. meningitidis CCUG 3269), N. sicca CCUG 34456 och M. catarrhalis CCUG 34455. 4. Immunologiska eller antigena metoder för specieskonfirmering av N. gonorrhoeae Användningsområde Den kommersiella metoden Phadebact Monoclonal GC Test (Bactus AB) för påvisning av antigen baseras på coagglutination med specifika monoklonala antikroppar riktade mot PorB hos gonokocker. Metoden har mycket hög sensitivitet och specificitet om strikt följsamhet till tillverkarens anvisningar praktiseras. Rekommenderade kontrollstammar Funktionskontroll vid ny batch och därefter en gång per månad: N. gonorrhoeae CCUG 33978 (serogrupp WI [PorB1a]) och N. gonorrhoeae CCUG 33979 (serogrupp WII/III [PorB1b]) 5. Preserveringsmedium för N. gonorrhoeae Användningsområde Spädnings- och preserveringsmedium vid frysförvaring av bakterier, inklusive Neisseria species. 203 I 6 Bilagor Preserveringsmedium för N. gonorrhoeae (deklaration per liter): BBL Trypticase Soy Broth (BD) Bacto Yeast Extract (BD) Agar No 2 (Lab M) RO-vatten Hästserum (inaktiverat; SVA) 30,0 g 3,0 g 0,5 g 700 mL 300 mL pH=7,5±0,1 Dispensering: 1 mL i sterila frysrör med skruvkork. Hållbarhet: 4 veckor vid +2-8 ºC. Rekommenderad kontrollstam Funktionskontroll vid ny batch: N. gonorrhoeae CCUG 33979. Adekvat överlevnad (maximal minskning av ”colony forming units” (CFU) med en 10 potens) efter preservering vid -70 ºC över natt. För längre tids förvaring bör bakteriestammarna frysas i rekommenderat frysmedium eller likvärdigt vid -70-80 ºC, i flytande kväve eller frystorkas. 204 I 6 Bilagor BILAGA 2 Cellodling Chlamydia trachomatis 205 I 6 Bilagor 206 I 6 Bilagor 2 Primärisolering och identifiering av Chlamydia trachomatis med cellodling Modifierad från Ripa & Mårdh (1). 2.1. Substratrecept 2.1.1. Provtagningsmedium 2-SP buffert med fetalt kalvserum och antibiotika 68,46 g sucrose löst i aq. dest (liten mängd) 2,088 g K2HPO4 löst i aq. dest (60 mL) 1,088 g KH2PO4 löst i aq. dest (40 mL) Blandas och späds med aq. dest till slutvolym 1000 mL. pH 7,0 Autoklav 15 min. 120 °C Ad. 10 % fetalt kalvserum (inaktiverat, 56 °C, 30 min) varje batch testas för inhibitorisk effekt på C. trachomatis 10,0 mg/L gentamicin 2,5 mg/L amfotericin B 100 mg/L vankomycin 2.1.2. Cellodlingsmedium RPMI 1640 Ad. 10 % fetalt kalvserum (inaktiverat) 1 % glutamin 10 mg/L gentamicin 2,5 mg/L amfotericin B 2.1.3. Provsättningsmedium Recept 2.1.2 + följande tillsatser 0,5 % (wt/vol) glukos 0,5-2,0 mg/L cykloheximid Koncentrationen testas för varje uppspädd lösning. 2.2. Cellslag Mykoplasmafria McCoy-celler med dokumenterad förmåga att vara värdcell för förökning av C. trachomatis används. Regelbunden kontroll för mykoplasmakontamination med PCR eller mykoplasmaodling rekommenderas. 207 I 6 Bilagor 2.3. Metod för primärisolering För cellpropagering och spädning av prov används RPMI 1640 med tillsatser enligt recept 2.1.2. ovan. Efter provsättning kompletteras detta medium med glukos och cykloheximid enligt recept 2.1.3. Observera att ny uttitrering av lämplig cykloheximidkoncentration (0,5-2,0 mg/L) bör göras vid varje ny beredning av cykloheximid. Likaså bör cykloheximidkoncentrationen uttitreras vid cellbyte. Denna uttitrering görs med kontroller enligt nedan och cykloheximidkoncentrationer 0,5-2,0 mg/L i 0,5 mg steg. Cellodlingsförfarande enligt gängse normer. Cellerna kan propageras på 250 mL plastflaskor eller större plast- eller glasflaskor efter behov. Celler för provsättning passeras efter 2-4 dagar i täthet 1,5-2×105 celler/mL (den erforderliga celltätheten beror på hur snabbt cellerna växer ut till ett konfluerande lager – för exakt inokulation räknas cellerna i Bürkerkammare). Till varje brunn i 24-håls cellodlingsplattor sätts 1 mL cellodlingsmedium med celler. Cellsuspensionen ska efter 1 dygns inkubering ge ett konfluerande cellager. Provsättning Upptining av prov som varit frysta bör ske snabbt (37 °C vattenbad). Transportröret med isittande provtagningspinne skakas i Vortex, eventuellt med cirka 10 glaspärlor i röret. Grumliga prov (i allmänhet cervix) spädes med cellodlingsmedium 1:1, och ceentrifugeras 2-300×g, 5 min. Från varje prov sätts till 2 brunnar: 0,5 mL ospätt prov + 0,5 ml cellodlingsmedium eller 1 mL spätt prov. Resten av provet fryses åter vid -20-70 °C. Vid varje analystillfälle sätts även positiv och negativ kontroll. Plattorna centrifugeras vid 3000×g, 37 °C i 1 timme. Plattorna inkuberas sedan vid 37 °C i 2 timmar, CO2-termostat. Därefter byts till provsättningsmedium (2.1.3.) och plattorna inkuberas vid 37 °C i 2 dygn i CO2-termostat. Färgning Medium avsugs från varje brunn. Cellerna fixeras i 1 mL 95 % etanol i 10 min. Etanolen hälls av. Cellerna färgas med fluoresceinmärkta monoklonala antikroppar mot C. trachomatis enligt fabrikantens instruktion. Avläsning sker i UV-mikroskop med filterkombination för fluoresceinisotiocyanat. För översiktsavläsning används ×10 objektiv och för verifiering av misstänkt inklusion ×40. En typiskt fluorescerande inklusion per brunn är tillräckligt för att ange provet som positivt. Den tidigare använda jodfärgningen ger lägre diagnostisk känslighet genom att färre typiska inklusioner ses i cellmattan (2) 208 I 6 Bilagor Kontroller Den positiva kontrollen titreras i provtagningsmedium så att ett visst antal inklusioner, exempelvis 5 per ×10 synfält, ses vid upprepade provsättningar. Om större avvikelser uppträder mellan olika analystillfällen, inklusive om inga inklusioner ses, byts positiv kontroll och/eller McCoy celler och orsak till avvikelsen klarläggs. Byte av McCoy celler, oavsett utfall av ovanstående kontroller, rekommenderas efter 6-8 veckor. ”Blind passage” Prov som är negativa vid ovanstående färgning: Plattorna inkuberas ytterligare 1 dygn, dvs sammanlagt 3 dygn. Medium hälls av och 0,5 mL provtagningsmedium sätts till den inokulerade icke färgade brunnen för varje negativt prov. Cellerna skrapas loss med en pasteurpipett och förs över till en ny brunn med McCoy-celler. 0,5 mL cellodlingsmedium tillsätts. Därefter inkuberas och färgas cellerna som ovan. Genom denna ”blinda passage” kan sensitiviteten av odlingen ökas. Referenser 1. Ripa, KT och Mårdh, P-A. Cultivation of Chlamydia trachomatis in cycloheximidreated McCoy cells. J Clin MIcrobiol 1977, 6:323-331. 2. Stamm, WE et al. Detection of Chlamydia trachomatis inclusions in McCoy cell cultures with fluroescein-conjugated monoclonal antibodies. J Clin Microbiol 1983, 17:666-668. 209 I 6 Bilagor 210 I 6 Bilagor BILAGA 3 Nukleinsyrabaserad metod för påvisning av Mycoplasma genitalium 211 I 6 Bilagor 212 I 6 Bilagor Nukleinsyrapåvisning av Mycoplasma genitalium (ej referensmetod) Analysprincip Metoden beskriver analysförfarandet vid nukleinsyrapåvisning med realtidsPCR utförd i LightCycler 1.5 (samma prestanda uppnås i LightCycler 480) (Roche Molecular Biochemicals) och detektion med TaqMan MGB (minor grove binder) probe. Mål-DNA är sekvens på 78 bp inom konserverad del av adhesionsgenen MgPa. Reagenser Probe TaqMan MgPa-380 probe (FAM-ACT TTG CAA TCA GAA GGTMGB) (Applied Biosystems) Primer MgPa-355Forward (5´-GAG AAA TAC CTT GAT GGT CAG CAA-3´) Primer MgPa-432Reverse (5´-GTT AAT ATC ATA TAA AGC TCT ACC GTT GTT ATC-3´) LightCycler Fast Start DNA Master Hybridization Probes eller LightCycler TaqMan Master eller (Roche) UNG (Uracil-DNA Glycosylase) (Roche) LightCycler Capillaries 20 μL (Roche) Vid extraktion i MagnaPure: DNA Isolation Kit (Roche) Vid manuell extraktion: Chelex 100 (Bio-Rad Lab. AB), spädd till 5 % (w/v) i destillerat vatten Analysprocedur Intern kontroll Positiv 1. Extraktionskontroll: Poolade positiva urinprover spädda 1/10 med negativa urinprover. Prepareras och analyserassom patientprover. Notera aktuell ”crossingpoint” vid LC-PCR-körning. Positiv 2. Renat DNA isolerat från Mycoplasma genitalium ATCC 33530D, 213 I 6 Bilagor konc 1 ng/μL, spädd till 10-5. Alternativt kan kontroll erhållas från SSI eller genom Kliniskt Forskningscenter US Örebro. Det är en DNA-preparation från M. genitalium spädd 10-5 innehållande 106 genom/mL. Denna späs till att motsvara cirka 5 genom/5 μL. Negativ: PCR-rent vatten Inhibitionskontroll: 4 μL av provtemplat och 1 μL av positiv kontroll sätts till separat kapillär med mastermix. Provberedning Prov utgörs av 5-10 mL förstaportions urin, för kvinnor kompletterad med prov från cervix/vagina. Pinnprov från cervix/vagina sätts i samma rör som urinprovet. Förvara prov i kyl men frys ej. Kan förvaras i kyl i minst 7 dygn. Urinprov och cervix/vagina i urin: Skaka prov på vortex och överför därefter 2 mL urin till ett kryorör. Centrifugera 20 000 g i 10 minuter. Vid extraktion i extraktionsrobot: Sug av supernatanten av men lämna ca 300 μL av urinen kvar i röret. Slamma upp pelleten i kvarvarande urin och hantera sedan enligt anvisning. Vid manuell preparering: Sug av hela supernatanten och slamma pelleten i Chelex 100-lösning enligt nedan Cervix/vagina/uretra prov i 2 SP: Vid extraktion med robot: extrahera provet efter att det skakats på vortex utan centrifugering enligt anvisning. Vid manuell preparering: Skaka provet på vortex och överför därefter 100 μL till 1,0 mL 0,85 % NaCl i kryorör och centrifugera som urinprov. Sug av supernatanten och resuspendera pelleten i 300 μL Chelex 100-lösning och skaka på vortex 60 sekunder. Inkubera i värmeblock 95-99 0C i 10 minuter. Centrifugera 5 min i 11 000 rpm. Master mix: Per prov μL (LightCycler Fast Start DNA Master Hybridization Probes): H2O 7,15 MgCl2 25mM 3,2 UNG 0,25 1 Primer MgPa-355F 20 μM 1 Primer MgPa-432R 20 μM 0,4 Probe MgPa-380 10 μM Master från kit 2 Tot 15 214 I 6 Bilagor Provsättning: Sätt kapillärer i kylblock och pipettera 15 μL mastermix och 5 μL extraherat prov enligt protokoll Realtids-PCR: UNG Preinkubering Amplifiering, 50 cykler Nedkylning Temperatur °C 40 95 95 60 72 (detektion) 40 Tid 10 min 10 min 5s 15 s 5s 30 s Jämförelser Denna realtids-PCR har jämförts genom provutbyte om 55 kliniska prover mellan laboratorierna i Västerås och Falun med jämförbart resultat (22 positiva i Västerås mot 21 positiva i Falun). Metoden används på flera laboratorier i landet och är ursprungligen utvecklad på Örebrolaboratoriet och jämförd mot konventionell PCR på Statens Seruminstitut (SSI) i Köpenhamn. REFERENSER 1. Jensen JS, Björnelius E, Dohn B et al. Use of Taqman 5´ nuclease real-time PCR for quantitative detection of Mycoplasma genitalium DNA in males with and without urethritis who were attendees at a sexually transmitted disease clinic. J Clin Microbiol 2004;42:683-692 2. Edberg A, Jurstrand M, Johansson E, et al. A comparative study of three different PCR assays for detection of Mycoplasma genitalium in urogenital specimens from men and women. J Med Microbiol 2008 Mar; 57(Pt 3):304-9. 215 I 6 Bilagor 216 I 6 Bilagor BILAGA 4 Substrat för isolering och identifiering av Mycoplasma hominis och Ureaplasma species 217 I 6 Bilagor 218 I 6 Bilagor Recept odlingsmedier Medium för Mycoplasma hominis Flytande: Heart Infusion Broth Hästserum, ej inaktiverat Jästextrakt L-arginin (30 %) Talliumacetat (2 %) Bensylpenicillin (20 000 IE/mL) 90,0 mL 20,0 mL 10,0 mL 1,0 mL 0,6 mL 0,25 mL pH 7,8 Indikator fenolrött 0,002 % Fast medium fås genom att tillsätta 1,7 g agar till ovanstående flytande medium utan indikator. Medium för Ureaplasma Trypticase Soy Broth Hästserum, ej inaktiverat Jästextrakt Urea (40 %) Bensylpenicillin (20 000 IE/mL) 100 mL 22,0 mL 10,0 mL 1,6 mL 0,25 mL pH 6,0 Indikator fenolrött 0,002 % Fast medium fås genom att tillsätta 1,7 g agar till ovanstående flytande medium utan indikator. Färglösning för påvisande av Ureaplasma -kolonier CaCl2 11,1 mL Urea 6,0 mL Vatten 1000 mL Steriliseras genom filtrering och förvaras fryst. 219 I 6 Bilagor 220 I 6 Bilagor BILAGA 5 Metoder för diagnostik av Treponema pallidum 221 I 6 Bilagor 222 I 6 Bilagor 5.1. Metodbeskrivning för PCR-detektion av Treponema pallidum (ej referensmetod) 5.1.1. Provtagningsmaterial och provtagning Pinnprov från sårkant (pinnskaftet ska ej vara av trä) för transport i koksalt, PBS eller transportmedel avsett för odling. Lämplig pinne är Copan 155C (pinne av plast med rayontip). Prov från andra provtagningslokaler transporteras som för odling. Lämpligt transportmedium är Copan 114C.USE (kolat medium, provtagningspinne som ovan). Prov förvaras i kyl fram till omhändertagandet. 5.1.2. Provhantering på laboratoriet Sår: Överför provtagningspinne till centrifugrör med 200 μL PBS/koksalt alternativt 1 mL av provet om detta transporterats i PBS/koksalt. Centrifugera 12 000 × g 10 min. Häll av supernatanten. Nukleinsyra extraheras från provet med valfri metod. På bakteriologiska laboratoriet i Göteborg används Roche Amplicor, sputum sample preparation kit enligt leverantörens instruktioner. Likvor: 1 mL likvor centrifugeras 12 000 × g 10 min i 1,5 ml centrifugrör. Fortsätt enligt ovan provmaterial från sår. Nukleinsyraamplifiering med PCR Primrar för detektion av bmp-genen kodande för 47-kDa membran immunogen (basic membrane protein) KO3A Forward 5’ GAAGTTTGTCCCAGTTGCGGTT3’ KO4 Reverse 5’ CAGAGCCATCAGCCCTTTTCA3’ Amplifiering med ovanstående primerpar ger ett DNA-fragment av storleken 239 bp. 223 I 6 Bilagor Mix / PCR-rör Reagens Konc. Brukslösning GeneAmp 10×PCR buffert II dNTP×4 10 mM Volym 10 μL 2 μL×4 = 8 μL MgCl2 25 mM 12 μL Primer×2 10 mM 2,5 μL×2 = 5 μL Taq Sterilt H2O 5 U/μL 0,4 μL 14,6 μL Tillsätt 50 μL templat-DNA (prov respektive kontroller) till respektive PCR-rör. PCR-program: 20 sek 95 °C 20 sek 62 °C 20 sek 72 °C 40 cycler Positiva kontroller Positivt patientprov vars positivitet verifierats genom sekvensering och BLAST sökning i GenBank. DNA för denna användning kan beställas från CCUG. 5.2. Serologisk diagnostik av syfilis (referensmetoder) Allmänt Infektioner med T. pallidum ger upphov till ett flertal antikroppar och dessa indelas i två grupper: 1). Ospecifika antikroppar riktade mot lipoidalt antigen i T. pallidums cellvägg och sådant lipoidalt antigen som uppstår genom vävnadsskada vid interaktion mellan värd och mikroorganism men även vid andra sjukdomstillstånd. 2). Specifika antitreponemala antikroppar riktade mot T. pallidum och som bestäms genom att man använder hela bakterier eller preparation av dessa som antigen. Sådana antikroppar är av två typer, nämligen gruppspecifika antikroppar även mot icke patogena spiroketer och antikroppar specifika för T. 224 I 6 Bilagor pallidum. Humorala antikroppar mot T. pallidum saknar sannolikt helt skyddseffekt mot förnyad infektion. Förekomst av specifika IgM-antikroppar talar för aktiv infektion. Dessa antikroppar kan dock vara svåra att påvisa vid sena infektioner med höga IgG-nivåer. A. Ospecifika test a) Flockningsreaktioner/reagintester Venereal Disease Research Laboratory (VDRL) test Rapid plasma reagin (RPR) test b) Komplementbindningsreaktion Wasserman reaktion (WR) B. Specifika antitreponemala test a) Treponema passiv particle-agglutination (TPPA) b) IgM-ELISA c) Analysinstrument, exempelvis Abbotts Architect 5.2.1. VDRL/RPR Analysprincip/Teststrategi: Vid reaktionen mellan ospecifika serumantikroppar (reaginer) och kardiolipin – lecitin – kolesterolantigen (VDRL-antigen) bildas aggregat. Denna aggregatbildning kan avläsas direkt i mikroskop (VDRL-test), eller okulärt vilket underlättas av tillsatta mikropartiklar av kol i antigenberedningen (RPR-test). Testerna är lätta att standardisera och har i stort sett samma prestanda. Vid VDRL-testen sätts antigenet till inaktiverat serum (observera att likvor inte skall vara inaktiverat), varefter eventuell aggregation av partiklar avläses i mikroskop. För RPR-testet används icke inaktiverat serum. Testerna kan med fördel utföras kvantitativt genom att antigenet sätts till olika spädningar av serum eller likvor. I svaret anges högsta spädning som ger positiv reaktion. Det bör noteras att om man endast använder VDRL-antigen i en låg serumspädning finns risk för prozonfenomen, det vill säga falskt negativt resultat vid mycket höga antikroppsnivåer. 225 I 6 Bilagor VDRL/RPR används dels vid primär screening av blodgivare och gravida och dessutom vid utredning av misstänkt syfilis inklusive neurosyfilis. Många svenska laboratorier har övergått till att primärt använda specifika tester (se Abbotts Architect Syphilis TP-test, denna bilaga 5.2.5.). Ospecifika tester kan ibland bli snabbare positiva vid tidig syfilis och har därför ännu en plats som komplement vid primärdiagnostiken. TPPA har dock till skillnad från den tidigare rekommenderade TPI lika hög sensitivitet som VDRL vid primär lues. Vid misstanke om neurosyfilis skall VDRL/RPR användas för primär undersökning av likvor. Titrering av serum för kvantitativ analys med ospecifik test är användbart för att följa behandlingsresultatet. Efter avslutad behandling för primär eller sekundär syfilis utförs testning efter tre, sex och tolv månader. Vid kvarstående titer genomförs ytterligare test efter 24 månader. Observera att de ospecifika reaginerna i normalfallet inte längre kan påvisas efter cirka 1-2 år efter genomförd behandling. Livslångt kvarstående titrar kan dock förekomma, framförallt vid sent insatt behandling. Efter behandling av neurolues bör undersökning av likvor göras efter sex månader. Reagintesterna kan då ha blivit negativa. Referenssera/Kontrollsera: Primär kalibrator är densamma för alla serologiska syfilistester (1:st international WHO standard human syphilis). Testerna kalibreras 2 gånger årligen med detta serum. Positiv kontroll tillverkas på det enskilda laboratoriet och används vid varje testomgång. Analysproceduren: Nedan beskrivs kortfattat den vanligt förekommande kommersiella RPR-testen ”Murex VDRL-antigen med kolpartiklar”. Produkten är CE-märkt enligt IVD-direktivet. Testen utförs på objektglas eller ljus analysbricka med ringar, cirka 18 mm i diameter. Blanda 16 µL VDRL antigensuspension med 50 µL prov på glaset eller analysbrickan. Skaka glaset eller analysbrickan 8 minuter på en skakapparat med horisontell plattform som roterar 100 varv/min med en rotationsdiameter på 18-22 mm. Avläs resultatet visuellt i god belysning. Ett positivt resultat indikeras genom att klart synliga svarta aggregat av partiklar utvecklas. Titrering av prover görs i serien 1, 1/2 -1/128. Det är lämpligt att utföra titrering upp till 1/16 redan primärt för att undvika eventuellt prozonfenomen. Titer rapporteras till klinik. 226 I 6 Bilagor Tolkning och prestanda: Ett positivt resultat indikerar förekomst av reagin, men är inte liktydigt med diagnosen syfilis. I litteraturen anges sensitiviteten för dessa tester till 74-100 % för primär syfilis, närmare 100 % vid sekundär eller latent syfilis, men bara 37-94 % vid sen syfilis. Specificiteten är cirka 93-99 %. Vid neurosyfilis är känsligheten maximalt cirka 70 %, men positiv test på likvor anses liktydlig med neurosyfilis. Det skall observeras att påvisbara reaginer uppstår först efter cirka 4-6 veckor efter infektionstillfället. VDRL är ospecifikt positivt i cirka 1 % av blodgivarsera. Observera att VDRL-titrering ger lägre titrar och sämre reproducerbarhet än WR och TPPA. Både falskt negativa och biologiskt falskt positiva (BFP) resultat ur ett diagnostiskt perspektiv kan erhållas med flockningstester. Upprepade positiva testresultat tillsammans med negativa specifika antitreponemala tester orsakas ofta av herpes genitalis. Som orsak till övergående BFP har också angivits graviditet, narkotikamissbruk, mykoplasmapneumoni, tuberkulos och malaria. Vid bestående (längre än 6 månader) BFP kan orsakerna vara autoimmun sjukdom som SLE, reumatoid artrit, autoimmun struma, poyarteritis nodosa, levercirros, malignitet, narkotikamissbruk och lepra. I över hälften av bestående BFP finner man emellertid ingen orsak. Detta är vanligare hos äldre och kan vara familjärt betingat. Vid BFP är det ofta inkongruens mellan VDRL/RPR och WR-testerna. Svarsrutiner: VDRL/RPR-resultatet angivande av eventuell titer. anges som positivt/negativt med REFERENSER 1. Hook EW, Marra CM. Acquired syphilis in adults. N Engl J Med. 1992; 326: 10601065 5.2.2. Wassermanreaktion (WR) Analysprincip/Teststrategi: I ett första steg binds i provet förekommande reaginer till kardiolipinantigen (VDRL-antigen) varvid ett antigen/antikroppskomplex bildas. Samtidigt tillsätts ett hemolytiskt system bestående av sensibiliserade fårblodkroppar, amboceptor (antikroppar mot fårblodkroppar) och marsvinskomplement. Eftersom komplementet binds till antigen/antikroppskomplexet hemolyseras inte blodkropparna av amboceptorn, utan dessa sjunker till botten. Om provet saknar reaginer är komplementet fritt och bidrar till lys av blodkropparna. I svaret anges den högsta serumspädning som ger 50 % hemolys eller mindre. 227 I 6 Bilagor Analysen rekommenderas som kompletterande ospecifikt test vid utredning av misstänkt syfilis, i första hand vid sannolika biologiskt falskt positiva (BFP) VDRL/RPR-resultat. På grund av sin något högre kvantitering och reproducerbarhet kan WR vara att föredra framför flockningstesterna vid uppföljning av behandlingsresultat. Testerna är för övrigt prestandamässigt i stort sett likvärdiga, men WR är något mer arbetsintensiv. Referenssera/Kontrollsera: Primär kalibrator är densamma för alla serologiska syfilistester (1:st international WHO standard human syphilis). Testerna kalibreras 2 gånger årligen med detta serum. Positiv och negativ kontroll tillverkas på det enskilda laboratoriet och används vid varje testomgång. Positiv tillverkas från positiva patientprover och spädes till lämplig titernivå med primär kalibrator som jämförelse. Titreringen skall utföras vid tre separata tillfällen. Analysproceduren: 1. 2. 3. 4. I ett första steg utförs amboceptortitrering i provrör (görs vid batchbyte). Därvid tillsätts komplement i överskott och amboceptor i den minsta mängd som ger fullständig hemolys. Man söker den spädning som innehåller 6 enheter/0,025 mL buffert. I ett andra steg utförs på motsvarande sätt komplementtitrering, varvid man använder titrerad amboceptor. Man söker den komplementspädning som innehåller 1,5 enheter/0,025 mL, varvid 1 enhet är den minsta mängd komplement som ger fullständig hemolys. Testet utförs enligt medföljande anvisningar. I princip blandas patientserum i olika spädningssteg med antigensuspension, 2 % fårblod, och uttitrerad amboceptor och komplement i mikrotiterplattor. Brunnar utan antigensuspension bereds också för varje prov för att möjliggöra bedömning av eventuell antikomplementär aktivitet hos proven. Plattorna inkuberas i 37ºC i en timme, varefter de sätts i kylskåp för att tillåta att kvarvarande blodkroppar kan sjunka till botten. Resultatet avläses varvid bedömning görs av hemolys som protokollförs som - eller + (positivt resultat) och ++ eller +++ (negativt resultat). Tolkning och prestanda: Ett prov med <50 % hemolys i godkänd omgång betraktas som positivt och uttitreras om så inte skett från början. Om provet är starkt antikomplementärt (både prov och serumkontroll ger <50 % hemolys) titreras detta vidare med och utan antigen för att bedöma graden av antikomplementär aktivitet i provet. Allmänna prestanda är i princip desamma som för VDRL/RPR. Kvalitetssäkring: Två egentillverkade kontroller (positiv och negativ) 228 I 6 Bilagor medtages vid varje analystillfälle. Dessa skall vara kalibrerade mot primär kalibrator och får avvika högst ett spädningssteg för godkänd analysomgång. Svarsrutiner: WR svaras ut som positiv med angivande av titer (den högsta spädning som ger <50 % hemolys) eller negativ (>50 % hemolys). REFERENSER 1. Wassermann, A., Neisser, A. and Bruck, C. Eine serodiagnostische Reaktion bei Syphilis. Dtsch. med. Wschr. 1906; 32:745. 5.2.3 TPPA Analysprincip/Teststrategi: För analysen används speciella bärarpartiklar av gelatin som har sensibiliserats med renade patogena T. pallidum (Nichols stam). Principen för testen är att dessa partiklar agglutinerar i närvaro av specifika antitreponemala antikroppar i humant serum eller human plasma. I föregående upplaga av denna bok angavs för verifiering T. pallidum hemagglutinationstest (TPHA) som referensmetod. TPPA är snabbare och enklare att utföra samt avläsa men har för övrigt samma prestanda och ersätter därför TPHA som referensmetod. FTA-abs rekommenderas inte längre, och TPI är inte längre tillgänglig. Referenssera/Kontrollsera: Primär kalibrator är densamma för alla serologiska syfilistester (1:st international WHO standard human syphilis). Testerna kalibreras 2 gånger årligen med detta serum. Positiv kontroll tillverkas på det enskilda laboratoriet och används vid varje testomgång. Analysproceduren: Nedan beskrivs kortfattat en kommersiell TPPA, Serodia – TP.PA (Fujirebio inc). Produkten är CE-märkt enligt DVD-direktivet. 1. 2. 3. 4. I förpackningen ingår frystorkade sensibiliserade och icke-sensibiliserade gelatinpartiklar som rekonstitueras med särskild medföljande lösning och 100 uL av respektive lösningar sätts till första brunnarna i mikrotiterplattor. Till följande brunnar sätts 25 uL av lösningarna. Icke inaktiverat serum eller plasma och positiv kontroll liksom laboratoriets egentillverkade positiva kontroll sätts till första brunnen och titreras därefter i de följande brunnarna enligt medföljande anvisningar. Mixa. Inkubera utan agitation i rumstemperatur mellan 2 timmar och ett dygn. Avläs därefter. Plattorna avläses okulärt. Ett negativt resultat karakteriseras av att partiklarna sedimenterat ner till botten av brunnen och där centralt format 229 I 6 Bilagor en distinkt pellet. Ett positivt resultat karakteriseras av att agglutinerade partiklar sedimenterat till ett jämnt skikt i botten på brunnen. Svagt positiva reaktioner förekommer som mellanformer (kompakt ring av partiklar eller stor ring med oskarpa kanter). Tolkning och prestanda: För godkänd analysomgång skall reaktionerna med osensibiliserade gelatinpartiklar uniformt utfalla negativt och positiv kitkontroll skall ha en titer på 1/320. Egen positiv kontroll skall uppfylla uppsatta kriterier. Omtestning bör ske om även osensibiliserade partiklar orsakat agglutination. Därvid absorberas först provet mot rekonstituerade osensibiliserade partiklar enligt medföljande anvisningar. Analysen har hög sensitivitet, dvs. motsvarande 70-90 % vid primär syfilis, i senare stadier av sjukdomen är sensitiviteten nära 100 %. Specificiteten är också hög och överstiger 95 %. De specifika antikropparna utvecklas något senare i sjukdomsförloppet än de ospecifika reaginerna (se ovan) och börjar uppträda mellan 5-12 veckor efter infektionstillfället. Däremot kvarstår antikroppsnivåerna livslångt, varför specifika tester inte kan användas för bedömning av behandlingseffekt. Svarsrutiner: Resultatet av godkänd testning rapporteras som TPPA negativ eller positiv med angivande av titer. 5.2.4. Specifik syfilisserologi utförd med ELISA-teknik Analysprincip/Teststrategi: Flera specifika EIA-tester baserade på T. pallidum-sonikat eller rekombinanta antigen har utvecklats för syfilisdiagnostik. Kommersiella sådana har i olika publikationer visats ha samma sensitivitet och specificitet som övriga specifika syfilistester. Captia Syphilis-M test påvisar IgM-antikroppar och rekommenderas bland annat för att påvisa kongenital syfilis. Western blot baserade EIA-tester är också under utveckling. Western blot tester som detekterar IgM antikroppar mot T. pallidum har i vissa studier till och med uppvisat högre sensitivitet och specificitet än ELISA vid diagnostik av kongenital syfilis. IgM-ELISA rekommenderas i dag som verifierande specifik test tillsammans med TPPA när ospecifika tester utfallit positivt. Specifika IgM-antikroppar uppträder visserligen något senare än de ospecifika reaginerna, men blir ofta positiv innan andra specifika tester blir det. Därmed kan testen användas för att påvisa primär syfilis, tidigt i förloppet. Vissa studier talar för att IgMantikroppar även uppträder vid reinfektion. IgM-ELISA är också användbar för 230 I 6 Bilagor att påvisa anti-TP-antikroppar vid misstänkt kongenital syfilis. Sådana antikroppar kan inte överföras från mor till barn, varför förekomst av sådana i blodprov från barnet indikerar kongenital syfilis. Referenssera/Kontrollsera: Primär kalibrator är densamma som för övriga diagnostiska syfilis-tester (se ovan). Analysproceduren: Utförs enligt tillverkarens anvisningar. Tolkning och prestanda: Reaktiviteten för IgM-testerna motsvarar i huvudsak TTPA, utom vid reinfektioner då känsligheten är lägre. Risk för falskt positiva resultat föreligger om serum innehåller reumafaktor. Svarsrutiner: Resultaten av tekniskt godkänd testning rapporteras som fynd av specifika IgM-antikroppar påvisade/ej påvisade. REFERENSER 1. Lefevre, J.C., Bertrand, M.A., och Bauriand, R. Evaluation of the Captia Enzyme immunoassays for detection of immunoglobulins G and M to T. pallidum in syphilis. J. Clin. Microbiol. 1990; 28(8):1704-1707. 5.2.5. Specifik syfilisserologi utförd på kommersiella analysinstrument Analysprincip/Teststrategi: Specifika antikroppar mot T. pallidum kan påvisas med olika tekniker och ett flertal kommersiella applikationer finns att tillgå. Förutom TPPA och olika ELISA-baserade metoder för påvisande av i huvudsak IgM är användandet av olika fabrikat av automatiserade analysutrustningar spridd vid landets mikrobiologiska laboratorier. Exempel på sådan utrustning är Architect® (Abbott) och Liaison® (DiaSorin), avsedda för screening av stora provmängder, exempelvis från blodgivare, plasmagivare eller gravida. Testerna påvisar specifika anti-T. pallidum-antikroppar med varianter av kemilumiscensmetoder och har i jämförande studier befunnits likvärdiga med sensitivitet och specificitet på >99 % jämfört med EIA-tester och TPPA (1). Dessa och likvärdiga metoder kan därför anses utgöra standard för screening av blodgivare, plasmagivare, gravida och vara ett alternativ till VDRL/RPR vid utredning av misstänkt syfilis. Referenssera/Kontrollsera: Primär kalibrator är densamma som för övriga diagnostiska syfilis-tester (se ovan). 231 I 6 Bilagor Analysproceduren: Här beskrivs som exempel kortfattat provhanteringen i Architect. Analysen (Chemiluminescent Microparticle Immunoassay, förkortas CMIA) utförs automatiskt i två steg. Den använder rekombinanta specifika antigen med den ungefärliga storleken 15, 17 och 47 kDalton klädda till mikropartiklar. Fabrikanten tillhandahåller med varje kit en kalibrator som skall användas i tre replikat vid kalibrering av metoden. Kalibreringen kontrolleras mot medföljande kitkontroller. 1. 2. 3. 4. Patientserum sätts till antigenklädda mikropartiklar suspenderade i buffert varvid eventuella anti-TP-antikroppar i provet binder till partiklarna. Akridinmärkt anti-humant IgG – och IgM-konjugat tillsätts och därefter två olika triggerlösningar. Den följande kemilumiscerande reaktionen mäts i relativa ljusenheter (RLU). Det råder en direkt relation mellan mängden antikroppar i provet och uppmätta RLU. Fabrikantens kit-kontroller och laboratoriets egentillverkade positiva kontroller används vid varje analystillfälle. Cut-off-värde bestäms som 0,2×erhållet värde för kalibratorn. Prover med S/CO-värden <1,0 betraktas som icke-reaktiva (negativa). Prover med S/CO-värden på >1,0 betraktas som reaktiva (positiva). Tolkning och prestanda: Analysens precision anges till <15 % av den medföljande positiva kontrollen. Initialt reaktiva prov centrifugeras för omtestning ×2. Om omtestningen blir negativ båda gånger betraktas provet som icke-reaktivt (negativt). Svarsrutiner: Icke-reaktiva prover svaras ut som negativa. Svaret kan vid klinisk frågeställning kompletteras med önskan om nytt senare taget prov för påvisande av möjlig serokonversion (se under TPPA om tidpunkt för uppträdandet av specifika antikroppar). Reaktiva prover svaras ut som positiva och kompletteras med TPPA och IgMELISA och eventuellt med VDRL/RPR/WR-titer. REFERENSER 1. Yoshioka N, Deguchi M et al. Evaluation of a chemiluminescent microparticle immunoassay for determination of Treponema pallidum antibodies. Clin Lab. 2007;53(9-12):597-603. 232 I 6 Bilagor BILAGA 6 Substrat för diagnostik av Haemophilus ducreyi 233 I 6 Bilagor 234 I 6 Bilagor GLV-3-plattor för odling av Haemophilus ducreyi enligt Bakteriologiska laboratoriet, Sahlgrenska sjukhuset, Göteborg Brain Heart Infusion Agar Dest vatten Super Q 37,0 g 15,0 g 1000 mL Löses med hjälp av värme. Autoklaveras 120 °C, 20 min. Blandningen får svalna till ca 50 °C före tillsats av: Hästblod skak, veckofärskt 150 mL Agar-blod-blandningen chokladiseras i 80 °C vattenbad 10-15 min. Värmebehandlingen får ej drivas så långt att mikroskopisk utflockning sker. Blandningen får svalna till ca 50 °C före tillsats av: Hästserum, ej inaktiverat 150 mL Jästautolysat 15,0 g/L 50 mL IsoVitaleX 1864 16,0 mL Vancomycinlösning 5,0 mg/mL (i frys) 0,8 mL (slutkonc 3 mg/L) En ampull vankomycin HCL à 500 mg Löses i 100 mL sterilt dest vatten Fryses i småportioner (ger 5,0 mg/mL) Blanda väl. Plattorna, något tjockare än vanligt, gjuts i vanliga petriskålar. Plattorna packas i plastpåsar. 235 I 6 Bilagor 236 I 6 Bilagor BILAGA 7 Trichomonas vaginalis 237 I 6 Bilagor 238 I 6 Bilagor Teknik för direktmikroskopi av Trichomonas En droppe vaginalsekret tas från bakre vaginalfornix till ett objektglas och blandas med lika delar kroppstempererad fysiologisk NaCl. Uretrasekret behandlas likartat. Urin (10 mL) centrifugeras 10 min vid 500×g. Bottensatsen används för mikroskopi och odling. Preparatet täcks med täckglas och granskas omedelbart med × 40 objektiv i ljusmikroskop eller med faskontrast. Figur 11. Trofozoiter av Trichomonas vaginalis (Giemsa-färgning, Wikimedia Commons, public domain) T. vaginalis är något större än en leukocyt och rör sig med hjälp av sina flageller och ett undulerande membran på ett karakteristiskt ryckigt vis. Orörliga T. vaginalis kan ej detekteras i våtpreparat. Samma mikroskoperingsteknik används vid avläsning av odlingar. 239 I 6 Bilagor Recept: Diamonds medium enl. Fouts & Kraus Streptomycin utbytt mot netimicin Trypticase 2,0 g Jästextratkt 1,0 g Maltos 0,5 g L-cystein hydroklorid 0,1 g Askorbinsyra 0,02 g Löses i 90,0 mL aq dest. Justera pH till 6,0. Autoklavera 10 min. Kyl till 48 °C och tillsätt: Inaktiverat sterilt hästserum 10,0 mL PcG 0,6 mg Netimicin 2,0 mg Amfotericin B 0,2 mg Agar 0,1 g Dispenseras på sterila skruvkorksrör à 9 mL/10 mL rör. Förvaras i kylskåp. Hållbarhet ej tillräckligt utvärderad, men buljongen kan frysas med sex månaders hållbarhet (Lillemor Karlsson, Karolinska Universitetssjukhuset, Solna, personligt meddelande) Kvalitetskontroll: Referensmaterial saknas. REFERENSER 1. Cudmore S L et al. Treatment of infections caused by metronidazole-resistant Trichomonas vaginalis. Clin Microbiol Rev. 2004;17: 783-793. 2. Fouts A C, Kraus S J. Trichomonas vaginalis: reevaluation of its clinical presentation and laboratory diagnosis. J Infect Dis 1980;141:137–143. 3. Hobbs M M et al. Methods for detection of Trichomonas vaginalis in the male partners of infected women: implications for control of Trichomoniasis. J Clin Microbiol 2006;44:3994-3999. 4. Seña A C et al. Trichomonas vaginalis infection in male sexual partners: implications for diagnosis, treatment, and. prevention. Clin Infect Dis 2007;44:13– 22. 5. Mayta H et al. 18S Ribosomal DNA-based PCR for diagnosis of Trichomonas vaginalis. J Clin Microbiol. 2000. 38: 2683-2687. 6. Radonjic I V et al. 2006. Diagnosis of Trichomonas vaginalis infection: The sensitivities and specificities of microscopy, culture and PCR assay. Eur J Obstet Gynecol Reprod Biol 126:116-120. 240 I 6 Bilagor BILAGA 8 Nukleinsyrabaserad metod för påvisning av Herpes simplexvirus 241 I 6 Bilagor 242 I 6 Bilagor Kvantitativ PCR för HSV-1 och HSV-2 vid Smittskyddsinstitutet Indikation Misstanke om infektion med Herpes simplex virus typ 1 eller 2 (HSV-1, HSV-2). Med kvantitativ polymerase chain reaction (PCR)analys är det möjligt att detektera och kvantifiera antalet virusgenom i provmaterial vilket kan utnyttjas för att följa utvecklingen av genomantal vid behandling. Analysprincip/teststrategi Med PCR-teknik amplifieras specifika nukleinsyrafragment (DNA-fragment) i närvaro av en fluorescerande probe. Mängden ursprungligt templat i okända prov kvantifieras genom att signalen från proben jämförs med en standardkurva generad från prov med en känd mängd templat. PCR-analysen kan dock inhiberas av olika faktorer exempelvis hämoglobin och proteinkomplex som kan finnas i de kliniska provmaterialen. På grund av detta måste alla prov extraheras innan PCR-analys. Innan extraktion tillsättes sälherpes (PhHV-1) till varje patientprov (spikning), som extraktionskontroll och inhibitionskontroll för prov i PCR-analysen. Provmaterial Misstänkt diagnos / Symtom CNS-infektion Virus HSV-1 HSV-2 HSV-1 HSV-2 Blåsor Provmaterial Cerebrospinalvätska Blåsinnehåll • Blåsinnehåll: Förvaras i rumstemperatur, kyl eller frys. • Cerebrospinalvätska (CSF): volym > 200 µL. Förvara i rumstemperatur, kyl eller frys. Provtagningsmaterial • Blåsinnehåll: Virocultrör eller sterilt rör med 250 µL NaCl. • Cerebrospinalvätska (CSF): Sterilt rör utan tillsats. 243 I 6 Bilagor Provtransport • Blåsinnehåll: Kan transporteras i rumstemperatur. • Cerebrospinalvätska (CSF): Kan transporteras i rumstemperatur. Reagenser ® • Mag Attract DNA Mini M48 kit, Qiagen art nr: 953336 (extraktion av vätskor i BioRobot M48) ® • QIAamp DNA Blood Minikit, Qiagen art nr: 51106 (manuell extraktion av vätskor) • Positiv extraktionskontroll för säl (PhHV-1) ® • TaqMan Universal PCR MasterMix, ABI art nr: 4318157 • MgCl2, 25 mM • Probe för de olika PCR-systemen • Primrar för de olika PCR-systemen • Standard (extraherade Namalvaceller som innehåller integrerat EBV DNA) • Positiv kontroll (acceptor) för de olika PCR-systemen • Negativ kontroll (NTC) för de olika PCR-systemen Probe för de olika PCR-systemen HSV-1: 5'FAM-CAGCACACGACTTGGCGTTCTGTGT3'TAMRA HSV-2: 5'FAM-CAGACAAACGAACGCCGCCG-3'TAMRA Säl: 5'FAMTTTTTATGTGTCCGCCACCATCTGGATC3'TAMRA Primrar för de olika PCR-systemen Primrarna i HSV-1-systemet är riktade mot US5-genen. HSV-1 forward: 5'-GGCCTGGCTATCCGGAGA-3' HSV-1 reverse: 5'-GCGCAGAGACATCGCGA-3' Primrarna i HSV-2 systemet är riktade mot US4-genen. HSV-2 forward: 5'-AGATATCCTCTTTATCATCAGCACCA-3' HSV-2 reverse: 5'-TTGTGCTGCCAAGGCGA-3' 244 I 6 Bilagor Primrarna i säl Hv-systemet är riktade mot gB-genen. Säl forward: 5'-GGGCGAATCACAGATTGAATC-3' Säl reverse: 5'-GCGGTTCCAAACGTACCAA-3' Analysprocedur Kort sammanfattning: • Extraktion av DNA med valt extraktionskit. Innan extraktion tillsättes en inhibitions-kontroll till varje prov (sälherpesvirioner). Om prov spädes ut/koncentreras skall hänsyn tas till det vid beräkningen av genomkoncentrationen. Vid varje extraktion ingår även en extraktionskontroll som extraheras parallellet med övriga prov. • Rena mixar bereds i templatfritt rum. • I provtillsättningsrummet blandas extraherat prov med PCRmixarna. Prover och kontroller fördelas i en 96-hålsplatta. Alla prover analyseras i duplikat för respektive PCR system. Alla prover analyseras även för sälherpes PCR systemet i en brunn (fungerar som inhibitions- och extraktionskontroll). Standard är 4 brunnar med cirka 5 EBV genom/brunn, 2 brunnar av vardera 50, 500, 5000 samt 50000 EBV genom/brunn. NTC (reagenskontroll utan templat, negativ) för respektive PCR system, i triplikat. Acceptor (positiv kontroll, cirka 20-50 genom/brunn) för aktuella PCR system, i triplikat. Slutvolymen på 25 µL i varje brunn består av 5 µL extraherat prov/kontroll och 20 µL PCR-mix. • Alla brunnarna försluts. PCR-analysen sker och analyseras direkt i PCR maskinen. Bedömning • För att ett prov skall bedömas som negativt skall båda brunnarna med aktuellt prov vara negativa. Samt att inhibitionskontrollen skall vara positiv, bör vara minst 20% positiv jämfört med extraktionskontrollens värde (sälherpes). • För att ett prov skall bedömas som positivt skall båda brunnarna med aktuellt prov vara positiva. Samt att inhibitionskontrollen skall vara positiv, bör vara minst 20% positiv jämfört med extraktionskontrollens värde (sälherpes). 245 I 6 Bilagor • Om endast en brunn av ett prov i duplikat blir positiv ska behörig utsvarare bedöma om provet ska svaras eller analyseras om. Om det finns tillräcklig mängd provmaterial kvar av ursprunget utföres en ny extraktion med efterföljande PCR-analys. Vid otillräcklig provvolym repeteras enbart PCR-analysen utan ny extraktion. 1. Om prov blir negativt i duplikat vid upprepad undersökning bedöms provet som negativt och besvaras så, om inhibitionskontrollen är OK. 2. Om prov blir positivt i duplikat vid upprepad undersökning bedöms provet som positivt och det erhållna genomantalet från denna analys besvaras, om inhibitionskontrollen är OK. 3. Om endast en brunn av ett prov i duplikat blir positiv vid upprepad undersökning och inhibitionskontrollen är OK, beräknas genomantalet i denna enstaka brunn. Därefter beräknas medelvärdet på genomantalen från de två analystillfällena. Medelvärdet besvaras. • Om negativa extraktionskontroller som extraherats parallellt med patientprov blir positiva måste patientprov som är positiva extraheras om. Negativa patientprov kan besvaras. • Om NTC för ett virus blir positiv måste positiva patientprov för detta virus analyseras om. Negativa patientprov kan besvaras. • Om patientprovets inhibitionskontroll blir negativ måste prov om möjligt extraheras om för att sedan analyseras på nytt. • Om acceptorn för ett virus blir negativ eller lägre än förväntat skall alla prov för detta virus analyseras om, ny extraktion är ej nödvändig. • Om acceptorn för ett virus blir högre än förväntat skall alla positiva prov för detta virus analyseras om, ny extraktion är ej nödvändig. Negativa patientprov kan besvaras. Prestanda Nedre detektionsgräns för alla virus i detta dokument: 200 genom/mL. Signifikant skillnad är > 3 gånger skillnad i koncentration jämfört med likadant provmaterial taget tidigare. 246 I 6 Bilagor Mätintervall Linjärt mätintervall: 1*103 genom/mL till 10*106 genom/mL. REFERENSER HSV-1: Schloss et al. An international external quality assessment of nucleic acid amplification of herpes simplex virus. Journal of Clinical Virology 28, 2003; 175-185. HSV-2: Malin Enbom et al. Detection of EBV, but not Human Herpesvirus 8, DNA in Cervical Secretions From Swedish Women by Real-Time PCR. Sexually Transmitted Diseases 2001 May; 28(5):300-6. Säl: G. J. J. Van Doornum et al. Diagnosing Herpesvirus Infections by Real-Time Amplification and Rapid Cilture. Journal of Clinical Microbiology Feb. 2003, p. 576-580. 247 I 6. Sexuellt överförbara infektioner (STI) 2:a upplagan 2009 Tidigare har i Infektionsdiagnostik-serien utgivits: I 1. Tarminfektioner, SBL-tryck 123-1990 2:a uppl 2002, SMI-tryck 141-2002 I 2. Nedre luftvägsinfektioner, SBL-tryck 127-1991 2:a uppl 2005, I 3. Mykobakteriologisk diagnostik, SBL-tryck 134-1993 I 4. Bakteriemi-diagnostik, SBL-tryck 135-1993 I 5. Urinvägsinfektioner/bakteriuri, SBL-tryck 136-1993 2:a uppl 2000, SMI-tryck 129-2000 I 6. Sexuellt överförbara infektioner, SMI-tryck 101-1994 I 7. Ögoninfektioner, SMI-tryck 102-1994 I 8. Övre luftvägsinfektioner (ÖLI), SMI-tryck 103-1994 I 9. Infektioner i centrala nervsystemet (CNS), SMI-tryck 114-1997 I 10. Svampinfektioner, SMI-tryck 121-1998 I 11 Bakteriologisk diagnostik av infektioner i hud, mjukdelar, skelett och inre organ, SMI-tryck 147-2003 Tidigare har i Metodik-serien utgivits: M 1:2. Validering och rutinkontroll av steriliseringsprocesser inom svensk sjukvård, SMI-tryck nr 120-1998 M 2. Infektionsserologi (arbetsupplaga) M 3. Primär diagnostik av Salmonella, Shigella och Yersinia, SMI-tryck nr 127-1999 Denna skrift trycks och distribueras på särskild beställning via Mikrobiologiskt laboratorium Centrallasarettet 721 89 Västerås E-mail: [email protected] Tel: 021-17 34 92 Fax:021-17 59 26 ISSN 1400-3473 248