Spårning av enskilda molekylers diffusionstillstånd och
advertisement

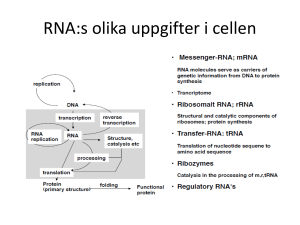
Spårning av enskilda molekylers diffusionstillstånd och övergångshastigheter i levande celler Tack vare ett nytt analysverktyg är det nu möjligt att kombinera information från tusentals korta förflyttningar bland enskilda molekyler av intracellulärt diffunderande proteiner. Metoden har redan bidragit till en objektiv interaktionskarta för Hfq-proteinet. En karta som visar ett antal nya diffusionstillstånd och övergångshastigheter. Ett sätt att öka kunskapen om kinetiken hos olika intracellulära processer är att observera svar på perturbationer (inducerade förändringar av biologisk funktion). Denna metod är kraftigt begränsad av svårigheterna med att inducera specifika perturbationer in vivo. En metod med större möjligheter är SPT (eng., single-particle tracking), där man följer enskilda partiklars förflyttningar. Med hjälp av SPT är det möjligt att följa enskilda proteinmolekylers förflyttningar i levande cellers membran och i cytoplasma. När de enskilda molekylernas bindningstillstånd förändras, förändras ofta diffusionsegenskaperna, vilket kan användas för att fastställa intracellulära reaktionshastigheter utan hjälp av några externa perturbationer. En utmaning med denna metod är dock att de enskilda intracellulära diffusionsbanorna som mäts med hjälp av fluorescensinmärkta fusionsproteiner sällan är längre än 100 ms. Samtidigt är det lätt att med hjälp av avancerade mikroskopitekniker samla in tiotusentals enskilda diffusionsbanor under bara några minuter. En annan utmaning är därför att kombinera informationen från tusentals korta molekylförflyttningar för att få fram antalet bindningstillstånd och hastigheten för övergångarna mellan de olika tillstånden. Forskarna har utvecklat en algoritm för att göra sådana analyser med tillförlitlig statistik och har implementerat metoderna i den fritt tillgängliga mjukvaran vbSPT (variational Bayes SPT). Forskarna på SciLifeLab testade metoden genom att spåra fluorescensinmärkt Hfq. Hfq är ett RNA-hjälpprotein som medierar genreglering efter transkriptionen genom att möjliggöra interaktioner mellan RNA och icke-kodande, små sRNA-molekyler. Eftersom mRNA antingen återfinns i fri form eller kopplat till andra makromolekyler, förväntade sig forskarna att hitta Hfq i bindningstillstånd med mycket olika diffusionsegenskaper. När man tillämpade vbSPT-analys på ett dataset som omfattade 12 130 förflyttningar från ett enda Hfq-spårningsexperiment på omkring tio E. coli-celler fick man fram en ”best-fit”modell med tre tillstånd med diffusionskonstanter på omkring 3 µm2 s−1, 0,7 µm2 s−1 och 0,2 µm2 s−1. För celler som har behandlats med antibiotikumet rifampicin (rif), i vilka RNA:t är nedbrutet, fick man fram en modell med två tillstånd med diffusionskonstanter som motsvarade de två snabbare tillstånden för obehandlade celler. Dessutom var den fraktion som hos de obehandlade cellerna utgjorde mellantillståndet, men som i de behandlade utgör det långsammaste tillståndet (0,7 µm2 s−1), betydligt mindre. Dessa tillstånd kan representera interaktioner mellan Hfq och olika RNA-varianter. Det långsammaste skulle kunna utgöras av Hfq bundet till RNA som transkriberas, medan minskningen av den långsammare fraktionen efter rif-behandling kan förklaras av det lägre antalet RNA-molekyler som finns tillgängliga för bindning. Omvandling från långsamt till snabbt tillstånd kan avspegla hastigheterna för Hfq:s dissociation från RNA och/eller RNAnedbrytning. Ingen av dessa parametrar förändras av rif-behandling. Användning av vbSPT för att skapa objektiva interaktionskartor för proteiner som Hfq ger ökade möjligheter att karaktärisera intracellulära processer baserat på spårningsinformation från enskilda molekyler. Referens Persson, Lindén et al. (2013) Extracting intracellular diffusive states and transition rates from single-molecule tracking data. Nature Methods Vol. 10 No. 3 265-269. Kontakt Johan Elf [email protected] I