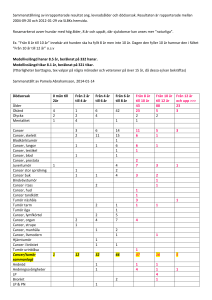
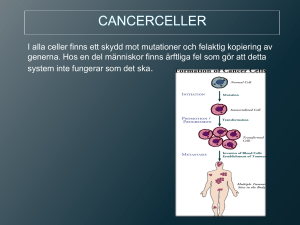
Document
advertisement

Håkan Olsson Tumör­ sjukdomar Studentlitteratur Kopieringsförbud Detta verk är skyddat av Lagen om upphovsrätt! Kopiering är förbjuden utöver lärares rätt att kopiera för undervisningsbruk enligt BONUS-avtal. BONUS-avtal tecknas mellan upphovsrättsorganisationer och huvudman för utbildningsanordnare, t.ex. kommuner och högskolor/universitet. Förbudet gäller hela verket såväl som delar därav och inkluderar lagring i elektroniska medier, visning på bildskärm samt bandupptagning. Den som bryter mot Lagen om upphovsrätt kan enligt 53 § åtalas av allmän åklagare och dömas till böter eller fängelse i upp till två år samt bli skyldig att erlägga ersättning till upphovsman/rättsinnehavare. Art.nr 3916 eISBN 91-44-10054-X Håkan Olsson och Studentlitteratur 1996 Omslagslayout: Kjeld Brandt Printed in Sweden Studentlitteratur, Lund Webbadress: www.studentlitteratur.se Tryckning/år 3 4 5 6 7 8 9 10 11 12 04 03 02 01 2000 Innehåll Introduktion 7 1 Historik 9 2 Vad är en malign och benign tumör? 11 3 Karcinogenes och tumörbiologi 17 Mekanismer bakom celldöd 24 4 Orsaker till cancer 34 Förvärvade risk/orsaksfaktorer vid cancer 34 Cancer och ärftlighet 58 5 Diagnostik, cancerklassificering, stadieindelning och utvärdering av terapi 88 Remissionsbegrepp 93 Diagnosmeddelandet till patient med tumörsjukdom eller hög risk för att drabbas av sjukdom 94 Viktiga punkter vid det onkogenetiska samtalet 97 Omhändertagande av familj med ökad disposition för tumörsjukdom 99 6 Cancerförekomst och registrering 103 Cancerförekomst i Sverige 104 EUs tio budord 106 7 Cancerdödlighet 107 8 Prognostiska och prediktiva faktorer 112 Exempel på en multivariat överlevnadsanalys (Proportionell hazard analys enligt Cox) 115 Nomenklatur för cytogenetik och DNA-flödescytometri 115 Kliniska korrelationer – cytogenetik/flödescytometri 116 © Studentlitteratur 3 9 Screening av tumörsjukdomar 119 10 Kirurgi vid tumörsjukdomar 124 Generell bakgrund 124 Exempel på operationsberättelse vid ovarialcancer 127 11 Cytostatikabehandling 129 Resultat 131 Exempel på cytostatikakort 132 Utveckling av nya kemoterapeutika 135 Resistensmekanismer vid cytostatikabehandling 135 Indelningen av cytostatika 136 12 Strålbehandling 139 Biologiska effekter av helkroppsbestrålning med röntgen eller gammastrålning. Strålningsolyckor 145 Radiojodbehandling 147 Blockering av tyreoideafunktionen 149 I-131 behandling av tyreoideacancer 149 P-32 behandling 152 Exempel på strålbehandlingskort 153 13 Hormonbehandling 154 14 Immunologisk behandling 156 Tumörer, cellyteantigen och immunitet 156 Immunologiska tekniker att behandla tumörer 158 Immunologiska behandlingsmetoder vid maligna tumörsjukdomar 160 15 Benmärgstransplantation/Stamcellsstöd 163 16 Akut onkologi 165 Trakea- eller bronkobstruktion/kompression 166 Vena cava superior syndrom 166 Avflödeshinder i urinvägar 167 Hinder i mag-tarmkanal – perforation 168 Hyperkalcemi 168 Hyperurikemi 169 Blodförgiftning 169 Intrakraniell tryckstegring 170 Skelettmetastaser – patologiska frakturer 170 Medullakompression 171 4 © Studentlitteratur Ascites 173 Perikardvätska 173 Pleuravätska 174 Blödningar 175 17 Cancerkakexi 176 18 Understödjande terapi 177 Tillväxtfaktorer som understödjande terapi/profylax inom onkologin 177 Smärtbehandling 180 Illamående och cytostatikabehandling 181 19 Rehabilitering, lindrande åtgärder och livskvalité 183 Krisreaktionens faser 183 20 Uppföljning av patienter 185 21 Något om de tio vanligaste tumörsjukdomarna hos män och hos kvinnor 187 Deras incidens, orsaker, symtomatologi, diagnostik, behandling, uppföljning och prognos 187 Prostatacancer 187 Lungcancer 189 Tjocktarm och rektum 192 Blåscancer 196 Hudcancer 198 Maligna lymfom (non-Hodgkinlymfom) 199 Magcancer 202 Njurcancer 203 Malignt melanom 205 Bröstcancer 208 Speciella former av bröstcancer 212 Tjocktarmscancer 213 Livmodercancer 213 Lungcancer 214 Äggstockscancer 214 Ändtarmscancer 217 Hudcancer 217 Malignt lymfom 217 Malignt melanom 217 Nervsystemets tumörer 217 © Studentlitteratur 5 22 Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns 220 Testistumörer 220 Hodgkins sjukdom 222 Trofoblastsjukdom 226 Analcancer 226 Livmoderhalscancer 227 Leukemi 228 23 Andra tumörsjukdomar med speciella behandlingar 230 Tyreoideacancer 230 Polycytemi 231 Tumörer i öron-näsa-halsregion 231 Pankreascancer 233 Mjukdelssarkom 234 Skelettsarkom 235 Myelom 235 24 Något om de vanligaste tumörerna och deras orsaker, tumörbiologi, symtomatologi, diagnostik, behandling, uppföljning och prognos hos barn 237 25 Aspekter på okänd primärtumör 246 Tumör från okänt origo 248 26 Genterapi och tumörsjukdomar 250 Mutation/genterapi 252 27 Utmaningar inför 2000-talet 255 Appendix 1 260 Referenslitteratur tumörsjukdomar, några exempel 260 Appendix 2 263 Formler för strålbehandling och biologiska stråleffekter 263 Appendix 3 264 Handläggningen av vissa vanligare hereditära cancerformer 264 Appendix 4 267 Exempel på genetiska evolutionsvägar vid några tumörformer 267 Sakregister 269 6 © Studentlitteratur Introduktion Handläggningen av patienter med elakartade tumörsjukdomar har genom­ gått en dramatisk utveckling de senaste 20–30 åren. Denna bok är baserad på ett kompendium som har utarbetats för att tjäna som bakgrundsdoku­ mentation vid problembaserad undervisning för både sjuksköterskor och medicine studerande. Boken har bara i begränsad omfattning enskilda avsnitt om speciella tumörsjukdomar och behandlar istället mer generella principer för deras orsaker, förebyggande, tumörbiologi, diagnostik och behandling. Doktorerna Stanislaw Garwics, Anita Gustavsson, Thomas Högberg, Elisabeth Kjellén, Torgil Möller, och Eva Cavallin Ståhl vid Universitets­ sjukhuset i Lund har bidragit med värdefulla synpunkter på enskilda avsnitt i denna bok. Mona Martinsson och Eva Henriksson vid Onkologiskt centrum och Onkologiska institutionen i Lund har gjort värdefulla insatser för illustrationerna i denna bok. Författaren © Studentlitteratur 7 1 Historik Elakartade tumörsjukdomar har varit kända mycket länge. Fornfynd av dinosaurier och tidiga människoskelett från Kina, Afrika och Sydamerika har visat att förhistoriska djur och människor sedan mycket länge har dött i tumörsjukdomar. Skelettfynd från Kina och Sydamerika (inkaindianer) har visat på förekomst av sarkom och melanom. Papyrusrullar har visat att bröstcancer var känt hos egyptierna. Att exempelvis nunnor hade en ökad risk för bröstcancer föreslogs redan vid slutet av 1700-talet. Med den ökade livslängden har antalet tumörsjuka kraftigt ökat, men även om man tar hänsyn till åldersförändringarna har en reell ökning av cancerförekomsten inträffat under den tidsperiod som cancerregister har funnits. Utslaget på hela befolkningen räknar man nu med att en av tre svenskar någon gång kommer att ha behandlats för en tumörsjukdom. Mellan olika kulturer och tidsperioder har panoramat av olika tumörsjuk­ domar skiftat. Definitionen av en elakartad tumör har ändrats under tidens lopp bl.a. beroende på nya diagnostiska instrument. Medan det tidigare var nödvän­ digt att utifrån makroskopisk vävnadsinspektion av stora tumörer fastslå om en elakartad tumör fanns, kan man nu med moderna molekylärbiologiska metoder i princip fastslå om en enda cell uppfyller malignitetskrav. Denna utveckling av diagnostiken gör att jämförelser av cancerförekomst mellan olika tidsperioder kan vara svåra att göra. Klassifikationen av tumörer är också i dynamisk förändring. Man kan t.ex. genom moderna immunhisto­ kemiska metoder lättare skilja ut histiogenesen vid lågt differentierade tumörer och påverkar genom detta den relativa fördelningen mellan olika typer av cancer. Tidig diagnostik vid flera tumörtyper har också medfört att sjukdoms­ stadiet vid diagnos blivit allt tidigare och med allt färre tumörer med metas­ tasering vid första diagnostillfället. Den ökande totalincidensen av tumör­ sjukdomar med en mindre ökning av totalmortaliteten har medfört en livlig debatt i forskarkretsar om behandlingsframstegens roll i relation till den ökande diagnostiken. Har vi blivit bättre på att behandla tumörsjukdomar generellt eller diagnostiserar vi fler icke-metastaserande tumörer? © Studentlitteratur 9 Kapitel 1 Tumörsjukdomarna utgör i ett folkhälsoperspektiv viktiga sjukdomar genom att de utgör den näst vanligaste dödsorsaken. Hos pojkar utgör tumörsjukdomar den vanligaste dödsorsaken. Hos kvinnor i åldersgrupper under 64 år dominerar tumörsjukdomar som dödsorsak. Vidare åstadkom­ mer sjukdomsgruppen ett mycket stort känslomässigt och fysiskt lidande. Tumörsjukdomarna fångar därför ständigt allmänhetens och massmedias intresse. 10 © Studentlitteratur 2 Vad är en malign och benign tumör? Elakartade tumörer beskrevs först som abnorma tillväxtprocesser som upp­ visade invasiv växt (respekterar ej normala barriärer och organavgränsningar) och som kunde ge upphov till dottersvulster (metasta­ ser). Invasiv växt och metastaserande sjukdom kunde påvisas initialt med inspektion och palpation. Den makroskopiska bilden kompletterades efter hand med en mikroskopisk bild av en invasiv och destruerande tillväxtpro­ cess, som ej respekterade normal tillväxtkontroll. Vävnaden uppvisade en mer eller mindre uttalad dedifferentiering. Senare har tillkommit metoder att med vävnadsprover (histopatologi/cytologi), röntgen, endoskopier och, med andra undersökningsmetoder som isotopundersökningar och NMR, säkrare och tidigt fastslå sjukdomsprocessers natur redan innan invasiv och metastaserande växt är etablerad. Genom att diagnostillfället successivt har flyttats tillbaka till mycket små tumörer kommer allt mindre vävnad att ligga till grund för bedömningen om en elakartad växt föreligger. Teoretiskt finns möjligheten att sätta diagnosen cancer på en enstaka cell genom att studera dess DNA-halt, genmönster och cytogenetiska förändringar. Cellproliferationen i en tumör måste skiljas från andra typer av celldel­ ning i kroppen såsom embryonal tillväxt, inflammationssvar, regeneration (ersättning av förlorade celler) och hyperplasi. Ett klart samband finns mel­ lan en vävnads förmåga till celldelning, dess differentiering och möjlighet att tumöromvandlas. Generellt är det lättare för en odifferentierad vävnad med hög celldelningshastighet att drabbas av mutationer och gå över i neoplastisk växt. Hos den vuxne individen kan vissa celler dela sig bättre än andra och viss vävnad har därför bättre regenerationsförmåga än annan. Celler med god delningsförmåga (labila celler) inkluderar hudepitel, slemhinneepitel och blodbildande celler. Körtelepitel, bindvävsceller och gliaceller kan vid behov dela sig (stabila celler) medan nervceller och mus­ kelceller betraktas som permanenta celler. Vävnad med god regenera­ tionsförmåga inkluderar bindväv, ben (frakturläkning), slemhinnor, kärl, hud och lever. Muskulatur har dålig regenerationsförmåga och nervceller saknar sådan. © Studentlitteratur 11 Kapitel 2 Med hypertrofi menar man en storleksökning av celler utan att cellantalet ökar medan storleksökningen vid en hyperplasi beror på ett ökat antal cel­ ler. Hypertrofin/hyperplasin kan vara dels kompensatorisk, dels bero på ett ökat arbetskrav på cellen eller vara hormonellt betingad. Metaplasi uppträder om en mogen celltyp ersätts av en annan mogen celltyp. Detta ses t.ex. i bronkialslemhinnan (skivepitelmetaplasi), liv­ moderkörtelepitel (skivepitelmetaplasi) och ventrikelslemhinnan (intesti­ nal metaplasi). En tumörbildning i form av neoplasi karakteriseras av en nybildning av celler med, på cellnivå nedärvd, rubbad tillväxtkontroll och i varierande grad avvikande eller defekt differentiering. Dessa abnorma egenskaper i cellen kvarstår i regel efter att de tumörframkallande fakto­ rerna upphört att verka. Den neoplastiska tillväxtprocessen är bristfälligt koordinerad, dåligt kontrollerad och onyttig. Cellnybildningen är ofta obe­ gränsad i tiden. Medan den normala celldifferentieringen sker via aktive­ ring och inaktivering av strukturella gener, har tumörcellen mutationer och uppvisar funktionsrubbningar. Olika grad av dedifferentieringen i en tumör är uppenbar. Om dedifferentieringen är uttalad benämns denna anaplasi. Cellproliferation, där enstaka celler ännu inte invaderat vävnad och ej heller gett upphov till dottersvulster, men som har karaktär av cancerceller, benämns cancer in situ (preinvasiv cancer), se figur 5.4. Hud, livmoderhals, bröst, stämband, bronkialslemhinna och tjocktarmsslemhinna är vanliga lokaler för cancer in situ. En dysplasi utgörs av atypier i ett proliferativt epitel som är mindre utta­ lat än vid cancer in situ. Cancercellens morfologi karaktäriseras av en relativt stor kärna och mindre cytoplasma (hög kärn/plasmakvot), se figur 5.3. Kärnan är hyper­ kromatisk med stor(-a) nukleol(-er) och ofta med mitoser som ej sällan är atypiska. Ibland är cellen flerkärnig med pleomorfism och basofil cyto­ plasma som tecken på ökad RNA-mängd. Den grundläggande uppfattningen om tumöruppkomst är att genetiska förändringar i cellens kärna föregår tumörtransformeringen och att denna process startar i en enda cell som sedan delar sig i nya genetiskt identiska celler, s.k. monoklonal tillväxt (se figur 2.1). Denna klonala växt resulterar i en oberoende evolutionsprocess på somatisk cellnivå som inbegriper nya mutationer och naturligt urval så att cellen får en överlevnadsvinst gent­ emot andra celler. Ackumulationen av mutationer får till resultat att malig­ nitetsutvecklingen sker stegvis och leder till att en tumörcellspopulation som till en början varit homogen blir heterogen, s.k. tumörheterogenitet. Tumörprocessen leder till inaktivering av tumörsuppressorgener, aktivering av protoonkogener och inaktivering av antimetastasgener (de somatiska och 12 © Studentlitteratur Vad är en malign och benign tumör? 47 47 47 47 47 47 Initiering av tumör 47 47 47 47 48 48 47 46 47 47 47 47 46 46 N 46 46 46 46 46 46 46 46 46 46 46 46 46 46 46 46 46 46 92 92 92 Figur 2.1 Klonal utveckling av tumör. Utvecklingsschemat är kraftigt förenklat med tidsavsnitt överhoppade av illustreringsskäl. Tumören initieras i en enda cell och denna cell delar sig i nya identiska kopior. Under utvecklingen uppstår en genetisk diversifikation pga. selektionstryck, dvs. tumören blir heterogen och den genetiska bilden och funktionen av olika delar av en tumör blir olika. Chansen ökar att en viss klon kan utveckla resistens mot behandlingen. Siffrorna inom celle­ rena anger kromosomtal. (Bilden har bearbetats från Frei III E., Oncology, Pathobiology, Medicine, Scienti­ fic American, 1992) hereditära genförändringarna vid tumörsjukdomar diskuteras i detalj senare). Sjukdomsprocessen är framför allt detekterbar genom defekter i terminal differentiering, defekter i tillväxtkontroll och resistens mot cyto­ toxicitet. Elakartade tumörer visar ofta abnormiteter på många plan av cellens reg­ lering alltifrån kärna, cytoplasma till cellmembran. Abnormiteten i kärnan kan spåras som avvikande DNA-halt, klonala kromosomaberrationer, histo­ patologisk atypi, genamplifiering etc. Balansen mellan stimulerande och hämmande tillväxtfaktorer är störd och kan påvisas av ökad/minskad © Studentlitteratur 13 Kapitel 2 mängd av tillväxtfaktorer och dess receptorer. Signalsamspelet mellan olika celler störs likaså med resultat att cellen blir mer oberoende av normalt tillväxtreglerande mekanismer och lättare invaderar och metastaserar. Pro­ teinsyntesen kan vara förändrad, antigenstukturer förändrade och en grad­ vis förlust kan ha skett av modercellens enzymmönster. Metabolismen är väsentligen glykolytisk och anaerob. Ibland förekommer ektopisk hormon­ produktion (s.k. paraneoplastiska syndrom). Exempelvis producerar ibland njurcancer parathormonliknande substanser, fibrosarkom insulinliknande substanser och bronkialcancer ACTH och antidiuretiskt hormon. Tumörer kan vara mer eller mindre lika sin ursprungsvävnad. Högt diffe­ rentierade tumörer liknar mycket sin ursprungsvävnad medan lågt differen­ tierade tumörer har tappat mycket av likheten och ibland även uppvisar embryonala karakteristika för celler av olika vävnadstyper. Olika block av differentieringsprocessen kan påvisas. Normala celler brukar vid regenera­ tion av vävnad uppvisa kontaktinhibition, dvs. de upphör att dela sig när de når kontakt med varandra. Hos maligna tumörceller upphör denna förmåga. Den programmerade celldöden (s.k. apoptos) är störd och tumörvävnaden kan genomgå ett mer obegränsat antal celldelningar. Karaktäristisk för en elakartad tumör är också förmågan att växa vid transplantation till nakna möss (mustyp som saknar T-cellsförmedlad immunitet). Godartade tumörer respekterar vid sin växt ofta ursprungsorganet, upp­ visar ej invasiv växt och omges ofta av en kapsel. Tillväxten, som är långsam, avstannar efter ett tag och metastaser utvecklas ej. Tumören inträ­ der i en stationär fas eller regredierar och genomgår mer sällan en process mot malignisering. Vid benigna tumörer uppvisar cellerna stor anatomisk likhet med ursprungsvävnaden och dess celler är högt differentierade. Van­ ligen föreligger ingen allmänpåverkan på patienten. Ibland kan dock sekun­ dära komplikationer eller tumörens lokalisation leda till att allmänpåverkan uppstår. Överproduktion av hormoner kan ibland också leda till symtom. Vid cytogenetiska studier har man funnit att flera godartade tumörer uppvi­ sar klonala kromosomförändringar. En homologi från en ursprungsvävnad finns i de gener som är engagerade vid en benign respektive malign tumör. Vid benign tumör är dessa förändringar mycket små medan de cytogene­ tiska förändringarna ofta är omfattande hos den maligna tumören. De gener som ofta är engagerade vid tumöromvandling i en vävnad är de gener som styr tillväxten och differentieringen av denna vävnad. Aktiveringen av dessa gener vid fel tidpunkt i livet kan leda till tumöromvandling. En tumör har genomgått mellan 30–40 generationer av celldelningar innan den upptäcks (se figur 2.2). Snabbväxande tumörer kännetecknas av att andelen celler i celldelning är stor medan andelen celler som dör är liten. 14 © Studentlitteratur Vad är en malign och benign tumör? 16 Diameter, cm Antal celler, billioner 8 2 4 0,5 1 1,0 0,5 0 10 20 40 60 80 Antal celldelningar Figur 2.2 Tumörtillväxt i relation till antalet celldelningar. Om tumören diagnosti­ seras tidigast när den uppnått 0,5 cm har tumören redan genomgått 30–40 celldel­ ningar och om behandlingen ej är effektiv avlider patienten efter ytterligare 20–30 celldelningar (i ungefär 1 kg tumör). En annan del av tumören har celler som ligger i vila (s.k. G0-celler). Hos långsamt växande tumörer finns en större andel celler som är programme­ rade att dö. En tumörs växt kännetecknas av att den ofta följer den Gompertzka tillväxtkurvan (se figur 2.3). Denna kurva visar, vid mycket små tumörer, initialt en långsam tillväxt (före detektion) som ökar och senare följer ett exponentiellt mönster för att, mot slutet, återigen minska. Följande är ett hypotetiskt exempel från en experimentell tumör på dubb­ leringstid, cellcykeltid och tillväxtfraktion i relation till tumörålder. Hypotetisk tumörålder Dubbleringstid (DT) Cellcykeltid Tillväxtfraktion (TF) 30 4 0.8 80 60 8 1.0 65 90 16 1.2 30 120 dagar 100 dagar 1.6 dygn 10 % Efter att en tumör diagnostiserats ökar dess dubbleringstid ganska mycket medan dess cellcykeltid förblir ganska konstant. Att dubbleringstiden ökar beror framför allt på att tillväxtfraktionen bland cellerna kraftigt minskar (celldöden ökar). © Studentlitteratur 15 Kapitel 2 Tumörvolym Tid Figur 2.3 Den Gompertzka tillväxtkurvan för en tumör. Cellcykeltiden är som regel inte kortare i tumörer. Tvärtemot finner man ofta i tumörer en lång cellcykeltid. Akut myeloisk leukemi uppvisar cell­ cykeltider på 80–84 timmar medan normal benmärg har cykeltider på 18 timmar. Kronisk myeloisk leukemi uppvisar ännu längre tider – ungefär 120 timmar. Cancersjukdomar generellt brukar uppvisa cellcykeltider på 190–250 timmar. Att en större andel celler läggs i vilofas hos en större tumör och att både strålterapi och kemoterapi framför allt påverkar icke-vilande celler har gjort att man vid behandlingen strävat efter att antingen hitta tumören så tidigt som möjligt eller reducera tumörvolymen maximalt på kirurgisk väg innan strål- eller kemoterapi satts in. Detta görs för att få så många celler som möjligt i aktiv cellcykel. Under en malign tumörs utveckling sker ofta en successiv, i regel irrever­ sibel, förändring av dess egenskaper (progression). Så övergår t.ex. ett högt differentierat adenokarcinom i en anaplastisk cancer, ett astrocytom blir ett glioblastoma multiforme, en hormonkänslig tumör blir hormonresistent eller en tumör som serietransplanteras i ett djur får ökad malignitetsgrad. 16 © Studentlitteratur 3 Karcinogenes och tumörbiologi Tumörer uppstår i de allra flesta fall från en cell (monoklonal tumör). Detta karakteriserar framför allt tumörer som uppstått av strålning och kemiska ämnen. I enstaka fall kan tumörsjukdomen uppstå samtidigt i flera celler (polyklonal tumör). Detta ser man ibland hos virusinducerade tumörer. Ämnen som igångsätter utvecklingen av en tumör och som själva enbart kan skapa tumören kallas initiatorer (t.ex. vissa kemikalier, joniserande strålning). Teorin om den klonala utvecklingen av maligna tumörer har fått starkt stöd genom studier av expressionen av X-bundna gener vid cancer hos kvinnor. Dessa studier visade att endast gener från den ena X-kromo­ somen uttrycktes i en tumör. Nuvarande uppfattning är att cancer genom en mutation, där en genetisk skada åstadkoms, leder till en genetiskt förändrad cell som äger förmåga att föröka sig. Alla mutationer leder dock inte till cancerutveckling. Cellen kan dö eller lägga sig i vila efter att en genetisk skada uppstått. Alla karcino­ gena faktorer verkar ej heller via mutationer. Exempelvis kan man tänka sig att kemiska faktorer påverkar cellmembran och cellens benägenhet att ta upp andra karcinogener. Trots detta kan man fastslå att de flesta karcinoge­ ner också är mutagener. Ytterligare en rad bevis finns för att cancerutveck­ lingen startar med en mutation i cellkärnan. Till dessa räknas att defekter i DNA-reparationsenzymer är kopplade till en ökad risk för tumörsjukdom, att metabolisering av en del karcinogener till en mutagen form ibland är nödvändig för dess cancerskapande effekt, att kromosombrottstillstånd är associerade med en ökad förekomst av cancer och att uppträdandet av can­ cer i familjer med en hereditär bas till sin sjukdom är associerat med muta­ tioner i könsceller. Initieringsfasen av en tumörsjukdom börjar oftast i en stamcell. Initie­ rande faktorer skiljer sig från faktorer som påverkar den efterföljande tumörpromotionen på flera plan. Medan initieringen av tumörsjukdomen sker genom en mutation, åstadkoms promotionen oftast av att genuttrycket modifieras och/eller att cellproliferationen ökar. Initieringsprocessen, som ofta består av ett enda steg, är irreversibel till skillnad från promotorernas © Studentlitteratur 17 Kapitel 3 effekt (flera steg). Durationen av exponeringen vid initieringen är kort till skillnad från promotionen. Vidare finns ingen tröskelnivå för exponeringen vid initieringen, medan promotionen har klar tröskelnivå. Andra viktiga skillnader mot promotionsfaktorer är att initierande faktorer kan vara svå­ rare att undgå exponering för, faktorerna verkar additativt och är ofta gömda. Exempel på initierande faktorer är exponering för joniserande strål­ ning och alkylerande kemikalier. Till promotionsfaktorer räknas ofta hor­ monexponeringar och kostfaktorer (t.ex. fett i kost). Cigarettrök innehåller både initiatorer och promotorer. Om man använder experimentellt fram­ kallad hudcancer som modell kan man visa att enbart applicering av en ini­ tiator på huden inte leder till tumörutveckling om denna inte åtföljs av exponering för en promotor. Promotorexponeringen kan vara sen, dvs. min­ net av initieringen kan återuppväckas sent och initieringen kvarstår som ett irreversibelt steg. Om promotionen sker före exponeringen för initiatorn, sker ingen tumörutveckling. Enbart exponering för promotorn är ej heller tillräckligt för att en tumör skall utvecklas. Promotorer är, som tidigare påpekats, faktorer som kan underlätta framväxten av tumörsjukdom, men som ej själva kan skapa tumörtillväxten (t.ex. kostintag av fett, hormoner). Oftast föregår initiatorerna promotorerna men ett väsentligt undantag kan utgöras av hormoninducerade tumörer. Här tror man att t.ex. hormoner (som promotorer) ökar celldelningen, för att efterföljas av initiatorer som muterar stimulerade celler som senare igång­ sätter cancerutvecklingen. Promotorer skulle alltså kunna föregå initie­ ringen vid hormonberoende tumörer, men detta utesluter inte att en promo­ tion också kan ske efter initieringen. En vävnads känslighet för canceromvandling sammanfaller med celldel­ ningshastigheten (organtillväxten) i detta organ vid en given tidpunkt. Exempelvis verkar bröstvävnaden uppvisa stor känslighet för cancerom­ vandling i åldersgruppen 10–25 år. Olika vävnader uppvisar dessutom olika benägenhet för att utveckla tumörer, t.ex. är bröstet exceptionellt genom att det utgör ursprung för 25 % av alla maligna tumörer hos kvinnan trots att organet står för en relativt begränsad totalvolym av kroppen. Människans samband med bröstcancer är unikt, då inget annat djurslag närmar sig män­ niskans benägenhet för att utveckla maligna tumörer i brösten. I homologi med bröstcancer kan ett liknande resonemang föras över mannens stora benägenhet för prostatacancer. Vävnad med hög celldelningshastighet har också kortare latenstid för tumörutvecklingen än vävnad med lägre hastighet i celldelningen. Kortaste latenstiden uppvisar tumörer från blod (t.ex. 0.5–10 år), medan solida tumörer ofta kan ha latenstider på 20–40 år. Kunskap om olika latenstider 18 © Studentlitteratur Karcinogenes och tumörbiologi har framför allt erhållits vid studier av patienter som exponerats för jonise­ rande strålning och senare utvecklat tumörsjukdom. En cancerutveckling är ofta en flerstegsprocess och multifaktoriell. Med ledning av cancerincidensens relation till ålder hos människan har man beräknat att ungefär fyra till sex kritiska, oberoende genetiska förändringar, är involverade vid cancerutveckling. Generellt är äldre människor känsligare för tumörinduktion än yngre. Vissa undantag finns från detta, t.ex. bröstcancer, lungcancer och vissa gynekologiska tumörer. För de flesta epiteliala tumörer kan incidensutveck­ lingen beskrivas av formeln I = kt4, dvs. incidensen (I) följer åldern (t) upp­ höjt till fyra. De reproduktiva tumörerna utgör här ett undantag (se figur 3.1). Alla maligna tumörer Incidens/100 000 Män Bröst Incidens/100 000 100 Kvinnor 1000 Kvinnor 100 10 Män 1 0,1 10 0 20 40 60 80 Prostata 0 0–34 40 10 1000 60 80 År Testis 100 10 1 1 0,1 0–34 40 60 80 0 0–34 40 60 80 År Figur 3.1 Incidenskurvor i relation till ålder för alla tumörsjukdomar samman­ slagna, bröstcancer, prostatacancer och testikelcancer. Tumörsjukdomar som drab- bar vissa reproduktiva organ som testis och bröst (kvinnor) avviker från totalbilden i incidens genom en ganska tidig debutålder. Bilden är hämtad från H. Olsson Reproductive and hormonal factors in relation to cancer occurrence in the breast, prostate, testis, uterine corpus, ovary, uterine cer­ vix and thyroid gland. In: Cancer and Aging, Eds. Maciera-Coelho A, Norden­ skjöld B. CRC Press. 1990, sid. 109–126. © Studentlitteratur 19 Kapitel 3 Som tidigare påpekats kännetecknas en elakartad tumör av invasiv växt och metastaserande förmåga. Denna makroskopiska definition har alltmer för­ ändrats i och med att tumörsjukdomar hittats i allt tidigare skede. Genom att studera en enda cell (DNA-innehåll, cellkärnestruktur eller kromosombild) kan man numera, med stor sannolikhet, fastslå att en tumörsjukdom förelig­ ger. Andra kännetecken för en tumörcell inkluderar oförmåga till kontaktin­ hibition (slutar ej växa vid cell-till-cellberöring) och växt hos nakna möss. Tillväxten av en tumör på en lokal brukar följa den Gompertzka tillväxt­ kurvan med en, till en början, snabb exponentiell tillväxt som sedan avtar (se figur 2.3). I absoluta tal är tillväxten av en tumör störst när den uppnått ungefär hälften av sin maximala storlek. Fraktionen celler i tillväxt faller dock under tiden samtidigt som tumören närmar sig maximal tillväxt. Metastasering kan ske när som helst under primärtumörens utveckling och man räknar med att spridning kan ha skett till en viss procent även vid mycket små tumörer. Den bakomliggande tanken är att kunna identifiera denna riskgrupp av patienter för att kunna ge adjuvant generell behandling (t.ex. genom cytostatika). Omkring 30 % av alla tumörpatienter uppvisar metastaser (om man exkluderar hudcancer som inte är melanom) vid primärtumörens diagnos. Ytterligare 20 % har ockult metastasering. Sannolikheten för metastaser ökar med tumörens storlek, låg differentieringsgrad, hög celldelning och om metastasering redan skett. Ett kort recidivfritt intervall ökar också ris­ ken för fler metastaser. Ett recidiv av sjukdom lokalt behöver inte nödvän­ digtvis innebära en generalisering av sjukdomen. Det har också visats att metastasering till ett särskilt organ beror på icke slumpmässiga faktorer och att exempelvis, vid malignt melanom, en särskild klon av tumören metasta­ serar till hjärna, en annan klon till hud etc. För att åstadkomma metastase­ ring i djurförsök, har betydelsen av att ursprungsorganet för tumören har skadats och/eller, att tillväxtfaktorer för detta organ aktiverats, visats. Man kan t.ex. genom att operera bort ena njuren hos en mus och ympa in tumör­ celler under njurkapseln vid den kvarvarande njuren åsamka en metastase­ ring till lungor. Detta skulle inte ha skett eller varit svårare om båda nju­ rarna lämnats kvar. Cellcykeln indelas normalt i G1-, S-, G2- och M-fas. Under S-fasen (c:a 12–14 tim.) sker syntes och fördubbling av DNA. Under G1-fasen (10–50 tim.) sker förberedelser till syntesen och G2-fasen (2–4 tim.) karakteriseras av att DNA ordnas i kromosomer. Under M-fasen (1–2 tim.) sker cellens mitos. G0 brukar man benämna cellens vilofas (se figur 3.2). 20 © Studentlitteratur Karcinogenes och tumörbiologi S G1 Gap 1. Förberedelser för DNA-syntes S DNA-syntes, DNA-mängd dubbleras G2 Gap 2. DNA ordnas i kromosomer M Celldelning, M = mitos G0 Vilofas G2 G1 M Utdifferentiering Celldöd G0 Figur 3.2 Cellcykeln. Från denna fas kan celler mobiliseras in i cykeln för celldelning. I en tumör sker störst celldelning i de bäst syresatta områdena (de perifera delarna), medan centrum av tumören med mer anaerob metabolism uppvisar mer tendens till celldöd och fler celler som ligger i vila. Det har också visats att pro­ liferationen är högre ju närmare ett blodkärl man kommer. Andelen celler i cellcykeln kan uppskattas t.ex. genom att man räknar mitoser, genom tymi­ dinmärkning och genom att man uppskattar S-fasen med flödescytometri. För att en tumör kliniskt skall upptäckas behöver den genomgå åtmins­ tone 30 celldelningar och bestå av ungefär 109 celler (1 cm3) (se figur 2.2). Tumörtillväxten kan stimuleras både genom autokrina (cell gör egna tillväxtfaktorer), parakrina (närbelägna celler stimulerar varandra) och endokrina mekanismer (celler stimulerar genom fjärreffekter t.ex. blod­ bundna). Tumörens stroma (bindväv, blodkärl etc.) har befunnits vara allt viktigare för tumörväxten. Ett karakteristikum för tumörens egna kärl är att de består av enbart kapillärer och saknar artärers olika vägglager. Metastaseringsprocessen involverar en rad skeenden såsom t.ex. invasion ut i vävnaden och växt bortom primärtumor, bildandet av nya växtkolonier samt tillväxt av den metastatiska kolonin. Vid invasionen ut i vävnaden utnyttjar tumörcellen olika enzymer (framför allt proteaser). Exempel på viktiga enzymer är kollagenaser, katepsiner, plasminogenaktivatorer, hyalu­ ronidas, heparinas och förlust av inhibitor till metalloproteinas-2. För inva­ sion och växt bortom primärtumören är vidare cellmotilitet och möjlighet © Studentlitteratur 21 Kapitel 3 att invadera in i kärl viktigt. Tumörcellerna måste sedan överleva i cirkula­ tionen. Det räcker inte med att tumörceller påvisas i cirkulation för att metastasering skall ske. De flesta tumörceller dödas i cirkulationen av cir­ kulerande immunceller och överlever alltså mycket kort tid. Endast en mycket liten fraktion av tumörceller har förmåga att bilda metastaser. Den genetiska instabilitet som kännetecknar en metastaserande cell är slump­ artad och oförutsägbar. Faktorer som kan öka aggregation av tumörceller kan också öka dess metastaseringsförmåga. Till sådana faktorer räknas lym­ focyter som inte kan döda tumörceller och faktorer som ökar koagulation. Modifierade membranreceptorer kan styra en tumörcell till specifika metas­ taseringslokaler. Adhesions- och extravaseringsmekanismer måste fungera för att endotel skall ge vika för en tumörcell. Vidare måste extra­ cellulärmatrix kunna digereras. För att en framgångsrik metastasering skall ske måste både frö och jordmån vara den bästa (den s.k. seed and soil theory). Metastaserade kloner uppvisar dessutom en utpräglad förmåga att ge upphov till nya metastaser. Olika metastaseringsvägar finns dessutom. Tumörspridningen kan ske genom direktspridning (per continuitatum), genom intrakavitär spridning (t.ex. i pleura, blåsa, bukhåla), genom implan­ tation (t.ex. vid operation) och genom lymfatisk eller hematogen spridning. En gammal huvudregel har varit att karcinom företrädesvis uppvisat lymfo­ gen spridning och sarkom hematogen spridning. Det finns dock många kar­ cinom som tidigt visar hematogen spridning, det är då ofta lever och lunga som är sekundära metastaslokaler. Spridning inom bukhålan är vanlig vid kolonkarcinom och ovarialcancer. I centrala nervsystemet sprider sig medulloblastom och ependymom ofta via cerebrospinalvätskan efter att tumör penetrerat in i ventriklar. Vissa tumörer visar ofta en uttalad invasion av vener. Detta gäller t.ex. njurcancer och levercancer. Kärlsystemets anatomi kan också vara av bety­ delse för metastaslokaler. Kärlnybildning i tumörer kan ha en stor betydelse vid metastaseringspro­ cessen. Stimulerande och hämmande kärltillväxtfaktorer som angiostatin har karakteriserats och djurmodeller har beskrivits som uppvisar likheter med paradoxala kliniska situationer hos människan där operationer av pri­ märtumör har lett till att metastaseringsprocessen har accelererats. För när­ varande finns ett mycket stort intresse att farmakologiskt modifiera inflytan­ det från kärltillväxtfaktorer vid tumörterapi. Mycket talar för att inte enbart tumörens lokalisation eller dess naturliga venösa dränage förklarar dess distribution av metastaser. Vissa tumörer har en inneboende förkärlek att metastasera till vissa lokaler. Exempelvis metastaserar prostatacancer oftare till skelett, njurcancer till lunga och 22 © Studentlitteratur Karcinogenes och tumörbiologi melanom till hjärna. Vissa organ som skelettmuskulatur, thymus och mjälte uppvisar mycket sällan metastaser. Det är oklart varför det är så. Även om de flesta tumörtyper har potential att metastasera, uppvisar basalcellscancer mycket sällan metastaser och gliom sätter i princip aldrig dottersvulster utanför centrala nervsystemet. Ännu har ingen speciell gen hittats som är ansvarig för metastasering. Expressionen av en gen, nm23, har uppvisat korrelationer till metastase­ ringsförmåga hos djurtumörer och bröstcancer hos människa. Dess defini­ tiva roll är dock ännu oklar. De genetiska abnormiteter man ser i en tumör kan principiellt vara av tre slag: 1. primära abnormiteter som är av vikt för tumörens initiala etablering och utveckling; 2. sekundära abnormiteter som är av vikt för tumörens progression och fortsatta växt; 3. slumpmässiga abnormiteter som beror på tumörens genetiska instabilitet och som inte direkt har någon funktion. Två typer av normala regulatoriska gener, dels de tillväxtstimulerande pro­ toonkogenerna och dels de tillväxtinhiberande suppressorgenerna, är de huvudsakliga måltavlorna för den/de genetiska skada(-or) som driver can­ cerutvecklingen. Nyligen har tillkommit en tredje grupp av gener som har stor betydelse för cancerutvecklingen, de s.k. mutatorgenerna eller DNA mismatch repair-generna. Mutationer i dessa gener leder till en ökad gene­ tisk instabilitet. En utförligare diskussion av mutatorgenerna kommer att ske under framför allt avsnittet om hereditär koloncancer. Bland de identifierade genprodukterna för protoonkogener finns tillväxtfaktorer, receptorer för tillväxtfaktorer, membranprotein, steroidre­ ceptorer och andra proteiner som reglerar funktioner i cellkärnan. I princip uppvisar varje human malign tumör som hittills analyserats multipla genetiska förändringar med både aktivering av flera onkogener och förlust av två eller flera suppressorgener. Cancerprocessen börjar med en mutation i en somatisk cell (vid ärftliga cancerformer har en mutation redan tidigare inträffat och finns i könscell). Ytterligare mutationer kan ske som leder till aktivering av tillväxt­ befrämjande onkogener och/eller inaktivering av tumörsuppressorgener. Summan av detta blir att förändrade genprodukter uttrycks och att en för­ lust sker av regulatoriska genprodukter. Detta leder till klonal expansion, ytterligare mutationer (progression) och tumörheterogenitet och att en malign tumör kan diagnostiseras. © Studentlitteratur 23 Kapitel 3 (Under avsnittet om cancer och ärftlighet diskuteras mer ingående onko­ gener och suppressorgener.) Mekanismer bakom celldöd Flera olika mekanismer kan ligga bakom att en cell dör. Varje organism och dess vävnad har en på förhand bestämd livstid. Ett visst antal celldelningar kan genomgås varefter vävnaden dör. En människa har en maximal livs­ längd på ungfär 110 år, medan musens motsvarande maximala livslängd är 3,5 år. Embryonala fibroblaster hos människan kan dela sig 50 (+/–10) gånger, medan musens embryonala fibroblaster endast kan dela sig 14–25 gånger. Tar man ut celler från en äldre individ och jämför med en yngre visar det sig att den äldre individens celler delar sig ett mindre antal gånger in vitro. Således föreligger ett visst samband mellan en speciesspecifik livs­ längd och cellers förmåga att dela sig in vitro. Men bilden är inte lika klar om man tittar på andra djurslag. Uppfattningen att den inneboende celldelningsförmågan är relaterad till livslängden hos människan har fått ökat stöd av att en sjukdom med kliniska tecken på för tidigt åldrande, Wer­ ners syndrom (autosomalt recessiv nedärvning), också uppvisar en kraftigt reducerad kapacitet för celldelning in vitro. Genen för detta syndrom har nyligen klonats och syndromet har rönt speciell uppmärksamhet då patien­ terna bl.a. uppvisar en ökad incidens av mjukdelstumörer. Tumörceller och transformerade celler uppvisar till skillnad från normal­ vävnad en indefinit kapacitet för celldelning. Enligt en hypotes beror skillnaden mellan tumörceller och normala celler i deras åldrande på att normala celler med ökad ålder får en förkortning av kromosomerna i riktning från telomer och inåt vid celldelningar. Enzymer, telomeraser, motverkar detta och tumörceller kan helt eller delvis skydda sig mot kromosomförkortningar genom telomeraser. Man studerar nu om telomerasinhibitorer skulle kunna vara viktiga inom tumörterapin. Hos en vuxen människa ersätts varje minut 300 miljoner celler. Apoptos är en fysiologiskt reglerad celldöd (programmerad celldöd), som pågår i den multicellulära organismen och kännetecknas av att enskilda celler dör och undanskaffas genom fagocytos. Detta sker utan att den normala vävnadens arkitektur eller funktion störs och utan att någon inflammations­ bild initieras. Processen definierades initialt morfologiskt men apoptos har nu vidgats till att betyda en väg för celldöd. Apoptos förekommer både under normal utveckling embryonalt och senare i livet som under sjukdom, t.ex. tumörväxt. Vid organutveckling och regression av vävnad förekommer 24 © Studentlitteratur Karcinogenes och tumörbiologi apoptos. Hormonellt styrda organ som bröst, endometrium och prostata uppvisar apoptos och i processer i immunapparaten, t.ex. selektion av immunkompetenta kloner och reglering av inflammationssvar, är apoptos en integrerad komponent. För förståelse av mekanismer bakom tumörbio­ logi och tumörterapiassocierad celldöd är det uppenbart att det finns apop­ tosmekanismer som är viktiga och ofta störda. Förhoppningen är att ökad kunskap inom området kan leda till allt mer specifik och effektiv terapi. Både lösliga faktorer, cell-till-cellinteraktion och cell-matrixinteraktion är viktiga för apoptosens reglering. En skillnad finns å andra sidan i reglering av apoptosen mellan fibroblaster och endotel/epitel. Hos fibroblaster betyder matrixkontakten/matrixkomposition i kontakt med cellen mindre medan den är essentiell för epitel och endotel. Detta har naturligtvis med fibroblastens fysiologiska roll, att i alla skeenden överbrygga vävnadsskador med ärrväv­ nad att göra. DNA-digestion genom endonukleaser är vanliga vid apoptos. Celldöd i en vävnad genom nekros är till skillnad från apoptosen alltid en sjukdomsprocess. Cellerna utövar en mer passiv roll när de förstörs och intracellulärt innehåll, som initierar en stor inflammation, frisätts. Nekrosen involverar typiskt närliggande celler och vävnadsarkitekturen är till stor del förstörd. En rad gener som stimulerar eller hindrar apoptos har nyligen blivit kända. Den mest kända faktorn är p53-genen som vid DNA-skada både inducerar cellcykelarrest i G1-fasen (för att möjliggöra DNA-reparation) och som annars, om reparation ej är möjlig, tillsammans med c-myc stimu­ lerar apoptos. Det första proteinet, som man fann som skyddade mot apop­ tos, var Bcl-2. Induktion av Bcl-2-genen är ofta essentiell för att förhindra apoptos. En homodimer av proteinet bax (bax-bax) stimulerar till apoptos och genom att Bcl-2 binder sig till en heterodimer (bax-bcl-2) förhindras apoptos. Ett annat protein som skyddar mot apoptos är abl. Vid kronisk myeloisk leukemi har en fusionsgen uppkommit genom att abl-genen fusionerats och aktiverats med bcr-genen och på så vis hålls leukemi­ cellerna konsitutivt i celldelning utan celldöd. Andra inducerare av apoptos inkluderar steroider, antikroppar, proteaser, onkoprotein (c-myc) och cyto­ toxiska faktorer (cytostatika, joniserande strålning). För det första är inte p53 essentiellt för en normal utveckling. Det är endast om celler utsätts för DNA-skada som p53-mekanismen blir viktig för att reparera celler eller inducera apoptos och undgå neoplasi. All celldöd genom apoptos styrs inte genom p53. Hos T-celler kan exempelvis gluko­ kortikoider åstadkomma apoptos genom att glukokortikoidreceptorer indu­ cerar gener som stimulerar till apoptos, vidare kan en immunologiskt styrd induktion av apoptos av T-celler medieras av generna nur77 och c-myc. Om © Studentlitteratur 25 Kapitel 3 T-cellen emellertid utsätts för joniserande strålning styrs apoptosen av p53 (se figur 3.3a). I tarmen sker en kraftig cellregeneration genom medverkan av p53. Den låga cancerincidensen i tunntarmen jämfört med tjocktarmen skulle kunna förklaras av att överlevnadsproteinet Bcl-2 inte finns aktiverat i tunntarmen till skillnad från i tjocktarmen. I figur 3.3b har en cellskada från joniserande strålning exemplifierats. Strålningen inducerar ett protein, AT, (ataxia telangiectasia-genens protein) som stimulerar p53. P53 ökar nivån av p21/WAF1 som leder till en hämning av celler i G1 och till G1-arrest via inhibition av cyklin/cdk-kom­ plex verksamt i G1. Om cellskadan ej kan repareras inducerar p53 GADD45 som leder till apoptos. För att G1-arresten inte skall bli för lång finns en negativ feedback loop genom mdm2 som inhiberar p53-transaktivering och hjälper celler att återhämta sig från G1-arresten. Det finns en rad positiva och negativa cellcykelregulatorer förutom de ovan nämnda, se figur 3.3c–d. Cellens inträde i cellcykeln stimuleras bl.a. av tillväxtfaktorer som styr cykliner via cyklinberoende kinaser (cdk) och cdk aktiverade kinaser. Andra suppressorgener som retinoblastomgenen (RB1) och p16-genen är viktiga för att bromsa cellen från att gå in i cell­ cykeln. Vissa tidpunkter i cellcykeln, restriktionspunkter, är viktiga att inte överskrida för att de stimulerande/hämmande effekterna skall kunna verka på cellen. Onkogenernas roll är framför allt att locka in celler från G0 till cellcykeln, medan suppressorgenernas effekter framför allt är att hämma de cyklinberoende stimulerande stegen. Regleringen av apoptotisk celldöd kan ha stor betydelse vid tumörterapi. Tidigare har ett fundament i det tumörbiologiska tänkandet vid terapi varit att tumörcellens proliferation styrde sjukdomens utgång. Numera är det också uppenbart att en minskad celldöd även leder till att tumörvolymen ökar. Vid t.ex. kronisk lymfatisk leukemi ackumuleras tumörceller inte på grund av en ökad cellproliferation (som inte är högre än i normalvävnaden) utan på grund av en reducerad celldöd. En cells överlevnad styrs också av s.k. överlevnadsfaktorer (survival fac­ tors) och dessa behöver ej vara helt identiska med proliferationsfaktorer. Exempel på cellöverlevnadsfaktorer är tillväxtfaktorer (EGF, PDGF, IGF-1, östrogen, Il 2, trombin), extracellulära matrix (fibronektin, vitronektin), närliggande celler (cadheriner), onkogener (ras, v-raf, bcr/abl), differentie­ ringsrelaterade gener (Bcl-2, Mcl-1) och virala gener (SV 40, t antigen, Ad5 E1B, EBV BHRF1). Proteinkinaser verkar mediera cellöverlevnad, medan fosfataser medierar apoptos. Målet med tumörterapi måste därför vara att både minska tumörcellspro­ liferationen och öka den apoptotiska celldöden. Försök görs därför att 26 © Studentlitteratur Karcinogenes och tumörbiologi påverka cellregulatoriska steg genom att introducera suppressorgener igen eller öka uttryck av suppressorgener och hämma cykliner eller andra stimu­ lerande steg. De allra flesta tumörer är utgångna från en celltyp i ett groddblad (se tabell 3.1). Om tumören är av mesenkymalt ursprung benämns tumören sar­ kom och om den är av epitelialt ursprung benämns den karcinom. Karci­ nom kan som ursprung ha epitel antingen i mesodermal, ektodermal eller endodermal vävnad. Karcinomen indelar man vidare i skivepitelkarcinom och adenokarcinom. I sällsynta fall har en tumör mer än en neoplastisk celltyp från ett grodd­ blad. Exempel på sådana tumörer är pleomorfa adenom i spottkörteln och dess maligna variant, malign blandtumör. Ett annat exempel är Wilms tumör som utgår från ett njuranlag. Att märka är att mogna teratom, dermoidcystor, omogna teratom och teratokarcinom utgår från mer än en neoplastisk celltyp, deriverad från mer än ett groddblad. Ursprungscellen utgörs av totipotenta stamceller i gonader eller i embryonal restvävnad. En tumörbeskrivning kan omfatta histiogenes, differentieringsgrad, för­ hållande till stroma och relation mellan tumör och stroma. En rad deskriptiva svulsttermer finns som, exempelvis, polyp (stjälkad eller bredbasig), papillom (grovpapillär eller finpapillär-villös), kystom (cystiska epiteliala tumörer), papillärt kystom (cystiska epiteliala tumörer med papillära formation), medullär tumör (sparsamt stroma) och skirrös tumör (rikligt med stroma). Adenom kan beskrivas som tubulära, tubulo­ villösa eller villösa. Hamartom har uppfattats som en icke neoplastisk för­ ändring där det på platsen förekommer normala vävnader i felaktiga pro­ portioner och relationer till varandra. © Studentlitteratur 27 Kapitel 3 Antigenpresenterande cell MHC Joniserande strålning Glukokortikoid CD3 TCR Cellmembran GR Cellkärna DNA GR­ inducerade gener p53 polyubiquitin nur77 c-myc Apoptos Figur 3.3a Joniserande strålning AT-genprodukt p53 GADD45 mdm2 mdm2/p53 (negativ feedback) p21WAF1 cdk G1 cyklin/cdk (inaktiv) G1 cyklin/cdk (aktiv) S G1 progression G1 cyklin G1 arrest Apoptos Figur 3.3b 28 © Studentlitteratur Karcinogenes och tumörbiologi Mitos celldelning G0-fas vilande/differentiering G2-fas Onkogener Tumörsuppressorgener G1-fas S-fas DNA-syntes Restriktionspunkt Figur 3.3c Övergripande bild av cellcykelns reglering. MPF ? M G0 G2 Tillväxt­ faktorer p16 Cyclin D CDK4 G1 Restriktionspunkt S Cyclin D E2F RB1 E2F CDK6 CDK4/6 DNA-skada G1 arrest E2F p107 E2F p107 RB1 PO4 p53 p21/WAF1 Cyclin A Cyclin E CDK2 CDK2 Bc1-2 GADD45 senescens PCNA ? p27 DNA-reparation TFGβ Figur 3.3d Exempel på regulatorer av cellcykeln. © Studentlitteratur 29 Kapitel 3 Tabell 3.1 Histiogenes och nomenklatur för benigna och maligna tumörer. Ursprungsvävnad Epiteliala tumörer Skivepitel Basalceller Körtel eller gångepitel Benign tumör Malign tumör Skivepitelpapillom Skivepitelcancer Basalcellscancer Adenokarcinom Cystadenokarcinom Övergångsepitelkarcinom (t.ex. blåscancer) Gallgångskarcinom Leverkarcinom Maligna melanom Njurkarcinom Adenom, cystadenom Övergångsepitel Övergångsepitelpapillom Gallgångar Leverceller Melanocyter Njurepitel Hudadnexkörtelepitel Svettkörtlar Talgkörtlar Germinalepitel Gallgångsadenom Levercellsadenom Nevus Renalt tubulärt adenom Trofoblast Svettkörteladenom Talgkörteladenom Benigna teratom Mola hydatidosa Mesenkymalt ursprung Lymfo-hematopoetisk vävnad Leukemi Lymfom Myelom Hodgkins sjukdom Neural och retinal vävnad Nervskida Neurinom (schwannom) Nervcell (gangliecell) Retinalvävnad(tappar) Neuroglial vävnad Svettkörtelkarcinom Talgkörtelkarcinom Embryonala karcinom Gulesäckskarcinom Seminom Maligna teratom Choriokarcinom Neurofibrom Ganglioneurom Malign perifer nervskidetumör Neuroblastom Retinoblastom Astrocytom Glioblastoma multiforme Juvenilt astrocytom Ependymom Oligodendrogliom 30 © Studentlitteratur Karcinogenes och tumörbiologi Forts. tabell 3.1 Ursprungsvävnad Benign tumör Malign tumör Bindvävnad Fibrös vävnad Fibroblast-histiocyt Fibromatoser Fibroxanthom Lipom Osteom Chondrom Fibrosarkom Malignt fibröst histiocytom Liposarkom Osteogent sarkom Chondrosarkom Muskelvävnad Tvärstrimmig Glatt muskulatur Rhabdomyom Leiomyom Rhabdomyosarkom Leiomyosarkom Endotel m.m. Blodkärl Hemangiom Fettvävnad Benvävnad Broskvävnad Lymfkärl Glomus Lymfangiom Glomustumör Angiosarkom Kaposis sarkom Lymfangiosarkom – Synovialmembran Mesotel Hjärnhinnor Lokaliserat mesoteliom Meningiom Synovial sarkom Malignt mesoteliom Maligna meningiom Tumörer med osäkert ursprung Ewings sarkom Ependymom Oligodendrogliom Omarbetat efter American Cancer Society Textbook of Clinical Oncology 1991. Holleb AI, Fink DJ, Murphy GP. (eds) © Studentlitteratur 31 Kapitel 3 Tabell 3.2 Exempel på vanliga metastaslokaler för vissa tumörsjukdomar. Tumörtyp Vanlig metastaslokal (-er) Prostatacancer Bröstcancer Colo-rektal cancer Sarkom Teratom Seminom Lungcancer Njurcancer Ovarialcancer Hjärntumör Follikulär thyroideacancer Papillär thyroideacancer Melanom Livmoderhalscancer Lymfkörtlar, skelett Lymfkörtlar, skelett, hud, lungor, lever, hjärna Lever, lymfkörtlar Lungor Lymfkörtlar, lungor Lymfkörtlar Lungor, lymfkörtlar, lever, binjurar, CNS Lungor, axelskelett Bukhåla, lever CNS Lunga, skelett Lymfkörtlar Lymfkörtlar, lunga, hud, hjärna, lever Lymfkörtlar, lever, lunga Tabell 3.3 Exempel på förvärvade tillstånd som är förstadier till cancerutveckling. Det finns ett antal förvärvade tillstånd som är förstadier till cancerutveckling även om i de flesta situationer risken för att utveckla cancer är låg. Benigna tumörer är sällan precancerösa. Ett viktigt undantag är benigna tumörer (adenom) i tjock­ tarmen. Nedan finns några förstadier uppräknade. Leukoplaki i mun, vulva och på penis ger ökad risk för skivepitelcancer på dessa lokaler Kronisk atrofisk gastrit – ökad risk för magcancer Kronisk ulcerativ colit – ökad risk för kolorektal cancer Hyperplastiska och dysplastiska proliferationer – ökad risk för endometriecancer hos individer med atypisk endometriehyperplasi, dysplastiskt bronkiellt epitel hos storrökare ger en ökad risk för lungcancer Cellregeneration – ökad risk för skivepitelcancer i kanten av kronisk fistel eller sår, ökad risk för levercancer hos patienter med cirrhos Villösa kolonadenom – hög risk för kolorektal cancer 32 © Studentlitteratur Karcinogenes och tumörbiologi Tabell 3.4 Exempel på proto-onkogener, mekanism för aktivering och associerade tumörformer. Kategori Protoonkogen Mekanism för Exempel på aktivering associerad tumörform Tillväxtfaktor PDGF sis fibroblast growth factor hst-1 Receptor för tillväxtfaktor Epidermal growth factor receptor erb-B1 Epidermal growth factor like receptor erb-B2 Protein involverat i cellsignalering GTP-bindning ras tyrosinaskinas abl Kärnregulatoriska protein transkriptionsaktivatorer Mitokondrieprotein myc N-myc Bcl-2 överuttryckt överuttryckt astrocytom magcancer amplifiering gliom amplifiering bröstcancer punktmutation lungcancer translokation kr. myeloisk leukemi translokation amplifikation translokation Burkitts lymfom neuroblastom follik. B-cellslymfom (Efter Robbins, Pathology, 1992.) Tabell 3.5 Exempel på tumörtyper som förekommer tillsammans i ökad frekvens. Skivepitelcancer i hud – basalcellscancer Lentigo maligna – basalcellscancer – skivepitelcancer Lungcancer – larynxcancer – annan ÖNH-cancer – cervixcancer – blåscancer Bröst-äggstockscancer Bröst (särskilt postmenopausal bröstcancer) – endometriecancer – tjocktarmscancer Bröst-tjocktarmscancer Bröst-sarkom Bröst-sarkom – hjärntumör – binjuretumörer – leukemi Hodgkins sjukdom – NonHodgkins sjukdom Hodgkins sjukdom – akut leukemi Polycytemia vera – akut leukemi © Studentlitteratur 33 4 Orsaker till cancer Det finns flera skäl att studera riskfaktorer/orsaksfaktorer vid tumörsjuk­ domar. 1. Kunskap om en sjukdomsorsak kan leda till dess förebyggande eller karakterisering av en riskgrupp för tidigdiagnostik. 2. Riskfaktorer kan påverka/vara associerade med en viss tumörbiologi och ökad kunskap om sådana faktorer kan öka förståelsen för sjukdomen. 3. Riskfaktorer kan genom samverkan med tumörbiologiska faktorer även vara relaterade till sjukdomens prognos, debutlokal etc. Förvärvade risk/orsaksfaktorer vid cancer Ämnesområdet cancer och riskfaktorer är mycket stort. En avgränsning av framställningen är därför nödvändig. Betydelsen av rökning och alkohol, kostfaktorer, reproduktionsvanor, infektioner, joniserande strålning, yrkes­ faktorer, solexponering samt elektromagnetiska fält kommer att granskas. Ärftlighet Miljöfaktorer fosterliv 0 barndom 20 pubertet 40 yrkesliv–livsstil 60 80 Ålder Figur 4.1 Miljöfaktorers och ärftliga faktorers roll och tidssamband för expone­ ringen i relation till åldern vid diagnos. Exempelvis är etiologin till tumörsjuk­ domar som debuterar före 20-årsåldern ofta att söka i fosterlivet, medan tumör­ sjukdomar som debuterar efter 60-årsåldern uppvisar samband med yrkesliv och livsstil i vuxna år. 34 © Studentlitteratur Orsaker till cancer Tabell 4.1 Miljöbetingad karcinogenes – exempel på initiala mutationer. Gen Etiologisk faktor UV-ljus p53 (skivepitel-/basalcellscancer i hud) Aflatoxin, hepatit B p53 (levercancer) Radon p53 (lungcancer) p53 Tobak, N-nitrosaminer, (lungcancer, ÖNH) PAH* Papillomvirus p53 (cervixcancer) FHIT Tobak, alkohol (lungcancer, esophagus- cancer, ÖNH-cancer) Mutationstyp pyrimidin dimerer CC:GG till TT:AA G:C till T:A (codon 249) AGG till ATG (codon 249) G:C till T:A inaktivering av p53 av protein från HPV-E6 ? * = polyaromatiska kolväten Cancerkommitténs betänkande 1984 försökte uppskatta antalet cancerfall i Sverige som är hänförbara till olika orsaker i miljö och levnadsvanor. Det framkom därvid att rökning generellt utgör den klart viktigaste definierade riskfaktorn för både cancerinsjuknande (15 %) och cancerdödlighet (30 %). Kostens betydelse är mer svårdefinierad och har angetts ha betydelse i mel­ lan 10–70 % av alla cancerfall. Under den senaste tiden har molekylärbiologiska rön presenterats som talar för att en viss typ av mutationer i en gen är relaterad till en speciell miljöfaktor (se tabell 4.1). Rökning Rökvanor Ända sedan tobak började rökas och fram till 1970-talets början har män rökt mer än kvinnor. Från och med 1978 är andelen rökare högre bland kvinnor. Under senare år har rökningen minskat något i befolkningen när det gäller män medan antalet rökande kvinnor är stabilt. Detta kommer att ha stora framtida konsekvenser för rökrelaterade tumörsjukdomars inci­ dens. Genom att det tar ungefär 20–30 år att utveckla en rökrelaterad tumörsjukdom kan man alltså förvänta sig att en större andel av rök­ © Studentlitteratur 35 Kapitel 4 Per 100 000 7,5 Män 5,0 Kvinnor 2,5 0 1960 1970 1980 1990 Figur 4.2 Redan 1993 har kvinnor under 55 år en högre incidens av lungcancer än män. (Cancer Incidence in Sweden 1993.) relaterade cancerfall förekommer bland kvinnor om 20–30 år. Det är ett sär­ skilt mönster i dessa rökvanor som är viktigt att påpeka. De åldersgrupper där kvinnor avviker starkast från män, dvs. där man röker mest, är bland de yngsta kvinnorna (18–24 år). Högre upp i åldrarna är skillnaderna inte stora och bland de allra äldsta åldersgrupperna är det återigen fler män som röker. Vi kommer att ha en så kallad kohorteffekt när generationer av kvinnor följs upp i åldrarna med mer rökrelaterade sjukdomar inklusive cancer (se figur 4.2). För det förebyggande arbetet är det viktigt att kunna bryta detta mönster. I cancerkommitténs betänkande från 1984 finns en redogörelse för hur rökvanor ändrar sig mellan olika årskurser i skolan. Jämför man vårterminen årskurs 6 med vårterminen årskurs 9 ser man att det är just mellan dessa årskurser som flickor blir rökare i högre grad än pojkar. Detta medför att det är redan i skolåldern som förebyggande åtgärder måste ini­ tieras. Sjukdomar relaterade till rökning Rökare kan drabbas av andra sjukdomar som har minst lika stor betydelse när det gäller dödligheten som cancer. Vid en uppskattning 1979 av antalet 36 © Studentlitteratur Orsaker till cancer dödsfall i Sverige, som anses rökningsrelaterade, framgår att hjärt-/ kärlsjukdomar är tre till fyra gånger vanligare än cancer i andningsrelate­ rade organ. Således kan man, genom att förebygga rökning, förebygga även andra sjukdomar såsom hjärt-/kärlsjukdomar och lungsjukdomar. Beträf­ fande cancer och rökning är det inte bara lungcancer som är relaterad till rökvanor. Även för cancer i munhåla, läpp och svalg, matstrupe, struphu­ vud, bukspottkörtel, livmoderhals, urinvägar och njurar finns överrisker för rökare (se figur 4.3). Sammanlagt fanns det 1979 i Sverige 4 906 fall bland män av dessa cancerformer. Cancerkommittén anser att 3 000 av dessa var rökningsorsakade. Bland kvinnorna inträffade samma år 2 795 cancerfall i dessa cancertyper. Då kvinnorna tidigare har haft mindre uttalade rökvanor räknar man med att drygt 800 av dessa fall skulle kunna vara röknings­ orsakade. Vad gäller rökning och lungcancer är dödligheten i lungcancer relaterad till den mängd man röker. Ju fler cigaretter desto högre dödlighet. Relation finns även till inhalationsmönstret. Den som inhalerar tar en större risk än den som inte drar halsbloss. Det finns även en synergism som är känd mellan rökning och andra faktorer. En sådan faktor är våra alkoholvanor. Särskilt när det gäller stämbandscancer, cancer i munhåla, matstrupe och svalg, finns en klar samverkan mellan tobaksrökning och alkohol för risken att få cancer. Vad gäller munhålecancer föreligger ett multiplikativt samband dvs. ris­ kerna för båda faktorerna multipliceras. Vid matstrupscancer visar bl.a. stu­ dier från Frankrike på ett likartat samband. När det gäller lungcancer finns det andra faktorer i miljön som kan sam­ verka med rökning som riskfaktorer. Ett multiplikativt samband är känt från radonexponering i gruvor och bostäder, arsenik- och asbestexponering samt för en del andra yrkesrelaterade faktorer. Andra skeenden runt lungkarcino­ genesen är dåligt utredda, t.ex. frågan om varför en del storrökare drabbas av lungcancer och andra inte. Man menar att ungefär en av tolv eller en av tretton storrökare får lungcancer om de röker i hela sitt liv. (Som storrökare har man definierat dem som röker mer än 25 cigaretter per dag.) Ett enzym som heter AHH (arylhydroxycarboxylas) kan metabolisera karcinogener till farliga komponenter. Vid hög nivå av detta enzym ökar lungcancerrisken kraftigt enligt vissa studier. Dessa studier är fortfarande omstridda men det pågår försök att kunna karaktärisera den disponerade individen på ett lämp­ ligt sätt. Släktfaktorer spelar sannolikt roll. Andra faktorer, som kan vara av betydelse, är intaget av A-vitamin, yrkesfaktorer, tidigare exponering för joniserande strålning och om man har ärrvävnad i lungan. Det finns en sam­ verkan av flera yttre faktorer och disposition som kan göra att just en enskild storrökare får lungcancer. © Studentlitteratur 37 Kapitel 4 a Mun/svalg Stämband Matstrupe Luftrör/ lunga Hud? Urinvägar/ blåsa Livmoderhals Analkanal Barnleukemi? (moderns rökning) b Läpp Mun/svalg Matstrupe Magsäck? Urinvägar? 38 Figur 4.3 a Schematisk bild över tumör­ sjukdomar som är associerade med rökning. b Schematisk bild över tumör­ sjukdomar där ett eventuellt samband med snusning behö­ ver studeras. Direkta hållpunkter för att snusning ökar risken för sjukdomar utanför läpp och munhåla sak­ nas, men pga. risk för nitrosa­ minbildning bör man studera eventuella effekter på gastro­ intestinalkanal och urinvägar. © Studentlitteratur Orsaker till cancer Vad gäller luftföroreningar tvistar man om dessa överhuvudtaget har betydelse när det gäller lungcancerförekomst. Skivepitelcancer och småcellig bronkialcancer uppvisar det starkaste sambandet med rökning bland lungtumörerna trots att alla histologiska undergrupper visar riskökningar i relation till rökning. Kvinnor har gene­ rellt oftare haft adenokarcinom och därför har det även spekulerats om hor­ monella faktorer kan spela roll vid lungkarcinogenesen. En framträdande internationell trend har varit att proportionen adenokarcinom kraftigt har ökat i relation till de andra histologiska typerna. Andra sätt att exponeras för tobak Det finns ett samband även mellan passiv rökning och risk för lungcancer. De som själva inte röker löper en större risk om de vistas i rökfyllda mil­ jöer. Den som först beskrev detta var en japansk forskare, Hirayama, som publicerade sina rön i British Medical Journal. Han kunde visa att bland japanska hustrur som levde med en rökande make var risken för lungcancer fördubblad. Det här resultatet har man lyckats återupprepa i studier från andra ställen, t.ex. i USA och även från Sverige. Man uppskattar risk­ ökningen för lungcancer till mellan 1,2 till 3 gånger för en icke-rökande individ som bor i en familj där makan eller maken är rökare. Detta kommer att få stora konsekvenser för den framtida lagstiftningen internationellt och nationellt när det gäller rökning i offentlig miljö. Bruket av tuggtobak, som framförallt varit frekvent förekommade i USAs sydstater, liksom beteltuggande i Indien, har visat sig vara associerat med en ökad förekomst av tumörer i munhålan. Snusning diskuteras ur cancersynpunkt. Ett samband misstänks med läppcancer. Dock är det så få som insjuknar i denna tumörform att det där­ för har varit svårt att belägga denna hypotes. Om snusningen leder till omfattande nitrosaminbildning i magsäck skulle även magtumörer i fram­ tiden kunna uppträda i ökad förekomst hos snusare. Cardiacancer ökar i incidens medan övriga tumörlokalisationer i magsäcken minskar i incidens och hypotesen har därför framkastats att tobaksprodukter medverkar vid ökningen av cardiacancer. I figur 4.3b har hypotetiska samband mellan tumörsjukdom och snusning indikerats. Nyligen har en gen, FHIT, karakte­ riserats där anlagsbäraren kan ha en ökad risk för tobaks- och alkoholrelate­ rad tumörsjukdom. © Studentlitteratur 39 Kapitel 4 Alkohol Vissa tumörformer uppvisar en klar association vad gäller alkohol. Gene­ rellt är det de organ eller delar av magtarmkanalen som först kommer i kon­ takt med alkohol, dvs. munhåla, svalg, stämband, matstrupe och magsäck som berörs (se figur 4.4). Patienter med alkoholorsakad skrumplever har också en högre risk för levercancer. Studier av ölkonsumtion har visat på ett samband med canceruppkomst i ändtarm och lever. På senaste tiden har det tillkommit studier som funnit att bröstcancer också skulle kunna vara rela­ terad till alkoholkonsumtion. Dessa resultat är dock inkonsistenta. Hur stor betydelse har alkohol som orsak till tumörer? Cancerkommittén har försökt uppskatta betydelsen av alkohol och kommit fram till att den bidrar till 500 cancerfall om året i Sverige 1979. Ungefär fem procent av tumörfallen bland män och 1,5 procent bland kvinnor skulle kunna vara associerade med alkohol enligt Cancerkommitténs betänkande. Mer än hälften av dessa fall är resultat av kombinationseffekter av rökning och alkohol. Som ensam faktor utgör alkoholen en liten del. För en icke-rökare anser man att risken för ovan Mun/svalg Stämband Matstrupe Bröst Lever Bukspottkörtel? Ändtarm (öldrickning) Figur 4.4 Schematisk bild över tumörsjukdomar som är associerade med alkoho­ lintag. 40 © Studentlitteratur Orsaker till cancer nämnda tumörer är två till tre gånger större om man har en kraftig alkohol­ konsumtion jämfört med en icke-rökande absolutist. Risken för icke-rökare med måttlig alkoholkonsumtion är lägre och svårigheter har funnits att överhuvudtaget påvisa en överrisk i de relaterade studierna. Kost Kosten har sannolikt en stor betydelse som riskfaktor för flera tumörsjuk­ domar. Svårigheterna med studier över just kostfaktorer är dels att vi under ett liv ändrar våra kostvanor ganska rejält, dels det mycket stora intaget av en rad faktorer, nutritionsämnen, drycker, tillsatsämnen i födan och tillsatser som konserveringsmedel. Vi har också föroreningar som inte borde finnas i födan men som kommit dit ändå från vår miljö. Att då för­ söka dra slutsatser om eventuella risksamband är svårt eftersom kosten innhåller komponenter som ur tumörsynpunkt är både skyddande och ohälsosamma. Man har ganska konsistenta resultat från djursystem som tyder på att kostfaktorer är av betydelse. Det gäller särskilt experiment där man modu­ lerat fett- och kaloriintaget. När det gäller forskning på människan och kos­ tens betydelse för cancersjukligheten, har man i vissa korrelationsstudier funnit samband mellan nivån av fettkonsumtion och hög cancerförekomst i landet. Sådana studier kan vara till viss hjälp för hypotesbyggandet men är fortfarande inget bevis för att fettintaget är viktigt på individnivå. Man har också tittat på individer som emigrerar från en kultur till en annan. Där finns också vissa mönster i cancerförekomsten som tyder på att en männis­ kas kost är av betydelse. Inom olika länder har det funnits etniska minorite­ ter som haft ett visst kostmönster. Man har då jämfört dessas kostföring med befolkningen i övrigt och även där har man funnit skillnader. Emeller­ tid kan de som emigrerar och etniska minoriteter i ett land ändra sitt lev­ nadssätt på flera olika sätt parallellt med kosten och det finns därför en viss osäkerhet i vad som direkt orsakar de skillnader man hittar. Sammantaget finns det dock indicier från migrationsstudier och studier av etniska minori­ teter, som talar för att kostfaktorer även hos människan har betydelse vid tumörsjukdom. Om man däremot går till helt individrelaterade studier, som fallkontroll­ studier eller interventionsstudier har man ännu inte på något konsekvent sätt visat att kostfaktorer har stor betydelse för cancersjukligheten. Det har gjort att man nu alltmer har börjat gå in direkt på interventionsstudier för att se om man på ett bättre sätt kan spegla kost–cancerfrågan. Vissa organ har tilldragit sig större intresse som riskorgan beträffande kost och cancer. © Studentlitteratur 41 Kapitel 4 Detta gäller hela gastro-intestinalkanalen, lever, bukspottkörtel och brösten hos kvinnan. Komponenter i det en kvinna äter kommer ut i bröstmjölken ganska snabbt och det finns alltså klara belägg för att bröstet borde vara ett målorgan för kostfaktorer. Andra organ där kostfaktorer kan spela roll är de gynekologiska organen, lunga och prostatakörteln hos mannen. Vidare finns experimentella studier som klart visar att mutagena ämnen bildas vid tillagningsprocedurer som t.ex. grillning och stekning. Över­ föringen av dessa data på humansituationen och individnivå ur cancerrisk­ synpunkt har inte varit lätt. När kostens roll diskuteras behöver man även ta i beaktande motion och fysisk aktivitet. Det finns ganska bra data på att kvinnor, som utövar aktiv tävlingsidrott särskilt under pubertetsåren, har en minskad risk att drabbas av bröstcancer. Detsamma gäller förmodligen både män och kvinnor och risken för tjocktarmscancer. Man har också visat att överviktiga individer i hög ålder har högre risk för bröstcancer, tjocktarmscancer och livmodercan­ cer. Vissa studier har pekat på samband som inte har varit helt konsistenta. Det gäller prostatacancer, pankreascancer och äggstockscancer. Det finns vissa cancerformer som underviktiga individer löper en ökad risk att få. Individer som drabbas av lungcancer har i flera studier visat sig vara magra personer. Detta kan också gälla cervixcancer, där epidemiologin är mycket likartad den vid lungcancer. Då dessa tumörformer är associerade med rök­ ning och rökning kan leda till en lägre kroppsvikt kan sambandet vara indi­ rekt. Vikten hos unga kvinnor, som drabbas av bröstcancer, är i nyligen genomförda studier lägre än i befolkningen i övrigt. Det paradoxala just med bröstcancer är att den yngre bröstcancerpatienten väger mindre och den äldre bröstcancerpatienten väger mer än normalt. Detta illustrerar svå­ righeterna när det gäller att dra slutsatser för en hel cancergrupp. Det kan alltså hända att de unga bröstcancerfallen har ett annat samband med kost och motionsfaktorer än de äldre. Det kan således vara fruktbart att studera undergrupper inom en cancerform istället för hela cancerformen i sig och detta gäller särskilt om epidemiologiska faktorer verkar vara olika för pre­ menopausala och postmenopausala kvinnor. Det kan diskuteras om övernutrition i sig är den viktiga faktorn. Från både människor och djur vet man att en överviktig individ har ett annat hormon­ mönster än en mager individ. Man vet också att fettvävnaden kan utgöra en upplagringslokal för karcinogener och på så sätt kunna utgöra en ökad can­ cerrisk. Speciella kostfaktorer kan vara förknippade med ett visst risk­ mönster (se figur 4.5), t.ex. nitrosaminer och risk för magsäckscancer. Saltad och rökt mat har också associerats med magsäckscancer. I Sydkina löper 42 © Studentlitteratur Orsaker till cancer Skyddande faktorer A-vitamin (skivepitelyta) C-vitamin Riskfaktorer Viss kinamat (Sydkina) Fe-brist Jodhaltig föda Aflatoxin Fiskintag (saltad, gravad, rökt) Fiberintag Kalciumintag Acetylsalicylsyra Gröna grönsaker (adenokarcinom generellt) Högt proteinintag fettintag ev. grillad, rökt mat Kaffeintag Figur 4.5 Schematisk bild över kostfaktorer som är associerade med tumörsjuk­ domar. individer som har en hög fiskkonsumtion en ökad risk för nasofarynxcancer. En samverkan finns här även mellan kostfaktorn, Epstein Barr-virus och ärftliga faktorer. Aflatoxin, ett svampgift, har associerats med levercancer. Högt fettintag i sig självt har associerats med bröstcancer och koloncancer medan däremot ökat fiberintag har associerats med minskad risk för kolon­ cancer. Vid undernutrition finns särskilda faktorer som kan påverka cancer­ risken. De som drabbas av järnbrist och Plummer-Vinson syndrom löper större risk att få cancer i svalg och matstrupe. Brist på vissa vitaminer, t.ex. A-vitamin eller spårämnen som t.ex. selen eller C-vitamin, kan öka risken för vissa cancerformer. C-vitamintillförsel kan vara skyddande genom att minska nitrosaminbildningen i magsäcken. A-vitamin tycks ha generell effekt på skivepitel och det har funnits en förhoppning att om man höjer A­ vitaminhalten för vissa riskgrupper skulle man kunna minska risken för can­ cer i skivepitel, t.ex. lungor och andra skivepitelbärande organ. Stora försök med kemoprevention har pågått utomlands för att se om man kan minska cancerrisken hos riskgrupper genom att tillföra A-vitamin eller dess analo­ ger. Dessa studier har inte givit de förväntade resultaten med en tumörinci­ © Studentlitteratur 43 Kapitel 4 denssänkning i relation till A-vitaminintag utan i vissa studier har man funnit en ökad tumörincidens. Försöken har därför nu avbrutits. Det har också kommit studier som talar för att om man tillför kalcium, exempelvis genom att dricka mycket mjölk eller äta ost, skulle man kunna minska risken för koloncancer. Av detta skäl diskuteras det allvarligt att råda dem som har haft benägenhet för polyper i tjocktarmen till ett högt kalkintag. Man har också experimentellt visat att celldelningen i tarm­ epitelet minskar vid tillförsel av kalk till riskgrupper med polyper i tarmen. Cancerkommitténs bedömning är att cirka 5 000 cancerfall totalt per år 1979 i Sverige skulle kunna bero på ett högt fettintag i sig självt. Det är svårt att på individnivå fastslå att det totala fettintaget har betydelse för can­ cerrisken i t.ex. bröst eller tjocktarm. En del forskare hävdar att fettintaget ej skiljer sig nog mycket mellan olika individer i Västerlandet för att man skall kunna fastslå att fett ligger bakom riskerna. En del forskare argumen­ terar för interventionsstudier med direkt fettreduktion. Även om det visar sig att cancerrisken ej nämnvärt påverkas så torde en reduktion av fett­ intaget vara gynnsamt ur andra sjukdomars synpunkt. När man bedömer betydelsen av fetma och övervikt får man komma ihåg att andra komponen­ ter också är direkt kostrelaterade. Det finns t.ex. en dansk tvillingstudie med bortadopterade tvillingar, där tvillingarna följer varandras viktkurva väl, mycket bättre än vikten hos den bortadopterades nya familj. Det finns såle­ des en stark genetisk komponent när det gäller fetma. I en amerikansk inter­ ventionsstudie hos 85 000 amerikanska sjuksköterskor där fettintaget sänkts med 10 % kunde inte någon effekt på bröstcancerincidensen påvisas. Däremot sågs en viss minskning av risken för kolorektal cancer. Fetman är olika fördelad på vår kropp. Individer som är runda om magen har en högre risk när det gäller kardiovaskulära sjukdomar än de som är runda om höfterna. Denna skillnad i manlig och kvinnlig fetma kan sanno­ likt också vara av betydelse när man bedömer viktens och kroppssamman­ sättningens betydelse för olika cancerformer. Det finns också ett klart ålderssamband, så att vikten ökar med tilltagande ålder. Hos vissa kvinnor är detta ålderssamband relaterat till barnafödande och menopaus. Detta kan alltså innebära att hormonella skeenden i kroppen är relaterade till viktupp­ gång och kan ha större betydelse än kostintaget. En hel del talar för att det också i framtiden kommer att vara mycket svårt att helt kunna avgränsa kostens betydelse för canceruppkomst hos människan. Dietens betydelse för tjocktarmscancer har också diskuterats och i pro­ spektiva studier har lipidhalter relaterats till cancerrisk 10–20 år senare. I korrelationsstudier finns ett samband på gruppnivå mellan högt intag av fett, hög köttkonsumtion, lågt fiberintag och risken för kolorektalcancer. 44 © Studentlitteratur Orsaker till cancer På individnivå har det dock inte gått att säkerställa om fettintag är relaterat till risk att få koloncancer. Visst bevis finns för samband mellan lågt fiberintag och risk för koloncancer. I några av studierna har individernas diagnos varit nära tiden för blodprovstagningen och man har spekulerat om tumörsjukdomen i sig har minskat kolesterolet. I en studie från Stockholm har man funnit positivt samband mellan serum-kolesterol och risk för koloncancer hos män. En tysk studie kunde påvisa en ökad risk för adenom i tjocktarmen (förstadie och godartad tumör) i relation till ett högt koleste­ rolvärde. Det finns, som redan påpekats, svaga belägg för att en hög ölkon­ sumtion ökar risken för cancer i ändtarmen. Man har i hypotesbildningen kring ölet diskuterat om ölet kan påverka tarmtömningens hastighet så att individer som tömmer tarmen långsamt skulle ha en ökad risk för ändtarms­ cancer. Kaffe har nyligen i en svensk studie visats ha en skyddande effekt på tjocktarmstumörbildning medan te skyddade mot ändtarmscancer. Dessa resultat behöver konfirmeras. En eventuell mekanism för denna effekt är okänd. Tjocktarmen är inte heller ett enhetligt organ. I flera studier har man funnit att individer med låg fysisk aktivitet dvs. de som har ett stillasittande arbete, företrädesvis drabbas av cancer i den vänstra delen av tjocktarmen. I dessa fall skulle kostfaktorn också vara av störst betydelse. På höger sida av tjocktarman har man funnit att hormonella faktorer kan ha betydelse. Det har visat sig i vissa studier att fler kvinnor, liksom gallopererade, har en ökad risk för cancer just i den delen av tarmen. Män som fått östrogen­ behandling för prostatacancer har mer tjocktarmscancer lokaliserad till denna del av tarmen. De som har en släkthistoria för koloncancer har oftare tumören på höger sida i kolon. Ett samband mellan högersidig koloncancer och exposition för cement och asbestdamm har diskuterats. Olika risk­ faktorer kan alltså ha betydelse i olika delar av tjocktarmen och intensiv forskning pågår både av sporadiskt och familjärt betingade fall av kolon­ cancer för att närmare klara ut skillnaderna. Nyligen genomförda studier har gett en konsistent bild av att intag av acetylsalicylpreparat reducerar risken att drabbas av tjocktarmstumörer. Mekanismen för en sådan effekt är oklar. Reproduktion En annan livsstilsfaktor, som påverkar cancermönstret, är våra reproduk­ tionsvanor. Ett antal händelser under ett fertilt liv som har att göra med reproduktionen kan relateras till risken att få en malign tumörsjukdom. Hos © Studentlitteratur 45 Kapitel 4 Tiden före första menstruation Graviditet Laktation 1840 Menstruation 1990 0 10 20 30 40 50 60 70 80 År Figur 4.6 Reproduktion och menstruationscykler hos kvinnor 1840 och 1990. En kvinna som levde 1840 hade en senare menarche, fler graviditeter och ammade varje barn längre än en kvinna som lever 1990 och som i snitt föder två barn. Den moderna kvinnan går igenom ett stort antal menstruationscykler (periodiska hor­ monsvängningar) som kraftigt ökar hennes risk för att få reproduktiva tumörer (särskilt bröstcancer). kvinnan utgör dessa faktorer exempelvis: antalet barn, ålder vid första barnet, ålder vid menarche och menopaus, antalet menstruationer, menstrua­ tionscykelns längd, aborter och missfall, antalet sexualpartners, ålder vid sexdebuten och exogen tillförsel av hormoner. Några av dessa faktorer finns också relaterade till cancerförekomst hos mannen nämligen antalet barn, antal sexualpartners, hetero- eller homosexualitet, infertilitet, penishygien och östrogentillförsel. Vid bröstcancer är antalet barn av stor betydelse och särskilt kvinnans ålder vid första barnet. En hög ålder vid första graviditeten ökar risken för bröstcancer 2–4 gånger. Man kan också visa att antalet sexualpartners och ålder vid sexdebuten har betydelse för risken att drabbas av livmoderhalscancer, ju tidigare debut desto högre risk. Om mannen haft många partners eller tidigare haft infek­ tioner som är sexuellt överförda är risken också ökad för kvinnan. Vid bröstcancer och dess relation till hormonella faktorer är åldern för expone­ ringen av stor betydelse för risken. När kvinnan föder första barnet ändrar sig situationen i bröstet så att det blir en lägre proliferation med utmognad av bröstepitelet. Möjligheterna att framkalla cancer skulle då vara lägre efter barnafödandet. Kvinnor, som har en ökad risk för äggstockscancer, har fött få barn och ej stått på exogen hormontillförsel. Därför har hypotesen framkastats att anta46 © Studentlitteratur Orsaker till cancer let ovulationer med åtföljande mikrotrauma av äggstocksepitelet ökar ris­ ken. Tillförsel av hormoner utifrån är särskilt aktuellt för kvinnan, t.ex. i form av p-piller och östrogener kring menopausen. Tidigare har hormontillförsel skett under graviditet för att förebygga spontan abort hos vissa kvinnor. Det har visats i flera undersökningar att tillförsel av dietylstilbestrol till modern under graviditeten ökar risken för cervixcancer hos dottern i tidig ålder. Risken finns också för vaginalcancer hos dottern i tidig ålder. Dessa karci­ nom har ett speciellt histopatologiskt utseende och benämns klarcellskarci­ nom. Möjligen ökar risken för testikeltumörer också hos sönerna. Kvinnan, som själv fått medlet under graviditeten, kan löpa en större risk att utveckla bröstcancer. När det gäller barn och tillförsel av hormoner finns ett par stu­ dier som antyder att tillförsel av anabola steroider möjligen kan öka risken för levercancer. Hur det är med tillförsel av anabola steroider i muskelupp­ byggande syfte och risk för cancer senare i livet är lite osäkert. En del data skulle kunna tyda på att de som har tagit anabola steroider möjligen har en något ökad risk för levercancer. Flera studier tyder på att p-pilleranvändning i puberteten och före första barnet ökar risken för bröstcancer. En längre tids användning i tidig ålder, samt, enligt nya rön, pågående användning oavsett ålder ökar risken. Det kan också vara så att samma typ av användningsmönster ökar risken för en sär­ skild form av cervixcancer nämligen adenokarcinom. Viktigt är att påpeka att riskökningen för bröst- och cervixcancer framförallt gäller högdoserade p­ piller och att data i stort sett saknas för lågdoserade p-piller då kvinnor som använt moderna p-piller ännu är för unga för att i större omfattning ha fått hormonrelaterade cancerformer. I vuxen ålder finns en skyddande effekt av p-pilleranvändning när det gäller ovarialcancer och livmodercancer. Ris­ kerna är ibland halverade för dessa cancerformer hos dem som ätit p-piller. I tre ganska nyligen genomförda studier har man visat på riskökning för lever- och gallvägscancer vid p-pilleranvändning. Vad gäller hormon­ användning runt menopaus och åren efter, finns det en del data som tyder på att p-pilleranvändning ger en liten eller måttlig riskökning. Långvarig östro­ genanvändning visar ett mer eller mindre konsistent samband med ökad risk för bröstcancer. De cancerformer som associerats med östrogenanvändning är sannolikt biologiskt mindre aggressiva cancerformer. Både bröstcancer och endometricancer kan ha bättre prognos och riskökningen är måttlig. Däremot finns okonfirmerade data som tyder på att bröstcancer som diag­ nostiseras hos unga kvinnor som i tidig ålder använt p-piller är en allvarliga­ re cancer med högre dödlighet än hos andra kvinnor med bröstcancer. Risk­ ökningen för östrogenanvändning peri-/postmenopausalt och bröstcancer © Studentlitteratur 47 Kapitel 4 gäller framförallt magra kvinnor, som vid östrogenanvändningen vägde mindre än 65 kg. Infektioner Det finns en rad infektiösa faktorer som har associerats med cancerföre­ komst. Vid Schistosomiasis-infektioner finns ett samband med blåscancer, bröstcancer hos män samt levercancer. Även parasitära angrepp på gall­ gångar kan vara associerad med gallgångscancer. Ärr efter utläkt tuberkulos kan tumoromvandlas. Uppemot 20 % av alla maligna tumörsjukdomar kan ha en virusetiologi (se figur 4.7). Bland dessa cancersjukdomar finns tumörsjukdomar som är Non-Hodgkinlymfom (EB-virus) Hodgkins sjukdom (EB-virus?) Hudcancer (papillomvirus) T-cellsleukemi (HTLV 1) Levercancer (hepatit B, C virus) Cervixcancer (papillomvirus) Analcancer (papillomvirus) Figur 4.7 Tumörsjukdomar associerade med virusinfektioner. 48 © Studentlitteratur Orsaker till cancer mycket vanliga såsom livmoderhalscancer och andra som är mindre vanliga såsom levercancer, nasofarynxcancer och T-cellsleukemi hos vuxna. Vidare kan vissa fall med Hodgkins sjukdom, non-Hodgkin-lymfom, hudcancer och analcancer ha virusetiologi. Orsaker till tumörsjukdomar är oftast multifak­ toriella och detta gäller även de vanligaste virusorsakade tumörsjukdomarna. Medan exempelvis skivepitelcancer i livmoderhalsen ofta är associerad med papillomvirusinfektion har man vid adenokarcinom i cervix ännu ej säkert visat på en virusetiologi. I västvärlden kan levercancer ofta uppstå utan att individen är virusinfekterad med hepatit B- eller hepatit C-virus. Vid Burkitt-lymfom samverkar sannolikt malariainfektioner och EpsteinBarr-virusinfektioner och ger en ökad risk. Epstein-Barr-virusinfektioner ökar förutom risken för Burkitt-lymfom, även risken för nasofarynx-infek­ tioner. Hodgkins sjukdom har relaterats till Epstein-Barr-virus i 30 % av fallen men den direkta kausala rollen är inte helt utredd. I utvecklingsländerna har hepatit-B-virus stor betydelse vid uppkomst av levercancer. Man räknar med att 11 % av all levercancer i USA skulle kunna ha ett sådant samband. I ett u-land kan siffran vara mycket högre, kanske 80–90 %. Därför förbereder man i u-länder vaccinationsprogram i stor skala för att på så sätt kunna förebygga denna cancerform. Även hepatit-C-infektioner kan leda till en ökad risk för levercancer. Av patienter med persisterande hepatit B-virusinfektioner räknar man med att upp till 50 % utvecklar levercancer bara de får leva länge nog. Vid persisterande HTLV-1-infektioner är det mindre än 5 % som utvecklar T-cellsleukemi. Det finns också ett samband mellan herpesvirusinfektioner och hud- och analcancer. Herpesvirus 8 har associerats med Kaposis sarkom. Individer infekterade med HIV har en ökad risk för lymfom, Kaposis sarkom, anal- och oralcancer. När det gäller anal- och oralcancer hos aids­ patienter tror man att ett annat virus som t.ex. papillomvirus kan vara med som en viktig faktor. Kaposis sarkom förekommer oftare vid HIV-infektion erhållen efter sexuell smitta än vid HIV-infektion orsakad av blodtrans­ fusion. Nyligen har man beskrivit samband mellan Helicobacter pylori-infektio­ ner och magcancer och mellan Helicobacter pylori-infektioner och utveck­ ling av malignt lymfom. Mekanismer bakom virustumorigenes hos människa faller principiellt inom två grupper. Dels kan uttrycket av en virusgen medföra att ett eller flera steg i cancerutvecklingsprocessen hoppas över, dels kan virusinfektio­ nen innebära att virus stabiliserar eller underlättar framväxt av en cellpopu­ lation i vilken därpå nya genetiska förändringar lättare kan ske. Virus kan © Studentlitteratur 49 Kapitel 4 störa tillväxtkontrollen hos djur och människa genom den första mekan­ ismen på följande principiella sätt: Transduktion av onkogen (exempelvis Rous sarkomvirus). Onkogenen tas upp via en rekombination och är under kontroll av viruspromotorer. Insertionsaktivering av onkogen (exempelvis murint leukemivirus, mouse mammary tumour virus) vilket innebär att den virala genen integrerar i eller vid onkogenen (promotor eller enhancer). Insertionsinaktivering av suppressorgen (exempelvis Friends murina leuke­ mivirus) vilket innebär att den virala genen integrerar i eller vid suppressor­ genen. Mekanismen är känd för tumörutveckling som involverar p53 och retinoblastomgenen. Transaktivering av onkogen (exempelvis humant T-lymfotropt virus) som innebär att aktiviteten stimuleras hos en annan gen eller genprodukt via en löslig faktor, t.ex. protein. Transinaktivering av suppressorgen (exempelvis humant papillomvirus­ infektion). Detta innebär en inhibition av aktiviteten hos en annan gen eller genprodukt via en löslig faktor, t.ex. protein. Exempel där tillväxtkontrollen störs framför allt genom att virus stabiliserar eller underlättar framväxten av en cellpopulation i vilken därefter nya gene­ tiska förändringar lättare kan ske kan vara tumorigenes associerad med hepatit B, hepatit C och Epstein-Barr-virusinfektioner. Lymfomutveckling i samband med HIV-infektion kan också bero på denna mekanism (se tabell 4.2). Profylaktiska vaccinationer som resulterar i prevention av virusinfektio­ ner kan vara effektiva sätt att reducera incidensen av några av dessa vanliga tumörsjukdomar. Solexponering Maligna melanom är den tumörform som ökar kraftigast i Sverige. Mycket talar för att akuta brännskador i samband med solbad är av betydelse för sjukdomen. Vi har exempelvis i en studie i Lund funnit att melanompatien­ ter från södra Sverige signifikant oftare än friska kontroller rest till länder nedanför Alperna. Ett fynd som kvarstår även om hänsyn tages till socio­ ekonomiska faktorer, kön och ålder. Andra viktiga riskfaktorer i Sydsverige för denna sjukdom inkluderar konstitutionella faktorer (röd och blond hår50 © Studentlitteratur Orsaker till cancer färg, många nevi på kroppen, fräknar), ärftlighet för melanom (inklude­ rande dysplastiskt nevussyndrom), solvanor, frekvent bruk av solarium samt hudens reaktionssätt vid solexponering. Den eventuellt skyddande effekten av solskyddsmedel är osäker och nyligen publicerade studier anty­ der till och med en riskökning efter bruk av solskyddsmedel som inte kan tillskrivas andra kända faktorer för melanom. För skivepitelcancer och basalcellscancer i huden spelar sannolikt den kumulativa dosen av UV-bestrålning störst roll. Betydelsen av solarium för risken att utveckla andra hudtumörer än melanom kan för närvarande ej bedömas. Exkluderat basalcellscancer räknar man 1979 med att ungefär 1 500 cancerfall per år i Sverige skulle ha UV-strålning som orsak. Joniserande strålning Den faktor som väl får anses bäst etablerad bland tumörinitierande faktorer hos människa är joniserande strålning. Kunskap om sambandet mellan joni­ serande strålning och tumörsjukdom har erhållits framförallt från över­ levande i Hiroshima och Nagasaki, men också från patienter som erhållit strålbehandling för godartade tillstånd. I princip kan såväl leukemi och lymfom som solida tumörer uppstå efter strålexponering. Sköldkörteltumö­ rer (framförallt papillär tyreoideacancer) har särskilt uppträtt i kohorter av exponerade individer. Latenstider beror framförallt på vilken ursprungsväv­ nad som exponerats samt tillförd dos, med korta latenstider för leukemiut­ veckling (0,5–10 år), längre för lymfom (5–15 år) och långa tider för solida Tabell 4.2 HIV-relaterade tumörsjukdomar. Kaposis sarkom Non-Hodgkin lymfom av B-cellstyp Högmalignt Intermediär typ Primärt CNS-lymfom (aids-definierande sjukdom) Hodgkins sjukdom stadium III-IV Mixed cellularity Nodulär skleros Sjukdomar med möjlig HIV-association Non-Hodgkin lymfom av T-cellstyp Cervixdysplasi/neoplasi Leiomyom/leiomyosarkom hos barn Analkarcinom © Studentlitteratur 51 Kapitel 4 tumörer (15–40 år). Yngre individer som befinner sig i aktiv organtillväxt är känsligare för tumörutveckling än äldre individer med organinvolution. En ökad risk finns med ökad dos. Riskkurvan är dock inte linjär då celldöd vid mycket höga doser gör att riskkurvan planar av. Risken med låga strålexpo­ neringar är svårstuderad och det är oklart om risksambanden inom låg­ dosområdet är linjära. Gränsvärden har dock anpassats till ett linjärt sam­ band och strålskyddet i samhället tar fasta på detta. Barn och vuxna som tidigare strålbehandlats för godartade tillstånd som bl.a. hemangiom, svamp- och andra infektioner, värk, andra inflammato­ riska tillstånd samt godartade bröstsjukdomar har varit föremål för upp­ följande epidemiologiska undersökningar där en ökad risk för tumörsjuk­ dom påvisats. Vid radiojodbehandling av icke malign tyreoideasjukdom och jodisotop­ undersökningar har uppföljande studier ej kunnat belägga några stora can­ cerrisker. Efter mycket höga radiojoddoser som vid utsläckningsdoser av tyreoidea vid malign sjukdom kan leukemi uppträda. Frekventa röntgenundersökningar av olika organ är också föremål för cancerepidemiologiska studier men tolkningssvårigheter föreligger av hittills framtagna resultat. Röntgenundersökningar av en kvinna under gravi­ ditet har ansetts kunna leda till leukemi hos barnet. Radonexponering i gruvor och bostäder kan öka risken för lungcancer. Ett eventuellt samband med akut myeloisk leukemi diskuteras. Tillförsel av ett radioaktivt röntgenkontrastmedel, thorotrast, har gett en riskökning för framförallt levercancer. Exponering för en radioaktiv isotop såsom strontium hos försöksdjur ger en ökad risk för akut leukemi och bihålecancer. Elektromagnetiska fält och maligna tumörer På senaste tiden har ett samband mellan exponering för elektromagnetiska fält och risk för tumörsjukdom uppmärksammats. Både tumörer hos barn (akut leukemi, hjärntumörer) och vuxna (akut, kronisk leukemi, manlig bröstcancer samt hjärntumörer) har uppvisat samband. Studier har genom­ förts både av populationer som bor nära högspänningsledningar och av individer som i sitt yrke exponerats för starka kraftfält. Orsakssamman­ hanget är dock ännu inte klart, då bland annat bra biologiska för­ klaringsmodeller saknas och konsistenta överrisker för samma typer av tumörer icke uppvisats mellan studierna. I flera väldesignade studier har riskökningar också helt saknats. Ett annat problem är att elektromagnetiska kraftfält är vanliga både i hemmiljö, arbete och fritid och svårigheter finns 52 © Studentlitteratur Orsaker till cancer därmed att särskilja en exponering retrospektivt. Riskökningarna som setts i studierna med ett dos-responssamband gör det angeläget att fortsätta stu­ dera hypotesen. Yrkesrelaterad cancer Totalt kan man säga att andelen individer med maligna tumörer som utvecklat sjukdomen på grund av yrkesexponeringar är liten. Uppskatt­ ningar har ofta hamnat från 1–2 % till 9 %. I figur 4.8 har angivits exempel på tumörsjukdomar och exponeringar där yrkes- och/eller miljösamband finns etablerade eller är sannolika. I tabell 4.3 finns angivet vilka tumörformer och yrkesexponeringar som för när­ varande ligger till grund för utredning enligt arbetsskadeförsäkringen och där samband är etablerade eller sannolika. Vid diskussion av yrkesbetingade tumörformer har lagstiftningen fram­ förallt tagit fasta på exponering för mutagena ämnen på arbetsplatsen och Bihåla (trädamm) Sköldkörtel (joniserande strålning) Lunga (krom, nickel, arsenik, radion, asbest, passiv rökning) Lungsäck (asbest) Urinblåsa (aminer) Benmärg (bensen, lösningsmedel, elektromagnetiska fält? joniserande stålning) Hjärna (kemisk exponering, elektromagnetiska fält?) Lymfkörtlar (lösningsmedel, herbicider?) Hud (kumulativ UV-ljusexponering) Melanom (excessiv episodisk UV-ljusexponering) Tjocktarm (stillasittande jobb, asbest) Pung (sot) Figur 4.8 Exempel på tumörsjukdomar associerade med yrkesfaktorer/yrkesexpo­ neringar. © Studentlitteratur 53 Kapitel 4 Tabell 4.3 Sammanfattning av sannolikhet för samband mellan en arbetsmiljö­ exponering och cancer (första steget i arbetsskadeförsäkringsbedömningen). Etablerade samband Exponering Asbest Sot och avgaser Krom (sexvärt) Bensen Vinylklorid Trädamm Dimma av starka syror Kadmiumföreningar Arsenik Radon Hög sannolikhet för samband Exponering Asbest Bensen Etylenoxid Silikos (kvarts) Målning Gummiindustriarbete (vissa arbeten) Glasindustri (vissa arbeten) Gjuteriarbete (vissa arbeten) Sannolika samband Exponering Formaldehyd Glasindustri (vissa arbeten) Magnetfält 50-60Hz Klorerade organiska lösnings­ medel Organiska lösningsmedel Fenoxisyror Tumörform Mesoteliom, lungcancer Lungcancer, urinblåsecancer Lungcancer Leukemi Leverangiosarkom Adenokarcinom i näsa Larynxcancer Lungcancer Lungcancer Lungcancer Tumörform Koloncancer Lymfom, leukemi Leukemi, lymfom Lungcancer Lungcancer Lungcancer, urinblåsecancer Magcancer Lungcancer Tumörform Nasofarynxcancer Koloncancer, lungcancer Leukemi Levercancer Non-Hodgkinlymfom Non-Hodgkinlymfom, mjukdelssarkom (Referens I. Lundberg, Cancer, Arbete och Hälsa, 1995.) 54 © Studentlitteratur Orsaker till cancer där exponeringen med stor sannolikhet kan anses har orsakat cancersjuk­ domen. Att stillasittande kan öka risken för vissa tumörsjukdomar eller det faktum att kvinnor som utbildar sig skaffar få barn och dessutom barn sent i livet samt har en ökad risk för vissa tumörsjukdomar, har hittills inte ansetts vara yrkesbetingad cancer. Livsstilsfaktorer, exponering för infektioner och exponering för UV-ljus har därför inte tillmätts samma roll som exponering för mutagena kemiska ämnen. Lagstiftningen har heller inte tagit hänsyn till att vissa individer av gene­ tiska eller förvärvade skäl är känsligare än normalbefolkningen för expone­ ring för karcinogener. Olika genetisk acetyleringsförmåga av läkemedel, genetiska varianter av glutationtransferas och p-450-systemet kan innebära olika hög cancerrisk i relation till en exponering (se tabell 4.4–4.5). Forskningsområdet mellan genetik och miljö inom cancerepidemiologin går under benämningen ekogenetik. Man ser hur olika markörer för ärftlig­ het ger benägenhet för cancer vid olika exogena expositioner. Om de som tidigare drabbats av retinoblastom, en elakartad ögontumör som ofta drabbar unga individer, får strålbehandling för sin ögontumör, löper de en mycket hög risk jämfört med andra att utveckla osteosarkom, en elakartad bentumör, just i det område där de har fått strålning. Det finns också vissa andra sådana syndrom, t.ex. xeroderma pigmentosum (en grupp individer som är extremt känsliga för solljus pga. av en defekt DNA-reparations­ förmåga), som ofta drabbas av tumörer i huden. Heterozygoter för vissa anlag kan vara intressanta att studera ur risksyn­ punkt. En sjukdom där heterozygoter tros ha en ökad sjukdomsrisk är ataxia telangiectasia. Bland annat har man funnit att kvinnliga heterozygo­ ter har en ökad risk för bröstcancer. Man räknar med att mellan 1–5 % av alla individer i populationen är heterozygoter för detta anlag. Denna grupp skulle på teoretiska grunder kunna vara extra känslig för joniserande strål­ ning. Preliminära studier av dessa individers lymfocyter tycks stödja detta antagande. Individerna med anlaget borde då vara särskilt observanta för olika typer av mutagena exponeringar och vid exempelvis terapi med joni­ serande strålning bör de kanske erhålla en lägre totaldos än andra. © Studentlitteratur 55 Kapitel 4 Tabell 4.4 Befolkningsvariationer i enzymer som hanterar karcinogener och i andra polymorfier. CYP1A1 CYP2D6 GST M1 NAT2 (långsam) O6-alkyldeoxyguanosin Hras-1 VTR 10 % Kaukasier metabolism (p450) förändrad 90–95 % Kaukasier metabolism (p450) förändrad 50 % Kaukasier deleterad gen 35 % Afro-amerikaner 50–60 % Kaukasier långsamma acetylerare 30–40 % Afro-amerikaner 14 % Asiater 180 ggr variation i DNAs reparationsförmåga 3% 18 % Kaukasier Afro-amerikaner Tabell 4.5 Association mellan enzym/polymorfi, karcinogen och olika tumörformer. Enzym/polymorfi Karcinogen Tumörform CYP1A1 CYP1A2 lungcancer kolon, urinblåse- och levercancer lungcancer urinblåse- och lungcancer blås- och bröstcancer koloncancer lungcancer dioxiner, polyaromatiska kolväten arylaminer, heterocykliska aminer aflatoxiner CYP2D6 nitrosaminer GST M1 polyaromatiska kolväten, ethylenoxid, styren NAT2 (långsam) 2-naftylaminer, 4-ABP (snabb) O6-alkyldeoxy- nitrosaminer guanosin Hras-1 VTR ? 56 lung-, bröst-, kolorektal, blåscancer och leukemia © Studentlitteratur Orsaker till cancer Tabell 4.6 Kriterier för en orsaksfaktor. Vissa kriterier har inom epidemiologisk forskning utvecklats för att distingera en orsaksfak­ tor till ett sjukdomssamband. Dessa kriterier bygger på ett förslag utarbetat 1965 av den engelske statistikern Bradford-Hill. 1. Det bör finnas ett tidssamband mellan faktor och sjukdom, dvs. orsaken bör föregå sjuk­ domen i tid. 2. Ett starkare samband har större chans att vara en riktig orsaksfaktor. 3. Ett dos-responssamband bör föreligga. En större dos bör leda till en större effekt om ett positivt orsakssammanhang råder, medan vice versa en lägre dos borde leda till mindre skyddande effekt om det finns en förebyggande effekt av faktorn. 4. Sambandet bör vara konsistent. Upprepade observationer i olika grupper, tidsperioder och geografiska lokalisationer bör ge samma resultat. 5. Specificitet bör råda. En orsaksfaktor bör leda till en effekt. 6. Reversibilitet bör kunna visas. Borttagande av faktorn bör leda till en reduktion av sjuk­ domsrisken. Reintroduktion av faktorn bör igen öka sjukdomsrisken. 7. Sambandet bör vara biologiskt plausibelt i relation till den apriori kunskap och bild över mekanismer för sjukdomsuppkomst som finns vid tidpunkten. 8. Analogi bör föreligga. Ett liknande orsaks- och effektmönster bör vara etablerat för en närliggande sjukdom/tillstånd. I allmänhet blir orsakssambandet starkare i tilltagande ordning med följande studier; fallrapport, serie av fall, tvärsnittsstudier, fall–kontrollstudier, kohortstudier och randomiserade kliniska studier. Tabell 4.7 Epidemiologiska studier. Experimentell studie Observationell studie Randomiserad studie oblindad, single blind, dubbelblind med eller utan placebo Icke randomiserad studie Fallbeskrivning Korrelationsstudie eller ekologisk studie Fallkontrollstudie Kohortstudie retrospektiv eller prospektiv studie Interventionsstudie © Studentlitteratur t.ex. djurförsök t.ex. läkemedelsprövning t.ex. behandlingstudie med historiska kontroller t.ex. tumörform och viss exponering t.ex. nationellt intag av fett och cancerincidens mellan länder t.ex. riskfaktorer hos patienter med melanom i jäm­ förelse med en kontrollgrupp t.ex. cancerrisken hos smältverksarbetare t.ex. påverkar sänkningen av fettintag bröstcancer­ risken hos 100 000 amerikanska sjuksköterskor 57 Kapitel 4 Tabell 4.9 Jämförelse fall–kontrollstudie och kohortstudie. Fall–kontrollstudie sjukdom + (fall) – (kontroller) a c b d Kohortstudie Exponering + – Vid en fall–kontrollstudie jämför man individer med en sjukdom med en kontrollgrupp rörande en viss exponering. Vid kohortstudien utgår man från exponeringen och följer indi­ viderna i tid i relation till exponeringen (man kan härvid göra jämförelser med en kontroll­ kohort eller med allmänbefolkningens sjukdomsrisk). a/antalet personår hos de exponerade I en kohortstudie beräknas relativa risken = ---------------------------------------------------------------------------------------­ c/antalet personår hos de exponerade a x d I en fall–kontrollstudie beräknas oddskvoten = ------------ b x d Det finns andra samverkanseffekter av exponeringar som kan influera can­ cerutveckling. Rökningens synergistiska roll med många yrkesexpone­ ringar har tidigare påtalats. I u-länder har ett samband mellan aflatoxin och hepatitinfektioner och risken att få levercancer noterats. Cancer och ärftlighet Det är sedan länge känt att tumörsjukdomar uppvisar familjära samband. Tumörsjukdomar, som debuterar i ung ålder, multifokalt och/eller visar benägenhet för presentation samtidigt i pariga organ, är oftare familjärt betingade. Om en första grads släkting (förälder, syskon eller barn) insjuk­ nat i en tumörsjukdom fördubblas vanligen för övriga nära familjemedlem­ mar att insjukna i tumörsjukdom. Risken ökar ytterligare om fler släktingar insjuknar, om insjuknandet skett i ung ålder och/eller engarerat bilaterala organ. Hos 5–10 % av alla tumörpatienter finns en mycket kraftig ärftlig dispo­ sition innebärande att uppemot hälften av patienterna i släktträden kommer att drabbas av maligna tumörer (s.k. hereditär tumörsjukdom – se tabell 4.13 och figur 4.9). Nedärvningsmönstret är här dominant, ofta med viss nedsatt penetrans vilket innebär att nästan hälften i ett släktträd insjuknar. 58 © Studentlitteratur Orsaker till cancer Tabell 4.8 Olika design av epidemiologiska studier – deras för- och nackdelar. Studietyp Fördel Nackdel Fallbeskrivning Enkel, billig hypotesgenererande Kan ej testa hypotes Fallserie Deskription av sjukdoms­ karakteristik Ingen kontrollgrupp, kan ej testa hypotes Tvärsnittsstudie Uppskatta prevalens Korrelationsstudie (Ekologisk studie) Hypotesgenererande snabb Kan ej bedömma tidpunkt, hypotesgenererande för exponering Inverkan av andra faktorer svårkontrollerat (confounding) Fall-kontrollstudie Kan studera multipla och ovanliga exponeringar, kräver få individer, snabb och mindre kostsam Selektion av kontroller svårt, exponering kan lätt bli bias, kan ej räkna ut incidens Kohortstudie Kan studera multipla utfall och ovanliga exponeringar. Selektionsbias och bias i exponeringsdata mindre troligt, kan räkna ut incidens Kan finnas bias i utfall, dyr, tar lång tid, ej bra för ovanliga sjukdomar, kan bara studera ett fåtal exponeringar, bortfall kan vara problem Fall-kontrollstudie inom kohortstudie Ger en möjlighet att värdera multipla exponeringar inom en kohort och kombinera fördelar med både en kohort­ och fall-kontrollstudie Ofta små studier Randomiserad studie (experimentell studie) Bästa design, kontrollerar för både okända och omät­ bara confounders Dyr, konstgjord, etiska invändningar kan finnas, svårast att genomföra Epidemiologisk studie Större djup i studie, kopplad med tumör­ möjliggör studier av meka­ biologisk studie nismer och ger en säkrare bas för kausalitet (Bearbetat efter Grisso, Lancet -93.) © Studentlitteratur 59 Kapitel 4 Tabell 4.10 Exempel på riskberäkning. Riskfaktor + – Sjukdom + – a c b d a, b, c, d beskriver antal individer i korstabell Sjukdomsdifferens exponerade/oexponerade = a/a+c - b/b+d Relativ risk = (a/a+c) / (b/b+d) Oddskvot = (a/b) / (c/d) = ad/bc Sjukdomsdifferens och relativ risk används vid kohortstudier och sjukdomsdifferens och oddskvot vid fall–kontrollstudier. SMR (standardised morbidity/mortality ratio) utgör ett synonymbegrepp för relativ risk. Hypotetiskt exempel Rökning + – Blåscancer + 50 50 – 25 75 Sjukdomsdifferens exponerade/oexponerade = 50/50 + 25 –50/50 + 75 = 50/75–50/125 = 4/ 15 Relativ risk = (a/a + c) / (b/b + d) = (50/75) / (50/125) = (2/3) / 0.4 = 1.65 Oddskvot = (a/b) / (c/d) = ad/bc = 50 × 75 / 50 × 25 = 3 Risker brukar dessutom presenteras med konfidensintervall (95 % oftast). Oddskvot = 2.3 (95 % CI 1.2-4.7) Vid dessa dominanta syndrom kan ibland risken vara förknippad med att insjukna i en enda tumörsjukdom, men risken kan också involvera ett par BR 48 BR 68 BR 45 BR 33 BR 72 OV 54 BR 39 BR 62 BR 28 Figur 4.9 Familj med ärftlighet för bröst- och äggstockscancer. Ålder vid insjuk­ nande illustreras liksom tumörtyp (BR – bröstcancer. OV – äggstockscancer). Notera att män kan förmedla anlaget i familjen utan att själva insjukna. Alla i släktträdet behöver inte ha fått sjukdomen av starkt disponerande gener. Exempel­ vis kan bröstcancer vid 72 års ålder vara ett sporadiskt fall. 60 © Studentlitteratur Orsaker till cancer till många olika typer av maligna tumörsjukdomar. Under de senaste tjugo åren har en dramatisk ökning av kunskapen på detta område skett. Koppling till gener, kloning av gener med tillkomst av mutationstest har ytterligare skärpt definitioner av syndrom vid sidan av att enbart använda individens släktträd för genetisk utredning. Tabell 4.11 Risk I:grads släkting. Bröstcancer Äggstockscancer Livmodercancer Melanom Lungcancer Tjocktarmscancer Magcancer Prostatacancer RR (relativ risk) Livstidsrisk M K 2,2 5,4 2,7 2,5 2,7 3,4 2,6 2,0 0,1 % 1–3 % 4% 3–4 % 2% 10 % 10 % 1% 2% 1–3 % 1,5–2,0 % 4% 1,5–2,0 % (Efter Easton och Peto, 1990.) Tabell 4.12 Kolorektalcancer. Affekterad släkting RR Livstidsrisk En förstagradssläkting x3 1/17 En förstagradssläkting före 45 års ålder x5 1/10 En första- och en andra­ gradssläkting 1/12 Båda föräldrar 1/8,5 Två förstagradssläktingar 1/6 Tre förstagradssläktingar 1/2 (Efter Murday, 1990.) © Studentlitteratur 61 Kapitel 4 Tabell 4.13 Dominant ärvd genetisk predisposition för tumörer. Syndrom Tumörtyper Kromosom Gen Lokal/Funktion Bröstcancer i ung ålder bröst bröst, prostata bröst, ovarie 17q 13q 17q BRCA1 BRCA2 BRCA1 kärna/? ?/? kärna/? Familjär adenomatös polypos kolorektala adenom, koloncancer 5q APC cytoplasma/ β-cateninbindande Hereditär icke polypos­ relaterad koloncancer kolonadenom, koloncancer, endometriecancer 2p 3p 2p 7p hMSH2 hMLH1 PMS1 PMS2 kärna/DNA mismatch repair genes Familjära melanom melanom 9p 12q p16 CDK4 kärna/kinasinhibitor mutation i p16s bind­ ningsställe medför utebliven hämning av onkogenprodukt Gorlins syndrom basalcellscancer medullablastom 9q ? ?/? Li-Fraumeni leukemi, mjukdelssar­ kom, osteosarkom, hjärntumör, bröst- och binjurebarkscancer 17p p53 kärna/reglerar transkription Multipel endokrin neoplasi typ 1 (MEN 1) paratyreoidea, endokrina pankreas, hypofys 11q ? ?/? Multipel endokrin neoplasi typ 2 medullär tyreoideacancer, 10q feokromocytom RET ?/? Neurofibromatos typ 1 perifera neurofibrom 17q NF1 cytoplasma/GTPas aktiverande protein Neurofibromatos typ 2 centrala schwannom meningeom 22q NF2 integration av cyto­ skelett med plasma­ membran Retinoblastom retinoblastom, osteosarkom 13q Rb kärna/reglerar transkription Tumörsjukdom vid f.a. tobaks- och alkoholrelaterad cancer lungcancer, esofagus, magsäck, nasofarynx, tjocktarm, njurcancer (konstitutionell trans­ lokation t(3,8)) 3p FHIT enzym/histidin triadfamilj von Hippel-Lindau njurcancer 3p VHL ?/? Wilms tumör nefroblastom 11p WT1 kärna/reglerar transkription Familjär bröst- och ovarialcancer (Bearbetad efter Kinzler, Vogelstein.) 62 © Studentlitteratur Orsaker till cancer Den molekylära bakgrunden till hereditär genetisk predisposition vid tumörsjukdomar börjar bli känd och viktiga generella mekanismer har bli­ vit klarlagda. Vid dominanta syndrom anses att patienterna föds med en mutation och endast en eller ett begränsat antal genetiska skador behövs ytterligare för att åstadkomma tumören (Knudsons tvåstegshypotes), se figur 4.10. Retinoblastom, en ögontumör, som både finns familjärt och spo­ radiskt och som drabbar unga individer, har mycket grundligt studerats i detta avseende. Man har härvid lokaliserat den ansvariga genen för retino­ blastom till den långa armen av kromosom 13 (band q14) och klonat den. Hereditära fall av retinoblastom debuterar tidigare och har ofta bilateral sjukdomsutbredning jämfört med sporadiska fall. Detta motsvaras av att patienterna med den hereditära formen redan har det ena anlaget utslaget (genom mutation från moder eller fader) och bara behöver få den andra allelen muterad för att insjukna, medan de sporadiskt uppträdande retino­ blastomen debuterar senare och ofta unilateralt. Här behöver båda anlagen slås ut innan tumörsjukdom uppträder (se figur 4.10). 1. Medfödd disposition Normal vävnad + rb rb + rb 2. Sporadisk tumör Normal vävnad + + Figur 4.10 Medfödd och spora­ diskt uppträdande tumörsjukdom. Principiell bild illustrerad med re­ rb tinoblastom. Vid sporadiskt uppträdande tumör krävs två mutagener efter födelsen för att tumör skall uppstå medan vid Tumör medfödd tumördisposition en mu­ tation redan finns vid födseln och endast en mutation måste ske se­ rb rb nare i livet för tumöruppkomst. Fylld box illustrerar muterad alTumör Hos ytterligare 20 % av patienterna med tumörsjukdom är den ärftliga belastningen ej lika tydlig och uppfyller inte helt kriterier för monogen ned­ ärvning. Man talar här om polygen nedärvning och man har postulerat att flera olika gener är inblandade samtidigt. Hos majoriteten av patienter med elakartade tumörer upptäcks ingen ärftlig belastning. Detta tillsammans med andra iakttagelser (som de stora geografiska skillnaderna i cancerföre­ komst) har fått forskare att postulera att miljöfaktorer är mycket viktiga för cancerinsjuknandet generellt. © Studentlitteratur 63 Kapitel 4 Tabell 4.14 Exempel på metoder vid epidemiologiska ärftlighetstudier vid cancer. Typ av studie Målsättning Nackdel Korrelationsstudier Hypotesgenererande Ger inget svar på ärftlighets­ mönster, ytlig, behöver ej vara kausalsamband Fall–kontrollstudier Hypotesgenererande kräver få individer, snabb. Möjliggör särskiljande av miljöfaktor och ärftlig faktor och studier av mul­ tipla etiologiska faktorer. Billig, kräver relativt litet material Bias kan uppstå vid val av kontrollgrupp, exponering kan lätt bli bias, kan ej räkna ut incidens. Ger inget svar på ärftlighetsgång Kohortstudier Se tabell 4.8 Se tabell 4.8 Kopplingsanalyser Möjliggör studier av associerade alleler och gener för genlokalisation Kan ge indirekta samband Segregationsanalys Ärftlighetsmönster kan studeras Ibland starkt beroende på de antaganden man gör om statistisk modell Tvillingstudier Jämförelse mono/dizygota tvillingpar Graden av heritabilitet kan uppskattas Adoptionsstudier Miljö kontra arv kan studeras Tvillingresultat behöver ej vara helt generaliserbara till andra populationer Som ovan Tre typer av genetiska mekanismer har framförallt diskuterats i samband med canceruppkomst; dominanta s.k. onkogener, recessiva s.k. suppressor­ gener och mutationer i gener som ökar den genetiska instabiliteten i celler, s.k. mutatorgener. Det står nu klart att onkogener utgörs av normalt regle­ rande gener som under vissa omständigheter stimulerar till proliferation. När nu en sådan gen (protoonkogen) aktiveras vid fel tidpunkt i en speciell vävnad uppstår betingelser som kan gynna tumöromvandling. En sådan aktivering kan uppstå genom olika genetiska mekanismer t.ex.; transloka­ tioner, punktmutationer och genamplifiering. I faktarutan på s. 68 anges två 64 © Studentlitteratur Orsaker till cancer viktiga, hos människa kända, mekanismer för onkogenaktivering vid trans­ lokationer. Det har uppskattats att av ungefär 50 000 olika gener hos män­ niskan utgör mindre än 100 potentiella onkogener. Produkter från proto­ onkogener/onkogener kan vara involverade i många olika aspekter av cellreglering som tillväxtfaktorer eller tillväxtfaktorreceptorer, tyrosinkina­ ser eller DNA-bindande protein. En andra typ är tumörsuppressorgener. Dessa gener fungerar som skyddsfaktorer för canceruppkomst genom att ofta nedreglera viktiga cell­ cykelsteg. Förlust av ena allelen leder till disposition för cancer, medan för­ lust av även andra allelen leder till tumöromvandling. Patienter med heredi­ tär cancer ärver redan mutationen i ena allelen och behöver därför endast drabbas av förlust av den andra för att utveckla tumör, medan patienter utan disposition drabbats av minst två mutationer innan man utvecklar tumörTabell 4.15 Hereditära tumörsjukdomar och sjukdomsbild. Ärftlighetsgång Polyposis coli AD Multipel endokrin neoplasi I (MEN I) AD Multipel endokrin neoplasi II (MEN II) AD Dysplastiskt nevussyndrom Retinoblastom AD AD Basalcellsnevussyndromet AD Sjukdomsbild Multipla adenomatösa polyper, adenokarcinom i tjocktarm, vissa har osteom, fibrom, lipom och epidermala cystor (Gardners syndrom) Hypofysadenom paratyreoideaadenom ö-cellstumör binjuretumör tarm- och bronkialcarcinoid Feokromocytom medullär tyreoideacancer paratyreoideacancer ibland neurofibrom Malignt melanom Ögontumör benägenhet för strålinducerade osteosarkom i orbita osteosarkom i nedre extremiteter Basalcellscancer medulloblastom ovariella fibrom utvecklingsdefekter i vissa fall AD = autosomalt dominant © Studentlitteratur 65 Kapitel 4 Tabell 4.16 Exempel på några tillstånd/sjukdomar med ärftlig komponent som ökar risken för att få en malign tumörsjukdom. Tumörsjukdomar Autosomala dominanta tillstånd Neurofibromatos Sarkom, gliom (hjärna, n. opticus), akusticus neurinom, meningeom och akut leukemi Tuberös skleros Hamartom i olika organ, hjärntumörer (framför allt jättecellsastrocytom) von Hippel-Lindaus syndrom Angiom i retina och cerebellum, njurcancer, phaeokromocytom och i vissa fall ependymom Peutz-Jeghers syndrom Hamartom i GI-kanal, cancer i GI-kanal, ovarialtumörer Cowdens syndrom Orala papillom, bröstcancer, tyreoideacancer och koloncancer Kromosomrubbningar Downs syndrom, trisomi 21 Klinefelters syndrom, XXY Leukemi, lymfom Manlig bröstcancer Allelförluster/mutationer Deletion av 13q14 Deletion av 11p13 Mutation av 17p Retinoblastom Wilms tumör Sarkom, bröstcancer, leukemi, hjärntumör DNA-reparationsdefekter, autosomalt recessiva* Xeroderma Pigmentosum Fanconis anemi Ataxia telangiectasia Hudcancer AML, skivepitelcancer i slemhinnor Lymfom, ALL, magcancer, bröstcancer (ökad risk hos heterozygoter) Immundefektssyndrom, autosomalt recessiva X-linked agammaglobulinemi Wiskott-Aldrich syndrom Lymfom, leukemi Lymfom, leukemi Vissa andra tillstånd Tylos Alfa-1-antitrypsinbrist Esofaguscancer Levercancer *Även heterozygoter har befunnits ha en ökad risk för tumörsjukdom och i och med att frekvensen hete­ rozygoter är betydligt större än homozygoter kan detta i vissa situationer ha stor betydelse. Vid ataxia teleangiectastia har heterozygotfrekvensen i befolkningen uppskattats till mellan 1–5 %. Dessa indivi­ der kan ha en ökad risk för bröstcancer och möjligen andra tumörsjukdomar. Vidare kan det vara så att en ökad känslighet för joniserande strålning och kemoterapi föreligger i denna grupp. 66 © Studentlitteratur Orsaker till cancer 5q mutation eller APC genförlust DNA hypometylering 12p mutation KRAS 18q förlust DCC? 17p förlust TP53 Andra förändringar Tid Normalt epitel Hyperproli­ ferativt epitel Tidigt Intermediärt Sent adenom Karcinom Metastaser Figur 4.12 Molekylärbiologisk modell för tjocktarmscancerutveckling vid familjär adenomatös polypos. Tumörutvecklingen sker efter förutsägbara genetiska steg. (Efter Fearn och Vogelstein, 1994) sjukdom. Således är den tumörskapande bilden recessiv på cellnivå medan disposition i släktträdet leder till en dominant nedärvningsbild. Vid jäm­ förelse av normalvävnad och tumörvävnad för olika alleler hos patienter/ familjer med en tumörsjukdom kan man undersöka tumörmutationer i suppressorgener. Canceromvandlingen tros gå igenom vissa steg av förutsägbara genför­ ändringar som börjar genom mutation i normalt epitel (se figur 4.12 och A b* b* N T A B a B A B a b* b* N T a b* b* N T Figur 4.11 Familj som kan ha ärftlig tumörsjukdom. Kvadrater är män och ringar kvinnor. Fyllda symboler är individer som drabbats av sjukdom. N står för normal­ vävnad och T för tumörvävnad. Man kan se att i tumörvävnaden har allelen A/a tappats bort. S.k. loss of heterozygosity föreligger. Allelen b* är muterad i germ line och ärvs dominant. (Obs! i detta schematiska exempel är familjestorleken av illustrationsskäl för liten för att avgöra ärftlighetsgången.) Endast individer med b*allel insjuknar. © Studentlitteratur 67 Kapitel 4 Mekanismer för onkogenaktivering vid translokationer I figuren anges de två viktigaste och mest kända mekanismerna för onkogenakti­ vering vid tumörkromosomtranslokationer hos människa. 1. Vid Burkitts lymfom sker vanligen en translokation mellan kromosomerna 8 och 14, t (8;14) (q24;q32). Protoonkogenen myc translokeras till kromosom 14 och kommer under inflytande av promotorn till immunglobulingenen belä­ gen på kromosom 14. Denna promotor i lymfocyter är påslagen då ständig produktion av immunoglobuliner sker här och därigenom uttrycks myc-genen med konsekvenser för tumörutveckling. 2. Vid kronisk myeloisk leukemi föreligger en translokation mellan kromosom 9 och kromosom 22. Vid denna translokation bildar delar av abl-genen från kro­ mosom 9 och delar av bcr-genen på kromosom 22 en fusionsgen med en ny genprodukt som har tyrosinkinasaktivitet och således stimulerar till celldel­ ning. Likartad mekanism tros föreligga vid tumöromvandlingen vid akut pro­ myelocytleukemi med t (15;17) (q22;q11–12), vissa akuta myeloiska leuke­ mier t.ex. t (8;21 (q22;q22), Ewing-sarkom t (11;22), liposarkom t (12;16) och papillär tyreoideacancer –inv10. 8 8q– 14 14q+ Immuno­ globulin Immunoglobulin MYC MYC 9 9q+ 22 BCR 22q– BCR ABL ABL 68 © Studentlitteratur Orsaker till cancer även appendix 4). Vid koloncancer som utvecklas hos patienter med polyposis coli har flera av dessa genförändringar kartlagts genom studier av polyper och tumörer i olika stadier. En mutation i APC-genen anses vara den tidigaste förändringen, åtföljd av en mutation i en av rasonkogenerna, vidare uppstår mutationer i p53-genen och i DCC-genen (kromosom 18). Medan mutationer i rasgenen kommer tidigt spelar det sannolikt inte så stor roll om p53-mutationen föregår förändringar av DCC-genen eller vice versa. Klonala tidiga kromosomförändringar har tillmätts en stor vikt för att beskriva tumörevolutionen och andra tentativa modeller vid andra tumör­ sjukdomar har postulerats. Vid hjärntumör (astrocytom) har en liknande modell som vid koloncancer med initial inaktivering av p53-genen, åtföljt av förlust av en gen på kromosom 9 (kandidatgener interferoner och multi­ ple tumor suppressors 1 och 2) och onkogenamplifiering av epidermal growth factor-receptorn. Slutligen sker en förlust av ena kopian av kromo­ som 10. En rad frågor är ännu obesvarade om den genetiska tumörevolutionen. Varför skiljer sig olika celltyper i vilka mutationer som är nödvändiga för att cellen skall övergå i en malign tumör? Hur är det möjligt att fem eller flera mutationer kan ackumuleras i en cell givet att varje händelse är sällsynt? En nyligen beskriven grupp av gener, som producerar proteiner som är ansva­ riga för att identifiera och reparera DNA-skador/misstag som uppkommit under cellens replikation, kan vara en del av förklaringen. Om dessa missmatch repair-gener skadas kommer antalet mutationer som propageras till dottercellen att öka dramatiskt. Dessa mutatorsgeners roll har framför allt vid koloncancer visat sig ha stor betydelse (se senare diskussion om heredi­ tär koloncancer). Olika vävnadsspecificitet för olika mutatorgener diskute­ ras som en möjlig orsak till att olika vävnad uppvisar olika disponerade mutationer för karcinogenesen. En annan mekanism för att tumöromvand­ ligen skall ske snabbare är att vissa mutationer dessutom kan ha multipla effekter genom att exempelvis påverka både cellproliferation och tumör­ kärlsbildning. Denna nya kunskap om tumörevolution kan ha mycket spän­ nande framtidsimplikationer för bl.a. tumörterapi och tumördiagnostik. Ökad kunskap inom detta område kan komma att leda till att läkemedel utvecklas som motverkar effekter av specifika mutationer och på så sätt gör att tumörutvecklingen sker långsammare eller hindras. Vissa rön tyder på att det kan räcka med att korrigera effekter av en eller ett par mutationer för att revertera en tumörcell. Genom att hitta tidiga mutationer i en vävnad under en tumörevolution kommer man sannolikt att mycket tidigt hitta en malign tumör. Detta kan komma att bli ett viktigt instrument vid screening­ undersökningar av högriskpopulationer. © Studentlitteratur 69 Kapitel 4 P53-genen (belägen på kromosom 17:s korta arm, 17p) tros koda för ett protein som bromsar cellen vid övergång mellan G1- och S-fas så att repa­ ration av DNA-skador lättare skall ske före celldelningen. Förlust av denna allel/gen leder till att sådana skador ackumuleras och att därför tumör­ omvandling lättare sker. Genen, som är en stor gen, har fem områden som evolutionärt är bevarade. Mutationer i dessa områden är därför nödvändiga för tumorigenesen. Mutationer förekommer ofta vid många olika tumör­ former. Man har vid olika studier visat att olika exponeringar ger upphov till benägenhet för specifika mutationer, se tabell 4.1 (t.ex. har hepatit B­ infekterade levercancerpatienter oftare mutationer i kodon 249). En med­ född mutation i denna gen disponerar vissa relativt sällsynta familjer till cancersjukdom i tidiga år, Li-Fraumeni-syndromet eller SBLA-syndromet. (I det klassiska Li-Fraumeni-syndromet har indexfallet sarkom före 45 års ålder associerat med sarkom, bröstcancer, binjurebarkstumör, leukemi och hjärntumörer hos förstagradssläkting före 45 års ålder och cancersjukdom hos en annan släkting före 45 års ålder eller sarkom oavsett åldern.) Risken att tumörsjukdom utvecklas före 50 års ålder hos individer som bär på p53mutationen kan vara så hög som 90 %. Syndromet är dock sällsynt då min­ dre än 1 % av alla bröstcancerpatienter har konstitutionella mutationer i p53. En ökad risk av mutationer har också visats hos barn med multipla tumörsjukdomar (7 %). Det står också klart att alla familjer, som uppvisar en klinisk bild som vid Li-Fraumeni-syndromet, inte har konstitutionella mutationer (bara ungefär 50 %). Detta kan delvis bero på svårigheter att mäta mutationer då genen är en mycket stor gen. Likaså har det blivit uppenbart att vissa familjer, som inte uppfyller kriterier på syndromet och som designerats Li-Fraumeni-lika, uppvisar mutationer. En starkare asso­ ciation finns också för patienter med osteosarkom och rabdomyosarkom än andra sarkompatienter till att ha mutationen. Svårigheten är alltså att hitta en eventuell mutation, men har mutationen identifierats, kan den användas för prediktion i den givna familjen. Genom kopplingsanalyser har man hos familjer med hereditär bröst- och ovarialcancer och familjer med hereditär ”early onset breast cancer” funnit att ungefär 95 % av bröst-ovarialcancerfamiljerna och 45 % av tidigt debu­ terande bröstcancer kan knytas till allelförluster hos en gen på långa armen av kromosom 17, nämligen 17q. Själva genen klonades i oktober 1994. Vad skall förväntas angående hereditär bröstcancer på basen av BRCA1? Preliminära data talar för att ungefär 1/800 (1/300–1/2 000) i allmänbefolk­ ningen är bärare av mutation i genen. Sjukdomspenetransen för bröstcancer har uppskattats till mellan 80–90 %. Ungefär 60 % av mutationsbärare utvecklar under sin levnad äggstockscancer. Vid bröstcancer med insjuk70 © Studentlitteratur Orsaker till cancer nande före 40-årsåldern är ungefär 8 %, 40–50 år 4 % och över 50-årsåldern 0,9 % BRCA1-associerade.Vid ovarialcancer med insjuknande före 40-årsåldern är ungefär 5,5 %, 40–50 år 4,2 % och över 50-årsåldern 1,7 % BRCA1-associerade. I tabell 4.17 har sannolikheten att olika konstellatioTabell 4.17 Uppskattad risk att ha BRCA1-mutation i relation till familjekonstella­ tion. Släktbild (cancertyp/ålder vid insjuknande) Sannolikhet att fall har BRCA1-mutation En person affekterad Bröstcancer >50 år Äggstockscancer >50 år Bröstcancer 40–49 år Bröstcancer <40 år Äggstockscancer <50 år Bröstcancer <30 år 0,01 0,02 0,03 0,06 0,07 0,12 Syskonpar affekterat Bröstcancer 40–49 år, bröstcancer 40–49 år Bröstcancer <40 år, bröstcancer <40 år Bröstcancer <50 år, äggstockscancer <50 år Äggstockscancer <50 år, äggstockscancer <50 år 0,20 0,37 0,46 0,61 Familj affekterad Bröstcancer bara, ≥3 fall diagnostiserade <50 år ≥2 med bröstcancer med ≥1 med äggstockscancer ≥2 med bröstcancer med ≥2 med äggstockscancer 0,40 0,82 0,91 (Efter Easton 1994.) ner av bröst- och/eller äggstockscancerinsjuknande i en familj är associerat med BRCA1-mutationer kalkylerats på basen av hittills rapporterade famil­ jer (adapterat efter modell av Easton). I figur 4.15a har den kumulativa pro­ portionen av BRCA1-mutationsbärare som utvecklar bröstcancer angivits i relation till ålder och i relation till bröstcancerinsjuknande i allmänna befolkningen. Ur figuren kan läsas att redan vid 50 års ålder har uppemot 60 % av mutationsbärarna insjuknat i bröstcancer jämfört med normalbe­ folkningens 2 %. Risken (andelen bröst- och äggstockscancer) är heterogen mellan olika familjer. Det är oklart om det är mutationstyp, miljöfaktorer eller modifierade gener som styr andelen äggstockscancerfall i familjerna. Okonfirmerade data kan tala för att bärare av sällsynta alleler för Harvey­ © Studentlitteratur 71 Kapitel 4 ras-onkogenen bland BRCA1-mutationsbärare har en ökad risk för ovarial­ cancer och att familjer med tidiga mutationer i BRCA1-genen har fler ova­ rialcancerfall. Genens normala funktion är till stor del okänd, men höga nivåer av mRNA har påvisats bl.a. i thymus, testis, äggstock och bröst. Troligtvis är funktionen av BRCA1 relaterat till tidiga utvecklingen av bl.a. bröst och äggstockar och sålunda är uttrycket av genen sannolikt viktigt mycket tidigt under embryogenes eller tidigt liv (pre- och peripubertalt). Genen är indi­ rekt styrd av könshormoner (östrogen och progesteron) och uttrycket i BRCA1 är uppreglerat vid perioder av snabb cellproliferation i bröstepite­ let. Preliminära data talar för att genprodukten från BRCA1 bara hittats hos däggdjur. Förlust av både anlagen hos en mus (homozygot förlust) leder till att musen dör intrauterint i grava missbildningar av CNS. Det är oklart om BRCA1 har någon betydelse för utveckling av icke hereditär bröstcancer även om preliminära data talar för att förlust av mRNA-nivåer i vävnaden är kopplat till mer aggressiva brösttumörer. Sambandet med BRCA1 kan både analyseras med kopplingsanalys och mutationsanalys. Genen är mycket stor och hittills är de flesta mutationer som hittats unika för respektive familj. Detta gör att det är mödosamt att leta mutationer och detta kan ligga bakom att fler familjer uppvisar signifi­ kant koppling än vad som hittas med mutationsscreening. Ytterligare en gen för tidigt uppträdande bröstcancer har tidigare kopp­ lats till långa armen på kromosom 13 (BRCA2) och har nu klonats. Muta­ tioner i detta anlag kan svara för 1/3 av hereditär bröstcancer. Anlagsbärare har en ökad risk för bröstcancer, manlig bröstcancer och prostatacancer. Vidare kan det förekomma en överrepresentation av larynxcancer, ägg­ stockscancer och melanom (speciellt okulära). Förekomsten av äggstocks­ cancer är dock mycket lägre än vid BRCA1. Sjukdomspenetransen för denna gen är något lägre än för BRCA1 och har uppskattats till 70 %. En annan gen, ATM (ataxia telangiectasia muterad), som är muterad vid den autosomala recessiva sjukdomen ataxia telangiectasia, har nyligen klo­ nats. Homozygoter drabbas bl.a. tidigt av cerebellär degeneration (manifes­ terad genom ataxier), neuromuskulär degeneration, telangiectasier i hud och konjunktiva och svåra defekter i det cellmedierade och humorala immunför­ svaret (medförande recidiverande sinuiter). Vidare inkluderar symtombilden tillväxtretardation, prematurt åldrande och en benägenhet att utveckla maligna lymfom. Patienterna dör vanligen mellan 10–30 års ålder. En kraf­ tigt ökad känslighet för joniserande strålning har noterats och en kromoso­ minstabilitet har åtföljt syndromet. Själva sjukdomen ataxia telangiectasia, där båda allelerna för ATM-genen är muterad (homozygoti), är mycket ovan72 © Studentlitteratur Orsaker till cancer lig och förekommer i en incidens mellan 1/40 000–1/100 000. Emellertid är det vanligare att ha ett defekt anlag och det har beräknats i populationen att mellan 0,5–1,4 % är bärare (heterozygoter) av en sådan mutation. Studier av heterozygoter har visat på att dessa också har en ökad radiosensibilitet, som ligger mellan homozygoternas extrema känslighet och normalpopulationens känslighet. Vidare har studier av kvinnliga heterozygoter visat på att dessa har en kraftigt ökad risk för bröstcancer och på grund av den relativa höga prevalensen av heterozygoter i befolkningen har man postulerat att uppemot 8 % av all bröstcancer skulle kunna bero på mutationer i ATM-genen. På grund av den ökade radiosensibiliteten har det postulerats att anlagsbärande kvinnor borde undvika exposition för joniserande strålning (inkluderande vanliga röntgenundersökningar som mammografi). Det är också möjligt att tumörsjukdom hos ATM-anlagsbärare borde behandlas med en lägre dos strålbehandling än som är vanligt, eftersom mutationen både finns i normal­ och tumörvävnad. ATM-genen är stor och transkriptet utgörs av 12 kiloba­ ser. Hittills förekommer ett stort antal spridda mutationer i genen. ATM­ genens normala funktion är ännu inte i sin helhet än utredd, men genproduk­ ten liknar fosfatidylinositol-3 kinaser och har därför postulerats att vara involverad i cellens tillväxtkontroll antingen genom att vara med i en signal­ kedja som får cellen att sluta dela sig när en DNA-skada sker eller genom att hjälpa cellen att hitta en DNA-skada så att denna skada kan repareras innan cellen delar sig. Fortsatt forskning om ATM-genen och dess kliniska bety­ delse kommer att ha hög prioritet eftersom denna gen kan vara den hittills vanligaste predisponerande bröstcancergenen. Preliminära studier antyder dock att dess betydelse vid bröstcancer kan vara överskattad. Hos en mindre andel patienter med kolorektal cancer, 10–20 %, uppstår tumörsjukdomen på grund av en stark predisposition för tumörsjukdom. Släktsambandet följer ett dominant nedärvningsmönster. En genbärare i en familj kan ha uppemot 80–100 % risk att under en livstid utveckla kolorek­ tal cancer. Familjemönstren kan variera så att i vissa familjer sjukdomsris­ ken enbart är kopplad till en risk för kolorektal cancer, medan i andra famil­ jer en ökad risk för andra tumörer som endometrie-, mag-, bröst- och ovarialcancer och hjärntumörer kan föreligga. Tumörsjukdom hos pre­ disponerade individer kännetecknas av att sjukdomen debuterar i tidigare ålder än dess sporadiska motsvarighet och att en predisposition finns för multipla tumörer. Tumörutvecklingen anses i de flesta fall gå över hyperplasi-polyp (ade­ nom)-cancersekvens. En molekylärbiologisk modell för koloncancerut­ veckling som Vogelstein presenterat har rönt stor uppmärksamhet och anses vara giltig både för cancer vid hereditär kolonpolypos (HPCC) och vissa © Studentlitteratur 73 Kapitel 4 genetisk orsak genetisk orsak MLH1, (3p21.3) MSH2, (2p21) PMS1 PMS2 ? HNPCC hereditär icke polypos­ relaterad koloncancer APC MCC, (5q21) SCRC sporadisk kolorektal cancer 5% 20 % >70 % koloncancer proximal koloncancer pseudo-diploid tumör mutator fenotyp mismatch repair defekt microsatellit instabilitet genetisk orsak FAP familjär adenomatös polypos 5% kolorektal cancer distal kolon och rektal cancer hyperdiploid tumör multipla allelförluster Figur 4.13 Olika steg i koloncancerutvecklingen. sporadiska kolorektala karcinom (se figur 4.12). Vissa former av hereditär koloncancer anses också utvecklas från s.k. flata adenom. Vid HPCC kännetecknas disponerade individer av att tjocktarm och rek­ tum utvecklar ett stort antal polyper, mer än 100, innan debut av malign sjukdom. Vid 15 års ålder har 50 % och vid 35 års ålder har 95 % av patien­ terna utvecklat adenom (figur 4.15b). Cancer utvecklas vid HPCC oftare i vänster kolon (84 %). Medelålder vid cancerinsjuknande har varierat från 34,5 till 43 år. Polypos och tumörbildning kan också finnas i andra delar av tarmkanal (duodenum och ventrikel). Vid hereditär icke polyposrelaterad koloncancer (på engelska hereditary non polyposis kolon cancer – HNPCC) följes oftast sekvensen hyperplasi-polyp(adenom)-cancer vid tumörutveck­ lingen. HNPCC-familjer har ofta en sjukdomsdebut i höger kolon (50– 60 %) till skillnad från HPCC-familjer där hela tarmen är riskorgan och polyposen även finns distalt. HPCC anses utgöra högst 1 % av alla kolorek­ talcancrar medan HNPCC anses vara vanligare och utgöra mellan 5–10 % av alla maligna kolontumörer. I befolkningen kan mutationsbärarfrekven­ sen för HNPCC vara så hög som 1/400. Vid HNPCC kan associerade tumö­ rer till syndromet även uppträda i endometrium, magsäck, äggstock, njure, 74 © Studentlitteratur Orsaker till cancer Tabell 4.18 Hereditära former av kolorektal cancer. Ärftlighets- Polyper mönster Syndrombild Familjär kolonpolypos (FAP) AD adenom vanligtvis >100 med början i distala kolon, adenom kan uppträda även i tunn­ tarm och ventrikel kolorektal cancer (medelålder 39 år), tunntarmscancer, magcancer, papillär tyreoideacancer, sarkom, hjärntumörer Hereditär icke polyposrelaterad koloncancer (HNPCC) AD enstaka adenom kolorektal cancer, (medelålder 44 år) endometrial cancer, äggstockscancer, tunntarmscancer, magsäckscancer, njurbäcken- och uretär­ cancer ”Hereditary flat adeno­ masyndrome” (flata adenomsyndromet AD adenom 5–10 st vanligen, mer sällan >100 st kolorektal cancer (medelålder 55 år) Turcots syndrom AD adenom 50–>100 st kolorektal cancer hjärntumörer Juvenil kolonpolypos AD hamartom i kolon kolorektal cancer (tunntarm, ventrikel) Peutz-Jeghers syndrom AD P-J polyper i ventrikel, tunntarm, ventrikel, tunntarm, kolon, äggstock, kolon testis, tumörer utgående från könslist Familjär koloncancer ? – kolorektal cancer Familjär ulcerativ kolit ?, AD polygenic pseudo­ polyper kolorektal cancer AD = autosomalt dominant. © Studentlitteratur 75 Kapitel 4 Tabell 4.18 Forts. Andra med fenotyp associerade kliniska tecken Familjär kolonpolypos (FAP) Hereditär icke polyposrelaterad koloncancer (HNPCC) ”Hereditary flat adenoma syndrome” Turcots syndrom Juvenil kolonpolypos Peutz-Jeghers syndrom Familjär koloncancer Familjär ulcerativ kolit Crohns sjukdom Familjär kolonpolypos (FAP) screening Hereditär icke polypos relaterad koloncancer (HNPCC) Mutationstestade (anlagsbärare) 76 Gardners syndrom (epidermoida cystor i hud, osteom i mandibel, hypertrofi av retinalt pigmentepitel) Desmoida tumörer, funduskörtelpolyper, binjure­ adenom Muir-Torres syndrom (multipla keratoakantom, sebaseösa adenom och karcinom) funduskörtelpolyper (cafe au lait märken och pigmenterade nevi) mukotan melaninpigmentering artrit, pyoderma gangrenosum, annulära erytem vaskulära tromboser, skleroserande kolangit Screening Profylaktiska operationer Flexibel sigmoido­ skopi/rektoskopi fr.o.m. 10–12 års ålder (vartannat år, efter 40 års ålder) Pga. hög rektalcancerrisk trots totalt borttagande av kolon och rektum (stomiop. med pouch) när fenotyp identifierad (alt. op. profylaktisk subtotal kolektomi med ileorektal anastomos) Vid tumör (subtotal l kolektemi med ileorekta anastomos Koloskopi fr.o.m. Borttagande av polyper 20–25 års ålder Hysterektomi hos kvinna som fullbordat reproduktion och drabbats av kolorektal cancer Generös med endometriebiopsi (skrapning) © Studentlitteratur Orsaker till cancer Tabell 4.18 Forts. Screening Profylaktiska operationer Ej mutationstestad Koloskopi fr.o.m. 20–25 års ålder, årligen Borttagande av polyper ”Hereditary flat adenoma syndrome” Koloskopi och skopi Om för många polyper att av övre GI-kanal screena profylaktisk subtotal fr.o.m. 20 års ålder kolektomi Turcots syndrom Flexibel sigmoido- Profylaktisk subtotal kolektomi skopi/frektoskopi om kolonpolyper finns fr.o.m. 10–12 års ålder årligen Juvenil kolonpolypos Koloskopi fr.o.m. 12 års ålder Peutz-Jeghers syndrom Basundersökning Om för många polyper att koloskopi och skopi screena profylaktisk subtotal av övre GI-kanal kolektomi vid 20 års ålder, flexibel sigmoido­ skopi därefter årligen Familjär koloncancer Basundersökning vid 40 års ålder, flexibel sigmoido­ skopi därefter vart 3 år Sedvanlig kirurgi vid cancer Familjär ulcerativ kolit och Crohns sjukdom Koloskopi årligen hos patient med pankolit av mer än 8 års duration Subtotal kolektomi vid cancer, överväg profylaktisk subtotal kolektomi/proktokolektomi hos patient med persisterande höggradig dysplasi © Studentlitteratur Om för många polyper att screena profylaktisk subtotal kolektomi 77 Kapitel 4 tunntarm, urin- och gallvägar. Risken att utveckla synkron eller metakron koloncancer vid HNPCC närmar sig 25 %. Medelålder vid insjuknande är 42 år. Livstidsrisker att utveckla kolorektalcancer närmar sig 80 %, endo­ metriecancer (kvinnor bara) 45 %, magsäckscancer 20 %, gallvägscancer 15–20 %, urinvägstumörer 10 % och äggstockscancer 10 %. Den molekylärbiologiska bakgrunden till de olika syndromen har sista åren blivit känd. Vid HPCC anses den tidigaste mutationen involvera APC­ genen på kromosom 5. Genens normala funktion är att förmedla en normal celladhesion med att förmedla en negativ tillväxtsignal till cellkärnan. Mutationer i denna gen motverkar således en normal cell till cellkontakt. E­ cadherinreceptorn på cellytan samverkar med cateniner och APC-proteinet (bundna till cytoskelettet) i denna negativa tillväxtsignalverksamhet. Vid neurofibromatos typ 2 finns en mutation i NF-2-proteinet och därmed störs en liknande negativ tillväxtsignal från integrinreceptorn som tillsammans med talin, vinkulin och NF-2 (bundna till cellens cytoskelett) annars hind­ rar excessiv cellnybildning. Vid HNPCC har nyligen mutationer i ett antal gener som är involverade i DNA-reparationen beskrivits. Dessa geners homologa motsvarighet beskrevs först i bakterier. Generna har stor betydelse för s.k. missmatch DNA-repair och har som sin uppgift att känna igen felaktiga DNA-sekven­ ser som behöver klippas bort. Mutationer i dessa gener kan leda till att ett stort antal felaktiga nukleotidsekvenser uppstår. De två gener av dessa som är vanligast involverade i kolonkarcinogenes är MSH2 på kromosom 2p och MLH1 på kromosom 3p (båda är nyligen klonade). Dessa gener anses vardera svara för 40 respektive 30 % av all HNPCC (se figur 4.13). Genom att studera tumörvävnad och vid southern blot leta efter extra band från alleler med DNA-missmatch kan man screena familjer som har större san­ nolikhet att vara bärare av germ-line-mutationer i dessa gener. Både APC­ genen och DNA-missmatch repair-generna anses också spela roll för spora­ diskt uppträdande kolorektal cancer. Både APC-genen och DNA-mismatch repair-generna anses också spela roll för sporadiskt uppträdande kolorektal cancer. Detta innebär naturligtvis att tumörstudier måste åtföljas av normalväv­ nadsstudier (germ-line-studier) för att bekräfta att genen är involverad vid hereditär kolorektal cancer. Vid mutationsscreening av HNPCC-familjer har man funnit klara belägg för geografiska samband av ursprungsmutationer (s.k. foundereffekter), där i senare generationer obesläktade familjer uppvisar samma mutation, som talar för ett långt tillbaks i tiden gemensamt ursprung. Två sådana mutatio­ ner involverar hMLH1 i mellersta och södra Finland. Liknande founder78 © Studentlitteratur Orsaker till cancer effekter har setts för BRCA1 i USA och Sydsverige. Foundereffekter har också beskrivits för BRCA2 på Island och i Sydsverige. Bakgrunden till vissa fall med ärftlig anhopning av malignt melanom börjar nu bli klar. En gen på kromosom 9 ansvarig för produktion av protei­ net p16 har visat sig vara viktig för att bromsa cellens inträde i cellcykeln förbi en viktig kontrollpunkt i G1-fasen (s.k. restriction point). Mutationer i denna gen disponerar vissa familjer för hereditärt melanom (se figur 4.14). Ibland är mutationen också förenlig med en disposition för pankreascancer. Det är för närvarande oklart om när en samverkan sker med en annan gen. CDK4 i komplex med cyklin D är den onkogenprodukt som hämmas av p16. Cyklin D och CDK4 tillåter i ett senare steg en fosforylering av reti­ noblastomproteinet och därmed påbörjas transkriptionen av gener som tar cellen förbi restriktionspunkten och vidare in i S-fasen. I Sverige och Hol­ land har foundermutationer i p16-genen påvisats för melanom. I andra familjer med disposition för melanom har nyligen påvisats att mutationer i inbindningsstället för p16 i CDK4-proteinet också leder till en ohämmad cellprofileration och melanomutveckling. Intensiv forskning pågår nu runt cyklin D/CDK/retinoblastomproteinet för att belysa frågan om en dysfunk­ tion kan utgöra ett obligatoriskt steg i tumorigenesen och förhoppningar har knutits till att för första gången kan cancerforskare ha identifierat ett målområde för mutationer som är gemensamt för de flesta tumörer. Molekylärbiologiska studier av en konstitutionell translokation mellan kromosom 3 och 8 i en familj med njurcancer har lett till identifierandet av en ny cancerdisponerande gen, FHIT klonad till 3p14.2. Denna gen upp­ träder homozygot deleterad i 80 % av hittills studerade maligna tumörer från lunga, 50 % från tumörer i esofagus, kolon, magsäck och nasofarynx. Detta stödjer bilden av att FHIT är en suppressorgen med funktion att i organ där framför allt rökning och alkohol är sjukdomsframkallande skydda mot tumörutveckling. FHIT tillhör histidintriadfamiljen och fungerar som ett enzym. BRCA1-risk och penetrans Förutom nedan angivna risker för bröstcancer har en mutationsbärare en 60 % risk att utveckla äggstockscancer och en 30 % risk att få cancer i andra bröstet under sin levnad. Risken för äggstockscancer/bröstcancer liksom åldern vid insjuknande är heterogen mellan olika familjer. I Sydsverige är medianåldern för insjuknande i bröstcancer 38 år och äggstockscancer 54 år och i de flesta familjer finns både bröstcancer och äggstockscancer. © Studentlitteratur 79 Kapitel 4 Risk att insjukna i bröstcancer Mutationsbärare Ej mutationsbärare (allmänbefolkning) Ålder 40 45 50 55 65 80 16 % 42 % 59 % 72 % 80 % 86 % 0,5 % 1% 2% 3% 4% 10 % Under 1990-talet räknar man med att hitta många värdefulla anlag/gener för olika tumörsjukdomar som kommer att få stor vikt för att förstå cancerupp­ komst, tumörbiologi och prognos vid sjukdomarna. Sannolikt kommer nya behandlingar att uppstå i relation till denna nya kunskap. Familjeutredningar med prediktiv screening i disponerade familjer kommer att bli vanligt. Hereditärt melanom Hereditär pankreascancer G2 ? M G0 p16 Tillväxt­ faktorer Cyklin D Hereditärt melanom G1 S Restriktionspunkt E2F CDK4 Cyklin D RB1 E2F RB1 PO4 + CDK6 CDK4/6 G1 arrest p21/WAF1 Figur 4.14 Hereditärt melanom och pankreascancer. 80 © Studentlitteratur Orsaker till cancer Kumulativ prop. som utvecklar bröstcancer a 0,8 Bärare av BRCA1-genen 0,6 0,4 Allmän befolkningen 0,2 0 0 20 40 60 80 År Figur 4.15a Kumulativ andel av genbärare (BRCA1 = genen för 40 % av tidig bröstcancer och 80–90 % av all familjär bröst/ovarialcancer belägen på kromoso­ marm 17q) som utvecklar bröstcancer i relation till ålder vid en penetrans på 80 %. Bröstcancerinsjuknandet i allmänbefolkningen illustrerat som jämförelse. (Efter M-C. King 1994.) b Kolorektal cancer Bärarrisk Penetrans 0,5 1,0 0,4 0,3 0,5 0,2 0,1 0 0 0 10 20 30 40 År Figur 4.15b Åldersbetingad risk (streckad linje) för familjär polypos för släkting med 50 % risk för familjär polypos efter att ha genomgått en negativ tarmunder­ sökning vid respektive ålder. (Efter Burns et al 1991.) © Studentlitteratur 81 Kapitel 4 BRCA1 24 exon, 1863 aminosyror BRCA2 27 exon, 3418 aminosyror ATM (ataxia teleangiectasia gen) 63 exon, 2998 aminosyror p16 3 exon, 148 aminosyror Figur 4.16 Exempel på storlek och exonuppbyggnad hos några gener predispone­ rade för tumörsjukdom. Handläggningen av hereditär cancer kan skilja sig betydligt från spora­ diskt uppträdande fall. I appendix har exempel på handläggning av fall med hereditär bröst-, ovarial-, koloncancer och melanom givits. Möjligheter för mutationstestning och kopplingsanalys finns framför allt vid bröstcancer (BRCA1 och BRCA2), hereditär polypsis coli/koloncancer, hereditär icke polyposrelaterad koloncancer, malignt melanom, medullär tyreoideacancer och vid misstanke på Li-Fraumenis syndrom. Screening för tumörsjukdom bör börja från 25 års ålder och framåt eller 5 år innan första sjukdomsfall inträffat i familj. De screeningmetoder som framför allt används vid sidan om kliniska undersökningar är vid bröst­ cancer (mammografi), äggstockscancer (ultraljud), endometreium (ultra­ ljud) och tjocktarms- och rektalcancer (koloskopi och rektoskopi). Tumör­ markörers roll är osäker. Möjligheter finns även till prevention av dessa sjukdomar genom framför allt profylaktiska operationer. Dessa operationer kommer framför allt i fråga hos individer med en risk mellan 40–100 % att utveckla en tumör­ sjukdom. Vid bröst- och äggstockscancer kommer ofta dessa operationer först i fråga efter 35 års ålder. Sannolikt reduceras risken rejält med pro­ fylaktiska operationer av bröst, äggstock, endometrium och tjocktarm. På grund av att man i flera typer av operationer vid profylaktiska operationer kvarlämnar viss vävnad kan man inte räkna med att framtida tumörrisk helt reduceras till noll. Dock kan risksänkningar förväntas från 60–100 % till ett 82 © Studentlitteratur Orsaker till cancer par procents risk. En viss risk finns också att tumörsjukdom med metastase­ ring redan finns etablerad vid det profylaktiska ingreppet. Oklart är vilken roll manipulation av miljöfaktorer har i relation till den ärftliga benägenheten. Sannolikt spelar dock arvet i dessa familjer den klart dominerande rollen och miljöns roll skulle mer kunna vara att modifiera åldern vid insjuknandet eller sjukdomspenetransen. Det är också oklart om man kan tänka sig använda läkemedel som förebyggande medel (s.k. kemoprevention). Försök sker för närvarande t.ex. med tamoxifen hos vissa högriskpopulationer för bröstcancer. När skall man misstänka att en familj har en kraftig ärftlig disposition för tumörsjukdom? I tabell 4.19 har angivits några faktorer som man måste ta hänsyn till vid en sådan värdering. Det finns en rad skäl som gör att man underskattar betydelsen av ärftliga faktorer. För det första har genetiska epi­ demiologer svårt att karakterisera icke dominant nedärvda syndrom som recessiva tumörsjukdomar, anhopning av tumörsjukdom sent i livet, anhop­ ningar i familjer av heterogena tumörformer och nymutationer. Andra fak­ torer som leder till att betydelsen av en ärftlig faktor underskattas är att familjen är för liten, individ är adopterad, individ har migrerat och har för dålig kunskap om ursprungsfamiljen, interkurrent morbiditet och mortalitet leder till att individer dör i en konkurrerande sjukdom i tidig ålder och hin­ ner inte utveckla tumörsjukdomen, individen har fel fader och sjukdomen har inkomplett penetrans med variabelt uttryck av gen. All utredning av hereditär tumörsjukdom börjar med en släktanamnes. Ofta behöver denna upptas/kompletteras vid flera tillfällen och genom införskaffande av journalkopior och patologutlåtande. Tumörer behöver ibland eftergranskas. Cancerregister och dödsorsaksregister utgör viktiga källor för kontroll av diagnoser. För att få mer extensiv släktinformation brukar informationen från journal och patient utvidgas genom tilläggsinfor­ mation om mer avlägset belägna släktingar (utvidgade släktträd). Därefter görs en bedömning av det ärftliga sambandet tillsammans med patient och/ eller anhörig. Om misstanke finns att hereditär tumörsjukdom föreligger kan man i vissa fall komplettera utredning med analys av markörgen eller kopplingsanalys (analysera allelförekomst av mikrosatellitmarkörer som är kopplade till den gen som orsakar sjukdomen). Vid exempelvis MEN II, bröst/ovarialcancersyndromet och Li-Fraumenis syndrom används sådana kompletterande metoder. Handläggning av familjer med ärftlig disposition för tumörsjukdom stäl­ ler stora krav på att ett fungerande psykosocialt nätverk finns för uppfölj­ ning av interventionen i familjerna. Samtidigt uppkommer en rad etiska frå­ geställningar som behöver bearbetas under organisationens uppbyggnad. © Studentlitteratur 83 Kapitel 4 Diagnostik och behandling av hereditär cancer bör utformas i samråd med de regionala onkologiska råden och regionala vårdprogramgrupper. Den molekylärbiologiska utredningen bör alltid ske genom informerat samtycke och individ/familj bör innan eventuella blodprov tas och gen­ studier påbörjas informeras om vilka konsekvenser en utredning kan inne­ bära. Tabell 4.19 När skall man misstänka hereditär tumörsjukdom? 1. Tidig debutålder (oftast 10–30 år innan medianåldern för insjuknandet i sjuk­ domen). 2. Anhopningar av insjuknade i en familj särskilt hos förstagradssläktingar (t.ex. två systrar och en moder som insjuknar i bröstcancer före 45-årsåldern. 3. Multifokal presentation/i pariga organ ofta bilaterala tumörer. 4. Förekomst av ovanliga tumörer (t.ex. feokromocytom och medullär tyreoidea­ cancer). 5. Förekomst av anhopningar av vanliga tumörer som har visats ha ett hereditärt samband (t.ex. bröst- och ovarialcancer). 6. Nytt tumörfall i familj där man med kopplingsanalys eller genanalys tidigare påvisat hereditär tumörsjukdom. Det bör anmärkas att kriterierna ovan är operationella definitioner och att även ärft­ liga faktorer sannolikt spelar roll för tumörsjukdom som debuterar sent i livet. Dessa sent debuterande tumörfall har dock studerats i mindre grad. Familjer kan också vara icke informativa, t.ex. genom att familjen är för liten för en säker ärftlig bedömning, den tumörsjuke kan vara adopterad, den tumörsjuke kan ha fel fader angiven (false paternity) och den tumörsjuke kan ha emigrerat och tappat kontakten med sina biologiska anförvanter. Journal- och patologmaterial från äldre insjuknade och avlidna kan också ha förkommit vilket kan försvåra en bedömning. Vidare kan indexfallet (det nya tumörfallet) självt vara en nymutation och utgöra början på ett nytt släktträd med ärftlig disposition (se även tabell 4.22). 84 © Studentlitteratur Orsaker till cancer Tabell 4.20 Tumörsjukdomar där det redan nu föreligger klinisk indikation för genetisk utredning. Bröst/äggstockscancer Kolorektal cancer Melanom Tyreoideacancer Övriga bl.a. Njurcancer Li-Fraumenis syndrom Neurofibromatos Retinoblastom Tabell 4.21 Potentiella fördelar och risker med prediktiv testning. Test negativ + Mer än hälften av individerna bör ha negativ test (psykologisk och socioekonomisk vinst) – Risken för tumör är ej eliminerad (falsk trygghet) Test positiv + Erbjuds interventioner som kan minska morbiditet och mortalitet Friskare livsstil Kan söka för symtom tidigare Intensivare screening/profylaktiska ingrepp Kemoprevention kan övervägas – Kostnader för intervention Sceening är bara delvis lyckosam Risk för psykosociala sequele Risk för brott mot konfidentialitet/integritet Risk för jobbdiskriminering Risk för familjebildning påverkas Risk för sjukdomsprägling Risk för försäkringsbekymmer © Studentlitteratur 85 Kapitel 4 Tabell 4.22 Faktorer som leder till att genetisk risk överskattas och underskattas. Överskattar risk Minnesbias fall/kontroll Ascertainment bias (selektion av pedigrees) Screening i familj med släktanamnes Aggregation av miljöexponering Underskattar risk Liten familj Adopterad Migration/dålig kunskap om familjen Interkurrent morbiditet/mortalitet Fel fader ”Nymutation” Inkomplett penetrans och variabelt uttryck av gen Tabell 4.23 Olika förutsättningar för handläggning av olika tumörsjukdomar. Bästa scenario Sjukdom kan tidigdiagnostiseras Screeningmetoder finns och är vetenskapligt utprovade Sjukdom är botbar Sjukdom kan bättre behandlas om behandling inleds vid ett tidigare sjukdomsstadium (mindre tumörvolym) Sjukdom uppträder ej oftare tillsammans med annan tumörsjukdom hos genbärare Sämsta scenario Sjukdom kan ej tidigdiagnostiseras Sceeningmetoder finns ej och är ej vetenskapligt utprovade Sjukdom är ej botbar Sjukdom kan ej bättre behandlas om behandling inleds vid ett tidigare sjukdomsstadium (mindre tumörvolym) Tabell 4.24 Molekylärbiologiskt bästa scenario. Gen känd (en sjukdom – en disponerande gen) Relativt sällsynt sjukdom – få sporadiska fall Genens funktion känd Dominant nedärvning – tidigt insjuknande Hög sjukdomspenetrans Ej varierande expressivitet Bra screeningmetoder för mutation – gärna på proteinnivå Liten gen (få exoner, som är små) Alla polymorfier är kända i befolkningen Få nymutationer 86 © Studentlitteratur Orsaker till cancer Tabell 4.25 Mutationer. Vilka mutationer hittas? Nonsense mutationer Frameshift mutationer Vilka mutationer kan missas? Missense mutationer Mutationer i promotorregion Mutationer som påverkar splicing av mRNA Mutation i samverkande gen (coexpressed) Mutationer som tolkas som polymorfier Studier av protein blir viktigt för mutationsdiagnostik Utseende och funktion av protein Tabell 4.26 Konsekvenser av en mutation i en gen. Mutation kan drabba kodande regioner av DNA såsom exon, intron eller regulatoriska sek­ venser eller icke kodande regioner av DNA. Mutationer kan också drabba sekvenser av vikt för splicing av mRNA. Mutationer leder till att genprodukt ej förändras, förändras, minskar/ökar i mängd, eller helt försvinner. Mutationer i könscell, tidigt embryo respektive färdigutvecklad somatisk stamcell har olika konsekvenser; endast mutationer i könscell kan leda till nedärvning av mutation. En mutation i ett tidigt embryo kan leda till att individ utvecklar mosaicism för en egenskap. Tabell 4.27 Vem har BRCA1- och BRCA2-mutationer. Ungefärliga siffror i %. BRCA 1 Fall från familj med bröstcancerfall i ung ålder 20 % Fall från familj med flera bröst- och äggstockscancerfall i ung ålder 60–80 % Kvinna med bröstcancer <40 år 10–20 % Kvinna med bröstcancer någon gång under livet Askenasisk judinna 1–2 % ≈ 0,9 % Isländsk kvinna med bröstcancer © Studentlitteratur 3–7 % 0,3–0,5 % ≈ 1,1 % 8% ≈ 20 % Män med bröstcancer i Sydsverige (prel. data) Frisk kvinna i befolkningen, släkt okänd BRCA2 1/800–1/2 000 1/2 000 87 5 Diagnostik, cancerklassificering, stadieindelning och utvärdering av terapi Diagnosen vid tumörsjukdomar ställs i den övervägande majoriteten av fall med histopatologiskt vävnadsprov och/eller med cytologiskt cellprov. Ett mindre antal tumörsjukdomar diagnostiseras på endast kliniska grunder utan vävnadsprov och ytterligare en liten andel av tumörsjukdomar diag­ nostiseras först vid obduktion. Det övervägande antalet nya tumörer diag­ nostiseras genom att patienten företer symtom. Emellertid har en större andel tumörer nu börjat diagnostiseras genom screening t.ex. av bröst och livmoderhals. Tumörsjukdomar som speciellt varierar i förekomst på grund av en stor andel obduktionsdiagnoser är prostatacancer, tyreoideacancer och hjärntumörer. Att enbart kliniska undersökningar ligger till grund för en diagnos är sällsynt, men kan ibland förekomma, speciellt vid tumörsjuk­ domar hos äldre personer. Ett patologiutlåtande vid en histopatologisk undersökning av en tumör bör innehålla följande: uppgift om neoplasin uppfattas som benign, cancer in situ eller malign, patologisk tumörstorlek, utbredningen av tumörinvasi­ viteten inkluderande eventuellt lokalt/regionalt lymfkörtelengagemang, tumörgradering och operationens radikalitet. Diagnosernas tillförlitlighet varierar med tumörens likhet med ur­ sprungsvävnaden. Lågt differentierade tumörer kan ofta vara svårbestämda. Överenstämmelsen mellan olika patologer kan vara särskilt dålig vid vissa diagnoser som t.ex. maligna lymfom. Stöd av fördjupande undersökningar med immunhistokemi, elektronmikroskopi, cytogenetik och DNA-under­ sökningar kan ofta vara värdefullt för patologens bedömning. Svårigheter med korrekta diagnoser har sannolikt ökat i och med ökad användning av tidigdiagnostik vid tumörsjukdomarna. Svårighet att urskilja om en tumör är benign eller malign är särskilt stor om en tumör är högt dif­ ferentierad och mycket lik ursprungsvävnaden. Om en tumör är lågt diffe­ rentierad och mycket olik ursprungsvävnaden föreligger större svårigheter att avgöra tumörtyp än att fastställa att det rör sig om en malignitet. I figur 5.1 har tidsförloppet för en tumörsjukdom med allvarlig utgång schematiskt angetts. 88 © Studentlitteratur Diagnostik m.m. Tumörbörda Prognostisk faktor Dödsorsak cancersjukdom annan sjukdom/ tillstånd Prediktiv faktor död med cancer­ sjukdom död av cancer­ sjukdom Tid Ingen Initiering ”Screening sjukdom diagnos” Promotion Start av Remission behand­ ling Recidiv Progress Död Obduktion Symtomatisk diagnos Sjukdomsfri överlevnad Överlevnadstid från diagnos Överlevnadstid från behandlingsstart (randomiserad studie) Figur 5.1 Schematiskt förlopp av en dödlig tumörsjukdom. Den histopatologiska indelningen av tumörer (se tabell 3.1) innefattar fram­ förallt: tumörer från epiteliala ytor – egentliga cancrar, tumörer från mesodermal vävnad – sarkom, och tumörer från blod och lymfa. Efter att diagnos erhållits, ofta via ett kirurgiskt ingrepp eller cytologisk punktion, sker en stadieindelning av tumören (dess utbredning i kroppen fastställes). Olika diagnostiska metoder utnyttjas då såsom exempelvis röntgenundersökningar, punktioner, isotopundersökningar, magnetkamera­ undersökningar, skopier och operationer. För att adekvat beskriva en tumör behöver både dess läge och morfologi anges på ett standardiserat sätt. För att koda morfologi (patologi och can­ cerregister) har man valt M-SNOMED-koden (Morfologi-Standardized Nomenclature of Medicine) både nationellt och internationellt (se tabell 5.1 och 5.2). ICD-O är det allmänt använda kodsystemet för att beskriva en tumör i olika register, framförallt cancerregistret. ICD-O (International classification of diseases-oncology) består av två komponenter, dels en kod för tumörens topografi som i princip utgöres av ICD-9 koderna 140-199 och dels en kod för tumörens morfologi vilken i prinip är identisk med SNOMED-koden. Flera revisioner har använts för att beskriva tumörer i cancerregistret. Exempelvis har man sedan 1958 tidigare använt ICD-7 för detta ändamål. Översättningar finns mellan de olika kodsystemen. © Studentlitteratur 89 Kapitel 5 Tabell 5.1 Klassifikationssystem för tumörsjukdomar och dödsorsaker i Sverige. År 1951 1958 1967 1987 1993 Klassifikation av tumörsjukdomar i cancerregistret Lokal/typ Histologi ICD-7 C-24 ICD-9 ICD O-2 SNOMED Klassifikation av dödsorsaker ICD-6 ICD-7 ICD-8 ICD-9 ICD = International classification of disease SNOMED = Standardised nomenclature of medical diseases Tabell 5.2 Internationell introduktion av tumörklassifikationssystem. Tidpunkt Tumörlokal Histopatologi 1950-tal ICD-7 C-24 1968 ICD-8 (kapitel 2) SNOP (standardised nomenclature of pathology) 1976 ICD-9 SNOMED (standardised nomenclature of medical diseases) 1990 ICD-10 SNOMED (utveckling av) Gemensam beteckning – MOTNAC ICD-O ICDO-2 MOTNAC = Manual of tumor nomenclature and coding För att standardisera beskrivningen av tumörutbredning har det s.k. TNM­ systemet utvecklats. (T betecknar storleken på primärtumören, N omfatt­ ningen av regional lymfkörtelmetastasering, M närvaro av fjärrspridning.) Den ursprungliga TNM-klassifikationen byggde enbart på inspektion och palpation. Senare har fynd förts in från t.ex. histopatologiska undersök­ ningar för att vidareutveckla klassifikationen av tumörutbredningen (pTNM). Olika TNM-grupper brukar sammanföras i olika tumörstadier (se t.ex. under bröstcancer). När tumörens stadium är känt är det dags att välja terapi – ofta har man då hjälp av befintliga vårdprogram i regionen för sjukdomsgruppen. Ibland pågår randomiserade studier för vissa ålderskategorier och för vissa tumör­ stadier. 90 © Studentlitteratur Diagnostik m.m. Behandlingseffekter utvärderas genom att remissionsgraden vid sjukdom bestäms och genom att livskvalitén för patienten bedöms. Remissions­ graden bedöms som komplett remission, partiell remission, oförändrad sjukdom och progressiv sjukdom (se faktaruta). Allmäntillståndet brukar skattas enligt en skala utarbetad av Karnofsky. De senaste åren har mera utvecklade måttskalor för olika aspekter på livskvalité tillkommit. Överlevnaden för en sjukdomsgrupp beskrivs ofta i en ”life table” (se figur 5.2) eller som en relativ risk för att dö vid multivariata jämförelser. Överlevnaden kan också korrigeras för interkurrent död. Recidivfri över­ levnad är ett värdefullt mått hos patienter som inte följts upp så länge. Om inte den direkta dödsorsaken är känd kan man använda den relativa överlev­ naden då tumörgruppen jämförs med en köns- och åldersmatchad total­ befolkning. Man brukar anse att patientgruppen uppnått bot när över­ levnadskurvans lutning sammanfaller med normalbefolkningens. Det har funnits en önskan att hitta lämpliga tumörmarkörer som skulle kunna medge att man genom ett blodprov skulle kunna diagnostisera/följa upp tumörsjukdomar. Markörer kan utgöras av tumörderiverade faktorer Sjukdomsfri överlevnad, % 100 S-fas <7,0 % S-fas 7,0–11,9 % 80 S-fas ≥12,0 % 60 p = 0,0007 40 20 0 0 1 157 54 75 2 3 142 45 52 4 5 År 28 8 10 Figur 5.2 Sjukdomsfri överlevnad vid bröstcancer (univariatanalys) vid tre kate­ gorier av S-fasvärden. Höga värden har sämre prognos. Under bilden har antalet individer med risk att vid respektive tidpunkt få recidiv angivits. (Efter Sigurdsson et al. N Engl J Med 1990.) © Studentlitteratur 91 Kapitel 5 som hormon, onkofetala antigen, isoenzym, specifika protein, muciner eller andra glykoprotein, onkogener och deras produkter eller tumörassocierade (värdsvar) faktorer såsom enzymer, immunkomplex, akutfasprotein och fer­ ritin. Sådana markörer har hittills endast fått en begränsad applikation främst pga. att de först ger utslag vid relativt stor tumörbörda och dessutom har en tämligen låg specificitet. Några markörer som funnit applikation är listade nedan. Markör Sjukdom Huvudanvändningsområde B-HCG testikelcancer diagnos, prognos, trofoblasttumörer, terapiutvärdering, uppföljning diagnos, prognos, terapiutvärdering, uppföljning testikelcancer, korionkarcinom, levercancer Ca 15-3 bröstcancer Ca 125 ovarialcancer Calcitonin medullär tyreoidea­ cancer Immunglobuliner myelom CEA koloncancer PSA prostatacancer Alfa-fetoprotein prognos, terapiutvärdering? uppföljning? diagnos, terapiutvärdering, uppföljning diagnos, uppföljning uppföljning diagnos, terapiutvärdering, uppföljning, prognos Några cytologiska kriterier på atypi vid en malign tumörsjukdom har angi­ vits i figur 5.3. Till dessa kriterier hör att kärncytoplasmakvoten är ändrad från benignt epitel 1:4-6 till malignt epitel 1:1-2, att celler ligger i oregel­ bundna förband och visar tecken på dissociation, att cellkärnan varierar i form och uppvisar oregelbundenheter i kärnmembran, att kromatinteck­ ningen blir grövre – s.k. hyperkromasi och att nukleolen (-erna) förstoras. I figur 5.4 visas epiteliala tumörväxter i form av cancer in situ (tumör utan invasiv växt) och en invasiv cancer där tumören har brutit igenom basalmembran. I den invasiva tumören ökar risken för lokal- och fjärr­ metastasering med tilltagande tumörvolym. 92 © Studentlitteratur Diagnostik m.m. Hög kärna/ cytoplasmakvot Celldissociation olikstora kärnor Förtjockat kärnmembran Stora och flera nukleoler Figur 5.3 Cytologiska kriterier på atypi vid malign tumörsjukdom. Cancer in situ Invasiv malign tumör Figur 5.4 Cancer in situ och invasiv tumörväxt illustrerad. Remissionsbegrepp Komplett remission Total tillbakagång av alla manifestationer som ursprungligen fanns, bedömt vid två oberoende tillfällen med fyra veckors mellanrum. Partiell remission Minst 50 % tillbakagång av alla manifestationer som ursprungligen fanns, bedömt vid två oberoende tillfällen med fyra veckors mellanrum utan att någon ny manifestation dykt upp. Stationär sjukdom Mindre än 25 % ökning i volym av den enda eller av någon av tumör­ manifestationerna eller mindre än 50 % tillbakagång av totala tumör­ © Studentlitteratur 93 Kapitel 5 volymen, bedömt vid två oberoende tillfällen med fyra veckors mellan­ rum. Progressiv sjukdom Minst 25 % ökning av någon tumörmanifestation eller tillkomst av en ny förändring, bedömt vid två oberoende tillfällen med fyra veckors mellan­ rum. Vissa manifestationer av tumörförändringar går ej, eller är svåra, att upp­ skatta i partiell remission t.ex. skelettmetastaser, lymphangitis karcino­ matosa eller pleuravätska. Här gäller oftast endast närvaro/frånvaro av manifestation. Vid benmetastaser har särskilda responskriterier utarbetats och komplett remission är här lika med fullständigt försvinnande av alla manifestationer iakttagbara på röntgen och isotopundersökningar. Partiell remission motsvaras av ett partiellt försvinnade i storleken av lytiska lesio­ ner, rekalcifiering av lytiska lesioner och minskad täthet av osteoblastiska lesioner. Oförändrat tumörsvar bör ej bedömas förrän det gått åtta veckor pga. det långsamma synliga svaret från benmanifestationer av tumörsjuk­ domen. Progressiv sjukdom innebär ökning i storleken av en existerande lesion eller debut av nytillkommen lesion. Kompressionsfraktur med dess läkning bör inte användas som enda mått på remissionsstatus. Vid remissionsbedömningen av en manifestation är det egentligen voly­ men av tumören som bör uppskattas, ej dess diameter eller radie. Diagnosmeddelandet till patient med tumörsjukdom eller hög risk för att drabbas av sjukdom Idealt bör så liten tid som möjligt förflyta mellan att undersökningar påbörjas och att diagnosen meddelas patienten. Patienten som söker med ett symtom är ofta bättre förberedd än den vars sjukdom eller genbärarskap för cancerdisposition uppdagas via en screeningundersökning. Diagnosen kan meddelas under patientsamtalet i sekvens med ökad all­ varlighet, t.ex. genom att först nämna att man hittat vävnadsförändring, sedan att denna utgjorde en tumör och sist säga att det man funnit är en elakartad cancer. Patienten är ofta i en svår chockfas vid diagnostillfället (denna kommer att följas av en bearbetningfas, en restitutionsfas och en nyorienteringsfas) och informationen behöver upprepas. Krisreaktionen vid en svår sjukdom, som cancer, följer inte helt reaktionsmönstret vid en olycka eller förlust av 94 © Studentlitteratur Diagnostik m.m. en anhörig. Den stora skillnaden vid cancersjukdom är att den sjuke inte säkert vet vad som väntar imorgon och därför drabbas cancerpatienten ofta av återfall av upplevelser av olika faser av krisreaktionen. Under chock­ fasen, som varar minuter, hör inte patienten informationen, ser inte bilder, talar inte och beter sig förvirrat. Timmar senare och under några dagar upp­ visar patienten ångest och sorg och är ibland utagerande. Oftast är det under denna tid som patienten träffar kirurgen. Senare under krisreaktionen, när bearbetningen påbörjats, visar patienten ambivalens, talar mer, läser om sjukdomen och letar efter alternativa behandlingar. Denna fas samman­ träffar ofta i behandlingen med att patienten träffar en onkolog. När måna­ der och år gått pågår restitutionsfasen då patienten antingen lär sig leva med cancer eller permanenterar krisreaktionen. Vissa undersökningar har funnit att uppemot 40 % av alla cancerpatienter har uttalade krisreaktioner. Med professionell intervention kan gruppen reduceras till omkring 10 %. Det första samtalet bör inte vara så långt (ungefär 15–20 minuter) och bör heller inte vara för detaljerat. Patienten bör ges tillfälle att kunna reflek­ tera över situationen och ett uppföljande samtal med doktor och/eller kontaktsköterska bör ske inom nära tid. Samtalet börjar ofta med en s.k. sluten invitation: Det är något jag behöver berätta för dig när alla undersök­ ningsresultaten nu föreligger … Stegvis bygger man sedan upp informatio­ nen genom att tala allt tydligare om att sjukdomen utgör en cancer. Exem­ pelvis kan man beskriva tillståndet först som cellförändringar, sedan som tumör och sist som cancer. Samtalet får sedan karaktären av en s.k. öppen invitation då man frågar patienten om det är något som hon undrar över och öppet inviterar till frå­ gor. En fokusering på patientens affektiva gensvar är naturlig t.ex. genom att fråga om hur han eller hon mår. Ibland fångas en patients reaktion bättre på yttre kroppssignaler än genom ord. Doktorn bör försöka svara på alla patientens frågor. Skräcken för att dö föresvävar ofta patienten och doktorn bör undvika att ge direkta över­ levnadssiffror, utan istället försöka framföra synpunkter som ”du behöver inte vara rädd för att dö omedelbart” och andra positiva moment i sjuk­ domen. Massiv information i tryckt form kan motverka sitt mål. Ofta kom­ mer man längre genom att rita och berätta för patienten därför att patienten då med sina frågor styr informationsflödet. Att bygga upp och underhålla ett framtida överlevnadshopp i relation till planerad behandling kan vara viktigt. När patienten inte orkar ta emot mer information bör man avbryta sam­ talet och återkomma senare istället. © Studentlitteratur 95 Kapitel 5 De ansträngningar som en människa gör för att återvinna jämvikt och känsla av kontroll brukar på engelska kallas coping. Det finns olika coping­ strategier och dessa leder till sinsemellan mycket olika beteenden. Patienten kan vara kognitiv (t.ex. accepterar, omvärderar, förnekar och är und­ vikande) eller uppvisa aktivt beteende (agerar utåt), informationssökande, emotionell (skrattar bort, tar det lätt, undandragande och kapitulation, självömkan, urladdning) och är retrospektiv (granskar sitt liv, vill förändra sitt livsmönster). Alla dessa sätt används av människan när hon utsätts för stress. De individer som visar ett utagerande, attackerande sätt eller är undandragande har i flera studier visat sig klara sig bäst på sikt medan de som blir retrospektivt grubblande klarar sig sämst. Medan patienten kastas mellan missnöje, hopp, förtvivlan, aggressivitet, olust, äckel, fysiskt intimitet, tacksamhet, kärlek, idealisering, erotisering och resignation används förnekande, distansering, rationalisering och reg­ ression som försvar. Läkaren använder tyvärr ofta en distanserande strategi, dvs. undviker att ta upp svåra ämnen med patienten. Bland patientens frågor dyker det ofta upp tankar om att man fått cancer för att man gjort fel i sin livsföring. Vidare är det vanligt att patienten und­ rar om barnen löper en ökad risk och om cancersjukdomen smittar. Vid läkarsamtalets slut dyker ofta de mest känsloladdade ämnena upp och man bör då vara mycket lyhörd för att på så sätt fånga upp patientens frågor och kommentarer. Vid sjukdomsrecidiv uppstår ofta en allt större psykisk reaktion för varje gång. I rädslan för att dö finns också en speciell rädsla för att man innan döden drabbas av svår smärta eller kvävningssymtom. I krisbearbetningens mål ingår att stödja patientens egna läk­ ningsresurser, att understödja att patienten uttrycker sina emotioner, att inte försöka ge patienten tillbaka vad patienten förlorat, att förmedla en ökad förståelse hos patienten att krisen kommer att gå över, att lindra det psy­ kiska lidandet och att vara lyhörd för den närmaste omgivningen runt patienten (familj etc.). Kvinnor har visat sig ha ett större behov att verbalisera sina krisreaktio­ ner än män och särskilt åldersgruppen runt 45–55 år har ett särskilt stort behov av psykosocialt stöd. Fler kvinnor än män uppvisar både fysisk och psykisk smärta utåt. I ett psykosocialt arbete ingår bl.a. att göra en psykisk bedömning/ behandling, göra psykoterapeutiska interventioner, utbilda personal av alla kategorier, terapeutiska förhållningsätt, stöd och hjälp till sjukvårdspersonal, gruppsamtal och självhjälpsgrupper, avslappning, 96 © Studentlitteratur Diagnostik m.m. kroppskännedom, patientutbildning och rehabilitering, samt hypnos och suggestionsmetoder. Psykiatrisk verksamhet inom onkologin innefattar att bedöma bl.a. suicidrisk, förändrade och ovanliga beteenden, ångest av svår grad, oförmåga att medverka till eller avböjande av behandling, depressiva sym­ tom och tidigare känd psykisk sjukdom. Prediktiva gentester har börjat användas inom onkologin för att förutsäga höga risker att drabbas av tumörsjukdom. Arbete med mutationstester reser nya etiska och psykosociala frågeställningar och det är viktigt att läkaren gör klart för sig vad testningens syfte är, hur tillförlitlig testningen är, hur man informerar om testningen och hur man redogör för resultatet inför familj och vårdpersonal. Även om testningen har vissa likheter med screeningverksamhet finns det frågor man behöver ställa. Bland dessa märks följande: Är tidigupptäckt en fördel för den enskilda individen? Kan tidpunkten för sjukdomens utbrott påverkas? Kan sjukdomen förebyggas? Kan sjukdomsförloppet påverkas? Finns kurativ och/eller palliativ behandling? Vem berörs av testningen? En viktig skillnad mot annan verksamhet är att den genetiska utred­ ningen kan komma att leda till att kunskap erhålles om andra individer i släkten än den individ som testas. För genetisk utredning är det viktigt att testningen sker genom informerat samtycke och att individer ges möjlig­ heter till betänketid innan man samtycker till såväl själva testningen som information om testresultat. Liksom vid andra tester är det viktigt att man har en hög sensitivitet och specificitet i testen så att andelen falskt positiva och falskt negativa svar minimeras. Det är av mycket stor vikt att en psyko­ social uppföljning sker av familjer där en genetisk utredning sker. Erfaren­ heter från familjer visar att inte enbart anlagsbärare utan även icke-anlags­ bärare ibland kan uppvisa svåra krisreaktioner. Det kommer därför att vara mycket viktigt att i en organisation för gene­ tisk utredning av cancerpatienter även funktioner för psykosocial uppfölj­ ning innefattas. Vidare är ett regionalt nätverk ute på sjukhusen viktigt för att sprida kunskap och stärka en lokal handläggning av cancerfamiljer. Viktiga punkter vid det onkogenetiska samtalet Etiska grundprinciper Respektera individens autonomi Respektera individens integritet Gör gott © Studentlitteratur 97 Kapitel 5 Förebygg lidande Skada inte Identifiera vem problematiken berör Individ Familj Samhälle Världssamfund Rådgivare bör iakttaga ett professionellt hållningssätt Förmedla den information som är nödvändig för individens/familjens ställningstagande Rådgivaren bör förhålla sig neutral och underlätta för den sökande att fatta eget beslut, samt stödja personen i det beslut som denne fattar Visa respekt för den sökandes integritet Andra viktiga principer vid den fortsatta kontakten Utnyttja specialkunskapen bland de olika medlemmarna i den onko­ genetiska teamet Högriskgrupp liksom lågriskgrupp bör erbjudas stöd Rådgivning och genetisk information skall ske enskilt (undantag vid prenatal rådgivning) Vid initial kontakt bör vissa saker informeras om Vad kommer undersökningen att innebära? Vilken information kan man uppnå? Vilka svårigheter och tveksamheter kan man hamna i? Första besöket bör ej resultera i ett beslut/tid bör erbjudas för eftertanke/ställningstagande/ge återbesök Kommunikation och samtalsteknik Bedriv samtalet som ”öppen kommunikation” Precisera frågor och klargöranden Summera Låt den sökande tala till punkt Fråga om det finns något mer att ta upp Bli överens om att gå vidare i samtalet Fokusera på emotionella reaktioner genom frågor om hur det känns, hur saker har upplevts Hur sprids informationen ut i familjen och vilka andra bör informeras? Patienten/probanden skall själv bestämma till vem och hur den genetiska informationen bör spridas. Detta gäller både information 98 © Studentlitteratur Diagnostik m.m. till andra familjemedlemmar, sjukvårdsapparat, arbetsgivare och försäkringsbolag En skriftlig sammanfattning till patient/proband kan för denne under­ lätta den egna kunskapen och fungera som stöd vid egen vidare­ information till andra Ett skriftligt dokument kan dessutom underlätta för efterlevande att förstå genetiska samband i den egna familjen Genom aktiv informationsverksamhet i samhället om onkogenetiska frågor underlättas enskilda individers ställningstagande till egen önskan att erhålla information och genetisk utredning. Omhändertagande av familj med ökad disposition för tumörsjukdom En familj med förmodad ökad cancerrisk kommer oftast i kontakt genom att en patient eller anhörig misstänker att tumörinsjuknandet kan vara ärft­ ligt betingat. Ibland hittas familjen via epidemiologiska frågeformulär eller genom remiss från annan läkare. Uppläggning av information och utred­ ning kan bli olika beroende på om probanden kommer via en genetisk mot­ tagning eller studeras som en forskningsfamilj. Vid flera vanliga tumörsjukdomar finns redan nu så mycket bakgrunds­ kunskap om ärftliga faktorer att kunskapen om ärftlighetsmönstret redan nu påverkar handläggningen av familjens medlemmar (tidigdiagnostik, pro­ fylaktiska operationer och behandling av nya tumörfall). Exempel på sådana tumörsjukdomar är bröstcancer, äggstockscancer, tjock- och änd­ tarmscancer och malignt melanom. Även mindre vanliga tumörsjukdomar som retinoblastom, Wilms tumör, medullär tyreoideacancer och tumörer associerade med neurofibromatos förtjänar att nämnas i detta sammanhang. Vid andra tumörsjukdomar där tidigdiagnostik och/eller profylaktiska åtgärder ej finns tillgänglig eller värdet ej är bevisat bedrivs ofta undersök­ ningar om ärftliga samband på forskningsbas. Genom informerat samtycke har patienten samtyckt till att någon individuell återinformation om forsk­ ningsresultaten inte kommer att ske och att alla genetiska studier utförs på avidentifierade material. Om ärftlighetsutredningen sker på klinisk grund eller i en forsknings­ situation där resultatet påverkar den kliniska handläggningen är det lämp­ ligt att en strikt rutin skapas för familjekontakten. Följande förslag kan tjäna som ett underlag för familjearbetet. © Studentlitteratur 99 Kapitel 5 Familjer identifierade genom forskningsprojekt Utredningen påbörjas genom information till alla i familjen om vad som betingar den initiala misstanken att familjen har en ärftlig disposition. Lämpligen sker detta genom en sammandragning av familjemedlemmar där generella synpunkter ges på ärftlighet och tumörsjukdom. Den aktuella sjukdomen diskuteras dessutom. Redan här informeras om vad man kan göra om man skulle hitta en ökad risk i familjen och för en enskild individ. I detta sammanhang är det mindre lämpligt att ge information telefonledes eller brevledes, men ibland är detta det enda praktiskt möjliga sätt att nå avlägsna familjemedlemmar. Vid den initiala informationen berättas också i tillämpliga fall om blodprovsanalyser (kopplingsanalys eller mutationstes­ ter) ytterligare kan öka säkerheten i bedömningen av enskilda individers cancerrisk. Frivillighetsaspekten att deltaga i utredningen måste under­ strykas och det är viktigt att den enskilde individen när som helst i utred­ ningen kan ändra sig och avstå/påbörja utredning. Utredning påbörjas därefter genom att man söker konfirmera diagnoser och ålder vid insjuknande i familj. Ibland utvidgas släktträd ytterligare för att få större säkerhet i analysen. Viktigt är att individerna var och en gett sitt samtycke att medverka i denna (skriftligt). Från kunskap av släktträdets utseende och individernas ålder vid insjuknande fattar man sedan ett beslut om fortsatt utredningsgång. Denna delinformation behöver bibringas del­ tagande individer. Innehåller utredningen blodprovsanalyser är det viktigt att det för indivi­ den framgått för vilken/vilka analyser blodprov tagits. Utvidgas testning att gälla andra genetiska samband är det viktigt att ett nytt informerat samtycke inhämtas från berörd individ. Vid den initiala informationen bör man också fatta ett beslut om vid vilken ålder individer i familjen bör inviteras att del­ taga i undersökningen. Enskilda individers rätt att avstå från undersök­ ningen bör respekteras och grupptryck och annan påverkan bör undvikas. Återinformationen till familjen innehåller lämpligen två faser. Dels en generell synpunkt på huruvida analyser konfirmerat ett ärftligt samband i hela familjen. Dels information på individuell nivå om egen risk. Viktigt är återigen att bekräfta att individen fortfarande står fast vid tidigare beslut om önskan att få information. Det är inget fel om viss tid förflyter mellan den generella återinformationen och den individuella återinformationen så att individen verkligen haft möjlighet att tänka över den egna önskan att få information. All individuell information bör lämnas i en enmanssituation och ej i grupp. Varje individ bör dessutom få ett individuellt förslag till scre­ ening och/eller behandling. 100 © Studentlitteratur Diagnostik m.m. Behandling och uppföljning (se även appendix 3) Uppföljning bör ske inom de närmaste dagarna om information uppfattats rätt och hur denna upplevts. Varje individ som har önskat återinformation har både muntligen och skriftligen erhållit information om sin egen risk, uppföljning och behandling. Individen har rådfrågats om till vilka läkare hon/han önskar att informationen delges. Individen skall dessutom råd­ frågas om hon/han ger sin tillåtelse att information om släktträdets utseende angående cancerrisk/cancerinsjuknande, men ej genbärarskap, kan vid förfrågan meddelas annan släktmedlem. Uppföljningen bör startas så fort som möjligt och frågan om eventuellt profylaktiska åtgärder bör tas upp i relation till lämlig ålder och reproduktionsstatus. Viktiga frågor att beakta är screeningmetoders tillförlitlighet, effekter av profylaktiska åtgärder på cancerrisk och patientens egen önskan. Vad som är en hög cancerrisk kan uppfattas väldigt olika av olika personer. Under hela informationen, utredningen och uppföljningen bör individens och familjens livskvalité studeras. Detta för att optimera omhändertagandet av den aktuella och framtida familjer. Individer som i utredningen befinns sakna ökad risk för cancersjukdom bör informeras om att de besitter bakgrundspopulationens vanliga cancer­ risker och att de bör följa de allmänna råd om tidigdiagnostik som sam­ hället erbjuder. Familjer identifierade via en genetisk mottagning Probanden i den nyidentifierade familjen informeras om sina risker att utifrån pedigreedata ha risk för ärftlig tumörsjukdom. Probanden informe­ ras också om vilka ytterligare bedömningsmöjligheter som kan stå till buds och vilka ytterligare utredningar som eventuellt kan göras (utvidgat släkt­ träd, kopplings- och mutationsanalys). Kontakt med andra familjemedlemmar initieras genom probanden som genom informerat samtycke gett sin tillåtelse att använda journaldata för den vidare familjeutredningen. All information sker individuellt, men gruppinformation kan förekomma. Eventuell mutationstestning sker enbart på individuell basis. Eventuella blodprov från friska familjemedlemmar bör ej tas vid första besöket (prediktiv test). Däremot kan blodprov på cancer­ sjuk patient tas vid detta besök (diagnostisk test). © Studentlitteratur 101 Kapitel 5 Uppföljning Varje patient erhåller en skriftlig sammanfattning av informationen som gavs vid besöket. Denna ska också omfatta förslag till åtgärder och uppfölj­ ning. Eventuellt initieras uppföljningen direkt genom remisser. I övrigt följer riktlinjer för uppföljningen som ovan för forskningsfamil­ jer. 102 © Studentlitteratur 6 Cancerförekomst och registrering Cancerförekomsten i en population kan mätas med antalet nyinsjuknade tumörfall i en definerad andel av befolkningen per tidsenhet och benämnes då incidens. För jämförelsen skull brukar cancerincidensen anges i antal fall per 100 000 av en definierad åldersammansättning per år och som befolkningsstandard används Sveriges befolkning 1970. Vid internationella jämförelser används en fiktiv världsbefolkning. Prevalensen av cancersjuka utgörs av alla levande med maligna tumörer vid en given tidpunkt i en defi­ nerad befolkning. För jämförelser används dock incidens, åldersspecifik incidens och åldersstandardiserad incidens. Ett annat viktigt mått är att följa cancerinci­ densen i olika födelsekohorter. Sedan 1958 finns en författning som föreskriver att alla nya fall av elak­ artade tumörsjukdomar skall anmälas till cancerregistret. Att det är nya tumörer som anmäls innebär att en individ kan finnas registrerad mer än en gång i cancerregistret. Författningen föreskriver dubbelrapportering, dvs. att anmälan sker både från morfolog (patolog och cytolog) och kliniker. Förutom att alla elakartade tumörsjukdomar anmäls, råder även anmäl­ ningsplikt för vissa godartade tumörer (endokrina tumörer och hjärntumö­ rer) och för vissa förstadier till cancer (t.ex. cancer in situ i cervix). Tumörregistren i de nordiska länderna täcker hela befolkningen vilket i ett världsperspektiv är unikt. I andra länder förekommer oftare sjukhus­ baserade register eller register baserade enbart på dödlighet. Regionala tumörregister sköter fortlöpande registreringen av nya cancerfall i respektive sjukvårdsregion. Från det regionala tumörregistret sker där­ efter en gång årligen en rapportering till det centrala cancerregistret i Stockholm. Förutom tumörregistrering åligger det onkologiskt centrum (en funktio­ nell samordning av kliniker i regionen som sysslar med cancervård) att också analysera cancerförekomst, studera riskfaktorer, utvärdera cancer­ behandlingar, utarbeta vårdprogram för tumörsjukdomar, och att vara ett service- och konsultorgan utåt i regionen. Onkologiska centrum medverkar dessutom vid utbildning och information samt vid utvärdering av screen­ ingverksamhet i respektive sjukvårdsregion. © Studentlitteratur 103 Kapitel 6 Data från cancerregister kan bl.a. användas för incidens- och trendbeskriv­ ningar, fördelning av cancer ur geografisk aspekt, klusteranalys, tvärsnitts­ studier, kohortstudier, fall–kontrollstudier och mortalitetsstudier. Cancerförekomst i Sverige De vanligaste maligna tumörformerna bland män är, i tur och ordning föl­ jande: prostatacancer, lungcancer, blåscancer, tjocktarmscancer, hudcancer, magcancer, ändtarmscancer, maligna lymfom, njurcancer och malignt mela­ nom. Bland kvinnor är de vanligaste: bröstcancer, tjocktarmscancer, ägg­ stockscancer, livmodercancer, lungcancer, ändtarmscancer, nervsystemets tumörer, hudcancer, malignt lymfom och malignt melanom (se tabell 6.1). Tabell 6.1 De tio vanligaste tumörerna hos män och kvinnor 1993 i Sverige. Hos män inträffade 21 267 nya tumörfall och hos kvinnor inträffade 20 618 nya fall 1993. Den procentuella fördelningen av fallen och antalet fall var enligt följande: Män prostatacancer lungcancer tjocktarmscancer blåscancer hudcancer ändtarmscancer maligna lymfom magcancer malignt melanom njurcancer Kvinnor bröstcancer tjocktarmscancer livmodercancer lungcancer äggstockscancer ändtarmscancer hudcancer malignt lymfom malignt melanom nervsystemets tumörer Procentuell andel Antal 27,1 8,5 7,1 7,4 5,9 4,9 4,1 3,8 3,4 3,2 5 755 1 807 1 502 1 570 1 262 1 035 881 807 715 687 25,4 8,2 5,5 4,7 4,6 4,0 3,9 3,7 3,5 3,2 5 228 1 682 1 129 977 950 834 804 763 716 663 (Källa: Cancer Incidence in Sweden 1993.) 104 © Studentlitteratur Cancerförekomst och registrering I södra sjukvårdsregionen finns, jämfört med riket i övrigt, en överrepresen­ tation av bl.a. tjocktarms- och ändtarmscancer, maligna melanom, hud- och läppcancer och non-Hodgkinlymfom. De större städerna i södra regionen visar särskilt en överrepresentation av de rökrelaterade tumörformerna. I Norrland finns en översjuklighet i magsäckscancer. I Malmö stad finns en översjuklighet i cancersjukdomar som delvis kan tillskrivas en ökad diagnostik (t.ex. fler obduktioner), allt fler äldre personer i populationen (i jämförelse med övriga riket) och, till sist, en reellt ökad förekomst av cancer. Cancerpanoramat är dynamiskt. I början av seklet utgjorde magsäckscan­ cer den vanligaste tumörformen i Sverige. Ute i världen är magsäckscancer fortfarande den vanligaste tumörformen sammanräknat bland män och kvinnor. WHO uppskattar att sex miljoner nya cancerfall insjuknar varje år. Av dessa inträffar tre miljoner fall i u-länder. Cancerpanoramat mellan u­ länder och i-länder är dock mycket olika. I i-länder dominerar tumörtyper som bröstcancer, kolorektalcancer, prostatacancer och hudcancer, medan i u-länder tumörer i munhåla, magsäck, lever och livmoderhals är mer fram­ trädande. Det faktum att allt fler kvinnor röker (kvinnorna gick år 1978 förbi männen i frekvensen rökare) kommer att göra att t.ex. lungcancer hos kvinnor kommer att öka ända in på 2000-talet och därigenom bli en allt Tabell 6.2 Tidstrender för cancerincidens i Sverige 1974–1993. Ökad incidens (medelökning per år, %. Källa: Cancer Incidence in Sweden 1993) Män Kvinnor Malignt melanom Skivepitelcancer (hud) Non-Hodgkin lymfom Lungcancer Testis Blåscancer (inkl. uretär, njurbäcken) Prostatacancer Bröstcancer 4,3 % 3,6 % 3,0 % –0,3 % 2,8 % 1,7 % 1,5 % – 3,3 % 3,6 % 3,2 % 3,8 % – 1,0 % – 1,3 % Minskad incidens (medelminskning per år, %. Källa: Cancer Incidence in Sweden 1993) Män Kvinnor Magsäckscancer 3,3 % 3,5 % Livmoderhalscancer – 2,2 % Hodgkins sjukdom 2,7 % 1,4 % © Studentlitteratur 105 Kapitel 6 vanligare tumörform. Hos männen däremot kan redan nu skönjas en ned­ gång i lungcancerincidensen i storstäderna. Hos kvinnor under 54 år är lungcancer nu vanligare än bland män i samma ålder (se figur 4.2). EUs tio budord EU har försökt att definiera tio budord för att reducera cancersjukligheten: 1. Rök inte och, om Du röker, sluta. 2. Moderera alkoholkonsumtionen. 3. Undvik överdrivet solande. 4. Följ gällande föreskrifter vid hantering av karcinogena ämnen. 5. Ät regelbundet färska grönsaker, frukt med hög fiberhalt. 6. Undvik att äta fett. Bli inte fet. 7. Sök läkare om Du upptäcker en knuta eller förändring i födelsemärke eller abnorm blödning. 8. Sök läkare vid bestående hosta, heshet, ändring av tarmfunktion, sår som inte läker eller viktminskning. 9. Genomför regelbundet cervixundersökningar (VS) 10. Kontrollera regelbundet brösten; vid över 50 år genomför mammografi regelbundet. National Cancer Institute har definierat olika scenarier för att uppnå en förväntad reduktion av cancerdödligheten år 2000. WHO har för de åtta vanligaste tumörformerna i världen föreslagit prio­ riteringsstrategi. Smärtlindring och antirökåtgärder har getts en hög prioritet. 106 © Studentlitteratur 7 Cancerdödlighet Dödligheten i maligna tumörsjukdomar kan mätas på olika sätt, t.ex. fem­ årsöverlevnad eller relativ risk för att dö. De statistiska metoderna som används för att beräkna överlevnad hos en grupp individer har utvecklats betydligt under 1970 och 80-talet. Med s.k. lifetable-teknik skattas en populations överlevnad mer exakt än med tidigare metoder. Multivariata analyser med t.ex. Cox-modeller har revolutionerat tolkningen av medi­ cinska studier där värdefulla rön tillkommit om prognostiska och prediktiva faktorer (faktor som predikterar behandlingseffekt) vid olika sjukdomar. Definitioner: med totaldödligheten menar man död som sker i alla dödsorsaker. Död i en speciell tumörsjukdom anger man som sjukdomsspe­ cifik dödlighet. Om inte dödsorsakerna är kända kan en relativ dödlighet beräknas utifrån den förväntade dödligheten. Andra viktiga begrepp är t.ex. åldersspecifik dödlighet, och åldersstandardiserad dödlighet. Om incidensen ökar men dödligheten är oförändrad eller minskar kan detta antingen bero på att behandlingen har blivit bättre, att fler ”ofarliga tumörfall” diagnostiserats eller att sjukdomarna generellt diagnostiseras tidigare medförande en ökad överlevnad. Överlevnaden vid en sjukdom kan mätas på olika sätt; i en randomiserad studie från initieringen av behandlingen till dödstillfället, utanför randomi­ serade studier från diagnostillfället (ofta PAD-datum eller dagen för första besöket för ett symtom vid sjukdomen) till dödsdatumet. Den recidivfria överlevnaden mäts från diagnos eller terapistart till tidpunkten för första recidiv. Se figur 5.1. Individer med en tumörsjukdom kan anses botade när lutningen på deras överlevnadskurva sammanfaller med lutningen på den förväntade överlev­ naden i bakgrundspopulationen. Generellt har stora behandlingsframsteg hos barn med tumörer medfört att överlevnaden kraftigt har förbättrats i denna grupp. Hos vuxna har fram­ stegen varit blygsamma, med några få undantag, som testiscancer hos män och Hodgkins sjukdomar hos kvinnor och män. © Studentlitteratur 107 Kapitel 7 Tabell 7.1 Dödsorsaker 1981–1985, män. Män 1–14 år Tumörer Leukemi Hjärntumörer Annan del av nervsystem Lymfom Olyckor, ej motorfordon på allmän väg Medfödda missbildningar Olyckor, motorfordon på allmän väg Män 15–44 år Självmord Tumörer Leukemi Hjärntumörer Lymfom Lunga, luftstrupe, luftrör Melanom Olyckor, motorfordon på allmän väg Olyckor, ej motorfordon på allmän väg Män 45–64 år Hjärtsjukdomar Tumörer Lunga, luftstrupe, luftrör Tjocktarm, ändtarm Urinvägar Bukspottkörtel Magsäckscancer Lymfom/myelom/polycytemi Cerebrovaskulära sjukdomar Matsmältningsorganens sjukdomar Män 65–74 år Hjärtsjukdomar Tumörer Lunga, luftstrupe, luftrör Prostata Tjocktarm, ändtarm Magsäckscancer Bukspottkörtelcancer Urinvägar Lymfom/myelom/polycytemi Cerebrovaskulära sjukdomar Andningsorganens sjukdomar Män 75 år– Hjärtsjukdomar Tumörer Cerebrovaskulära sjukdomar Andningsorganens sjukdomar % 23 % Antal (191) 11 % 4% 2% 2% 19 % 15 % 15 % (163) (130) (129) 20 % 13 % (2 380) (1 497) 2% 1% 1% 1% 1% 13 % 12 % (1 485) (1 458) 40 % 26 % (17 013) (11 146) 6% 3% 2% 2% 2% 2% 5% 4% (2 101) (1 847) 46 % 25 % (31 133) (16 867) 5% 4% 3% 2% 2% 2% 1% 8% 6% (5 240) (3 783) 45 % 18 % 11 % 10 % (54 515) (21 717) (12 778) (12 322) (Källa: Health in Sweden, Yearbook of Statistics 1987–88. Statistics Sweden, Stockholm 1987.) 108 © Studentlitteratur Cancerdödlighet Tabell 7.2 Dödsorsaker 1981–1985, kvinnor. Kvinnor 1–14 år Tumörer Leukemi Hjärntumörer Annan del av nervsystem Bindvävs- och mjukdelstumör Olyckor, motorfordon på allmän väg Medfödda missbildningar Olyckor, ej motorfordon på allmän väg Kvinnor 15–44 år Tumörer Bröstcancer Hjärntumörer Leukemi Äggstockscancer Lunga, luftstrupe, luftrör Lymfom, myelom, polycytemi Melanom Självmord Olyckor, motorfordon på allmän väg Skada ovisst om uppsåt eller olycka Kvinnor 45–64 år Tumörer Bröstcancer Äggstockscancer Lunga, luftstrupe, luftrör Tjocktarm/ändtarm Bukspottkörtel Urinorgan Hjärtsjukdomar Cerebrovaskulära sjukdomar Andningsorganens sjukdomar Kvinnor 65–74 år Hjärtsjukdomar Tumörer Bröstcancer Tjocktarm/ändtarm Lungor, luftstrupe, luftrör Bukspottkörtel Äggstockscancer Cerebrovaskulära sjukdomar Andningsorganens sjukdomar Kvinnor 75 år– Hjärtsjukdomar Cerebrovaskulära sjukdomar Tumörer Andningsorganens sjukdomar % 24 % Antal (137) 8% 4% 3% 2% 16 % 15 % 9% (91) (88) (55) 33 % (1 786) 8% 3% 3% 2% 2% 2% 2% 17 % 8% 5% (950) (437) (288) 50 % (11 050) 11 % 5% 5% 5% 3% 2% 18 % 6% 5% (3 979) (1 425) (1 010) 35 % 33 % (13 847) (13 011) 5% 4% 3% 3% 2% 11 % 5% (4 241) (2 039) 42 % 15 % 14 % 8% (60 100) (20 927) (20 412) (11 567) (Källa: Health in Sweden, Yearbook of Statistics 1987–88. Statistics Sweden, Stockholm 1987.) © Studentlitteratur 109 Kapitel 7 Tabell 7.3 Relativa överlevnadstal vid 5 år (%) för cancerpatienter i Finland, sjuk­ dom diagnostiserad 1974–81. Cancerform Män Kvinnor Samtliga 30 47 Läpp Hud (ej melanom, ej bc) Livmoderkropp Öga Sköldkörtel 90 87 – 78 73 – 84 78 76 78 Hudmelanom Bröst Testikel Hodgkins sjukdom Livmoderhals 60 – 65 57 – 76 70 – 63 61 Struphuvud Urinblåsa (papillom ingår ej) Vulva Prostata Skelett 59 59 – 56 38 58 57 – 51 Hjärna Mjukdelar Ändtarm Tjocktarm Njure 36 45 43 41 37 49 47 46 43 40 Äggstockar Lymfom Myelom Leukemi Magsäck – 32 30 22 16 39 37 28 22 14 Lunga Gallblåsa Matstrupe Bukspottkörtel Lever 10 11 4 2 2 13 6 8 2 2 (Efter Pukkala E, Rimpelä A, Läärä E. Cancer i Finland. Cancerföreningen i Finland, publikation nr 36. Finlands Cancerregister, Helsingfors 1987.) 110 © Studentlitteratur Cancerdödlighet Tabell 7.4 Incidens, prevalens och mortalitet vid två sjukdomar med olika prognos. Sjukdom med låg dödlighet (A) Incidens Prevalens Mortalitet 5/100 000 40/100 000 1/100 000 Sjukdom med hög dödlighet (B) 12/100 000 8/100 000 10/100 000 En sjukdom med låg mortalitet (antingen i sitt naturalförlopp eller genom behand­ ling) kan leda till att prevalensen är högre än en sjukdom med hög mortalitet. Detta kan uppstå trots att incidensen kan vara lägre för sjukdomen med god prognos än sjukdomen med hög mortalitet. Tabell 7.5 Femårsöverlevnad av några vanliga tumörsjukdomar (%) hämtad från litteraturen. Tumörtyp Bröst Prostata Kolorektal Äggstockscancer Lungcancer Magsäckscancer Blåscancer Uterus Livmoderhals Testis Melanom Esofagus Lever © Studentlitteratur Alla stadier Lokaliserad Spridd 75 55–70 53 37 13 16 77 83 67 91 80 6 3 90 70–100 85 83 33 57 88 91 86 98 89 13 8 62 20 38 23 7 8 41 50 43 82 39 3 2 111 8 Prognostiska och prediktiva faktorer Det finns en rad faktorer som har prognostisk betydelse vid tumörsjuk­ domar. På senare år har man också börjat att skilja på prognostiska och pre­ diktiva faktorer för sjukdomsrecidiv och totalöverlevnad. En prognostisk faktor speglar då mer naturalförloppet av sjukdomen medan en prediktiv faktor talar om huruvida terapin påverkar sjukdomsprognosen. Här följer en uppräkning av några mer allmängiltiga prognostiska fakto­ rer: anamneslängd/tillväxthastighet ålder kön primärtumörens växt storlek ulceration fixation genomväxt av hinnor/barriärer närvaro av regionala lymfkörtelmetastaser/om dessa är fixerade närvaro av fjärrmetastaser metastaslokal mängd metastaser tumörvolym/sjukdomsstadium allmäntillstånd histopatologiska kriterier tumörtyp differentieringsgrad proliferation mitoser S-fas labelling index markörer (Ki-S1, Ki-67, PCNA, Brdu) 112 © Studentlitteratur Prognostiska och prediktiva faktorer kärlinväxt nervinväxt lymfkörtelmetastaser/periglandulär växt cytogenetiska/molekylärbiologiska kriterier antal kromosomaberrationer/antal kloner onkogenamplifiering Kriterium på att en ny prognostisk faktor är en viktig faktor vid en tumör­ sjukdom faktorn bör ha/vara; – en biologisk bakgrund – lätt att mäta, billig att analysera och analysen bör uppvisa hög reprodu­ cerbarhet – en stark faktor – ”oberoende” av tidigare kända faktorer – förmåga att definiera, företrädesvis, en liten högriskgrupp för dålig prog­ nos – prognostisk betydelse både för hela sjukdomsgruppen liksom för sub­ grupper – möjlig att indela optimalt i höga och låga värden (indelningsgrunden bör vara statistiskt optimerad om inte faktorn används som en kontinuerlig variabel). © Studentlitteratur 113 114 Tumörutbredning TNM-stadium antal regionala lymfkörtel­ metastaser, tumörstorlek tumörfixation, ulceration benmärgsinfiltration Histologisk grad/typ DNA-mängd i tumörcell Tumörcellsproliferation Angiogenes Perivaskulär/perilymfatisk infiltration Molekylärbiologiska faktorer onkogen amplifiering (ex. erbb-2, c-myc, p53) Tumörutbredning TNM histologisk grad prostataspecifikt antigen DNA-mängd i tumörcell Hb S-testosteron alkaliska fosfataser Prostatacancer Bröstcancer Tumörrelaterade faktorer Sjukdom ADL-status interkurrent sjukdom symtom av tumörsjukdom Ålder (mycket unga/gamla) Symtomduration innan diagnos Mammografiupptäckt tumör Ras, etnisk grupp Tidigare bruk av östrogen? Tidigare bruk av p-piller? Obesitas Pågående graviditet ADL-status ålder interkurrent sjukdom symtom av tumörsjukdom Patientrelaterade faktorer Duration av respons vid endokrin terapi Adjuvant endokrin/cytostatikabehandling Operationsradikalitet Postoperativ strålbehandling (f.a. lokalrecidivrisk) Hormonreceptorstatus i tumör Duration av respons vid endokrin terapi Behandlingsrelaterade faktorer Tabell 8.1 Exempel på prognostiska/prediktiva faktorer vid prostata- och bröstcancer. Kapitel 8 © Studentlitteratur Prognostiska och prediktiva faktorer Exempel på en multivariat överlevnadsanalys (Proportionell hazard analys enligt Cox) Multivariat analys av recidivfri överlevnad hos 150 körtelnegativa bröstcan­ cerpatienter där modellen inkluderar immunohistokemiskt detekterbart p53 i tumörvävnad, tumörstorlek och progesteronreceptorpositivitet av tumör och där modellen justerats för menopausalstatus. Hazard ratio anger här risken för sjukdomsrecidiv för respektive faktor givet att hänsyn tagits till de andra variablerna i modellen. Modell Hazard ratio 95 % konfidensintervall Variabel* p53 positivitet tumörstorlek >20mm pgr-receptor pos. 2,4 1,4 0,6 1,2–4,9 0,7–2,7 0,3–1,2 * referensgruppen vid p53-positivitet är patienter med p53-negativa tumörer, tumörstorlek >20 mm patienter med tumörstorlek ≤20 mm och vid pgr-receptorpositiva tumörer patienter med pgr-receptornegativa tumörer. Nomenklatur för cytogenetik och DNA-flödescytometri Kromosomer numreras så att autosomer får 1–22, könshormoner X eller Y, korta armen designeras p och långa armen q. Regioner med band och subband numreras från centromer och utåt. En translokation förkortas t, en deletion del, en inversion inv, en insertion ins, en duplikation dup, en iso­ kromosom i, en ringkromosom r, en markörkromosom mar och en derive­ rad kromosom der. Plus (+) och minus (–) används för att indikera att en hel kromosom tillkommit eller förlorats. En klon definieras som att två eller flera celler finns med samma strukturella eller supernummerära kromosom. Kromosomantalet kan dessutom beeskrivas som diploid (n = 46), hypodiploid <46 och hyperdiploid >46. Karyotyper med 46 kromosomer som ända kan vara strukturellt förändrade kallas pseudodiploida. I tumörer kan kromosomantalet dessutom beskrivas som haploida, tetraploida, triploida etc. processer som leder till förlust av genetiskt material är deletioner och monosomier, medan duplikationer och trisomier leder till en ökad mängd genetiskt material. Inversioner, insertioner och translokationer ändrar inte den totala mängden DNA utan omfördelar det genetiska materialet. Vid flödescytometriska undersökningar av tumörer beskrivs också DNA­ halten i termer av ploidi. En diploid tumör uppvisar då en DNA-halt som © Studentlitteratur 115 Kapitel 8 Antal celler Antal celler Diploid Non-diploid S-fas 2 S-fas 4 2 4 DNA-innehåll Figur 8.1 Schematisk bild av en flödescytometerundersökning av en diploid och en icke-diploid tumörs DNA-innehåll. Det mörka området illustrerar S-fasen. I den non-diploida bilden har S-fasen för den icke-diploida populationen indikerats. Modalvärdet för G0/G1 anges med 2 och för G2 med 4 för den diploida populatio­ nen. överensstämmer med en standard från normalceller av DNA t.ex. i intervallet för G1-celler 0,95–1,05 och för G2-celler 1,95–2,05. Icke-diploida tumörer uppvisar då en eller flera DNA-toppar utanför det normala G1/G2-området. En fullständig överensstämmelse föreligger inte i ploididefinitioner mel­ lan DNA-mätningar och kromosomanalyser då kromosomförändringar kan finnas i en flödescytometriskt analyserad diploid tumör. Det krävs således ganska stora genetiska förändringar innan en tumör blir icke-diploid flödes­ cytometriskt. Andelen celler i procent mellan G1 (modalvärdet på G0/G1-toppen) och G2 (modalvärdet på G2-toppen) beskriver S-fasen i ett flödescytogram. Fraktionen celler i S-fas uppskattas i DNA-histogrammet vara rektangulärt distribuerad. Kliniska korrelationer – cytogenetik/flödescytometri Cytogenetik Klonala kromosomaberrationer, speciellt om de är komplexa, indikerar närvaro av neoplasi. I undantagsfall har klonala aberrationer beskrivits från normal vävnad som trisomi 7 (exempelvis hjärna, njure, lunga, osteoartrit, aterosklerotisk plaque, leversteatos, åderbråck). Förlust och tillskott av könskromosomerna x, y har också setts i både normal och neoplastisk väv­ nad. 116 © Studentlitteratur Prognostiska och prediktiva faktorer De cytogenetiska fynden är dock tillräckligt informativa för att utnyttjas vid följande differentialdiagnostiska dilemma vid solida tumörer: 1. Benign versus malign epitelial tumör. 2. Benign versus malign mesenkymal tumör. 3. Malign ben- eller mjukdelstumör. 4. Differentialdiagnos småcellig rundcellstumör. Vid lymfom och hematologiska neoplasier finns sedan länge en etablerad roll för cytogenetik både ur diagnostisk och prognostisk synvinkel. Epiteliala tumörer har oftare en mera komplex kromosombild än mesen­ kymala tumörer. Vidare uppvisar benigna mesenkymala tumörer en cyto­ genetisk bild som ej behöver vara en evolutionsprocess in i dess maligna motsvarighet. Vid benigna epiteliala tumörer finns enkla karyotypfynd som även återkommer i dess maligna motsvarighet, men då påspätt av ytterligare kromosomavvikelser. Nya cytogenetiska fynd för skivepiteltumörer i öron­ näsa-halsområdet och bröstcancer kan tala för att en betydande andel tumö­ rer har en polyklonal bakgrund. Vid vissa hematologiska tumörsjukdomar och mjukdelstumörer kan karakteristiska cytogenetiska fynd hjälpa till att skilja mellan olika differen­ tialdiagnoser (se vidare under respektive tumörform, barntumörer och tumör från okänt origo). Se även sid. 248. Antalet klonala aberrationer i en tumör kan vara relaterat till prognosen vid sjukdomen. Vidare uppvisar tumörer med högre differentieringsgrad enklare karyotyper med färre kromosomavvikelser än lägre differentierade tumörer. Studier av klonala kromosomavvikelser kan också hjälpa till att skilja ut om bilaterala tumörer, t.ex. i bröst och äggstock, utgör i sig distinkta nya primärtumörer eller metastaser från den ena sidans organ. Vid bröstcancer är den preliminära bilden att en ny tumör föreligger i vissa fall medan i andra fall kontralateral metastasering är trolig. Vid äggstockscancer verkar huvudparten kontralaterala tumörer däremot vara metastaser från andra sidans äggstock. Flödescytometri Andelen celler i S-fas har vid ett flertal tumörer prognostisk betydelse. Även DNA-ploidiindex har vid vissa tumörformer prognostisk innebörd. Ofta är de mer snabbprolifererande tumörerna med icke-diploid DNA-halt histopatologiskt korrelerade till mer lågdifferentierade tumörer. © Studentlitteratur 117 Kapitel 8 Tabell 8.2 Exempel på metoder som används vid karaktärisering av tumörcellers molekylära cellbiologi. Ändamål Metoder Numeriska och strukturella kromosomförändringar med genlokalisation klonala kromosomaberrationer fluoroscerande in situ hybridisering (FISH) DNA-mängd flödescytometri imageanalys Cellproliferation mitosindex flödescytometri (s-fas, BRDUinmärkning) thymidin labelling index immunhistokemiskt (PCNA, Ki-67, Ki-S1 etc) Förändringar av genkomplex kopplingsanalyser pulsfältsgradient gelektrofores Förändringar på genDNA- och mRNA-nivå kvantitativt (genuttryck, genamplifiering) kvalitativt (rearrangement, deletioner) dot/slot blot Southern blot (DNA) Northern blot (DA) PCR (differentierad PCR) Southern/Northern blot PCR (allelspecifika oligonukleotider) pulsfältgradient gelelektrofores Förändringar på exon/nukleo­ tidnivå) (punktmutationer, mikro­ deletion) PCR molekylär kloning denaturingsgradient elektrofores PTT (proteintrunkeringstest) konformationspolymorfism (SSCP) ”ribonucleas-protection” sekvensering Jämförelse tumör/normal vävnad Loss of heterozygosity (LOH) studies Allelförlust i tumörvävnad Förlust/tillkomst av genetiskt material i tumör 118 Comparative genomic hybridisation (CGH) © Studentlitteratur 9 Screening av tumörsjukdomar Vid screening av en tumörsjukdom hittas ofta sjukdomen vid ett tidigare tumörstadium än om sjukdomen skulle ha diagnostiserats symtomatiskt. Den tidigare diagnosen leder i sig till att individens överlevnad ökar (tid med tumörsjukdom ökar), se figur 5.1. Denna potentiella bias i bedömning av överlevnad benämns i engelskspråkig litteratur, lead time bias. Vid screening tenderar man framförallt att hitta långsamväxande tumör­ sjukdomar medan mer snabbväxande missas. Denna typ av bias benämns i engelskspråkig litteratur, length time bias. Screening kan vara opportunistisk, dvs. innebära tidigdiagnostik på enstaka patienter, eller riktad–selektiv dvs. screening av högriskgrupper. Vid masscreening omfattas hela befolkning av tidigdiagnostik. En tests värde för screening vid en sjukdom brukar beskrivas genom begreppen sensitivitet, specificitet, positivt och negativt prediktivt värde. Nedan följer en definition av dessa begrepp. Sjukdom ja nej positiv a b negativ c d Test Sensitivitet = andelen sjukdomspositiva som fångas in av test (sant posi­ tiva), a/a + c. Specificitet = andelen sjukdomsnegativa som verkligen är testnegativa, d/ b + d. andelen falskt positiva = 1-specificiteten. Positivt prediktivt värde = andelen av alla positiva test som verkligen är sjukdomspositiva, a/a + b. Negativt prediktivt värde = andelen av alla negativa test som verkligen är sjukdomsnegativa, d/c + d. © Studentlitteratur 119 Kapitel 9 Om exempelvis 10 000 kvinnor screenas för bröstcancer, och man räknar med en prevalens av 4/1 000 med bröstcancer, ger en sensitivitet på 98 % och specificitet på 98 % ett fall som är falskt negativt och 199 fall som är falskt positiva. Vid en sensitivitet på 95 % och en specificitet på 95 % erhålles två falskt negativa och 498 falskt positiva och vid en sensitivitet på 90 % och en specificitet på 90 % erhålles fyra falskt negativa och 996 falskt positiva. Det är sålunda av mycket stor vikt i en screeningundersökning att både en hög sensitivet och specificitet upprätthålls. Det positiva prediktiva värdet av en test med hög sensitivitet och specifi­ citet påverkas av sjukdomens prevalens. Vid sällsynta sjukdomar (< några procents prevalens) sjunker det positiva prediktiva värdet starkt och testet blir oanvändbart. Vid bröstcancer kan den intitiala mammografiscreen­ ingen, även om lokala variationer finns, plocka upp t.ex. 3,3 % som behöver utredas vidare (positivt prediktivt värde 13 %). Efter kompletterande mam­ mografi, ultraljud och palpation har det positiva prediktiva värdet stigit till 42 % hos de 1 % av alla kvinnor som behöver utredas vidare. Slutligen går ungefär 0,6 % av alla initialt screenade kvinnor vidare till kirurgisk biopsi pga. misstanke om cancer efter att finnålsbiopsi utförts och patienten disku­ terats i en multidisciplinär konferens (positivt prediktivt värde för cancer­ sjukdom 73 %). Tabell 9.1 Mammografiscreening – sammanslagna svenska studier. Alla centra Ålder vid ingång Personår vid uppföljning 1000-tal IG KG Händelser IG KG RR (95 % Cl) 40–49 50–59 60–69 70–74 40–74 427 350 540 454 372 271 91 64 1430 1139 73 137 121 48 379 0.87 0.71 0.71 0.94 0.76 68 162 126 36 392 (0.63–1.20) (0.57–0.89) (0.56–0.91) (0.60–1.46) (0.66–0.87) IG = inviterad grupp KG = kontrollgrupp (Källa: The Lancet 341, April 17, 1993.) 120 © Studentlitteratur Screening av tumörsjukdomar Tabell 9.2 Mammografiscreening – sammanslagna svenska studier. Reduktion i bröstcancermortalitet per 100 000 kvinnoår Ålder vid ingång Antal kvinnor 40–49 50–59 60–69 2 10 16 Värdet av screeningmetoder undersöks bäst i randomiserade studier. Fall­ kontrollstudier är dåliga utvärderingsinstrument vid screening eftersom de påverkas av bias. För att screening av en sjukdom skall vara motiverad ur folkhäl­ sosynpunkt, bör det löna sig att hitta sjukdom tidigt, dvs. det bör finnas en bättre behandling och en reproducerbar screeningmetod som är ekonomiskt försvarbar. Det ställs stora krav på en screeningorganisation (läkare och teknisk apparatur) för att hitta en tumörsjukdom. T.ex. vid bröstcancer insjuknar i åldersgruppen 40–70 år 2/1 000 per år i bröstcancer och mindre än 1/1 000 dör i sjukdomen per år. I fallet med bröstcancerscreening har en kombinerad analys av data från svenska undersökningar visat på följande reduktion av bröstcancermortali­ teten per 100 000 kvinnoår (eller 10 000 kvinnor som följs under 10 år): I åldersgruppen 40–49 år, två kvinnor, i åldersgruppen 50–59 år, tio kvinnor och i åldersgruppen 60–69 år 16 kvinnor. Effekterna är därför i ett folk­ hälsoperspektiv mycket blygsamma och man kan därför inte förvänta sig stora effekter av screening vid andra tumörsjukdomar med lägre prevalens/ incidens. Ett alternativ till screening av totalpopulationer kan därför vara screening av högriskpopulationer. Svenska undersökningar om mammografi och bröstcancer har varit ban­ brytande. En reduktion i bröstcancermortaliteten med 30 % har uppnåtts och effekten finns beskriven i tabellerna 9.1 och 9.2. Emellertid är det i ett folkhälsoperspektiv få kvinnor bland de screenade som får sin dödlighet förskjuten. Vid prostatacancer råder stor tveksamhet om att utföra masscreening. Metoder som digital/rektal examination, PSA och ultraljud kan kombineras så att cancern kan upptäckas innan den givit symtom. Prediktiva värden på över 40 % kan uppnås. Proven i sig själva är inte särskilt kostsamma, där­ © Studentlitteratur 121 Kapitel 9 Tabell 9.3 Screeningrekommendationer från American Cancer Society november 1992. Undersökning Kön Ålder Frekvens Sigmoidoskopi (Flexibelt skop att föredra) Män och kvinnor 50 och över vart 3-5 år Blod i avföring Män och kvinnor 50 och över varje år Rektumpalpation Män och kvinnor 40 och över varje år Prostataundersökning Män (rektumpalpation och analys av PSA, prostataspecifikt antigen) 50 och över varje år PAP-smear Kvinnor 18 och över efter tre konsekutiva år med normala undersökningar, mindre frekvent undersökning i fortsättningen Gyn. palpationsundersökning av bäckenet Kvinnor 18–40 vart 1–3 år i samband med PAP-smear varje år Endometriebiopsi Kvinnor vid menopaus hos kvinnor risk* vid menopaus och vid behov senare Bröst, självundersökning Kvinnor 20–40 varje månad Bröst, läkarundersökning Kvinnor 20–40 40 och över vart 3:e år varje år Mammografi Kvinnor 40–49 50 och över vart 1–2 år varje år Hälsoråd och läkarundersökning inriktad mot tumörorgan** Män och kvinnor 20 och över 40 och över vart 3 år varje år 40 och över * anamnes på infertilitet, fetma, frånvaro av ovalutioner, abnorma uterusblödningar, tamoxi­ fenterapi och östrogenterapi. ** inkluderar undersökning för tyreoideacancer, testikelcancer, prostatacancer, ovarialcan­ cer, lymfkörtelcancer, tumörer i mun och svalg och hudtumörer. Råden inkluderade dessutom rekommendation för screening av individer med minst en förstagradssläkting med cancer, tidigare anamnes på inflammatorisk tarmsjukdom och tidi­ gare anamnes på adenom i tjocktarm eller ändtarm. 122 © Studentlitteratur Screening av tumörsjukdomar Tabell 9.4 Exempel på tumörsjukdomar där screening pågår i Sverige. Tumörtyp Metod Populationsbaserade Livmoderhals PAP-smear Bröst mammografi Intervall/ålder Överlevnadsvinst vartannat år, 25–50 år vartannat år, 50–70 år Trolig, ej visad via randomiserad studie Visad i randomiserad studie, ej visad effekt under 50 år Riskgruppsorienterade. Screening: se även bilaga 3. Ulcerös kolit Kolorektal cancer koloskopi, F-hb årligen speciellt Trolig flex. proctoefter 10 års sjuk­ sigmoid. domshistoria emot finns stort tvivel om tidig behandling är meningsfull. Risken för över­ behandling bedöms som mycket stor. Tabell 9.5 Exempel på tumörsjukdomar där screening pågår utomlands men ej i Sverige. Tumörtyp Metod Intervall/ålder Överlevnadsvinst Japan Magsäck – Japan gastroskopi årlig/35–70år trolig Melanom – Australien hudinspektion årlig/20–70 år osäker © Studentlitteratur 123 10 Kirurgi vid tumörsjukdomar Generell bakgrund En forskargrupp inom EU har kommit fram till att av gängse terapimodali­ teter har och är kirurgin basbehandling genom att ungefär 20–22 % av alla tumörer kureras genom enbart kirurgi. Ungefär 12 % av alla tumörsjuk­ domar kureras enbart genom strålterapi och i 6 % av fallen ger kombinatio­ nen av kirurgi och strålbehandling kuration. Vid generaliserad tumörsjuk­ dom kan kemoterapi kurera drygt 5 % av patienterna. Vid vissa tumörformer som lungcancer, hjärntumörer och bukspottkörtelcancer har behandlings­ framstegen ur överlevnadssynpunkt varit mycket begränsade, medan vid exempelvis testistumörer, Hodgkins sjukdom och barntumörer betydande behandlingsframsteg har gjorts. I figur 10.1 har utifrån situationen i USA den procentuella förändringen av incidens och mortalitet 1973–88 illustre­ rats för olika tumörformer. Det är uppenbart att man behöver hitta nya sätt att angripa cancersjukdomen för att ytterligare förbättra behandlingsresulta­ ten. Vid flera relativt vanliga tumörsjukdomar som lungcancer, myelom, lymfom, melanom och hjärntumörer ökar både incidens och dödlighet. Nyare behandlingsstrategier med immunologiska tekniker eller biologisk behandling har ej ännu i större skala omsatts i överlevnadsvinster. Likaså föreligger ej nog lång uppföljning vid högdoskemoterapi med stamcellsstöd för att kunna bedöma om överlevnadsvinster uppnås vid solida tumörer. Eftersom tumörsjukdomar är vanliga och 5 års överlevnad mellan 50– 60 % totalt uppnås med en ansenlig proportion långtidskurerade kommer en betydande andel tidigare tumörbehandlade individer att finnas i befolk­ ningen. Detta gäller inte minst individer som tidigare behandlats för barn­ tumörer. Man räknar med att mellan 250 000 till 300 000 svenskar tidigare erhållit behandling för tumörsjukdom. Kirurgi har länge utgjort basbehandling för en rad tumörsjukdomar genom att: 1. En kirurgisk biopsi har varit förutsättningen för diagnos. 2. Det kirurgiska ingreppet ofta har varit en kurativ operation för tidiga tumörformer. 124 © Studentlitteratur Kirurgi vid tumörsjukdomar Lunga, kvinnor Melanom Multipelt myelom Non-Hodgkins lymfon Lunga, män Prostata Njure Esofagus Hjärna Lever Alla tumörer Bröst Pankreas Larynx Leukemi Äggstock Tjocktarm Munhåla Livmoder Tyreoidea Urinblåsa Magsäck Livmoderhals Hodgkins sjukdom Testikel –80 –40 0 Incidens 40 80 120 Mortalitet Figur 10.1 Procentuell förändring av incidens och mortalitet i USA 1973–88. (Efter Scientific American, jan. 1994.) Vid bröstcancer (som diagnostiseras genom symtom och ej genom generell screening) uppkommer i 20 % ett lokalrecidiv efter kirurgi vid stadium ll och högre om inte behandlingen åtföljs av strålbehandling (då recidivfrek­ vensen lokalt reduceras till 5 %). För alla bröstcancerfall sker, i nästan hälf­ ten av fallen, en generalisering senare även om det kirurgiska ingreppet lokalt och regionalt har ansetts vara adekvat. Det har blivit uppenbart att en rad tumörsjukdomar är generaliserade redan tidigt och att den lokala behandlingen ibland inte nämnvärt påverkar sjukdomsspridningen. Tenden­ sen inom onkologin har därför varit att utföra allt mer begränsade kirur­ giska ingrepp och istället börja med generell kemoterapi eller endokrin © Studentlitteratur 125 Kapitel 10 behandling. Pendeln har dock på allra sista tiden igen börjat svänga tillbaka till en mer nyanserad bild, då en del nya resultat börjat antyda att metastase­ ringsmönstren vid olika tumörsjukdomar i sig kan vara olika, dvs. att sek­ vensen primärtumör-regional lymfkörtel-fjärrspridning ibland förekommer liksom bilden primärtumör med direkt fjärrspridning. Redan tidigare har behandlingssekvenser vid barntumörer ofta varit först kemoterapi, sedan strålning och sist eventuellt operation för kvarvarande resttumörer. Utvecklandet av finnålspunktioner har också för diagnostiken reducerat behovet av kirurgiska öppna biopsier. Vid mjukdelssarkom är det primära omhändertagandet av sjukdomen av stor vikt för att reducera risken för lokalrecidiv. Kompartmentell kirurgi eftersträvas efter det att diagnos ofta erhållits via finnålspunktion. Regional lymfkörtelutrymning har mer betydelse för stadieindelningen av tumörsjukdomen och den anses vid flertalet sjukdomar ej vara ett tera­ peutiskt ingrepp. I vissa situationer kan metastaskirurgi vara av stort värde för att höja livs­ kvalité och förbättra överlevnad hos den enskilde patienten. Sådana exem­ pel utgör; begränsad levermetastasering från tjocktarmscancer, enskilda lungmetastaser från solida tumörer t.ex. sarkom samt enstaka hjärnmetasta­ ser från solida tumörer. Faktorer som kan tala för gynnsam effekt av sådan behandling är t.ex. långt recidivfritt intervall från primärtumöroperation till recidiv, begränsad och avgränsad metastasering, väl differentierad tumör. Palliativa kirurgiska ingrepp inkluderar dessutom åtgärder för att bevara gastrointestinal motilitet (t.ex. vid ileussituationer, tarm by pass och sto­ mier), näringsintag (Witzelfistlar, sondinläggningar, stentinläggning), PTC­ katetrar och/eller stent (avhjälpa avflödeshinder för galla), pyelostomier (avhjälpa urinavflödeshinder), avhjälpa blödning (t.ex. YAG-laserkoagula­ tion), smärtkirurgi (avskärning av nervbanor), medullakompressioner (laminektomier och stabiliseringsoperationer), och vid patologiska fraktu­ rer (proteskirurgi, cementering). Resektionsmarginaler kan variera, t.ex. bör man sträva efter ungefär fem centimeters resektionsmarginal vid tarmresektioner. Vid maligna melanom pågår studier över optimal resektionsmarginal 2 eller 5 centimeters margi­ nal. Vid tunnare melanom (≤ 2 mm) är det redan visat att två cm marginal är tillfyllest. Vid en mycket lokaliserad tumörväxt, som t.ex. en basalcellscan­ cer, kan ofta tumören excideras med 2 mm marginal, medan vid operation av exempelvis en tunga en marginal på två cm ofta behövs. Operationer av esofaguscancer kräver ofta marginaler på uppemot 10 cm pga. risk för intramural spridning. 126 © Studentlitteratur Kirurgi vid tumörsjukdomar Det terapeutiska värdet av lymfkörtelutrymningar är omtvistat och åtgär­ den har, som ovan nämnts, oftare ett värde för stadieindelning av tumören. I den kirurgiska hanteringen av tumörvävnaden strävar man efter att manipulera/röra vävnaden så lite som möjligt innan den resecerats. Vid t.ex. testikeloperationer ligeras både tillförande och avförande blodkärl innan testikeln manipuleras. Fryssnitt under operationer har fortfarande en viktig roll även om man allt mer har strävat efter att få patienten färdigutredd före operationen. Vissa kirurgiska metoder kan vara mindre lämpliga vid tumörkirurgi eftersom det kan influera på efterföljande histopatologisk bedömning (t.ex. laserkirurgi). Den gemensamma trenden inom modern tumörkirurgi har varit en utveckling av mindre mutilerande ingrepp med bibehållen organfunktion och livskvalité. Kirurgi sker också som behandlande åtgärd vid en rad premaligna lesio­ ner och vid cancer in situ. Speciellt gäller detta för tumörer i hud, mun och cervix. Kolonpolyper och cancer in situ i bröstet behandlas också framgångsrikt med kirurgi. Profylaktiska operationer förekommer hos patienter med stark disposi­ tion för cancer i ett organ som exempelvis kolektomier vid ulcerös kolit och familjär adenomatös polypos, mastektomier vid hereditär bröstcancer och vid generaliserad lobulär cancer in situ, profylaktiska ooforektomier hos BRCA1-genbärare och tyreoidektomier vid medullär tyreoideacancerrisk. En allt viktigare roll inom kirurgin har också den rekonstruktiva kirurgin fått genom användning av bl.a. proteser och lambåer. Exempel på operationsberättelse vid ovarialcancer Exstirpation uteri totalis ad modum Wertheim + bilat lymfkörtelutrymning + paraaortal lymfkörtelutrymning + salpingo-oophorectomia bilat + exstirpation av bäckenperitoneum. Vä-sidigt pararektalsnitt. Man kommer in i fri bukhåla. C:a 200 ml ascites står i Douglas och denna sändes för cytologi. Palpatoriskt föreligger nor­ mala förhållanden vad avser diafragmakupolerna, levern, njurarna, ventri­ kel, pancreasområdet samt mjälten. Paraaortalt föreligger ett flertal för­ storade lymfkörtlar upp till i höjd med njurarna men inte att palpera där ovanför. Den största av dessa körtlar ligger på vä sida omedelbart nedanför njurvenen och mäter 3 × 2 cm. Sålunda även i övrigt rikligt med förstorade © Studentlitteratur 127 Kapitel 10 körtlar paraaortalt. I lilla bäckenet är uterus normalstor. Det föreligger en ovarialcancer utgången från hö ovarium. Cancern är ungefär apelsinstor. Den var fritt rörlig till sin omgivning. Även vä ovarium var förstorat. Mått­ ligt med karcinos föreligger i Douglas. På vä sida föreligger förstorade körtlar längs iliaca externakärlen. På hö sida föreligger ett stort körtel­ konglomerat som omfattar hela externalogen ner till vena circumflexa men som även slår om och går ner i obturatoriuslogen. Presakralt föreligger en hel del förstorade körtlar. Ligamenta rotunda delades och omstacks långt ut bilat. Plica vesicoute­ rina inciderades och blåsan sköts ned. Uretärerna fripreparerades på båda sidor fram till sitt inmynningsställe i blåsan. Härvid delades arteria och vena uterina invid avgångsstället från iliaca internakärlen. Prep. delades nedom portio. Vaginaltoppen syddes med enstaka dexon lateralt och fort­ löpande dexon per atraumatisk nål i medellinjen. Dessförinnan hade hö adnex avlägsnats och sänts för histopatologisk bedömning och det prelimi­ nära beskedet blir dysgerminom. Även vä adnex avlägsnades separat sedan ligamentum infundibulo pelvicum delats och ligerats dubbelt högt upp. Tillsammans med läkare från kir klin påbörjas därefter körtelutrymningen. Man utrymmer de makr. förändrade körtlarna i iliaca externalogen på vä sida. Därefter rymdes iliaca externa hö samt obturato­ rius hö, communis vä, det paraaortala området samt det presacrala området. Körtlarna har hela tiden legat helt tätt på kärlen framför allt venerna men det har gått att komma i clivage överallt. Körtelutrymningen paraaortalt har utförts t.o.m. njurkärlen men ej längre. Ovanför här har några förstorade körtlar ej kunnat kännas. Vidare har på samtliga lokalisationer utrymningen utförts fakultativt. Slutligen exstirperar man peritoneum i Douglas och ingreppet blir mak­ roskopiskt tumörfritt här. Här har förelegat en ovarialcancer stad III. Ingreppet blev makr. radikalt i lilla bäckenet och några palpatoriskt förstorade körtlar har ej kvarlämnats. Cancerförändringar har ej kunnat konstateras på diafragmakupolerna. Till PAD sändes uterus, vä och hö adnex, körtlar från iliaca externa vä, communis vä, iliaca externa hö, obturatorius hö, paraaortalt och presacralt samt resektat från peritoneum och cytologi från Douglas. Snittet som under operationens gång har utvidgats till att omfatta hela området ända upp till processus xiphoideus slöts i etager. Enstaka suturer i huden. Patienten har överstått det synnerligen långvariga ingreppet väl. 128 © Studentlitteratur 11 Cytostatikabehandling Cytostatika är en tämligen ny behandlingsmodalitet. Efter att ha utvecklats från kvävesenapsgas, blev i slutet av 1940-talet och början av 1950-talet mustin det första kliniskt användbara cellhämmande medlet. Därefter har en strid ström av nya preparat utvecklats med olika verkningsmekanismer. En viktig mekanism för cytostatikans effekt är förhindrandet av cellens tillväxt genom att hämma nybildningen av byggstenar för cellen, exempelvis nuk­ leinsyror och proteiner, eller genom att hämma själva celldelningsproces­ sen. Både normala celler (de med högre celldelningshastighet som blod, hår och tarmepitel) och tumörceller skadas av behandlingen, men man utnyttjar särskilt tumörcellernas sämre reparationsförmåga vid behandlingen. Till en början gavs cytostatika som ”single-drug”-behandling (endrogs­ behandling, monoterapi). Emellertid fann man att behandlingen var mer framgångsrik vid de flesta tumörformer om flera cytostatika kombinerades, kombinationskemoterapi. Flera fördelar uppnåddes med att kombinera cytos­ tatika. Medel med olika biverkningsmönster kunde kombineras, mindre risk för resistens mot behandlingen kunde uppnås och ibland potentierade medlen varandra. Viktigt var också att man kunde kombinera medel med olika angreppspunkter i cellcykeln. Särskilt framgångsrik har kombinationscytos­ tatikabehandlingen varit vid lymfom- och testistumörer (t.ex. Hodgkins sjuk­ dom – MOPP-behandling; testikeltumörer – CVB- och BEP-behandling). På teoretiska grunder borde cytostatikaterapi vara mer framgångsrik vid små tumörer (fler celler i celldelning). Det har emellertid visat sig att detta inte alltid stämmer, då det vid behandling av tumörer som uppvisar känslig­ het för cytostatika mycket väl fungerar att behandla bort större tumörer. Konceptet att effekten av cytostatika ökar med ökad dos stämmer heller inte för alla tumörer, då veckovis lågdosbehandling kan vara framgångsrik. Principiellt och på teoretiska grunder borde intermittent högdos­ behandling ha fördelar framför kontinuerlig lågdosbehandling. Detta har dock inte visat sig gälla generellt och nya verkningsmekanismer har postu­ lerats för att kontinuerlig behandling med lågdos kan fungera i vissa situa­ tioner. © Studentlitteratur 129 Kapitel 11 Ett problem vid cytostatikabehandling är den utveckling av resistens mot behandlingen som kan ske. Denna anses bero på en heterogenitet bland tumörceller, som uppstår särskilt i snabbt prolifererande celler. Olika meka­ nismer bakom denna resistens finns, exempelvis bildar vissa celler ett gly­ koprotein i cellmembranet som minskar upptaget av cytostatika. Paradoxen finns alltså att snabbt prolifererande celler, som borde vara mer känsliga för behandlingen, också snabbare utvecklar resistens mot behandlingen. Netto­ effekten blir att patienter med snabbt prolifierande tumörer generellt har en sämre sjukdomsprognos än patienter med långsamt prolifererande tumörer. Cytostatika kan indelas efter verkningsmekanism i cellcykeln i fasspeci­ fika (mitoshämmare och antimetaboliter) och icke-fasspecifika (alkylerare och antibiotikaderivat). Cytostatika kan administreras vid olika tidpunkter i relation till kirurgi­ och strålbehandling (pre-, peri- och post-). Dessutom indelas cytostatika­ behandlingen i behandling av manifest sjukdom, adjuvant sjukdom, induk­ tionskemoterapi, konsoliderande terapi och underhållsterapi. Vid neoadju­ vant terapi inleds den generella behandlingen (cytostatikabehandlingen) innan eventuella lokala behandlingsåtgärder av tumörsjukdomen påbörjas. Administrationen av cytostatika kan ske peroralt, parenteralt (iv bolus, iv korttidsinfusion, iv långtidsinfusion, intraarteriell, intramuskulärt), intra­ tekalt, intraperitonealt, intravesikalt, intrapleuralt och lokalt på hud. Vid administration aktiveras cytostatika i levern (särskilt viktigt för cyk­ lofosfamid). Vissa organ nås mindre lätt av cytostatika som t.ex. hjärna och testiklar skyddade av organbarriärer. Utsöndringen av cytostatika sker framförallt genom lever och njure (mindre genom hud, avföring och utand­ ning). Vid start av behandling måste man tänka på flera viktiga faktorer: – indikationen (kurativ, palliativ eller psykologisk), – patientens AT (ålder, mentalt status etc.) – ev. komplicerande sjukdomar (exempelvis hjärtsjukdom, njursjukdom, autoimmuna sjukdomar, blodsjukdom, tillförsel av andra läkemedel), – att behandlingen dokumenteras riktigt (se exempel på behandlingsproto­ koll), – längd och vikt, – blodstatus, – lever och njurfunktion, – hjärtstatus, – ungstatus, – pågående infektioner, 130 © Studentlitteratur Cytostatikabehandling – näringstillstånd, – nyligen given annan behandling med cytostatika eller strålbehandling, – nyligen utförd operation, – administrationsvägar (bra kärl, behövs exempelvis porth a cath). Vid behandlingen är det viktigt att skapa trygghet och förebygga eventuella biverkningar som t.ex. illamående. Se upp för komplikationer som infektio­ ner, blödningar, blodbrist, normalvävnadsskada och extravasering av cyto­ statika (särskilt adriamycin, mitomycin C, vinblastin). Patientinformation är mycket viktig (t.ex. Leukovorin vid högdos metotrexate). Skada på normalvävnad är särskilt frekvent som: – benmärgsdepression (de flesta medel), – slemhinnor (metotrexate, 5-FU), – nervsystem (vinkaalkaloider, cisplatinum), – hår (de flesta men särskilt högdos adriamycin, sendoxan och cisplatinum) – magtarmkanal (sendoxan, cisplatinum, adriamycin), – lungor (bleomycin), – hjärta (adriamycin), – hud (bleomycin), – urinblåsa (sendoxan) och – njure (cisplatinum, högdos metotrexate). Sena bieffekter kan uppstå. Hos män och kvinnor kan sterilitet uppkomma. Dos- och åldersrelaterad risk, som är svår att förebygga (spermanedfrys­ ning kan vara viktig innan behandling påbörjas). Amenorré och impotensbesvär kan uppkomma. Sekundära maligniteter har särskilt varit frekventa hos patienter som både strål- och cytostatikabe­ handlats. Någon risk för avkomman till patienter som erhållit behandling innan de avlat barn har ej visats, till skillnad från behandling av kvinnor under första trimestern, då både missbildade och dödfödda barn har beskri­ vits. Resultat Sjukdomar där cytostatikabehandling kan ge full remission och bestående bot Korionkarcinom ALL (barn) © Studentlitteratur 131 Kapitel 11 Exempel på cytostatikakort 132 © Studentlitteratur Cytostatikabehandling © Studentlitteratur 133 Kapitel 11 Hodgkins sjukdom Non-Hodgkinlymfom Wilms tumör Testistumörer Ewings sarkom Embryonalt rabdomyosarkom Sjukdomar där cytostatikabehandling kan ge remission och förlängd över­ levnad men där cytostatikaterapin sällan själv botar patienten Cancer mammae Cancer ovarie Småcellig lungcancer Myelom Leukemi hos vuxna Osteogent sarkom Olika barntumörer Sjukdomar där cytostatikabehandling kan ge palliation och objektiva remis­ sioner, men sällan förlänger överlevnaden Skivepitelcancer i huvud/halsområdet/avancerad sjukdom (?) Malignt melanom Hjärntumörer Mjukdelssarkom hos vuxna Kolorektal cancer Cancer ventrikuli Cancer corporis uteri Cancer vesica urinaria Sjukdomar där cytostatikabehandling sällan ger tumörsvar Bronkialcancer (ej småcellig) Cancer cervix uteri Cancer renis Cancer prostatae Cancer pancreatis Endokrina tumörer 134 © Studentlitteratur Cytostatikabehandling Utveckling av nya kemoterapeutika Screening av tänkbara droger tumörsystem Djur eller vävnadsstudier Humanstudier Fas I studier toxicitet och maximal tolerabel dos testas Fas II studier respons i olika tumörer testas Fas III studier jämförande randomiserade studier optimal behandlingsuppläggning adjuvant manifest sjukdom ”single” eller kombinationsbehandling Resistensmekanismer vid cytostatikabehandling Mekanism Exempel på involverat cytostatika Minskat drogupptag Ökad drogefflux p-glykoprotein metotrexat Förändrad intracellulär metabolism glutation och associerade enzymer Förändrad intracellulär distribution genom bindningsmekanismer Förändrade nivåer eller mutationer i kritiska enzymer topoisomeras II dihydrofolat reduktas Ökad DNA reparation O-6-metyl guanin metyl transferas © Studentlitteratur doxorubicin vincaalkaloider mitoxantron trimetrexat Ara-C alkylerare vinkristin doxorubicin doxorubin metotrexat nitrosourea 135 Kapitel 11 Multidrogresistens (MDR) är associerat med överexpression av membran­ transportproteinet p-glykoprotein (se ovan). Genen som kodar för proteinet benämns mdr1-genen. En rad kemoterapeutika är associerade till denna multidrogresistens; doxorubicin, vincaalkaloider, mitoxantron, trimetrexat, daunorubicin, etoposid, taxol, dactinomycin och mitomycin. Olika sätt att komma åt denna resistens har prövats: 1. Genom att använda droger som inte är associerade med MDR 2. Genom att använda medel som kan inhibera funktionen av p-glyko­ protein kalciumkanalblockerare kalmodulin inhibitorer quinidiner detergenter steroidhormon antiöstrogener t.ex. verapamil t.ex. phenothiaziner t.ex. cyklosporin A t.ex. cremophor EL t.ex. progesteron t.ex. tamoxifen 3. Genom att använda monoklonala antikroppar riktade mot p-glyko­ protein 4. Genom att inhibera mdr1-genexpression med hjälp av antisense oligo­ nukleotider 5. Genom att använda högdoskemoterapi. Indelningen av cytostatika Alkylerare (korsbinder DNA-strängar och förhindrar DNA-replikation, ej cellcykelspecifika, hämmar även DNA-, RNA-, proteinsyntes genom monofunktionell alkylering): ifosfamid mustin cyklofosfamid klorambucil melfalan prednimustin busulfan BCNU CCNU metyl-CCNU streptozotocin tiotepa 136 © Studentlitteratur Cytostatikabehandling Alkylerare med enbart monofunktionell hämning av DNA-, RNA- och pro­ teinsyntes. Ej cellcykelspecifika: prokarbazin dakarbazin karboplatin cisplatinum Antibiotika (interkalerar angränsande baspar i DNA-strängarna. Hämmar DNA-syntes. Ej cellcykelspecifika): doxorubicin (antracyklin) 4-epidoxorubicin (antracyklin) aklarubicin (antracyklin) daunorubicin (antracyklin) idarubicin (antracyklin) bleomycin mitomycin dactinomycin mitramycin (plicamycin) Antimetaboliter (intefererar med DNA-syntes. Oftast S-fasspecifik): 2-CdA cytarabin fudarabin 5-fluorouracil gemcitabin* 6-merkaptopurin metotrexat metyl-GAG pentostatin 6-thioguanin * Har även andra verkningsmekanismer som s.k. masked DNA chain termination och egenstimulering av effekt. Mitoshämmare (stör funktion av mikrotubuli, förhindrar celldelning. Mitos­ fasspecifika). taxol estramustinfosfat © Studentlitteratur 137 Kapitel 11 vinkristin vinblastin vindesin Övriga amsakrin hexametylmelanin mitoxantron etoposid (podofyllotoxinderivat) teniposid (podofyllotoxinderivat) asparaginas (Ur: Cytostatikamanual 1993 Onkologiskt centrum för södra sjukvårdsregionen.) 138 © Studentlitteratur 12 Strålbehandling Terapi med joniserande strålning började som ”spin off-effekt” till upptäck­ ten av röntgenstrålarna, och makarna Curie har givits äran av att ha applice­ rat metoden i behandlande syfte i början av 1900-talet. I Sverige dröjde det till mellan 1910 och 1915 innan röntgenbehandling började i begränsad omfattning. Terapin inriktade sig både på tumörsjukdomar och godartade tillstånd (för vilket det annars inte fanns någon dåtida behandling) såsom lymfadeniter, hemangiom, svampinfektioner etc. Först senare tillkom terapi med högre energi än röntgenstrålar, t.ex. med linjäracceleratorer. Strålbehandling kan ges dels som extern, intrakavitär, interstitiell och intern radioterapi. Det som karakteriserar joniserande strålning är den lokaliserade frigörel­ sen av en mycket stor mängd energi, vilket är tillräckligt för att bryta även mycket starka kemiska bindningar. Man brukar uppdela den joniserande strålningen i partikelstrålning och elektromagnetisk strålning. Till partikel­ strålningen hör bl.a. elektroner, protoner, alfapartiklar och neutroner, medan man till den elektromagnetiska strålningen brukar föra röntgen- och gam­ mastrålning. Den elektromagnetiska strålningen kan antingen beskrivas som en vågrörelse eller som en ström av energipaket, fotoner (se figur 12.1). Den joniserande strålningen absorberas i materia genom att den verkar både direkt (partikelstrålning) och indirekt joniserande (elektromagnetisk strålning). Den elektromagnetiska strålningens absorption beror vid låga energier på en fotoelektrisk process (foton förlorar all energi genom att slå ut fast bunden mer central elektron, varvid mer perifer elektron tar den cen­ tralas plats och avger karakteristisk röntgenstrålning) och vid högre ener­ gier dominerar Comptonprocesser (elektron slås ut ur sin perifera bana och det bildas också en foton med lägre energi). Strålningen kan sedan direkt (via elektron) eller indirekt (genom bildning av fri radikal) påverka DNA och framkalla letala eller subletala skador. Vid strålbehandling är celler i tidig S-fas och G2-fas mest känsliga. Man utnyttjar den sämre reparations­ förmågan hos tumören jämfört med normalvävnaden i terapihänseende. © Studentlitteratur 139 Kapitel 12 Elektromagnetisk strålning Icke joniserande Joniserande Radiovågor, mikrovågor Synligt ljus LV MV KV UKV 10–18 10–9 10–6 10–3 IR Röntgen Gammastrålning UV 1 103 106 Energi eV Betastrålning Neutroner Alfa-strålning Partikelstrålning Figur 12.1 Typer av strålning och deras energimängd uppdelat på elektromagne­ tisk och partikelstrålning. UV = ultraviolett ljus, IR = infrarött ljus, radiovågor uppdelade på UKV = ultrakortvågor, KV = kortvågor, MV = mellanvågor och LV = långvågor. Aktiviteten av joniserande strålning anges som Bequerel (Bq) och en Bq motsvarar sönderfallet per sekund av en given isotop. Absorberad dos bru­ kar anges i Gray (Gy), där 1 Gy motsvarar 100 rad eller 1 joule/kg. Olika typer av joniserande strålning kan dock trots samma dos medföra olika vävnadsskada och därför behöver typen av strålning i doshänseende viktas (alfastrålning är ungefär 20 ggr skadligare än annan strålning). Man pratar därför om dosekvivalenter och dess enhet är Sievert (Sv). Vid standardise­ ring av radioterapi mellan olika vävnader och metoder används begrepp som CRE och a/ß (se appendix 2). För ytligt liggande tumörer utnyttjas lägre energi (kilovolt) genom konventionell röntgen eller genom närbestrålningsapparater, medan man för djupare belägna tumörer använder högvoltsapparater som 60Co-apparater eller linjäracceleratorer. Nackdelen med konventionell röntgen om man skall behandla djupare belägna tumörer är att huvuddelen av dosen stannar ytligt t.ex. i hud. Högvoltstekniken har dessutom fler fördelar, som en skarpare avgränsning av strålfältet mot nor­ malvävnad och mindre spridd strålning. Elektronstrålning har ideal dosför­ delning för ytligt belägna tumörer med en skarpare avgränsning mot normal vävnad. Vid strålbehandling av Hodgkin’s sjukdom har 5-årsöverlevnaden förbättrats från 10 % hos obehandlade, 25–50 % hos röntgenbehandlade till 65–75 % hos högvoltsbehandlade fall (efter Kaplan 1980). 140 © Studentlitteratur Strålbehandling Strålbehandling kan också ges genom intrakavitär (t.ex. radiuminlägg), interstitiell metodik (t.ex. iridiumnålar) och med radioaktiv isotop admi­ nistrerad iv eller peroralt (t.ex. 131I). De vanligaste radionukliderna för intern terapi är: Radionuklid Halveringstid Användningsområde I-131 I-131-MIBG P-32 8.1d Au-198 2.7d Y-90 2.7d Sr-90 50.5d Hypertyreos, tyreoideacancer Feokromocytom, neuroblastom Polycytemi, trombocytemi, intracavitär behandling Intraartikulär behandling, intrakavitär behandling Intraartikulär behandling, intrakavitär behandling Skelettmetastaser 14.3d En rad faktorer påverkar stråleffekten i tumörvävnad såsom: – typ av tumör – tumörens storlek – hur väl syresatt tumören är – vid en stor tumör finns alltid områden med dålig syresättning och risk för dålig terapieffekt – ålder hos patienten – andra sjukdomar och allmäntillstånd. Normalvävnadens tolerans (ryggmärg tål vanligtvis upp till 45 Gy, hjärna mellan 50–58 Gy, ögonlins 4 Gy, hel lunga 15 Gy etc). Tumörer kan uppvisa olika känslighet för strålbehandling. Till de strål­ känsligaste hör seminom där ofta en dos på 30 Gy räcker, lymfom är också känsliga 30–45 Gy, medan måttlig strålkänslighet uppvisas av t.ex. bröst­ cancer och tumörer utgångna från skivepitel i ÖNH-området 44–70 Gy. Låg strålkänslighet uppvisas av tumörer i hjärna, pankreas, njure och melanom (ofta skulle en dos över 70 Gy behövas). Vid seminom och lymfom kan strålbehandlingen i sig vara botande. Ofta ges strålbehandlingen vid andra tumörer i palliativt syfte eller i en kombi­ nerad behandling för kuration. Vid bröstcancer syftar den postoperativa behandlingen till att reducera risken för lokoregionala recidiv, medan behandlingen i sig inte tycks påverka överlevnaden. Eventuella bieffekter av behandlingen är relaterade till hur stor dos som ges, fraktioneringsmönster, hur stor kroppsyta som behandlas, interkurrenta sjukdomar, allmäntillstånd, patientens ålder och lokal som behandlas. Gene­ © Studentlitteratur 141 Kapitel 12 rellt är den akuta reaktionen större om fler fraktioner används medan lång­ tidsbiverkningarna är mer betydande om färre och större doser används. Fraktioneringsmönstret vid radioterapi kan beskrivas enligt nedan: Totaldos Fraktions- Antal dos fraktioner Antal fraktioner, totalt Sedvanlig Hypofraktionerad beh. Hyperfraktionerad beh. Hyperfraktionerad/ accelererad beh. 2,0 Gy 5,0 Gy 1,0 Gy 1 per dag 2 per vecka 2 per dag 35 8 35 70 Gy 40 Gy 70 Gy 1,7 Gy 2 per dag 19 64,4 Gy Med kortare behandlingstid (genom hyperfraktionerad strålbehandling) uppnås ofta bättre lokalkontroll till priset av stora akuta biverkningar t.ex. från slemhinnor. Sena biverkningar är mindre eller lika (mindre dos per fraktion). Ett av de viktigaste argumenten för en hyperfraktionerad strålbe­ handling och därigenom kort behandlingstid är iakttagelsen av att efter 2–3 veckors radioterapi behöver dosen höjas för att erhålla samma isoeffekt (hos människan förloras ungefär 0,6 Gy/dag i effekt från omkring v 2–3). Detta tror man beror på repopulationsfenomen i tumören. Om större kroppsvolymer behandlas kan generella symtom som trötthet, illamående och matleda uppstå. Blodbildningen kan också påverkas särskilt om benmärgsreserven tidigare är komprimerad. En generell stressreaktion kan uppträda med gastrit/ulcussymtom. I huden kan en rodnad och i sällsynta fall sår uppkomma om en bety­ dande del av dosen hamnar ytligt. I munhålan kan en mucosit och epitelit uppkomma med ibland svåra symtom i form av smärta, nedsatt salivsekretion, illaluktande mun, svampinfektion och stora sår. Senare kan svåra kariesangrepp ske om inte tandprofylax insättes. Behandlingen är symtomatisk. Vid bestrålning över 30 Gy till magtarmkanalen kan patienten drabbas av lös avföring/diarré. Från urinblåsan kan cystit uppkomma som ibland sekundärinfekteras. Lymfödem kan uppstå i armar och ben. Detta tillstånd är svårbehandlat annat än symtomatiskt (manuellt lymfdränage, strumpa och pulsator). I extrema fall kan operation med fettsugning tillgripas. Vid bestrålning av lunga kan pneumonit uppstå som vanligen debuterar 4–6 veckor efter behandlingen. Vid symtom ges behandling med steroider och antibiotika. 142 © Studentlitteratur Strålbehandling Bestrålning av gonader i doser över 1 Gy kan temporärt nedsätta fertilitet och i doser över 3–10 Gy inträder bestående sterilitet. Sena bieffekter inkluderar hudatrofi, kärlnybildning, bindvävsinväxt, salivbortfall, hårbortfall, atrofi av slemhinnor, sterilitet, tillväxtrubbningar och risk för sekundär malignitet. Vid bestrålning av barn bör man vara särskilt aktsam på skelettet där tillväxtrubbningar kan ske. Risken för tumörutveckling efter tidigare behandling är ofta högre ju yngre man var vid bestrålningen. Särskilt benägna för tumörutveckling är tyreoidea, bröst, blod och lymfvävnad och mjukdelar. Kombinationsbehandling med cytostatika och joniserande strålning kan ibland vara problematisk och helst bör behandlingen ske sekventiellt och ej samtidigt. Behandling med adriamycin samtidigt med joniserande strålning aggraverar strålreaktionen påtagligt. Höga preoperativa doser bör undvikas då dessa kan försvåra operations­ möjligheterna. Innan strålbehandlingen ges bestäms targetområde och dos. Erforderliga diagnostiska undersökningar har ofta redan gjorts eller görs i samband med planeringen av behandlingen. För att hålla patienten i ett standardiserat behandlingsläge tillverkas ofta ett ”skal” eller mask. Simulator används för Påvisbar tumör Påvisbar tumör och misstänkt tumör Påvisbar tumör, misstänkt tumör samt osäkerhetsmarginal Minimidos till 3 Låg isodosyta som inkluderar 1–4 1 2 3 4 5 Figur 12.2 Exempel på olika planeringsvolymer vid strålbehandling. Efter ICRU Report no 50, 1993. © Studentlitteratur 143 Kapitel 12 att med hjälp av röntgen indikera behandlingsfält och CT-snitt. Med CT planeras behandlingen och targetområdet fastställs. Med dator och fysikers hjälp ges olika behandlingsalternativ. På en gemensam konferens med läkare och fysiker antas den mest optimala planeringen. Det antagna behandlingsförslagets fält inritas på simulator och fältbilder tages. En jäm­ förelse med dosplan och patientläge sker på simulatorn. Behandlingen bör­ jar sedan på anvisad apparat. Behandlingens fortgång kontrolleras med fält­ bilder, sondmätningar och läkarkontroller av tumör och vävnadsreaktioner. Strålbehandlingens kliniska roll (indikationer) kan sammanfattas enligt nedan: Kurativ som enda behandlingsmodalitet ÖNH-cancer Cervixcancer Seminom Hodgkins sjukdom och non-Hodgkin lymfom Blåscancer Tidig prostatacancer Analcancer Hudcancer Medulloblastom och några andra mindre vanliga hjärntumörtyper Tyreoideacancer Komponent i en multimodal kurativ behandling Bröstcancer Rektalcancer Mjukdelssarkom Avancerad ÖNH-cancer Helkroppsbestrålning före benmärgstransplantation Palliativ radioterapi Smärta (speciellt kotmetastaser) Frakturprofylax Hemostatisk Medullakompressioner Hjärnmetastaser Venösa och lymfatisk obstruktioner Terapi med olika typer av joniserande strålning kan också beskrivas som ”high LET”- (t.ex. neutroner, argon, neon, heliumisotoper) och ”low LET”­ (t.ex. foton, elektron och proton) strålning. High LET-strålning är mer obe­ roende av DNA-reparation, fraktioneringsmönster, bruk av sensitizers, 144 © Studentlitteratur Strålbehandling syrenivå i vävnad, och cellcykelfas än low LET-strålning. LET = linear energy transformation. Dosdistribution på djupet är mer fördelaktig för pro­ tonbehandling än högvoltsterapi, som i sin tur är fördelaktigare än kobolt­ och röntgenbehandling. Radiosensitizers (radiosensitizer = ämne som tillförs för att öka strål­ ningens effekt i en tumörvävnad utan att själv ha en egen stråleffekt om ämnet administreras enskilt) har sin effekt framförallt om de tillförs före och under strålbehandling medan ingen eller liten effekt syns vid tillförsel sent efter behandlingen. Hypertermi används kliniskt för att förstärka effek­ ten av strålbehandling vid lokalrecidiv i huden. Värmen appliceras med mikrovågsapplikator till ungefär 42°C i nära anslutning till strålbehand­ lingen. Stereoskopisk strålbehandling används framför allt vid CNS-tumörer. Multipla strålkällor medger koncentration av dosen mot ett litet område. Utvecklingslinjer för radioterapin i framtiden inkluderar ökad förståelse för tumörbiologi och särskilt tumörers genetiska bakgrund, utvärdering av indikationerna för behandling av premaligna förändringar, studier av ”radiosensitizing drugs”, studier av isotop immunokonjugat, introduktion av tredimensionell dosplanering och radioterapi, prediktiv testning av indi­ viduella tumörer och normalvävnadkänslighet för joniserande strålning, manipulationer av stamceller för att skydda normalvävnad, intraoperativ strålbehandling, kombinerad kemo- och radioterapi och förändrat fraktio­ neringsmönster, framförallt genom att använda multipla behandlingar per dag. Biologiska effekter av helkroppsbestrålning med röntgen eller gammastrålning. Strålningsolyckor Helkroppsdos Effekt 0–0,25 Gy Inga omedelbara effekter. Möjlighet finns att fördröjda effekter kan uppträda i låg frekvens. Inga subjektiva obehag. Övergående reduktion kan ses av vissa blodkroppar som lymfocyter och granulocyter. Fördröjda effekter kan uppträda i låg frekvens. Subjektiva besvär (trötthet, illamående, kräkningar). Reduktion av antalet lymfocyter och neutrofila med för­ dröjd återhämtning. 0,25–1,0 Gy 1,0–2,0 Gy © Studentlitteratur 145 Kapitel 12 2,0–6,0 Gy > 6,0 Gy I regel återhämtning inom 3 månader. Fördröjda effekter kan förkorta medellivslängd (med ungefär 1 %). Kraftiga subjektiva besvär (trötthet, illamående, kräk­ ningar och diarré). Med en latensperiod på 1–2 veckor uppträder feber, håravfall, blödningar och inflammatio­ ner i slemhinnor. Har exponeringen varit mer än 3,0 Gy finns en 50 %-ig risk för dödlig utgång i komplikationer inom 6 dagar. Återhämtningen tar annars ungefär 6 månader. Understödjande behandling kan påskynda denna återhämtning. Osannolikt att någon överlever. Enstaka individ kan överleva efter att moderna intensivvårdsresurser inklu­ derande benmärgstransplantation erbjudits. Dödsfall vid lägre doser beskrivs som hematopoetiska syndrom, vid mellandoser som gastrointestinala syndrom och vid mycket höga doser som CNS-syndrom. En biologisk värdering (klinisk dosimetri) av stråldosen kan ske genom registrering av initialt huderytem och illamående, dess tidpunkt och var­ aktighet och erytemets utbredning. Medeldosen för uppträdande av hud­ erytem är 2 Gy, för illamående 1,2 Gy och för kräkningar 1,8 Gy. Vid Tjer­ nobylolyckan visade det sig att en sådan klinisk dosimetri träffade rätt inom +/– 20 % av objektiv dos. Blodprover (analys av antal lymfocyter, granulocyter och trombocyter, kromosomförändringar och antal mikrokärnor) kan ge stöd för expone­ ringsvärderingen. Om lymfocyttalet är normalt ett dygn efter bestrålningen kan man oftast utesluta en totalkroppsexponering på >1 Gy. Vid en bestrålning på mellan 2–5 Gy uppvisar lymfocyter nadirvärde redan efter ett dygn medan granulocyter och trombocyter först efter 20 dagar når lägsta värde. Vid en strålningsolycka gäller det att så fort som möjligt avsluta/begränsa fortsatt exponering/kontamination. Vid olyckor med radioaktiva isotoper bör material tas till vara för identifiering av nuklider. Jodprofylax (blocke­ rar upptag av jodisotop i sköldkörtel) kan vara aktuell beroende på expone­ ringen och bör i så fall insättas snabbt då effekten av sådan profylax kan avta redan efter några timmar. Katastrofplaner/kommittéer finns upprättade vid landets sjukhus i händelse av strålningsolyckor. Statens strålskyddsin­ stitut skall omedelbart informeras om inträffad olycka, bistå i räddnings­ åtgärder och om nödvändigt även skicka experter till olycksområdet. 146 © Studentlitteratur Strålbehandling Radiobiologiska termer Radiobiologisk term Definition Måttenhet Aktivitet Radioaktivt sönderfall per tidsenhet Sönderfall per sekund (s–1). Becquerel (Bq) Absorberad dos Mängd strålningsenergi som viss mängd materia tar upp Joule per kilogram (J*kg–1). Gray (Gy) Dosekvivalent Dosen i Gy multiplicerad med stråltypens relativa biologiska effekt. Joule per kilogram (J*kg–1). Sievert (Sv) Effektiv dosekvivalent Dosekvivalenten viktad för typ Sievert (Sv) av vävnad. Kollektiv effektiv dosekvivalent Dosekvivalenten viktad för typ Man-Sievert av vävnad till en grupp (man-Sv) individer. Radiojodbehandling Vid I-131-behandling av tyreotoxikos får man ta hänsyn till: endokrinologiska aspekter radioterapeutiska aspekter strålskyddsöverväganden Exempel på lämplig absorberad dos vid olika thyreotoxikosbakgrund Toxiskt autonomt adenom Toxisk nodös struma © Studentlitteratur 300 Gy 120–150 Gy 147 Kapitel 12 Var i cellcykeln utövar terapimodaliteten sin effekt? Joniserande strålning Cytostatika alkylerare antimetaboliter antibiotika antracykliner mitoshämmare Tidig S-fas, mitosfas, celldöd efter celldelning/ar Dödar mest proliferande celler, men har även effekt på ickeprolifererande celler Maximal effekt i S-fas Störst effekt i S-fas / G2-fas, men även effekt hela cellcykeln Maximal effeket i mitosfas Toxisk diffus struma Långvarig tyreostatika behandling 120 Gy lägg till ytterligare 1/3 i dos Formel för beräkning av aktivitetstillförsel vid radiojodbehandling D×M A = ----------------------P×T×K A D M P T K = Tillförd aktivitet I-131, MBq = Absorberad dos, Gy = Thyroideas massa = % tillförd aktivitet, som har tagits upp i tyreoidea efter 24 timmar = Effektiva halveringstiden = Konstant Kontraindikationer för radiojodbehandling Barn och ungdomar Graviditet och amning Relativa kontraindikationer Oftalmopati (progredierande) Hotande hjärtinkompensation (Fertila kvinnor som önskar föda barn) 148 © Studentlitteratur Strålbehandling Blockering av tyreoideafunktionen Jodblockad Jodmedikation Röntgenkontrast: Urografi Flebografi Angiografi Kolecystografi Lymfografi 3 mån 1 vecka 1 vecka 1 vecka 3 mån 1–2 år Utsättningstid före I-131-test/terapi: Trijodtyronin Levaxin Tyreostatika 1–2 veckor 4 veckor 1–2 veckor I-131 behandling av tyreoideacancer Tyroideacancer behandlas med operation, radiojod, extern strålbehandling, endokrin suppressionsbehandling och kemoterapi. Operationerna inklude­ rar lobektomier och istmusresektioner (tidig papillär cancer, ockult folliku­ lär cancer) och totala tyreoidektomier (avancerad papillär cancer samt all follikulär och medullär cancer). Vid lymfkörtelmetastasering görs hals­ lymfkörtelutrymning. En adekvat extern postoperativ stråldos omfattar ofta en dos på 50–60 Gy given på 5–6 veckor. För att supprimera TSH rekom­ menderas en tyroxindos som supprimerar TSH till 0,1 mIU/L med ett ytter­ ligare tillägg på 20–50 mikrogram. Indikationerna för radiojodterapi är: 1. Högriskpatient, postoperativt, tillförd aktivitet ungefär 3 700 MBq/ behandlingstillfälle. Målet är att utplåna kvarvarande tyreoidearester för att öka käns­ ligheten och tillförlitligheten med tyreoglobulinanalyser och med even­ tuell efterföljande gammakameraundersökning. Vidare kan behand­ lingen utplåna kvarvarande hematogena/lymfogena mikrometastaser. Högriskpatienterna vid papillär tyreoideacancer är de som har kapselge­ nombrott, pT4, pN3 och/eller med inslag av lågt differentierad cancer eller DNA aneuploidi. Patienter med makroskopisk kvarvarande tumör © Studentlitteratur 149 Kapitel 12 150 © Studentlitteratur Strålbehandling Figur 12.3 Dosplanering av strålbehandling av prostata för en lokalt tidigt växande prostatacancer. Patienten ligger på rygg. Trefältsteknik Figur 12.4 Dosplanering av strålbehandling av prostata för en lokalt tidigt växande prostatacancer. Patienten ligger på mage. Trefältsteknik. Observera den mindre bestrålningen av rektum vid detta tillfälle. Figur 12.5 Dosplanering av tangentiell strålbehandling av vänster bröst efter seg­ mentresektion av en stadium I-bröstcancer. Två tangentiella fält. © Studentlitteratur 151 Kapitel 12 eller icke-resektabel tumör erhåller dessutom jodbehandling.Vid folliku­ lär tyreoideacancer ges radiojodbehandling till patienter med icke-resek­ tabel cancer, med makroskopisk kvarvarande tumör, med makroskopiskt radikalt opererad cancer som har kvarvarande tyreoideavävnad och till makroskopiskt radikalt opererade utan scintigrafiskt påvisad kvar­ varande tyreoideavävnad. Således erhåller alla patienter med follikulär cancer radiojod utom de med ockult cancer (pT1 pN0). 2. Behandling av jodupptagande metastaser. Ungefär 7 400 MBq tillförs vid varje behandlingstillfälle. Biverkningar: Risken för leukemi efter I-131 i utsläckningsdos är sannolikt mycket liten. I djurförsök har dominanta mutationer i gonader påvisats men hos människan har ej än detekterats någon ökad risk av missbildningar hos avkomman till behandlade patienter. Detta trots att man även undersökt barn som senare vuxit upp och givit upphov till avkomma. En temporär infertilitet har påvisats hos vuxna män efter utsläckningsdoser. P-32 behandling Primär polycytemi och trombocytemi behandlas på framförallt tre sätt: venesectio P-32 cytostatika (alkylerare) Vid P-32-behandling tillförs 0,1 mCi/kg (3,7 MBq/kg) kroppsvikt. Admi­ nistrering kan ske peroralt eller intravenöst, men intravenös tillförsel är att föredra pga. stora interindividuella skillnader i resorbtion samt risk för förvärrade gastrit/ulcusbesvär. Restriktivitet i antalet P-32-behandlingar bör iakttagas pga. en ökad risk för akut leukemi terminalt (10–20 %). En motsvarande risk föreligger också efter behandling med alkylerare. 152 © Studentlitteratur Strålbehandling Exempel på strålbehandlingskort © Studentlitteratur 153 13 Hormonbehandling Redan vid slutet av 1800-talet fann den skotske kirurgen Beatson att bröst­ tumörer hos kvinnor som kastrerades kunde tillbakabildas. Senare fann man att andra tumörformer som t.ex. prostatacancer också svarade på endokrina manipulationer. De endokrina behandlingsmetoderna vid cancer har däref­ ter utvecklats i samspel med den ökade kunskapen om endokrina system, först så att specifika hormoner tillfördes och senare så att cancerns effekt hindrades på receptornivå i cellerna eller att olika tillväxtfaktorsystem påverkats. Nedan följer en sammanställning av de viktigaste behandlings­ indikationerna för hormonterapi vid maligna sjukdomar. Sjukdom Behandling Bröstcancer Högdos östrogen (kvinnor och män) Högdos progestiner Antiöstrogen Aromatashämmare LHRH-analoger Prostatacancer Östrogen Antiandrogen LHRH-analog Kastration Njurcancer Lymfom Progestiner Kortikosteroider Exempel bieffekter Ödem, trombosrisk Maskulinisering, viktuppgång Vissa bortfallssymtom Hudexantem Kortisonbrist (om ej substitueras) Bortfallssymtom Kastration, bortfallssymtom Bortfallssymtom, ödem (hjärt-kärlsjukdom), trombosrisk Bortfallssymtom Bortfallssymtom Bortfallssymtom Desmoider/sarkom Antiöstrogen Ovarialcancer Progestiner Antiöstrogener Viktuppgång, ödem Cushingbild Skeletturkalkning Vissa bortfallssymtom Maskulinisering, viktuppgång (Bortfallssymtom) Uteruscancer Melanom Maskulinisering, viktuppgång Vissa bortfallssymtom 154 Progestiner Antiöstrogener © Studentlitteratur Hormonbehandling Antiöstrogener tillförda som adjuvant behandling vid bröstcancer har visat sig öka överlevnaden hos postmenopausala kvinnor. Nyligen utförda under­ sökningar talar för att fem års adjuvant terapi med antiöstrogen är bättre än två års terapi. Värdefulla behandlingseffekter av antiöstrogener har också beskrivits hos premenopausala kvinnor. Behandlingsvaret vid bröstcancer kan delvis predikteras genom att halten av östrogen och progesteronrecep­ torer i tumören mätes. Vid utvärdering av hormonell terapi kan ibland behandlingsvaren komma sent (efter 2–3 månader) och ibland är behand­ lingen framgångsrik om man uppnår stationär sjukdom. Tumörer som förväntas svara på endokrina manipulationer har ofta växt långsamt, är högt differentierade, oftare diagnostiserade hos äldre kvinnor, och uppvisar låg celldelningshastighet med hög hormonreceptorhalt. Om en kvinna tidigare svarat på en hormonmanipulation är chansen större att hon även svarar på nästa hormonbehandling. Metastasernas lokalisation kan också påverka hormonsvaret. Hud- och skelettmetastaser vid bröstcancer svarar t.ex. oftare på hormonterapi än andra lokalisationer. Hos äldre kvinnor, där man velat undvika operation, har man i vissa situationer infört antiöstrogen­ behandling som första terapi. Hormonmanipulationer samtidigt som man ger cytostatikabehandling eller i form av sekventiell behandling har ej säkert visat sig vara effektivare än om vardera terapin ges var för sig. Hos premenopausala kvinnor kan adjuvant cytostatikabehandling liksom oofo­ rektomier öka den recidivfria och totala överlevnaden. Det har livligt disku­ terats om åtminstone en del av den cytostatiska effekten skulle kunna förmedlas genom en kastrationseffekt av cytostatika. Vid symtomgivande prostatacancer används endokrin behandling för att palliera patienten. Vid tidigt använd endokrin terapi har biverkningarna i form av förlust av sexualfunktion varit framträdande. Med användning av mer moden teknik med exempelvis rena antiandrogener kan förhoppnings­ vis sådana biverkningar undvikas. Vissa studier har antytt att s.k. total androgen blockad (LHRH-analog samt antiandrogen) skulle leda till ytter­ ligare ökad överlevnad jämfört med enbart ett av medlen. Ibland kan man se paradoxala tumörsvar vid hormonterapi. T.ex. kan en tumör som annars progredierat gå i regress om hormonterapin utsätts. Vid inledandet av tumörbehandlingen kan initialt ibland ses en ökad tumörväxt (tumor flare) som senare utbyts mot en tumörhämning. Kvinnor med ske­ lettmetastaser kan ibland utveckla en övergående hyperkalcemi vid start av antiöstrogenbehandling. Vid fjärrmetastaserad tumörsjukdom har det inte visats att patienter botas med endokrin terapi även om ibland långa partiella eller kompletta remis­ sioner kan ses. © Studentlitteratur 155 14 Immunologisk behandling Tumörer, cellyteantigen och immunitet På cellytan av en tumörcell sker en rad förändringar som kan leda till immunsvar mot cellen. Tumörer inducerade med onkogena virus (t.ex. EBvirus, HTLV-1, papillomvirus) uppvisar virusrelaterade peptider på cellytan vilka, tillsammans med MHC-molekyler, kan utgöra starka transplanta­ tionsantigen och generera haplotypspecifika cytotoxiska T-celler. Under tumorigenesen kan produkter av, hos den adulta organismen, normalt tysta gener uttryckas, s.k. onkofetala antigen. Exempel på detta är CEA (karcinoembryonalt antigen) vid tarmcancer och alfafetoprotein vid levertumörer. Vissa andra intracellulära protein, som i vanliga fall inte är destinerade att hamna i cellmembran/cellyta, kan ändå påvisas genom pep­ tid/MHC klass 1-komplex på cellytan och vara ett mål för cytotoxiska T­ celler. Ett mer eller mindre tumörspecifikt antigen för vissa melanom påvisades genom denna mekanism nyligen och studier pågår för att söka använda antigenet som mål för immunterapi vid melanom. Minskar immunsvar Ökar immunsvar Förlust av MHC klass 1 molekyler Virusantigen Onkofetala antigen Tumörcell Muterade onkogener Tumörspecifika antigen Lewisantigen Mucinsyntes Abnorma glykoprotein Förlust av blodgruppsantigen Kemiskt inducerad tumör Spontant uppträdande tumör Virusframkallad tumör UV-ljussframkallad tumör Figur 14.1 156 © Studentlitteratur Immunologisk behandling En annan mekanism för uttryck av svaga nya antigen på cellytan är expres­ sion av punktmuterade gener såsom p53-genen och rasgenen. Även kolhydratstrukturen på cellytan i en tumör kan förändras, som för­ lust av blodgruppsuttryck, ökad syntes av Lewis Lea-antigen eller ökad mucinsyntes. Dessa förändringar kan leda till immunsvar mot en tumör. Likaså kan abnorma uttryck av glykoprotein i tumörkärl vara ett mål för immunterapi. Metastaserande tumörer tappar ofta MHC klass 1-molekyler och detta skulle kunna innebära att cellerna är mindre sårbara för T-celler och NK­ celler. Experimentella undersökningar har visat att en kemiskt inducerad tumör, MCA-1, kan inducera immunitet mot en implantation av samma tumör i samma djur, men inte immunitet för en tumör inducerad i en syngen mus med samma karcinogen. Tumörer, inducerade med ett givet onkogent virus, immuniserar däremot mot tumörer producerade i syngena möss med samma virus, men inte mot tumörer inducerade med annat virus. Sålunda delar tumörer, producerade med samma onkogena virus, ett vanligt antigen, en viral peptid, som är närvarande på alla neoplastiska celler som bär virus­ genomet och som leder till att cytotoxiska T-celler aktiva mot en tumör vill korsreagera med alla andra tumörer producerade med samma virus. Potentiellt kan både viruskontrollerade antigen, expression av normalt tysta gener, muterade antigen, förändringar i kolhydratstukturen, föränd­ ringar på cellytan på grund av cellcykelrelaterade fenomen och föränd­ ringar relaterade till metastaseringspotential hos tumören leda till att immunsvar mot tumören framkallas. Stora variationer kan dock finnas i svarets styrka och dess påverkan på tumörväxt. Starka antigen skapar exem­ pelvis starka immunreaktioner vid virusassocierade tumörer och vid tumö­ rer som är UV-ljusinducerade, medan transplantationsantigenen vid kemiskt inducerade tumörer är svagare och mycket variabla. Tumörer som uppträder spontant hos djur producerar inget eller mycket svagt immunsvar hos värden. Hos immunsupprimerade individer dyker en ökad frekvens av starkt immunogena tumörer upp som ofta är virusassocierade med eller utan kom­ bination av UV-ljusexponering. Däremot är tumörer med låg immunogeni­ citet inte påtagligt ökade i frekvens hos immunsupprimerade. Immunologiska effektormekanismer vid tumörsjukdomar inkluderar cytotoxiska T-celler (aktiverande av makrofager via helper T-celler), lymfo­ kiner från T-celler som aktiverar makrofager till cytotoxiska egenskaper, makrofager och lymfocyter stimulerade av antikroppar till cytotoxiska egenskaper, natural killer-celler som är spontant cytotoxiska, lymfokinakti­ © Studentlitteratur 157 Kapitel 14 verade lymfocyter (LAK-celler), antikroppar som aktiverar komplement och aktivering av K-celler via Fc-receptorn från antikropp bunden till can­ cercell. Hämmande effekter på immunsvar kan bl.a. åstadkommas av vissa T-cellspopulationer och immunkomplex. Immunologiska tekniker att behandla tumörer Sedan 1960-talet har en omfattande forskning bedrivits för att använda mekanismer från vårt immunsystem till att bekämpa cancersjukdomar. En teori om att immunsystemet verkade som ett polissystem och övervakade/ spårade upp/dödade neoplastiskt omvandlade celler (the immunosur­ veillance hypothesis) var länge populär. För närvarande har man åtminstone delvis gått ifrån denna hypotes. Ett avgörande argument mot den har varit att individer med förvärvade/ärftliga immundefekter inte har en generellt ökad förekomst av maligna tumörer utan istället drabbas av vissa speciella mer sällsynta tumörformer där virusinfektioner kan spela en roll (t.ex. maligna lymfom, tumörer i kroppsöppningar och hud). Forskning om att ändå använda immunologiska metoder för att behandla tumörsjukdomar har dock fortsatt och längst har utvecklingen kommit vid användning av interferoner, interleukiner, TIL-celler (tumörinfiltrerande lymfocyter), LAK-celler (lymfokinaktiverade lymfocyter) och monoklo­ nala antikroppar. Vid en tumörsjukdom, hårcellsleukemi, kan man med interferonbehand­ ling åstadkomma långtidsremissioner i 70–90 % av fallen. Viktigare behandlingssvar har dessutom setts vid lymfom, myelom, njurcancer och hudmetastaser av melanom. Interferoner som förekommer i olika typer (alfa, beta, gamma) har flera olika effekter: de inhiberar virusreplikation, hämmar celldelning, inducerar feber, stimulerar både antikroppsbildning och cellförmedlade immunreaktioner och verkar i höga koncentrationer cytostatiskt. Med monoklonala antikroppar har partiella remissioner setts i 10–20 % av fallen vid behandling av koloncancer, pankreascancer, melanom och lymfom. Genom att kombinera levamisol (medicin mot masksjukdom med icke specifika immuneffekter) och 5-fluorouracil som adjuvantbehandling har, vid koloncancer stadium Duke C, en reduktion i recidivfrekvens med 30–40 % uppnåtts. Behandling med interleukin-2 tillsammans med LAK­ celler eller TIL-celler har visat effekt vid melanom, njurcancer och kolorek­ tal cancer i 10–30 % av fallen (kompletta och partiella remissioner). Denna behandling har visat sig vara mycket toxisk. Bl.a. finns risk för hypotoni 158 © Studentlitteratur Immunologisk behandling och generellt kapillärläckage (capillary leak syndrome). En associerad effekt vid den immunologiska behandlingen är induktion av feber. Då feber i sig själv kan ha en antitumoreffekt blir det viktigt att i framtiden visa att nya immunologiska metoder verkar oberoende av feberinduktion. Förutom feber är trötthet, influensalika symtom och viktnedgång vanliga generella biverkningar vid immunterapi. Vid forskningen med lymfocyter och monoklonala antikroppar söker man också bl.a. övervinna problem med tumörcellsheterogenitet och distri­ butionen i blod/tumörvävnad av antikropp. Det finns som beskrivits en rad kvalitativt och kvantitativt specifika, tumörassocierade antigener. Många av dessa är onkofetala antigener, som framförallt kan få betydelse för tumördiagnostik framöver. Mer eller mindre tumörspecifika antigener har nyligen beskrivits från vissa tumörer som muterade onkoproteiner (ras m.fl.) och ett ytantigen för malignt mela­ nom (MAGE; förekommer hos 30–50 % av alla melanom). Den kliniska betydelsen av de sista upptäckterna är oklar, men skulle kunna öppna möj­ ligheter för tumörvacciner. Forskningen om tumörvacciner följer olika vägar såsom att använda hela celler som vaccin, mikrob- eller virusvektor­ bundna vacciner, protein/peptidvacciner, kolhydratvacciner, heat-shock proteinvacciner, anti-idiotypiska vacciner och DNA/RNA-vacciner. Den sistnämnda metoden innebär att några celler, vid injektion av naket gene­ tiskt material direkt i hud eller muskel, tar upp DNA/RNA och inkorporerar detta genom att uttrycka genprodukter som t.ex. tumörantigen. Cellens övervakningssystem kan bryta ned delar av dessa protein till peptidfrag­ ment som uttrycks på cellytan så att immunförsvaret kan upptäcka dem. Forskning kring superantigen (potenta mitogen som stimulerar hela Tcells subpopulationer och som delar samma T-cellsreceptor Vß familj obe­ roende av antigenspecificitet) pågår för att utnyttja denna mekanism vid immunterapi mot humana tumörer. Staphylococcus aureus-enterotoxin är ett exempel på ett potent superantigen. Bispecifika antikroppar kan också komma att bli viktiga komplement till tumörbehandlingen. Så kan t.ex. en del av antikroppen binda sig till en cytotoxisk T-cell och en annan del till tumörcellen varvid T-cellen fram­ kallar cytolys av tumörcellen. © Studentlitteratur 159 Kapitel 14 Immunologiska behandlingsmetoder vid maligna tumörsjukdomar Aktiv immunterapi Specifik Inaktiverade tumörvaccin (autologa, allogena) Humana tumörhybrider Monoklonala tumör anti-idiotypiska antikroppar Icke-specifik Kemiska immunstimulerare (t.ex. levamisol, cimetidin) Biologiska immunstimulerare (t.ex. BCG, C.Parvum, cyklofosfamid) Cytokiner (interferon, IL-2, TNF) Kemoterapi (cyklofosfamid, melfalan, cisplatin, doxorubicin, vinca alka­ loider) Passiv immunterapi Specifik Heterologa antisera – från immuniserad människa Monoklonala antikroppar – djur, människa, chimärer Biologiska (via opsonisering, komplement fixation eller antikropps­ beroende cellulär cytotoxisk reaktion) Radioterapeutiska (alfa- eller gammastrålning) Kemoterapeutiska (adriamycin, metotrexat, difteri elller ricinkonju­ gat) T-lymfocyter – autologa, allogena, xenogena Från in vitro sensitisering Från tumördränerande lymfkörtlar Från tumörinfiltrerande lymfocyter (TIL-lymfocyter) Monoklonala lymfocyter – från någon av ovan nämnda källor av T-lym­ focyter Allogen benmärgstransplantation med ablativ kemoterapi eller strålterapi (graft versus tumor) Icke-specifik Lymfocytaktiverade celler (LAK-celler) – skapade med IL-2, IL-4. Aktiverade makrofager – interferon, forbolestrar Cytostatiska eller cytotoxiska cytokiner – alfa-, beta- och gammainter­ feron, TNF (Efter Lotze och Rosenberg.) 160 © Studentlitteratur Immunologisk behandling Möjliga källor till vaccin vid tumörsjukdom Vaccin Exempel Fördel Hel tumörcell Fysiskt förändrad Expression av flera antigen (strålning, virus oncolys) Genetiskt förändrad Uttryck av multipla antigen (Il-2, TNF-a, IFN, Gm-CSF, B1) (immunmodulerande molekyler) Peptid/protein Peptid i inkomplett Freunds adjuvans Ren, enkel epitop Plasmid DNA Intramuskulär inj Genkanon inj Lätt renad Inga visade reaktioner mot vektor Rekombinanta BCG organismer Listeria Producerar höga nivåer av heterologa proteiner Unika biologiska egenskaper Stark adjuvant aktivitet Rekombinanta Vaccinia, adenovirus, virus retrovirus Producerar höga nivåer av heterologa proteiner Exploaterar intracellulära signalvägar Direkt syntes av membran glykoprotein (även costimule­ rande molekyler) Stark adjuvant aktivitet Exempel på antigen på tumörceller igenkännbara av autologa cyto­ toxiska T-celler Antigen gen Tumörcell HLA-presentation Mage 1,3 Tyrosinas gp75 Melan-A/MART-1 gp100 mutant CDK4 MUC-1 ras p12 melanom, lunga melanom melanom melanom melanom melanom pankreas, bröst pankreas A1, -A2, -CW16 A2, -A24, -BW44 A31 A2 A2 A2 © Studentlitteratur 161 Kapitel 14 Exempel på antigen på tumörceller som kan spåras med antikroppar i sera från tumörpatienter Klass Glykolipider Blodgrupper Gangliosider Glykoprotein Antigen Tumörtyp T, Tn, Sialosyl-Tn GM2, GD2 9-0-Ac GD3 Karcinom Melanom, sarkom Glioblastom M-TAA U-TA gp75 MUC 1 Melanom Melanom Melanom Bröst Cellcykel/signal­ Her2/neu transduktionsprotein p53 (icke muterat) Bröst Bröst Kolhydratantigen Kolhydratantigen är mycket vanligare förekommande på cellyta än proteinantigen. Kolhydratantigen är unika effektiva mål för antikroppsmedierad cancerimmunterapi. Antikroppar är den primära mekanismen för att elimi­ nera en cirkulerande patogen, ett paradigm som är väl anpassat till en behandling av cancer adjuvant. Kombination med ett adjuvans inducerar de högsta IgM- och IgG-nivåerna. Anti-idiotypiskt monoklonalt antikroppsvaccin Fördelar framför allt 1. När antigen förekommer i små mängder eller är orent 2. När antigen inte är ett protein och bara svagt immunogent 162 © Studentlitteratur 15 Benmärgstransplantation/ Stamcellsstöd Benmärgstransplantation sker i princip på två sätt: allogen transplantation varvid benmärg ges från annan person vanligen ett syskon och autolog transplantation då patienten är sin egen donator. I faktarutor har indikatio­ nerna för allogen och autolog benmärgstransplantation sammanfattats. Övre åldersgränsen för allogen transplantation är 50–60 år och för autolog ligger gränsen på 60 år. Stamcellsskörd sker hos vuxna med akut myeloisk och akut lymfatisk leukemi – ”standardrisk” helst i första remission även om transplantation sker senare. Hos barn med akut lymfatisk leukemi sker ben­ märgsskörd i första remission endast då indikation för autolog transplanta­ tion föreligger. Perifera stamceller utgör ibland ett alternativ och adjuvans till benmärg. Vissa kontraindikationer till transplantationer finns. Bland dessa märks annan svår organsjukdom som kan leda till risk för transplanta­ tionsrelaterade komplikationer, psykisk instabilitet/sjukdom, pågående all­ varlig infektion samt tidigare maximal strålbehandling mot vitala organ. Vid allogen benmärgstransplantation eftersträvas helst HLA-kompatibili­ tet hos donerande syskon. Även helsyskon med 1-antigens ”mismatch” på HLA A, B, C, och DR-locus kan övervägas vid gynnsam ”mixed lymfocyte culture”. Den initiala utredningen vid allogen benmärgstransplantation inkluderar HLA-typning, blodgruppering med utvidgad fenotypning och virusserologi. I den förberedande utredningen av patient inför benmärgs­ transplantationen ingår kompletterande kompatibilitetsutredning, tandun­ dersökning, lungfunktionsundersökning, njurfunktionsutredning, ögonun­ dersökning, gynekologisk undersökning, spermabankning, kuratorskontakt, frisör (perukutprovning), röntgenundersökning av lungor, lumbalpunktion, benmärgstransplantation, molekylärgenetisk undersökning, samt diverse laboratorieundersökningar (odling svalg, nasofarynx, feces, serologi, toxo­ plasma, legionella, pneumocystis carinii, candida, Aspergillus, CMV, Her­ pes Zooster/varicella, EBV IgG, HBSag, och HIV). Konditioneringen sker antingen med högdoscytostatika eller med cyto­ statika och helkroppsstrålbehandling. Cyklofosfamid, Busulfan, Cytosina­ rabinosid och BCNU har varit de mest använda cytostatika vid konditione­ © Studentlitteratur 163 Kapitel 15 ringen. Helkroppsbestrålningen ges dagen innan eller de fyra sista dagarna före transplantationen (antingen som 2 Gy , 2 Gy × 2 eller 3 Gy:s fraktio­ ner). Vuxna med akut lymfatisk leukemi och akut myeloisk leukemi FAB M4 och M5 erhåller metotrexat intratekalt dag nio och två före transplanta­ tionen. Övriga akuta eller kroniska leukemier och non-Hodgkinlymfom erhåller intratekal terapi dag nio. Benmärgen tas från spina iliaca och vid autolog transplantation skördas 15–20 ml/kg kroppsvikt. Till komplikationer räknas akut graft versus host disease (aGvHD). De organ som oftast är engagerade vid aGvHD är hud, lever och tarm. Genom att tillföra Cyklosporin ensamt vid milda reaktioner och tillsammans med cortison vid svåra reaktioner söker man minska incidensen av denna kom­ plikation. Det finns även en kronisk graft versus host reaktion som enga­ gerar hud, munhåla, ögon, lever och esofagus. Andra komplikationer inklu­ derar hemorragisk cystit (cyklofosfamidorsakad) och veno-ocklusiv sjukdom (relaterat till konditionering men mekanism okänd). Indikationer för autolog benmärgstransplantation Akut myeloisk leukemi i första (eventuellt senare) remission Akut lymfatisk leukemi ”standardrisk” i andra (eventuellt senare) remission Akut lymfatisk leukemi ”högrisk” i första (eventuellt senare) remission Högmalignt non-Hodgkin lymfom i remission eller ”sensitive relapse”. I selekterade fall kan autolog benmärgstransplantation även övervägas vid: Solida tumörsjukdomar där sedvanlig cytostatikabehandling ej varit framgångsrisk Myelom Hodgkins sjukdom Bröstcancer Neuroblastom hos barn Indikationer för allogen benmärgstransplantation Akut myeloisk leukemi i första (eventuellt senare) remission Akut lymfatisk leukemi – ”standardrisk” i andra (eventuellt senare) remission Akut lymfatisk leukemi – ”högrisk” i första (eventuellt senare) remission Svår aplastisk anemi (konstitutionell eller förvärvad) särskilt hos individer under 30 år Kronisk myeloisk leukemi i första kroniska (eventuellt senare) fas Högmalignt non-Hodgkin lymfom i remission eller ”sensitive relapse” 164 © Studentlitteratur 16 Akut onkologi Exempel på akuta behandlingssituationer hos tumörpatienter Snabbt växande tumör Obstruktion av vitalt organ trakea/bronk vena cava superior syndrom magtarmkanal gallvägar/lever urinvägar ryggmärg/hjärnödem blodkärl trombos/emboli Infiltration av vitala organ ryggmärg hjärna ögon skelett hotande fraktur etablerad fraktur lever hjärta tarmvägg Pleura exudat Ascites Blödning Smärta Infektion lokalt sepsis Metabola/paraneoplastiska symtom kakexi hyperurikemi hyperkalcemi depressioner hyperviskositet ektopisk hormonproduktion ACTH, insulin, karcinoider, glukagon polyneuropatier central demyelinisering © Studentlitteratur 165 Kapitel 16 Kliniska överväganden vid värdering av en onkologisk akutsituation (Efter Glover and Glick 1991.) Är de kliniska tecknen och symtomen orsakade av behandlingen, tumör­ sjukdomen eller annan parallell sjuklighet? Hur snabbt progredierar den akuta situationen? Finns det redan innan en malignitetsdiagnos? Hur långt är det recidivfria intervallet mellan primärdiagnos och akut­ situation? Är patienten terminalt sjuk? Har tidigare terapi varit effektiv? Bör behandlingen inriktas på tumörsjukdomen eller på akutsituationen? Hur är patientens allmäntillstånd? Klarar patienten av extensiv effektiv behandling? Finns chans till kuration? Vilka är de palliativa vinsterna? Riskerna? Trakea- eller bronkobstruktion/kompression De vanligaste tumörerna som orsakar kompression av trakea eller bronker är lungcancer, lymfom eller storcellig tyreoideacancer. Primär trakeacancer är en sällsynt orsak. Behandlingen består av högdos steroider, högläge (patient om möjligt sittande), om diagnos ej känd försök till cytologisk eller histopatologisk konfirmation av tumör/tumörtyp, inläggning av stent i tra­ kea/bronker, laserbehandling av tumörer som växer intraluminalt, strålbe­ handling och/eller cytostatikabehandling akut. Cytostatikabehandling kan speciellt övervägas vid lymfom och småcellig bronkialcancer. Vena cava superior syndrom Tumörväxt i mediastinum som påverkar det venösa avflödet från huvud och hals kan ge upphov till Stoke’s krage eller vena cava superior syndrom. Van166 © Studentlitteratur Akut onkologi ligaste orsaker är lungcancer (75 %) och lymfom (10–15 %). Den vanligaste icke-tumörorsaken till syndromet är trombbildning kring en central ven­ kateter. Symtomen beror framförallt på svullnaden och syrebrist. Det vanli­ gaste kliniska tecknet är att vener upptill på bröstkorgen distenderas. Patien­ ten får också ansikts- och halsvullnad, andfåddhet och hosta. Ödem av övre extremiteter och bål kan inträffa. Patienten kan bli agiterad, ångestfylld, oro­ lig, få kvävningskänslor, huvudvärk, svårt att svälja, ökat tåravflöde, heshet (stämbandspåverkan) och även Horners syndrom. Behandlingen består av högläge, steroider i högdos, syrgas, eventullt cytostatikabehandling, inlägg­ ning av stent, strålbehandling akut och antikoagulantia. Strålbehandlingen initieras akut med höga dagliga fraktioner (3–4 Gy/dag). Avflödeshinder i urinvägar Tumörer intraabdominellt, retroperitonealt och i lilla bäckenet kan ganska ofta ge upphov till postrenala avflödeshinder. Om hindret är högt (uretär) är orsaken oftare lymfom, sarkom eller lymfkörtelmetastaser från cervixcancer, blåscancer, prostatacancer, ovarialcancer eller rektalcancer. Hinder i blåsnivå är ofta sekundärt till växt av prostatacancer, cervixcancer eller blåscancer eller beroende av benign prostatahypertrofi. Symtomen kan vara urinstämma, flanksmärta, hematuri eller recidive­ rande urinvägsinfektioner. Låga hinder kan ge svag stråle/liten urinmängd, efterdropp, trängningar och nattlig behov av att urinera. Om hindret kom­ mer långsamt kan polyuri övergå i oliguri. Dilaterade urinvägar kan visas med ultraljud, urografi. En nedsatt funk­ tion av njurar kan studeras med isotopundersökning. Ibland ger CT-under­ sökning tilläggsinformation. Njurfunktion studeras med kreatinin, kreatinin clearance, elektrolyter. Pyuri och bakteriuri undersöks. Med urografi kan man i 80 % av fallen avgöra var obstruktionen finns. Perkutan antegrad pye­ lografi kan användas både för diagnos och terapi genom att man kan för­ söka få kateter förbi hinder. Om hindret kvarstår kan man med pyelostomi avlasta njure i väntan på att effektiv terapi får tumör att gå tillbaka. Stents kan placeras vid obstruktion via cystoskopi och retrograd pyelografi. Om inte hinder avhjälps leder bilateral obstruktion till anuri, hyperkalemi och död. Viktigt att tänka på under behandlingen är att vissa cytostatika för opti­ mal användning kräver öppna urinvägar och/eller normal njurfunktion (t.ex. cisplatin, metotrexat, cyklofosfamid och ifosfamid). © Studentlitteratur 167 Kapitel 16 Tumör som orsakar avflödeshinder kan behandlas med strålterapi och kemoterapi. Lymfom är särskilt tacksamma att behandla och mycket tidigt kan urinflöde återkomma efter det att effektiv terapi insatts. Hinder i mag-tarmkanal – perforation Obstruktion av esofagus, ventrikel, tolvfingertarm-tunntarm, tjocktarm kan uppstå under en tumörsjukdoms förlopp. Diagnosen kan ställas via endo­ skopi eller röntgenundersökningar. Vid proximala stenoser (t.ex. i esofagus) har i allt högre grad stentar framgångrikt används som palliation. Vid ileus­ situationer avlägsnas hinder ofta operativt och avlastning sker med stomier. Vid en efterföljande operation i lugnt skede stängs stomi och tarm läggs sedan ned. Strålkänsliga tumörer kan bli föremål för postoperativ behand­ ling. Även kemoterapi kan vara aktuell vid lymfom och germinalcellstumö­ rer. Perforation av tarmar kan uppkomma. Predisponerande faktorer är bruk av steroider, stressfyllda situationer och tumör som med sin växt involverar tarmvägg. Kemoterapi kan leda till att tumör går i nekros med efterföljande perforation. Därför är indikationen stor för tarmresektion vid lymfom som involverar tarmväggar innan start av kemoterapi. Vid perforation är dödligheten hög. Hyperkalcemi Ofta uppstår hyperkalcemin i samband med extensiv skelettmetastasering (se detta avsnitt). De tumörtyper som oftast är associerade med hyperkalcemi är lungcancer, bröstcancer och njurcancer. Vid initiering av hormonbehandling vid bröstcancer kan initialt (de första veckorna) hyperkalcemi uppstå. Mekanismerna kan vara två. Dels kan tumören producera en parat­ hormonliknande peptid, dels kan det ske en produktion av en osteoklast­ aktiverande faktor. Symtomen är illamående, trötthet, kräkningar, matleda, abdominella smärtor, polyuri och törst. Vid gravare hyperkalcemi blir individen apatisk­ komatös, utvecklar anuri, arrytmier etc. Behandlingen inriktar sig på att häva dehydrering, minska kalciumfri­ görelsen från skelettet och framgångsrikt behandla tumörsjukdomen. Vik168 © Studentlitteratur Akut onkologi tigt är att man noga har klart för sig om patienten befinner sig i terminalfas av sjukdomen. Att dö i koma av hyperkalcemi kan vara bättre än att sluta sina dagar i kvävning från bronkobstruktion. Förutom kausal terapi av tumörsjukdomen inkluderar behandlingen hydrering med forcerad diures, diuretika, steroider, bifosfonater och even­ tuellt kalcitonin. Hyperurikemi Hyperurikemi uppträder vid tumörsjukdomar där stor cellomsättning sker, dvs. vid stora tumörer som behandlas framgångsrikt eller vid tumörer som har en stor andel celler som dör spontant. Lymfohematopoetiska tumörsjuk­ domar uppvisar oftare än andra tumörsjukdomar hyperurekemi. Diagnostik sker genom s-urat. Ibland symtom på gikt eller njursten. För att undvika att urinsyra/urater skadar urinvägar bör patienten under speciellt första delen av terapin hålla en hög diures med alkalisering av urin. Allopurinol (Zyloric) insättes före behandling med kemoterapi eller radioterapi av stora tumörer. Om skada redan skett avbrytes cytostatikabe­ handling temporärt och vid njurinsufficiens kan det vara aktuellt med tem­ porär dialys. Blodförgiftning Infektioner uppstår lätt hos patienter med tumörsjukdomar. Dels kan nor­ mala barriärer vara brutna, dels kan sjukdomen i sig bära en immundefekt och ökad infektionsbenägenhet (t.ex. lymfom) och dels kan behandlingen trycka ned de vita blodkropparna med ökad infektionsbenägenhet som resultat. Nadir i blodvärden vid cytostatikabehandling inträffar ofta 7–14 dagar efter behandlingen. Individer som genom behandling får sitt immun­ och infektionsförsvar nedtryckt kan uppvisa vaga eller atypiska symtom på infektioner. Kroppsöppningar, kateteringångar eller sår är ofta infektions­ portar. Odlingar inkl. blododlingar kan vara av stor vikt för att isolera agens vid feber och neutropeni. Vid låga granulocytvärden och misstanke på sep­ sis kan det vara indikation för utredning och behandling på infektionsklinik. Valet av terapi styrs ofta av patienttyp och klinisk misstanke på infek­ tionsport. Terapi anpassas senare till odlingssvar (resistensmönster). Vissa patientgrupper kan ha opportunistiska infektioner exempelvis med pneumo­ cystis carinii och toxoplasmos. Om terapisvar ej erhållits inom 4-6 dagar © Studentlitteratur 169 Kapitel 16 bör byte ske till annan kombination. Vanliga antibiotika som används inkluderar penicilliner (t.ex. piperacillin, pivmecillinam, bensylpenicillin, fenoximetylpenicillin), cefalosporiner (t.ex. ceftazidim, cefuroxim), amino­ glykosider (t.ex. netilmicin), klindamycin, erytromycin och sulfametoxa­ zol-trimetoprim. Intrakraniell tryckstegring Symtom på ökad intrakraniell tryckstegring utgör illamående, kräkningar (speciellt projektillika på morgonen), huvudvärk, dimsyn, högt blodtryck och låg puls. Ibland förekommer epileptiska anfall och mentala föränd­ ringar. Detta kan uppstå med eller utan fokala symtom på hjärntumör/hjärn­ metastaser. Lungcancer är orsaken i ungefär 25–35 % av fallen med hjärn­ metastaser, bröstcancer i 20 %, melanom i 10 %, njurcancer i 5–10 % och tumörer i mag-tarmkanal i 5 %. En etiologisk orsak till den intrakraniella tryckstegringen är viktig att fastställa. Symtom på hjärnödem och menin­ geala retningar kan ju förekomma vid infektioner och andra terapikompli­ kationer. CT och MR kan i de flesta fall ge diagnos. Om en tumörsjukdom är orsaken till tryckstegringen ges steroider i hög dos i avsvällande syfte, antiepileptika och strålbehandling 3Gy × 10. Vid solitära metastaser (t.ex. av melanom) och vid primärtumörer i hjärnan kan neurokirurgi vara aktuell. Skelettmetastaser – patologiska frakturer Strålbehandling har en given roll vid smärta från skelettmetastaser. Ett van­ ligt behandlingschema består av att ge 10 st 3 Gy:s fraktioner under två veckors tid. Ett alternativ kan vara att ge en 8 Gy:s fraktion. Strålbehand­ lingens roll är framförallt att åstadkomma smärtlindring och denna effekt kan lika gärna åstadkommas genom att inflammatoriska celler runt tumören påverkas som genom en direkt tumöreffekt. Av erfarenhet vet man att 70 % uppnår smärtlindring som står sig minst 6 månader. Strålbehandlingen av skelettmetastaser har liten påverkan på totaldödligheten i patientgruppen. Strålbehandlingen har ibland andra mål som t.ex. att åstadkomma fraktur­ profylax eller tumörreduktion för att tumör hotar andning, neurologfunk­ tion eller annat vitalt organs funktion. 170 © Studentlitteratur Akut onkologi Modern handläggning av skelettmetastaser är numera ofta ett samarbete mellan ortoped, neurokirurg, anestesiolog, röntgenolog och onkolog. Ortopeder och neurokirurger har de senaste åren fått en mer aktiv inställ­ ning till att behandla skelettmetastaser. Åtgärder inkluderar bl.a. stabilise­ rande operationer, cementering, fixation av patologiska frakturer, profylak­ tiska fixationer, totalhöfter och dekompressiva laminektomier. Vid patologiska frakturer i ryggrad ges palliativ strålbehandling och senare görs eventuellt en stabiliserande operation. Vid patologisk fraktur av långa rör­ ben görs ortopedisk osteosyntes åtföljd av radioterapi. Skelettmetastaser kan nu framgångrikt pallieras med strontiumbehand­ ling. Lämpliga kandidater för denna typ av behandling är framförallt patienter med multipla symtomgivande metastaser utan frakturer. Bifosfonater reducerar snabbt och effektivt hyperkalcemi. Genom att inhibera osteoklastfunktionen hoppas man dessutom åstadkomma metas­ tasprofylax och frakturprofylax. Randomiserade studier pågår för att utröna dessa möjligheter. Medullakompression Ungefär 1/3 av alla tumörpatienter med generaliserad sjukdom har metasta­ ser i kotpelaren. Frekvensen av patienter med kompression av medulla eller cauda equina är svårare att skatta, men i ett obduktionsmaterial av generali­ serad cancer har det angivits i frekvensen 1/20 och, som diagnostiserats innan döden, hos ungefär 1/100 med generaliserad cancer. Hos 10 % av patienterna utgör den epidurala metastasen den första manifestationen av tumörsjukdomen. Årligen drabbas i Sverige omkring 1 000 patienter av symtom av medullakompression. De vanligaste tumörsjukdomarna som orsakar ryggmärgspåverkan är bröstcancer, prostatacancer och lungcancer. Mindre vanligt är tumörer från njure, tyreoideacancer och myelom. Hos barn är Ewing sarkom, neuroblastom och olika germinalcellstumörer vanli­ gaste orsaken. Det initiala symtomet på medullakompression vid en tumörsjukdom kan variera men följande sekvens är vanlig. Lokal smärta brukar vara det första symtomet övergående i en neuralgisk rotsmärta som accentueras vid hosta, nysning och krystning. Därefter brukar bortfallsymtom av sensorisk eller motorisk art visa sig för att slutligen övergå i pareser/plegier med störningar av sfinkterfunktion. Vid diagnos av medullakompressionen brukar frekven­ sen av betydande neurologiska bortfallsymtom vara högt. © Studentlitteratur 171 Kapitel 16 Procenten uppegående patienter varierar i olika material från 11–75 % beroende på indikationerna för utredning av medullakompression. Lokalisationen för medullkompressionen är till 60–70 % i thorakalrygg, till 25 % i lumbosakralrygg och till 10 % i cervikalryggen. Utbredningen av metastaser är i 50 % en kota, i 25 % två kotor och i 25 % tre eller fler kotor. Patient med ryggmärgspåverkan bör omedelbart ha steroider i hjärn­ ödemdos insatt som avsvällande terapi. Handläggningen av patienten bör ske skyndsamt. Möjligheterna att restituera bortfallssymtom är avhängiga av tiden som har förflutit. Momentant insättande pares som stått komplett i 8–12 timmar kan ej restitueras, vid en mer långsamt inträdande pares kan en restitution uppnås upp till flera dygn. Anamnes är viktig för bedömning av prognos och nivå. Diagnostiken inkluderar neurologstatus (nivådiagnostik, sfinkterutredning, residualurin vid blåspares), konventionell röntgen av columna och MR samt, vid behov, CT som komplement. Om primärtumör är okänd bör också ansträngningar göras för att erhålla en diagnos. De operativa teknikerna har utvecklats under senare år och operationer som syftar till dekompression av medulla och stabilisering av kotpelare kan troligen ge bättre resultat än enbart laminektomier. Behandlingen kan antingen vara operation, strålterapi och /eller kemo­ terapi (framförallt vid behandling av barntumörer). Vid valet av terapi skall man beakta vissa saker. Är tumören strålkänslig? Föreligger kotinstabilitet? Finns lesioner på multipla nivåer? Har symtomen kommit långsamt? Är patienten redan tidigare opererad? Är patienten redan tidigare strål­ behandlad? Bedömning av lämplig terapi i det enskilda fallet bör ske i samråd mellan onkolog, ortoped och neurokirurg. Vid tumörer med låg strålkänslighet är operation förstahandsalternativ. Hos patienter med tumörer med intermediär strålkänslighet kombineras ofta operation och strålbehandling. Patienter med tumör på flera nivåer och med långsam symtomutveckling och där stabilisering ej är möjlig ges strål­ terapi primärt. Efter operation bör alla patienter erhålla postoperativ strålbehandling om de ej tidigare är strålbehandlade mot samma region. Strålbehandlingen ges med högenergetisk fotonstrålning (kobolt eller linj. accelerator). Vanligen behandlas med två kotors marginal till en total­ dos av 30–48 Gy under 2–5 veckors tid. Vid progress under strålbehand­ lingen tar man ställning till operation. 172 © Studentlitteratur Akut onkologi Till strålkänsliga tumörer räknas: lymfom, myelom/plasmocytom, leu­ kemi, småcellig bronkialcancer och seminom. Till intermediärt strålkäns­ liga räknas; bröstcancer, prostatacancer, skivepitelcancer, gastrointestinal cancer, germinalcellstumörer, Ewings sarkom, neuroblastom, gynekolo­ giska tumörer och tyreoideacancer. Njurcancer, melanom, osteosarkom och kondrosarkom uppvisar låg strålkänslighet. Fysioterapi både på regionklinik och hemortsklinik är av stor vikt i reha­ biliteringen av patienten. För hela sjukdomsgruppen är totalöverlevnaden dålig. Endast 16–20 % lever efter ett år. Ascites I flera studier av tumörpatienter som utvecklat ascites är medianöverlevna­ den ungefär 2 månader. Detta indikerar att ascitesutvecklingen symbolise­ rar ett slutstadium av patientens sjukdom. Ascites vid tumörsjukdomar är ofta blodigt eller blodtillblandat. Särskilt tumörer från äggstockar, tjock­ tarm, magsäck och livmoder är benägna att under sina förlopp bilda ascites. Symtomen på ascites är framför allt ett ökat bukomfång. Kliniska tecken inkluderar utflytande buk med flankdämpning och vågslag. Ascites kan misstänkas på buköversikt och kan ses på CT-undersökning av buk och med ultraljud. Abdominell paracentes bör göras för diagnos och för att utesluta benigna orsaker till vätska i buken. Behandling kan försökas med diuretika (t.ex. spironolakton) men ofta är detta otillräckligt och behöver kompletteras med upprepade paracenteser eller dränage. Intrakavitär installationsbehandling med cytostatika kan användas och har också angetts ha en fördelaktig farmakokinetisk bild jäm­ fört med intravenös terapi (t.ex. genom Port-A-Cath administrerad cispla­ tin). Kirurgi för att ta bort tumörmassor tillsammans med intraperitoneal kemoterapi har i enstaka studier visat lovande resultat. Peritoneovenösa shuntar mellan bukhåla och centrala vener har också använts. Perikardvätska I ett obduktionsmaterial på 3 300 patienter fanns metastaser i perikard och hjärta i 5 % av fallen. De vanligaste maligna sjukdomarna som orsakar © Studentlitteratur 173 Kapitel 16 perikardvätska är lungcancer, bröstcancer, leukemi, lymfom, melanom, tumör från mag–tarmkanal och sarkom. Symtom inkluderar andfåddhet, bröstsmärta, ortopné, palpitationer, svaghet, trötthet och yrsel. Hjärttamponad ger symtom av oro, bröstsmärta och dyspné och patienten får symtomlindring av att sitta framåtlutat. Kli­ niska tecken på perikardvätska inkluderar utfyllda halsvener, hjärtför­ storing, svaga avlägsna hjärtljud, perikardiellt gnidningsljud och arrytmier. Hjärtsvikt i form av ascites och leverförstoring förekommer. Kliniska tecken på tamponad är pulsus paradoxus, lågt blodtryck, samt takykardi med svaga hjärttoner. Hjärt–lungröntgen, CT och ekokardiografi kan ge diagnos. EKG kan visa små QRS-komplex och ospecifika ST-segment och T-vågsför­ ändringar. Percutan perikardiocentes med tvådimensionell ekokardiografi har få komplikationer och ger en hög diagnostisk säkerhet samtidigt som ingrep­ pet snabbt häver symtom. Om perikardvätska är hemorragisk finns oftast maligna celler i prov trots att andelen falskt negativa prov är hög. Perikarddränage kan användas med eller utan installation av cytostatika (t.ex. cisplatin, bleomycin, vinblastin, novantrone). Strålterapi mot hjärta/ hjärtsäck kan användas (t.ex. 3 Gy × 10 eller 2 Gy × 15) och är särskilt lämpligt vid lymfom. Hos patienter som krävt upprepade perikardiocenteser eller som inte sva­ rar på installation av cytostatika eller strålterapi, är operation indicerat. På senare år har subxifoiddränage rekommenderats som bästa operations­ metod. Överlevnaden är dock mera beroende av tumörtyp än av operations­ typ. Recidivbenägenheten är dock större ju mer perikard som lämnas kvar efter operationen och därför bör man sträva efter att resecera så mycket perikard som möjligt. Det bör också påpekas att perikardexsudat och pleuraexsudat kan vara terapiorsakat och inte alltid behöver vara recidivtecken. Aktiva diagnostiska åtgärder är indicerade eftersom en strålningsorsakad konstriktiv perikardit är behandlingsbar. Pleuravätska Ökad mängd pleuravätska uppstår om det sker en ökning av den kapillära permeabiliteten genom inflammation eller skada på det kapillära endotelet eller genom en störning av det lymfatiska dränaget. Mer sällan ligger ett transudat som vid hypoalbuminemi, hjärtsvikt eller leversvikt bakom 174 © Studentlitteratur Akut onkologi pleuravätskan. Vanligare är ett proteinrikt exudat. Vid direkt tumörengage­ mang av pleura blir exudatet hemorragiskt och organiseras med förtjockad lungsäck. Ett blodigt exudat är ett mycket starkt tecken på malignitet. Andfåddhet, torrhosta och smärta är de vanliga presentationssymtomen. Trötthet är tämligen vanligt. Kliniskt uppvisar patienten takypné och arbet­ sam andning med nedsatta bröstkorgsrörelser. Dämpning och minskat fre­ mitus är andra kliniska tecken. Mängden vätska är ofta mer än 500 ml. Diagnos sättes på kliniskt fynd, röntgen av lungor med bilder i sidoläge, CT och/eller ultraljud. Thorakocentes görs. Pleuravätska analyseras cytolo­ giskt. LD, glukos, specifik gravitet och cellantal mäts. I vissa fall kan pleu­ rabiopsi, thorakoskopi och thorakotomi vara aktuellt. Prognosen beror på underliggande typ av tumörsjukdom. Om alla patien­ ter med pleuravätska slås ihop är prognosen dålig, 80 % är döda inom 6 månader. Vissa grupper av bröstcancerpatienter har bättre överlevnad medan ovarial och lungcancerpatienter har dålig prognos. Behandlingen består av diuretika och/eller skleroterapi. I fall av lymfom kan strålbehandling och eller kemoterapi vara framgångsrik terapi och i vissa material försvinner uppemot 90 % av lymfomexudaten på strålterapi mediastinum och hemithorax. Pleuroperitoneala shuntar har i enstaka situa­ tioner också försökts. Blödningar I varje organ som är involverat av tumör kan i princip också blödning upp­ stå. På vissa ställen kan konsekvenserna av en sådan blödning bli mer eller mindre dramatiska. Erosion av större blodkärl av tumör (t.ex. skivepitel­ cancer på hals som eroderar a.carotis) kan inom minuter leda till förblöd­ ning. Magsäcksblödning sekundärt till tumörväxt, eller terapi med steroi­ der/antiflogistika kan vara liten till stor och, beroende på debuthastighet, leda till olika symtom alltifrån mer akuta till mer vaga. Patienter med kom­ prometterad leverfunktion (låga koagulationsfaktorer) eller blodbildning (låga trombocyter) är speciellt känsliga för blödningskomplikationer. Mer ovanliga blödningssituationer, såsom trombotisk trombocytopen purpura och olika disseminerade intravasala koagulationsbilder, kan uppstå associe­ rat med trombosbildning. Stora ytliga tumörer som blöder kan ofta effektivt koaguleras med dia­ termi, röntgenbestrålning eller laserbehandling. © Studentlitteratur 175 17 Cancerkakexi Många cancerpatienter lider, under senare delen av sin sjukdom, av trötthet, viktnedgång (framförallt förlust av fettvävnad och muskulatur), ovilja att äta mat och blodbrist. Det har uppskattats att omkring 2/3 av alla cancerpatienter som avlider är kakektiska vid tidpunkten för sin död. Incidensen varierar starkt mellan olika tumörformer. Sjukdomar som ofta redan vid diagnosen är associerade med kakexi är magsäckscancer, pankreascancer, lungcancer och prostata­ cancer. Orsakerna till kakexin är troligen multifaktoriell. Trots ett minskat matin­ tag fortsätter energikonsumtionen att vara hög (speciellt arbetar levermeta­ bolismen på hög nivå). En rad metabola abnormiteter såsom t.ex. hypoalbuminemi, försämrad glukostolerans med förhöjd glukoneogenes, förändrat spektrum av lever­ enzymer, hyperkalcemi, hyperlipedemi, abnorma hormonsekretionsmönster och lactacidemi kan uppmätas hos patienterna. I kliniken framträder ske­ lettmuskelatrofi, atrofi av inre organ, immunologisk anergi, anorexi, asteni, trötthet och symtom på anemi, neuropati och matleda. Ibland kan bilden vara förvillande lik en obehandlad överfunktion av sköldkörteln eller B12-brist. Tumour necrosis factor och gamma interferon är faktorer som diskuterats som möjliga mediatorer av kakexin. Försök till att öka matintag brukar ej vara framgångsrika. Progesterontill­ försel har med viss framgång använts i terapi. Ibland kan rubbningar i kalciumnivåer, lever- och njurfunktion påverka matintag. Viktigt att tänka på är att viktnedgång, förutom att vara betingad av tumörmetaboliska skäl, bl.a. också kan bero på matleda (tumörbehandlings­ orsakad, psykologiska faktorer, slemhinneskador, infektioner) samt organ­ obstruktioner. Den kan också vara associerad med annan sjukdom (t.ex. tyreotoxikos), diarrétillstånd och annan medicinering. 176 © Studentlitteratur 18 Understödjande terapi Den understödjande terapin vid behandling av tumörsjukdom inkluderar bl.a. följande moment: Blodtransfusioner Vita blodkroppar Trombocyter Gammaglobulin Tillväxtfaktorer Antibiotika Antitumorlysmedel Antidoter Medel mot illamående Hudmedel Peruk Proteser Lymfödemterapi Analgetika Matintag Tandvårdsmedel Tillväxtfaktorer som understödjande terapi/profylax inom onkologin Ett problem vid intensiv cytostatikabehandling är att benmärgen inte alltid regenerar blodkomponenterna som förväntat. I uppemot 20 % av fallen uppträder perioder av febrila neutropenier vid konventionell cytostatikabe­ handling. En del av dessa episoder kan var livshotande. Vidare kan dessa febrila neutropenier medföra långa sjukhusvistelser med dyr antibiotika­ behandling och andra dyra intensivvårdsåtgärder. Episoderna kan också leda till att lägre cytostatikadoser ges (ev. suboptimala) eller att behand­ lingsintervallet förlängs. Vid flera tumörformer finns ett intresse att intensifiera cytostatikabehand­ lingen för grupper med dålig prognos och att ge högdosterapi, ibland åtföljd av autologa benmärgstransplantationer. Tidigare har benmärgsregeneratio­ nen varit en begränsande faktor. Pluripotenta stamceller (PPSC) utgör en mindre andel (1–3 %) av ben­ märgens mononukleära celler. Stamcellen är inte morfologiskt mer karakte­ riserad utan utgör ett funktionellt begrepp innefattande en cellpopulation som har förmåga till självförnyelse, förmåga att differentiera till olika cell­ linjer och som under lång tid ger en repopulation av hematopoetiska celler. Bäst definieras hematopoetiska stamceller genom sin CD34-positivitet. © Studentlitteratur 177 Kapitel 18 Trots detta är CD34-positiva celler ingen homogen grupp utan fortfarande utgör de egentliga stamcellerna bara en subgrupp av alla CD34-positiva cel­ ler. Man kan kvantifiera stamcellerna med hänsyn till deras förmåga att bilda kolonier (s.k. colony forming units och colony forming cells). Stam­ cellerna kan ej växa utan kontakt med benmärgstroma där sannolikt secer­ nerande tillväxtfaktorer s.k. cytokiner och faktorer väsentliga för celladhesion är viktiga. Bland cytokiner märks G-CSF, Gm-CSF, Epo, Tpo, stamcellsfaktorn och interleukiner. Stamcellsfaktorn har ensam ingen egen­ effekt, men tillsammans med andra kolonistimulerande faktorer ger den upphov till en kraftig potentiering av omogna celler. Generellt behövs fler tillväxtfaktorer för att stimulera en omogen cell än för en mer mogen cell. Hittills finns endast en begränsad kunskap om tillväxtfaktorer och sam­ spelet mellan dessa. När det gäller proliferationen av hematopoetiska celler finns både stimulerande (t.ex. TNFa, TNFß, Gamma-Interferon ) och hämmande system (t.ex. CSF, stamcellsfaktorn, interleukiner och LIF). Vid sidan om proliferationspåverkan föreligger en påverkan av faktorer som ökar viabiliteten av celler (s.k. survival factors). Dessa senare faktorer anses spela stor roll för att celler skall slippa undan apoptos (programmerad cell­ död). Tumörnekrosfaktorn, som finns i två former, TNFa och TNFß, har visat sig ha stor betydelse bland cytokiner både för reglering av hematopoes och för andra funktioner i kroppen. TNF har visat sig vara ansvarig för tumör­ regresser i samband med allvarliga infektioner och feberepisoder och har både direkt cytotoxiska effekter, fysiologiska roller vid infektioner och inflammationer och en patologisk roll vid autoimmuna sjukdomar, sepsis och vissa anemier. Hittills har svåra biverkningar i samband med använd­ ning av TNF i tumörterapi begränsat dess användning. Receptorer för TNF kan nu indelas i två olika former (p55 och p75) och dessa skiljer sig fram­ förallt åt genom olika intracellulära domäner. Det har nu visat sig att p55formen medierar cytotoxicitet, utan att vara förenad med allvarliga biverk­ ningar. P75-receptorn har framför allt en växthämmande effekt och det har diskuterats om den kan användas i radioprotektivt syfte för benmärgen. TNF är sålunda en pleitrop multifunktionell cytokin, som genom senare rön nu kan få ökad aktualitet inom tumörterapin genom att en mer biverknings­ fri receptorvariant isolerats. Myeloiska tillväxtfaktorer har kommit i klinisk praxis sedan slutet av 1980-talet framförallt i form av två substanser, G-CSF (granulocytstimule­ rance faktor) och Gm-CSF (granulocytmakrofagstimulerande faktor). Eryt­ ropoetin (Epo) är en annan tillväxtfaktor för den röda blodbildningen som finns tillgänglig för kliniskt bruk men den kommer inte att närmare beröras 178 © Studentlitteratur Understödjande terapi då den hittills inte fått någon större roll inom onkologisk vård. Nyligen har trombopoetin (Tpo), en tillväxtfaktor för trombocyter, beskrivits. Denna tillväxtfaktor väntas få stor betydelse i framtiden vid behandling av trombo­ cytopenier. Preliminära data tyder på att Tpo även har potentierande effek­ ter på G-CSF. Exempel på kliniska indikationer för dessa tillväxtfaktorer är sammanfat­ tade i nedanstående tabell: 1. För att reducera durationen av svåra febrila neutropenier efter konven­ tionell cytostatikabehandling. Här visar cost-benefitanalyser att rutinan­ vändning av myeloiska tillväxtfaktorer vid cytostatikabehandling ej är försvarbar utan skall erbjudas patienter med svåra neutropeniepisoder. 2. För att reducera durationen av svåra febrila neutropenier efter högdos cytostatikabehandling och autolog benmärgstransplantation. 3. För att underlätta skörd av perifera stamceller inför benmärgstransplan­ tation. Inom ramen för randomiserade kliniska prövningar undersöks nya indika­ tioner vid sidan av de ovan nämnda som t.ex. kombinationer med andra fak­ torer som interleukin 3 och 6 etc. Mest använt vid cytostatikainducerad neutropeni har G-CSF blivit. Vid cytostatikabehandling av solida tumörer har en minskning erhållits i neutro­ peniperiodens längd medan djupet av neutropenin ej påverkats. En minsk­ ning av såväl antalet infektioner och durationen av dessa, som för­ brukningen av antibiotika och av antalet sjukdagar har setts. Det har varit möjligt att ge fler cytostatikakurer vid planerad tidpunkt. Stöd för detta har man också i de få randomiserade studier som hittills gjorts. Vid behandlingen bör man inte ge tillväxtfaktorn inom 24 timmar före eller efter cytostatikabehandlingen då sådan dosering i stället kan förvärra neutropeni. Behandling brukar bedrivas under 10–14 dagar mellan kemo­ terapicykler. Terapi bör avbrytas om neutrofila överstiger 10×109/L efter att nadirvärdet nåtts. Detta för att undvika ett alltför högt ”rebound värde”. Rekommenderad dos är 5µg/kg per dag subcutant eller intravenöst för G­ CSF. Den vanligaste biverkan som setts för G-CSF är bensmärta (10– 20 %). Biverkningarna verkar vara något vanligare vid terapi med Gm-CSF och inkluderar hudutslag, trötthet, feber och myalgi. Svårare, mer sällsynta biverkningar inkluderar pleura och perikardvätska, lungemboli och ett syn­ drom med hypotension, andningsbesvär, flush och syrebrist. © Studentlitteratur 179 Kapitel 18 Några orsaker till anemi hos cancerpatienten – Anemi associerat med kronisk sjukdom – Pure red cell anemia – Behandlingsinducerad anemi (cytostatika, strålterapi) – Tumörinfiltration – Blödning med Fe-brist – Megaloblastanemi – Mikroangiopatisk hemolytisk anemi – Autoimmun hemolytisk anemi – Hypersplenism Smärtbehandling Smärtlindringsmetoder Tumörspecifik behandling Psykologiskt stöd och omhändertagande Analgetika icke narkotiska preparat narkotiska preparat milda starka Radioterapi Transkutan nervstimulering och akupunktur Neurokirurgiska ingrepp Vid behandling av smärta är den tumörspecifika behandlingen viktig. Vid framgångsrik tumörbehandling kan både cytostatikabehandling och radio­ terapi verka smärtlindrande. I smärteffekten kan dessutom ligga effekter på både inflammationen runt en tumör och mediatorer av inflammatoriska svar. För detta talar att man med relativt modesta doser av radioterapi kan uppnå smärtlindring utan att tumörsjukdomen i sig själv regredierat påtagligt. Människan har också kroppsegna smärtlindrande substanser, s.k. endorfi­ ner. Ungefär en tredjedel av patientpopulationen har stora resurser för att mobilisera denna egeneffekt. Vid behandling av lätt smärta väljes ofta ett preparat som har huvuddelen av sin verkan perifert, t.ex. preparat innehållande paracetamol eller sali180 © Studentlitteratur Understödjande terapi cylika. Vid svårare smärta kan, efter doshöjning, tillägg av antiinflammato­ riska medel vara en väg att gå. Ibland kan man behöva kombinera ett peri­ fert och ett centralt verkande analgetikum (t.ex. genom tillägg av ett preparat innehållande dextropropoxyfen). En lägre dos av neuroleptika kan ibland också vara ett stöd i behandlingen (potentierar effekt). Vid mycket svår smärta behöver man ofta tillgripa morfinpreparat. Hjälp kan man ibland ha av att ge morfin epiduralt och med infusionspump varvid individen själv kan bestämma behandlingsdos. Långverkande morfinanaloger är ofta bra alternativ vid svår smärta. Nervblockader perifert är ganska ofta använda medan operationer av smärt­ banor/-centra i nervsystemet spinalt eller centralt endast tillgrips i mycket svåra smärtsituationer. Den smärtstillande effekten av radioterapi brukar tidigast visa sig efter en dryg veckas behandling och generellt anges att upptill 70 % upplever smärtlindring av radioterapi med en medelduration av 6 månader. Ett van­ ligt radioterapischema för smärtlindring av skelettsmärtor brukar innehålla 10 fraktioner på vardera 3 Gy. En alternativ behandling är engångsdoser på 8 Gy. Under de senaste åren har tillkomsten av intern strontiumbehandling inneburit ett värdefullt tillskott i behandling av skelettsmärta särskilt om smärtan är spridd, migrerande och utan frakturinslag. Vid behandling av terminalt sjuka bör stor generositet iakttas rörande smärtlindring och ofta ges denna behandling även profylaktiskt över dyg­ nets alla 24 timmar för att förebygga smärtepisoder. Illamående och cytostatikabehandling Faktorer som påverkar risken för att utveckla illamående Ålder (tonåringar och yngre vuxna värst) Kvinnor mer än män Ångestfyllda patienter Tidigare drabbats av cytostatikautlöst illamående Individer som lätt utvecklar illamående i andra situationer åksjuka-sjösjuka migrän graviditet Sjukdomsprogress ökar risken Större alkoholkonsumtion minskar risken för illamående © Studentlitteratur 181 Kapitel 18 Endogen kortisolhalt (låg nivå ökar risken) Typ av cytostatika Hög benägenhet Cisplatin Dacarbazin Doxorubicin >75 mg Cyklofosfamid >1 g Medelhög benägenhet Cyklofosfamid < 1 g 5-FU > 1 g Methotrexat >100 mg Karboplatin Doxorubicin 20–75 mg Mitomycin Låg benägenhet Doxorubicin <20 mg Bleomycin Cytarabin Etoposid 5-FU < 1 g Methotrexat <100 mg Vincristin (Efter Lindley et al. J Clin Oncol 1989.) Behandling Vid högemetogena behandlingar profylax. Vid medel och lågemetogena behandlingar individualiserad behandling. I rutinmässigt bruk används dopaminantagonister, serotoninantagonister, kortikosteroider och sedativa. Medel som används inkluderar dixyrazin (Esucos), metoklopramid (primperan), proklorperazin (Stemetil), halope­ ridol (Haldol), benzodiazepiner och selektiva 5HT3-receptorblockerare (t.ex. Zofran, Navoban, Kytril). Steroider har också en antiemetisk effekt och kan med fördel kombineras med andra medel. 182 © Studentlitteratur 19 Rehabilitering, lindrande åtgärder och livskvalité Genom det moderna omhändertagandet överlever en allt större andel patienter sin tumörsjukdom (5 års överlevnad mer än 55 %). En långtidsuppföljning av hälsotillstånd pågår hos ett stort antal tidigare behandlade barn som botats och som nu är uppe i vuxenålder. Hittills är resultaten på lång sikt mycket goda. Avkomman till tidigare behandlade patienter har heller inte uppvisat en ökad andel missbildningar eller andra sjukdomar. På senare år har behovet av psykologiskt stöd under tumörbehandlingen, både för patienten själv och hennes familj, alltmer uppmärksammats. Sär­ skilda psykosociala enheter har byggts upp på tumörbehandlade sjukvårdsinrättningar och då framförallt på onkologiska kliniker. Tumörsjukdomen blir för många vuxna också en kronisk sjukdom där patienten behöver ha intermittent behandling och stöd. Handläggningen är ofta multidisciplinär vid gemensamma tumörkonferenser. Samspelet mellan hemortslasarett och regionklinik samt mellan specialistvård och primärvård har blivit allt viktigare. Lindrande åtgärder i form av smärtbehandling och specifik symtom­ behandling, såsom behandling av blödningar, infektioner, andningsbesvär, ödem, gall-, urinvägsavflödeshinder, tarmpassagehinder, och psykiska reak­ tioner, har en mycket hög prioritet. T.ex. har särskilda smärtteam byggts upp för att kunna ge en adekvat smärtlindring. Ett stort antal vetenskapliga publikationer, inkluderande avhandlingar, har nu patientens livskvalité och rehabilitering som centrala teman. Krisreaktionens faser Vid besked om livshotande tumörsjukdom genomgår människan, liksom i andra allvarliga situationer i livet, olika krisfaser. Krisreaktionen vid tumör­ sjukdom kan delvis vara annorlunda än vid exempelvis en svår bilolycka. Vid tumörsjukdomen finns större möjlighet att krisutlösande händelser (trauman) återkommer såsom exempelvis sjukdomsrecidiv med tilltagande livshotande symtom. © Studentlitteratur 183 Kapitel 19 Chockfasen kan vara i alltifrån ett kort ögonblick och upp till några dygn och tillvaron är ofta kaotisk för individen som inte helt fattat vad som hänt. Efter chockfasen inträder reaktionsfasen som ofta varar i upp till några månader. Det är nu som individen börjar förstå vad som hänt. Sorgereaktio­ nen påbörjas. Individen uppvisar såväl sorg som ilska. Psykosomatiska symtom uppträder. Skuld- och anklagandekänslor kan uppstå. Isolation, depression, förnekelse och ångest förekommer ofta. Inte sällan regredierar den drabbade till ett mer barnlikt beteende. Reparationsfasen efterträder reaktionsfasen och varar ofta i upp till ett år. Individen börjar acceptera det inträffade. En anpassning börjar ske. Sist inträder nyorienteringsfasen då det inträffade har lämnat ett ärr i sjä­ len men där individen börjar att hitta nya utvägar i tillvaron och där det för­ gångna inte hindrar individen att leva mer fullt ut i olika livssituationer. Nyorienteringsfasen pågår ständigt. Vårt sätt att bemästra kriser är mycket individuellt och i princip måste sjukvårdspersonal, som behandlar patienter med tumörsjukdom, vara beredd på att möta alla facetter av krismönster från de lindriga till de mycket allvarliga. Ett från särskilt patienter ofta diskuterat område är huru­ vida svåra livskriser påverkat uppkomsten eller förloppet av tumörsjuk­ domen. Hittills finns inga övertygande bevis för att en tumörsjukdoms upp­ komst på ett betydande sätt påverkats av svåra händelser i livet (s.k. life events) eller en individs psykiska läggning. Vissa indirekta samband kan dock finnas, som t.ex. att en ångestfylld individ röker mer och därför har större chans att få lungcancer. Man kan också tänka sig att överlevnaden vid en tumörsjukdom marginellt kan påverkas av en individs livslust t.ex. däri­ genom att en individ med stor livslust kommer i åtnjutande av mer omfat­ tande understödjande behandling (s.k. life support). Patientens egen önskan/vilja måste till stor del styra doktorns och övrig sjukvårdspersonals agerande. Information till make/maka, barn, andra släk­ tingar, bekanta och vänner sker enbart efter att man inhämtat godkännande från patienten själv att förmedla informationen. Man bör undvika att ge tidsrelaterade prognoser. Data angående recidiv och överlevnad är deriverade från grupper av patienter. Den enskilde patienten är unik och man kan bara med stor osäkerhet ge tidsangivelser för en enskild patients överlevnad. Patienten själv styr ofta med sina frågor hur detaljerad information vederbörande önskar om sin sjukdom. Kontakt mellan patient och sjukvården blir oftast bäst om man visar öppenhet i sin kommunikation och undviker att undanhålla patienten infor­ mation. 184 © Studentlitteratur 20 Uppföljning av patienter Målsättningen med uppföljning av patienter som behandlats för sin tumör­ sjukdom kan vara flerfaldig. Det kan gälla att medge tidigupptäckt av lokal­ respektive fjärrspridning av sjukdomen, att upptäcka nya tumörsjukdomar, att följa upp effekter av prevention, att diagnostisera eventuella seneffekter/ biverkningar av terapi, att följa en sjukdoms naturliga förlopp samt erbjuda patienten och hennes familj ett gott psykosocialt omhändertagande. Vidare kan det finnas vetenskapliga skäl till att ett strikt uppföljningsschema följes. Exempelvis kan, vid en randomiserad undersökning, standardiserade upp­ följningstidpunkter finnas för att hitta första recidiv och följa dödsorsaker. Det är då av stor vikt att de olika behandlingsarmarna följs upp lika och med samma tidsintervall vid jämförande studier. Om man ur ren tumörsynpunkt skall utföra screening för sjukdomsreci­ div måste det finnas en bra terapi för sjukdomen i recidivsituationen. Det kan annars, ur etisk synpunkt, vara mycket diskutabelt att leta efter asymto­ matisk sjukdom. En annan nackdel med att intensivt leta efter recidiv är att frekvensen av besvärliga, långdragna utredningar ökar. Förväntningar från patienten är ofta orealistiska när det gäller värdet av uppföljning och kon­ trollundersökningar. Huvuddelen av sjukdomsrecidiven ”upptäcks” av patienten själv. I ett material av bröstcancerpatienter (Ojeda et al. Eur J Cancer 1987) hittades 1/3 av recidiven vid rutinbesöket medan 2/3 av reci­ diven hittades pga. symtom. Av 2 944 rutinundersökningar ledde 1,3 % till diagnos av ett recidiv (0,6 % klinisk undersökning, 0,3 % lungröntgen, 0,3 % skelettundersökning, 0,03 % blodprov). Vid några få tumörsjukdomar har man visat att det även lönar sig att leta efter asymtomatisk sjukdom. Till dessa sjukdomar hör testiscancer och korionkarcinom. Ett tidigt lokalrecidiv både vid analcancer, rektalcancer, ÖNH-tumörer och bröstcancer är av vikt att hitta för efterföljande terapis skull. I många situationer påverkar dock inte behandlingen av lokalrecidiv totalöverlevnaden. Det är av stor vikt att seneffekter av behandlingen påvisas. Vid behand­ ling av Hodgkins sjukdom kan strålbehandlingen på halsen åstadkomma en © Studentlitteratur 185 Kapitel 20 underfunktion av sköldkörteln som lätt kan behandlas. Tandproblem (bris­ tande salivfunktion) kan åtgärdas och hormonrubbningar sekundärt till strålbehandling av hypofys/gonader kan substitueras. Förbyggande av infektioner vid lymfödem eller efter splenektomier är viktiga. Risk för sekundärtumörer föreligger särskilt hos individer som erhållit kombina­ tionsbehandlingar med cytostatika och strålbehandling. Seneffekter som fistlar och svårläkande sår kan ofta lindras. Man har inte visat på risker för missbildningar hos avkomman till cyto­ statikabehandlade patienter där konceptionen skett efter behandlingens slutförande. Barn som avlats första året efter en kemoterapi har i vissa fall uppvisat låg födelsevikt troligen beroende på en tillväxthämning av uterus hos modern förorsakad av kemoterapin. Ibland kan en exponering, exempelvis i form av tobaksrök, återigen öka risken för en ny tumör hos den tidigare behandlade tumörpatienten. Således är, efter tre års uppföljning, risken större hos öron-näsa-halspatienten för en ny rökrelaterad tumör än för ett sjukdomsrecidiv. Familjer med ärftlig disposition för tumörsjukdom behöver följas upp efter speciella riktlinjer beroende på syndrombild och ålder vid insjuk­ nande. Uppföljningen kan ha olika uppläggning beroende framförallt på vilken sjukdom som följs upp. 1. Självkontroll, läkarbesök endast vid behov? 2. Regelbundna kontroller a. enbart klinisk undersökning (anamnes och fys.status) b. klinisk undersökning, röntgenundersökning av relevanta organ, endo­ skopier c. klinisk undersökning, röntgenundersökning, isotopundersökningar, MR. Generellt brukar uppföljningen med kliniska undersökningar vara tätare ini­ tialt (se exempel på uppföljningsschema). År 1 År 2 År 3 År 4 År 5 År 7 År 10 186 4 ggr / år 4 ggr / år 2 ggr / år 2 ggr / år 2 ggr / år 1 gång / år 1 gång / år © Studentlitteratur 21 Något om de tio vanligaste tumörsjukdomarna hos män och hos kvinnor Deras incidens, orsaker, symtomatologi, diagnostik, behandling, uppföljning och prognos Prostatacancer Män Kvinnor Prostata Bröst Lunga Tjocktarm Blåsa Livmoder Lunga Tjocktarm Hud Äggstockar Rektum Rektum Malignt lymfom Hud Mage Malignt lymfom Malignt melanom Malignt melanom Njurar Nervsystemet 30 20 10 0 0 10 20 30 Incidens, % Figur 21.1 De tio vanligaste tumörformerna hos män och kvinnor. (Cancer incidence in Sweden 1993.) Incidens: Svarar för 1/5 av alla tumörer hos män. Kumulativ livstidsrisk ungefär 10 %. Förekommer ofta latent. I åldersintervallet 50–70 år har vid obduktion mikroskopiska foci av prostatacancer påvisats hos 8–35 %. Sak­ nas hos eunucker. Svarta män i Los Angeles utgör en högriskpopulation. Orsak: Manligt könshormon är sannolikt av stor betydelse. Unga svarta män har högre plasmatestosteronvärden än andra etniska grupper i Los © Studentlitteratur 187 Kapitel 21 Angeles. En överrepresentation av prostatacancer har hittats i familjer med kvinnlig bröstcancer. En familjär anhopning av prostatacancer uppträder. Kostfaktorer har osäker betydelse. Betydelsen av tungmetaller som kad­ mium har diskuterats. Män som genomgått vasektomi har en ökad risk för sjukdomen. Symtomatologi: Ofta bifynd palpatoriskt/cytologiskt vid utredning av prostatahypertrofi. Obstruktionsbesvär sena symtom. Metastassymtom sent (t.ex. ryggvärk). Diagnostik: Primärtumörutredning: palpation, finnålsbiopsi, prostataspe­ cifikt antigen (PSA), CT, ultraljud. Utredning av metastaserad sjukdom inkluderar: PSA, CT/ultraljud bäcken, lungröntgen, skelettscintigram, lymfkörtelbiopsi i lilla bäckenet. Färgdoppler kan vid ultraljudsundersök­ ningen ge stöd för vilka områden som bör biopseras. Stadieindelning: TNM-klassifikation: T1 – ej palpabel tumör, T2 – pal­ pabel tumör < 1,5 cm, T3 – tumörväxt utanför kapseln, T4 – tumör fixerad eller inväxt i omgivande strukturer. N1-3 – ökande grad av regional lymfkörtelspridning, M1 – fjärrmetastaser. Behandling: Tidig prostatacancer har behandlats med expektans, T2-T3, N0 tumörer behandlas med kurativt syftande operation eller kurativt syf­ tande strålbehandling. Metastaserad prostatacancer är ej möjlig att bota. Spridd prostatacancer kan behandlas endokrint (ablatio testis, östrogen, antiandrogen, LHRH-agonist). Moderna trender har varit att alltmer gå ifrån östrogenbehandling till förmån för de andra alternativen, då östrogen­ behandlingen varit förenad med stor kardiovaskulär morbiditet. Ett annat vanligt behandlingsalternativ har varit att använda ett kombinationspreparat (estracyt), som både innehåller ett cytostatikum och östrogen. Cytostatika­ behandling har gett blygsamma responssiffror. Obstruktionsbesvär kan framgångsrikt behandlas med transuretral resektion och symtom från lokalt avancerade tumörer kan behandlas med strålbehandling (t.ex. 50 Gy/25 fraktioner). Strålbehandling externt kan palliera skelettsmärtor och andra metastasmanifestationer. Strontium som radionuklidbehandling kan palliera skelettsmärtor. Uppföljning: Prostataspecifikt antigen (PSA) fungerar som en bra tumör­ markör och bra mätare på aktuell tumörvolym. Vanliga metastaslokaler inkluderar regionala lymfkörtlar (bäcken), skelett, lungor och lever. Prognos: Beroende både av histologisk grad och tumörstadium. Över­ levnaden korrrigerad för interkurrent dödlighet är efter 10 år för T1–T2 tumörer ungefär 75–85 %, för T3–T4 tumörer 40–50 % och för regionalt eller fjärrmetastaserad sjukdom 10–20 %. 188 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna Lungcancer Incidens: Drygt dubbelt så vanlig hos män som hos kvinnor. Incidensen ökar fortfarande hos kvinnor medan särskilt i storstäder ökningen har planat ut för män. Sedan 1993 är incidensen av lungcancer vanligare hos kvinnor än män för individer yngre än 55 år. Orsak: Tobaksrökning svarar för den överväldigande majoriteten av fall (80–85 %). Andra riskfaktorer inkluderar exponering för radon, asbest, arsenik, metaller (krom, nickel, kadmium, beryllium), kvarts, sot och tjära, postinfektiösa ärr i lungan och en släkthistoria av tumörsjukdomar i luft­ vägar. Sambanden mellan rökning och de andra riskfaktorerna är ofta mul­ tiplikativt. Riskökningen störst om exponeringen sker tidigt i vuxenlivet. Passiv rökning ökar risken ungefär två ggr hos icke rökande maka/make. Luftföroreningar i en storstad och dessas eventuella roll i lungkarcinogene­ sen hos människan är omdiskuterade. Kemopreventionsförsök med retinoi­ der pågår hos storrökare men har hittills varit en besvikelse. Om man slutar röka får den f.d. rökaren ej samma låga incidens som en person som aldrig rökt, men den f.d. rökaren slutar att ackumulera ytterligare riskår. Symtomatologi: Ändrad hosta, hemoptys, pip i bröstet och recidiverande pneumonier. Vid avancerad lungcancer: symtom på kollapsad lunga, bröst­ smärta, perikardit, pleurit. Vid uttalad tumörväxt och metastaser: allmän­ symtom, andningshinder, vena cava superior-syndrom, dysfagi, recur­ renspares, påverkan på autonoma nervsystemet (Horners syndrom), förstorade lymfkörtlar, CNS-symtom och skelettsmärtor. Paramaligna sym­ tom förekommer som trombos/embolier, tromboflebiter, hyperkalcemi, Cushings syndrom, myasteni, ledbesvär och neuropatier. Trumpinnefingrar kan förekomma. Histopatologi: Skivepitelcancer i olika material svarar för mellan 3050 % av alla lungcancerfall. Adenokarcinom svarar för mellan 10–30 % och småcellig cancer för mellan 15–30 % av alla lungcancerfall. Storcellig lungcancer förekommer i 5–15 % av fallen. I olika material är adenokarci­ nom ofta den vanligaste cancerformen hos kvinnor och dess andel av alla lungcancerfall ökar successivt. Sambandet mellan lungcancer och rökning är starkast för småcellig cancer och skivepitelcancer. Adenokarcinom är överrepresenterade bland tumörer med perifer lunglokalisation. Diagnostik: Primärtumörutredning kan förutom anamnes och fysikalisk status inkludera röntgen (konventionell lungröntgen, genomlysning, tomo­ grafi, datortomografi, magnetisk resonanstomografi, bronkografi, angio­ grafi), bronkoskopi, transbronkiell finnålsbiopsi, sputumcytologi, transtho­ rakal finnålsbiopsi, thorakoskopi och explorativ thorakotomi. I 90–100 % © Studentlitteratur 189 Kapitel 21 av centralt i bronkträdet växande tumörer kan diagnos erhållas vid bronko­ skopi med biopsi. Av mer perifert belägna tumörer erhålles diagnos via bronkoskopi i mellan 50–80 %. Vid metastasutredningen spelar mediastinoskopin en central roll för att bedöma en tumörs operabilitet. Lymfkörtlar, lever, skelett och lunga utgör de vanligaste fjärrmetastaslokalerna. Inför en operation utreds även indivi­ dens funktionsstatus (speciellt lunga och hjärta). De tumörmarkörer som rönt störst intresse vid lungcancer är CEA (karcinoembryonalt antigen) och NSE (neurospecifikt enolas). Förhöjt NSE i serum kan ge stöd för diagno­ sen småcellig lungcancer. Stadieindelning: TNM-klassifikation: T1 – diameter < 3cm, omgiven av lunga eller visceral pleura utan bronkoskopiska belägg för central växt proximalt om lobära bronker (dvs. inte i huvudbronk eller stambronk), T2 – tumör med minst en av ovannämnda egenskaper; tumör > 3 cm, tumör engagerar huvudbronk eller stambronk minst 2 cm distalt om carina, inväxt i viscerala pleura, atelektas eller obstruktiv pneumonit som når hilusområ­ det men inte omfattar hela lungan. T3 – tumör av vilken storlek som helst som växer in i något/några av följande: bröstkorgsvägg, diafragma, media­ stinala pleura, parietala perikardiet eller tumör av vilken storlek som helst som växer i huvudbronk < 2 cm från carina utan engagemang av carina eller förenad med atelektas eller obstruktiv pneumonit som omfattar hela lungan. T4 – tumör av vilken storlek som helst som växer in i något av föl­ jande: mediastinum, hjärta, stora kärl, trakea, esofagus, kotkropp, carina, eller tumör med malign pleural vätskeutgjutning. N0 – inga regionala lymfkörtelmetastaser. N1 – metastasering till ipsilaterala peribronkiella lymfkörtlar och/eller ipsilaterala hiluslymfkörtlar inklusive direkt inväxt. N2 – metastasering till ipsilaterala mediastinala och/eller subcarinala lymf­ körtlar. N3 – metastasering till kontralaterala mediastinala lymfkörtlar, kontralaterala hiluskörtlar, ipsi- eller kontralaterala skalenus eller supraklavikulära lymfkörtlar. M1 – fjärrmetastaser. Stadium I inkluderar T1–T2 N0 M0, stadium II T1–T2 N1, stadium III T3–T4 N0–N3 och sta­ dium IV T1–T4 N0–N3 M1. Behandling: Lungcancer kan behandlas med kirurgi, kemoterapi och radioterapi. Vid kirurgi bör minst lobektomier eftersträvas. Den operativa mortaliteten vid lobektomier är ungefär 1 % och vid pulmektomier 5 %. Strålterapi är liksom kirurgi en lokoregional behandling. Vid icke småcellig lungcancer har man sett att regimer som inluderar cisplatinum tillsammans med vindesin eller etoposid ger en högre remissions­ frekvens utan att påverka totalöverlevnaden i sjukdomen. Kemoterapi har annars en etablerad roll vid småcellig lungcancer. De mest använda kombi190 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna nationerna inkluderar cyklofosfamid, doxorubicin och vinkristin. Vid andra former av lungcancer är kemoterapi experimentell och bör endast ges inom ramen för randomiserade studier. Flertalet patienter med icke resektabel icke-småcellig lungcancer har tumörvolymer som är så stora att en stråldos på 80–100 Gy skulle erfordrats för lokal utläkning. Strålbehandling kan i enstaka fall med perifert belägna icke opererade tumörer vara kurativ i sig själv. Om doser över 40Gy/20 fraktioner ges (t.ex. 66Gy) bör en krympande targetteknik utnyttjas. En överlevnadsvinst ses med den högre dosnivån. Hos äldre patienter med dåligt AT kan en palliation erhållas med en targetdos på 40 Gy. Studier av värdet av hyperfraktionerad strålbehandling pågår och hittills är resultat uppmuntrande.Värdet av att kombinera strålbehandling med metoclopramid eller analoger undersöks för närvarande. Vid begränsad tumörutbredning förbättrar sannolikt radioterapi progno­ sen av småcellig cancer. Vid småcellig lungcancer ges också profylaktisk CNS-bestrålning 30 Gy/ 15 fraktioner. Laserbehandling har tillkommit som behandlingsoption vid palliation både vid kvävningshotande tumörer, hemoptyser och avstängningspneumo­ nier. Neodym-YAG-lasern är speciellt lämplig att koagulera blödande tumörer. Fotodynamisk behandling med hematoporfyrinderviat, HPD, och laserljus är ett nytillkommet alternativ till neodym-YAG-lasern. Andra palliativa ingrepp inkluderar stentning av vena cava superior syn­ drom och komprimerade luftvägar samt strålbehandling av metastaslokaler. Uppföljning: De flesta sjukdomsrecidiv vid lungcancer inträffar de 2–3 åren närmast efter diagnos. Då inga möjligheter finns till långtidsbot vid recidiv bör en uppföljning av tidigare behandlade lungcancerpatienter ske med sunt förnuft.Vid uppföljningsbesök bör ingå anamnes, kliniskt status och lungröntgen. Endast i förekommande fall behöver andra spe­ cialundersökningar göras. Prognos: Prognosen vid lungcancer är generellt dålig med en total fem­ årsöverlevnad på ungefär 5 %. Vid småcellig cancer uppvisar en liten grupp efter modern behandling långtidsöverlevnad. Med radikal kirurgi, som endast en liten andel patienter kommer i åtnjutande av, kan man vid T1tumörer uppnå en femårsöverlevnad på drygt 50 %. Lymfkörtelmetastaser (N1) försämrar prognosen påtagligt till omkring 30 % femårsöverlevnad. Totalt lever en tredjedel av alla opererade patienter efter 5 år. Den radikala kirurgin är lättare att åstadkomma hos perifert belägna tumörer och adeno­ karcinom förekommer oftare med denna presentationslokal. © Studentlitteratur 191 Kapitel 21 Tjocktarm och rektum Incidens: Sjukdomen är för män och kvinnor den näst vanligaste tumör­ formen i Nordamerika, Nord- och Västeuropa. I Sverige 1993 drabbades 2 537 fall av koloncancer och 1 869 fall av rektalcancer. Sjukdomen är ungefär lika vanlig hos män och kvinnor och ovanlig före 40-årsåldern. En svag ökning i incidensen har noterats. Orsak: Ärftlighet (familjär adenomatös polypos, andra polypassocierade syndrom som hereditary non-polyposis kolon cancer, flat adenoma syn­ drome), adenomatösa och villösa polyper, kronisk inflammatorisk tarm­ sjukdom, stillasittande jobb, diet rik i fett och med låg fiberhalt. Gallsyre­ utsöndring och nedbrytninsprodukter av kolesterol anses spela stor roll. Skyddande faktorer har beskrivits, bl.a. ett högt kalciumintag, salicylika­ bruk, frekventa tarmtömningar och stor fysisk aktivitet. En hög ölkonsum­ tion har associerats med rektalcancer i flera studier. Genen för familjär polypos är belägen på kromosom 5 (5q21–q22) och identifierades 1991. En annan gen för koloncancer finns på kromosomarm 18q (DCC gen). Vidare anses p53-genen på kromosomarm 17p ha betydelse för tumörevolutionen. Nyligen har 4 gener beskrivits som också kan ha stor betydelse för icke polyposrelaterad koloncancer. Mutationer i dessa gener leder till genetisk instabilitet. Symtomatologi: Ändrade avföringsvanor, blödning, obstruktion (ileus­ besvär) och slembildning. Sena symtom: smärta, peritonit och icterus. Tumörbiologi: Ett hyperplastiskt epitel med eller utan polyper ökar risk för cancerutveckling. Den molekylärbiologiska evolutionen mellan ett hyperplastiskt epitel, polyp, cancer in situ och invasiv cancer har beskrivits av Vogelstein och medarbetare (se avsnitt om hereditär cancer). Primärtumör växer oftare runt i tarmens cirkumferens snarare än longitu­ dinellt i tarmvägg. Caekum, kolon transversum och sigmoideum ligger intraperitonealt och är täckta med serosa. Tumörer som debuterar i dessa lokaler har större benägenhet till peritoneal karcinos medan tumörer i kolon ascendens, kolon descendens, flexura hepatis och flexura splenica är delar av tarm med företrädesvis extraperitonealt läge och därför ofta saknar serosa på bakvägg. Det finns därför hos tumörer från dessa lokaler en större tendens till direkt invasion i mjukvävnaden retroperitonealt med invasion mot njure, uretär och bukspottkörtel. Ändtarmen saknar serosa och tumörer härifrån växer ofta ut i mjukvävnaden perirektalt. Urinblåsa, prostata och vagina blir lätt tumörinvolverade. Det övre venplexat i rektum dräneras via mesenterica inferior till vena porta och levern, medan i nedersta ändtarmen 192 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna venplexa via bäckenvener tömmer sig i vena cava inferior. Detta senare kan förklara den högre lungmetastasincidensen från distala rektalcancrar. De nedre bäckenvenerna står också i förbindelse med sakrala plexa ut i kotor vilket kan förklara den högre incidensen av sakrum och kotmetastaser från tumörer långt ned i rektum. Adenomatösta polyper över 2 cm i diameter betraktas som förstadier till cancer och bör tas bort. Slyngning med dia­ termi används ofta för att avlägsna polyperna antingen med rektoskop eller flexibelt koloskop. Canceromvandlingen i villösa adenom är också mycket hög (i vissa serier upp till 70 %). Dessa avlägsnas genom lokal excision eller när större adenom föreligger med segmentell resektion. Mellan 10–25 % av alla patienter har detektabla levermetastaser vid diagnos. En samtidig annan (synkron) kolorektalcancer hittas hos mellan 2– 8 % av alla nya patienter och hos 12–62 % hittas en samtidig polyp. Diagnostik: Screening för kolorektal cancer vore sannolikt kostnads­ effektiv. Metoder som prövats är detektion av blod i avföring, per rektum­ palpation, rektoskopi och flexibel koloskopi och sigmoidoskopi. Det som rönt störst uppmärksamhet på sistone är flexibel sigmoidoskopi och en upp­ läggning med en engångsundersökning vid 55 års ålder i hela populationen verkar vara kostnadseffektiv. Ännu saknas randomiserade studier för att visa detta. Två tredjedelar av alla kolorektaltumörer är belägna i rektosig­ moideum med mer än en tredjedel i rektum. Detta innebär att 1/3 kan diag­ nostiseras med rektalpalapation och nästan 2/3 med rektosigmoideoskopi. Blod i avföringen verkar ha för låg sensitivitet och för lågt prediktivt värde. Per rektumpalpation har en roll för de mer distala tumörerna och bör inte försummas hos individer över 50 år vid kliniska undersökningar. De heredi­ tära formerna av kolorektalcancer kräver särskild screening och profylak­ tiska ingrepp (se avsnittet om hereditär cancer). Vid utredning av symtoma­ tisk sjukdom används blod i avföring, koloskopi, biopsi och makroskopisk värdering, kolonröntgen (dubbelkontrast), laboratorieanalyser, rektoskopi, sigmoideoskopi, per rektum palpation, CT-thorax, buk (inkl. lever), bäcken (NMR), och preoperativ utredning av lungor och hjärta. CEA (karcino­ embryonalt antigen) har prognostisk betydelse och bör tas preoperativt. Stadieindelning: Dukes stadieindelning brukar användas. Duke A mot­ svarar en tumör engagerande enbart slemhinna. Inga lymfkörtelmetastaser. Vid Duke B har tumör penetrerat muskelatur i tarmen. B1 om serosa ej pene­ trerad och inga lymfkörtelmetastaser. B2 om serosa penetrerad och inga lymfkörtelmetastaser. Vid Duke C finns lymfkörtelmetastaser. Om proxi­ mala mesenteriala körtlar involverade C1, om distala mesenteriala körtlar engagerade C2. I övrigt har tumörens differentieringsgrad, läge (rektal can­ cer sämre än annan koloncancer) och de som debuterar med tarmobstruktion © Studentlitteratur 193 Kapitel 21 sämre prognos. Intravaskulär och intralymfatisk spridning och tarmperfora­ tion vid operationstillfällen försämrar också prognosen. Tumörcellsprolife­ ration och DNA-index är under utvärdering som prognostikum. Behandling: Operation är basbehandlingen vid tidig kolorektal cancer. Höger- eller vänstersidig hemikolektomi med lymfkörtelutrymning kan utföras i uppemot 90 % av alla fall. Vid ingreppet strävar man att manipulera tarm så lite som möjligt (s.k. no-touch technique) för att minska risken för hematogena metastaser. Implantationsmetastaser vid operationen söker man också förhindra på olika sätt. Vid tumörer distalt belägna utföres abdomino­ perineala rektumextirpationer. Främre resektioner utföres av tumörer belägna i övre rektum. Vid familjär polypos bör man eftersträva total prok­ tokolektomi som intial operation. Patienter med ileussymtom (20 %) opere­ ras ofta i ett flerseansförfarande med en avlastande temporär stomi. Själva tarmresektionen utföres sedan i lugnt skede och därefter sker en operativ Kliniska värdet av nuvarande kombinationsbehandlingar som finns tillgängliga vid gastrointestinal cancer Behandling Eso- Magfagus säck Kolon Rektum Anal Pancreas Gall- Lever vägar Preoperativ strålning + kemoterapi + strålning+kemoterapi + – – – – – – ++ + ++ ++ ? ++ – – – – – – – – – Postoperativ strålning – kemoterapi – strålning+kemoterapi – – – – ++ - ++ + ++ + – + – – – – – – – – – Lokalt avancerad sjukdom strålning + kemoterapi – strålning+kemoterapi + – + ++ – + + + + ++ ++ ? ++ – – – – – – – – – Avancerad sjukdom strålning – kemoterapi – strålning+kemoterapi – – – + – + + + + + + ? + – – – – – – – – – ++ definitiv effekt + moderat effekt – ingen effekt, studier av behandlingformen kan pågå (Efter Falkson et al, 1993.) 194 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna slutning av den temporära stomin. Hos de 20 % av patienterna som har sprid­ ning av sin tumör vid diagnos bör en palliativ resektion övervägas för att und­ vika ileus senare. Adjuvant behandling av koloncancer Duke C med 5-FU och levamisol resulterade i en minskad recidivfrekvens särskilt extraabdomi­ nellt. Strålbehandling halverar frekvensen av lokalrecidiv vid rektalcancer. Möjligen uppnås även en förlängd överlevnad. Denna behandling ges vid extirpabel rektalcancer företrädesvis som preoperativ behandling (25 Gy/ 5fraktioner). Vid inextirpabel rektalcancer kan efter preoperativa doser på 40–50 Gy uppemot 50 % av patienterna bli resektabla. Genom att kombinera strålbehandling med cytostatika (MFL, methotrexat, 5-FU och leukovorin) studeras om fler tumörer kan göras resektabla. Vid adjuvant behandling av B2-C rectalcancer resulterade kombinationen av postoperativ strålbehand­ ling och 5-FU i två randomiserade studier i en signifikant förbättrad sjuk­ domsfri överlevnad. Vid recidiv i bäckenet utgör strålbehandling en mycket viktig palliativ åtgärd med smärtkontroll initialt i upp till 80–90 % av alla patienter. Vid inextirpabel rektalcancer och lokalrecidiv kan intraoperativ strålbehandling komma ifråga och då i höga engångsdoser (20–25 Gy). Vid levermetastaser kan objektiva remissioner ses med systemisk kemoterapi hos mellan 25–40 % (5-FU eller 5-FU/leukovorin). Flera randomiserade studier vid disseminerad sjukdom har nu visat på att kombinationen 5-FU och leu­ kovorin ökar responssiffor signifikant. Tillägget av leukovorin ökar cytotox­ iciteten av 5-FU genom att leukovorin ökar inhibitionen av tymidylatsynte­ tas. Den mesta blodtillförseln i levertumörer tros komma från a. hepatica medan leverparenkymet får sin blodförsörjning framförallt från v. porta. Detta har bildat en rational för intraarteriell behandling av levermetastaser. En högre objektiv responsfrekvens (40–60 %) har också observerats med intraarteriell kemoterapi, jämfört med 10–20 % vid systemisk terapi. Emel­ lertid har ingen ökad överlevnad uppnåtts. Intraarteriell kemoembolisering av levermetastaser och kombinationer av kemoterapi given systemiskt och intraarteriellt är också föremål för vetenskapliga studier. Uppföljning: Många patienter har efter operationen en kolostomi som kräver särskild träning och uppföljning. Anastomosläckage, rubbningar av blås- och sexualfunktioner förekommer postoperativt. Både lokalrecidiv och särskilt enstaka metastaser till t.ex. lever kan vara viktiga att hitta då operation av patienter med enstaka levermetastaser förlänger överlevnaden och även kan kurera enstaka patienter. Anastomosrecidiv kan, om det diag­ nostiseras tidigt, med framgång reseceras. Blod i avföringen, rektoskopi och kolonröntgen är viktiga uppföljningsundersökningar under de första åren för att avslöja ett anastomosrecidiv. Smärta och bäckentumor är de två vanligaste symtomen på recidiv. © Studentlitteratur 195 Kapitel 21 Prognos: Femårsöverlevnad Duke A 61-81 %, Duke B 25–64 % och Duke C 10–50 %. Prognosen har efter kirurgiska ingrepp inte förbättrats under senaste 30 åren. Lokalrecidiv förekommer i en frekvens på ungefär 10 % med en högre frekvens vid distala rektumcancrar 30–40 %. En korre­ lation mellan stadium och risk för lokalrecidiv finns. En mer omsorgsfull operationsmetod enl. Held vid rektalcancer prövas nu. Preliminära resultat antyder en ännu lägre lokalrecidivfrekvens. Randomiserade studier för att utreda behovet av preoperativ strålterapi efter operation enl. Held pågår. Vid konventionell rektumoperation föregången av preoperativ strålterapi antyder nu resultaten en överlevnadsvinst. Levern utgör första recidivlokal vid kolorektalcancer hos 33 %, lunga 22 %, locoregionalt 21 %, intraabdominellt i 18 % och retroperitonealt i 10 %. Anastomosrecidiv finns hos 3–5 %. Med reresektion av lokaliserade recidiv kan man uppnå en medelöverlevnad på 33–60 månader med lång­ tidsöverlevnad hos 30–50 %. Siffrorna är dock något svårtolkade då resul­ taten ofta bygger på biologiskt starkt selekterade grupper. Utan reresektion är femårsöverlevnaden ungefär 4 % för kolorektal cancer. Blåscancer Incidens: Blåscancer är tre gånger vanligare hos män än hos kvinnor (25/ 100 000 mot 8/100 000). En ökning av incidensen pågår. Orsak: Rökning, yrkesmässig aminexposition, kroniska infektioner (schistosomiasis), kaffedrickande (framförallt kvinnor) och släkthistoria för blåscancer. Symtomatologi: Blödning, trängningar, smärta, recidiverande infek­ tioner, obstruktionssymtom. Trötthet och avmagring vid avancerad sjuk­ dom. Tumörbiologi: Den höga incidensen av cancer i blåsan jämfört med res­ ten av urinvägarna kan bero på den ständiga kontakt mellan urin och epitel som här sker. Patienter har en benägenhet för att utveckla multipla tumörer. Hittills har molekylärbiologiska studier talat för en klonal utveckling i blåsan istället för en rad nya tumörer och därför bör man misstänka intra­ vesikal metastasering eller implantation som orsak till de flesta multipla tumörer. Den vanligaste histologiska typen av blåscancer är av över­ gångsepitel. Skivepitelcancer och adenokarcinom förekommer också. Tumörer relaterade till schistosomiasisinfektioner är oftast skivepitelcancer. Adenokarcinom är belägna i blåstak och utvecklas i rester av urachus. 196 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna De vanligaste enstaka cytogenetiska förändringarna i blåstumörer har utgjorts av en isokromosom 5p, trisomi 7 och monosomi 9. Frekventa för­ ändringar på kromosom 1 och 11 har ansetts som sekundära. En korrelation till tumördifferentieringsgrad och deletioner av kromosomarm 3p och 17p finns. Diagnostik: Urincytologi, uretrocystoskopi, bimanuell palpation under muskelrelaxation (också före och efter utförd transuretral blåsresektion), urografi och lungröntgen. Urinodling bör också utföras. Liten tumör extir­ peras. Vid palpabel tumör utföres djup biopsi för att undersöka eventuell muskelinfiltrativ tumörväxt. Stadieindelning: TNM-klassifikationen används. TIS – karcinom in situ, T1 – fritt rörlig tumör som ej kvarstår efter TUR-B och/eller där mikro­ skopi visar att tumör ej sträcker sig utom lamina propria. T2 – vid palpation induration av vägg som är fritt rörlig. Ingen kvarvarande induration efter TUR-B och/eller det finns mikroskopisk invasion i ytlig muskulatur. T3 – vid bimanuell palpation induration eller en nodulär mobil massa som känns i blåsvägg och som persisterar efter TUR-B och/eller där det finns mikro­ skopisk invasion i djup muskulatur eller extension genom blåsvägg. T4 – tumör fixerad mot omgivande strukturer och/eller där det finns mikrosko­ piska tecken på sådan infiltration. N0 – inga metastaser i regionala körtlar. N1 – engagemang av en enstaka homolateral regional lymfkörtel. N2 – engagemang av kontralateral, bilateral eller multipla regionala lymfkörtlar. N3 – fixerad massa mot bäckenvägg med en fri yta mellan denna massa och blåstumör. N4 – engagemang av juxtaregional lymfkörtel. M0/M1 – från­ varo/närvaro av fjärrmetastaser. Histologisk gradering utföres i en tregradig skala och denna gradering har visats ha prognostisk betydelse. Behandling: Cancer in situ behandlas med TUR. Om det, trots den trans­ uretrala resektionen, finns tumörceller i blåssköljvätska och vid utbredd cancer in situ ger man installationsbehandling med cytostatika (t.ex. mito­ mycin C, doxorubicin) eller BCG. T1-tumör, grad 1–2 behandlas med TURB-B. T1-tumör grad 3 – om stor tumör göres cystektomi. Multipla ytliga tumörer behandlas med TUR-B, BCG/mitomycin och i sista hand cystektomi. T2-tumörer behandlas med cystektomi eller med preoperativ strålbehandling åtföljd av cystektomi. T3-tumörer behandlas med kombine­ rad preoperativ strålbehandling och cystektomi. T4-tumörer behandlas med induktionskemoterapi (M-VAC = metotrexat, doxorubicin, vinblastin, cisplatinum eller varianter på denna regim) efterföljt av radikal cystektomi eller strålbehandling. I regel ges 4 cykler M-VAC. Patient med tumör som uppvisar lymfkörtelmetastasering eller fjärrmetastaser erbjuds, om organ­ © Studentlitteratur 197 Kapitel 21 funktion och AT tillåter, M-VAC. Antal cykler bestämmes av tumörsvar och toxicitet. I den moderna blåscancerbehandlingen har rekonstruktionen av urinvägar efter blåscanceroperationen mycket stor betydelse. Om cystektomi ingår som behandlingsalternativ måste hänsyn tas till om patient tidigare har haft en tumör i njurbäcken eller uretärer och om tumör eller cancer in situ enga­ gerar suprakollikulära delen av prostatiska uretra. Om tumör ej finnes/fun­ nits på ovannämnda lokaler kan, hos män, blåssubstitution övervägas som rekonstruktiv åtgärd. Annars bör cystouretrektomi rekommenderas som behandling. Urinavledningen efter cysturetrektomi/cystektomi individuali­ seras till antingen bilateral uretero-enterokutaneostomi (kolon eller ileum­ konduktor), blåssubstitut eller kontintent urinreservoir (baserad på kolon eller ileum). Hos yngre individer bör de två senare vara för­ stahandsalternativ. Ureterosigmoideostomi med uretärimplantation ad modum Leadbetter är också en möjlighet om normal analsfinktertonus finns. Uppföljning: Livslång. Till en början görs cystoskopi var tredje månad under de första två åren med senare längre intervall. Prognos: Ytlig blåscancer har en femårsöverlevnad på ungefär 60 %. Vid tidig blåscancer av högmalign typ ger kombinerad behandling (strålbehand­ ling och cystektomi) en femårsöverlevnad på upptill 50 %. Vid T3-tumörer ger strålbehandling en femårsöverlevnad på 30 % som sjunker till 5–10 % vid T4-tumörer. Förhoppningen är att kombinationer av cytostatikabehand­ ling (t.ex. M-VAC) med operation/strålbehandling på lång sikt kan förbättra överlevnad vid mer avancerad blåscancer. Hudcancer Incidens: I Sverige diagnostiseras ungefär 2 060 fall/år med en incidens på ungefär 7,5/100 000. Hudcancer är vanligare hos män än hos kvinnor. Orsak: Kumulativ UV-exponering, utomhusarbete, arsenikexponering ökar risken. Exponering för tjära, kroniska sår, joniserande strålning, och papillomvirus samt en känslig hy, ärftliga faktorer och sällsynta DNA-repa­ rationssjukdomar, är andra faktorer som uppvisat samband. Symtomatologi: Sår som ej vill läka på solexponerad yta. Blödning. Tumörbiologi: Skivepitelcancer. Växer ofta eleverat, vallartad kant med central ulceration. Ökad hornbildning kan också ses. Lokaliserade framför allt till kraftigt solbelysta områden (ansikte, öron, hals och handrygg). Diagnostik: Finnålspunktion och/eller biopsi. Viktigt är att ta material från tumor och ej i ulceration eller nekros. 198 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna Behandling: Operation och/eller strålbehandling. Förstahandsbehandling är operation. Tumörens lokalisation och storlek är avgörande för val av terapi. För stora tumörer med metastasering kan både preoperativ och post­ operativ strålbehandling vara aktuell. Uppföljning: Det finns en ökad risk för recidiv framför allt de 2–3 första åren efter primärbehandlingen. Därför bör kontrollerna vara tätare under denna period och kan sedan glesas ut eller skötas i primärvård senare. En ökad risk för nya hudtumörer finns och gör det motiverat att aktivt screena hudkostymen hos tidigare hudcancerpatienter. Prognos: Om lymfkörtelmetastaser saknas vid diagnos är prognosen god, 90 % kuration. Finns lymfkörtelmetastaser försämras överlevnaden till ungefär 60–70 % femårsöverlevnad. Maligna lymfom (non-Hodgkinlymfom) Incidens: Uppvisar näst maligna melanom den största incidensökningen i Sverige. I västvärlden finns en ökning av högmaligna lymfom associerade med AIDS-epidemin (framförallt CNS lymfom). AIDS-epidemin förklarar dock inte den stora ökningen av non-Hodgkinlymfom. Nya immunhisto­ kemiska metoder har medfört att fler odifferentierade tumörer och ”anaplas­ tiska cancrar” nu kan kännas igen som lymfom och nya klassifikationssys­ tem har gjort att enstakta subgrupper som tidigare tillhört Hodgkins sjukdom nu klassas som non-Hodgkinlymfom. Inte heller dessa två faktorer kan förklara den stora ökningen av non-Hodgkinlymfom som iakttagits och därför måste det allvarligt övervägas att det finns hittills okända etiologier. I norra Tyskland har man framförallt noterat att sjukdomsökningen har haft att göra med gastrointestinala lymfom. Sjukdomen är vanligare hos män än hos kvinnor, ökar med ålder med en medianålder för insjuknande över 65 år. Orsak: Virus (t.ex. HTLV1, EB-virus), immundefektsjukdomar (för­ värvade eller medfödda som agammaglobulinemier, autoimmuna sjuk­ domar, aidspatienter, organtransplanterade individer), ärftlighet, yrkesfakto­ rer (t.ex. lösningsmedelsexponering, arsenikexponering, andra kemikalier). Ett eventuellt samband med herbicidexponering (dioxinkontaminerade fenoxysyror) har livligt diskuterats. Joniserande strålning. I Sydsverige har vi i preliminära studier noterat ett samband med tidigare blodtransfusioner. Debutlokal vid diagnos verkar vara relaterad till olika riskfaktorer så att lym­ fom som uppträder hos immundefekta företrädesvis har en lokalisation till CNS, lymfom hos lösningsmedelsexponerade debuterar nära luftvägar, her­ © Studentlitteratur 199 Kapitel 21 bicidexponerade har oftare hud- och slemhinneassocierade lymfom, coelia­ kiassocierade lymfom debuterar oftare tarmnära, strålassocierade lymfom debuterar i eller nära strålningslokal etc. Ett samband mellan cytogenetiska tumörkaryotyper och riskfaktorer finns (t.ex. Burkittlymfom och 8,14 trans­ lokation i tumören och lösningsmedelsassocierade lymfom och 14q+). Symtomatologi: Svullen(-na) lymfkörtel(-lar), förstorad lever och/eller mjälte. Allmänsymtom i form av feber, viktminskning och svettningar. Klåda (vanligare vid Hodgkins sjukdom). Anemi. Trombocytopeni. Sym­ tom från enskilda tumörengagerade organ (ofta vid extranodala lymfom). Tumörbiologi: De flesta lymfom hos vuxna patienter utgörs av B-cells­ deriverade maligniteter. T-celler utgör ursprung för en mindre del (vanligast hos barn) och ännu sällsyntare är äkta histiocytära lymfom. Tumören avspeglar delvis fysiologi hos den normala ursprungslymfocyten. Således finns det lymfom som har sin huvudpresentation och distribution till slem­ hinnor och mag-tarmkanal s.k. MALT (= mucosa associated lymphatic tissue) lymfom. Andra lymfom debuterar i tyreoidea eller orbita. Hos barn finns ofta T-cellsderiverade mediastinala lymfom. Burkittlymfom engagerar ofta lymfoid vävnad i mun/nära mandibel och i ovarium. Det har redan påpekats att hos immunsupprimerade uppträder lymfom oftare i centrala nervsystemet. Vid coeliaki debuterar lymfomet tarmnära. Vissa hudlymfom (t.ex. Sezarys syndrom) uppstår från en T-cell i huden. Diagnostik: Ett flertal histopatologiska klassifikationer har använts vid non-Hodgkinlymfom. Två av de mest använda utgör Kiel-klassifikationen och Lukes-Collins-klassifikation. Ett försök att sammanfoga olika klassifi­ kationer har gjorts i den s.k. Working formulation of lymphoma och nu senast i REAL-klassifikationen. I Sverige används REAL-klassifikationen. Diagnosen lymfom sätts ofta via cytologi, däremot kräver själva klassifika­ tionen att tumörvävnad undersöks omsorgsfullt med optimala metoder (lymfkörtel omhändertas på ett atraumatiskt sätt och sänds ofixerad till pato­ logavdelning för specialundersökningar). Non-Hodgkinlymfomen delas in i högmaligna och lågmaligna lymfom. De lågmaligna lymfomen debuterar oftast med spridd sjukdom. Benmärgsengagemang är vanligt. Trots initialt gott terapisvar är sjukdomen kronisk och leder till döden ofta efter 5–10 år. En del lågmaligna övergår i ett terapiresist högmalignt lymfom. De hög­ maligna lymfomen är till en tredjedel lokaliserade och då ofta med extrano­ dal växt (växt utanför egentliga lymfkörtlar). Tumören växer snabbt och obehandlad leder sjukdomen ofta till död inom ett år. Hos denna grupp av patienter kan intensiv behandling leda till kuration. En speciell form av lym­ fom utgör lymfoblastlymfomen som ofta debuterar hos unga individer (15– 35 år) med snabbt växande tumör i mediastinum eller buk. Här kan sjuk200 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna domen leda till död inom några dagar/veckor om den lämnas obehandlad. Det är därför mycket viktigt med ett snabbt omhändertagande och insättande av terapi. I standardutredningen ingår anamnes, blodstatus, leverstatus, elektro­ lyter, SR, elfores, S-LD, tymidinkinas, serologi för toxoplasmos, CMV och HIV, ÖNH-status, undersökningar av lymfkörtlar, buk (inkl. lever och mjälte) och yttre genitalia. Röntgen lungor, CT-thorax (framförallt Hodg­ kins sjukdom) och buk och bäcken. Ultraljud kan vara ett komplement till CT. Förr gjordes lymfografier i stor omfattning men dessa har nu ersatts av CT- och ultraljudsundersökningar. I vissa situationer görs MR. Vid utredningen inkluderas också gastroskopi vid tonsillymfom, öron­ näsa-hals-skopi vid ventrikellymfom och likvorundersökning vid ben­ märgsengagemang och CNS-nära engagemang av högmalignt lymfom. Stadieindelning: Ann Arbor-klassifikationen används för att definiera tumörutbredning. Stadium I – engagemang av en lymfkörtelstation. Sta­ dium II – engagemang av två lymfkörtelstationer på samma sida av dia­ fragma. Stadium III – engagemang på båda sidor av diafragma. Stadium IV – diffust extranodalt engagemang. Frånvaro/närvaro av B-symtom (feber, nattsvettningar och viktnedgång) beskrivs med bokstäverna A/B. Behandling: Lågmaligna lymfom: Patienter med lågmaligna lymfom och stadium I erhåller strålbehandling i kurativt syfte. Vid spridd sjukdom kan man antingen välja att behandla med en/ett mild(-t) cytostatikakombination (cytostatikum) utan större biverkningar eller iakttaga en avvaktande attityd och endast behandla när symtom som cytopenier, obstruktioner av vitala organ, infektioner, trycksymtom, och B-symtom uppstår. Exempel på cyto­ statika som använts vid lågmaligna lymfom är sterecyt (kombination leu­ keran och steroid), 2-CdA (nukleosidanalog) eller cyklofosfamid. Strål­ behandling används också som lindrande behandling t.ex. mot stora lymfom. Högmaligna lymfom: Vid lokaliserade högmaligna lymfom (stadium I och IE) ges strålbehandling i kurativt syfte. Behandlingen omfattar engage­ rad lokal med närmast angränsande station till 44 Gy. Cytostatikabehand­ ling ges till stadium II-IV. Standardregimen är CHOP (Cyklofosfamid, doxorubicin, vincristin och deltison) i åtta cykler var tredje vecka. En alter­ nativ cytostatikakombination som prövats är MACOP-B. Hos yngre patien­ ter som svarar på ny kemoterapi är autolog benmärgstransplantation ett nytt intressant behandlingsalternativ. För yngre patienter, där sedvanlig cyto­ statikaterapi (t.ex. CHOP) ej botar, förstärker man nu med högdos­ behandling med stamcellsskörd. Lymfoblastlymfom: Behandlingen följer i princip riktlinjer för barn­ lymfom av respektive immunlogisk fenotyp med intratekal profylax. © Studentlitteratur 201 Kapitel 21 Uppföljning: De flesta recidiv av högmaligna lymfom sker inom de för­ sta 1–2 åren och eftersom det finns en chans att bota denna typ av lymfom syftar uppföljningen till att framförallt hitta tidiga recidiv hos dessa patien­ ter. Hos patienter med de lågmaligna lymfomen har uppföljningen mer inriktning på att hitta mer funktionshotande tumörväxt som uretärobstruk­ tion, trycksymtom, hämningar av blodbildning och infektioner. Prognos: Lågmaligna lymfom har en lång medianöverlevnad, men är i spridd form ej kurabla. Av högmaligna lymfom kureras mellan 1/3–1/2. Goda möjligheter till kuration föreligger också vid lymfoblastlymfom om patienterna utreds och behandlas snabbt. Prognostiska faktorer vid lymfom inkluderar bl.a. andelen tumörceller i proliferation (mitoser, labelling index, S-fas i DNA-histogram, Ki-67, Ki-S1) och histologisk typ (högmalign/ lågmalign/lymfoblast). Magcancer Incidens: Länder som Japan, Island och f.d. Sovjetunionen har hög före­ komst av sjukdomen. I Sverige har de norra delarna av landet en högre inci­ dens. Magsäckscancer, som i början av seklet utgjorde den vanligaste can­ cerformen i Sverige, har minskat kraftigt i incidens. Den är dock, för båda könen, världens vanligaste elakartade tumör. Cardiacancer är en lokalisa­ tion i magsäcken där man, under de senaste åren, både ute i världen och i Sverige noterat en ökning i incidens och där etiologin sannolikt skiljer sig från resten av magsäcken. Orsak: Hög fiskkonsumtion där fisk beretts på ett mer ålderdomligt sätt (saltats, gravats), nitrosaminer, blodgrupp A, atrofisk gastrit (B12-brist), magsäcksoperationer (Billroth II-operationer). Ett högt A- och C-vitamin­ intag kan verka skyddande. Möjligen ytterligare skyddseffekter av intag av gröna grönsaker. Rökningens roll osäker. En överrepresentation finns hos lägre inkomstgrupper. Heliobacter pyloriinfektioner har associerats som en bidragande faktor till karcinogenesen och slemhinneskadan. Symtomatologi: De flesta patienter har små okarakteristiska epigastrala besvär. Rapningar, hicka, fyllnadskänsla och lätt illamående. Hos 5–10 % förekommer ulcussymtom. Ytterligare 10 % har allmänsymtom med vikt­ nedgång, trötthet, blodbrist och svaghet. Obstruktionssymtom och blöd­ ningar är relativt ovanliga. Tumörbiologi: Histopatologiskt urskiljs en högt differentierad ”intestinal typ”, en odifferentierad ”diffus” eller ”gastrisk typ” och en blandtyp. Den 202 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna intestinala formen av cancer har minskat i antal gentemot den gastriska typen och detta anses bero på att den dietrelaterade intestinala formen minskar i förekomst. Män har relativt sett mer intestinal cancer och kvinnor mer diffus cancer. Den intestinala förekommer dessutom i något högre ålder. Stumpcancer uppträder efter magsäcksoperationer (framförallt BII-ope­ rationer) efter 10–15 år. Initialt är cancerförekomsten lägre men ökar sedan med ungefär 30 % vart femte år från år 10 och framåt efter operationen. Kronisk atrofi, gallreflux, ändrad bakterieflora och ökad endogen nitros­ aminbildning anses orsaka cancern. Ett stort antal patienter med screeningupptäckta magcancrar har framgångsrikt opererats vid uppfölj­ ning av tidigare magsäcksopererade. Diagnostik: Klinisk undersökning (palpation av buk, per rektum och lymfkörtelstationer inkluderande Virschoffs körtel). Ibland Fe-brist, anemi och blod i avföring. Gastroskopi med biopsier, lungröngten, CT-buk (före operation). Stadieindelning: TNM-systemet används. Early gastric cancer är endoskopiupptäckt mycket tidig magcancer lokaliserad till mucosa eller submucosa (en polypös, plan och ulcererad form särskiljs). Behandling: Vid tumör i magens övre två tredjedelar görs total gastrek­ tomi och vid cardiacancer tas också den nedre delen av esofagus. För can­ cer i den distala tredjedelen av magen kan ibland göras subtotal gastrek­ tomi. En esofagojejunostomi med en Roux-en-Y-slynga är vanlig. Lymfkörtelutrymning sker oftast av de närmast belägna körtelstationerna. Palliativ kirurgi med bl.a. Witzelfistlar och gastroenteroanastomoser är van­ liga. Endoskopiska dilatationer kan ibland ge god lindring. Uppföljning: Förutom screening för sjukdomsrecidiv behöver patien­ terna, precis som andra ventrikelopererade, övervakas ur nutritionssyn­ punkt. Substitution av Fe och vitaminerna B12 och folsyra. Det finns också ett dåligt upptag av A- och E-vitamin och fett. Prognos: Totalt lever drygt 20 % fem år. Femårsöverlevnaden har förbättrats till ungefär 40 % (30 % hos individer med körtelmetastaser annars 50 % hos N0) hos resecerade mot tidigare 15 %. Den intestinala cancern har en relativt bättre prognos än den diffusa infiltrativa. Aneuploida tumörer har sämre prognos. Närvaro av lymfocyter korrele­ rar till en bättre prognos. Njurcancer Incidens: Män har en högre förekomst av njurcancer än kvinnor 16/100 000 mot 9/100 000. © Studentlitteratur 203 Kapitel 21 Orsak: Etiologin till adenokarcinom i njuren är dåligt känd. Ett ärftligt samband kan finnas. För Wilms tumör finns en klonad suppressorgen på kromosomarm 11p13. Von Hippel-Lindaus syndrom har associerats med en gen på kromosomarm 3p. Denna gen har nyligen klonats. Patienter med Von Hippel-Lindaus syndrom löper en större risk att utveckla njurcancer. Strukturella rearrangemang av den korta armen på kromosom 3 med brott­ punkter lokaliserade till 3p11–21 är också den vanligaste kromosomför­ ändringen som konsistent har observerats vid njurcancer. En familj med anhopning av njurcancer har också uppvisat en konstitutionell balanserad translokation mellan kromosom 3 och 8 hos alla familjemedlemmar som utvecklat njurcancer. En gen, FHIT, har nyligen klonats som ansvarig för sambandet. Njurcancer uppvisar ofta deletioner av 17p (p53). Vid njur­ bäckencancer finns ett samband med högt intag av fenacetinhaltiga anal­ getika. Rökning kan vara en riskfaktor. Thorotrastexponering liksom yrkes­ exponering av asbest och kadmium är associerade med en ökad risk. Patienter med end-stage renal disease som utvecklar cystisk njursjukdom under dialysbehandling har en hög risk att utveckla njurcancer. Symtomatologi: Blödning i urinvägar, smärta i njurregion och palpabel tumor. En vanlig metastaslokal är proximala överarmsskelettet. Andra mer vanliga metastaslokaler är lungor och CNS. En hög sänkningsreaktion, feber och anemi är andra kliniska fynd. Någon gång ser man polycytemi associerad med ökad erytropoetinproduktion. Tumörbiologi: Adenokarcinom utgör 90 % av alla njurtumörer, njur­ bäckentumörer 8 % och Wilms tumör 2 %. Diagnostik: Urografi, nefroangiografi, CT, MR, finnålspunktion och ope­ rativ biopsi. Stadieindelning: TNM-klassifikationen har inte fått någon större praktisk betydelse. Större roll spelar utredning av tumörens malignitetsgrad. Behandling: Standardbehandlingen är operation (perifasciell nefrektomi samt regional lymfkörtelexstirpation). En roll för preoperativ strålbehand­ ling har diskuterats för lågt differentierade tumörer men har inte fått gene­ rellt genomslag i landet. Postoperativ strålbehandling har getts till patienter där den operativa radikaliteten varit tveksam eller ofullständig eller där lymfkörtelmetastaser påträffats. Ocklusionsbehandling genom att injicera material i a. renalis vid inexstirpabla tumörer har praktiserats. Vid generella metastaser har viss effekt uppnåtts hos 15–20 % av patien­ terna med hormonbehandling (framförallt progesteron). Remissioner har dock varit korta och kvinnor har haft mer glädje av denna behandling än män. Immunologiska metoder har också används vid njurcancerbehandling (interferon och interleukiner). Ingen av behandlingarna kan sägas vara 204 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna etablerade men hos subgrupper av patienter har tumörsvar noterats. Interleukin-2 ger tumörsvar hos 15–20 % av patienter med metastaserande njur­ cancer oavsett om behandlingen kombineras med LAK-celler (lymfo­ kinaktiverade lymfocyter) eller interferon-A. Studier som använder tumörinfiltrerande lymfocyter (TIL-celler) i kombination med IL-2 pågår. Solitära metastaser (t.ex. till skelett eller lunga) som dyker upp med ett långt recidivfritt intervall kan det löna sig att särskilt aktivt behandla (fram­ förallt med operation och/eller strålbehandling). Uppföljning: Individualiseras. Prognos: Femårsöverlevnaden vid högt differentierade tumörer är 90 % att jämföras med 10–20 % hos lågt differentierade. Malignt melanom Incidens och folkhälsobetydelse: Melanom är den tumörsjukdom som ökar mest i incidens. Risken är nu uppe i 1/90 för att få melanom någon gång i livet (I Queensland, Australien har har den vita befolkningen en risk på 1/30). Dödligheten har endast ökat obetydligt i relation till incidensen. Män upp­ visar fler melanom på bål medan kvinnor uppvisar fler melanom på extremi­ teter. Medianåldern för insjuknande är ungefär 55 år för både män och kvin­ nor (melanom inom huvud-halsområdet har medianåldern 65 år). Orsak: En rad fynd talar för att excessiv exponering för UV-ljus (solljus eller artificellt UV-ljus i sollampor och solarier) av oskyddad hud kan öka ris­ ken för melanom. Vissa konstitutionella faktorer såsom rödhårighet, blond hårfärg, lättbränd hud, antal nevi samt kongenitala och dysplastiska nevi, ökar denna risk påtagligt. Värdet av solskyddsmedel är oklart. Indirekta anta­ ganden talar för att tidig UV-exponering kan vara särskilt farlig. För mela­ nom i ansiktet hos äldre individer, s.k. lentigo maligna, spelar den kumula­ tiva UV-exponeringen sannolikt större roll än ”akuta brännskador”. En ärftlig komponent finns och i det s.k. dysplastiska nevussyndromet föreligger sannolikt en monogen nedärvning. Molekylärbiologiska studier av familjer med melanom har associerat sjukdomsrisken till kromosom 1 och 9. Två gener, p16 och CDK4, har associerats med hereditärt melanom. Ibland före­ kommer pankreascancer också i dessa familjer. Symtomatologi: Ett födelsemärke som ändrar karaktär (ökar i storlek, ändrar färg, ulcererar etc.) bör föranleda misstanke om melanom. Tumörbiologi: Tumör utgår från melanocyter (pigmentceller). Hos vissa patienter finns en nevuskomponent nära tumör vilket gör att man kan tro att tumör utgått från melanocyt i befintligt nevi. Troligtvis utgår många fram­ © Studentlitteratur 205 Kapitel 21 förallt superficiellt spridda melanom från befintliga s.k. dysplastiska nevi. Vanliga födelsemärken nybildas i huden upp till 20–30-årsåldern. Dys­ plastiska nevi nybildas även senare i livet, är större än vanliga nevi och har ofta ojämn pigmentering och ojämn gräns. Uppträder oftare på bål. Tumör kan ha olika växtsätt såsom superficiellt, nodulärt eller ulcererande. Ibland kan primärtumör uppvisa regressionsfenomen eller t.o.m. helt ha spontan­ regredierat. Man tror att detta ligger bakom att några procent av alla mela­ nom debuterar som metastaser utan känd primärtumör. Melanom har stor benägenhet att utveckla resistens för tumörbehandlingen genom mekanis­ mer som t.ex. att öka DNA-reparationsmekanismer. Enzymet O6-metylguanin-DNA metyltransferas kan utgöra en sådan resistensfaktor. Melanomcel­ ler innehåller dessutom stora mängder glutation och glutationtransferaser som kan skydda cellernas DNA för cytostatika av alkylerartyp. Diagnostik: Ett PAD-utlåtande över malignt melanom bör ta fasta på his­ togenetisk typ av melanom, invasionsnivå enligt Clark, tumörtjocklek enligt Breslow, förekomst av ulceration, mitosfrekvens/10HPF(1mm2), lymfocyt­ svar, regressionsfenomen, invasion i blod och lymfkärl, radikalitet och före­ komst av nevuskomponent. Stadieindelning: Stadium I – primärtumör och ev. satellit inom 5 cms radie. Stadium II – engagemang av regional lymfkörtel och/eller hudmetas­ tas (mellanliggande). Stadium III – spridd sjukdom med metastas bortom de regionala lymfkörtlarna. Invasionsnivåer enligt Clark; I epidermis, II papillära dermis, III gränsen papillära-retikulära dermis, IV retikulära dermis och V subcutana fettväven. Genom att mäta djupast förekommande tumörceller till granularcellslagret i epidermis anges tumörtjockleken i mil­ limeter. Lokalisation på kroppen kan också ha betydelse för sjukdomsprog­ nos. Behandling: Kirurgi är basbehandling vid lokaliserade melanom. Avlägsnande av nevi skall alltid ske med excisionsbiopsi som tillåter histo­ patologisk undersökning. Koagulationsbehandlingar av födelsemärken är ej lege artis då risk finns att man koagulerat ett melanom. Vid melanom ≤ 0,8 mm är en marginal vid den kirurgiska excisionen på 1–2 cm tillräcklig. Vid melanom 0,8 mm–≤ 2,0 mm har genomförts en prospektiv studie i landet för att utreda excisionsmarginalens roll (2 eller 5 cm). Då studien inte visat på någon skillnad i överlevnad anses 2 cm nu vara tillräcklig marginal. En likartad studie görs nu för melanom >2,0 mm för att utreda om 2 eller 5 cms marignal är optimalt. Elektiva lymfkörtelutrymningar påverkar ej överlev­ naden varför man i dagsläget ej rekommenderar sådana. Vid manifest regio­ nal lymfkörtelmetastas rekommenderas kirurgisk lymfkörtelutrymning. Adjuvant cytostatikabehandling har ej visat säkerställd effekt på överlevna206 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna den. Vid avancerad metastaserad sjukdom kan kortvariga remissioner upp­ nås hos upp till 20 % av patienterna med cytostatika som DTIC, cisplatin, vindesin och melfalan. Kvinnor svarar något lättare än män. Generellt är det lättare att uppnå remissioner om metastaser är belägna i hud, lymfkörtlar och lungor jämfört med lever, skelett och hjärna. Studier pågår nu med kombinationer av cytostatika för att ytterligare för­ söka höja remissionsfrekvensen. Perfusioner intraarteriellt av en metastastyngd extremitet med cytostatika kan ge värdefulla lokala remissioner. Kortvariga remissioner kan också ses vid behandling med interferon av framförallt subcutana melanom. Försök med specifik immunisering har gjorts utan att säkra överlevnadsvinster uppnåtts. Behandling med inter­ leukin II och LAK-celler har i selekterade mindre serier gett remissioner hos 15–20 % av patienterna. Intressanta försök pågår nu med monoklonala antikroppar med reaktivitet riktad mot antigen i melanomcell. Radioterapi har en begränsad roll vid maligna melanom. In vitro-studier talar för att höga fraktionsdoser bör ges (5Gy och mer). 60–80 % av patien­ ter med melanommetastaser behandlade med höga engångsfraktioner 1–2/ ggr vecka uppvisar objektiv regress av tumör. Uppföljning: Exempel på uppföljning: Patient med Clark I (melanoma in situ) ingen formaliserad efterkontroll vanlig. Informeras om att söka vid nya symtom. Vid melanom < 0,8 mm kontroll 4 ggr/år de första tre åren. Därefter ingen uppföljning. Informeras om att söka vid nya symtom.Vid melanom ≥ 0,8 mm kontroll 4 ggr/år de första tre åren, därefter 2 ggr/år de efterföljande 2 åren och sedan eventuellt 1 gång/år tills 10 år gått. Informe­ ras om att söka vid nya symtom.Vid varje klinisk kontroll inspekteras hud­ kostym och palperas operationsområdet och regionala lymfkörtlar. Röntgen och laboratorieundersökningar bara om symtom påkallar detta. Familjer med dysplastiskt nevussyndrom följs upp enligt speciella rikt­ linjer. Prognos: Totalöverlevnaden är efter 5 år ungefär 60–70 % (kvinnor något högre än män). Inga generaliserade melanom botas. Femårsöverlev­ naden i relation till Clark-nivå är ungefär nivå II 95 %, nivå III 82 %, nivå IV 72 % och nivå V 40 % och i relation till invasionsdjup 0–0,9 mm 95 %, 1–1,9 mm 85 %, 2–2,9 mm 72 %, 3–3,9 mm 67 %, ≥4 mm 42 %. Andra prognostiska faktorer inkluderar cellproliferation, tumörlokal (bål sämre än extremitet), tumörulceration, lymfocytsvar (frånvaro medför sämre prog­ nos) och kärlinväxt. © Studentlitteratur 207 Kapitel 21 Bröstcancer Incidens: Kvinnans vanligaste tumörsjukdom. Ungefär 1/9 kommer under sin levnad att utveckla bröstcancer. Medianåldern för insjuknande är 64 år. Bröstcancerincidensen ökar framförallt i åldersgruppen 50–70 år beroende på screeningverksamhet. En ökning sker också i yngre åldrar. Bröstcancer är något vanligare i vänster bröst och i den yttre laterala kvadranten. Orsak: Kvinnor som är nullipara, har en sen första graviditet, har en tidig menarche och en sen menopaus har en ökad bröstcancerrisk. Gemensam nämnare kan vara antalet menstruationscykler som en kvinna går igenom och att en cyklisk hormonstimulering av både östrogen och progesteron ser ut att öka risken för bröstcancer. Vidare har kvinnor som ätit p-piller en längre tid i unga år, eller som fått östrogen perimenopausalt, en ökad risk för sjukdomen. Strålbehandling i unga år mot brösten ökar också sjukdoms­ risken. Ungefär var tionde bröstcancerpatient uppvisar dessutom ett starkt ärftligt samband för sjukdomen. Ibland kan detta samband innebära att familjen uppvisar en dominant ärftlighet för bröst- eller ovarialcancer. I sådana familjer med kvinnor som insjuknar i tidig ålder särskilt i bröstcancer och äggstockscancer har den ärftliga benägenheten kopplats till en gen på den långa armen av kromosom 17. Denna gen (BRCA1) är nu klonad och mutationsscreening av genen är möjlig. En annan gen, BRCA2, som anses svara för ungefär 1/3 av hereditärt insjuknande i tidig ålder i bröstcancer, har nyligen lokaliserats till 13q 12–13 och också klonats. Familjer kopplade till BRCA2 har som delfenom uppvisat manlig bröstcancer och prostatacancer och mindre ofta äggstockscancer hos disponerade individer. Bröstcancer förekommer också som delkomponent i följande hereditära syndrom: LiFraumenis syndrom (tillsammans med sarkom, hjärntumörer, leukemi och binjuretumörer), Cowdens sjukdom (tillsammans med tricholemmom i ansiktet, papillomatos av läppar och munslemhinna, akrala keratoser, gast­ rointestinala polyper och uterusleiomyom) och Muirs syndrom (basal cells karcinom, benigna och maligna gastrointestinala tumörer). Kvinnor med benign bröstsjukdom och som speciellt har atypiska hyperplasier och en släkthistoria med bröstcancer löper stor risk att utveckla bröstcancer. Vissa andra faktorer diskuteras ur risksynpunkt. Till dessa hör alkohol­ intag, motionsidrott, och kostfaktorer som fettintag och mjölkintag. Bröstcancer kan förebyggas genom profylaktiska operationer eller genom kemoprevention. Genom att operativt avlägsna bröstet reducerar man kraftigt risken för bröstcancer men eliminerar den inte helt. Subkutana mastektomier är ett sämre alternativ då vävnad lämnas bakom bröstvårta, i kanter och uppåt axill. Även vid en profylaktisk mastektomi kan vävnad bli 208 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna kvarlämnad i kanter och uppemot axill. Ooforektomi halverar sannolikt ris­ ken att få bröstcancer. Kemoprevention med antiöstrogen, t.ex. i form av tamoxifen, reducerar bröstcancerincidensen med 40 % i det kontralaterala bröstet efter en bröstcanceroperation. Stora kemopreventionsstudier av högriskpatienter med tamoxifen pågår nu i USA, England och Italien. Adjuvant kemoterapi (givet t.ex. som CMF) halverar också bröstcancerinci­ densen i kontralaterala bröstet. Symtomatologi: Många kvinnor med bröstcancer är nu mammografiskt upptäckta genom den organiserade bröstcancerscreeningen. Det vanligaste tumörstadiet vid sjukdomspresentation är nu stadium I. Andelen kvinnor som kommer med mycket stora tumörer har inte ändrat sig utan utgör unge­ fär 3–5 %. Däremot har en förskjutning skett från stadium II–III till stadium I. Symtomatiska tecken på bröstcancer inkluderar bl.a. knuta i bröstet, indragning av hud, eksem på bröstvårta, smärta från bröst, svullnad i arm­ håla, peau de orange i huden och ulceration. Tumörbiologi: Bröstcancerspridning sker ej preferentiellt tumör-lymf­ körtel-ut i kropp. Att tumör diagnostiseras i lymfkörtel mäter istället en tumörbörda vid den givna tidpunkten och även den lilla tumören kan ha en benägenhet att sprida sig. Bröstcancerceller har en förkärlek att metastasera till lungor, lever, binjurar, hud, äggstockar och skelett. Vissa onkogener är oftare amplifierade vid bröstcancer som c-myc, her2-neu och int-2. På kro­ mosom 1, 16, 17 och 22 antas viktiga suppressorgener vara belägna. Diagnostik: Randomiserade studier har visat att screening med mammo­ grafi kan reducera dödligheten i bröstcancer för kvinnor över 50 år. Vinster med mammografi för kvinnor under 50 år är osäkra. Vid undersökning av misstänkt tumor (ej palpabel) brukar i samband med mammografi s.k. indikering vid hålplatta utföras för finnålspunktion. Lokaliseringen av tumörvävnad kan förbättras genom injektion av färg­ ämne och bruk av nålar. Postoperativ röntgen av opererad vävnad rekom­ menderas för att öka säkerheten att mammografiskt synlig tumör bortopere­ rats. Vid palpabel tumör görs efter mammografi finnålspunktion mot misstänkt palpfynd/tumorområde. Vid trippeldiagnostik uppnås en hög diagnostisk säkerhet. Kirurgiska exstirpationer och biopsier är viktiga vid utredning. Nya metoder för bröstdiagnostik som NMR, ultraljud och laser­ undersökning är under utveckling. Tumörmarkörer som Ca 15–3 kan vid uppföljning vara av värde men mer sällan vid diagnossättandet i sig. Flera system för att klassificera brösttumörer histopatologiskt finns. De stora grupperna enligt WHO-indelningen är duktal cancer, lobulär cancer, medul­ lär cancer, kolloid cancer, comedocancer och papillär cancer. Linells klassi­ fikation är en annan ofta använd klassifikation. © Studentlitteratur 209 Kapitel 21 Stadieindelning: T0 inga tecken till primärtumör, Tis karcinoma in situ, T1 ≤ 20 mm, T2 >20 mm-≤50 mm, T3 >50mm, T4 om överväxt i hud eller bröstkorgsvägg. N0 inga regionala lymfkörtelmetastaser, N1 ipsilateralt rör­ liga axillmetastaser, N2 ipsilateralt fixerade axillmetastaser och N3 ipsi­ lateralt mammariainterna metastaser. M0 inga fjärrmetastaser. M1 fjärr­ metastaser (inkluderar även metastaser i fossa supraclavicularis). Stadium 0 Stadium I Stadium II Stadium III Stadium IV T N M Tis T1 T0 T1 T2 T2 T3 T3 T0–4 T0–4 T4 T0–4 N0 N0 N1 N1 N0 N1 N0 N1 N2 N3 alla N N0–3 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M1 Behandling: Bröstcancer behandlas kirurgiskt, hormonellt, med cytostatika och med högdos cytostatika med autolog benmärgstransplantation. Andra terapimodaliteter på experimentell bas inkluderar behandling med inter­ feron och monoklonala antikroppar. En genomgående trend i kirurgin är att allt mindre primära operationer (mer konservativa operationer) har utförts utan att patientöverlevnaden har komprometterats. Strålbehandlingen har till uppgift att reducera antalet lokalrecidiv men påverkar inte alls eller mar­ ginellt totalöverlevnaden i sjukdomen. Överlevnadsvinster har påvisats med adjuvant cytostatika (premenopausala kvinnor), adjuvant hormonterapi (antiöstrogen-postmenopausala kvinnor) och adjuvant ooforektomi. Frek­ vensen av symtomgivande skelettmetastaser kan påverkas genom terapi med bifosfonater (ej säkert överlevnadsvinst visad). Strålbehandling mot skelettmetastaser minskar/upphäver smärta hos 70 % av patienterna under 6 månader. Den terapeutiska vinsten av högdos cytostatiska med autolog ben­ märgstransplantation hos högriskpatienter (patienter med mer än 10 lymfkörtelmetastaser) är ännu ej visad men är föremål för studier. Stadium I opereras antingen med ablatio och axillutrymning (då ingen efterbehandling med strålterapi) eller med bröstbevarande kirurgi (segmen210 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna tresektion med axillutrymning åtföljt av strålterapi mot bröstparenkymet). Vid stadium II görs ablatio mammae med axillutrymning åföljt av adjuvant kemoterapi (CMF) eller hormonterapi (antiöstrogen). Vid tumörer upp till 3 cm kan man även överväga segmentresektion. Stadium III behandlas som ovan. Neoadjuvant kemoterapi kan vara aktuell. Postoperativ strålterapi. Vid stadium IV kan kemoterapi övervägas som första terapi. Lokala åtgär­ der kan övervägas (strålterapi och/eller operation). CMF eller lågdos epiru­ bicin eller adriamycin är vanliga cytostatikaval. Bröstcancer utan lymfkörtelmetastaser (N0) består av en stor grupp patienter med god prog­ nos och en mindre grupp patienter som senare utvecklar fjärrmetastaser. Med hjälp av tumörstorlek, progesteronreceptor och procentuella andelen celler i S-fas (uppskattat oftast från flödescytogram) kan man med ett prog­ nostiskt index definiera en högrisk grupp för sjukdomsrecidiv bland de körtelnegativa patienterna. En randomiserad studie pågår nu i landet för utröna om adjuvant kemoterapi till denna grupp förbättrar prognosen. Nuclear grading enligt Nottinghamskalan kan vara ett viktigt alternativt prognostiskt instrument. Recidiv av tumörsjukdomen behandlas enligt följande grova riktlinjer. Ett lokalrecidiv (uppträder hos omkring 4 % av tidigare strålbehandlade patien­ ter och hos 25–30 % av icke-strålbehandlade patienter) kan behandlas med reexcision, ev. ny strålbehandling med eller utan hypertermi. Om det tidi­ gare ej givits strålbehandling ges denna efter recidivoperationen eller som tillägg till annan behandling om operation ej kan utföras. Det kan vara aktuellt att ge tilläggsbehandling med cytostatika eller genom en hormonell manipulation (t.ex. antiöstrogen, progestin, LHRH-analog, kastration). Fjärrspridning av sjukdomen behandlas hos äldre kvinna ofta med endo­ krinterapi (antiöstrogen eller med progestiner om sjukdom recidiverat på antiöstrogen). Sannolikheten för att patientens tumör skall svara på endo­ krinbehandling ökar med längden av det recidivfria intervallet, om tumör är högt differentierad, om primärtumör har hög hormonreceptorhalt och låg cellproliferation, om tumör tidigare svarat på endokrinterapi och om individ är äldre än 50 år vid diagnos (postmenopausal). En tumör med låg differen­ tiering, snabb tillväxt och låga hormonreceptorer hos en ung kvinna lämpar sig bättre för kemoterapi. Vanliga kemoterapikombinationer är FEC (farmo­ rubicin, cyklofosfamid och 5-fluorouracil) och CMF (sendoxan, metotrexat och 5-FU). Ett alternativ till kombinationsbehandling är veckovis behand­ ling med adriamycin eller farmorubicin. Uppföljning: Efter primärbehandlingen för bröstcancer inkluderar upp­ följningen kliniska kontroller (viktigt är att utesluta lokalrecidiv, ny tumör i andra bröstet eller fjärrspridning), mammografi årligen av icke-abladerade © Studentlitteratur 211 Kapitel 21 bröst, och vid behov lungröntgen. Lungröntgen görs dessutom efter strål­ terapin för att utesluta pneumonit (svår strålreaktion). Skelettscintigram hos asymtomatiska patienter är inte av värde och har därför under senaste åren slopats i rutinuppföljningen och förbehålls individer med symtom. Blod­ prover av leverfunktion tas regelbundet. Ca 15–3 är en tumörmarkör som visat sig ha en viss roll särskilt vid bröstcancer och studier pågår för att definiera dess definitiva roll. Prognos: Vid stadium I är femårsöverlevnaden ungefär 90 %, vid sta­ dium II 77 %, vid stadium III 50 % och vid stadium IV 15–20 %. Patienter med bröstcancer fortsätter att avlida i bröstcancer även 25–30 år efter primärdiagnosen, vilket har fått vissa pessimistiska forskare att yttra att man aldrig kan bota bröstcancer. I en internationell översikt har Early Breast Cancer Trialists’ Collaborative Group genom metaanalys av bröst­ cancerstudier visat att användning av kombinationscytostatika signifikant reducerade både risken för recidiv i bröstcancer och död hos premenopau­ sala kvinnor (t.ex. 37 % reduktion i årliga oddsen att få ett recidiv). Två års behandling med tamoxifen reducerar med 30 % den årliga oddsen att få ett recidiv postmenopausalt, med 27 % den årliga oddsen att få ett recidiv pre­ menopausalt. Motsvararnde överlevnadsvinst var 20 %. Kombination av tamoxifen och cytostatikabehandling gav inget ytterligare i behandlings­ värde. Speciella former av bröstcancer Gravida och unga kvinnor Bröstcancer hos unga kvinnor (kvinnor yngre än 35 år vid diagnos) har en sämre prognos än hos andra kvinnor med bröstcancer. Speciellt dålig prog­ nos har bröstcancer som diagnostiseras under en graviditet. Män Bröstcancer kan uppträda hos män (1/100 fall är män). Sjukdomen har ungefär samma prognos som hos kvinnor. På grund av männens mindre bröst debuterar cancersjukdomen ofta med ett högre tumörstadium än hos kvinnor. Trots detta är totalöverlevnaden likartad mellan män och kvinnor. Detta innebär att TNM-klassifikationen inte har samma prognostiska inne­ börd som hos kvinnor, särskilt för hud- och bröstkorgsfixation av tumören. Männens brösttumörer uppvisar dessutom två biologiska skillnader mot 212 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna kvinnors; dels saknas lobulära cancrar och dels är andelen hormonreceptor­ rika tumörer större än hos kvinnor. Behandlingen bedrivs likartat. Endo­ krina manipulationer inkluderar bruk av antiöstrogener, LHRH-analoger och ablativa ingrepp av testis. Tjocktarmscancer (se tjocktarm och rektum, s. 192) Livmodercancer Incidens: Incidensen har de senaste 10–20 åren ökat något. Medianålder vid insjuknande ligger nära 65 år. Orsak: Tillförsel av östrogen utan progesterontillägg perimenopausalt ökar risken för endometriecancer. Vidare löper kvinnor som är överviktiga, har högt blodtryck och som har diabetes en högre risk för livmodercancer. Här tror man att en ökad endogen syntes av östrogen ifrån fettväv kan ha etiologiskt betydelse. Progesteron har en hämmande effekt på endometriet och teorin har framförts att endometrierisken är kopplad till ”unopposed estrogen excess”. Östrogen med cykliskt tillägg av progesteron minskar ris­ ken för uteruscancer. Behandling med partiella antagonister/agonister för östrogen som tamoxifen ökar risken för endometriecancer. Detta tros bero på att tamoxifen verkar på uterusslemhinnan som ett östrogen medan den i vissa andra vävnader fungerar som ett antiöstrogen. En liten del av liv­ modercancer kan ha samband med germlinemutationer i mismatch-repair­ gener ansvariga för hereditär icke polyposrelaterad koloncancer. En livs­ tidsrisk på över 40 % för endometriecancer har beskrivits för anlagsbärarna i dessa familjer. Symtomatologi: Det vanligaste symtomet är en postmenopausal blöd­ ning. Tumörbiologi: I 70 % av alla fall är tumör lokaliserad till uterus och högt och medelhögt differentierade tumörer dominerar. Spridning sker sent till iliakala och paraaortala lymfkörtelstationer. Hematogen spridning kan ske till lungor och, mer ovanligt, till skelett. Till prognostiska faktorer hör infil­ trationsdjup i myometrium, differentieringsgrad, histologi och DNA-ploidi. Diagnostik: Varken en vanlig klinisk undersökning eller cytologprov från vagina eller cervix brukar vanligtvis avslöja livmodertumören. Fraktionerad skrapning är standardmetod för att erhålla patologiskt material. Med endo­ metrieaspiration etc. har också nyare cytologiska hjälmedel tillkommit © Studentlitteratur 213 Kapitel 21 vilka höjt den cytologiska undersökningens träffsäkerhet. Ultraljud med mätning av livmoderväggens tjocklek är ett viktigt diagnostikum. Stadieindelning: Stadium I – karcinom begränsad till corpus. Stadium II – karcinom som involverar cervix men som inte sträcker sig utanför liv­ moder. Stadium III – karcinom utanför livmoder men ej utanför bäcken; kan involvera vagina. Stadium IV – karcinom som involverar slemhinna i ändtarm eller blåsa och/eller sträcker sig utanför bäckenet. Behandling: Tidig uteruscancer kan behandlas med antingen operation eller strålbehandling eller en kombination av båda (uterusexstirpation följd av bestrålning av vaginalslemhinna) beroende på den lokala terapitraditio­ nen. De senaste åren har patienter med tidig uteruscancer börjat stratifieras i prognostiska faktorer med avseende på högrisk respektive lågrisk för sjuk­ domsrecidiv. Lågriskpatienterna har då enbart genomgått operation medan högriskfall erhållit kombinerad behandling eller deltagit i randomiserade studier. Ibland behandlas även lymfkörtelstationer i bäckenet med strål­ terapi. I mer avancerade tumörstadier kombineras kirurgi och strålbehand­ ling med progesterontillförsel eller kemoterapi. Intrakavitär brachyterapi med radium, cesium eller iridium är en effektiv strålbehandlingsform vid uteruscancer. Vaginal brachyterapibehandling kan ges i anslutning till de intrauterina behandlingarna. Extern strålterapi ges i 20 fraktioner/40 Gy. Vid recidiv och vid avancerat kliniskt stadium kan progesteron- eller anti­ östrogenterapi vara aktuell företrädesvis styrt av receptorstatus. Cytostati­ kabehandling kan komma ifråga inom ramen för randomiserade studier både hos högriskpatient med tidig uteruscancer och vid avancerad tumör­ sjukdom. Till de mest använda preparaten hör farmorubicin och cisplatin. Uppföljning: Klinisk undersökning och vid behov palpation i narkos, CT-buk och lungröntgen. Prognos: Efter fem år lever ungefär 75 % av patienterna. Om sjukdomen är lokaliserad till endometriet är prognosen mycket god med en femårsö­ verlevnad på 90–95 %. Lungcancer (se s. 189) Äggstockscancer Incidens: Ovarialcancer är den tredje vanligaste tumören bland kvinnor. Medianåldern vid insjuknande varierar mellan 60–64 år beroende på stude­ rat material. Från 1970 och framåt ses en svag minskning av incidensen i landet. Nordeuropa är ett högriskområde för ovarialcancer. 214 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna Orsak: Antalet ovulationer har, i epidemiologiska studier, utpekats som en trolig riskfaktor. Mikrotraumat till äggstockens epitel vid varje ovulation anses öka dess celldelningen och en ökad celldelning är associerad med en ökad risk för cancer. Faktorer som hämmar antalet ovulationer, såsom t.ex. bruk av p-piller, verkar delvis skyddande mot ovarialcancer. Profylaktisk ooforektomi reducerar också risken för ovarialcancer och bör allvarligt övervägas tillsammans med hormonsubstitution vid rutinbukingrepp hos kvinnor som är 45 år och äldre. Ett ärftligt samband mellan bröst- och ova­ rialcancer har nyligen påvisats vid familjestudier och en gen BRCA1 belä­ gen på kromosomarm 17q har klonats. Denna gen anses svara för tumörsin­ sjuknandet i 90 % av alla hereditära bröst- och ovarialcancerfamiljer och för 40 % av tidigt debuterande hereditär bröstcancer med monogen nedärv­ ning. Ovarialcancer är dessutom överrepresenterad hos mutationsbärare för mismatch repair generna, p 53 och BRCA2. Symtomatologi: Symtom ofta sent. Ofta okarakteristiska diffusa buk­ symtom. Ett av de vanligare sena symtomen är ett ökat bukomfång som kan orsakas av antingen ascites eller en stor lokal tumor. Tumörbiologi: C:a 80–90 % av tumörerna utgår från ovariernas ytepitel. Dessa tumörer indelas i serösa, mucinösa, endometroida, klarcelliga och odifferentierade karcinom. Tumörerna saknar motsvarighet hos testikel­ tumörerna och är resistentare mot kemoterapi vilket förklarar att ovarial­ cancer, trots modern kemoterapi, har betydligt sämre prognos än testikel­ cancer. En mindre andel tumörer uppstår från stromaceller i ovariet (10 %). Den vanligaste tumören av detta slag är granulosa-tekacells-tumör. Från germinalepitelet utgår tumörer som dermoidcystor, dysgerminom och endodermala sinustumörer. Diagnostik: Preoperativt utföres palpation i narkos, lungröntgen, abrasio, ultraljudsundersökning och tumörmarkörer (t.ex. Ca-125). Populationsbaserad screening med ultraljud med färgdoppler (vaginalt) och Ca-125 undersöks i en randomiserad internationell studie. Stadieindelning: FIGO-systemet används för stadieindelning. Stadium I – tumörväxt begränsad till ovarierna, Stadium II – tumörväxt involverande ett eller båda ovarierna med utbredning utanför desamma i lilla bäckenet, Stadium III – tumör engagerande det ena eller båda ovarierna med intra­ peritoneala metastaser utanför lilla bäckenet eller positiva retroperitoneala lymfkörtlar. Tumör begränsad till lilla bäckenet med histologiskt bekräftad metastas till tunntam eller oment, Stadium IV – tumörväxt engagerande ett eller båda ovarierna med fjärrmetastaser. Differentieringsgraden av tumö­ ren har också betydelse för prognos och behandling. © Studentlitteratur 215 Kapitel 21 Behandling: Primärbehandlingen är kirurgisk. Principen vid ovarial­ canceroperationen är att så mycket tumör som möjligt avlägsnas. För att undvika felaktigt tilldelat lågt stadium av tumören vid operationen palperas buken inklusive leverns ovansida och pleurakupolen. Bukhålan sköljes rutinmässigt för cytologi, resektion av omentum majus infracoliska del vil­ ken är predilektionsställe för metastasering, och provexcisioner av perito­ neum utföres. Kirurgi kan även komma ifråga senare i form av borttagande av kvarvarande tumörmassor efter den primära operationen eller efter reci­ div (tumörreducerande kirurgi), exploration av buken görs ofta i samband med kemoterapistudier för att utröna behandlingseffekt (s.k. second look operation) och palliativa ingrepp. Cytostatikabehandlingen, som tidigare gått ut på att använda melfalan som ”single”-behandling, har under 1980-talet utvecklats så att kombina­ tionsbehandling baserad på cisplatin blivit standardbehandling. En analog till cisplatin, carboplatin (paraplatin) har allt mer ersatt cisplatin under senare år pga. av mindre oto-, nefro- och neurotoxicitet. Vid dosberäk­ ningen av carboplatin använder man iohexol plasmaclearance. Femårsöver­ levnaden vid avancerad ovarialcancer (stadium III–IV) har höjts från 10 % med ”single”-behandling till 25 % med kombinationsbehandling. Strålbe­ handling ges ibland i palliativt syfte. Uppföljning: Inbegriper kliniska undersökningar, palpation i narkos och vid behov ultraljud, CT-buk och lungröntgen. Vid uppföljningen kan tumör­ markören Ca-125 också vara av värde. Familjer med hereditär bröst/ ovarialcancer behöver följas upp och behandlas på ett speciellt sätt (se avsnitt om hereditär cancer). Prognos: Femårsöverlevnaden är för alla patienter ungefär 40 %. Yngre patienter (<45 år) har en bättre överlevnad med en femårsöverlevnad på ungefär 70 %. För stadium I är femårsöverlevnaden 80 % och för stadium III–IV högst 25–30 %. I studier prövas nu om adjuvant behandling med car­ boplatin förbättrar sjukdomsprognosen vid stadium I (medelhögt diff. och lågt diff. tumör). Stadium II-IV erhåller carboplatin och cyklofosfamid i 6– 8 kurer beroende på remissionstatus. I forskningsprogram studeras betydel­ sen av DNA-mätningar och onkogenanalyser. Vidare studeras borderline ovarialtumörer i relation till prognostiska faktorer. Taxol har registrerats vid recidiv av ovarialcaner och utreds f.n. som pri­ mär kemoterapi i kombination med bl.a. cisplatin. 216 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna Ändtarmscancer Hudcancer (se tjocktarm och rektum hos män, s. 192) (se s. 198) Malignt lymfom (se s. 199) Malignt melanom (se s. 205) Nervsystemets tumörer Incidens: I Sverige inträffar ungefär 1 200–1 300 nya tumörer i nervsyste­ met per år. Hälften av dessa tumörer är gliom. En svag ökning pågår i inci­ densen. Hos barn utgör hjärntumörer 1/4 av alla maligna tumörer. Orsak: Etiologin till hjärntumörer är dåligt känd. Hjärntumörer förekom­ mer som delkomponent i vissa hereditära tumörsjukdomssyndrom (t.ex. LiFraumenis syndrom, von Hippel-Lindaus syndrom). Bland mer miljö­ betingade faktorer har diskuterats skalltrauma, exponering för joniserande strålning, exponering för kemikalier (kemister ökad risk) och exponering för elektromagnetiska fält. Symtomatologi: Är beroende av tumörens lokalisation. Förlamningar, känselnedsättningar, epilepsianfall och talsvårigheter är vanliga som debut­ symtom. Symtom på högt intrakraniellt tryck inkluderar huvudvärk, illa­ mående och kräkningar (särskilt projektillika morgonkräkningar). Senare synpåverkan och påverkan på vakenhetsgrad, andning och cirkulation. Tumörbiologi: Lymfogen eller hematogen spridning utanför CNS, från primära tumörer i CNS, är mycket sällsynt. Spridning av tumörceller kan dock ske via likvorrummet. Nervvävnad kan ej regenerera varför även benigna tumörer, pga av deras lokalisation, ibland ej kan opereras. Supra­ tentoriella tumörer förekommer oftare hos vuxna jämfört med infraten­ toriella (tumörer i bakre skallgrop). Av de primärt intraspinala tumörerna utgörs de flesta av neurinom, meningeom och gliom. I perifera nervsyste­ met förekommer maligna schwannom och neuroblastom. Diagnostik: Kliniskt status, kraniell datortomografi (CT) eller magnet­ resonansundersökning (MR) av CNS. MR har mycket stor betydelse vid © Studentlitteratur 217 Kapitel 21 diagnostik av förändringar i bakre skallgrop eller i spinalkanal. Stereo­ taktiska biopsier för diagnos kan vara aktuella. Gliom indelas histopatologiskt i astrocytom grad I–III och glioblastoma multiforme. Behandling: Gliom Före operationen kan det vara aktuellt med tryckavlastande åtgärder såsom insättande av högdos steroider etc. Observera risker med lumbalpunktion hos patienter med tumör i temporallob eller i bakre skallgrop (risk för inklämning). Operation är primärbehandling av de flesta hjärntumörer. Så extensiv resektion som möjligt eftersträvas även om det ofta är omöjligt att få större marginaler. Operationsmikroskop utnyttjas ofta för att förfina dis­ sektion mellan normalvävnad och tumör. Postoperativt hos yngre patienter ges ofta strålbehandling mot CNS (t.ex. 58 Gy mot opererad sida och 50 Gy mot kontralateral sida). Vid ependymom och medulloblastom behandlas hela CNS och spinalkanalen eftersom dessa tumörer har stor benägenhet att sprida sig i likvorrum. Värdet av cytostatikabehandling är osäkert. CCNU (Lucostine) är ett ofta använt cytostatika till gliompatienter. Meningeom Kan ofta opereras radikalt. Vid recidivbenägenhet kan strålbehandling bli aktuell. Hos patienter, och anhöriga till patienter, med hjärntumörer är det av utom­ ordentlig betydelse att ha en psykosocial stödorganisation uppbyggd. Sjuk­ domen är ofta mycket svår. Komplikationer till sjukdomen och behand­ lingen kan vara svåra. Familjen kan ställas inför svåra sociala och ekonomiska problem. Uppföljning: Vid uppföljningen kontrolleras neurologstatus, ibland CT eller MR. Speciell uppmärksamhet riktat på symtom på intrakraniellt tryck. Kontroller sker ungefär var tredje månad hos patienter med de malignare formerna av hjärntumörer och 1–2 ggr. per år hos patienter med de mer godartade tumörerna. Patienter medicinerar med antiepileptika. Prognos: Överlevnaden har förbättrats något för de mer benigna for­ merna av hjärntumörer (oligodendrogliom och astrocytom) medan de 218 © Studentlitteratur Något om de tio vanligaste tumörsjukdomarna malignare formerna av hjärntumör har oförändrad dålig prognos. För astro­ cytom grad I är överlevnaden flera år, för grad II är femårsöverlevnaden 20– 30 %, för grad III och IV är överlevnaden utan strålbehandling ungefär 6 månader och efter strålbehandling förlängs sannolikt överlevnaden till 10– 12 månader. Yngre patienter verkar ha störst nytta av denna behandling. Vid radiosensibla tumörer som medulloblastom och ependymom har femårsö­ verlevnaden stigit till över 50 %. © Studentlitteratur 219 22 Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns Testistumörer Testistumörer klassificeras histopatologiskt i seminom och i icke-seminom. Överlevnaden i sjukdomen har dramatiskt förbättrats från 20 % på 1960-talet till över 90 % på 1990-talet. Medelinsjuknandeålder är tio år tidigare för icke-seminom än för seminom (25 versus 35 år). Testiscancerincidensen ökar kraftigt i hela den industrialiserade världen. Livstidsrisken är ungefär 1 på 500. Kaukasier har en högre risk att få testiscancer än färgade. Speciellt hög incidens har Danmark, västra Sverige och kustnära sydliga delar av Norge. Orsaken till testistumörer är endast delvis känd. Släktfaktorer är viktiga även om en nära anhörig med testikelcancer endast förekommer i 3–5 % av alla insjuknade fall. Nyligen har stöd erhållits för att en vanligt förkommande recessiv gen kan vara en viktig sjukdomsorsak. Sjuk­ domspenetransen skulle dock vara så låg som mellan 45–50 %. En tidigare icke-nedvandrad testikel (ungefär 10 % av alla testiscancerpatienter), hydrocele eller mediala ljumskbråck är också riskfaktorer. En hypotes är att faktorer hos modern under graviditeten är av betydelse för att skapa en abnorm hormonmiljö hos fostret tidigt i livet (t.ex. obesitas hos modern, kraftig viktuppgång, östrogenterapi). Risken för testiscancer är ökad både i den icke nedvandrade testikeln och i den nedvandrade testikeln. Det är kon­ troversiellt om en operation (orkidopexi) av en icke-nedvandrad testikel tidigt i barndomen påverkar risken för testiscancer. Den kraftiga ökningen av cancerincidensen kan göra att det kan finnas ytterligare, okända faktorer, som kan ha betydelse för cancerinsjuknandet. Seminom och icke seminom förekommer i ungefär samma frekvens. Gulesäckstumörer, en typ av non-seminom, är den vanligaste testistumören hos barn. Hos vuxna förekommer den oftast i kombination med andra tumörformer och är då ansvarig för produktion av AFP (alfa-fetoprotein). AFP produceras inte i rena seminom. Syncytiotrofoblastelement i seminom och non-seminom är ansvariga för produktionen av ß-HCG (humant cho­ rion-gonadotropin). Fem till tio procent av seminomen har förhöjda ß-HCG medan AFP och/eller ß-HCG produceras i 85 % av non-seminom. 220 © Studentlitteratur Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns Halveringstiden för en tumörmarkör är viktig för bedömningen av behandlingseffekt. Halveringstiden för AFP är 5–7 dagar och för ß-HCG 24–36 timmar. Ett specifikt cytogenetiskt fynd vid testiscancer, nämligen en isokromo­ som för den korta armen på kromosom 12, i(12p), förekommer i 90 % av hittills undersökta tumörer hos både seminom- och icke-seminompatienter. I övrigt har tumörerna triploida eller tetraploida kromosomtal. Det vanligaste symtomet vid testiscancer är en ensidig testissvullnad eller förhårdnad. Smärta förekommer som debutsymtom endast hos 10 %. I sällsynta fall kan infertilitet vara orsak till att man hittar tumören. Gyne­ komasti hittas vid diagnos hos 5 % av patienterna. I omkring 10 % är det metastaser som är debutsymtom (halstumor, andningsbesvär, gastrointesti­ nala symtom eller ryggsymtom). Vid utredningen av testisresistens görs ultraljud. Testistumörmarkörer tas före en eventuell operation. Ablatio testis görs för att fastställa diagnos (his­ topatologiskt) och utgör dessutom en viktig del i behandlingen. Operatio­ nen görs med radikal inguinal orkiektomi med tidig avbindning av sädes­ ledare, blod- och lymfkärl. Differentialdiagnoser till testiscancer inkluderar testistorsioner, epidymiditer, orkiter, hydrocele, bråck, hematom, och sper­ matocele. CT-buk och lungröntgen ingår i utredningen. Ibland kompletteras lungröntgen med CT-thorax. Hos ungefär 25 % av patienterna med retro­ peritonela lymfkörtelmetastaser syns metastaser ej på CT (dokumenterade senare vid retroperitoneal lymfkörtelutrymning). Syns däremot förstorad lymfkörtel med CT-buk har detta högt positivt prediktivt värde. Retro­ peritoneal lymfkörtelutrymning kvarstår därför som den basundersökning som bäst kan skilja stadium I och II av testiscancer åt. Stadieindelning (enl. Royal Marsden): Vid stadium I finns inga metasta­ ser. Stadium II har lymfkörtelmetastaser abdominellt. Vid stadium III finns lymfkörtelmetastaser supradiafragmalt och vid stadium IV finns extralym­ fatisk metastasering (oftast lungor). Behandling av seminom. Ablatio testis är primärbehandling. Adjuvant strålbehandling ges mot ipsilaterala iliakala lymfkörtlar och paraaortalt till 30 Gy på 17 fraktioner vid kliniskt stadium I. Vid små lymfkörtelmetastaser retroperitonealt (stadium IIA/B) ges strål­ behandling mot samma fält till 40 Gy. Vid stadium II–IV ges 4 cykler kemoterapi, BEP (bleomycin, etoposid och cisplatin). Uppföljningen inriktar sig på att hitta tidiga recidiv eftersom recidiv­ behandling också kan leda till bot. Recidiv är sällsynta och om de uppstår diagnostiseras de flesta inom de första 3 åren. Hjälp har man av att följa © Studentlitteratur 221 Kapitel 22 tumörmarkörena ß-HCG, PLAP och S-LD om dessa var förhöjda från bör­ jan. Prognosen vid seminom är mycket god med femårsöverlevnad för stadium I på 95–100 %, för stadium II på 90 % och för stadium III–IV på 70–80 %. Behandling av non-seminomatös cancer. Patienter, där metastaser ej påvisats (= CS I): efter orkiektomi indelas patienterna i riskgrupper som baseras på förekomst av tumörväxt i kärl och om preoperativt AFP är för­ höjt. Lågriskgruppen behandlas med expektans och intensiv uppföljning (kliniska kontroller, röntgen lungor, CT-buk och testismarkörer). Hos inter­ mediär riskgrupp görs unilateral lymfkörtelutrymning. Om denna inte visar på metastaser följes patienten med täta kontroller enl. ovan. Finns metasta­ ser mikroskopiskt ges cytostatika (BEP i tre cykler). Högriskgruppen erhåller direkt 3 cykler BEP. Patienter med kliniskt stadium II–IV ges 4 cykler BEP åtföljt av retroperitoneal lymfkörtelutrymning. Om inga metas­ taser påvisas följer intensiv uppföljning. Skulle metastaser påvisas ges ytterligare kemoterapi i några cykler. Om patient progredierar på standard­ kemoterapi kan ytterligare bestående remissioner erhållas med ifosfamid, vinblastin och cisplatin (VIP) hos enstaka patienter. Man prövar nu om högdosbehandling med stamcellsskörd kan förbättra prognosen för patien­ ter som får återfall efter BEP-behandling. Prognosen för patienter med icke-seminom är god. Stadium I har en fem­ årsöverlevnad på 95–100 %, stadium II 85–95 %, stadium III 85 % och sta­ dium IV 70 %. Seneffekter efter BEP-behandling inkluderar bl.a. infertilitet i 50 % av fallen, Raynauds fenomen och pneumonit. Risken för terapiinducerade sekundärtumörer är hittills låg. Den retroperitoneala lymf­ körtelutrymningen kan leda till skador på autonoma nerver och åtföljande retrograd ejakulation och infertilitet. Hodgkins sjukdom Sjukdomen definierades 1832 av Thomas Hodgkin. Till skillnad från nonHodgkins sjukdom uppträder Hodgkins sjukdom nästan uteslutande i lymf­ körtlar efter en mer eller mindre definerad spridningsmodell. Man har haft svårt att karakterisera/definiera tumörcellen vid sjukdomen. Det har i omgångar också ansetts att sjukdomen representerar en okontrollerad benign immunproliferation. För närvarande tror de flesta att sjukdomen representerar en verklig tumörssjukdom men att sjukdomen är heterogen. Ibland är en T-cellsderiverad lymfocyt tumörcell och ibland en annan typ av 222 © Studentlitteratur Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns lymfocyt. De maligna cellerna tros utgöra en minoritet av celler i tumören vid Hodgkins sjukdom vilket har ökat svårigheterna i tumörcellens karakte­ risering. De celler som lockas till tumören av lymfokiner, är en blandning av normala celler (lymfocyter, eosinofila leukocyter, plasmaceller etc.). Ett annat dilemma är att den histopatologiska definitionen av sjukdomen san­ nolikt har ändrats genom att vissa subgrupper som tidigare kallades Hodg­ kins sjukdom nu, med immunfenotypning, överförts till non-Hodgkinlym­ fom (t.ex. Lennert lymfom, malign histiocytos). Sjukdomen har sedan en tid minskat i incidens medan non-Hodgkinlymfom istället ökat. Patologer har också, både sinsemellan och mellan olika tidsperioder, haft stora svårig­ heter att standardisera diagnossättandet. Exempelvis omklassades diagno­ sen på ungefär hälften av fallen som tidigare kallats Hodgkins sjukdom i ett material från norra Sverige från 1970-talet. Sjukdomen indelas histologiskt i fyra undergrupper; lymfocytär predomi­ nans (lymfocytic predominance), nodulär skleros (nodular sclerosis), blan­ dad typ (mixed cellularity) och lymfocytär utarmning (lymfocytic depletion). Sjukdomen har en bimodal åldersfördelning med en topp vid 20 års ålder (f.a kvinnor med nodulär skleros) och igen ökad incidens efter 40-årsåldern. I mindre industrialiserade utvecklingsländer drabbas fler barn än ungdomar av tumören (fler har också blandad typ). Utredningen och stadieindelningen följer i princip samma riktlinjer som vid non-Hodgkinlymfom (se non-Hodgkinlymfom). Vissa skillnader förelig­ ger dock. Tidigare gjordes laparatomi i ”staging”-syfte hos unga patienter då non-invasiva utredningen hittills gett vid handen att patienten hade ett tumör­ stadium I–II och strålbehandling kunde bli aktuell. Vid denna laparatomi gjordes splenektomi och bl.a. provexisioner från lever och retroperitoneala lymfkörtlar. I mycket hög utsträckning har man upphört med detta ingrepp. Vissa andra speciella utredningar/åtgärder sker också hos en Hodgkin­ patient; serologi mot toxoplasmos undersöks, vaccination med pneumovax görs för reducera risk för sepsis hos splenektomerad (denna vaccination bör ske så tidigt som möjligt efter diagnos) och spermaanalys med infrysning av sperma sker före ev. cytostatikabehandling. Vidare bör tandstatus noga gås igenom och åtgärdas i samråd med behandlande onkolog då dåliga karierade tänder kraftigt kan försämras efter strålbehandling som inkluderar munhåla. Värdering av allmänsymtom (s.k. B-symtom, se avsnitt om nonHodgkins sjukdom) är också viktigare vid Hodgkin än non-Hodgkins sjuk­ dom då det direkt har prognostisk betydelse och har terapeutisk implika­ tion. (Observera att klåda till skillnad från nattsvettingar, feber och viktned­ gång ej räknas till B-symtom.) © Studentlitteratur 223 Kapitel 22 Högt tumörstadium, B-symtom, lymfocytär utarmning, hög ålder, utta­ lad immundefekt, hög SR, anemi och leukopeni är relaterat till en dålig prognos. Vid stadium I–II ges ofta strålbehandling, vilken botar huvuddelen av alla dessa patienter. Är sjukdomen belägen ovan diafragma inkluderas alla körtelstationser ovan diafragma, s.k. mantelbestrålning, och om sjukdomen är belägen nedom diafragma (ganska sällsynt) ges s.k. omvänt Y. Patienter med stadium III–IV behandlas med cytostatika. Den nu van­ ligaste kombinationen inkluderar alternerande behandlingar mellan MOPP (mustin, onkovin, prokarbazin och prednison) och ABV (adriamycin, bleo­ mycin, velbe). Behandlingen ges under 6–8 månader med 2 cykler efter att remission uppnåtts. Kombinerad behandling med cytostatika och strålning kan vara aktuell om patienten har stor tumör (= bulky disease). Ofta läggs denna behandling upp så att 2–4 cykler av cytostatika ges före strålbehandlingen. Behand­ lingen medför då att mindre volym behöver strålbehandlas. Exempelvis behöver, vid stor mediastinal tumör, ett mindre lungfält bestrålas om tumör förkrympts med cytostatika. Om tumörsjukdomen återkommer efter att kemoterapi givits eller under behandlingen finns små möjligheter till kuration. En ny experimentell behandling vid recidiv efter tidigare kemoterapi är högdoserad/intesivt given cytostatika åtföljt av stamcellsstöd. Denna behandling ges till yngre patienter (< 50 år) och förhoppningar finns att fler kan botas. Recidiven inträffar vanligtvis inom 3 år från diagno­ sen och kuration är möjlig även i recidivsituation varför uppföljningen efter primärbehandlingen bör ta fasta på detta. Uppföljningen inkluderar kliniska kontroller, SR, blodstatus, lungröntgen. Det är viktigt att man är observant på vissa faktorer vid uppföljningen av patientgruppen då infektioner av flera skäl lätt kan uppträda. Dels finns en speciell benägenhet att drabbas av bältros–vattkoppor (varicellae zoster) där en sjukdomsassocierad immunde­ fekt (av den cellmedierade immuniteten) och behandling av sjukdomen kan spela roll. Behandlingen av denna infektion hos Hodgkinpatienten har att göra med om individen tidigare haft vattkoppor/zoster. Är detta inte fallet bör kontakt tas med infektionsklinik om möjligheter att ge immunglobulin. Har primärinfektion skett tidigare och individen utvecklat symtom på virus­ sjukdomen ska behandling med acyclovir omedelbart insättas. Det har tidi­ gare påpekats att vaccination med pneumovax bör genomföras tidigt efter diagnos. Splenektomerade, särskilt om detta sker i barndomen, har en ökad risk att få och att avlida i grampositiv sepsis. Även vid banala övre luft­ vägsinfektioner bör behandling med antibiotika (med penicillin) inledas 224 © Studentlitteratur Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns omedelbart hos en splenektomerad patient. Patienter som är splenektome­ rade har ofta bland sina tillhörigheter ett kort som informerar på olika språk att de är splenektomerade.Vid utlandsresor bör en splenektomerad patient i sitt bagage medföra antibiotika. En benägenhet finns för opportunistiska infektioner som t.ex. pneumo­ cystis carinii, och svampinfektioner (koccidiodomykos, kryptokockus). Strålbehandling mot halsen medför att sköldkörtelhormonproduktionen förr eller senare kan bli låg. Genom att följa TSH och omedelbart sub­ stituera patienten med levaxin vid TSH-stegring söker man höja allmän­ befinnandet och undvika negativ påverkan på blodfetter och möjlig TSH­ stimulerad tyreoideacancerkarcinogenes. Strålbehandling mot ljumskar (inom ett omvänt Y) kan temporärt/permanent störa spermieproduktion medan mindre effekter finns på hormonproduktionen av testosteron. Hos kvinnor kan gonaddoser över 6 Gy åstadkomma infertilitet. Cytostatika­ behandling kan bestående påverka både spermiefunktion och testosteron­ produktion och framkalla menopaus hos kvinnan. Effekterna visar både ett åldersberoende, könsberoende och terapiberoende. Forskning har de senaste åren varit inriktad på att hitta mindre toxiska, optimala regimer inkluderade regimer som är mindre gonadskadande. Hos patienter som tidigare behandlats för Hodgkins sjukdom bör man vara observant på eventuella kardiopulmonella symtom (särskilt hos dem som erhållit strålbehandling mot hjärta/perikard eller behandling med kar­ diotoxiska cytostatika som Adriamycin). Både konstriktiv perikardit och prematur kardioskleros är möjliga sequelae till terapin. Det kan vara viktigt att ha andra riskfaktorer för hjärtkärlsjukdomar som rökning, hypertoni och blodfetter under kontroll vid uppföljningen. Både strålbehandlingen (mantelbestrålningen) och cytostatikabehand­ lingen (framförallt Bleomycin) kan skada lungparenkymet med åtföljande möjlighet av recidiverande pneumonier, pneumoniter, kronisk bronkit och lunginsufficiens. Prevention av rökning kan även för denna komplikation vara viktig. En påtaglig risk för sekundärtumörer finns. Risken är störst för tungt behandlade patienter och när kombinationer av behandlingar använts. Ris­ ken för akut leukemi har uppskattats till mellan 2–10 % och relaterad till exponering för alkylerare (t.ex. Mustin). Riskökningen ses redan efter ett halvår men minskar snabbt efter 5 år. Leukemin är terapiresistent och har karakteristiska cytogenetiska förändringar. Solida tumörer har längre latenstid och dyker framförallt upp efter 10 år. Den sammanlagda risken för solida tumörer är ännu ej känd eftersom patientgruppen behöver följas under en hel generation. © Studentlitteratur 225 Kapitel 22 Vid lokaliserad sjukdom kan mellan 80–90 % av alla fall med Hodgkins sjukdom nu botas. Även vid spridd sjukdom kan 60–70 % av fallen botas. Trofoblastsjukdom Hos patienter med mola hydatidosa (benign tumör från placentas cellager) utvecklas mellan 3–10 % till trofoblastsjukdom. Tumören producerar humant koriongonadotropin (hCG). Symtomen är starkt varierande men en oregelbunden blödning efter en abort, fullgången graviditet eller mola bör leda till att hCG analyseras. Ett annat kännetecken som kan utnyttjas diag­ nostiskt är att tumören utbildar arteriovenösa shuntar och kärltumörer i ute­ rus. Tumören har en god prognos om den behandlas med cytostatika. Patient med metastaser kan också botas varför det är viktigt att dessa patienter behandlas centraliserat vid högspecialiserade centra som besitter tillräcklig kunskap och har tillräckligt patientunderlag. Cytostatika som använts inkluderar metotrexat, daktinomycin, vinkristin, doxorubicin eller cyklofosfamid och etoposid. Analcancer Årligen diagnostiseras i Sverige ungefär 60 fall av tumörer lokaliserade till analkanal eller perianalt. Histopatologiskt förekommer två typer varav en är av skivepiteltyp och en basalcellscancerlik (kloakogen). Medianåldern vid insjuknande är 65–70 år. Tumören är 4–5 ggr. vanligare hos kvinnor än män. Etiologin till sjukdomen är föga känd men hos en liten grupp av patienter finns ett samband med tidigare herpes och papillomvirusinfektio­ ner. En överrepresentation finns hos homosexuella män och hos HIV-smit­ tade. Tumören uppträder ofta tillsammans med fistlar, fissurer och hemor­ rojder. Debutsymtomet är ofta diffus obehagskänsla och klåda. Smärta och tenesmer förekommer hos de mer avancerade fallen. Ulceration och blöd­ ning uppträder sent. Inkontinens kan i enstaka fall uppträda. Kuration kan uppnås med antingen kirurgi eller strålterapi eller en kombination av meto­ derna. I enstaka fall kan man, vid små ytliga tumörer, enbart nöja sig med lokal excision. Annars är den vanligaste kirurgiska metoden rektumamputa­ tion. Vid enbart kirurgi har man en hög frekvens av lokalrecidiv (30–70 %). Tumören är relativt strålkänslig och kan botas med doser av 50–70 Gy. Cytostatika kan potentiera effekt av strålning. Strålterapi med cytostatika (bleomycin) har också gett goda resultat i något mer avancerade fall. 226 © Studentlitteratur Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns Behandlingen kan efterföljas av radikal kirurgi i fall där tumör ej helt för­ svinner. Kombinationsbehandlingen strålning och bleomycin har fördelen att den kan bevara sfinkterfunktionen lättare än när kirurgi sker. Femårs­ överlevnaden är ca 40 %. Livmoderhalscancer Patienter med livmoderhalscancer debuterar vid en medianålder strax över 50 år. Incidensen av sjukdomen är i minskande. Högre incidens finns i stor­ städer och i utvecklingsländer. Kvinnor med fler sexuella partners och fler barn har en högre risk, men även det antal partners maken har spelar roll. Risken för cervixcancer är högre hos kvinnor som gifter sig med en man som tidigare varit gift med en kvinna som haft cervixcancer. Mycket talar för att infektioner med papil­ lomavirus (HPV) spelar etiologisk roll. Speciellt HPV (typerna 16 och 18) har associerats med invasiv cervixcancer. Cofaktorer vid cancerutveck­ lingen verkar cigarettrökning och bruk av hormoner (t.ex. p-piller) vara. I tidiga stadier är sjukdomen symtomfri eller ger symtom i form av flyt­ ningar. I avancerade former symtom från exofytisk växt, endofytisk växt eller blödning. Diagnostiken inkluderar klinisk undersökning med cervixcytologi, kol­ poskopi med riktade px-och cervixskrap, eventuellt operativt borttagande av kon. Invasiv cancer utreds med palpation i narkos, cystoskopi, lung­ röntgen, CT-buk och bäcken och med kontrast för att visualisera urinvägar (alt. urografi). Följande är ett exempel på en WHO-klassifikation som används för att klassificera cervixcytologi: Normal, Atypisk, Dysplasi (mild, moderat och svår), Carcinoma in situ, Invasiv skivepitelcancer-Invasivt adenokarcinom. TNM-klassifikationen eller FIGO-klassifikationen används annars för att stadieindela tumörväxten. Tidig cervixcancer (cancer in situ, stadium 0, tidig invasiv cancer sta­ dium IA1 och IA2) behandlas vanligtvis med kirurgi. En alternativ behand­ ling är intrakavitär strålbehandling. Stadium IB och IIA kan behandlas effektivt med antingen kirurgi eller en kombination av intrakavitär brachy­ terapi och extern strålbehandling. Optimal behandling bör individualiseras. Stadium IIB-IVA behandlas med kombinerad intrakavitär och extern strål­ behandling. Patienter med stadium IVB kombinationsbehandlas ofta med kemoterapi och strålning. © Studentlitteratur 227 Kapitel 22 Långtidskomplikationer till strålbehandlingen (uppträder hos ungefär 5– 15 % av alla behandlade) inkluderar bl.a. proktiter, cystiter, vaginal stenos och fistlar. Risken för sjukdomsrecidiv är störst inom de första tre åren. Femårsöver­ levnaden är för stadium I ungefär 90 %, stadium IIA 80 %, stadium IIB 60 %, stadium III 45 % och för stadium IV 15–30 %. Till prognostiska fak­ torer räknas tumörstadium, lymfkörtelmetastasernas antal, och histologi (adenokarcinom eller skivepitelcancer). DNA-mängd och S-fas är omtvis­ tade prognosfaktorer. Högriskpatienter för recidiv bland stadium IB och IIA försöker man nu identifiera i vetenskapliga studier för att hos en lågrisk­ grupp kunna minska terapin och eventuellt intensifiera adjuvant terapi i högriskgruppen. Neoadjuvanta studier pågår. Patienter med sjukdomsreci­ div och avancerad sjukdom bör bli föremål för randomiserade studier med nya terapiformer. Leukemi Kan indelas i myeloiska och lymfatiska leukemier som kan vara antingen akuta eller kroniska. Akut myeloisk leukemi (AML) är vanligare hos vuxna och hos män medan akut lymfatisk leukemi (ALL) framförallt drabbar barn. Etiologin till akuta leukemier inkluderar genetiska faktorer, hereditära syndrom (Downs syndrom, Fanconis anemi, Blooms syndrom, Klinefelters syndrom, trisomi D, ataxia telangiectasia, Wiskott-Aldrich syndrom, kongenital agranulocy­ tos), joniserande strålning, kemiska exponeringar (bensen, andra lösningsmedel, alkylerande mediciner) och virusexponeringar (t.ex. HTLV1). Vissa tillstånd som myeloproliferativa sjukdomar, aplastisk anemi, parox­ ysmal nokturn hemoglobinuri, kronisk myeloisk leukemi och polycytemi kan ha blastkris i sitt senare naturalförlopp. Myelodysplastiska syndrom kan föregå framförallt AML. De senaste åren har den molekylära bakgrunden vid leukemier klarnat. Karakteristiska cytogenetiska klonala abberationer kännetecknar olika leukemier såsom exempelvis t(1;19)(q23,p13) vid ALL, t(8;21)(q22;q22) vid AML, t(15;17)(q22;q11) vid akut promyelocytleukemi, inv(16)(p13q22) vid akut myelomonocytleukemi, t(9;22)(q34;q11) vid kro­ nisk myeloisk leukemi, +12 vid kronisk B-cells leukemi, inv(14)(q11q32) vid kronisk T-cells lymfatisk leukemi och del(5q) vid myelodysplasi. FAB klassifikationen används vid AML (M1-M7). Diagnos och klassi­ fikation baseras både på rutinmorfologi av benmärg och blod samt cyto­ genetik. 228 © Studentlitteratur Vissa mera sällsynta tumörsjukdomar där betydande behandlingsframsteg finns Vid behandling av patienterna söker man understödja blodfunktioner så att anemi, trombocytopeni och infektioner kan undvikas. Behandlingen av AML inkluderar kemoterapi (t.ex. daunorubicin, cytarabin, doxorubicin, VP-16, mitoxantron, tioguanin, merkaptopurin, azacytidin) både som induktionsterapi och konsolideringsterapi. Mellan 60–80 % går i remission vid AML, men efter två år kvarstår bara 20–40 % i remission. Överlevnads­ siffror hoppas man förbättra genom intensifierad terapi efter att patient gått i remission antingen med högdos kemoterapi med autolog benmärgstrans­ plantation eller med allogen benmärgstransplantation vid första remissio­ nen. Vid ALL ges också CNS-profylax. Vinkaalkaloider tillsammans med steroider har en viktig roll i kemoterapin. Doxorubicin och asparaginas finns ofta också med i behandlingsprotokollen. Benmärgstransplantation kan komma i fråga framförallt till barn i andra remission eller senare (för indikationer och mer om benmärgstransplantationer se särskilt kapitel). Hos barn går 80–90 % med ALL i remission och 50 % överlever 5 år. Hos vuxna med ALL är dessa siffror mycket lägre. Vid kronisk myeloisk leukemi ses en kraftig förhöjning av vita blod­ kroppar med alla mognadsstadier, lågt alkaliskt fosfatas i leukocyter, närvaro av Philadelphia-kromosom (translokation mellan kromosom 9 och 22) i blod eller benmärg, hypercellulär benmärg med myeloid hyperplasi och med ≤5 % blaster och splenomegali. Trötthet och ospecifika symtom (som buksmärta, ömhet över sternum) brukar dominera. Trombocytopeni (med blödningar) förekommer bland en minoritet av patienterna. Behand­ lingen består av cytostatika (myleran eller hydrea). Interferon har visat sig ha en viss effekt, framförallt tidigt i sjukdomsförloppet. Hos yngre patienter har benmärgstransplantationer gett hoppingivande resultat med 50–70 % som kan uppnå komplett remission i 3–5 år. Kronisk lymfatisk leukemi ses hos äldre individer och är vanligare hos män. Etiologin är dåligt känd. Leukemin tycks ej vara associerad med joni­ serande strålning. En viss familjär tendens har noterats. Kriterier på diagnos inkluderar varaktig lymfocytos (≥15000/µL) i det perifera blodet och ben­ märgen >40 % av mogna lymfocyter som inte kan härledas till infektioner eller annat, mogna B-lymfocyter i blod, lymfadenopati, splenomegali, anemi och trombocytopeni. Patienten kan sakna symtom tidigt i sjukdomsförloppet. Anemi och blöd­ ningar kan dyka upp senare. Immunfunktionsrubbningar (hypogamma­ globulinemi) är vanliga. Vid behandlingskrävande generella symtom ges cytostatika (t.ex. klorambucil eller sterecyt) och, vid lokaliserade symtom, strålbehandling. Splenektomi kan ibland vara indicerat liksom immun­ globulintillförsel. Sjukdomen har ett kroniskt förlopp. © Studentlitteratur 229 23 Andra tumörsjukdomar med speciella behandlingar Tyreoideacancer Huvudgrupperna av tyreoideacancer består av follikulär, papillär, och med­ ullär cancer samt den storcelliga anaplastiska cancern. De småcelliga tyreoideacancrarna har vid eftergranskning till stor del befunnits vara lym­ fom. Tyreoideacancer är vanligare hos kvinnor än hos män. Riskfaktorer för tyreoideacancer inkluderar exponering för joniserande strålning (särskilt den papillära formen), jodintag, jodbrist, TSH-stimulering, genetiska fakto­ rer och reproduktiva (hormonassocierade faktorer). Tyreoideacancer före­ kommer ofta ockult (5–35 % av fallen). Det vanligaste debutsymtomet är en palpabel knuta. På ett teknetiumscintigram framträder ofta knutan helt utan isotopupptag (s.k. kall knuta). En kall knuta i sig själv med palpabel resistens utgöres i 20 % av cancer. Cytologi (finnål) är en värdefull under­ sökning före en eventuell operation (svårigheter kan finnas att differentiera benigna adenom från högt differentierad follikulär tyreoideacancer med cytologi, ofta svarar cytologen då follikulär resistens och detta bör då leda till operation av knutan för diagnos). Preoperativt tas en lungröntgen. Basbehandlingen vid tyreoideacancer är operation. Vid medullär tyreoi­ deacancer utföres total tyreoidektomi medan, vid follikulär och papillär, total lobektomi utföres på den afficerade och subtotal lobektomi på den icke-afficerade sidan. Vid papillär ockult cancer och papillär radikalt ope­ rerad intrathyoidal tumör ges ingen tilläggsbehandling förutom endokrin suppression. Hos patient med extrakapsulär växt eller med tveksam radika­ litet eller låg differentieringsgrad eller DNA-aneuploidi kan reoperation vara aktuell tillsammans med radiojodbehandling och endokrin suppres­ sion. Om papillär makroskopisk tumör finns kvar efter operation kan reope­ ration vara aktuell samt radiojodbehandling, extern strålterapi och endokrin suppression. Hos icke resektabel patient kan radiojodbehandling, extern strålterapi och endokrin suppression vara aktuell. Patienter med follikulära tyreoideacancrar handläggs på ett likartat sätt. Här slås eventuell kvar­ varande tyreoideavävnad ut med radiojod även hos radikalt opererade 230 © Studentlitteratur Andra tumörsjukdomar med speciella behandlingar patienter som inte har kvar tyreoideavävnad på scintigram. Medullär tyreoideacancer behandlas med operation och extern strålterapi (om kirur­ gisk radikalitet tveksam eller makroskopisk tumör kvar). Den externa strål­ terapin ges när det finns kvarvarande makroskopisk tumör eller vid icke resektabel cancer. Observera att patienten kan vara del i familjärt syndrom, MEN II (se ärftlig cancer). Anaplastisk tyreoideacancer behandlas med superfraktionerad strålterapi med cytostatika (adriamycin). Postoperativt undersöks S-Ca, tyreoglobulin och TSH suppression av levaxin. CT av halsen görs för den postoperativa strålbehandlingen. Hel­ kroppsjodscintigram utföres efter att hela tyreoidea bortopererats eller utsläckts med radiojod för att hitta eventuella jodupptagande fjärrmetasta­ ser (observera att levaxin utsättes temporärt inför denna undersökning). Jodupptagande metastaser kan med fördel behandlas med radiojod. Tyreoglobulin har störst värde vid uppföljningen om inte tyreoideaväv­ nad finns kvar. Calcitonin är en värdefull markör vid medullär tyreoidea­ cancer. Polycytemi Vid polycytemi föreligger en ökad produktion av röda blodkroppar och trombocyter och mer måttlig ökning av granulocyter. Cirkulatoriska sym­ tom uppträder exempelvis i form av hudrodnad, trombosembolier, trötthet, huvudvärk och yrselkänsla samt TIA-attacker. Obehandlat är tillståndet all­ varligt. Behandlingen består av venaesectio, 32P-behandling eller cyto­ statika. Medan venaesectio påverkar antalet röda blodkroppar påverkar det ej trombocytnivån. 32P behandling kan ur leukemiriskhänseende vara att föredra före cytostatikabehandling då trombocytnivån behöver sänkas. Ungefär 10 % av fallen utvecklar leukemi i en senare sjukdomsfas. Tumörer i öron-näsa-halsregion Tobak och alkohol är vanliga etiologiska faktorer till tumörsjukdomar i öron-näsa-halsområdet. Yrkesfaktorer kan spela roll, exempelvis finns vid adenokarcinom i bihålor ett samband med exponering för trädamm. Epstein-Barrvirusinfektioner har ansetts ha etiologisk betydelse för epi­ farynxcancer. Illapassande, skavande proteser kan predisponera till cancer i munhålan. Tobakstuggande och snusning kan öka risken för oral cancer. © Studentlitteratur 231 Kapitel 23 Brist på A-vitamin kan möjligen vara en kofaktor vid karcinogenesen i skivepitel. Heshet är ett vanligt symtom vid larynxcancer. Andra vanliga symtom vid tumörsjukdom i denna region är en palpabel knuta, smärta, blödning, protes som inte längre passar, ensidig otit eller otosalpingit. En knuta på halsen i form av lymfkörtelmetastas är debutsymtom hos 25 % av patien­ terna. Kontralateral lymfkörtelspridning är ej ovanlig. Fjärrmetastaser bru­ kar ses sent i förloppet och då med metastaser till lunga, lever och skelett. Den överväldigande majoriteten av tumörfall utgörs av skivepitelcancer. Utredningen sker med indirekt skopi av ÖNH-regionen, palpation av lymf­ körtelstationer, biopsier för PAD. Direktskopi med palpation i narkos utförs också av de flesta patienterna. Röntgen av lungor, CT, MR eller ultraljud ingår ofta i utredningen. Behandlingen kan inkludera strålbehandling, kirurgi och cytostatika­ behandling och är ofta ett teamwork mellan onkologer, ÖNH-kirurger, oral­ kirurger, plastikkirurger, patologer, röntgenologer, dietister och kuratorer. Ofta inleds behandlingen med strålterapi åtföljt av kirurgi och eventuellt postoperativ strålbehandling. Hos patienter med avancerade tumörer men med ett, efter omständigheterna relativt gott allmäntillstånd, kan det vara aktuellt med att ge cytostatika först (ofta i form av cisplatin och 5-FU), åtföljt av operation och/eller strålterapi. Vid strålterapin krävs ofta raffine­ rade 3-dimensionella dosplaner, individuell fixationsanordning och simule­ ring av terapi. Generellt strävar man efter att ge 50 Gy till mikroskopisk sjukdom, 60–70 Gy till små tumörer och c:a 70 Gy till större tumörer, givet med 2 Gys fraktioner. Möjligen kan ett bättre behandlingsresultat uppnås med hyperfraktionerad behandling (fler fraktioner per dag och dessa med lägre dos). Implantationsbehandling med radioaktiva iridiumnålar kan vara värdefullt komplement vid sjukdom i läppar, tunga, munbotten och tonsill. Bäst effekt synes också uppnås om hela behandling ges i en serie utan uppehåll. På grund av biverkningar behöver dock ofta pauser läggas in i behandlingen. Bieffekter uppträder som akut strålreaktion i slemhinna i mun och svalg, med svampinfektioner, sväljningproblem och nutritionsproblem. Den akuta strålreaktionen varar 2–4 veckor efter strålterapins slut. Patientens tillstånd kan delvis underlättas genom extra nutrition (t.ex. clini­ feedsond, TPN), antisvampmedel, analgetika, svalgbedövning och konst­ gjord saliv. Bortfallet av saliv och medföljande kariesproblem och bortfall av smak är bekymmersamt för patienten. Vid lokaliserad läppcancer uppnås bot i 90 % och vid lokaliserad mun­ hålecancer uppnås bot i 70–80 %. Vid mer avancerad munhålecancer varie­ rar botsiffror mellan 10–50 %. Både epifarynx och orofarynx är mindre 232 © Studentlitteratur Andra tumörsjukdomar med speciella behandlingar tillgängliga för kirurgi. Vid epifarynxcancer uppnås bot av mellan 30–50 % av patienterna (enstaka tidiga cancrar utan metastaser 80 %) med strålterapi ibland föregånget av kemoterapi och med senare halslymfkörtelutrymning. Orofarynxcancer har en ungefärlig överlevnad på fem år i 30–50 % av fal­ len. Sämre överlevnad för tungbas, tonsill och bakre svalgvägg. Behand­ lingsresultaten vid hypofarynxcancer är dåliga med endast 20–30 % lång­ tidsöverlevande. Larynxcancer har ofta en utmärkt prognos sannolikt på grund av att sjukdomen ger symtom tidigt (vid glottistumör stadium I och II uppnås bot i mellan 80–90 % av fallen). Behandlingen vid mycket ytliga glottiska tumörer kan bestå av laserkirurgi och vid något större tumörer joniserande strålning till 64 Gy. Vid kvarvarande tumör efter strålterapi vid glottisk tumör i stadium II utföres laryngektomi. Strålterapi är basbehand­ ling både vid supraglottiska och subglottiska tumörer. Vid resttumör eller recidiv göres laryngektomi. Vid cancer i näskavitet och bihålor ges preoperativ strålterapi 50 Gy och därefter maxillektomi med protetisk rekonstruktion varvid långtidsbot upp­ nås i 50 % av fallen. Om tumör inoperabel ges strålterapi till 64–70 Gy. Då lymfkörtelmetastaser är ovanliga bestrålas bara primärtumörområde. Efter strålbehandling kan ett begränsat kirurgiskt ingrepp vara aktuellt. Progno­ sen är dock tämligen dålig men god palliation kan uppnås. Pankreascancer Drygt 1 300 insjuknar per år. Etiologin är väsentligen okänd även om sjuk­ domen har ansetts vanligare hos rökare. Ett ärftligt anlag på kromosom 9, p16, kan i vissa familjer disponera till sjukdom, då ofta med risk för även malignt melanom. Vidare uppträder pankreascancer i familjer med BRCA1och BRCA2-mutationer. Tumören har en mycket dålig prognos. Diagnosen sker ofta mycket sent vid en tidpunkt när radikal kirurgi ej är möjlig. Smärta, avmagring och ikterus är vanliga symtom. De operativa ingreppen, som bara kan erbjudas 10–20 % av patienterna, har inkluderat pankreatico­ duodenal resektion med bevarande av svansen av bukspottkörteln (Whipp­ les ingrepp) eller radikal total pankreaticoduodenektomi. Enstaka patienter med periampullär sjukdomslokalisation har kunnat radikalopereras med längre överlevnad. Varken cytostatikabehandling eller konventionell strål­ behandling har haft någon plats som värdefull terapi. Vissa förhoppningar har nu knutits till intraoperativ strålbehandling som tillägg till ett operativt förfarande. Femårsöverlevnaden har tidigare varit 1–5 %. © Studentlitteratur 233 Kapitel 23 Mjukdelssarkom Drygt 300 nya fall med mjukdelsarkom diagnostiseras årligen. Sjukdomen blir vanligare med stigande ålder. Hos barn förekommer ett fåtal fall, mest som rabdomyosarkom. Sarkom består av en heterogen grupp av olika sjuk­ domar där malignt fibröst histiocytom (ca 35 %), liposarkom, leiomyo­ sarkom, synovialt sarkom och neurofibrosarkom är de vanligaste tumör­ typerna. En ärftlig benägenhet för tumörsjukdom kan finnas i vissa familjer med sarkom (se kapitel om ärftlighet och cancer). Ett sådant syndrom är LiFraumenis syndrom (indexfallet har sarkom före 45-årsåldern associerat med sarkom, bröstcancer, binjurebarkstumör, leukemi och hjärntumörer hos förstagradssläkting före 45-årsåldern och cancersjukdom hos en annan släkting före 45-årsåldern eller sarkom oavsett åldern). Strålbehandling kan öka risken för sarkom efter en längre latenstid. Bland andra miljöfaktorer som diskuterats är herbicidexponering (dioxinförorenade fenoxysyror) och exponering för klorfenoler. I extremiteter med ödem kan angiosarkom utvecklas. Kaposis sarkom finns i ökad frekvens särskilt hos homosexuella HIV-infekterade och även andra HIV-smittade personer och hos äldre män. Sarkom hos djur har ofta en viral etiologi, t.ex. Rous sarkomvirus hos höns. Sarkomen debuterar ofta som en tumor i en extremitet. Diagnosen skall misstänkas särskilt hos alla ytliga mjukdelstumörer över 5 cm och hos alla djupa mjukdelstumörer. I den preoperativa utredningen ingår MR, CT, och skelettscintigram samt, ibland, angiografi. I flertalet fall kan diagnosen sät­ tas på finnålspunktion. Det är viktigt att man vid operationen medtar even­ tuell stick eller biopsikanal. Efter en preoperativ lungröntgen opereras patienten helst med ett radikalt kirurgiskt ingrepp som myektomi, muskel­ loge-exstirpation och vid excision. Vid operationen söker man använda naturliga barriärer såsom fascior som tumörgränser. En marginell excision är ej radikal och behöver oftast åtföljas av postoperativ strålbehandling. Amputation, som tidigare var vanligt, behöver nu göras i mindre än 10 % av fallen. Lokalrecidivfrekvensen är efter en marginell excision ungefär 70 % och efter radikala kirurgiska ingrepp omkring 10 %. Strålbehandling redu­ cerar påtagligt risken för lokalrecidiv. Behandling och prognos är mer bero­ ende av kärlinväxt, malignitetsgrad, tumörstorlek, tumörnekros, aneuploidi och om patienten är man. Metastasering sker oftast genom hematogen spridning till lungor, lever och skelett. Responssiffror på 30 % vid endrogs­ behandling (Doxorubicin) och 50 % vid kombinationsbehandlingar (Doxo­ rubicin, cyklofosfamid, vinkristin, actinomycin-D och DTIC) har uppnåtts. Ifosfamid och VP-16 är en kombination som nyttjas vid metastatisk sjuk­ dom som en fas II undersökning. Adjuvant cytostatikabehandling vid hög234 © Studentlitteratur Andra tumörsjukdomar med speciella behandlingar gradiga mjukdelsarkom med adriamycin har ej förbättrat prognosen. Nu planeras på nordisk bas adjuvant behandling av patientgrupper med dålig prognos med kombinationscytostatika (t.ex. ifosfamid och VP-16). De flesta recidiven diagnostiseras inom 3 år. Kontroller är då mer intensiva de första tre åren, vanligtvis var 3:e månad. Patienter med dåliga prognostiska tecken har en låg femårsöverlevnad medan patienter med goda prognostiska tecken har en femårsöverlevnad på 80 %. Skelettsarkom Till skelettsarkom räknas osteosarkom, kondrosarkom, Ewing sarkom, chordom och jättecellstumörer. Både Ewing sarkom och osteosarkom är vanligast i 10–20-årsåldern. Osteosarkom är vanligast i metafyserna av dis­ tala femur, proximala tibia, proximala humerus och proximala femur. Kon­ drosarkom har sin vanligaste lokalisation till bäcken och proximala femur medan Ewing sarkom oftare förekommer i proximala femur eller i bäcken­ ben. Radikal borttagning av tumör är inte tillräcklig för bot då subklinisk spridning kan ha skett vid högmaligna tumörer som osteosarkom och Ewing sarkom. Systembehandling i form av cytostatika (neoadjuvant kemoterapi) brukar därför inledas före lokalbehandlingen. Vid osteosarkom har femårsöverlevanden förbättrats från 20 % till 60 % med modern extre­ mitetsbevarande kirurgi och cytostatikabehandling innehållande högdos metotrexat, adriamycin, cisplatin, ifosfamid och VP-16. Kondrosarkom har ofta ett långsamt förlopp men det finns sarkom som kan ha ett hastigt förlopp med snabb metastasering. Kirurgi är basbehand­ ling och femårsöverlevnaden är 50 %. Vid Ewing sarkom ges en kombination av preoperativ kemoterapi, kirurgi, strålbehandling och kemoterapi. Behandlingen har förbättrat prog­ nosen från en femårsöverlevnad på 10 % till över 50 %. Cytostatika som använts inkluderar ifosfamid, doxorubicin, vinkristin och cisplatin. Myelom Tumörsjukdom som utgår från en immunglobulinproducerande B-lymfo­ cyt. Drabbar oftast äldre män och kvinnor. Orsaken till myelom är okänd men i djurmodeller spelar genetiska faktorer i kombination med kronisk sti­ mulering av immunsystemet roll. Vid symtom brukar skelettsmärtor eller © Studentlitteratur 235 Kapitel 23 låga blodvärden vara vanliga. Ibland hittas sjukdomen accidentellt genom en hög sänka eller en M-komponent i serum. Plasmacellerna infiltrerar både benmärg (åstadkommer anemi, trombocytopeni och leukopei) och skelett (åstadkommer urkalkning med frakturrisk). De diagnostisk kriterierna inkluderar; >10 % plasmaceller i benmärg, M-komponent i serum och/eller monoklonala lätta kedjor i urin associerade med en sänkning av normala halten serum immunglobuliner, röntgenologiska tecken på osteolytiska pro­ cesser eller generell osteoporos. Anemi, hyperkalcemi och nedsatt njur­ funktion är vanligt. Terapin går ut på att reducera antalet plasmaceller och palliera patienten på bästa sätt. Sjukdomen har ofta ett långdraget förlopp. Den generella behandlingen inkluderar cytostatika (t.ex. melfalan, sen­ doxan, doxorubicin, vincaalkaloider, kortison) och strålterapi (vid lokalise­ rade smärtsymtom, patologiska frakturer och medullakompressioner efter laminektomier). 236 © Studentlitteratur 24 Något om de vanligaste tumörerna och deras orsaker, tumörbiologi, symtomatologi, diagnostik, behandling, uppföljning och prognos hos barn Ungefär 1 av 650 barn drabbas av en elakartad tumörsjukdom före 15 års ålder. Totalt uppskattas >50–60 % av alla barnfall att bli botade. Detta med­ för att vid år 2000 ungefär 1/1 000 unga vuxna har behandlats för barncancer och överlevt sjukdomen. Klart är att de långtidsöverlevande barnen fortsätter att uppvisa en högre total sjuklighet som resultat av deras behand­ ling som ofta inkluderat kemoterapi och strålbehandling. Fortsatt uppfölj­ ning av dessa långtidsöverlevande barn/unga vuxna är av stor vikt både forskningsmässigt och kliniskt (se nedan). Åldern vid diagnos spelar stor roll ur flera aspekter. Först varierar tumör­ typer med presentationsålder (t.ex. förekommer neuroblastom och retino­ blastom mest i tidig barndom medan lymfom och bentumörer debuterar senare). Histologiskt identiska tumörer kan ha olika prognos i olika ålders­ intervall (t.ex. neuroblastom). Pojkar är generellt överrepresenterade bland barntumörer (teratom undantaget). Både skillnader mellan etniska grupper och geografiska loka­ ler finns när det gäller barntumörer. Färgade har ungefär 20 % lägre före­ komst av barntumörer medan Burkittlymfom och levertumörer har klara geografiska samband. Studier har associerat prenatala händelser (som olika exponeringar hos moder, fader och foster) till risken för barntumörer. Sådan faktorer är rökning hos modern, prenatala infektioner och expone­ ring för joniserande strålning i form av röntgenundersökningar under fos­ terlivet. Resultaten från dessa studier är fortfarande både omdiskuterade och svårtolkade. Det finns ett behov av fler och bättre designade studier för att studera dessa hypoteser. Ett starkt ärftligt inslag finns bland barntumö­ rer. Detta gäller exempelvis tumörer som retinoblastom, Wilms tumör och vissa sarkom. Risken för barntumörer hos barn som saknar ett genetiskt syndrom men som har ett annat syskon med barntumör dubbleras till unge­ fär 1/300. Den molekylära bakgrunden till det starka hereditära inflytandet vid dessa tumörer har också börjat karakteriseras, t.ex. kromosomband © Studentlitteratur 237 Kapitel 24 De vanligaste barntumörerna Leukemi ALL Hjärntumörer Medulloblastom Opticusgliom Kraniofaryngeom Lymfom Hodgkins sjukdom Non-Hodgkins sjukdom Histiocytosis X Letterer-Sive Hand-Schüller-Christians sjukdom Eosinofilt granulom Neuroblastom Wilms tumör Bentumörer Osteogent sarkom Ewings sarkom Mjukdelssarkom Rabdomyosarkom Retinoblastom 13q14 (läget för en recessiv retinoblastomgen), 11p13 (vissa av Wilms tumörer) och 17p (Li-Fraumenis syndrom med sarkom hos barn och muta­ tioner i p53 genen). Leukemier svarar för en tredjedel av alla tumörfall. Den klart domine­ rande leukemiformen är akut lymfatisk leukemi (ALL) som själv svarar för drygt 25 % av alla fall med tumör. Initiala symtom kan inkludera feber, trötthet och blekhet. Sjukdomsdebuten kan både vara smygande eller mer akut (blödningar och sepsis). Diagnosen baseras på benmärgsundersökning. För närvarande kan 70–80 % av alla barn med ALL utan dåliga prognos­ tiska faktorer förväntas bli långtidsöverlevande. Till dåliga prognostiska faktorer hör ett högt antal vita blodkroppar, massiv organförstoring, patient under 1 år och över 10 år och CNS-engagemang vid diagnos. Exempel på andra faktorer som är associerade med en sämre prognos är mediastinal 238 © Studentlitteratur Något om de vanligaste tumörerna och deras orsaker … tumör, trombocytnivå, FAB-klassifikation, hur snabbt remission uppnåtts, tumörkromosomstatus och kön (pojkar). I patientutredningen ingår även immunofenotypning, cytogenetisk analys, molekylär genotypning och bio­ kemiska prover. Kombinerad behandling ges med cytostatika. Nuvarande behandling inkluderar induktionsbehandling, CNS-profylax, konsolide­ rande behandling och underhållsbehandling. Allogen benmärgstransplanta­ tion kan ha en roll vid sjukdomsrelaps och producerar långtidsöverlevande, 15–30 %, beroende på när i sjukdomsförloppet transplantationen görs. Non-Hodgkinlymfom debuterar oftare något senare i barnaåren än leuke­ mier. Tumören uppträder oftast som lymfoblastlymfom eller odifferentie­ rade lymfom (t.ex. Burkittlymfom). Sjukdomen uppträder oftare extra­ nodalt och med diffust växtsätt än lymfom hos vuxna. Lymfom i tarmar och främre mediastinum är vanliga. Hos barn utgör också B-cellslymfom en mindre andel än hos vuxna (60 % mot 80 %). Genetiska faktorer spelar san­ nolikt stor roll. Immundefektsyndrom som svår kombinerad immundefekt, Wiskott-Aldrich-syndrom eller Ataxia Telangiectasia kan sällsynt vara pre­ disponerande sjukdom. Epstein-Barr-virusinfektioner verkar vara relaterade till patogenesen vid många av lymfomen som debuterar hos immundefekta. Immunsuppressiv terapi, organtransplantation och malariainfektion är andra faktorer som kan öka risken för lymfom. Utredningen inkluderar bl.a. fullständigt blodstatus, lungröntgen, ben­ märgsbiopsi-aspiration, lumbalpunktion och cytocentrifugering för analys av celler, leverfunktionstest, njurfunktionstest, thorax och buk CT. Behandlingen inkluderar cytostatika med intratekal terapi, strålterapi (dock begränsad roll vid lymfom hos barn). På grund av att kombinations­ cytostatikabehandling varit framgångsrik vid barnlymfom har hittills ben­ märgstransplantationer endast rönt begränsad entusiasm. Nittio procent av patienter med begränsad sjukdom och 60–80 % av patienter med extensiv sjukdom botas. De allra flesta recidiv diagnostiseras inom 2 år. Omkring 10–15 % av alla Hodgkinfall uppträder hos barn. Cytostatika­ behandling har dominerat behandlingen ännu mer än hos vuxna, framförallt på grund av att strålningen medfört tillväxtproblem hos barnen. Tioårsöver­ levnaden är nu ofta över 90 % i olika material. Histiocytosis X utgör en grupp av kliniskt divergerande syndrom som histopatologiskt gemensamt karakteriseras av granulomformation med infiltration och proliferation av histiocyter. En del histiocytoser kan vara benigna icke neoplastiska proliferationer medan andra kan vara sant neoplastiska. Eosinofilt granulom (lokaliserat, beningt förlopp), HandSchüller-Christians sjukdom (kroniskt förlopp) och Letterer-Siwe (fulmi­ nant förlopp) är tre former av histiocytos i stigande allvarlighetsgrad. Vid © Studentlitteratur 239 Kapitel 24 den neoplastiska histiocytosen har cytostatikabehandling, steroidbehand­ ling och radioterapi förbättrat prognosen. Till den svåraste formen räknas också malign histiocytos och akut monocytleukemi (klass III histiocytoser) med en mortalitet på över 70 % trots cytostatikabehandling. Medianåldern för insjuknande i neuroblastom är två år. Vanligaste pre­ sentationslokalen är abdominellt både hos barn yngre än ett år och hos äldre barn. Cytogenetiskt karakteriseras tumören av partiell monosomi av kromosomarm 1p och abnormiteter på kromosom 17. Den vanligaste amplifierade genen är MYCN (kromosom 2). Neuroblastom är biologiskt unika genom att de har kapacitet att spontant differentiera (till ganglion­ celler) och regrediera hos småbarn. Liksom andra tumörer med neurallist­ ursprung utsöndras katekolaminmetaboliter (VMA, vanillin-mandelsyra och HVMA, homovanillinsyra används som tumörmarkörer). Behand­ lingen inkluderar, för lokaliserade fall, operation och strålterapi medan kemoterapi är central för metastaserade och icke resektabla fall. Totalt botas ungefär 30 % av alla patienter. De flesta patienter med neuroblastom tillhör ”hög-riskkategori” med en överlevnad kring 15 %. Lågrisk- och interme­ diärriskpatienter uppnår en överlevnad på mellan 60–90 %. Wilms tumör uppträder hos 1/10 000 barn. Tumören kan uppträda både unilateralt (medianålder vid diagnos 39 månader) och bilateralt (median­ ålder 26 månader). Mikroskopiskt uppvisar tumören omoget njurparenkym med mesenkymal och epiteliala cellpartier. En rad kongenitala anomalier kan vara associerade såsom aniridi, hemihypertrofi, missbildningar av geni­ talia etc. En nyligen klonad gen, lokaliserad till kromosomband 11p13 anses vara orsak till en del sjukdomsfall, men sannolikt finns också flera andra gener av betydelse för Wilms tumör. Det vanligaste presentationsättet är ont i magen eller palpabel tumör i buken. I ungefär 15 % av fallen före­ kommer metastaser vid diagnos och då framförallt till lunga. Man bör und­ vika att traumatisera tumör (spridningsrisk!). Efter att diagnos satts inleds ofta behandlingen med kemoterapi. Kemoterapi som ofta inkluderar vin­ kristin och aktinomycin-D används för alla sjukdomsstadier. Behandlingen inkluderar kirurgi (så radikal som möjlig). Postoperativ radioterapi ges till stadium III och IV patienter och till patienter med ogynnsam histologi. Omkring 90 % av alla patienter med Wilms tumör är botbara med modern terapi. Empiriska risker för den hereditära risken för avkomman till en patient med Wilms tumör finns väl karakteriserad (se appendix). Medulloblastom. De flesta barn insjuknar innan 10-årsåldern. Den typiska lokalisationen är i cerebellum, framförallt i medellinjen eller i pos­ teriora vermis. Den metastaserande potentialen är hög och redan vid diag­ nos uppvisar 30 % spinal spridning. Metastaser utanför CNS är mindre van240 © Studentlitteratur Något om de vanligaste tumörerna och deras orsaker … liga. Operation med så extensiv resektion av tumör som möjligt. Postoperativ kraniospinal strålbehandling med 55 Gy mot bakre skallgrop samt 35 Gy mot övriga delen av subaraknoidalrummet ges. Total sjukdoms­ fri överlevnad är efter 5 år ungefär 50 %. Utbredningen av tumören definie­ rar prognos. Vidare har patienter under 4 år sämre prognos. Optikusgliom. Nästan alla uppträder före 20 års ålder (de flesta har debu­ terat före 10 års ålder). Hos några fall finns en familjär koppling till neurofi­ bromatos. Histologisk diagnos eftersträvas (25 % involverar n. opticus, 73 % chiasma och 3 % synbanor). Symtomen är framförallt synstörningar och skelning. Om tumör är unilateralt belägen framför synnervskorsning göres resektion av tumör och synnerv. Vid central lokalisation och tumör som påverkar synnerv kan inte radikal resektion utföras. Så extensiv opera­ tion som möjligt utföres, därefter ges strålbehandling 50 Gy på 28 fraktio­ ner (1,8 Gy/fraktion) mot tumör med 2 cms marginal. Ungefär 60 % av både opererade och strålbehandlade barn överlever. Bättre prognos har setts för patienter med bara n. opticusutbredning och för patienter med tumör som bara involverar främre chiasma. Kraniopharyngeom finns nästan enbart hos barn. De uppstår från celler som är kvarstående öar efter Rathke’s ficka vid övergången mellan den infundibulära stjälken och hypofysen. Tumörerna är ofta större än 3 cm innan de ger symtom och är ofta cystiska. Röntgenologiskt ser man för­ kalkningar. Komprimerar ofta chiasma eller hypofys med resulterande sym­ tom på hormonell dysfunktion eller synproblem. Behandlingen sker med kraniotomi och tumörresektion. Hos barn och ungdomar under 18 år ges ingen strålbehandling postoperativt. Regelbundna kontroller med CT, MR och neurooftalmologiska undersökningar. Recidiverande tumörer behand­ las med radioterapi 50 Gy på 28 fraktioner med 2 cms marginal. (Hos vuxna ges postoperativ strålbehandling 54 Gy på 30 fraktioner.) Överlevna­ den visar att även för inkomplett resecerade patienter med postoperativ strålbehandling kan en 62–84 % tioårsöverlevnad uppnås. Av retinoblastom (som utgör en viktig modell för barntumörer) beräknas 10 % vara hereditära på basis av familjehistorien. Bland patienter med bila­ terala retinoblastom verkar 100 % vara hereditära. Även bland de unilate­ rala och, enligt familjeanamnes, ”sporadiska” fallen finns ungefär 10–12 % med hereditära retinoblastom. Totalt beräknas ungefär 40 % av alla retino­ blastom ha en hereditär bakgrund (av dessa har 75 % bilaterala tumörer och 25 % unilaterala). Det föreligger en hög risk för sekundärtumörer hos tidi­ gare behandlade patienter och då särskilt hos dem med hereditära retino­ blastom (8 % sekundärtumörer 18 år efter diagnos). Behandlingen sker med kirurgi, strålbehandling, fotokoagulation, kryoterapi och kemoterapi. Målet © Studentlitteratur 241 Kapitel 24 Ärftlig risk för avkomman till patient med retinoblastom eller Wilms tumör att utveckla samma sjukdom Familjestatus Retinoblastom affekterad avkomma med affekterad fader eller syskon oaffekterad avkomma, förälder och syskon eller 2 syskon affek­ terade affekterad avkomma, ingen annan i familj oaffekterad avkomma, ett barn affekterat oaffekterad avkomma, förälder affekterad oaffekterad avkomma, syskon affekterad Wilms sjukdom förälder affekterad förälder och annan affekterad släkting två affekterade barn, ej hos förälder syskon affekterat Risk (%) om affekterad har Unilateral Bilateral sjukdom sjukdom 40 6,6 6 1.6 40 6,7 40 8 6,7 <1 10 30 30 10 1 10 (Efter Harper.) med behandlingen är att bevara åtminstone synen på ett öga och bota barnet. Med modern behandling uppnås sjukdomskontroll i 80 % av sjukdoms­ fallen, även om patienter med tämligen avancerade retinoblastom inklude­ ras. Kemoterapins roll är fortfarande dåligt definierad vid retinoblastom. Genen för sjukdomen har nu klonats och är belägen vid kromosomband 13q14. Prober kan numera användas för att prediktera sjukdomsrisk. Sjuk­ domen har en nedsatt penetrans då enbart 80 % av dem som är genbärare utvecklar sjukdomen. Empiriska risker för den hereditära risken för avkom­ man till en patient med retinoblastom finns väl karakteriserade (se appen­ dix). 242 © Studentlitteratur Något om de vanligaste tumörerna och deras orsaker … Osteogena sarkom förekommer oftast hos tonåringar eller tidigt vuxna med predilektionsställe de långa rörbenens metafyser. Smärta och palpabel tumör är initiala symtom. Distala femur och proximala tibia är presenta­ tionslokal för 50 % av tumörerna. Högdos cytostatikabehandling med metotrexat och leukovorin åtföljt av kirurgi har förbättrat överlevnaden. Lungorna är den vanligaste metastaslokalen. Ewing sarkom uppträder oftast i bäckenregion eller proximala femur. Revben kan också vara engagerade med en stor extraskeletal komponent. Över 90 % av patienterna dog tidigare med enbart lokalbehandling. Genom preoperativ kemoterapi, kirurgi, eventuell strålbehandling samt postopera­ tiv kemoterapi har prognosen kraftigt förbättrats. Mjukdelssarkom domineras bland barn av rabdomyosarkom. Hos barn dominerar den embryonala formen med lokalisation framförallt till huvud– halsregion eller urogenitalia. Efter initial kemoterapi (ofta inkluderande vinkristin, actinomycin-D, cyklofosfamid, doxorubicin) och kirurgi med eller utan radioterapi har en 70 % recidivfri överlevnad uppnåtts. Tillväxten kan störas av strålbehandling dels om denna ges lokalt mot ett skelettområde och dels om centrala nervsystemet bestrålas med tillväxt­ hormonbrist som följd. Strålbehandling mot halsen kan exempelvis vid Hodgkins sjukdom senare leda till sänkt tyreoideafunktion. Störd sköldkörtelfunktion kan även uppstå efter kranialbestrålning. Hjärtskador kan uppträda efter strålbehandling mot mediastinum och som inkluderar hjärtsäck och delar av eller hela hjärtat. En tidigarelagd koronarskleros har diskuterats då efterundersökningar av Hodgkinpatienter uppvisad en hög både symtomatisk och asymtomatisk frekvens av hjärt­ problem hos tidigare behandlade patienter. Antracyklinbehandling är poten­ tiellt hjärttoxiskt särskilt om den drivits över rekommenderade maxdoser (t.ex. för vuxen rekommenderad adriamycindos 550 mg/m2 kroppsyta om hjärta ej samtidigt bestrålats). Även andra cytostatika, som exempelvis kombinationen platinol och 5-fluorouracil, kan ha en hjärttoxisk effekt. Vincaalkaloider har en neurotoxisk effekt. Tidiga symtom på toxiska effekter kan ses från långa perifera nerver (som bortfall av akillesreflexer och störningar av den autonoma innervationen av tarmar). Mindre vanligt är direkta pareser av nedre extremiteter t.ex. som utveckling av droppfot. Behandling med cytostatikat cisplatinum kan ge upphov till skador på hörsel och njure särskilt om behandling ej skett med erforderlig hydrering och hänsyn till dosnivåer. © Studentlitteratur 243 Kapitel 24 Det germinativa epitelet i gonader är i alla åldrar känsligt för skador orsa­ kade av cytostatika och joniserande strålning. Utbredningen och kon­ sekvenserna av exponeringen är dock olika i olika åldrar och mellan könen. Generellt är testiklarna mer känsliga än äggstockarna. Män i pubertet och i vuxen ålder löper stor risk att bli infertila av vissa cytostatikaregimer. Tidigare strålbehandling och hormoner/tillväxt hos barn GH* KönsThyroidea hormon Kranial bestrålning ++ + + Kraniospinal bestrålning ++ + + ”Total body irradiation” + + + Skelett­ utveckling – ++ + * GH = tillväxthormon Stråldosens betydelse för tillväxthormon och tyreoideafunktionen Kranial bestrålning (Gy) –24 25–45 46–55 % med tillväxthormonbrist 20–30 50 80–100 % med abnorm tyreoideafunktion 2 40 46 Sena sequele till tumörbehandling i tidig ålder Endokrina Tillväxt Gonadfunktion Tyreoideafunktion Andra bristtillstånd Njurskador Hjärtskador Neurologiska skador Syn Hörsel Infektionsbenägenhet Sekundära tumörer Genetisk skada hos avkomma Missbildning Tumörsjukdom 244 © Studentlitteratur Något om de vanligaste tumörerna och deras orsaker … Mindre känsliga är de hormonproducerande cellerna i gonaderna, men även här kan man se framförallt kompenserade testosteronbrister (t.ex. förhöjda LH-nivåer med testosteron inom normalvärdesgräns). Övergående hormon­ rubbningar efter att cytostatikabehandlingen avslutas är vanliga (t.ex. gyne­ komasti första 1–2 månaderna, vilket implicerar ett relativt östrogenöver­ skott i förhållande till testosteron). Efter vissa tumörbehandlingar kan man se förhöjda testosteronnivåer och höga LH och FSH nivåer, vilket skulle kunna tala för att även hormonreceptordelen kan störas av cytostatikabe­ handlingar. Hos kvinnor är den gonadskadande effekten och risken för tidig menopaus åldersbetingad. Ju närmare en kvinna befinner sig åldern för naturlig menopaus desto känsligare är kvinnan för behandlingen. Risken för sekundärtumörer hos behandlade barn varierar från 3–12 % inom 20 år från behandlingstillfället (detta motsvarar en tiofaldig ökning jämfört med bakgrundsbefolkningen). Exponering för joniserande strålning och alkylerande cytostatika är de huvudsakliga terapiriskfaktorerna. Dess­ utom måste det påpekas att barn som haft en tumör på grund av en hereditär risk, i sig själv kan ha en ökad risk för en ny tumör. Medeltiden för att utveckla en terapiorsakad leukemi var 4,5 år, 5 år för ett non-Hodgkinlym­ fom och 12 år för en solid tumör efter behandling för Hodgkins sjukdom hos barn. De flesta sekundära solida tumörer (ben och mjukdelssarkom, tyreoideacancer, bröstcancer och hudtumörer) är relaterade till given strål­ behandling. Typen av cytostatika som givits spelar roll för risken att utveckla leukemi. Ju längre terapi med alkylerare som givits desto större är också risken. Cytostatika i form av MOPP (mustin, onkovin, prokarbazin och prednisolon) verkar vara mer leukemogen än ABVD (adriamycin, bleo­ mycin, vinblastin, deltison). Sista året har en mycket hög risk för bröst­ cancer beskrivits hos flickor som fick strålbehandling för Hodgkins sjuk­ dom under puberteten. En livstidsrisk på mellan 50–75 % har beskrivits. Avkomman till patienter som behandlats med cytostatika uppvisar inte fler missbildningar än förväntat om behandlingen givits före konceptionen. Enstaka missbildade barn har beskrivits hos kvinnor som erhållit kemoterapi under första trimestern. Graviditeter inom ett år från avslutad kemoterapi kan leda till att en ökad frekvens av lågviktiga barn föds och detta tros snarare bero på att cytostatikabehandlingen hämmar uterusfunktionen än på en kvar­ stående effekt av kemoterapin hos barnet själv. Möjligheterna av en ökning av recessiva mutationer hos avkomman till en tidigare cytostatikabehandlad patient som blir synliga först flera generationer i framtiden har diskuterats. Medan djurförsök kan ge ett visst stöd för att en sådan risk kan finnas, finns det ännu ej några forskningsdata från människan som stödjer detta. © Studentlitteratur 245 25 Aspekter på okänd primärtumör Adenokarcinom svarar för omkring 40–60 % av alla tumörer där pri­ märtumören initialt är okänd. De vanligaste lokalisationerna för metastaser där primärtumören är okänd är halslymfkörtlar, lever och ben. När en skiv­ epitelcancermetastas uppträder på halsen utan att primärtumör är känd visar det sig vid en uppföljning att naso- och hypofarynx är de vanligaste ursprungslokalerna. En submentalt belägen metastas, en metastas belägen under hakan, talar för primärtumör i mungolv, läppar eller främre del av tunga, en submaxillär metastas kan ha sitt ursprung i trigonum retromolare eller mellan tunga och gom. En metastas till jugulodigastriska körtlar talar för primärtumör i epifarynx, tungbas, tonsill, nasofarynx eller larynx. En metastas mitt på halsen talar för primärtumör i epifarynx, orofarynx, tung­ bas eller larynx. Metastas långt ned på halsen kan ha tyreoidea, epifarynx eller nasofarynx som ursprung. Supraklavikulära körtlar pekar mot lunga, tyreoidea, GI-kanal eller urogenitalsfär. En hjärnmetastas eller benmärgsinfiltration utan känd primär har ofta lunga som primärtumörursprung. Hos en kvinna som debuterar med en axillmetastas hittas tumören ofta i samma sidas bröst. I 2 % av melanom­ fallen hittas ingen primärtumör och hypotesen är att primärtumören i dessa fall kan ha spontanregredierat. En rad tumörmarkörer kan vara stöd vid ett diagnostiskt övervägande. Hos anaplastiska eller lågt differentierade tumörer kan ibland tumörmarkö­ rer eller cytogenetik bidra till diagnos. En del av dessa tumörer utgör lågt differentierade lymfom och det kan vara terapeutiskt viktigt att särskilja dessa. Hos andra generaliserade eller lokalt avancerade odifferentierade eller anaplastiska tumörer (lågt differentierat karcinom eller lågt differen­ tierade adenokarcinom med okänd primärtumör) kan man ibland åtmins­ tone temporärt ha god nytta av kemoterapi. Vanliga kombinationer har då inkluderat cisplatinum och/eller doxorubicin. Kompletta och partiella remissioner kan ses i upp till 50 % av fallen i olika patientmaterial och det har hävdats att mellan 5–10 % av patientgruppen är potentiellt kurabla. 246 © Studentlitteratur Aspekter på okänd primärtumör Behandlingen av en skivepitelcancermetastas på halsen med okänd pri­ märtumör får ofta uppläggningen av konventionell radioterapi mot metas­ tasområde inkluderande möjliga ockulta primärtumörområden. För N1–N3sjukdom kombineras ofta strålbehandling med operation (”radical neck dis­ section”). Om metastas är stor och fixerad kan initial behandling med cytos­ tatika övervägas (ofta inkluderande cisplatin och 5-fluorouracil). Vid perito­ neal karcinomatos kan det ibland vara svårt att avgöra primärtumörursprung. Ofta rör det sig om metastasering från ovarium, mag-tarmkanal eller bröst. Både morfologi och tumörmarkörer kan vara ospecifika och klinikern får ibland inleda terapi utan säker primärtumördiagnos. Terapi har oftast följt riktlinjer för avancerad ovarialcancer och bäst resultat har uppnåtts med systemisk eller intraperitoneal cisplatinbaserad kemoterapi. Kirurgisk redu­ cering av tumörmassor (”debulking operationer”) kan vara aktuella. Kon­ troll av ascites kan även inkludera drän, buktappningar och infusion av radionuklider. Bland neuroendokrina tumörer hos vuxna (se s. 249) finns undergrupper som kan svara på kombinationskemoterapi (cisplatin och etoposid inne­ hållande regimer). Patienter med förhöjda B-HCG eller AFP och med kliniska tecken som kan tala för ett extragonadalt teratom bör behandlas med kemoterapi effek­ tivt för teratom, även om den histopatologiska diagnosen inte är diagnos­ tisk. En primär tumörs ursprung kan säkrare fastställas med histopatologiska specialundersökningar, cytogenetik, elektronmikroskopi och molekylärbio­ logiska undersökningar. Specialfärgningar keratin, melanin, leukocytantigen, T- och B-cells­ antigen, markör för neuroendokrin vävnad, tumörmarkörer. Cytogenetik a) benign versus malign epiteliell tumör i njure, tyreoidea, spottkörtel och äggstock b) benign versus malign mesenkymal tumör i fett- och muskelvävnad c) typ av ben- och mjukdelstumör d) diagnos av odifferentierad småcellig tumör. Molekylärbiologi somatiska mutationer i tumör. Elektronmikroskop sarkom, melanom, småcelliga tumörer. © Studentlitteratur 247 Kapitel 25 Tumör från okänt origo En patient som debuterar med metastaserande sjukdom utan att primär­ tumören är känd behöver utredas på ett speciellt sätt. Vilka ursprungstumö­ rer är behandlingsbara och botbara? Nedan följer exempel på viktigare origo som behöver uteslutas. Tumörtyp Kommentar Testistumör Även botbar som spridd sjukdom. Cytologi. Histopatologi med tumörmarkörer. Även botbar som fjärrspridd sjukdom. Cytologi. Histopatologi med immunologisk fenotypning. Cytogenetik. Om endast regional spridning möjlighet till bot. Cytologi. Histopatologi. Spridd sjukdom kan pallieras om cancer radiojodupptagande. Kan pallieras. Cytologi. Histopatologi. Prostataspecifikt alkaliskt fosfatas. Om endast regional spridning möjlighet till bot. Cytologi. Histopatologi. Immunologisk färgning. Hormonreceptorer. Långtidsöverlevande finns hos barn. Histopatologi. Katekolaminer och dess metaboliter. Även botbar som fjärrspridd sjukdom. Benmärgsprov, blodanalys. Cytogenetik. Om ensam metastas långvarig palliation möjlig. Cytogenetik Cytologi. Immunologi och cytogenetik. Om endast regional spridning möjlighet till bot. Cytologi och/eller histopatologi. Immunodiagnostik. Om ensam metastas långvarig palliation möjlig. Cytologi. Histopatologi. Melaninpigment. Även botbar som fjärrspridd sjukdom. Cytologi. Histopatologi. Neuronspecifikt enolas. Lymfom Tyreoideacancer Prostatacancer Bröstcancer Neuroblastom Leukemi Sarkom Histopatologi ÖNH-tumör Melanom Småcellig lungcancer 248 © Studentlitteratur Aspekter på okänd primärtumör Neuroendokrina tumörer hos vuxna – småcellig lungcancer – extrapulmonellt småcelligt karcinom – karcinoider – ö-cellstumör i pancreas – medullär tyreoideacancer – paragangliom – merkelcelltumör – atypisk karcinoid (lunga) – perifert neuroepitheliom – neuroblastom hos vuxen Cytogenetiska fynd som är karaktäristiska i vissa småcelliga tumö­ rer av rundcelltyp Neuroblastom del(1p), hsr, dmin Extraskelettala kondrosarkom t(9;22)(q22;q12) Ewings sarkom t(11;12)(q24;q12) Rabdomyosarkom t(2;13)(q35;q14) t(1;13)(p36;q14) Desmoplastisk småcellig rundcellstumör t(11;22)(p13;q12) Non-Hodgkin-lymfom olika specifika aberrationer © Studentlitteratur 249 26 Genterapi och tumörsjukdomar Ett framtidsområde inom medicinen innefattar naturligtvis möjligheterna av att kunna manipulera gener genom att antingen ersätta en defekt gen eller introducera en normal gen till celler som saknar genen i fråga. Onkologin är här inget undantag. Överföring av genetiskt material kan ske på många sätt, varav det vanli­ gaste innefattar användning av retrovirala vektorer. De retrovirala vekto­ rerna konstrueras genom att gag-, pol- och env-gener tas bort (dessa gener kodar för produktion av virala proteiner) och ersätts av genen av intresse. Saknar vektorn gag-, pol- och env-generna kan vektorn ej föröka sig själv, men den kan produceras i särskilda paketerande cellinjer som själva inne­ håller gag-, pol- och env-sekvenser. Dessa cellinjer saknar dock psi-genen som är nödvänding för att sätta ihop viruset. Vektor-DNA (med genen av intresse) och som innehåller psi-genen introduceras till den paketerande cellinjen. Cellinjen producerar därefter retrovirala vektorpartiklar som innehåller företrädesvis genen av intresse. Genen kan därefter överföras genom att den vektorproducerande cellin­ jen samkultiveras med målceller eller genom att inkubera målceller i medium från vektorproducerande cellinjer. Vissa nackdelar med retrovirala vektorer finns. För det första finns begränsningar i storlek av det överförbara genetiska materialet, vilket med­ för att man inte kan överföra humana gener som är större än 10 kilobaser. Det andra problemet är att retrovirus bara kan infektera celler i delning. Vilande celler, vilka ju utgör huvuddelen av kroppens celler, kan ej nås. Det tredje problemet med retrovirala vektorer är att de snabbt förstörs i serum. Alternativ till retrovirus är under utveckling. Bland de mer hoppingivande metoderna återfinns användandet av adenovirus, adenoassocierade virus och herpes simplex virus. De två förstnämnda grupperna uppvisar en vävnadstropism för epiteliala ytor som ibland kan vara värdefull. Tropism till respiratoriskt epitel har bl.a. utnyttjats vid cystisk fibros. Herpes simples virus är stora och kan bära en enorm mängd humant DNA. Både adenoasso­ cierade virus och herpes simplex kan infektera vilande celler. 250 © Studentlitteratur Genterapi och tumörsjukdomar Metoder att ersätta ytprotein hos virus med antikroppsfragment för att påverka dess tropism är under utveckling. Ett annat sätt att överföra DNA är att naket DNA injiceras. Genöver­ föring har åstadkommits genom injektion av DNA på detta sätt i muskel. För att ytterligare styra överföringen kan DNA kopplas till exempelvis en receptor som cellen uttrycker (DNA-ligand komplex). Andra sätt som utvecklats för att överföra genetiskt material är komplex mellan lipider, liposomer och DNA-plasmider. Genöverföring har också åstadkommits med guldpartiklar klädda med DNA som bombarderat en cell. Attenuerade bakteriestammar, innehållande en viktig gen, kan också användas för att nå retikuloendoteliala systemet och inducera ett immunsvar. Genterapi har redan använts för att undersöka tumörinfiltrerande lymfo­ cyters (TIL) vävnadsdistribution vid melanom. Vidare har TNF (tumour necrosis factor) tillförts TIL i terapeutiska försök. Genterapi har också använts för att ersätta kongenitala immundefekter (t.ex. adenosin deaminas defekt). Teoretiskt skulle genterapi kunna ges för att ersätta förluster av suppressorgener. Problemet här är att alla tumörceller måste nås av genen. Ett annat område som prövas är att styra cytotoxisk terapi selektivt till tumörceller, genom att man med vektorer introducerar enzym som kon­ verterar cytostatika till aktiva former mer selektivt i tumörceller (enzymet självt aktiveras av gensekvenser som bara finns i tumörcell). Anticancervaccin är en annan forskningslinje som rönt ökat intresse i och med upptäckten att humana tumörceller har minskad mängd MHC (major histocompatibility) klass I molekyler. Hos tumörceller som transfekteras med MHC I gener i djurmodeller förhindras metastasering och remissioner uppstår i metastaser vid etablerad sjukdom. Ett annat område för genterapi kan vara bruk av antisense oligodeoxynu­ kleotider komplementära till specifika DNA- eller RNA-sekvenser av t.ex. onkogener. Bundna till sitt mål inhiberar dessa molekyler selektivt trans­ lationen av dessa gener. I cellkulturer har Burkittlymfomväxt inhiberats genom att antisense oligodeoxynukleotid riktats mot den abnorma c-myc genen. Ett problem hittills med antisense oligodeoxynukleotider är deras relativa instabilitet. Detta håller man på att försöka lösa med kemisk modi­ fikation. Om det vid solida tumörsjukdomar med tumörspecifika translokationer visar sig vara vanligt med fusionsgener kan dessa geners mRNA eller pro­ tein bli ett mycket viktigt mål för tumörterapi, eftersom dessa fusionsgener är primära förändringar och genprodukterna tumörspecifika. I framtiden kan man därför räkna med ett stort antal möjligheter att över­ föra genetiskt material som terapi. Möjligheten att utnyttja tumörspecifika © Studentlitteratur 251 Kapitel 26 promotorer, joniserande strålning eller ett läkemedel för att aktivera gen selektivt i tumörvävnaden öppnar oanade möjligheter inför framtiden. Det vi hittills sett är bara början på en mycket spännande era inom humanmedi­ cinen. Mutation/genterapi Olika nivåer för genetisk intervention/terapi Före konception avstå från reproduktion selektivt val av livspartner Embryonalt provtagning av chorion villi/fetala celler i amnionvätska, mutations­ analys med möjlighet till abort målstyrd genkorrektion (targeted gene replacement) Barndom-vuxet liv Tumör vektoröverföring av gen antisense-terapi antigen-terapi terapi med läkemedel som affekterar tumörinitierande/promotions gener Normal vävnad autolog (allogen-) transplantation av vävnad som genetiskt förändrats t.ex. targeted gene replacement i lymfocyter (t.ex. TIL celler) läkemedel som påverkar initierande gener eller promotionsgener i en vävnad som annars verkar som prekursorer för tumörutveckling (kemoprevention) Förutsättningar för genterapi hos människa 1. 2. 3. 4. 5. Genen är isolerad Relativt lätt att förflytta/introducera genen Genen bör uttryckas en längre tid Transplantationsprocedur bör finnas för människa En korrektion av sjukdomsfenotyp bör ske efter transplantation 252 © Studentlitteratur Genterapi och tumörsjukdomar Kriterier på sjukdom speciellt lämplig för genterapi 1. Obehandlad är sjukdomen dödlig 2. Sjukdomen är ovanlig 3. Konventionell behandling är dålig eller saknas 4. Sjukdomsgen är isolerad och är helst en liten gen med ett fåtal till en enda variant av sjukdomsmutation 5. Sjukdomsgenen har en okomplicerad reglering 6. Genprodukten (proteinet) fungerar över ett stort koncentrationsintervall 7. Överproduktion av proteinet är inte farligt 8. Endast celler med normal gen överlever 9. Målcell kan lätt isoleras och vävnad kan lätt manipuleras (t.ex. ben­ märg) 10. Tillförd gen uttrycks under lång tid i cell Genterapi – begränsningar typ av gen typ av drabbad vävnad vävnad prolifererar eller i vila typ av sjukdom behöver alla celler rekonstitueras räcker partiell rekonstitution räcker det med att ett litet fåtal celler får gen vektor typ av vektor [virus (AAV, retrovirus, adenovirus), plasmid, liposom] vävnadstropism vektorns egen genmassa immunogenicitet transfektionens resultat behov av cytostatikastimulering behov av tillväxtfaktorer (Il-3, Il-1, SCF) antal injektioner av celler som transfekterats andel celler med ny gen (vanligen 0.5–3 %) Sjukdomar där direkt genterapi spåtts en stor framtida roll hematologiska sjukdomar immunologiska sjukdomar maligna sjukdomar © Studentlitteratur 253 Kapitel 26 Exempel på användning av genterapi och hematopoetiska stamceller 1. Som markör för tillförd benmärgs- eller perifer stamcell 2. För att modulera funktion av immunologiska celler t.ex. genom att till­ föra gen som ökar immunsvar hos immunocyt 3. För att generera tumörvaccin från tumörceller isolerade från benmärg t.ex. genom genterapi öka immunogenicitet av tumörcell 4. För korrektion av enstaka gendefekter (single gene defects) 5. För att modifiera drogkänslighet hos stamceller t.ex. öka resistens mot cytostatika 254 © Studentlitteratur 27 Utmaningar inför 2000-talet Incidensen av vissa tumörsjukdomar som melanom, non-Hodgkinlymfom, och testiscancer ökar. Rent allmänt uppskattar man att cancerincidensen kommer att öka mellan 1990 och 2010 med drygt 20 %. Inför de närmaste åren blir det en viktig uppgift att försöka identifiera orsaken till denna ökning och om möjligt eliminera eventuella miljöfaktorer som kan vara ansvariga. För melanom vet man att intermittent UV-exponering som leder till brännskador hos disponerade individer spelar roll. Det är ännu oklart om en förtunning av ozonlagret bidrar till den ökade risken.Vissa andra faktorers betydelse för melanomsjukdomen, såsom bruk av solskyddsmedel och olika typer av solariebruk, är också oklara. En del talar för att ytterligare riskfaktorer vid sidan om UV-ljus och konstitution återstår att upptäcka om man skall kunna förklara den kraftiga sjukdomsutvecklingen. Orsaken till ökningen av non-Hodgkinlymfom är okänd. Eftersom HIV är associerat med lymfomsjukdom har det föreslagits att HIV-epidemin skulle vara orsak. Detta kan dock inte stämma då en mycket liten andel av alla lym­ fompatienter är HIV-positiva. Fortsatta studier för att definiera möjliga risk­ faktorer bör ha en hög prioritet. Nyligen upptäcktes att patienter som fått blodtransfusioner har en ökad risk för lymfom 5–15 år efter exponeringen, ett fynd som möjligen kan ha betydelse. Möjligheten att nya, icke-definie­ rade virus skulle kunna vara förklaringen till detta samband måste utredas. Testiscancer ökar. Den högsta incidensen i världen finns på Själland med en hög incidens i kustbandet längs västra Sverige och Norge. Även en ökning av antalet barn födda med kryptorkism (en riskfaktor för testiscancer) har noterats. En hypotes har gjort gällande att hormonförändringar hos modern (t.ex. östrogenöverskott) påverkar fostret och senare ger ökad risk för testiscancer. Således är det en angelägen uppgift att klarlägga dessa samband för att finna en effektiv prevention för sjukdomen. Orsaken till ökningen av lungcancer hos kvinnor är till största delen känd. Effektiv antirökpropaganda behöver nå ut till kvinnor/flickor särskilt i årskurs 7–9 i skolan. Det är i denna ålder som flickor börjar röka mer än © Studentlitteratur 255 Kapitel 27 män. Detta scenario kommer att ha till följd att efter år 2000 kommer fler kvinnor än män att få lungcancer och möjligen även andra rök­ ningsrelaterade tumörer. Redan får fler kvinnor än män lungcancer innan 55-årsålder. I övrigt kommer forskningen kring orsaker till cancersjukdomarna att vara inriktad på att finna samband mellan kostfaktorer och maligna tumörer. Denna forskning kommer att vara oerhört svår på grund av att kosten varie­ rat så mycket i olika åldrar och att det finns så många komponenter. Extremgrupper som för speciella dieter eller individer som migrerar mellan olika kulturer kan möjligen ge oss viss kunskap. Ett säkert hormonellt preventivmedel för kvinnor utvecklat både för att förhindra bröstcancer och gynekologisk cancer kommer snart att finnas och ersätta nuvarande hormonmediciner. Fysiskt aktivitet (t.ex. motionsidrott eller tävlingsidrott i tidig ålder) har redan nu visats ha en tumörförebyggande effekt och propaganda för detta blir viktig att underhålla i framtiden. Kemoprevention, t.ex. med A-vitamin eller dess derivat till riskgrupper för rökningsrelaterade tumörsjukdomar, kanske blir viktig även om nyligen publicerade resultat lett till en viss besvikelse inom detta område. Ett annat område med stor potential verkar vara förebyggandet av kolorektalcancer med antiinflammatoriska medel som t.ex. acetylsalicylika hos högriskindivider. Likaså kan riktad kemoprevention till patientgrupper med hög risk för hormonberoende tumörsjukdom bli etablerad. Ett riskgruppstänkande, då man mer tänker på individens–familjens spe­ ciella risker för tumörsjukdom och annan sjukdom, kommer att bli viktigare än ett tänkande som utgår mer diffust ifrån hela befolkningens risker. Detta kommer att sporras av den moderna kartläggningen av olika gener vid de olika tumörsjukdomarna. Effekten av detta blir att screeningverksamhet kommer att individ/familjeanpassas och riskgrupper kommer att ”screenas” snarare än hela befolkningen. Sjukvårdsekonomiskt kommer man att spara stora pengar på denna individorienterade screening där screening av både tumörsjukdom och andra sjukdomar ofta skulle kunna kombineras och skräddarsys mot familjens sjukdomsrisk. Kanske kommer vi att få speciella screeningcentra som erbjuder detta. Screeningmetoder riktade till hela befolkningen finns hittills i praktiskt bruk bara för kvinnor (bröstundersökning för kvinnor över 50 år och liv­ moderhalsundersökning hos kvinnor från 25 års ålder). Metoder att ”screena” kvinnor under 50 år för bröstcancer och män och kvinnor för kolorektalcancer vid 50–60 års ålder är under utarbetande. Ovarial- och 256 © Studentlitteratur Utmaningar inför 2000-talet prostatacancer är två andra sjukdomar där studier med tidigdiagnostik pågår men där cost-benefit ej säkert visats. En ökad användning av profylaktiska operationer för individer med here­ ditär högrisk för maligna tumörer kommer att ske. Förhoppningsvis kom­ mer läkemedel/genterapi senare som gör att man kan undvika stympande operationer av högriskindivider. Uppföljning av livskvalité och tumör­ preventiva effekter är mycket angeläget i högriskfamiljerna. Forskningen om orsaker kring cancer kommer alltmer att gå ifrån stora ytliga registerstudier och i stället kommer man att få se mer epidemiolo­ giska studier som sammankopplar riskfaktorstudier med tumörbiologiska fynd och molekylärbiologi. Detta kommer att ge en djupare förståelse för hypoteser som studeras. Det är också troligt att man kommer att identifiera fler tumörmutationer som direkt kan knytas till ett speciellt etiologiskt agens. Sammankopplingen mellan genetisk konstitution och risk för miljö­ påverkan kommer också att bli bättre utrett (området ekogenetik blir forsk­ ningsmässigt mer etablerat). En ökad strävan att mäta en tumörs funktionella aggressivitet snarare än att få en episodisk ögonblicksbild över utseendet av tumören, kommer att ställa stora krav på morfologer att ge tumörbeskrivningar en mer funktio­ nell/fysiologisk bild (”det blir viktigare att mäta vad en tumör gör än hur den ser ut”). Nya diagnostiska metoder, som t.ex. PET (positron emissions tomografi) och funktionell MR-diagnostik, kommer att bli etablerade sätt att studera tumörförlopp ur ett mer fysiologisk betraktelsesätt. Användning av monoklonala antikroppar kommer att öka både i diag­ nostik och terapi. Det står dock redan klart att denna nya teknologi kommer att brottas med likartade problem som andra diagnostik- och terapimodali­ teter redan stött på t.ex. tumörheterogenitet och tumörprogression. För varje patient behövs sannolikt ett batteri med antikroppar, som mer eller mindre blir individanpassat. Olika möjligheter till genterapi väntar runt hörnet och förhoppningarna är stora på att man skall kunna finna terapeutiska genombrott speciellt vid flera av våra vanliga tumörsjukdomar, som vi dåligt kan behandla vid regional- eller fjärrspridning. Fundamentalt är då hur det egentligen för­ håller sig mellan olika tumörsjukdomar och mellan olika patienter med samma sjukdom. Är det så att ett fåtal basala genförändringar styr can­ ceromvandlingen i olika tumörer eller mellan olika patienter, då finns det hopp om att man kan hitta ny värdefull terapi genom att utforska dessa gemensamma genmekanismer. Är det istället så att ett stort antal olika slumpartade förändringar var och en för sig kan orsaka kaos i det genetiska © Studentlitteratur 257 Kapitel 27 materialet med död för cellen eller tumöromvandling som resultat och att det i princip kvittar vilken förändring som inträffar, då finns anledning till stor pessimism angående möjligheterna att finna generella terapier för maligna tumörer. Vid behandling kommer man att starkare skilja på den behandling som är lokalrecidivförebyggande och den som är metastasförebyggande. Ökad användning av neoadjuvant cytostatikabehandling kan till viss grad förutspås. Däremot kommer introduktion av nya cytostatika att vara begrän­ sad. Det kommer att bli viktigare att för olika sjukdomar utreda om behand­ lingsresultaten påverkas mer av dosintensitet än total duration av behandling. Nya fraktioneringsmönster vid strålbehandling är under utveckling. Man kan förutspå en ökad användning av hyperfraktionerad strålterapi. Patienten kommer att få en intensivare primärbehandling med mer akutreaktioner men med sannolikt mindre seneffekter och bättre behandlingsresultat. Om ekonomin tillåter kommer patienter att behandlas med flera fraktioner strål­ behandling per dag inkluderande helger. Man kommer också att kunna skräddarsy dosfördelning på ett bättre sätt och genom tredimensionell dos­ planering optimera strålfält. Med moderna diagnostiska metoder kommer en bättre avgränsning mellan tumör och normalvävnad till stånd. Använd­ ning av nya strålmodaliteter, som t.ex. protonterapi kommer att öka. Olika sätt att optimera kemoterapi och strålterapi genom kombinerad behandling, med hypertermi eller med ”sensitizers”, kommer att utvecklas. Nya terapimodaliteter som laserljus med hematoporfyrinderivat kommer ännu mer att utvecklas, även om dess användning framförallt kommer till pass vid ytliga tunna tumörer. Det är möjligt att vårt mål med terapin i många fall borde vara att etablera en balans mellan värd och tumör och att alltså se tumörsjukdomen mer som en kronisk sjukdom än en sjukdom som måste utrotas. Utveck­ lingen med tumördifferentierande terapi har kanske ännu inte gett det man hoppats på, men genombrott kan kanske komma. Organisationen av cancersjukvården kommer att ses över. En utveckling mot högspecialiserade cancersjukhus är trolig. En multidisciplinär samver­ kan mellan olika specialister organvis i både klinik och forskning är trolig. Prevalensen av tumörsjuka kommer att öka. Det har uppskattats att bort­ emot 350 000 individer i befolkningen 2010 kommer att ha drabbats av en malign tumörsjukdom. Botade barn som kommer in i vuxenålder liksom vuxna som någon gång haft en tumörsjukdom kommer att vara talrika. I vår medicinska utövning bör vi bibehålla en skärpt uppmärksamhet på sen­ effekter av behandlingen. Viktigt är då att inte bara tänka på kroppsliga komplikationer utan även på potentiella psykosociala bekymmer. 258 © Studentlitteratur Utmaningar inför 2000-talet Vår patient kommer att bli allt mer konsumentmedveten och mer ifråga­ sätta doktorns auktoritet. Det kommer att bli vanligt att patienten söker flera doktorer för att få höra mer än en åsikt innan patienten tar beslut. Fram­ tidens patient kommer också att söka information via kompletterande vägar som Internet och således ibland vara mer påläst än doktorn själv om de senaste medicinska nyheterna. Användning av alternativa behandlingar och naturmedel kommer att fortgå i oförminskad grad. Oerhört viktigt i denna marknadsorienterade sjukvård är att man bevarar vårdprogram och strävar att utveckla terapin med hjälp av populationsbaserade randomiserade stu­ dier i en sjukvårdsregion. En ohämmad användning av cytostatika och andra behandlingar bland doktorer, som skulle kunna styras av andra motiv än vetenskap och beprövad erfarenhet, blir mycket kostsam för huvudmän­ nen och patienten. Rikstäckande och nordiska/internationella vårdprogram vid mer sällsynta tumörsjukdomar är av stor vikt för att upprätthålla en hög vetenskaplig kompetens. Det är också viktigt att vetenskapligt dåligt doku­ menterade behandlingsmetoder ställs i rampljuset och under en omfattande vetenskaplig granskning innan politiker och administratörer ger ekonomiskt stöd (det senaste exemplet på en dåligt dokumenterad behandlingsform är elektricitetsbehandling av cancersjukdomar). Likaså kan man säga att om forskningen skulle visa att t.ex. elektricitetsbehandlingen av tumörsjukdo­ mar har en plats, då har forskare också en plikt att på ett ansvarsfullt sätt meddela detta till allmänheten. Det europeiska samarbetet och EU-anslutningen är ett faktum och en ökad samverkan över gränserna kan också väntas med länderna i Öst­ europa. Sjukvård och forskning kommer att utvecklas snabbt och förhoppningsvis kommer länderna kring Östersjön att återfå en ledande roll inom medicinen. De nordiska länderna måste strida för personnumrens bevarande inom medicinen inför den EU-lagstiftning som diskuteras. Per­ sonnumren är vitala för att identifiera individer inom sjukvårdsapparaten och vid epidemiologisk forskning är personnumret nästan oersättligt. © Studentlitteratur 259 Appendix 1 Referenslitteratur tumörsjukdomar, några exempel Medicinska tidskrifter – allmänna Norden Läkartidningen Norsk Tidskrift for Laeger Ugeskrift for Laeger Nordisk Medicin Europa The Lancet British Medical Journal International Journal of Epidemiology Journal of Chronic Disease USA, övrigt The New England Journal of Medicine Science Nature American Journal of Epidemiology Medicinska tidskrifter – tumörsjukdomar Norden Acta Oncologica Europa European Journal of Cancer British Journal of Cancer International Journal of Cancer Cancer Causes and Control The Cancer Journal Anticancer Research Neoplasma 260 © Studentlitteratur Appendix 1 Annals of Oncology Genes, Chromosomes and Cancer Seminars in Oncology Surgical Oncology Radiotherapy and Oncology USA, övriga länder Journal of the National Cancer Institute Cancer Cancer Research Journal of Clinical Oncology Cancer Detection and Prevention Cancer Epidemiology, Biomarkers and Prevention International Journal of Preventive Oncology International Journal of Radiation, Oncology, Biology and Physics Journal of Cancer Education Cancer Genetics and Cytogenetics Oncogene Gann Specialtidskrifter The Breast Breast Diseases Breast Cancer Research and Treatment Melanoma Research Leukemia Research Hematological Oncology The Blood European Journal of Heamatology American Journal of Pathology American Journal of Surgical Pathology Acta Pathologica Microbiologica Scandinavica Acta Dermatologica British Journal of Dermatology Acta Obstetrica Gynecologica American Journal of Obstetrics and Gynecology British Journal of Obstetrics and Gynecology Acta Obstetrica Gynecologica Scandinavica Surgery, Obstetrics and Gynecology Nature Medicine Nature Genetics © Studentlitteratur 261 Appendix 1 Böcker Cancer, Principles of Oncology and Practice, de Vita et al Surgical Oncology, Veronesi et al Medical Oncology, Bonnadona et al Cancer and Aging, Nordenskjöld et al Cancer Cytogenetics, Heim and Mitelman Tumörsjukdomar, Romanus et al Cancer Incidence of Sweden, 1992 Cytostatikamanual i Sydsverige. 1993. Regionala tumörregistret, Lund Referensbanker Medline Cancerlit Current Contents Excerpta Medica Index Medicus Cancergram Vårdprogram Avhandlingar 262 © Studentlitteratur Appendix 2 Formler för strålbehandling och biologiska stråleffekter Strandqvists diagram Log D i relation till Log T D = kT 0.22 Cohens formel D = kT 0.33 NSD = nominell standard dos D = konst * N0.22 * T0.11 för hudtolerans D = konst * N0.20.22 * T0.112 för behandling 5 dagar i veckan CRE (cumulative radiation effect) D = konstant * N0.24 * T 0.11, CRE = konstant, D = totaldos, N = antal fraktioner, T = total behandlingstid, d = fraktionsdos CRE = D * N–0.24 * T–0.11 Obs! stämmer vid rimliga doser. Vid extremt höga eller låga doser stämmer modell ej. TDF (time dose factor) matematisk omskrivning av NSD eller CRE. a/ß linjär kvadratisk modell –lnS = N(ad + ßd2) eller –lnS = D(a + ßD) Antar att viss vävnadseffekt (E) motsvarar en viss utarmningsnivå för en kritisk targetcell population (S) E = –lnS E/a = -lnS/a = D/a(a + ßD/a) BED = biologisk effektiv dos, BED = D(1 + d/a/ß), a/ß kan bestämmas empiriskt från cellöverlevnadskurvor, svårare att bestämma a och ß i sig själv. Hög a/ß = 10 kännetecknar tidigt reagerande vävnad medan sent reagerande vävnad har en låg a/ß = 2–3. © Studentlitteratur 263 Appendix 3 Handläggningen av vissa vanligare hereditära cancerformer Diagnostik och uppföljning av hereditär cancer Cancerform Bröstcancer Screeningmetod Intervall Särskilda kommentarer mammografi 1 gång/år ultraljud* MR* klin. undersökning egen undersökning Ca 15-3 1 gång/år 1 gång/år 1 gång/år varje månad 2 gånger/år profylaktisk opera­ tion efter 35 års ålder start 25 år eller 5 år innan första diagnosår i familj ” ” ” utbild. på egen palpation vid start av screening försöks­ verksamhet övervägas eller efter fullbordad reproduk­ tion (lobulär cancer, atypiska hyperplasier stärker indikation) Ovarialcancer, bröst-ovarialcancer bröst som ovan klinisk undersökning ultraljud ovarier (färg-doppler-u-ljud)* Ca 125 profylaktisk operation 1 gång/år start 25-årsåldern eller 5 år innan första sjukdomsfall inträffat 1 gång/år start 25-årsåldern eller 5 år innan första sjukdomsfall inträffat start 25-årsåldern eller 5 år innan första sjukdomsfall inträffat efter 35-årsåldern eller efter full­ bordad reproduktion 2 gånger/år (ovarium) hormonell substitution (kombinerad östrogen/ progestin om uterus kvar) * På forskningsbasis. 264 © Studentlitteratur Appendix 3 Cancerform Screeningmetod Intervall Särskilda kommentarer Tjocktarmscancer Familjär polypos (Gardner och FAP) proktosigmoidoskopi (alla första gradssläktingar) varje år start 10–12-årsåldern vart tredje år efter 40-årsåldern gastroskopi/ start vid polyposdiagnos duodenoskopi profylaktisk vid diagnos av FAP colektomi Hereditär icke polyposrelaterad koloncancer F-Hb vartannat år coloskopi profylaktisk colektomi ultraljud av utrerusslem­ hinna curretage start 25-årsåldern/5 år innan yngsta diagnosålder vartannat år/ start 25-årsåldern/5 år innan yngsta diagnosålder årligen polypektomier med histopato­ logisk undersökning kan övervägas i vissa situationer abnorm blödning efter 45-års- åldern kan övervägas om kvinna om kvinna >45 år om släktträd uppvisar endometriecancer vid abnorm blödning och miss­ tanke på livmodercancer profylaktisk hyster­ ektomi hysterektomi Annan familjär koloncancer klin. undersökning F-Hb proktosigmoidoskopi coloskopi vart 3–5 år vart 3–5 år vart 3–5 år vart 5 år start 35–40 års ålder start 35–40 års ålder start 35–40 års ålder start 40–50 års ålder Melanom (särskilt dyspl. nevus syndromet) klin. undersökning 2–4 gånger/år start 20–25 års ålder tidiga operationer © Studentlitteratur 265 Appendix 3 Cancerform MEN II Screeningmetod Intervall Särskilda kommentarer Efter att gen för sjukdomsrisken nu karakteriserats (klonats) prediktiv testning vid 7–12 års direkt gentest ålder (kromosom 10) om stigande S-kalcitonin: årlig pentagastrintest operation (S-kalcitonin) genbärare profylaktisk tyreoidea­ ektomi postoperativ årlig pentagastrintest (S-kalcitonin) genbärare årlig urin katekolaminer om stigande katekolaminer CT binjurar om stigande katekolaminer, operation av binjure pos. CT, MIBG-scintigram Substitution efter operation levaxin, dygratyl-etalpha tyreoidea cortal/cortone, florinef binjure Li-Fraumenis syndrom (handläggning stort etiskt dilemma pga. av olika tumörsjukdomar där endast bröstcancer har etablerad tidigdiagnostik och att sjukdom i barnaålder förekom­ mer) Cancerform Screeningmetod Intervall Särskilda kommentarer Li-Fraumenis syndrom klin. undersökning markörgenstudie mammografi ev. MR (bröst) ev. ultraljud (bröst) ev. CT, MR (CNS) profylaktisk operation (subcutan mastektomi) årligen 20 års ålder 15–25 års ålder 25 års ålder 25 års ålder 25 års ålder 25 års ålder efter 35 års ålder övervägas 266 årligen årligen årligen årligen © Studentlitteratur Appendix 4 Exempel på genetiska evolutionsvägar vid några tumörformer Kolon APC, MCC (5q21) mutation, deletion MSH2 mutation (2p21) MLH1 mutation (3p21) PMS1 mutation (2q) PMS2 mutation (7p) Hjärna p53 mutation Bröst BRCA1 mutation BRCA2 mutation KRAS, (12p13) mutation, codon 12, 13 DCC, (18q21.3) deletion p53, (17p13.1) mutation, deletion 8p22-p21.3, deletion 1p35, deletion 14q, deletion etc 13q, 17p, 22q förlust 9p förlust ERBB2 amplifikation cyklin D amplifikation myc amplifikation p53 expression deletion 1p, 3p etc E-cadherinmutation cethepsin urokinas p53 mutation ATM mutation Prostatacancer förlust av kromosom 8 mutation av BRCA1/BRCA2 eller närliggande gen (mutation i androgenreceptor kromosom 10 förlust EGFR amplifikation 16q förlust 10p förlust 10q förlust (p53, RB1 involverade) (PSA uttryck i stimulerat, gen finnspå 19q13) Tyreoideacancer RET, TRK rearrangemang p53 mutation (papillär cancer) NRAS, KRAS, HRAS mutation p53 mutation (follikulär cancer) RET mutation MEN2 syndrom (inkl. bl.a. medullär tyroideacancer Lunga (småcellig lungcancer) 3p förlust RB1 mutation P53 mutation/17p förlust myc amplifiering Skivepitelcancer (öron-näsa-halstumör) p53 mutation cyklin D1 (PRAD 1) förlust av 3p HPV 16/18 inf. 11q13 aplikon EGFR överexpression EBV inf. myc amplifikation RAC mutation Skivepitelcancer (hud) p53 mutation i >90 % av fall Skivepitelcancer (cervix) p53 mutation förlust av 3p, 9q, 10q, 17p HPV 16/18 inf. p53 och RB1 inaktivering Melanom mutation i p16 (9p21) gen förlust av kromosom 1p, 7, 11 mutation i gen för CDK4 mutation i suppressorgen 1p36 © Studentlitteratur 267 Sakregister absorberad dos 147 adenokarcinom 27 adenom 27 aktivitet 147 akut lymfatisk leukemi (ALL) 228, 238 akut myeloisk leukemi (AML) 228 alkohol 39 allogen transplantation 163 analcancer 226 anaplasi 12 anemi 180 apoptos 14, 24 arbetsskadeförsäkring 54 ascites 173 ataxia telangiectasia 26, 72 atypi 93 autolog transplantation 163 avflödeshinder i urinväg 167 bröstcancer 208 – gravida och unga kvinnor 212 – män 212 Burkitts lymfom 68 bakre svalgvägg 233 barntumör 237 Bcl-2 25 befolkningsvariationer i enzymer 56 benmärgstransplantation 163 bentumör 238 Bequerel 140 bispecifik antikropp 159 blodförgiftning 169 blåscancer 196 blödning 175 BRCA1 70 BRCA2 72 diagnosmeddelande 94 DNA-flödescytometri 115 dominant ärvd genetisk predisposition för tumör 62 dosekvivalent 147 dubbleringstid 15 dysplasi 12 dödsorsak 108 © Studentlitteratur cancer in situ 12, 93 cancerincidens 103 – tidstrender 105 cancerklassificering 88 cell – cykel 20 – cykeltid 15 – proliferation 11 chordom 235 c-myc 25 cyklin 26 – beroende kinaser 26 cytogenetik 115 cytostatika 129 effektiv dosekvivalent 147 elektromagnetisk – fält 52 – strålning 139 eosinofilt granulom 238 269 epidemiologiska studier 57 epifarynx 232 erytropoetin 178 etisk grundprincip 97 Ewings sarkom 235 fall–kontrollstudie 58 femårsöverlevnad 111 FHIT 79 flerstegsprocess 19 formler för strålbehandling och biologiska stråleffekter 263 fraktioneringsmönster 142 – hyperfraktionerad 142 – hyperfraktionerad/accelererad 142 – hypofraktionerad 142 G-CSF 178, 179 genterapi 250 Gm-CSF 178, 179 Gompertzka tillväxtkurvan 15 Gray 140 hamartom 27 handläggningen av vissa vanligare hereditära cancerformer 264 Hand-Schüller-Christians sjukdom 238 hereditär icke polyposrelaterad koloncancer (HNPCC) 73 hereditär kolonpolypos (HPCC) 73 high LET-strålning 144 hinder i mag-tarmkanal – perforation 168 histiocytosis X 238 hjärntumör 238 Hodgkins sjukdom 222, 238 hormonbehandling 154 – antiandrogen 154 – antiöstrogen 154 – aromatashämmare 154 – LHRH-analoger 154 hudcancer 198 hyperkalcemi 168 270 hyperplasi 12 hypertrofi 12 hyperurikemi 169 hypofarynxcancer 233 I-131 149 illamående 181 immunologisk behandling 156 indelning av cytostatika 136 infektion – behandling 169 – cancerrisk 48 initiering 17 interferon 158 interleukin-2 158 intrakraniell tryckstegring 170 invasiv växt 11 jodblockad 149 jättecellstumör 235 karcinogenes 17 Karnofsky skala 91 kirurgi 124 Knudsons tvåstegshypotes 61 kollektiv effektiv dosekvivalent 147 komplett remission 93 kondrosarkom 235 kontaktinhibition 20 kost 41 kraniofaryngeom 238 krisreaktion 94 – fas 183 kriterier för en orsaksfaktor 57 kronisk lymfatisk leukemi 228 kronisk myeloisk leukemi 68, 228 larynxcancer 232 lead time bias 119 leiomyosarkom 234 length time bias 119 letterer-Sive 238 leukemi 228, 238 leukoplaki 32 © Studentlitteratur life table 91 liposarkom 234 livmodercancer 213 livmoderhalscancer 227 low LET-strålning 144 lungcancer 189 lymfom 238 lymfödem 142 läppcancer 232 magcancer 202 malignt fibröst histiocytom 234 malignt lymfom 199 malignt melanom 78, 205 medullakompression 171 medulloblastom 238 medullär tumör 27 metaplasi 12 metastas 11, 20 –kirurgi 126 –lokal 32 mismatch repair-gen 23 mitoser – atypiska 12 mjukdelssarkom 234, 238 monoklonal – antikropp 158 – tillväxt 12 – tumör 17 multifaktoriell tumörutveckling 19 multivariat överlevnadsanalys 115 mutation 17 myelom 235 negativt prediktivt värde 119 nekros 25 neoplasi 12 nervsystemets tumörer 217 – gliom 218 – meningeom 218 neuroblastom 238 neuroendokrin tumör 249 neurofibrosarkom 234 neutropeni 177 © Studentlitteratur njurcancer 203 non-Hodgkinlymfom 199, 238 nur77 25 okänd primärtumör 246 onkogen 23 operationsberättelse 127 opticusgliom 238 orofarynx 232 osteogent sarkom 235, 238 P-32 152 p53 25, 35, 69 palliativt kirurgiskt ingrepp 126 pankreascancer 233 papillom 27 papillärt kystom 27 paraneoplastiskt syndrom 14 partiell remission 93 partikelstrålning 139 patologisk fraktur 170 perikardvätska 173 pleuravätska 174 pneumonit 142 polycytemi 231 polyklonal tumör 17 polyp 27 positivt prediktivt värde 119 prediktiv faktor 112 prevalens 103 profylaktisk operation 127 prognostisk faktor 112 progressiv sjukdom 94 promotion 17 prostatacancer 187 proto-onkogen 33 rabdomyosarkom 238 radiobiologisk term 147 radiojodbehandling 148 radionuklid 141 radiosensitizer 145 radioterapi – extern 139 271 – intern 139 – interstitiell 139 – intrakavitär 139 referenslitteratur 260 rehabilitering 183 rektum 192 relativ överlevnad 110 remissionsbegrepp 93 reproduktion 45 resektionsmarginal 126 resistensmekanism vid cytostatikabehandling 135 retinoblastom 63, 238 retroviral vektor 250 riskfaktor/orsaksfaktor 34 rökning 35 sarkom 27 screening 119 seminom 220 sensitivitet 119 Sievert 140 sjukdomsfri överlevnad 91 sjukdomsspecifik dödlighet 107 skelettmetastas 170 skelettsarkom 235 skirrös tumör 27 skivepitelkarcinom 27 smärtbehandling 180 SNOMED-koden 89 solexponering 51 specificitet 119 stadieindelning 88 stamcellsstöd 163 stationär sjukdom 93 strålbehandling 139 strålningsolycka 145 suppressorgen 23 synovialt sarkom 234 targetområde 143 testistumör 220 tillväxtfaktor 177 272 tillväxtfraktion 15 tillväxtmekanismer – autokrina 21 – endokrina 21 – parakrina 21 tjocktarmscancer 67, 73, 192 TNM-systemet 90 tonsill 233 totaldödlighet 107 trakea- eller bronkobstruktion/ kompression 166 trofoblastsjukdom 226 trombocytopeni 177 trombopoetin 179 tumör 267 – heterogenitet 12 – i öron-näsa-halsregion 231 – markör 91 – nekrosfaktor 178 – progression 16 – vaccin 159 tungbas 233 tyreoideacancer 230 uppföljning 185 vena cava superior syndrom 166 virusinfektion 48 Wilms tumör 238 yrkesrelaterad cancer 53 åldersspecifik – dödlighet 107 – incidens 103 åldersstandardiserad – dödlighet 107 – incidens 103 äggstockscancer 214 överlevnad 91 överlevnadsfaktor (survival factor) 26 © Studentlitteratur