Oral tolerans
advertisement

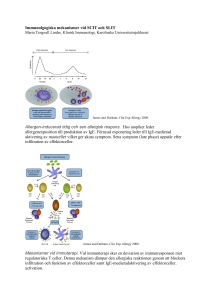
Oral tolerans – från forskning till klinik CAROLINE NILSSON S A MMA NFAT T N I NG Incidensen av matallergi har ökat med mer än 18 % mellan 1997 och 2007. En störning av immunsystemets toleransutveckling kan leda till IgE-förmedlad sensibilisering mot allergen. Trots den ökande förekomsten av matallergi, finns för närvarande inga etablerade behandlingar. Flera olika former av allergenspecifik immunoterapi mot matallergi håller på att utvecklas. Oral immunoterapi, OIT, är den mest beprövade och lovande behandlingen. Livsmedlet som individen är allergisk emot introduceras oralt i mycket små doser som ökas över tid. De livsmedel som framför allt har studerats är jordnöt, mjölk och ägg. Behandlingarna har gett goda resultat hos ca 50–75 % av deltagarna. Flera studier visar också att fördröjning av introduktion av fast föda ex mjölk, ägg och fisk, hos spädbarn, leder till en ökad frekvens av allergi senare i livet. En välgjord studie, med stor statistisk styrka, visar tydligt att tidig introduktion av jordnötter förebygger jordnötsallergi hos riskbarn. Dessa tydliga resultat väcker nya frågor om hur vi ska råda dagens föräldrar gällande kosten för att förebygga allergisk sjukdom. Caroline Nilsson, Barnläkare, Docent, Sachsska Barnsjukhuset, Södersjukhuset kontaktadress: Caroline Nilsson Sachsska barn- och ungdomssjukhuset SE- 118 83 Stockholm [email protected] 12 ALLERGI I PRAKX SIS 3/2015 M atallergi är en reaktion på livsmedel, framför allt på proteiner, förmedlad via immunförsvaret vilket leder till allergiska symtom från huden, mag-tarmkanalen och/eller luftvägarna. Upp till 8 % av barn och 5 % av vuxna rapporterar en allergi mot åtminstone ett livsmedel (1). Incidensen av matallergi, i internationella studier, har ökat med mer än 18 % mellan 1997 och 2007 (2). Trots den ökande förekomsten av matallergi, finns för närvarande inga etablerade behandlingar. Den drabbade måste undvika maten ifråga och behandla allergiska reaktioner vid oavsiktlig förtäring. Allergiska reaktioner mot mat omfattar både IgE- och icke IgE-förmedlade allergier, inklusive eosinofil esofagit och food protein induced enterocolitis syndrom (FPIES). Denna artikel kommer endast att diskutera IgE-förmedlade matallergier. Tolerans Tolerans mot mat innebär att ett potentiellt allergen inte framkallar ett immunsvar (3). Flera immunceller är inblandade, både antigenpresenterande celler, såsom dendritiska celler (DC), som makrofager, och regulatoriska T (Treg) celler. Treg-celler är viktiga nedreglerare av det cellulära och humorala immunsvaret (FIGUR 1, SE SIDAN 14). En förenklad förklaring av tolerans är att DC vid tarm-mukosans yta tar upp antigener (allergener) (4–6). Efter att antigenet känts igen migrerar DC till lokala lymfkörtlar i tarmen och presenterar antigenet för T- hjälparceller typ 0 (Th0) och drar igång ett immunsvar från Treg-celler vilka producerar IL-10. Detta anses vara av avgörande betydelse för utvecklingen av tolerans. Treg-celler är viktiga mediatorer vid tolerans och trycker ned immunsvaret genom att producera immun-regulatoriska cytokiner så som Il-10 och TGF-ß. Treg-celler tillsammans med andra celler i immunsvaret till exempel B-celler, T-celler och natural killer T (NKT) celler förmedlar oral tolerans efter upprepad allergenexposition. Utvecklingen av tolerans på immunförsvarets nivå påverkas naturligtvis också av den genetiska läggningen hos individen i fråga. Vi vet ju att barn med allergiska föräldrar oftare får allergiska manifestationer än de utan allergiska föräldrar. Allergensensibilisering En störning av immunsystemets toleransutveckling kan leda till IgE-förmedlad sensibilisering mot allergen. Ett sådant immunsvar kännetecknas av Th2-dominerande cytokinsvar och leder till att B-cellerna isotyp-växlar från att göra IgGtill IgE-antikroppar. En Th2 driven inflammation är associerad med ökade nivåer av IL-4, Il-5 och IL-13 (7, 8, 9, 10). IL-4 leder till en ökad mängd Th2-celler och påverkar B-cell isotyp-växling samt utveckling av mastceller. IL-5 driver tillväxt, mognad, rekrytering och aktivering av eosinofiler (11, 12). IL-13 inducerar IgE-syntes, rekryterar eosinofila och basofila celler samt leder till ökad slemproduktion från epitelceller Oral immunoterapi är en av flera former av allergenspecifik immunoterapi mot matallergi som håller på att utvecklast. De livsmedel som framför allt har studerats är jordnöt, mjölk och ägg. Behandlingarna har gett goda resultat hos ca 50–75 % av deltagarna. FOTO: COLOURBOX.COM (13–16). Utebliven oral tolerans är förknippad med minskat svar från Treg-celler (FIGUR 2, SE SIDAN 14) (17, 18). Epitelceller finns på bland annat hud, i lunga och tarm och är också en viktig aktör vid allergiutveckling (FIGUR 2). Epitelcellerna fungerar som barriär mot främmande proteiner, och ökad permeabilitet är förknippad med sensibilisering och allergiutveckling (19). Matallergi är ofta förknippat med eksem och den trasiga hudbarriären vid eksem kan ses som en möjlig väg för sensibilisering då matallergen hamnar på huden (20). Mutationer i filaggringenen som kodar för det protein som är associerat med barriärfunktion i huden leder till ökad hudpermeabilitet och en ökad risk för utveckling av matallergi (21). Huden är sannolikt inte den enda vägen för IgE-sensibilisering mot livsmedel då en ny studie har funnit att lungans dendritiska celler liknar dendritiska celler i tarmen och verkar kunna inducera migration av T-celler till mag-tarmkanalen efter intranasal immunisering (22). Dessa fynd tyder på att IgE-sensibilisering och utveckling eller störning av tolerans kan vara olika hos patienter med matallergi jämfört med annan allergi och kan variera beroende på vilken väg och mekanism för antigenexponering som leder till matallergi. Då vi vet att allergi är ärftligt kan man spekulera i om vissa individer har epitelceller på olika håll i kroppen som redan innan de utsätts för allergen är predisponerade att släppa igenom allergen. Behandling Den rapporterade incidensen för akuta allergiska reaktioner vid oavsiktligt intag varierar kraftigt. En studie där 782 patienter med jordnötsallergi följdes över flera år har rapporterat att 7,3 % per år hade ett oavsiktligt intag av jordnötter och fick en allergisk reaktion (23). En annan publikation har visat att av 512 barn, mellan 5–15 månader, med mjölk och/eller äggallergi reagerade 42 % per år allergiskt på oavsiktligt intag av mjölkprodukter (24). Även om dödligheten är låg, finns det en stor rädsla för oavsiktligt intag vilket avsevärt försämrar livskvaliteten för de drabbade och deras familjer. Förutom symtomlindrande läkemedel som adrenalin och antihistamin finns i dagsläget ingen botande behandling, men olika studier pågår världen över. En ökad förståelse för de cellulära och molekylära mekanismerna som leder till tolerans respektive allergisk reaktion mot mat har betydelse för att utveckla terapeutiska implikationer för att försöka framkalla tolerans. Immunoterapi Flera olika former av allergenspecifik immunoterapi mot matallergi håller på att utvecklas; oral, sublingual, epikutan eller subkutan administre- ALLERGI I PRAK X SIS 3/2015 13 A FIGUR 1. Oral tolerans. Hos patienter med oral tolerans känns allergenet igen av immunsystemet men inducerar inga negativa immunreaktioner. Den dendritiska cellen presenterar allergenet för Th0 vilket leder till bildning av Treg via påverkan av bl a IL-10 och TGF-ß. Treg utsöndrar IL-10 vilket reglerar och trycker ned ett inflammatoriskt svar. FIGUR 2. Sensibilisering via tarmepitelceller. Ökad permeabilitet leder till att allergener kommer i kontakt med den inre delen av slemhinnan. Epitelcellerna producerar cytokiner som främjar Th2- cytokiner. De dendritiska cellerna låter matallergen migrera till lyftkörteln istället för att ta upp dem och presentera allergenet via den dendritiska cellen. I lymfkörteln presenteras matallergenet för naiva Th0-celler som med påverkan av Th2-cytokiner leder till utveckling av fler celler av Th2-typ. Dessa utsöndrar ytterligare Th2-cytokiner ex IL-4, IL-5 och IL-13 vilket leder till att B-cellen producerar IgE-antikroppar. IgE binder till FcsRI/Il-receptorer som uttrycks av mastceller och basofiler. Vid förnyad exponering kan en allergisk reaktion ske. 14 ALLERGI I PRAKX SIS 3/2015 ring av små mängder av naturliga eller modifierade matallergen. Oral immunoterapi, OIT, är den mest beprövade och lovande behandlingen (25). Livsmedlet individen är allergisk emot introduceras oralt i mycket små doser som ökas över tid. Både snabba och mer långsamma uppdoseringsscheman har prövats. De livsmedel som framför allt har studerats är jordnöt, mjölk och ägg. Behandlingarna har gett goda resultat hos ca 50-75 % av deltagarna. Flera studier visar att allergiska reaktioner, både lindriga och allvarliga, uppstår hos cirka 50–70 % och att adrenalin behöver ges till cirka 10–20 % av deltagarna under behandlingen (26). Det är fortfarande oklart om individen som genomgår OIT blir varaktigt tolerant eller om allergin kan komma tillbaka om individen inte äter livsmedlet under en tid. Mekanismerna bakom de immunologiska förändringarna vid OIT är fortfarande oklara. Dock verkar en trolig mekanism vara en omprogrammering av Th-celler, från Th typ 2 som påverkar immunförsvaret att producera IgE-ak, till Th typ 1, som istället driver B-cellen att producera IgG-ak (27). Det finns ett behov av nya alternativ eller kompletterande terapier som förbättrar säkerheten och effektiviteten hos OIT. För att försöka minska antalet biverkningar vid OIT har monoklonala anti-IgE antikroppar, omalizumab, prövats att ges före och under uppdoseringen av livsmedlet vid OIT. Nadeau et al. har visat att 9/11 skolbarn med mjölkallergi som behandlades med omalizumab före och under OIT med mjölk klarade en mjölkprovokation 2 månader efter att omalizumab satts ut (28). Enskilda fall av behandling med OIT eller OIT och omalizumab har genomförts i Sverige med hittills goda resultat men ytterligare studier krävs innan denna behandlingsform kan introduceras i rutinsjukvården (29). En svensk studie pågår där ungdomar med svår jordnötsallergi behandlas med OIT med jordnöt under skydd av omalizumab, monitorerat med basofil stimulering. Då full dos jordnötter uppnåtts trappas omalizumab ned. Man kan fundera på om livsmedel kan kallas läkemedel, men när livs- medlens proteinstrukturer tillverkas som rekombinanta allergen klassas det som läkemedel. Nya läkemedel som är under utveckling, till exempel rekombinanta jordnötsproteiner administrerade oralt för att inducera tolerans, har provats i Fas I och Fas II studier med goda resultat. En multicenter Fas II studie står för dörren. Rekombinanta jordnötsallergen har också testats att ges rektalt hos ett fåtal patienter, men antalet allergiska biverkningar var stort och inkluderade anafylaxi (30). Kinesisk örtmedicin för att bota matallergi har studerats men örtpreparatet, FAHF-2, som visade sig öka toleransen för jordnöt i djurförsök, lyckades inte upprepa de positiva resultaten i en studie på människor (31). Biologiska läkemedel Det finns ett ökat intresse för användningen av biologiska läkemedel för behandling av allergiska sjukdomar, särskilt astma, och relativt få studier har undersökt tillämpningar för behandling av matallergi. Men omalizumab, nämnt ovan, vilket binder fritt IgE i blodbanan till 99 % och därmed ändrar Th1/Th2 cytokinbalansen har rönt stort intresse vid matallergi, både med och utan OIT. Även en ny monoklonal anti-IgE-ak (ligelizumab) med 12 gånger högre affinitet till fritt IgE jämfört med omlizumab, vilket gör den mycket mer potent, är under utveckling. Fas II studier för ligelizumab för att utvärdera den kliniska effekten, ligger inom snar framtid. Andra biologiska läkemedel som studeras är blockering av Th2 cytokinerna IL-4 och IL-13 via monoklonala anti–IL-4 receptorantikroppar (dupilumab) vilket i studier har gett god effekt på allergiska symtom så som astma och eksem (32, 33). Andra terapier har provat att blockera ett cytokin ex IL-4 eller IL-5 eller IL-13, men har visat sig vara mindre effektiva (34). Studier pågår för ytterligare biologiska läkemedel till exempel blockering av B-celler som tillverkar IgE, blockering av CD23 vilket reducerar IgE produktion, olika Toll-receptor agonister vilket driver på Th1 cytokinsvar. En bra sammanfattning över biologiska läkemedel som kan appliceras vid matallergi finns av Bauer et al. (35). Även epitelcellsfunktion och andra komponenter vid den IgE-förmedlade reaktionen är intressanta mål för behandling. Primärprevention Det bästa vore om vi kunde förebygga den allergiska sjukdomen redan innan den manifesterats. Flera studier visar att fördröjning av introduktion av fast föda ex mjölk, ägg och fisk, hos spädbarn, leder till en ökad frekvens av allergi senare i livet (36, 37). En intressant iakttagelse har presenterats i en studie från Storbritannien publicerad 2008, där man fann att judiska barn bosatta i London hade 10 gånger mer föräldra- FIGUR 3. LEAP-studiens upplägg. 640 barn (4–11 mån) med eksem,och/eller äggallergi 542 barn negativa i pricktest för jordnöt 270 barn; kost utan jordnötter 98 barn positiva (>0–< mm) i pricktest för jordnöt 277 barn; 6 g jordnötsprotein/vecka 51 barn; kost utan jordnötter 6 g jordnötsprotein = 24 g (30 st) rostade jordnötter Medianålder för att börja äta jordnötskex; 7,8 månader 47 barn; 6 g jordnötsprotein/vecka rapporterad jordnötsallergi än judiska barn som vuxit upp i Israel. Skillnaden var att barnen i Israel hade fått äta jordnötsinnehållande mat från ca 7 månaders ålder, medan barnen i London hade fått vänta med att introducera jordnötter i kosten till efter det första levnadsåret (38). Denna iakttagelse ledde till den mycket spännande studie (LEAP= Learning Early About Peanut Allergy) som publicerades februari 2015 i New England Journal of Medicine, där betydelsen av att introducera jordnötter tidigt i livet har utvärderats ytterligare (39). Totalt 640 barn, 4–11 månader gamla, med eksem och/ eller äggallergi randomiserades till att äta jordnötter i form av jordnötskex eller att helt utesluta jordnötter i sin kost fram till 5 års ålder (FIGUR 3). Barnen kontrollerades med hudpricktest för jordnöt vid inklusionen, och de som hade pricktest >4 mm i diameter mot jordnöt ansågs redan ha stor risk för att vara jordnötsallergiska och exkluderades. De barn som var negativa i pricktest vid inklusionen randomiserades till att äta respektive inte äta jordnötter. Intaget av jordnötter bestod av minst 6 g jordnötsprotein per vecka i form av jordnötskex, fördelat på tre eller fler tillfällen. Efter de första 5 levnadsåren genomgick alla barn i studien jordnötsprovokation. I gruppen som ätit jordnötter reagerade 1,9 % vid jordnötsprovokationen och ansågs ha en jordnötsallergi jämfört med de som uteslutit jordnötter där 13,7 % fick diagnosen jordnötsallergi. Även barnen med positivt resultat vid pricktest (1–<4 mm) vid inklusionen randomiserades till två grupper (efter att ha genomgått jordnötsprovokation för att utesluta befintlig jordnötsallergi): att äta eller inte äta jordnötter upp till 5 års ålder. Även här visade det sig att intag av jordnötter i tidig ålder har gynnsam effekt. Endast 10,6 % bland de barn som åt jordnötskex regelbundet jämfört med 35,3 % hos de som uteslöt jordnötter var allergiska mot jordnöt. Antalet barn som utvecklade födoämnesallergiska reaktioner och/eller anafylaxi var mycket litet, men något högre i gruppen som inte åt jordnötter. A ALLERGI I PRAK X SIS 3/2015 15 Studien, som är välgjord med stor statistisk styrka, visar tydligt att tidig introduktion av jordnötter förebygger jordnötsallergi hos riskbarn. Ett observandum är att studien inte är utförd på ett populationsbaserat barnmaterial. Dessa tydliga resultat väcker nya frågor om hur vi ska råda dagens föräldrar gällande kosten. Ska vi rekommendera att alla spädbarn, förslagsvis från 4 månaders ålder, ska börja med jordnötter i kosten? Kan fynden i den aktuella studien appliceras på andra livsmedel, t ex ägg och mjölk? En mindre dubbel-blind randomiserad studie från Australien, där barn rekryterats vid 4 månaders ålder, visade en icke statistiskt signifikant skillnad mellan de som åt ägg (n=39) jämfört med de som inte åt ägg (n=37) vid 12 månaders ålder. Barnen med äggintag var i lägre utsträckning allergiska, 33 % jämfört med 51 % bland de som inte ätit ägg. Ett problem i studien var dock att 1/3 av barnen redan vid inklusionen var äggallergiska och reagerade på ägg (40). Flera studier pågår med tidig introduktion av ägg och från Australien har resultaten bekräftats i en större men ännu inte publicerad studie (41). Andra preliminära data från Tyskland, presenterade under den Europeiska allergikongressen i Barcelona 2015, talade emot att tidig introduktion av ägg förebygger äggallergi. Mjölkintag och mjölkallergi har studerats i en epidemiologisk studie med 13019 nyfödda barn, där föräldrarna telefonintervjuades om barnens matvanor och eventuella allergier regelbundet under första levnadsåret. Studiens slutsats var att tidig exponering för komjölk främjar tolerans mot komjölk (42). Utifrån LEAP-studiens resultat uppstår många frågor. Ett dokument med tillfälliga riktlinjer baserade på konsensus från flera olika organisationer (American Academy of Allergy, Asthma & Immunology, American Academy of Pediatrics, Australasian Society of Clinical Immunology and Allergy, Canadian Society of Allergy and Clinical Immunology, European Academy of Allergy and Clinical Immunology, Israel Association of Allergy and Clinical Immunology, 16 ALLERGI I PRAKX SIS 3/2015 Japanese Society for Allergology och World Allergy Organization) har publicerats i avvaktan på att en grupp med representanter från flera av dessa organisationer kommer med ett slutligt konsensus (43). De tillfälliga riktlinjerna rekommenderar tidig (4–11 månaders ålder) introduktion av jordnötsinnehållande livsmedel till högrisk-barn i länder där jordnötsallergi är vanligt, då en senare introduktion kan vara associerad med risk för jordnötsallergi. Barn med tidig debut av atopisk sjukdom såsom eksem eller äggallergi under de 4–6 första levnadsmånaderna ska utredas med pricktest mot jordnöt. De med positiv test på jordnöt ska genomgå en jordnötsprovokation och om de inte reagerar ska de börja med jordnötter i kosten. Hur ska vi förhålla oss i Norden till dessa riktlinjer? Har vi resurser att utreda alla spädbarn med eksem och äggallergi trots att detta kan generera en lägre prevalens jordnötsallergi? Det som talar för den strategi som rekommenderas i de tillfälliga riktlinjerna är att nu kan vi kanske bryta trenden av ökande förekomst av jordnötsallergi bland barn och ungdomar. REFERENSER 1. Sicherer SH, Sampson HA. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment. J Allergy Clin Immunol 2014; 133(2): 291–307; quiz 308. 2. Branum AM, Lukacs SL. Food allergy among children in the United States. Pediatrics 2009; 124: 1549–55. 3. Wang J, Sampson HA. Food allergy. J Clin Invest 2011; 121 :827–35 4. McDole JR, Wheeler LW, McDonald KG, Wang B, Konjufca V, Knoop KA, et al. Goblet cells deliver luminal antigen to CD1031 dendritic cells in the small intestine. Nature 2012; 483: 345–9. 5. Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta G, Bonasio R, et al. Dendritic cells express tight junction proteins and penetrate gut epithelial monolayers to sample bacteria. Nat Immunol 2001; 2: 361–7. 6. Lelouard H, Fallet M, de Bovis B, Meresse S, Gorvel JP. Peyer’s patch dendritic cells sample antigens by extending dendrites through M cell-specific transcellular pores. Gastroenterology 2012; 142: 592–601.e3 7. Berin MC, Shreffler WG. T(H)2 adjuvants: implications for food allergy. J Allergy Clin Immunol 2008; 121: 1311–22. 8. Bischoff SC, Sellge G, Lorentz A, Sebald W, Raab R, Manns MP. IL-4 enhances proliferation and mediator r elease in mature human mast cells. Proc Natl Acad Sci U S A 1999; 96: 8080–5. 9. Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities Den engelska LEAP-studien, som har visat att tidig introduktion av jordnötter förebygger jordnötsallergi hos riskbarn, kvarlämnar många nya frågor. Studien är inte utförd på ett populationsbaserat barnmaterial, därför återstår att se om vi bör rekommendera att alla spädbarn ska börja med jordnötter i kosten från fyra månaders ålder. FOTO: COLOURBOX.COM and secreted proteins. J Immunol 1986; 136: 2348–57. 10. Finkelman FD, Katona IM, Urban JF, Holmes J, Ohara J, Tung AS, et al. IL-4 is required to generate and sustain in vivo IgE responses. J Immunol 1988; 141: 2335-41 11. Sur S, Kita H, Gleich GJ, Chenier TC, Hunt LW. Eosinophil recruitment is associated with IL-5, but not with RANTES, twenty–four hours after allergen challenge. J Allergy Clin Immunol 1996; 97: 1272–8. 12. Yamaguchi Y, Suda T, Suda J, Eguchi M, Miura Y, Harada N, et al. Purified interleukin 5 supports the terminal differentiation and proliferation of murine eosinophilic precursors. J Exp Med 1988; 167: 43–56. 13. Punnonen J, de Vries JE. IL-13 induces proliferation, Ig isotype switching, and Ig synthesis by immature human fetal B cells. J Immunol 1994; 1 52: 1094–102. 49. 14. Pope SM, Brandt EB, Mishra A, Hogan SP, Zimmermann N, Matthaei KI, et al. IL-13 induces eosinophil recruitment into the lung by an IL-5– and eotaxin-dependent mechanism. J Allergy Clin Immunol 2001; 108: 594-601. 15. Voehringer D, Reese TA, Huang X, Shinkai K, Locksley RM. Type 2 immunity is controlled by IL-4/IL-13 expression in hematopoietic non-eosinophil cells of the innate immune system. J Exp Med 2006; 203:1435-46.. 16. Kuperman DA, Huang X, Koth LL, Chang GH, Dolganov GM, Zhu Z, et al. Direct effects of interleukin-13 on epithelial cells cause airway hyperreactivity and mucus overproduction in asthma. Nat Med 2002; 8: 885–9. 17. Bedoret D, Singh AK, Shaw V, Hoyte EG, Hamilton R, DeKruyff RH, et al. Changes in antigen-specific T-cell number and function during oral desensitization in cow’s milk allergy enabled with omalizumab. Mucosal Immunol 2012; 5: 267–76. 18. Syed A, Garcia MA, Lyu SC, Bucayu R, Kohli A, Ishida S, et al. Peanut oral immunotherapy results in increased antigen-induced regulatory T-cell function and hypomethylation of forkhead box protein 3 (FOXP3). J Allergy Clin Immunol 2014; 133: 500–10.e11 19. Ventura T, Polimeno L, Amoruso AC, Gatti F, Annoscia E, Marinaro M, et al. Intestinal permeability in patients with adverse reactions to food. Dig Liver Dis 2006; 38: 732–6. 20. Eigenmann PA, Sicherer SH, Borkowski TA, Cohen BA, Sampson HA. Prevalence of IgE-mediated food allergy among children with atopic dermatitis. Pediatrics 1998; 101 21. Brough HA, Simpson A, Makinson K, Hankinson J, Brown S, Douiri A, et al. Peanut allergy: Effect of environmental peanut exposure in children with filaggrin loss-of-function mutations. J Allergy Clin Immunol 2014; 134: 867–75. 22. Ruane D, Brane L, Reis BS, Cheong C, Poles J, Do Y, et al. Lung dendritic cells induce migration of protective T cells to the gastrointestinal tract. J Exp Med 2013;210: 1871-88 23. Neuman-Sunshine DL, Eckman JA, Keet CA, Matsui EC, Peng RD, Lenehan PJ, et al. The natural history of persistent peanut allergy. Ann Allergy Asthma Immunol 2012; 108: 326–1. 24. Fleischer DM, Perry TT, Atkins D, Wood RA, Burks AW, Jones SM, et al. Allergic reactions to foods in preschool-aged children in a prospective observational food allergy study. Pediatrics 2012; 130:e25–32. 25. Beyer K. A European perspective on immunotherapy for food allergies. J Allergy Clin Immunol 2012; 129(5): 1179–84. 26. Calatayud CM, Garcia AM, Aragones AM, Caballer BL. Safety and efficacy profile and immunological changes associated with oral immunotherapy for IgE-mediated cow’s milk allergy in children: systematic review and meta-analysis. J Investig Allergol Clin Immunol 2014; 24(5): 298–307. 27. Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol 2011; 127(1): 18–27. 28. Nadeau KC, Schneider LC, Hoyte L, Borras I, Umetsu DT. Rapid oral desensitization in combination with omalizumab therapy in patients with cow’s milk allergy. J Allergy Clin Immunol 2011; 127(6): 1622–4 29. Nilsson C, Nordvall L, Johansson SG, Nopp A. Successful management of severe cow’s milk allergy with omalizumab treatment and CD-sens monitoring. Asia Pac Allergy 2014; 4(4): 257–60. 30. Wood RA, Sicherer SH, Burks AW, Grishin A, Henning AK, Lindblad R, Stablein D, Sampson HA. A phase 1 study of heat/ phenol-killed, E. coli-encapsulated, recombinant modified peanut proteins Ara h 1, Ara h 2, and Ara h 3 (EMP-123) for the treatment of peanut allergy. Allergy 2013; 68(6): 803–8. 31. Wang J, Jones SM, Pongracic JA, Song Y, Yang N, Sicherer SH, et al. Safety, clinical, and immunologic efficacy of a Chinese herbal medicine (Food Allergy Herbal Formula-2) for food allergy. J Allergy Clin Immunol 2015. [Epub ahead of print] 32. Wenzel S1, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, Wang L, Kirkesseli S, Rocklin R, Bock B, Hamilton J, Ming JE, Radin A, Stahl N, Yancopoulos GD, Graham N, Pirozzi G. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med 2013; 368(26): 2455–66. 33. Beck LA, Thac¸i D, Hamilton JD, Graham NM, Bieber T, Rocklin R, et al. Dupilumab treatment in adults with moderate-to-severe atopic dermatitis. N Engl J Med 2014; 371: 130–9. 34. Wenzel S, Wilbraham D, Fuller R, Getz EB, Longphre M. Effect of an interleukin-4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet 2007; 370: 1422–31. 35. Bauer RN, Manohar M, Singh AM, Jay DC, Nadeau KC. The future of biologics: applications for food allergy. J Allergy Clin Immunol 2015; 135(2): 312–23. 36. Prescott SL, Smith P, Tang M, Palmer DJ, Sinn J, Huntley SJ, Cormack B, Heine RG, Gibson RA, Makrides M. The importance of early complementary feeding in the development of oral tolerance: Concerns and controversies. Pediatr Allergy Immunol 2008: 19: 375–380. 37. Magnusson J1, Kull I, Rosenlund H, Håkansson N, Wolk A, Melén E, Wickman M, Bergström A. Fish consumption in infancy and development of allergic disease up to age 12 y. Am J Clin Nutr 2013; 97(6): 1324–30. 38. Du Toit G, Katz Y, Sasieni P, et al. Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy. J Allergy Clin Immunol 2008; 122: 984–91. 39. Du Toit G, Roberts G, Sayre PH, et al. Randomized Trial of Peanut Consumption in Infants at Risk for Peanut Allergy. N Engl J Med. 2015; 372(9): 803–13. 40. Palmer DJ, Metcalfe J, Makrides M, Gold MS, Quinn P, West CE, Loh R, Prescott SL, Early regular egg exposure in infants with eczema: A randomized controlled trial J Allergy Clin Immunol 2013; 132(2): 387–92. 41. Personal communication with Katie Allen. 42. Katz Y, Rajuan N, Goldberg MR, Eisenberg E, Heyman E, Cohen A, Leshno M. Early exposure to cow’s milk protein is protective against IgE-mediated cow’s milk protein allergy. J Allergy Clin Immunol 2010; 126(1): 77–82 43. Fleischer DM, Sicherer S, Greenhawt M, Campbell D, Chan E, Muraro A, Halken S, Katz Y, Ebisawa M, Eichenfield L, Sampson H, Lack G, Du Toit G, Roberts G, Bahnson H, Feeney M, Hourihane J, Spergel J, Young M, As’aad A, Allen K, Prescott S, Kapur S, Saito H, Agache I, Akdis CA, Arshad H, Beyer K, Dubois A, Eigenmann P, Fernandez-Rivas M, Grimshaw K, Hoffman-Sommergruber K, Host A, Lau S, O’Mahony L, Mills C, Papadopoulos N, Venter C, Agmon-Levin N, Kessel A, Antaya R, Drolet B, Rosenwasser L. Consensus communication on early peanut introduction and the prevention of peanut allergy in high-risk infants. J Allergy Clin Immunol 2015; 136(2): 258–61. ◗◗ Jahreprisen 2015 for forskning på cøliaki og leddgikt Professor Ludvig M. Sollid ved Institutt for klinisk medisin, Universitetet i Oslo og professor Rikard Holmdahl, Karolinska Institutet, Stockholm er tildelt Jahreprisen 2015. Ludvig Sollid mottok prisen for sin forskning på årsaker og mekanismer ved cøliaki. Sollid og medarbeidere har vist hvorfor immunsystemet hos personer som har cøliaki, overreagerer ved inntak av glutenprotein i korn og gir betennelse i tarmen. Forskningen har også avdekket en arvelig faktor som disponerer for sykdommen og mekanismene for hvordan denne arvelige faktoren virker. Funnene gir håp om bedre diagnostiske tester og behandlingsmetoder ved cøliaki. Rikard Holmdahl mottok prisen for sin banebrytende forskning på rheumatoid artritt. Han har vist hvordan immunsystemet hos personer som har leddgikt, aktiveres til å angripe kroppens egne proteiner, blant annet modifiserte utgaver av bindevevsproteinet kollagen. Prisen på én million kroner ble delt ut i Universitetets aula torsdag 15. oktober. Prisen deles likt mellom de to forskerne. Anders Jahres medisinske priser belønner fremragende forskning innen basal og klinisk medisin. Jahreprisene deles ut av Universitetet i Oslo og er blant de største innen medisin i Norden. Ludvig Sollid, UiO (t.v.) og Rikard Holmdahl, Karolinska Institutet mottok årets Jahrepris for fremragende forskning. FOTO: UNIVERSITETET I OSLO/KAROLINSKA INSTITUTET ALLERGI I PRAK X SIS 3/2015 17