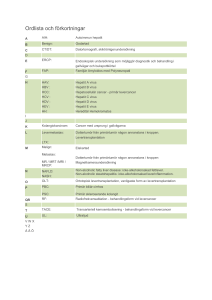
Publicerad 2001 - Läkemedelsverket
advertisement

Behandling av kronisk hepatit B infektion hos vuxna och barn – Bakgrundsdokumentation Artiklar publicerade under rubriken Bakgrundsdokumentation är författarnas manuskript. Budskapet i dessa delas därför inte alltid av expertgruppen. Hepatit B – stadier och diagnostik M AGNUS LINDH Inledning Hepatit B är ett stort globalt hälsoproblem. Det finns i världen över 350 miljoner kroniskt infekterade, av vilka en del har progressivt förlopp med utveckling av levercirros och primär hepatocellulär cancer. Problemet är störst i regioner med hög prevalens såsom östra Asien och subsahariska Afrika. Sverige tillhör länderna med lägsta prevalensen (<0,1%), men med invandring de senaste decennierna har antalet bärare ökat kraftigt (1-2). Akut hepatit B i Sverige har ändå minskat i incidens, och ses främst hos drogmissbrukare och deras partners medan spridning från invandrare med kronisk hepatit B tycks ovanlig (3-4). Kontroll av patienter med kronisk hepatit B syftar till att ge och följa upp smittskyddsinformation, och att identifiera patienter med tecken på eller risk för progressiv leverskada, och särskilt dem som behöver behandling. För detta behövs diagnostiska metoder, helst non-invasiva, som graderar smittsamhet och som predikterar leverskadeutveckling och terapisvar. Virologi Hepatit B-virus är ett 40 nm stort höljeförsett DNA-virus. Det kompakta genomet på 3 200 baspar innehåller fyra överlappande genregioner (läsramar) som kodar för HBsAg, core och HBeAg, polymeras och för det s k X-proteinet. Efter vidhäftning till en ännu ej identifierad receptor på hepatocyten inträder kapsiden och leds till cellkärnan där DNA töms och cirkulariseras till ett episomalt DNA. Man har uppskattat att det i varje infekterad levercell finns cirka 20 sådana cccDNA-molekyler, vilka utgör mallar vid transkriptionen av de olika mRNA som används vid proteinsyntes och revers transkription. Dessutom kan DNA integreras i det humana genomet, vilket kan ha betydelse för carcinogenes, men normalt inte för virusreplikation. Möjligen kan integrerat subgenomiskt DNA koda för syntes av till exempel Info från Läkemedelsverket 4:2001 HBsAg och i vissa fall förklara att HBsAg kan påvisas i blodet hos patienter som saknar tecken på virusreplikation (HBV-DNA i blodet). I regel torde dock HBsAg även i dessa fall kodas av cccDNA, och förklaringen till att det påvisas trots att HBV-DNA saknas är nog den att HBsAg, på grund av effektivare transkription och translation, bildas i mycket större mängd (kanske 100 000 gånger mer) än polymeraset (som står i 1:1-relation till antalet virioner). På basen av genetisk variation har tidigare sex genotyper, A-F, definierats, och nyligen har ytterligare en genotyp (G) sannolikt identifierats. Genotyperna skiljer sig i mer än 8% av genomet, vilket är betydligt mindre än den 30% variation som ses mellan genotyper i HCV. Det är ännu oklart om eller vilken betydelse genotyperna har för förlopp och terapisvar (5-9). Infektionsförloppet HBV är normalt inte cytopatogent utan leverskadan orsakas av immunsvaret mot virus (10). Ett effektivt immunsvar omfattar en kraftig och bred reaktion med såväl B- som T-cellsaktivitet mot flera virala antigen, och resulterar i akut hepatit. Sannolikt är cytotoxisk T-cellsmedierad cytolys av infekterade celler viktig för ett sådant förlopp. Ett ineffektivt immunsvar leder till kronisk infektion och kan ha flera orsaker. Tidig ålder är kanske viktigast; före ett års ålder blir 90% kroniska bärare, i vuxen ålder endast <5%. Immunmodulerande effekter av HBeAg, ett virusprotein som utsöndras från infekterade hepatocyter, har troligen betydelse för utveckling av kronisk infektion hos barn, särskilt vid vertikal smitta (11). Möjligen kan den mycket höga utsöndringen av HBsAg bidra till att dämpa immunsvaret, förutom att det motverkar antikroppsmedierad blockering av cell-till-cellspridning i leverlobuli. Genetiska värdfaktorer har också betydelse för förloppet. Till exempel har HLA-typ och TNFα-promotorpolymorfism visats påverka utläkning (12-13). Karakteristiskt för kronisk infektion är det stadievisa förloppet (14) som är tydligast vid infektion förvärvad perinatalt (Figur 1). 19 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Figur 1. Schematisk beskrivning av förloppet genom stadium I-III vid kronisk hepatit B. Ett gynnsamt förlopp illustreras av: (a) Risk för progressiv leverskada föreligger vid utdragen immunaktivering med kontinuerlig inflammation (b) eller vid bristande övervakning med skovvis inflammation (c). I det första stadiet ses mycket hög virusreplikation men ett svagt immunsvar och obetydlig leverinflammation. Detta stadium kan vara flera decennier och avlöses av immunaktiv fas med inflammation i levern och efterföljs i gynnsamma fall av ett lågaktivt stadium med ringa virusreplikation och leverinflammation. Sannolikt krävs även i denna lågaktiva fas (“healthy carrier state”) en fortsatt immunologisk övervakning för att förhindra reaktivering av infektionen (15). Avgörande för ett gynnsamt förlopp av kronisk infektion är således 20 dels en aktivering av ett effektivt immunsvar, som leder till sjunkande virusnivåer, sannolikt via både cytolys och icke-cytolytisk dämpning av replikationen (16-17), dels fortsatt kontroll för att förhindra reaktiveringar. Ett progressivt förlopp tycks bero på ett ineffektivt immunsvar med utdragen cytolys utan reduktion av virusreplikationen, eller på bristande övervakning med återkommande skov som följd (Figur 1). Merparten av kroniskt infekterade med gynnsamt förlopp förblir HBsAg-positiva livet ut. Årligen är det någon procent som blir HBsAg- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn negativa. Även hos sådana individer, som endast har antikroppar mot HBV (anti-HBs, antiHBc, anti-HBe) påvisbara i serum, kan dock ofta HBV-DNA påvisas med känslig metodik, som tecken på viss kvarvarande virusreplikation (18-21). I sådana fall är sannolikt HBsAgproduktionen så låg att den neutraliseras av anti-HBs, som faktiskt bildas även tidigt i infektionsförloppet, men som då inte kan påvisas med standardserologisk metodik. Det är oklart vilken betydelse den kvarvarande virusreplikationen har. Sannolikt är smittorisken försumbar vad gäller horisontell smitta, men virusförekomsten utgör en potentiell risk för spridning via blodprodukter och organ (2226). Risken för fortsatt leverskadeutveckling är troligen mycket liten eftersom den låga antigenpresentationen knappast provocerar en aggressiv inflammation. Den kliniska betydelsen av HBsAg-negativ HBV-infektion behöver klargöras, liksom frågan om i vilken grad HBsAgnegativa individer kan löpa ökad risk för levercancer beroende på det tidigare förloppet (27). Diagnostik Diagnostiken syftar till att identifiera akut eller kronisk HBV-infektion, och att stadiebedöma kronisk infektion. Serologiska metoder utgör grunden, och omfattar två antigentester (HBsAg och HBeAg, proteiner som utsöndras från infekterade celler) och fyra antikroppstester (anti-HBs, anti-HBc, anti-HBe och anti-HBc IgM). Anti-HBc kan bildas och kan påvisas redan i tidig tolerans. Anti-HBe och anti-HBs bildas när immunaktiva fasen börjar (Th-beroende), men kan på grund av hög insöndring av HBsAg och HBeAg inte påvisas med standardmetoder förrän långt senare när immunsvaret reducerat virusaktiviteten till mycket lägre nivåer (28). Anti-HBe blir således påvisbart när viremin reducerats till under 105-106 kopior/ml, men kan även påvisas om HBeAg-syntesen upphört eller minskat på grund av vissa mutationer (29-30). Anti-HBs blir påvisbart först vid ännu lägre virusnivåer (<100-1 000 kopior/ml, troligen varierande, beroende på anti-HBs-koncentrationen), vilket sker endast hos en minoritet av HBV-bärarna och ofta sammanfaller med att de blir HBV-DNA-negativa (beroende på testets känslighet). Akut HBV-infektion identifieras genom förekomst av HBsAg och/eller anti-HBc IgM. Med få undantag har alla med kronisk infektion både HBsAg och anti-HBc IgG i serum. För att Info från Läkemedelsverket 4:2001 stadiebedöma används HBeAg/anti-HBe: HBeAg-positiva bärare har en medianviremi på cirka 300 miljoner (108,5) kopior/ml och är i stadium I eller II (Figur 1). HBeAg-negativa bärare har en medianviremi på cirka 30 000 kopior/ml och är i stadium II eller III. Således skiljer i medel fyra log-steg (10 000 gångers skillnad) mellan HBeAg-positiv och -negativ fas. Emellertid är variationen stor, bland HBeAg-positiva från 1010 till 105 kopior/ml, och bland HBeAg-negativa från 108 till 102 kopior/ml. Av detta skäl, och särskilt som i princip endast patienter i stadium II skall behandlas, behövs kompletterande tester för att bedöma inflammationsgrad, virusaktivitet och smittsamhet. Det enklaste är aminotransferasbestämning. HBeAg-positiva bärare med normala ALAT är i högaktiv toleransfas, HBeAg-negativa bärare med normala ALAT i regel i lågaktiv fas utan progressiv sjukdom. HBeAg-negativa patienter med inaktiv cirros kan dock ha normalt ALAT och även vid progressivt skovvis förlopp kan ALAT intermittent ligga normalt. Upprepade normala ALAT och protrombinvärden (och avsaknad andra cirrostecken) talar för att en individ är frisk bärare med god prognos. Om endast enstaka värden finns eller om en del värden är patologiska kan HBV-DNA-mätning vara av värde för att identifiera patienter med risk för fortsatt skadeutveckling (31-33). HBeAg-positiva patienter med förhöjt ALAT har någon grad av inflammation, och kan komma ifråga för behandling. Om leverskadan är mild finns det dock skäl att avvakta, eftersom många har ett gynnsamt spontanförlopp och behandlingsresultaten är särskilt dåliga i sådana fall (34). Lätt förhöjt ALAT (<2 x ULN) talar för mild inflammation och att man kan avvakta. Vid högre ALAT (två värden >2 x ULN med sex till tolv månaders intervall) kan behandling vara indicerad, men även då kan inflammationen vara lindrig och exspektans lämplig. I dessa fall är en leverbiopsi värdefull eftersom det saknas blodprovsbaserade metoder för att säkert identifiera patienter med allvarlig inflammation. Likaså saknas tillräckligt bra metoder för att identifiera HBeAg-positiva patienter som svarar dåligt respektive väl på behandling. Det är i och för sig dokumenterat att patienter med relativt låga ALAT (<2 x ULN) eller mycket höga virusnivåer (>3-500 miljoner kopior/ml) svarar sämre (35-36), men prediktiva värden vid olika tröskelnivåer har inte klarlagts. Det är möjligt att analyser som skattar immunsvarets 21 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn styrka eller analys av virus genetiska variabilitet (genotyper, mutationer) kunde vara av värde för att bättre prediktera terapisvar. HBeAg-negativa patienter med förhöjt ALAT kan ha lindrig eller allvarlig inflammation. Risken för allvarlig inflammation är mindre om ALAT är <2 x ULN, men å andra sidan löper svår HBeAg-negativ hepatit ofta i skov med periodvis normala eller endast lätt förhöjda ALAT-nivåer. Diagnostik under pågående behandling syftar till att dokumentera primärt terapisvar (eller -svikt) och att upptäcka sekundär terapisvikt och resistens. Aminotransferaser och histologi bedömer indirekta, serologi (HBeAg, anti-HBe, HBsAg, anti-HBs) och HBV-DNA direkta, tecken på respons. HBeAg/anti-HBe kan bara användas för responsbedömning av patienter som primärt är HBeAg-positiva. Vid interferonbehandling markerar HBe-serokonversion i regel en minskning av viremin till nivåer under 105-106 kopior/ml, i likhet med spontan HBeserokonversion (37-38) (Lindh, opublicerade data). Lamivudinbehandling stänger av replikationen (reversa transkriptionen) men inte transkriptionen av mRNA. Förlust av HBeAg torde därför snarare avspegla en minskad cccDNA load och en clearance av HBV-infekterade celler, och ses inte hos alla patienter som svarar med minskad viremi (39-41). Resistens mot lamivudin påvisas genom analys av specifik mutation i YMDD-motivet (42-43). HBV-DNA kvantifiering Som nämnts ovan kan mätning av HBV-DNAnivån vara av värde för klinisk stadieindelning och prognosbedömning, för ställningstagande till behandling och bedömning av behandlingsresultat. HBeAg-negativa patienter med hög vireminivå >106-107 kopior/ml har i regel allvarlig leverskada (och är i regel infekterade med s k precoremutant), medan de med nivåer under 104 kopior/ml i regel har mild inflammation (32). Vid nivåer mellan dessa gränser tillför HBV-DNA-kvantifiering inte mycket, frånsett att de med nivåer över 2 x 105 kopior/ml tycks ha ökad risk för progressiv sjukdom. HBV-DNA-mätning kan vara vägledande inför interferonbehandling av HBeAg-positiva patienter, eftersom de med nivåer över 100-300 pg/ml (35-36) eller >500 miljoner kopior/ml, (Lindh et al, opublicerade data) har mindre chans att svara. Det är emellertid osäkert om prediktiva värdena för en sådan gränssättning 22 är tillräckliga för en strikt tillämpning. Patienter med stark behandlingsindikation och HBVDNA-nivå över 500 miljoner kopior/ml bör därför knappast uteslutas från interferonterapi. HBV-DNA-bestämning ger en mer korrekt bedömning av terapisvar än ALAT och HBeAg (37-38, 44) men den högre kostnaden begränsar användningen. Fördelen i förhållande till att endast följa ALAT och HBeAg kan också skilja sig mellan interferon- och lamivudinbehandling. Det är dessutom oklart när sådana HBV-DNA-mätningar skall göras och hur resultatet skall påverka fortsatta behandlingen. Vid interferonbehandling kan det vara rimligt att göra HBV-DNA-kvantifiering före och efter 1224 veckors terapi (i viss mån beroende på veckodosen). En studie visade nyligen att nyttan av förlängd interferonbehandling var beroende av HBV-DNA-nivån efter 16 veckors behandling (45). En förlängd behandlingstid skulle alltså kunna motiveras om terapisvaret efter 12-24 veckor inte är obefintligt (<1 log reduktion) eller helt tillfredsställande (till <104 kopior/ml). Någon strikt rekommendation kan dock inte ges på grund av att bakgrundsdata är otillräckliga. Även för lamivudinbehandling är bästa tidpunkterna för HBV-DNA-bestämningar osäker. Terapisvar kan i regel påvisas efter cirka fyra månader, men tyvärr har i publicerade studier känslig metodik i regel inte använts och detaljer om virologisk respons saknas. En HBVDNA-nivå under 104-105 kopior/ml efter fyra månader skulle kunna användas som mått på tillfredsställande terapisvar. Mätning vid denna tidpunkt skulle även vara lämplig för att senare kunna bedöma resistensutveckling. Fortsatta kontroller kan vara motiverade varje halvår eller vid misstanke på reaktivering (resistens) på grund av till exempel stigande ALAT. HBV-DNA-kvantifiering är också viktig inför levertransplantation. Risken för reinfektion av den nya levern kan minimeras om virusnivån vid transplantationstillfället är låg och specifikt immunglobulin (HBIG, Aunativ) ges. En dokumenterat låg viremi vid transplantationen kombinerat med per- och postoperativ HBIG-behandling skulle kunna reducera risken så att livslång HBIG-behandling inte är nödvändig, men detta måste först visas i kontrollerade studier (46-47). Efter transplantation är HBVDNA-mätningar av värde för att upptäcka reaktiverad infektion. Äldre metoder för HBV-DNA-kvantifiering (direkthybridisering/dot blot), hybridisering i Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn lösning (DNA-RNA hybridisering) (48) har detektionsgränser kring 1-10 pg/ml. Teoretiskt motsvarar det 300 000 till 3 miljoner kopior/ml, men gränser ligger sannolikt högre än så. Branched DNA (bDNA, Quantiplex) har något, men inte markant, högre känslighet (cirka 700 000 kopior/ml) (33, 49-50). Dessa tester passar därför endast för kvantifiering av HBeAg-positiva och en mindre del av HBeAgnegativa prover, och är inte så lämpade för monitorering av viremi under behandling. Kvantitativ PCR har mycket bättre sensitivitet (100-1 000 kopior/ml) men ett smalt detektionsomfång som inte täcker det vida spektrum av nivåer som ses vid HBV-infektion (från 100 till 1010 kopior/ml). Amplicor HBV Monitor (Roche) är det enda här tillgängliga kommersiella testet som bygger på kvantitativ PCR (32, 37-38, 51). Dess detektionsomfång sträcker sig från 1 000 till 107 kopior/ml. En automatiserad version, Cobas Amplicor HBV Monitor, har nyss släppts (44). Det har högre sensitivitet men ett smalare detektionsomfång (100 till 105 kopior/ml) (51). Analys av HBeAg-positiva prover kräver därför spädning av provet före analys. Så kallad real-time PCR (TaqMan (52), lightcycler (43)) har mycket brett detektionsomfång. Denna metodik kommer troligen användas i framtida kommersiella tester, men möjliggör också utveckling av bättre in-housetester. Genotypning Genotypning kan göras med sekvensering eller med enklare metoder såsom RFLP (restriktionsenzymer (53-54)) och LIPA (hybridisering, (55)). Det är ännu emellertid oklart om genotypen påverkar prognosen eller behandlingsutfallet vid HBV-infektion, varför genotypning för närvarande inte är kliniskt motiverad. Mutationsanalys Betydelsen av mutationer för infektionsförlopp och terapiresultat har undersökts i ett flertal studier (sammanfattade av Günther et al. (56)). Publicerade data är motstridiga (7-8, 57-62) men inga mutationer har säkert kunnat associeras med bättre eller sämre respons vid interferonbehandling. Mutationer i den s k a-determinant regionen i HBsAg har visats ha betydelse för vaccin-escape och reaktivering under HBIG-behandling efter transplantation (63-65). Vid lamivudinbehandling har mutationer i YMDD-motivet i polymerasets aktiva site för revers transkription visats förmedla resistens Info från Läkemedelsverket 4:2001 (66). Dessa mutationer uppträder i cirka 15% och 40% efter ett respektive två års monoterapi med lamivudin (67-68) och är associerade med stigande HBV-DNA-nivåer. HBV-stammar med mutationen har dock nedsatt replikationsförmåga, varför fortsatt behandling kan vara av värde även om mutationen utvecklats. Den nedsatta replikationen tycks inte dämpa reaktiveringen vid samtidig immunsuppression, varför utveckling av mutationen efter levertransplantation är ett särskilt kliniskt problem. Sammanfattningsvis tycks i nuläget bara analys av resistensmutationer i polymeraset (YMDD-motivet) vid lamivudinbehandling vara kliniskt motiverad. Möjligen kan även analys avseende mutationer i a-determinantregionen vara av värde vid tecken på reaktivering hos HBIG-behandlade transplanterade patienter. Nyttan av att inför eller under behandling påvisa av mutationer i precore, core promotorn eller andra regioner är tveksam och sådan diagnostik är nuläget inte kliniskt motiverad. Referenser 1. Lindh M, Eriksson K, Norkrans G, Stenqvist K, Taranger J. Hepatitis B virus carriers in Sweden – effects of immigration. Scand J Infect Dis 1993;25:411-6. 2. Söderström A, Lindh M, Eriksson K, Horal P, Krantz M, Kristiansson B et al. Chronic hepatitis B in children in Gothenburg, Sweden. Scandinavian Journal of Infectious Diseases 1999; 31:109-14. 3. Iwarson S, Jilg W, Stroffolini T. Substantial decline of notified hepatitis B in major parts of Europe after 1985. Scand J Infect Dis 1994; 26(1):19-22. 4. Lindh M, Horal P, Norkrans G. Acute hepatitis B in Western Sweden – genotypes and transmission routes. Infection 2000;28(3):161-3. 5. Lindh M, Hannoun C, Dhillon AP, Norkrans G, Horal P. Core promoter mutations and genotypes in relation to viral replication and liver damage in East Asian hepatitis B virus carriers. J Infect Dis 1999;179(4):775-82. 6. Kao J, Chen P, Lai M, Chen D. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B. Gastroenterology 2000;118:554-9. 7. Erhardt A, Reineke U, Blondin D, Gerlich WH, Adams O, Heintges T et al. Mutations of the core promoter and response to interferon treatment in chronic replicative hepatitis B. Hepatology 2000;31(3):716-25. 23 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn 8. Zhang X, Zoulim F, Habersetzer F, Xiong S, Trépo C. Analysis of hepatitis B virus genotypes and pre-core region variability during interferon treatment of HBe antigen negative chronic hepatitis B. J Med Virol 1996;48:8-16. 9. Mayerat C, Mantegani A, Frei PC. Does hepatitis B virus (HBV) genotype influence the clinical outcome of HBV infection? J Viral Hepat 1999;6(4):299-304. 10. Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol 1995;13(29): 29-60. 11. Milich DR, Jones JE, Hughes JL, Price J, Raney AK, McLachlan A. Is a function of the secreted HBeAg to induce immunologic tolerance in utero. Proc Natl Acad Sci USA 1990;87:6599603. 12. Hohler T, Gerken G, Notghi A, Lubjuhn R, Taheri H, Protzer U et al. HLA-DRB1*1301 and *1302 protect against chronic hepatitis B. J Hepatol 1997;26(3):503-7. 13. Hohler T, Kruger A, Gerken G, Schneider PM, Meyer zum Buschenefelde KH, Rittner C. A tumor necrosis factor-alpha (TNF-alpha) promoter polymorphism is associated with chronic hepatitis B infection. Clin Exp Immunol 1998;111(3):579-82. 14. Chu CM, Karyannis P, Fowler MJF, Monjardino J, Liaw YF, Thomas HC. Natural history of chronic hepatitis B virus infection in Taiwan: Studies of HBV DNA in serum. Hepatology 1985;5 (3):431-4. 15. Rehermann B, Lau D, Hoofnagle JH, Chisari FV. Cytotoxic T lymphocyte responsiveness after resolution of chronic hepatitis B virus infection. J Clin Invest 1996;97(7):1655-65. 16. Guidotti LG, Rochford R, Chung J, Shapiro M, Purcell R, Chisari FV. Viral clearance without destruction of infected cells during acute HBV infection. Science 1999;284(5415):825-9. 17. Guo JT, Zhou H, Liu C, Aldrich C, Saputelli J, Whitaker T et al. Apoptosis and regeneration of hepatocytes during recovery from transient hepadnavirus infections. J Virol 2000;74(3):1495505. 18. Thiers V, Nakajima E, Kremsdorf D, Mack D, Schellekens H, Driss F et al. Transmission of hepatitis B from hepatitis-B-seronegative subjects. Lancet 1988;ii(8623):1273-6. 19. Brechot C, Degos F, Lugassy C, Thiers V, Zafrani S, Franco D et al. Hepatitis B virus DNA in patients with chronic liver disease and negative tests for hepatitis B surface antigen. N Engl J Med 1985;312(5):270-6. 24 20. Larsen J, Hetland G, Skaug K. Posttransfusion hepatitis B transmitted by blood from a hepatitis B surface antigen-negative hepatitis B virus carrier. Transfusion 1990;30(5):431-2. 21. Noborg U, Gusdal A, Horal P, Lindh M. Levels of viraemia in subjects with serological markers of past or chronic hepatitis B virus infection. Scand J Infect Dis 2000;32(3):249-52. 22. Wachs ME, Amend WJ, Ascher NL, Bretan PN, Emond J, Lake JR et al. The risk of transmission of hepatitis B from HbsAg (-), HbcAb (+), HBIgM (- ) organ donors. Transplantation 1995; 59(2):230-4. 23. Shiota G, Oyama K, Udagawa A, Tanaka K, Nomi T, Kitamura A et al. Occult hepatitis B virus infection in HBs antigen-negative hepatocellular carcinoma in a japanese population: involvement of HBx and p53. J Med Virol 2000; 62(2):151-8. 24. Cacciola I, Pollicino T, Squadrito G, Cerenzia G, Orlando ME, Raimondo G. Occult hepatitis B virus infection in patients with chronic hepatitis C liver disease. N Engl J Med 1999;341(1):22-6. 25. Chazouilleres O, Mamish D, Kim M, Carey K, Ferrell L, Roberts JP et al. "Occult" hepatitis B virus as source of infection in liver transplant recipients [see comments]. Lancet 1994;343 (8890):142-6. 26. Sanchez-Quijano A, Jauregui JI, Leal M, Pineda JA, Castilla A, Abad MA et al. Hepatitis B virus occult infection in subjects with persistent isolated anti-HBc reactivity. J Hepatol 1993;17(3): 288-93. 27. Huo TI, Wu JC, Lee PC, Chau GY, Lui WY, Tsay SH et al. Sero-clearance of hepatitis B surface antigen in chronic carriers does not necessarily imply a good prognosis. Hepatology 1998;28 (1):231-6. 28. Maruyama T, McLachlan A, Iino S, Koike K, Kurokawa K, Milich DR. The serology of chronic hepatitis B infection revisited. J Clin Invest 1993;91(6):2586-95. 29. Carman W, Jacyna MR, Hadziyannis S, Karayiannis P, McGarvey MJ, Makris A et al. Mutation preventing formation of HBeAg in patients with chronic hepatitis B infection. Lancet 1989; ii:588-91. 30. Okamoto H, Tsuda F, Akahane Y, Sugai Y, Yoshiba M, Moriyama K et al. Hepatitis B virus with mutations in the core promoter for an e antigen-negative phenotype in carriers with antibody to e antigen. J Virol 1994;68(12):8102-10. 31. Niitsuma H, Ishii M, Miura M, Kobayashi K, Toyota T. Low level hepatitis B viremia detected by polymerase chain reaction accompanies Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. the absence of HBe antigenemia and hepatitis in hepatitis B virus carriers. Am J Gastroenterol 1997;92(1):119-23. Lindh M, Horal P, Dhillon AP, Norkrans G. Hepatitis B virus DNA levels, precore mutations, genotypes and histological activity in chronic hepatitis B. J Viral Hepat 2000;7(4):25867. Chen CH, Wang JT, Lee CZ, Sheu JC, Wang TH, Chen DS. Quantitative detection of hepatitis B virus DNA in human sera by branched-DNA signal amplification. J Virol Methods 1995;53(1): 131-7. Evans AA, Fine M, London WT. Spontaneous seroconversion in hepatitis B e antigen-positive chronic hepatitis B: implications for interferon therapy. J Infect Dis 1997;176(4):845-50. Brook MG, Karayiannis P, Thomas HC. Which patients with chronic hepatitis B virus infection will respond to alpha-interferon therapy? A statistical analysis of predictive factors. Hepatology 1989;10(5):761-3. Perrillo RP, Schiff ER, Davis GL, Bodenheimer HJ, Lindsay K, Payne J et al. A randomized, controlled trial of interferon alfa-2b alone and after prednisone withdrawal for the treatment of chronic hepatitis B. The Hepatitis Interventional Therapy Group. N Engl J Med 1990;323 (5):295-301. Gerken G, Gomes J, Lampertico P, Colombo M, Rothaar T, Trippler M et al. Clinical evaluation and applications of the Amplicor HBV Monitor test, a quantitative HBV DNA PCR assay. J Virol Methods 1998;74(2):155-65. Nagata I, Colucci G, Gregorio GV, Cheeseman P, Williams R, Mieli-Vergani G et al. The role of HBV DNA quantitative PCR in monitoring the response to interferon treatment in chronic hepatitis B virus infection. J Hepatol 1999;30(6): 965-9. Lai CL, Ching CK, Tung AK, Li E, Young J, Hill A et al. Lamivudine is effective in suppressing hepatitis B virus DNA in Chinese hepatitis B surface antigen carriers: a placebo-controlled trial. Hepatology 1997;25(1):241-4. Schalm SW, Heathcote J, Cianciara J, Farrell G, Sherman M, Willems B et al. Lamivudine and alpha interferon combination treatment of patients with chronic hepatitis B infection: a randomised trial [see comments]. Gut 2000;46 (4):562-8. Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z et al. Lamivudine as initial treatment for chronic hepatitis B in the United States. N Engl J Med 1999;341(17):1256-63. Info från Läkemedelsverket 4:2001 42. Chayama K, Suzuki Y, Kobayashi M, Tsubota A, Hashimoto M et al. Emergence and takeover of YMDD motif mutant hepatitis B virus during long-term lamivudine therapy and re-takeover by wild type after cessation of therapy. Hepatology 1998;27(6):1711-6. 43. Cane PA, Cook P, Ratcliffe D, Mutimer D, Pillay D. Use of real-time PCR and fluorimetry to detect lamivudine resistance- associated mutations in hepatitis B virus. Antimicrob Agents Chemother 1999;43(7):1600-8. 44. Noborg U, Gusdal A, Pisa EK, Hedrum A, Lindh M. Automated quantitative analysis of hepatitis B virus DNA by using the Cobas Amplicor HBV monitor test. J Clin Microbiol 1999;37(9):2793-7. 45. Janssen HL, Gerken G, Carreno V, Marcellin P, Naoumov NV, Craxi A et al. Interferon alfa for chronic hepatitis B infection: increased efficacy of prolonged treatment. The European Concerted Action on Viral Hepatitis (EUROHEP). Hepatology 1999;30(1):238-43. 46. Markowitz JS, Martin P, Conrad AJ, Markmann JF, Seu P, Yersiz H et al. Prophylaxis against hepatitis B recurrence following liver transplantation using combination lamivudine and hepatitis B immune globulin. Hepatology 1998;28(2): 585-9. 47. Angus PW, McCaughan GW, Gane EJ, Crawford DH, Harley H. Combination low-dose hepatitis B immune globulin and lamivudine therapy provides effective prophylaxis against posttransplantation hepatitis B. Liver Transpl 2000;6 (4):429-33. 48. Kuhns MC. Monitoring hepatitis B virus replication. J Hepatology 1990;11:S90-S4. 49. Lai VC, Lai CL, Low BG, Lau JY, Wu PC. Quantitative detection of serum HBV DNA in Chinese patients. J Viral Hepat 1997;4(5):35962. 50. Butterworth LA, Prior SL, Buda PJ, Faoagali JL, Cooksley WG. Comparison of four methods for quantitative measurement of hepatitis B viral DNA. J Hepatol 1996;24(6):686-91. 51. Ranki M, Schatzl HM, Zachoval R, Uusi OM, Lehtovaara P. Quantification of hepatitis B virus DNA over a wide range from serum for studying viral replicative activity in response to treatment and in recurrent infection. Hepatology 1995;21(6):1492-9. 52. Pas SD, Fries E, De Man RA, Osterhaus ADME, Niesters HGM. Development of a Quantitative Real-Time Detection Assay for Hepatitis B Virus DNA and Comparison with Two Commercial Assays. J. Clin. Microbiol. 2000;38(8):2897-901. 25 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn 53. Lindh M, Andersson AS, Gusdal A. Genotypes, nt 1858 variants, and geographic origin of hepatitis B virus – large-scale analysis using a new genotyping method. J Infect Dis 1997;175(6): 1285-93. 54. Lindh M, Gonzalez JE, Norkrans G, Horal P. Genotyping of hepatitis B virus by restriction pattern analysis of a pre-S amplicon. J Virol Methods 1998;72:163-74. 55. Stuyver L, Wyseur A, Rombout A, Rossau R, Maertens G. Rapid and simultaneous detection of hepatitis B virus genotypes and precore mutants by means of a line probe assay (LiPA). In: AASLD Annual Meeting; 1996;Chicago;1996. 56. Günther S, Fischer L, Pult I, Sterneck M, Will H. Naturally occurring variants of hepatitis B virus. Advances in virus research 1999;52:25-137. 57. Brunetto MR, Giarin M, Saracco G, Oliveri F, Calvo P, Capra G et al. Hepatitis B virus unable to secrete e antigen and response to interferon in chronic hepatitis B. Gastroenterology 1993;105(3):845-50. 58. Lok AS, Akarca US, Greene S. Predictive value of precore hepatitis B virus mutations in spontaneous and interferon-induced hepatitis B e antigen clearance. Hepatology 1995;21(1):19-24. 59. Fattovich G, McIntyre G, Thursz M, Colman K, Giuliano G, Alberti A et al. Hepatitis B virus precore/core variation and interferon therapy. Hepatology 1995;22(5):1355-62. 60. Laskus T, Rakela J, Persing DH. Nucleotide sequence analysis of precore and proximal core regions in patients with chronic hepatitis B treated with interferon. Dig Dis Sci 1995;40(1):1-7. 61. Kanai K, Kako M, Aikawa T, Hino K, Tsubouchi H, Takehira Y et al. Core promoter mutations of hepatitis B virus for the response to interferon in e antigen-positive chronic hepatitis B. Am J Gastroenterol 1996;91(10):2150-6. 26 62. Cabrerizo M, Bartolom:e J, Ruiz-Moreno M, Otero M, Lopez-Alcorocho JM, Carre:no V. Distribution of the predominant hepatitis B virus precore variants in hepatitis B e antigen-positive children and their effect on treatment response. Pediatr Res 1996;39(6):980-4. 63. Carman WF, Zanetti AR, Karayiannis P, Waters J, Manzillo G, Tanzi E et al. Vaccine-induced escape mutant of hepatitis B virus. Lancet 1990; 336(8711):325-9. 64. Carman WF, Trautwein C, van Deursen FJ, Colman K, Dornan E, McIntyre G et al. Hepatitis B virus envelope variation after transplantation with and without hepatitis B immune globulin prophylaxis. Hepatology 1996;24(3):489-93. 65. Ghany MG, Ayola B, Villamil FG, Gish RG, Rojter S, Vierling JM et al. Hepatitis B virus S mutants in liver transplant recipients who were reinfected despite hepatitis B immune globulin prophylaxis. Hepatology 1998;27(1):213-22. 66. Ling R, Mutimer D, Ahmed M, Boxall EH, Elias E, Dusheiko GM et al. Selection of mutations in the hepatitis B virus polymerase during therapy of transplant recipients with lamivudine. Hepatology 1996;24(3):711-3. 67. Liaw YF, Leung NW, Chang TT, Guan R, Tai DI, Ng KY et al. Effects of extended lamivudine therapy in Asian patients with chronic hepatitis B. Asia Hepatitis Lamivudine Study Group [see comments]. Gastroenterology 2000;119(1):17280. 68. Dienstag JL, Schiff ER, Mitchell M, Casey DE, Jr., Gitlin N, Lissoos T et al. Extended lamivudine retreatment for chronic hepatitis B: maintenance of viral suppression after discontinuation of therapy. Hepatology 1999;30(4):1082-7. Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Naturalförlopp vid hepatit B GUNNAR NORKRANS Allmän bakgrund Akut hepatit B läker vanligtvis ut hos immunkompetenta vuxna patienter och endast några få procent utvecklar kronisk hepatit B (1). Ett undantag är personer som i hög ålder rapporterats bli hepatit B-bärare i ända upp till 60% (2). Förloppet hos barn skiljer sig markant ifrån förloppet hos vuxna, eftersom nästan 90% av de som smittas i samband med förlossning utvecklar kronisk hepatit B. Andelen barn som blir kroniska bärare minskar snabbt med stigande ålder vid exposition. De som exponeras i tidig skolålder har samma låga risk för bärarskap som vuxna. I världen finns cirka 350 miljoner kroniska hepatit B-bärare. Sverige är i detta avseende ett lågendemiskt land med cirka 15 000 bärare rapporterade till Smittskyddsinstitutet under 1990 talet. Merparten av hepatit B-bärarna i Sverige har ursprungligen exponerats i områden med betydligt högre endemicitet för hepatit B än Sverige. Immunmedierad läkning eller sjukdom Hepatit B virus anses inte vara cytopatogent. Utläkning eller sjukdom har en immunologisk bakgrund (3). Den kroniska hepatit B infektionen beskrivs framskrida i tre immunologiska faser med olika innebörd. Under den första fasen föreligger immunologisk tolerans mot hepatit B virus med en mycket hög virusmängd samt avsaknad av biokemisk och histologisk inflammationsreaktion. Fas nummer två kännetecknas av immunologisk reaktivitet mot hepatit B virus, varvid inflammationsreaktionen blir märkbar, virusreplikationen minskar och om förloppet är gynnsamt övergår detta i en tredje fas, så kallad övervakningsfas. HBsAg-bäraren är då lågviremisk, saknar e-antigen och inflammationsreaktionen upphör liksom eventuell fibrosbildning. I bästa fall fortsätter den goda immunologiska kontrollen, vilket kännetecknar den ”friska/inaktiva” HBsAg-bäraren. Många patienter får en långdragen immunreaktiv fas eller pendlar mellan (bristande) immunologisk övervakning och immunologisk Info från Läkemedelsverket 4:2001 reaktivitet. Det leder till skov av nekroinflammation, vilket föranleder de svåra komplikationer som ses vid kronisk hepatit B, nämligen levercirrhos, med risk för dekompensation, och levercancer. Risk för dödliga komplikationer vid kronisk hepatit B I en kohortstudie på Taiwan omfattande 22 707 män, varav 15,2% var HBsAg-positiva, var den relativa risken i denna grupp att avlida i primär levercancer 224, jämfört med gruppen HBsAg-negativa män. 73% av patienterna med levercancer hade även levercirrhos. Det var också en mycket markant överdödlighet i levercirrhos med svikt bland de HBsAg-positiva männen (4). Den ackumulerade risken för personer med kronisk hepatit B att dö i leverkomplikationer, är störst bland ostasiatiska män där den har beräknats till minst 40%, vilket sannolikt är mer än dubbelt så stor risk som i västvärlden. Bland sammanlagt 19 100 asymtomatiska blodgivare, som vid blodgivning upptäckts vara HBsAg-positiva, har den relativa risken att dö i levercancer jämfört med HbsAg-negativa blodgivare beräknats till 27 respektive 42 i studier från USA och England (5-6). Siffrorna i dessa studier kan inte jämföras, men det är ett väletablerat faktum att kronisk hepatit B medför en påtaglig överdödlighet i cirrhos med leversvikt och/eller levercancer även i västvärlden. Asymtomatisk bärare eller ”frisk” bärare? Asymtomatiska HBsAg-bärare är ett kliniskt heterogent begrepp eftersom det egentligen kan innefatta personer i toleransfas, med hela infektionsförloppet framför sig, liksom symtomfria bärare i immunreaktiv fas, av vilka en del senare utvecklar sjukdom. Merparten av asymtomatiska bärare som upptäcks i Sverige är dock sannolikt så kallade ”friska” HBsAg-bärare, vilket inte heller är ett helt lättdefinierat begrepp. ”Friska” bärare beskrevs tidigare som HBsAg-positiva, anti-HBe-positiva bärare med normala transaminaser och normala rutinleverfunktionsprov vid ett undersökningstillfälle. Blodfynden korrelerar oftast väl till lindriga histologiska förändringar hos dessa patienter, men även patienter med histologisk inflamma- 27 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn tion och till och med cirrhos, kan klassificeras felaktigt med denna definition (7). Termen ”inaktiv” bärare har lanserats men den förenklar i praktiken inte klassificeringen. Långtidsstudier, med medianuppföljningstid på tio respektive 16 år av ”friska” bärare, histologiskt diagnostiserade, visar att prognosen är god, fast antalet ”friska” bärare som följts under så lång tid i dessa två studier, endast är cirka 300 (8-9). ”Friska” HBsAg-bärare har oftast detekterbart HBV-DNA i blod, men en mycket låg mängd (10). Diagnosen ”frisk” bärare kan göras mer tillförlitlig genom upprepade biokemiska analyser och även HBV-DNA-analys i blod under till exempel ett års tid. Kontinuerligt normala transaminaser och syntesfunktionsprov samt en låg stabil HBV-DNA-nivå talar för att patienten inte har någon signifikant leversjukdom (11). En stabil, om än något högre HBV-DNAnivå, tycks också vara förenligt med god immunologisk kontroll. En prospektiv studie av värdet i denna noggranna karaktärisering kräver förstås en mycket lång tids uppföljning av stort antal individer, vilket inte finns redovisat. Risken för rent spontan reaktivering är alltså mycket låg hos den ”friska” bäraren, men vid till exempel insatt immunsuppression sker i allmänhet en reaktivering. Fall av levercancer, där omgivande levervävnad i stort sett varit normal eller endast uppvisat lindrig septal fibros, finns också beskrivna (12). Några frekvenssiffror för utvecklingen av levercancer i den situationen finns inte tillgängliga. Vad kännetecknar patienter som inte blir ”friska/inaktiva” bärare? Under toleransfas, finns idag inte möjligheter att förutsäga långtidsförloppet. Merparten av patienter i västvärlden utvecklar dock ett bärarskap utan risk för senkomplikationer. Ålder vid smittillfället har betydelse för långtidsprognosen (13), vilket sannolikt är en förklaring till varför kinesiska bärare tycks ha en sämre prognos än patienter från västvärlden. De asiatiska patienterna har ofta smittats i anslutning till förlossning. Vissa virusspecifika faktorer har associerats till skillnader i förlopp (14-15), men också genetiska faktorer och exogena faktorer såsom alkohol och aflatoxin har betydelse. Cirka 5-10% av vuxna patienter med kronisk hepatit B har HBeAg-serokonverterat årligen i uppföljningsstudier (16). Upprepade inflammationsskov, som inte leder till HBeAg-serokonversion, är associerat till risk för utveckling 28 av cirrhos. Detsamma gäller även de patienter som HBeAg-serokonverterar, men ändå har upprepade biokemiska reaktiveringar (och ibland även med HBeAg-återkomst) (17). Vid noggrann uppföljning kan även nivån av alfafetoproteinstegring och/eller förekomsten av ”bridging hepatic necrosis” vid akuta exacerbationer, associeras till en ökad risk för cirrhosutveckling. I allmänhet följs inte patienter så noggrant med leverbiopsi, så den typen av histologisk förändring finns sällan dokumenterad hos oss. Överlevnadstid efter att histologisk cirrhos diagnostiserats Vid histologisk och ibland kliniskt märkbar men kompenserad levercirrhos vid kronisk hepatit B har sannolikheten för primär levercancer i ett europeiskt material beräknats till 6% och 15% fem respektive tio år efter att cirrhosdiagnos konstaterats. Sannolikheten för dekompensering av leversjukdomen inom samma tidsperiod har beräknats till 23% respektive 37% (18). Prognos för överlevnad efter att diagnosen histologisk cirrhos med kompenserad leversjukdom har ställts, har beräknats till 84% efter fem års uppföljning och 68% efter tio års uppföljning (19). Dödorsak är i de flesta fall leversvikt. Sannolikheten för överlevnad fem år efter första dekompensationsskovet har beräknats till 35% (18). I en tidigare amerikansk studie beräknades femårsöverlevnad vid kronisk, aktiv hepatit med cirrhos till 55%. Den vanligaste dödsorsaken var även där leversvikt. Man skiljde inte på kompenserad respektive dekompenserad cirrhos initialt i redovisningen av denna studie (20). Högre ålder och kvarvarande e-antigenpositivitet vid cirrhosdiagnosen är förenat med en sämre prognos. Laboratoriemässiga och kliniska tecken på försämrad leverfunktion och portal hypertension är, inte helt oväntat, förenat med ett snabbare progressivt förlopp. Spontan biokemisk remission och e-antigenserokonversion är associerat till förbättrade överlevnadssiffror (21). Som beskrivits kan cirrhos och levercancer utvecklas hos anti-HBe-positiva patienter också (22). HBsAg-negativ, kronisk hepatit B sjukdom Patienter med signifikant leversjukdom, i form av cirrhos och anti-HBe-positivitet, kan trots HBsAg-negativitet vara viremiska med detek- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn terbart HBV-DNA. Dessa replikerande patienter löper risk att utveckla dekompenserad leversjukdom och eventuell levercancer. Tillståndet förfaller vanligare bland kinesiska patienter än europeiska. Sen HBsAg-serokonversion hos män har associerats till tillståndet (23). Vanligtvis HbsAg-serokonverterar 1-2% av vuxna bärare årligen i redovisade långtidsuppföljningar, och det har mestadels associerats till god prognos. Histologisk diagnostik av levervävnaden Tidigare användes till exempel begreppen kronisk persisterande hepatit och kronisk aktiv hepatit. Numera har de ersatts av scoringsystem vilka graderar de olika inflammatoriska komponenterna och stadieindelar fibros separat (24-26). Scoringsystem kan användas för att studera effekten till exempel i läkemedelsstudier, men också för att bedöma sannolikt förlopp och prognos samt indikation för eventuell behandling. Sammanfattande synpunkter Kronisk hepatit B, obehandlad, anses orsaka levercirrhos med svikt och/eller primär levercancer bland cirka 15-40% av kroniska bärare. Geografiska skillnader föreligger beträffande prognos. Högst risk för allvarlig komplikation tycks föreligga bland kinesiska män, vilka vanligtvis smittats i anslutning till förlossningen. Ett utdraget immunaktiveringsförlopp utan läkning, men med accelererande skada, predisponerar för de svåra komplikationerna. Laboratoriemässigt kännetecknas detta i allmänhet av kvarvarande tecken på replikering samt inflammation biokemiskt. Stabila tecken på nedsatt virusreplikation och avsaknad av inflammationsreaktion är å andra sidan gynnsamma tecken på att patienten befinner sig i en effektiv övervakningsfas med god prognos. Referenser 1. Bortolotti F, Bertaggia A, Crivellaro C, Armigliato M, Alberti A et al. Chronic evolution of acute hepatitis type B: Prevalence and predictive markers. Infection 1986;14:64-7. 2. Kondo Y, Tsukada K, Takeuchi T, Mitsui T, Iwano K et al. High carrier rate after hepatitis B virus infection in the elderly. Hepatology 1993; 18:768-74. 3. Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Ann Rev Immunol 1995;13:29-60. 4. Beasley RP, Lin C-C, Hwang L-Y, Chien C-S. Risk of hepatocellular carcinoma in hepatitis B Info från Läkemedelsverket 4:2001 virus infection: A prospective study in Taiwan. Viral Hepatitis [The Franklin Institute, Ed Szmuness W, Alter HJ, Maynard JE] 1982:261-70. 5. Dodd RY, Nath N. Increased risk for lethal forms of liver disease among HBsAg-positive blood donors in the United States. J Virol Methods 1987;17:81-94. 6. Hall AJ, Winter PD, Wright R. Mortality of hepatitis B positive blood donors in England and Wales. Lancet 1985;i:91-3. 7. Lindh M, Horal P, Dhillon AP, Furuta Y, Norkrans G. Hepatitis B virus carriers without precore mutations in HBeAg-negative stage show more severe liver damage. Hepatology 1996;24:495-501. 8. de Franchis R, Meucci G, Vecchi M, Tatarella M, Colombo M et al. The natural history of asymptomatic hepatitis B surface antigen carriers. Ann Intern Med 1993;118:191-4. 9. Villeneuve J-P, Desrochers M, Infante-Rivard C, Willems B, Raymond G et al. A long-term follow-up study of asymptomatic hepatitis B surface antigen-positive carriers in Montreal. Gastroenterology 1994;106:1000-5. 10. Lindh M, Horal P, Dhillon AP, Norkrans G. Hepatitis B virus DNA levels, precore mutations, genotypes and histological activity in chronic hepatitis B. J Viral Hepatol 2000;7:25867. 11. Lindh M, Horal P, Norkrans G. Manuskript. 12. Kalayci C, Johnson PJ, Davies SE, Williams R. Hepatitis B virus related hepatocellular carcinoma in the non-cirrhotic liver. J Hepatol 1991;12: 54-9. 13. Hsieh CC, Tzonou A, Zavitsanos X, Kalamani E, Lan SJ et al. Age at first establishment of chronic hepatitis B virus infection and hepatotcellular carcinoma risk: a birth order study. Am J Epidemiol 1992;136:1115-21. 14. Lindh M, Furuta Y, Vahlne A, Norkrans G, Horal P. Emergence of precore TAG mutation during hepatitis B e seroconversion and its dependence on pregenomic base pairing between nucleotides 1858 and 1896. J Infect Dis 1995:172: 1343-7. 15. Lindh M, Hannoun C, Dhillon AP, Norkrans G, Horal P. Core promoter mutations and genotypes in relation to viral replication and liver damage in East Asian hepatitis B virus carriers. J Infect Dis 1999;179:775-82. 16. Alison A, Evans, Manette Fine, and W. Thomas London. Spontaneous Seroconversion in Hepatitis B e Antigen-Positive Chronic Hepatitis B: Implications for Interferon Therapy. JID 1997; 176:845-50. 29 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn 17. Liaw Y-F, Chu C-M, Su I-J, Huang M-J, Lin D-Y et al. Clinical and histological events preceding hepatitis B e antigen seroconversion in chronic type B hepatitis. Hepatology 1988;8:493-6. 18. Fattovich G, Giustina G, Schalm SW, Hadziyannis S, Sanchez-Tapias J et al. Occurrence of hepatocellular carcinoma and decompensation in Western European patients with cirrhosis type B. Hepatology 1995;21:77-82. 19. Realdi G, Fattovich G, Hadziyannis S, Schalm SW, Almasio P et al. Survival and prognostic factors in 366 patients with compensated cirrhosis type B: a multicenter study. J Hepatol 1994;21:656-66. 20. Weissberg JI, Andres LL, Smith CI, Weick S, Nichols JE et al. Survival in chronic hepatitis B. An analysis of 379 patients. Ann Intern Med 1984;101:613-6. 21. Di Marco Vito, Lo Iacono Oreste, Cammà Calogero, Vaccaro Alessandra, Giunta Marco, Martorana Giuseppe et al. The Long-Term Course of Chronic Hepatitis B. Hepatology 1999;30:25764. 22. Fattovich G, Brollo L, Alberti A, Pontisso P, Giustina G et al. Long-term follow-up of antiHBe-positive chronic active hepatitis B. Hepatology 1988;8:1651-4. 23. Hou T-I, Wu J-C, Lee P-C, Chau G-Y, Lui W-Y et al. Sero-clearance of hepatitis B surface antigen in chronic carriers does not necessarily imply a good prognosis. Hepatology 1998;28:2316. 24. Knodell RG, Ishak KG, Black WC, Chien TS, Craig R et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981;1:431-5. 25. Desmet VJ, Gerber M, Hoofnagle JH, Manns M, Scheuer PJ. Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology 1994;19:1513-20. 26. Ishak K, Baptista A, Bianchi L, Callea F, De Groote J et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995;22:696-9. Behandling av hepatit B – resultat av interferon- och nukleosidanalogbehandling OLA WEILAND Fram till nyligen har alfa-interferon varit den enda tillgängliga behandlingen för kronisk hepatit B virus (HBV) infektion. Tillgången på läkemedel förbättrades därför väsentligt i och med att lamivudin blev registrerat som första nukleosidanalog för behandling av kronisk HBV-infektion. Syftet med behandlingen Syftet med den antivirala behandlingen har varit: • att minska risken för fortsatt leverskada • att minska risken för senkomplikationer som levercirrhos och hepatocellulär cancer (HCC) • att minska smittsamheten och eliminera infektionen. Patienter med aktiv replikation (HBeAg positiva med höga HBV-DNA-nivåer) och förhöjda ALAT-nivåer har vanligen en progressiv sjukdom med mindre fördelaktigt förlopp än pati- 30 enter med låg virusreplikation och normala SALAT-nivåer. Bestående förlust av markörer för aktiv virusreplikation (HBeAg och HBV-DNA testat med liquid hybridisation) spontant eller genom behandling medför förbättring och remission av leverskadan vilket avspeglas genom att den biokemiska, kliniska och histologiska bilden förbättras. Total elimination av infektionen kan vanligen inte uppnås med antiviral behandling, om någonsin, varför behandlingsmålet vanligen får bli eliminering/minskning av virusreplikationen och normalisering/ minskning av S-ALAT-nivåer och därmed minskning av den histologiska leverskadan (1). Muationer i HBV-genomet Virus av vildtyp (wt) kan mutera vid flera positioner i genomet. En vanlig och viktig mutation inträffar i precore-regionen vid position 1896 (G till A) vilket ger upphov till en stoppkodon som förhindrar produktionen av HBeAg fast hela infektiösa viruspartiklar fortfarande kan produceras (2). Patienter med en dominans av dessa mutanter kan ha höga virusni- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn våer i serum och därmed vara mycket smittsamma fast de är anti-HBe positiva i serum. I vissa situationer kan infektioner med denna mutant ge upphov till svåra leverskador. Infektioner med mutantvirus är också mer svårbehandlade än infektioner med wt virus. Infektioner med precore-mutanter svarar således sämre på interferon än infektioner med wt virus (3). Lamivudin däremot minskar virusreplikationen effektivt även vid infektioner orsakade av precore-mutanter (4), långtidsstudier saknas dock. Infektioner orsakade av precoremutanter dominerar för närvarande hos personer med kronisk HBV-infektion som kommer från medelhavsområdet som Grekland och Italien. Interferon alfa (IFN) versus lamivudin INF-behandling är begränsad av dess många biverkningar och genom att den är effektiv endast i en subgrupp av patienter som kännetecknas av basala demografiska faktorer som indikerar god chans till ett fördelaktigt svar på behandlingen. Lamivudin däremot har mycket få biverkningar men å andra sidan utvecklas ofta resistenta mutanter under behandlingen som minskar effekten särskilt hos immunsupprimerade patienter. Frekvensen resistenta mutanter tilltar med tilltagande behandlingstid. Utredning inför ställningstagande till behandling av en kronisk hepatit B • Fastställ att en kronisk HBV-infektion föreligger • Uteslut kontraindikationer till behandling • Kartlägg leverskadans omfattning och aktivitet (S-ASAT, S-ALAT, PK (INR), S-albumin samt histologisk bedömning via biopsi) Om kontraindikationer för behandling saknas och en kronisk hepatit B-infektion föreligger utföres innan en eventuell behandling HBV DNA-kvantifiering, bestämning av HBeAg och anti-HBe samt en leverbiopsi. Indikationer för behandling Patienter med dokumenterad kronisk HBV-infektion (>6 månaders duration), förhöjda ALAT-nivåer, aktiv replikation (HBV-DNA positiva), och med tecken på fortgående leverskada orsakad av HBV i sin leverbiopsi är kandidater för antiviral behandling. Generellt sett svarar patienter med ett aktiverat immunsys- Info från Läkemedelsverket 4:2001 tem kännetecknat av förhöjda leverenzymer bättre på både IFN och lamivudin än patienter med normala transaminaser. Behandlingssvaret är således korrelerat till S-ALAT-nivåerna för båda läkemedlen, så att andelen patienter som svarar på behandlingen ökar med stigande SALAT-nivåer. Indikationerna för behandling av kronisk HBV-infektion är för närvarande under snabb förändring beroende på den nya kunskap som kontinuerligt genereras från pågående kliniska studier. Behandlingsval • • • • Ingen behandling IFN alfa Lamivudin Inkludering i kliniska studier Behandling med IFN Den för dagen rekommenderade dosen av interferon alfa 2b (Introna®) eller alfa 2a (Roferon®) är 5 MU dagligen eller 10 MU tre gånger per vecka (tiw) subkutant. Behandlingen ges vanligen under 16 veckor i USA men nyare data talar för att om denna förlängs till sex månader så uppnås bättre resultat. Ett flertal behandlingsstudier indikerar att förlusten av HBeAg ökar två till tre gånger med IFN-behandling jämfört med den som uppnås spontant utan behandling (5) så att upp till 40% av patienter med fördelaktiga basala demografiska faktorer kan serokonvertera i e-systemet. I en metaanalys visade Wong och medarbetare att IFN-behandlade patienter med HbeAg-positiv kronisk hepatit B, jämfört med obehandlade kontroller, förlorade HBeAg i 33% respektive 12% och blev HBV-DNA-negativa i 37% respektive 17% (5). Frekvensen patienter som gör sig av med HBsAg och utvecklar anti-HBs indikerande utläkning är få men klart fler efter behandling med IFN än efter spontan serokonversion. Detta antal tycks också öka med tiden efter en IFN-inducerad HbeAg-serokonversion (6). Förbehandling med steroider (steroidpriming), för att stimulera det egna immunsystemet, med efterföljande IFN-behandling tycks kunna öka chansen till HbeAg-serokonversion hos patientgrupper med liten chans till serokonversion (patienter med låga till normala transaminasnivåer) (7-8). Denna behandling har inte vunnit någon allmän acceptans och kan vara farlig hos patienter med avancerad sjukdom hos vilka den kan provocera fram leversvikt. 31 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Demografiska faktorer som indikerar ett fördelaktigt svar på IFNbehandling Ett flertal faktorer som indikerar ett fördelaktigt svar på IFN har rapporterats (9). • Låg basal HBV-DNA-nivå (<100 pg/ml = 440 x 106 kopior/ml) • Förhöjda S-ALAT- nivåer • Vildtyp virus (wt) • Aktiv nekroinflammation i levern • Kvinnligt kön • Kort sjukdomsduration • Frånvaron av immunsuppression och samtidig annan infektion (HIV, HDV, HCV) Eftersom biverkningarna vid IFN-behandling är påtagliga och ofta besvärande bör endast patienter med basala demografiska faktorer som indikerar god chans till behandlingssvar behandlas med IFN. För patienter med dekompenserad cirrhos är IFN-behandling kontraindicerad. Patienter med asiatisk härkomst, avancerad leversjukdom, HIV samt dekompenserad cirrhos bör inte behandlas med IFN då chansen till behandlingssvar i dessa grupper är liten och behandlingen kan vara riskabel för de med avancerad sjukdom. Många patienter (två av tre) som svarar på IFN-behandling med e-serokonversion uppvisar en påtaglig stegring i sina S-ALAT-värden under behandlingen eller inom sex månader efter dess avslutning (så kallad flare-reaktion). Denna anses indikera en aktivering av individens immunsvar vilket är en viktig förutsättning för ett gott terapisvar. Också barn svarar bra på IFN-behandling om de har förhöjda leverenzymer och måttligt höga HBV-DNA-nivåer (10). Lamivudin Lamivudin är den första nukleosidanalogen som har blivit registrerad för behandling av kronisk hepatit B. Många tidigare nukleosidanaloger (ARA-AMP, Filauridin) har varit behäftade med svåra biverkningar. Det värsta exemplet, Filauridin, orsakade svår systemtoxicitet med utvecklandet av laktacidos och död i leversvikt orsakad av mitokondritoxicitet (11). Lamivudin å andra sidan tycks ha en mycket stor säkerhet med få biverkningar och ingen toxisk skada på mitokondrier (12-13). Lamivudin (LAM) inhiberar HBV-DNA-polymeras och förhindrar förlängningen av DNA-kedjan. LAM är påtagligt mer effektivt än IFN att reducera virusreplikationen och i praktiken fritt från svåra biverkningar. Detta gör att LAM kan användas på patienter som inte kan tolerera IFN. 32 Således kan LAM utnyttjas också för patienter med dekompenserad cirrhos (14) av läkare med specialistkunskaper och i samarbete med en klinik där levertransplantationer utföres. Den använda doseringen för lamivudin är 100 mg (Zeffix®) dagligen, en något lägre dos än den som används vid HIV. Med denna dosering under ett år uppnås hos naiva kineser och europeer som är HbeAg-positiva en genomsnittlig HbeAg-serokonversion på 17-30% beroende på den basala S-ALAT-nivån. Således uppnådde kinesiska patienter med basala SALAT-nivåer <2 x övre normalvärdet (ÖNV), 25 x ÖNV och >5 x ÖNV serokonversion i 5%, 26%, respektive 64% efter ett års behandling (15). Andelen som serokonverterar stiger med ökande behandlingslängd. Således ökade HbeAg-serokoversionen från 17% till 27% när behandlingen förlängdes från ett till två år hos kinesiska patienter (16). Under behandling med LAM förbättras också leverhistologin. Även patienter som inte serokonverterar förbättras histologiskt medan förbättringen hos IFN-behandlade patienter främst är begränsad till den grupp som svarar på behandlingen. Resistensutveckling under lamivudinbehandling Ett bekymmer med lamivudinbehandling är utveckling av resistenta mutanter. Dessa utvecklas i stigande frekvens med tilltagande behandlingstid. Således utvecklar efter ett års behandling 16-32% och efter tre års behandling nästan 50% resistenta mutanter med mutationer i YMDD-motivet i HBV-DNA-polymerasgenen (17). Dessa så kallade YMDD-mutanter tycks dock vara mindre replikationseffektiva än wt-stammarna och ger således upphov till mindre uttalad leverskada med lägre S-ALAT och HBV-DNA-nivåer än wt-stammarna av HBV. Resistenta mutanter uppstår lättare och snabbare hos immuninkompetenta individer (till exempel transplanterade patienter) och kan hos dessa ge upphov till en snabbt progredierande leversjukdom (18). Nyare nukleosidanaloger (adefovir dipivoxil) som har bibehållen antiviral effekt mot LAM-resistenta mutanter är effektiva mot dessa mutanter och används som ”rescue-terapi” hos transplanterade patienter när dessa utvecklar mutanter under LAM-behandling (19). Bland immunkompetenta individer som utvecklar YMDD-mutanter tycks man emellertid kunna fortsätta att behandla även efter att dessa uppstått och ändå uppnå HbeAg-serokonversion hos flera (16). Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Långtidsuppföljning av patienter som utvecklat dessa mutanter under behandling saknas dock, varför fortsatta studier får visa hur förloppet blir för dessa patienter. Om lamivudinbehandlingen avbryts när mutantstammar uppstår återkommer wild-typ stammen hos de flesta patienter som utvecklat YMDD-mutanter eftersom wild-typ stammarna är mer replikationseffektiva. När lamivudinbehandlingen avslutas ses ibland återfall av HBV-infektionen med återkommande virusreplikation och enligt en koreansk studie i hela 50% inom två år efter avslutad behandling efter serokonversion i e-systemet (20). Återfall är ibland associerad med svåra exacerbationer av den kroniska hepatit B infektionen (21). Långtidsuppföljning efter avslutad lamivudinbehandling saknas varför stabiliteten efter uppnådd HbeAg-serokonversion är bristfälligt dokumenterad, med enligt preliminära studier är återfall till HbeAg-positivitet och förnyad virusreplikation vanliga (20,22). Andra droger och kombinationsbehandling Behandlingen av hepatit B är i dagsläget inte optimal varför det finns stort behov av förbättringar. Dessa kommer sannolikt att komma via kombinationer av flera läkemedel och med utvecklandet av nya läkemedel precis som förhållandet varit för HIV. Famciklovir (FAM), den orala prodrogen till penciklovir, är en tillgänglig nukleosidanalog med in vitro aktivitet mot HBV. Den har nyligen värderats i en internationell studie där den visats ha begränsad effekt (23). I denna studie gavs famciklovir 500 mg tre gånger dagligen under ett års tid. Fler behandlade än kontroller serokonverterade för HBeAg (9% vs 3%), en låg siffra jämfört med vad man brukar se vid behandling med IFN eller lamivudin givet som monoterapi (23). Nyligen har kombinationen av LAM och FAM visats vara mer effektiv att minska virusreplikationen än lamivudin givet som monoterapi och minst additiv om inte synergistisk (24). Det tycks vara så att den HBVDNA-reducerande effekten i serum av nukleosidkombinationer är likvärdig med effekten man erhåller med högre dosering av en nukleosidanalog. Ökande doser av en nukleosidanalog kan dock orsaka ökad toxicitet, ett problem som många nukleosidanaloger har liksom IFN. Kombinationsbehandling kan därför vara en attraktiv möjlighet att öka den antivira- Info från Läkemedelsverket 4:2001 la effekten utan att öka doseringen och utan att öka biverkningarna. Förutom att minska risken för biverkningar torde kombinationsbehandling också minska risken att utveckla resistenta mutanter. En annan attraktiv behandlingsmodell vore att kombinera nukleosidanalogbehandling med immunmodulatorisk behandling. Schalm et al. publicerade nyligen en studie där IFN och lamivudin i kombination utvärderades vid behandling av HbeAg-positiv kronisk HBV-infektion och jämfördes med effekten av monoterapi med lamivudin eller IFN (25). Detta är den största kontrollerade kombinationsstudien med IFN och LAM som hittills publicerats. Man fann ett högre svar hos de kombinationsbehandlade patienterna. Schalm et al. använde sekventiell kombinationsbehandling där lamivudin gavs först följt av kombinationen med interferon. Detta förfaringssätt kan ha medfört en partiell förbättring av värdens eget immunsvar när HBV-DNA-nivåerna sjönk under den initiala lamivudinbehandlingen innan kombinationen gavs. Man vet således att den minskning av virusreplikationen som lamivudin åstadkommer leder till en partiell förbättring av den T cellsoförmåga till att angripa HBV som man ser hos patienter med kronisk HBV-infektion (26). Att immunmodifierande terapi i kombination med direkt antiviral behandling med nukleosidanaloger kan var en väg att gå visar också en pilotstudie där man utnyttjat den rebound immunsystemet uppvisar efter steroidbehandling genom att efter förbehandling med steroider ge lamivudin (27). Steroidpriming inducerade ett immunologiskt svar med S-ALATstegring när steroidbehandlingen avlutades. När lamivudin sedan gavs i denna fas ökade HbeAg-serokonversionen väsentligt (27). Samma fenomen har setts när IFN getts efter priming med steroider hos patienter med låga transaminaser (7-8). Konklusion Terapin för kronisk hepatit B har på senare år förbättrats och både IFN och LAM är nu registrerade för behandling av kroniska HBV-infektioner. IFN monoterapi är fortfarande värdefull för en subgrupp patienter som har basala demografiska faktorer som indikerar god chans till behandlingsframgång men kan inte användas hos transplanterade patienter eller hos patienter med avancerad sjukdom och patienter med dekompenserad cirrhos som är kandidater för levertransplantation. Hos dessa patien- 33 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn ter kan fortfarande lamivudin användas, men timingen av behandlingsstarten är viktig. Förlängd behandling med lamivudin före transplantationen kan orsaka uppkomsten av YMDD-mutanter vilka i sin tur kan omöjliggöra en säker transplantation. I framtiden kommer säkert kombinationsterapi inkluderande nukleosidanaloger och immunmodulerande terapi att förbättra behandlingsresultaten ytterligare. Referenser 1. Niederau C, Heintges T, Lange S, Goldmann G, Niedarau C, Mohr L et al. Long-term follow-up of HBeAg-positive patients treated with interferon alfa for chronic hepatitis B. N Engl J Med 1996;334:1422-7. 2. Carman W, Jaycena M, Hadziannys S, Karayiannis P, McGavery M, Makris A et al. Mutations preventing formation of hepatitis B e antigen in patients with chronic hepatitis B infection. Lancet 1989;ii:588-91. 3. Brunetto M, Giarin M, Saracco G, Oliveri F, Calvo P, Capra G et al. Hepatitis B virus unable to secrete e antigen and response to interferon in chronic hepatitis B. Gastroenterology 1993; 105:845-50. 4. Tassopoulos N, Volpes R, Pastore G, Hetahcote J, Buti M, Goldin R et al. Efficacy of lamivudine in patients with hepatitis B e antigen-negative/hepatitis B virus DNA-positive (precore mutant) chronic hepatitis B. Lamivudine Precore Mutant Study Group. Hepatology 1999;29:88996. 5. Wong D, Cheung A, O´Rourke K, Naylor C, Detsky A, Hethcote J. Effect of alpha-interferon treatment in patients with hepatitis B e antigenpositive chronic hepatitis B: a meta-analysis. Ann Intern Med 1993;119:312-23. 6 Korenman J, Baker B, Waggoner J, Everhart J, Di Bisceglie A, Hoofnagle J. Long-term remission of chronic hepatitis B after alfa-interferon therapy. Ann Int Med 1991;114:629-34. 7. Perillo R, Schiff E, Davis G, Bodenheimer H, Lindsay K, Payne J et al. A randomized, controlled trial of interferon alfa-2b alone and after prednisolone withdrawal for the treatment of chronic hepatitis B. N Engl J Med 1990;323:295301. 8. Kroogsgaard K, Marcellin P, Trepo C, Berthelot P, Sanchez-Tapias J, Bassendine M et al. Prednisolone withdrawal therapy enhances the effect of human lymphoblastoid interferon in chroniic hepatitis B. J Hepatol 1996;25:803-13. 34 9. Malik A, Lee W. Chronic hepatitis B virus infection: treatment strategies for the next millennium. Ann Intern Med 2000;132(9):p723-31. 10. Solko E, Cinjeevaram H, Roberts E, Alvarez F, Bern E, Goyens P et al. Interferon alfa therapy for chronic hepatitis B in children: a multinational randomized controlled trial. Gastroenterology 1998;114:988-55. 11. McKenzie R, Fried M, Sallie R, Conjeevaram H, AM DB, Beames M et al. Hepatic failure and lactic acidosis due to filauridine (FIAU), an investigational nucleoside analogue for chronic hepatitis B. N Engl J Med 1995;333(1099-105.). 12. Lai C-H, Chien R-N, Leung N, Chang T-T, Guan R, Tai D-I et al. A one-year trial of lamivudine for chronic hepatitis B. N Engl J Med 1998;339: 61-8. 13. Dienstag J, Schiff E, Wright T, Perillo R, Hann H, Goodman Z et al. Lamivudine as initial tretment for chronic hepatitis B in the US. N Engl J Med 1999;341:1256-63. 14. Villeneuve J, Condreay L, Willems B, PomierLayrargues G, Fenyves D, Bilodeau M et al. Lamivudine treatment for decompensated cirrhosis resulting from chronic hepatitis B. Hepatology 2000;31:207-10. 15. Chien R-N, Liaw Y, Atkins M, Group ftAHlT. Pretherapy alanine transaminase level as a determinant for hepatitis B e antigen seroconversion during lamivudine therapy in patients with chronic hepatitis B. Hepatology 1999;30:770-74. 16. Liaw Y-F, Leung N, Chang T-T, Guan R, Tai DI, Ng K-Y et al. Effects of extended lamivudine therapy in Asian patients with chronic hepatitis B. Gastroenterology 2000;119:172-80. 17. Leung N, Lai C, Chang T, Guan R, Lee C, Wu P et al. Three year lamivudine therapy in chronic hepatitis B (abstract). J Hepatol 1999;30 (Suppl 1):59. 18. Bartholomew M, Jansen R, Jeffers L, Reddy K, Johnson L, Bunzendahl H et al. Hepatitis-B-virus resistance to lamivudine given for recurrent infection after orthoptic liver transplanation. Lancet 1997;349:20-2. 19. Perillo R, Schiff E, Yoshida E, Statker A, Hirsch K, Wright T et al. Adefovir dipivoxil for the treatment of lamivudine-resistant hepatitis B mutants. Hepatology 2000;32:129-34. 20. Song B, Suh D, Lee H, Chung Y, Lee Y. Hepatitis B e antigen seroconversion after lamivudine therapy is not durable in patients with chronic hepatitis B in Korea. Hepatology 2000;32(4 Pt 1):p803-6. 21. Honkoop P, de Man R, Niesters H, Zondervan P, Schalm S. Acute exacerbation of chronic he- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn patitis B virus infection after withdrawal of lamivudine therapy. Hepatology 2000;31:635-9. 22. Lau D, Khokhar M, Doo E, Ghany M, Herion D, Park Y et al. Long-term therapy of chronic hepatitis B with lamivudine [see comments]. Hepatology 2000;32 (4 Pt 1):p828-34. 23. de Man R, Marcellin P, Habal F, Desmonf P, Wright T, Rose T et al. A randomized, placebocontrolled study to evaluate the efficacy of 12month famciclovir treatment in patients with chronic hepatitis B e antigen-positive hepatitis B. Hepatology 2000;32:413-7. 24. Lau G, Tsiang M, Hous J, Yuen T-T, Carman W, Zhang L et al. Combination therapy with lamivudine and famciclovir for chronic hepatitis Binfected Chinese patients: a viral dynamic study. Hepatology 2000;32:394-9. 25. Schalm S, Heathcote J, Cianciara J, Farell G, Sherman M, Willems B et al. Lamivudine and alpha interferon combination treatment of patients with chronic hepatitis B infections: a randomised trial. Gut 2000;46:562-8. 26. Boni C, Bertoletti A, Penna A, Cavalli A, Pilli M, Urbani S et al. Lamivudine treatment can restore T cell responsiveness in chronic hepatitis B virus infection. J Clin Invest 1998;102:968-75. 27. Liaw Y-F, Tsai S-L, Chien R-N, Yeh C-T, Chu CM. Prednisolone priming enhances Th1 response and efficacy of subsequent lamivudine therapy in patients with chronic hepatitis B. Hepatology 2000;32:604-9. Behandling av kronisk hepatit B infektion hos barn ANN SÖDERSTRÖM Bakgrund Kronisk hepatit B virus (HBV) infektion hos barn är vanligen asymtomatisk men kan leda till cirrhos och levercancer. De flesta barn smittas tidigt i livet antingen i samband med förlossning (vanlig smittväg i Asien där fertila kvinnor i hög grad är HbeAg-positiva) eller under småbarnsåren. Risken att utveckla en kronisk infektion är omvänt proportionell till ålder vid smittotillfället, <1 år 90% risk, >5 år 5-10% risk. Barn som smittas med hepatit B virus tidigt i livet går in i en toleransfas med höga nivåer av virus men sparsamt med inflammation i levern. Vilka faktorer som gör att barn spontant kan bryta denna toleransfas är ofullständigt kända. Barn som ej tar sig ur immunaktiveringsfasen löper risk för bestående leverskada som ett resultat av den pågående inflammationen i levern. Studier från Sydeuropa visar att 80% av barnen spontant serokonverterar före vuxen ålder (1). Långtidsuppföljning från Asien visar lägre frekvens av spontan serokonversion (2). Interferonbehandling leder hos cirka 30% av patienterna (jämförbara resultat vuxna och barn), till serokonversion (clearance av HBeAg och utvecklande av anti-HBe), normalisering av ALAT, sänkning av eller odetekterbara HBVDNA-nivåer och minskad inflammatorisk aktivitet i levern. Info från Läkemedelsverket 4:2001 Vilka barn ska behandlas? De barn som svarar bäst på behandling är de som har tecken på immunaktivering i form av förhöjt ALAT, lågt HBV-DNA(<100 pg/ml alt <300 milj kopior/ml) eller högre grad av inflammation i leverbiopsi (3-5). Dessa parametrar är också de samma som anger god chans till spontan serokonversion från HBeAg till anti-HBe. En statistisk modell för att försöka särskilja prediktiva faktorer för spontan serokonversion och för serokonversion efter interferonbehandling har nyligen publicerats (6). Det är dock svårt att på individnivå kunna prediktera vilket barn som har mest nytta av behandling. Flera studier visar att interferonbehandling accelererar spontan serokonversion men vid långtidsuppföljning finner man ingen signifikant skillnad i frekvens av serokonversion mellan behandlingsgrupp och kontrollgrupp (7-8). Vinsten med att skynda på det naturliga förloppet skulle vara att minska risken för leverskada genom att bryta inflammationsprocessen i levern tidigare och att minska integrationen av HBV-DNA i hepatocyterna. Flera studier visar en högre frekvens av HbsAg-negativitet i behandlingsgrupp jämfört med kontrollgrupp även vid långtidsuppföljning, detta gäller speciellt de barn som serokonverterar tidigt under behandling (7). Långtidsstudier hos vuxna (9-10) visar att interferonbehandling förbättrar överlevnad och minskar risken för cirrhosutveckling. En nyli- 35 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn gen publicerad långtidsuppföljning hos barn (7) kunde inte påvisa någon inverkan på cirrhosutveckling men cirrhos hos barn är en sällsynt komplikation och förefaller mer vara en tidig komplikation än resultat av en långvarig kronisk inflammation i levern (1). Trots serokonversion kan cirrhos och hepatocellulär cancer utvecklas senare i livet (2,11). Någon bra markör för att välja ut de barn som löper störst risk att utveckla leverskada saknas. I en studie från Asien visade man att ett år efter att man noterat första förhöjda ALAT-värdet har ungefär 50% av barnen serokonverterat, frekvensen ökar desto högre ALAT (12). Det går ej att ange exakt hur länge man kan avvakta en spontan serokonversion vid förhöjda ALAT-värden. Det beror på grad av inflammation i levern, ALAT-nivåer och naturligtvis behandlingsmotivation hos barnet och föräldrarna. Barn som serokonverterat antingen spontant eller efter interferonbehandling blir i allmänhet friska bärare med låga virusmängder och normala ALAT-nivåer. Till skillnad från vuxna är det hos barn ovanligt med aktiv hepatit efter serokonversion till anti-HBe och erfarenhet av behandling av anti-HBe-positiva barn saknas. Behandlingsschema Rekommenderad dos är 5 MU/m2 alfa-interferon subkutant tre gånger/vecka i sex månader (3). Förbehandling med prednisolon har i någon studie visat högre frekvens av serokonversion hos patienter med normalt ALAT (13) men i andra studier har man inte sett någon signifikant skillnad i behandlingsresultat (8) och denna behandling rekommenderas ej. Behandlingsresultat Behandlingsresultaten i flera kontrollerade studier ligger mellan 3-66% räknat i HbeAg-serokonversion (tabell I). Den stora skillnaden i behandlingsresultat kan sannolikt förklaras av olika grad av immunaktivering hos barnen vid inklusion i de olika studierna. Den genomsnittliga siffran för serokonversion i studierna som redovisas i tabellen är 30% för behandlade barn (109 av 364) och motsvarande siffra för obehandlade kontroller blir 12% (32 av 273). Längre uppföljningstid ger i allmänhet en högre frekvens serokonversion i kontrollgruppen. Två studier i tabellen är utförda på asiatiska barn (14-15) och det har tidigare ansetts att dessa barn svarar sämre på behandling. Den stora skillnaden mellan de 36 asiatiska studierna och övriga redovisade studier är dock att i de europeiska studierna är det huvudsakligen barn med förhöjda transaminaser som är inkluderade medan det i de asiatiska studierna är två barn totalt i varje studie med förhöjda transaminaser vid inklusion (de som senare serokonverterade). Barn som är vertikalt smittade har ofta en längre toleransfas och svarar sämre på behandling, Bruguera m fl (16) visade att ingen av de vertikalt smittade jämfört med 72% av de horisontellt smittade barnen i deras studie svarade på behandling. Hos barn förefaller HbeAg-serokonversion och ALAT-normalisering vara stabila såväl efter interferonbehandling som efter spontan serokonversion (17). Relapsers med återkomst av HBeAg (ej utvecklat anti-Hbe) noterades endast i en studie från tabell I (13) till skillnad från vuxna där frekvensen relapsers ligger omkring 12% (18). I de flesta studier noterades en nedgång i HBV-DNA under behandlingen men efter behandlingstidens slut såg man vanligen en snabb återgång (en till tre månader) hos de barn som ej svarade på behandling. I konsensusutlåtande från 1999 (3) rapporterades relaps i form av återkomst av HBV-DNA tillsammans med ALAT-stegring hos 1-6% av barnen som serokonverterat. HbsAg-serokonversion noterades hos 3%20% i de olika studierna i tabell I. Om man sammanför alla barn i de olika studierna så var det 4,9% av barnen i behandlingsgrupperna jämfört med 0,3% i kontrollgrupperna som blev HbsAg-negativa. Leverbiopsier före och efter behandling finns mer fullständigt utvärderat i några studier (8, 19-20) och visar en signifikant skillnad i histologi enligt Knodells index (21) mellan responders och non-responders. Någon skillnad mellan behandlade och obehandlade barn som serokonverterat i form av reaktivering eller histologisk förbättring kunde ej påvisas. Erfarenhet av ytterligare interferonbehandling till barn som ej svarat på en första interferonbehandling med adekvat dos är begränsad och rekommenderas ej (3). Förekomst av precore-mutationer hos barn har inte visat någon påverkan på behandlingsresultat med interferon (22). Det finns få cost-benefit analyser av interferonbehandling av barn med kronisk hepatit B infektion (23) och det är svårt att värdera medicinska vinster med att tidigarelägga serokonversion. Det är inte visat att frekvensen av cirrhos eller levercancer minskar hos inter- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Tabell I. Kontrollerade behandlingsstudier med Interferon +/- Prednisolon till barn med kronisk hepatit B infektion Ref Ant pat IFN dos 3 ggr/vecka Beh tid (14) 12 IFN 10 MU/m2 3,5 mån 12 (15) 31 29 30 (19) 12 Kontrollgrupp Prednisolon 6 v IFN 5 MU/m2 IFN 5 MU/m2 Kontrollgrupp IFN 10 MU/m2 12 (20) 12 Kontrollgrupp IFN 10 MU/m2 12 12 (27) 10 IFN 5 MU/m2 6 mån Kontrollgrupp IFN 3 MU 12 mån (IFN ej doserat/m2) 10 (28) 29 Kontrollgrupp IFN 9 MU/m2 25 (29) 22 kontrollgrupp Prednisolon 4 v IFN 3 MU/m2 Kontrollgrupp IFN 7,5 MU/m2 Behandlingsschema (Beräknad Uppföljningstotaldos) tid (mån) (330 MU/m2) 15 HBeAg clearance (HBV-DNA under detektionsnivå) % 8 (17) 4 mån 4 mån (240 MU/m2) (240 MU/m2) 18 3 mån (360 MU/m2) 15 13 (16) 3(3) 0 33 (33) 6 mån (720 MU/m2) 9 25 (25) 581 (58) 6 421 (42) 17 (17) 20 (30) 8 10 (10) 38 (48) 4 mån (360 MU/m2) (468 MU) (450 MU/m2) 8 41 (41) 9,5 (9,5) 6 mån (585 MU/m2) 12 30 (35) IFN 3 MU/m2 Kontrollgrupp Prednisolon 6 v IFN 10 MU/m2 IFN 10 MU/m2 Kontrollgrupp Prednisolon 4 v IFN 5 MU/m2 6 mån (234 MU/m2) 12 mån 12 mån (1560 MU/m2) (1560 MU/m2) 24 56 (56) 66 (66) 33 (44) 3 mån (190 MU/m2) 18 38 (41) 30 31 (31) 70 IFN 5 MU/m2 Kontrollgrupp IFN 6 MU/m2 3 mån (190 MU/m2) 4-6 mån (297-441 MU/m2) 6 74 Kontrollgrupp (8) 12 9 (13) 34 r-IFN alfa-2b r-IFN alfa-2a r-IFN alfa-2b r-IFN alfa-2a r-IFN alfa-2b 8 (8) (468 MU/m2) 19 37 9 r-IFN alfa-2a 8 (17) 12 mån 21 (30) 20 Typ av IFN Info från Läkemedelsverket 4:2001 r-IFN alfa-2a r-IFN alfa-2a 21 (37) 13,5 (21) 40 (37) 16 (26) 26 (26) r-IFN alfa-2b lymfIFN alfa-n1 r-IFN alfa-2b 11 (11) 37 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn feronbehandlade barn. Genom att påskynda serokonversion förkortar man den högviremiska fasen som innebär ökad risk för smitta vilket är en faktor som också bör beaktas. Biverkningar Interferon tolereras i allmänhet väl och avbrytande av behandling är sällsynt. Den sammanlagda erfarenheten från konsensusutlåtande 1999 var att totalt 18 av 1 122 interferonbehandlade barn ej kunnat fullfölja behandlingen (vanligaste orsaken var feberkramper) (3). De vanligaste biverkningarna är feber och influensaliknande symtom som uppträder hos cirka 80% under de första veckorna av behandlingen men som därefter brukar försvinna. Besvären kan dämpas med paracetamol. Anorexi och viktnedgång uppträder hos cirka 1/3 av barnen och asteni och/eller huvudvärk hos cirka 20%. Håravfall ses hos cirka 10%. Den vanligaste orsaken till dosreduktion eller utsättande av behandling är neutropeni som i ett poolat material uppträdde i en frekvens av 22% (2-90) (3). Mer ovanliga biverkningar är illamående (8%), ångest (7%), feberkramper (3,6%), depression (1,8%). Biverkningarna är övergående och försvinner efter utsättande av behandlingen. Jämfört med vuxna har barnen färre allvarliga biverkningar som hjärt,- lung eller njurbiverkningar, autoimmuna sjukdomar och hypo- eller hyperthyroidism. Speciella biverkningar hos barn är påverkan på tillväxten. De flesta studier anger anorexi och viktnedgång som biverkan men det är få studier gjorda som särskilt inriktat sig på att mäta längd och viktutveckling under behandling. En studie av Gottrand m fl från 1996 (24) studerade viktutveckling hos 11 barn 4-16 år gamla som fick interferon i doser 5-10 MU/m2 tre ggr/vecka under sex månader. Viktnedgången var i medeltal 1,4 kg vilket motsvarade 4,5% av ingångsvikten. Maximal viktnedgång noterades efter tre månaders behandling. Tredje till sjätte behandlingsmånaden ökade vikten igen men var ej normaliserad förrän sex månader efter avslutad behandling. Längdtillväxten påverkades ej i denna studie. Viktnedgången orsakades av anorexi som ledde till ett minskat kaloriintag. Någon ökad frekvens av diarréer eller kräkningar förekom inte. Det finns två studier som speciellt studerat längdtillväxt (5,25). Man såg i dessa ingen säker påverkan efter sex månaders behandling med interferon i doser mellan 5-10 MU/m2 tre ggr/vecka. Om man utsträckte behandlingen 38 till tolv månader så föll 40-50% av patienterna en percentil. De flesta hade dock en återhämtning efter utsatt behandling men ännu efter tolv månader hade inte alla barn återgått till sin längdkurva. Man bör undvika att ge interferon under perioder med kraftig tillväxt. Nukleosidanaloger Lamivudin har prövats hos barn (26) och dosen som rekommenderas är 3 mg/kg för barn mellan två och tolv års ålder. Större fas III-studier med lamivudin är under utförande hos barn med kronisk hepatit B. Sammanfattning • • • • • • Kronisk hepatit B infektion hos barn är vanligen asymtomatisk. De flesta barn serokonverterar spontant före vuxen ålder men 50% är fortsatt HBVDNA positiva med PCR analys. Interferonbehandling accelererar serokonversion men långtidseffekt på utveckling av cirrhos och levercancer är ej visat hos barn. Någon bra markör för att välja ut och behandla de barn som löper risk att utveckla bestående leverskada saknas. Behandling kan övervägas för HBeAg-positiva barn >2 år som långvarigt befinner sig i en immunaktiveringsfas karakteriserad av förhöjt ALAT, lågt HBV-DNA (<300 milj kopior/ml) eller hög grad av inflammation i leverbiopsi. Rekommenderad interferondos är 5 MU/m2 kroppsyta subkutant tre ggr/vecka under sex månader. Referenser 1. Bortolotti F, Jara P, Crivellaro C, Hierro L, Cadrobbi P, Frauca E et al. Outcome of chronic hepatitis B in Caucasian children during a 20-year observation period. J Hepatol 1998;29(2):18490. 2. Chang MH, Hsu HY, Hsu HC, Ni YH, Chen JS, Chen DS. The significance of spontaneous hepatitis B e antigen seroconversion in childhood: with special emphasis on the clearance of hepatitis B e antigen before 3 years of age. Hepatology 1995;22(5):1387-92 issn: 0270-9139. 3. Jara P, Bortolotti F. Interferon-alpha treatment of chronic hepatitis B in childhood: a consensus advice based on experience in European children [see comments]. J Pediatr Gastroenterol Nutr 1999;29(2):163-70. 4. Torre D, Tambini R. Interferon-alpha therapy for chronic hepatitis B in children: a meta-ana- Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn lysis. Clin-Infect-Dis 1996;23(1):131-7 issn:10584838. 5. Vajro P, Migliaro F, Fontanella A, Orso G. Interferon: a meta-analysis of published studies in pediatric chronic hepatitis B. Acta Gastroenterol Belg 1998;61(2):219-23. 6. Comanor L, Minor J, Conjeevaram HS, Roberts EA, Alvarez F, Bern EM et al. Statistical models for predicting response to interferon-alpha and spontaneous seroconversion in children with chronic hepatitis B. J Viral Hepat 2000;7(2):14452. 7. Bortolotti F, Jara P, Barbera C, Gregorio GV, Vegnente A, Zancan L et al. Long term effect of alpha interferon in children with chronic hepatitis B [see comments]. Gut 2000;46(5):715-8. 8. Vajro P, Tedesco M, Fontanella A, De Vincenzo A, Vecchione R, Ammendola R et al. Prolonged and high dose recombinant interferon alpha-2b alone or after prednisone priming accelerates termination of active viral replication in children with chronic hepatitis B infection. PediatrInfect-Dis-J 1996;15(3):223-31 issn: 0891-3668. 9. Lau DT, Everhart J, Kleiner DE, Park Y, Vergalla J, Schmid P et al. Long-term follow-up of patients with chronic hepatitis B treated with interferon alfa. Gastroenterology 1997;113(5):1660-7. 10. Niederau C, Heintges T, Lange S, Goldmann G, Niederau CM, Mohr L et al. Long-term followup of HBeAg-positive patients treated with interferon alfa for chronic hepatitis B [see comments]. N Engl J Med 1996;334(22):1422-7. 11. Fujisawa T, Komatsu H, Inui A, Sogo T, Miyagawa Y, Fujitsuka S et al. Long-term outcome of chronic hepatitis B in adolescents or young adults in follow-up from childhood [In Process Citation]. J Pediatr Gastroenterol Nutr 2000;30 (2):201-6. 12. Lee PI, Chang MH, Lee CY, Hsu HY, Chen JS, Chen PJ et al. Changes of serum hepatitis B virus DNA and aminotransferase levels during the course of chronic hepatitis B virus infection in children. Hepatology 1990;12(4 Pt 1):657-60. 13. Gregorio GV, Jara P, Hierro L, Diaz C, de la Vega A, Vegnente A et al. Lymphoblastoid interferon alfa with or without steroid pretreatment in children with chronic hepatitis B:a multicenter controlled trial. Hepatology 1996;23(4): 700-7. 14. Lai CL, Lok AS, Lin HJ, Wu PC, Yeoh EK, Yeung CY. Placebo-controlled trial of recombinant alpha 2-interferon in Chinese HBsAg-carrier children. Lancet 1987;2(8564):877-80. 15. Lai CL, Lin HJ, Lau JN, Flok AS, Wu PC, Chung HT et al. Effect of recombinant alpha 2 interfe- Info från Läkemedelsverket 4:2001 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. ron with or without prednisone in Chinese HBsAg carrier children. Q J Med 1991;78(286): 155-63. Bruguera M, Amat L, Garcia O, Lambruschini N, Carnicer J, Bergada A et al. Treatment of chronic hepatitis B in children with recombinant alfa interferon. Different response according to age at infection. J Clin Gastroenterol 1993;17(4): 296-9. Ruiz-Moreno M, Otero M, Millan A, Castillo I, Cabrerizo M, Jimenez FJ et al. Clinical and histological outcome after hepatitis B e antigen to antibody seroconversion in children with chronic hepatitis B. Hepatology 1999;29(2):572-5. Krogsgaard K. The long-term effect of treatment with interferon-alpha 2a in chronic hepatitis B. The Long-Term Follow-up Investigator Group. The European Study Group on Viral Hepatitis (EUROHEP). Executive Team on AntiViral Treatment. J Viral Hepat 1998;5(6):389-97. Ruiz Moreno M, Jimenez J, Porres JC, Bartolome J, Moreno A, Carreno V. A controlled trial of recombinant interferon-alpha in Caucasian children with chronic hepatitis B. Digestion 1990; 45(1):26-33. Ruiz Moreno M, Rua MJ, Molina J, Moraleda G, Moreno A, Garcia Aguado J et al. Prospective, randomized controlled trial of interferon-alpha in children with chronic hepatitis B. Hepatology 1991;13(6):1035-9. Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981;1(5):431-5. Cabrerizo M, Bartolome J, Ruiz-Moreno M, Otero M, Lopez-Alcorocho JM, Carreno V. Distribution of the predominant hepatitis B virus precore variants in hepatitis B e antigen-positive children and their effect on treatment response. Pediatr Res 1996;39(6):980-4. Louis Jacques O, Olson AD. Cost-benefit analysis of interferon therapy in children with chronic active hepatitis B. J-Pediatr-GastroenterolNutr 1997;24(1):25-32 issn: 0277-2116. Gottrand F, Michaud L, Guimber D, Ategbo S, Dubar G, Turck D et al. Influence of recombinant interferon alpha on nutritional status and growth pattern in children with chronic viral hepatitis. Eur-J-Pediatr 1996;155(12):1031-4 issn: 0340-6199. Iorio R, Pensati P, Botta S, Moschella S, Impagliazzo N, Vajro P et al. Side effects of alpha-interferon therapy and impact on health-related quality of life in children with chronic viral he- 39 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn patitis. Pediatr Infect Dis J 1997;16 (10):984-90. 26. Sokal EM, Roberts EA, Mieli-Vergani G, Mc Phillips P, Johnson M, Barber J et al. A dose ranging study of the pharmacokinetics, safety, and preliminary efficacy of lamivudine in children and adolescents with chronic hepatitis B. Antimicrob Agents Chemother 2000;44(3):5907. 27. Utili R, Sagnelli E, Galanti B, Aprea L, Cesaro G, Digilio L et al. Prolonged treatment of children with chronic hepatitis B with recombinant alpha 2a-interferon: a controlled, randomized study. Am J Gastroenterol 1991;86(3):327-30. 28. Sokal EM, Wirth S, Goyens P, Depreterre A, Cornu C. Interferon alfa-2b therapy in children with chronic hepatitis B. Gut 1993;34(2 Suppl): S87-90. 29. Utili R, Sagnelli E, Gaeta GB, Galanti B, Nardiello S, Felaco FM et al. Treatment of chronic hepatitis B in children with prednisone followed by alfa-interferon: a controlled randomized study. J Hepatol 1994;20(2):163-7. 30. Barbera C, Bortolotti F, Crivellaro C, Coscia A, Zancan L, Cadrobbi P et al. Recombinant interferon-alpha 2a hastens the rate of HBeAg clearance in children with chronic hepatitis B. Hepatology 1994;20(2):287-90. 31. Sokal EM, Conjeevaram HS, Roberts EA, Alvarez F, Bern EM, Goyens P et al. Interferon alfa therapy for chronic hepatitis B in children: a multinational randomized controlled trial. Gastroenterology 1998;114(5):988-95. Resultat av profylax/behandling av hepatit B vid levertransplantation JAN ANDERSSON Bakgrund Både donator, recipient och transfunderat blod screenas för Hepatit B (HBV) infektion. På grund av känsligheten hos dessa tester är sannolikheten att ådra sig HBV från organ eller transfunderat blod mycket låg. Å andra sidan är samtliga patienter som genomgår levertransplantation på grund av leversvikt orsakad av HBV, högriskpatienter för reinfektion i synnerhet de med kronisk HBV och mera ovanligt de med akut HBV (1-3). Källan till denna reinfektion kan vara cirkulerande fria virioner eller extrahepatiska reservoarer av HBV till exempel benmärg, lymfocyter och pankreas, vilket leder till att reinfektion uppstår så gott som undantagslöst (4-5). Enda undantaget är patienter som genomgår levertransplantation på grund av akut fulminant hepatit HBV. Hos dessa patienter föreligger oftast ingen aktiv virusreplikation vid tiden för transplantation och de kännetecknas av ett extremt starkt cellbundet immunsvar mot HBV. Detta är sannolikt skälet varför de inte ådrar sig reinfektion via allograftet med HBV. Tidigare förekom att sjukvården endast accepterade att levertransplantation erbjöds pati- 40 enter med HBV som saknade markörer för aktiv virusreplikation (negativ HBeAg och HBVDNA). I realiteten är emellertid replikationsstatus hos patienten före transplantation ointressant. Nästan 100% av dessa patienter kommer i alla fall att reaktivera HBV på grund av den immunsuppressiva behandlingen som är nödvändig för kontroll av rejektioner. Det är tidigare visat att glukokortikoider reaktiverar HBV via ett glukokortikoid responsivt element i HBV-genomet (6-7). Studier redan under 1980talet visade att patienter med reaktiverad HBV efter levertransplantation kunde ha extremt höga nivåer av HBV-replikation oavsett deras tidigare HBV-replikationsmarkörer. Vi har uppmätt upp till 1013 HBV-partiklar/ml serum hos levertransplanterade patienter med aktiv reinfektion av HBV. Detta gör dessa patienter extremt smittoförande och de skall därför alltid vårdas i isoleringsrum. I motsats till immunkompetenta personer där höga HBV-replikationsnivåer ofta är associerat med leverskada kan immunsupprimerade transplantationspatienter med exogen immunsuppression initialt sakna histologiska tecken på leverskada. Cirka 50% av transplanterade patienter med HBV-reaktivering är initialt asymtomatiska men högreplikativa bärare av HBV. En viss del av dessa patienter kommer emellertid att utveckla virusorsakad leverskada efter transplantation. Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Spektrum på den kliniska sjukdomen är mycket brett och variabel. Det kan variera från mild, minimalt progressiv leverskada kännetecknad av en begränsad hepatocellulär inflammation och måttligt förhöjda levertransferaser till en snabbt progressiv leverskada som kan uppstå inom ett till fem år efter levertransplantationen. Detta får till följd att ettårsöverlevnaden hos levertransplanterade patienter med HBV är ungefär 20% lägre än patienter utan HBV (Figur 1). Dessutom har HBV-infekterade patienter ökad graft förlust samt ökad incidens av sepsis och pankreatit. infektion i allograftet efter levertransplantation. Ej heller har singel interferonterapi visats effektiv i att behandla etablerad HBV-infektion efter transplantation. Tidigare undersökningar genomförda av Parfrey et al har visat att av samtliga njur- och levertransplanterade patienter med HBsAg-positivitet före transplantation erhöll cirka 65% dokumenterad HBV-infektion inom sex månader efter transplantation. Ingen av patienterna förlorade HBsAg under ett till åttaårs uppföljningsperiod. Före utvecklandet av specifik antiviral HBV-terapi var därför markörer tydande på HBV-infektion en direkt kontraindikation till organtransplantation (10-12). Hepatit D vid levertransplantation Figur 1. Figuren visar överlevnad i två olika kohorter efter levertransplantation (LTx). Den övre kurvan representerar LTx-patienter utan HBV-infektion medan den undre representerar de LTx-patienter som uppvisade tecken på aktiv HBV. * signifikant sämre femårsöverlevnad. Inom de första veckorna och till och med månader efter transplantation kan patienter med reaktiverad HBV ha mycket låga eller ej detekterbara HBs-Ag- nivåer i serum. Mest pålitligt är att påvisa HBsAg i leverbiopsi. HBVinfektion ger oftast upphov till lobulära leverskador medan rejektioner oftast initialt initieras portalt och periportalt enligt studier utförda vid Cambridge-King’s College Hospital (8-9). Vare sig profylaktisk HBV-vaccination eller interferonterapi har visats effektiv i att förhindra re- Info från Läkemedelsverket 4:2001 Levertransplanterade patienter med en leversjukdom sekundär till infektion av HBV associerat med Delta-hepatit (HDV) förefaller att ha en bättre prognos än patienter enbart infekterade med HBV. Ettårs graft överlevnad kring 90-95% har rapporterats vilket ej är skilt från patienter utan HBV. HDV efter levertransplantation är unik på två sätt. 1) Detta är den enda situation vid vilken HDV-infektion förefaller att mildra HBV-infektion. 2) Det är det enda scenariet ihop med HBV vid vilken levertransplantation inte alltid leder till en HBV-reinfektion i allograftet (13). Cirka 20% av patienter som erhåller leverallograf på grund av HDV förlorar både HBV och HDV efter transplantationen (14). Det vill säga trots att en del av patienter som genomgår levertransplantation på grund av HDV kommer att få rekurrent och oftast svår leversjukdom. Trots detta är prognosen totalt sett bättre för dessa patienter än patienter med enbart HBV-infektion (15-16). Antivirala strategier vid hepatit B infektion hos levertransplanterade patienter I tabell I sammanfattas de många olika alternativ som står till buds vid behandling och profylax av HBV-infektion hos levertransplanterade patienter. Dessa terapier har utvecklats under mer än 20 års tid och har gradvis förfinats och blivit alltmer effektiva (17-20). 41 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Tabell I. Antiviral strategi vid hepatit B infektion hos levertransplanterade individer Foscarnet Ganciklovir α-interferon Famciklovir Lamivudin Adefovirdipivoxil Adoptiv lymfocytterapi** Hyper Immunglobulin (Aunativ®) * ** Klinisk effekt +* + + ++ + + - Foscarnet har i öppna studier visat en potentiell klinisk effekt vid akut fulminant hepatit Adoptiv lymfocytterapi innebär infusion av HLA-identiska lymfocyter som stimulerats in vitro med HBV-antigen och därefter expanderats före infusion. Finns än så länge enbart data från stamcellstransplantation. Foscarnet Foscarnet utvecklades som en DNA-polymerashämmare för herpesgruppens virus under slutet av 1970-talet. Fosfonomyrsyra som är den aktiva beståndsdelen är en mycket aktiv chelatbindare med hög kalciumbindande kapacitet. Läkemedlet har prövats i synnerhet vid akut fulminant hepatit både hos immunkompetenta och hos levertransplanterade patienter. I öppna studier har foscarnet givet till patienter med akut fulminant HBV-hepatit visat sig ha en anmärkningsvärd effekt även på individer med leverkoma. Ingen placebokontrollerad prospektiv studie finns dock genomförd. Analyser av både leverbiopsier och blod visade att foscarnet inte har någon effekt på HBVreplikation. Förklaringen till den kliniska effekten har först etablerats under senare år då det visat sig att foscarnet har en effektiv antiapoptoseffekt. Denna leverskyddande effekt medieras troligen via foscarnets kraftfulla kalciumbindande effekt som därvid blockerar initiala steg i apoptosprocessen. Ganciklovir Ganciklovir har prövats i små okontrollerade studier. Cirka 50% av levertransplanterade patienter med reaktiverad hepatit B svarade med HBV-DNA-negativitet då ganciklovir gavs intravenöst i en dos av 5 mg/kg x 2 (21). Effekten är dock övergående då snabb resistens uppstår. Utöver antiviral effekt har också ganciklovir visat sig kunna normalisera transaminasstegring. Effekten har icke bedömts av sådan grad att den motiverar allmänt användan- 42 Antiviral effekt + + + ++ + + + de av ganciklovir vid HBV-infektion hos levertransplanterade. Alfa-interferon Två öppna studier med rekombinant IFN-α2b har genomförts på levertransplanterade patienter med reaktiverad HBV-infektion. IFN-α2b har givits i en dos av 3 x 106 IU tre gånger/ vecka under som längst ett års tid. En signifikant HBV-DNA-sänkning har noterats hos behandlade patienter men summan av individer med kvarstående HBsAg negativitet har varierat mellan 10% och 15% och de med PCR HBVDNA-negativitet mellan 10% och 25% (22). I hittills genomförda studier med IFN-α till levertransplanterade patienter finns ingen rapporterad ökad benägenhet för rejektion. Denna effekt får anses för beskedlig för att motivera singelterapi med α-interferon. Famciklovir Famciklovir är en nukleosidanalog med effekt på flertal herpesvirus men också på HBV. Icke placebokontrollerade studier har genomförts både som profylax och terapi vid HBV-infektion hos levertransplanterade. Behandling med 500 mg tre gånger dagligen har givits under sex till 60 månader. Läkemedlet har haft en övergående effekt. En god initial antiviral och klinisk respons noterades hos cirka 80% av de behandlade patienterna med en duration i medeltid på 16 månader (23). Tyvärr reaktiverade cirka 80% av de patienter som initialt svarade på terapin och ett kvarstående virologiskt svar noterades endast hos cirka 20% av patienterna Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn (24). Därför kan effekten av famciklovirbehandling sammanfattas som initialt god men långtidseffekten är tveksam och den stora majoriteten av patienterna kommer att relapsa på grund av utvecklande av antiviral resistens på grund av HBV-mutation. Läkemedlet tolereras annars väl och har mycket få biverkningar. Famciklovir kan därför ej rekommenderas som singelterapi till denna patientgrupp. Lamivudin Lamivudin utvecklades under 1990-talets början som ett potent HIV-läkemedel vars effekt var hämning av virussspecifikt reverterat transkriptas. I mitten av 1990-talet upptäcktes att lamivudin även hade god effekt på HBV-DNA. Öppna studier med lamivudin har genomförts på levertransplanterade patienter med reaktiverad eller de novo infektion av HBV. Det är det mest potenta anti-HBV läkemedel vi har tillgång till för närvarande. 100% av behandlade patienter har ett initialt antiviralt svar som uppnås med maximum efter ungefär två och en halv månader (25). Åtminstone 80% av behandlade patienter når HBV-DNA-negativitet men mellan 20 och 40% utvecklar terapisvikt på grund av mutation av HBV. Lamivudin har givits i en dos av 100-150 mg dagligen som singelterapi med mycket få biverkningar (2627). Patienterna som svarar med HBV-DNA-negativitet har också normalisering av transaminasnivån samt en förbättrad leverhistologi. 6080% av patienterna har ett kvarstående svar under minst 20 månader. Resistens är förknippad med en YMDD-mutation i HBV-genomet (28). Hos icke immunsupprimerade patienter har denna virusmutant ett mera benignt förlopp med betydligt långsammare utveckling av leverskada. Mekanismen för detta är än så länge okänd. I nyligen publicerade studier har lamivudin kombinerats med IFN-α 2a eller 2b (29). Detta har lett till en reducerad virusreplikation även hos patienter som har utvecklat en lamivudinresistens. Normalisering av transaminaser har varit regel. Studier har endast genomförts på små patientmaterial och alla studier har varit öppna och ej placebokontrollerade. Denna kombination kan vara ett behandlingsalternativ vid uppkomst av lamivudinresistens (30). HBV-immunglobulin Det finns ett flertal studier där hyperimmunglobulin prövats som profylax eller terapi vid levertransplantation hos HBV-infekterade pati- Info från Läkemedelsverket 4:2001 enter eller patienter som erhållit HBV-positivt organ (31-32). Hyperimmunglobulin har givits under den anhepatiska fasen, omedelbart postoperativt och därefter en gång/vecka. Man har använt intramuskulära beredningar men initialt givit immunglobulinet intravenöst. Målsättningen har varit att upprätthålla en anti-HBs-titer i serum över 100 IE/ml. Efter den första postoperativa månaden har hyperimmunglobulin i allmänhet getts en gång/månad. Resultaten av dessa studier har visat att man får en 50%-ig reduktion av incidensen av re- eller nyinfektion i graftet. Efter mer än sex månader från transplantationen ökar dock risken för HBV-mutation med risk för behandlingssvikt. Den är särskilt uttalad hos patienter som före transplantationen har aktiv HBV-replikation (31-32). Detta har lett till kombinationsbehandling med aktiv immunisering. Postoperativt har patienterna immuniserats fyra gånger med 2040 mg Engerix-b® vid en, två, fyra och sex månader efter transplantation (33). Hyperimmunglobulin har tillförts under en 18 månaders period. Av 17 immuniserade patienter utvecklade 14 (82%) en protektiv serumnivå av anti-HBs (här definierat som över 10 IE/ml serum). Hos vissa patienter kan detta vara en framgångsrik väg att förhindra reaktivering eller de novo infektion av HBV i graftet (34). Den profylaxregim som tidigare givits vid Huddinge Universitetssjukhus sammanfattas i tabell II. Detta protokoll har använts under tio års tid och lett till en signifikant sänkning av HBV-sjukdom efter transplantation. I en annan nyligen genomförd studie har patienter med måttlig risk för HBV-reaktivering (HBsAg-positivitet, HBeAg-negativitet) före levertransplantation erhållit behandling med 100 mg lamivudin dagligen i kombination med hyperimmunglobulin (35). Det senare doserades så att man erhöll en anti-HBs-titer överstigande 10 IE/ml. I medeltal hade patienterna en 74 månader lång observationstid. Samtliga patienter som överlevde denna observationstid saknade tecken på aktiv HBV-replikation och blev bestående HBsAg-negativa. Medelobservationstiden var 51 månader i denna grupp. Dessa resultat visar att kombinationen lamivudin och hyperimmunglobulin kan effektivt förhindra recidiv av HBV-infektion hos levertransplanterade patienter. Denna terapikombination är emellertid mycket kostsam och enbart hyperimmunglobulinkostnaden kan belöpa sig till mellan 200 000 och 400 000 kronor/år. 43 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn En alternativ väg har nyligen prövats med lågdos intravenöst hyperimmunglobulin (400800 IU under anhepatisk fas, omedelbart postoperativt första veckan efter transplantation och därefter månadsvis plus lamivudin). Även här har den intramuskulära hyperimmunglobulin beredningsformen använts för intravenöst bruk utan tecken till njurtoxicitet. I denna kohort var 31 av 32 patienter HBsAg-negativa under första 18 månaderna postoperativt (36). Kostnaden för hyperimmunglobulin var reducerad tiofald. Detta är sannolikt en framkomlig väg i framtiden för profylax och preemptiv terapi mot HBV-infektion hos levertransplanterade. Tabell II Profylax mot recidiverande B virus hepatit (HBV) hos HBV-seropositiva levertransplantationspatienter (LTx) (enligt Huddingemodellen) Bakgrund En levertransplanterad patient med replikerande HBV (HBsAg-positiv och/eller HBV-DNA- positiv preoperativt) har hög risk för reinfektion av transplantatet. Därför skall profylax med Aunativ® (hepatit B immunoglobulin) samt HB-Vax® ges. Behandling 1. Under anhepatiska fasen vid LTx ges 5 000 E Aunativ® (250 E/ml) i v (SIC!) som två-timmars infusion. OBS! Bör ej spädas. 2. 2 500 E Aunativ® ges dag 1-7 efter LTx som två-timmars infusion i v alternativt i m injektion om patienten har normalt INR och trombocyter över 50. 3. 1 250 E Aunativ® i m ges sedan en gång/ vecka i tre månader och därefter minst 12 månader efter LTx om anti-HBsAg titer sjunker <100 IU/ml. 4. Aktiv HBV-vaccination med 10 µg (=1 ml) HB-Vax® i m utförs 10, 14 och 34 veckor efter LTx. Uppföljning Anti-HBs, anti-HBe, HBsAg, HBeAg, anti-delta (det vill säga serologi) och HBV-DNA tages före LTx. Serologiska analyser upprepas dag 1 efter LTx och en gång/månad från och med tredje månaden efter LTx. HBV-DNA följes dag 1 och varannan månad (det vill säga månad två, fyra osv). Denna uppföljning pågår första året efter LTx; sedan vid årskontroller. 44 Adefovirdipivoxil Adefovir är ett nyutvecklat läkemedel mot HBV. Det har en direkt antiviral effekt och är en HBV-DNA-polymerashämmare. I en nyligen genomförd öppen studie på ett fåtal patienter prövades adefovir på patienter som utvecklat lamivudinresistens. Läkemedlet gavs i kombination med lamivudin. En reduktion av HBVDNA-nivåer på 2-4 log noterades i samtliga behandlade patienter (37). Kontinuerlig HBVDNA-suppression har erhållits under i medeltal en 14 månader lång period. Adefovir kan därför eventuellt i framtiden bli en tilläggsmedicin vid utvecklad lamivudinresistens. Vaccination mot HBV hos potentiella levertransplantationskandidater Patienter med kronisk leversjukdom och levercirrhos har visat sig svara mycket dåligt på konventionell rekombinant HBsAg-immunisering. Flerdosimmunisering med 20 mg Engerixb® resulterade i att endast 28-60% av patienterna svarade med ett specifikt anti-HBs-antikroppssvar (38-39). Även studier med immunisering efter levertransplantation utan samtidig hyperimmunglobulin eller antiviral terapi har också visats ge mycket klena resultat. Immunisering utan antiviral terapi är därför inte en framkomlig väg vid levertransplantation. Adoptiv terapi Transfusion av virusspecifika aktiverade lymfocyter har utvecklats för kronisk CMV- och EBVinfektion. Detta kan eventuellt även bli ett behandlingsalternativ vid kronisk HBV-infektion hos transplanterade. Det finns än så länge inga humanstudier genomförda men väl fallstudier där allogen benmärgstransplantation har genomförts från anti-HBs-positiva givare utan tecken på aktiv virusreplikation (40). Transfusion av stamceller till benmärgstransplanterade patienter med kronisk hepatit B och tecken till aktiv virusreplikation har i ett antal fallbeskrivningar visat ge upphov till specifikt anti-HBVimmunsvar (41). Patienterna har initialt fått en uppflamning med kraftfull CD8-lymfocytinfiltration i levern och i samband med detta en aktiv leverinflammation och transaminasförhöjningar. Patienterna har därefter blivit HBsAgnegativa samt HBV-DNA-negativa. Försök pågår att in vitro stimulera lymfocyter från immunkompetenta individer med genomgången HBV med HBV specifika antigen. Dessa celler expanderas därefter med hjälp av cytokinet IL-2. Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn De HBV-specifika CD8 + T-cellerna infunderas därefter i patienter med kronisk HBV. Resultat från denna behandlingsapproach föreligger ännu ej. Sammanfattning Under de sista åren har vi fått tillgång till ett flertal läkemedel med god anti-HBV-aktivitet. I synnerhet lamivudin men även adefovir samt famciklovir har visat biologisk aktivitet in vivo mot HBV. Det finns emellertid ännu inte ett konsensus huruvida kombinationer av dessa läkemedel skall ges eller huruvida man behöver kombinera lamivudin med hyperimmunglobulin alternativt aktiv immunisering med HBsAg (42-43). En svårighet i att evaluera effekten av given terapi är att det än så länge inte finns några stora placebokontrollerade studier och därmed svårt att forma ett absolut konsensus. De publicerade data anger emellertid att en profylaktisk eller preemptiv behandlingsterapi är att föredra framför en klinisk terapi när patienterna väl har ådragit sig en magnifik virusreplikation. HBV har i likhet med HIV visat sig vara ett virus som lätt muterar och genererar antiviral resistens. Kombinationsbehandlingar är därför att föredra vid långtidsbehandling. Referenser 1. Starzl TE, Demetris AJ, Van Thiel DH: Liver transplantation: Part II. N Engl J Med 1989;321: 1092-9. 2. Wright TL, Lake JR: Liver transplantation for patients with hepatitis B; what have we learned from our results? Hepatology 1991;13:796-9. 3. Todo S, Demetris AJ, Van Thiel D et al: Orthotopic liver transplantation for patients with hepatitis B virus-related liver disease. Hepatology 1991;13:619-26. 4. Yoffe B, Burns DK, Bhatt HS et al: Extrahepatic hepatitis B virus DNA sequences in patients with acute hepatitis B infection. Hepatology 1990;12:188-92. 5. Feray C, Zignego AL, Samuel D et al: Persistent hepatitis B virus infection of mononuclear blood cells without concomitant liver infection. The liver transplantation model. Transplantation 1991;49:1155-8. 6. Miller RH, Kaneko S, Chung CT et al: Compact organization of the hepatitis B virus genome. Hepatology 1989;9:322-7. 7. Farza H, Salmon AM, Hadchouel M et al: Hepatitis B surface antigen gene expression is regu- Info från Läkemedelsverket 4:2001 lated by sex steroids and glucocorticoids in transgenic mice. Proc Natl Acad Sci USA 1987; 84:1187-91. 8. Demetris AJ, Jaffe R, Sheahan DG et al: Recurrent hepatitis B in liver allograft recipients. Differentiation between viral hepatitis B and rejection. Am J Pathol 1986;125:161-72. 9. Davies SE, Portman BC, O’Grady JG et al: Hepatic histological findings after transplantation for chronic hepatitis B virus infection, including a unique pattern of fibrosing cholestatic hepatitis. Hepatology 1991;13:150-7. 10. Carey W, Pimentel R, Westveer MK et al: Failure of hepatitis B immunization in liver transplant recipients: Results of a prospective trial. Am J Gastroenterol 1990;85:1590-2. 11. Rakela J, Wooten RS, Batts KP et al: Failure of interferon to prevent recurrent hepatitis infection in hepatic allograft. Mayo Clin Proc 1989; 64:429-32. 12. Neuhaus P, Steffen R, Blumhardt G et al: Experience with immunoprophylaxis and interferon therapy after liver transplantation in HBs Ag positive patients. Transplant Proc 1991;23: 1522-4. 13. Ottobrelli A, Marzano A, Smedile A et al: Patterns of hepatitis delta virus reinfection and disease in liver transplantation. Gastroenterology 1991;101:1649-55. 14. Rosen HR, Martin P: Viral hepatitis in the liver transplant recipient. Infect Dis Clin North Am 2000;14(3):761-84. 15. Fan ST, Cheung ST, Lo CM: Indications for liver transplantation in patients with chronic hepatitis B and C virus infection and hepatocellular carcinoma. J Gastroenterol Hepatol. 2000;15 Suppl:E181-6. 16. McCaughan GW: Liver transplantation in chronic hepatitis B and C. J Gastroenterol Hepatol 2000;15 Suppl:E172-4. 17. Tong MJ, Terrault NA, Klintmalm G: Hepatitis B transplantation: special conditions. Semin Liver Dis 2000;20 Suppl 1:25. 18. Uemoto S, Inomata Y, Sakurai T: Living donor liver transplantation for fulminant hepatic failure. Transplantation 2000;70(1):152-7. 19. Ishitani M: HBV vaccination and liver transplantation for hepatitis B: winning by recruiting from within? Liver Transpl 2000;6(5):659-61. 20. Zuckerman JN, Zuckerman AJ: Current Topics in Hepatitis B. J Infect 2000;41(2):130-6. 21. Roche B, Samuel D, Gigou M et al: Long-term ganciclovir therapy for hepatitis B virus infection after liver transplantation. J Hepatol 1999;31(4):584-92. 45 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn 22. Terrault NA, Holland CC, Ferrell L et al: Interferon alfa for recurrent hepatitis B infection after liver transplantation. Liver Transpl Surg 1996;2(2):132-8. 23. Rayes N, Seehofer D, Bechstein WO et al: Longterm results of famciclovir for recurrent or de novo hepatitis B virus infection after liver transplantation. Clin Transplant 1999;13(6):447-52. 24. Terrault N: Management of hepatitis B virus infection in liver transplant recipients: prospects and challenges. Clin Transplant 2000;14 Suppl 2:39-43. 25. Malkan G, Cattral MS, Humar A et al: Lamivudine for hepatitis B in liver transplantation: a singlecenter experience. Transplantation 2000;15;69(7) :1403-7. 26. Yao FY, Bass NM: Lamivudine treatment in patients with severely decompensated cirrhosis due to replicating hepatitis B infection. J Hepatol 2000;33(2):301-7. 27. Seehofer D, Rayes N, Berg T et al: Lamivudine as first- and second-line treatment of hepatitis B infection after liver transplantation. Transpl Int 2000;13(4):290-6. 28. Gutfreund KS, Williams M, George R et al: Genotypic succession of mutations of the hepatitis B virus polymerase associated with lamivudine resistance. J Hepatol 2000;33(3):469-75. 29. Seehofer D, Rayes N, Berg T et al: Additional interferon alpha for lamivudine resistant hepatitis B infection after liver transplantation: a preliminary report. Transplantation 2000;69(8): 1739-42. 30. Mutimer D, Pillay D, Shields P et al: Outcome of lamivudine resistant hepatitis B virus infection in the liver transplant recipient. Gut 2000; 46(1):107-13. 31. Kruger M: European hepatitis B immunoglobulin trials: prevention of recurrent hepatitis B after liver transplantation. Clin Transplant 2000;14 Suppl;2:14-9. 32. Pruett TL, McGory R: Hepatitis B immune globulin: the US experience. Clin Transplant 2000; 14 Suppl 2:7-13. 33. Sanchez-Fueyo A, Rimola A, Grande L et al: Hepatitis B immunoglobulin discontinuation followed by hepatitis B virus vaccination: A new strategy in the prophylaxis of hepatitis B 46 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. virus recurrence after liver transplantation. Hepatology 2000;31(2):496-501. Mutimer D, Dusheiko G, Barrett C et al: Lamivudine without HBIg for prevention of graft reinfection by hepatitis B: long-term follow-up. Transplantation 2000;70(5):809-15. Dodson SF, de Vera ME, Bonham CA et al: Lamivudine after hepatitis B immune globulin is effective in preventing hepatitis B recurrence after liver transplantation. Liver Transpl 2000; 6(4):434-9. Angus PW, McCaughan GW, Gane EJ et al: Combination low-dose hepatitis B immune globulin and lamivudine therapy provides effective prophylaxis against posttransplantation hepatitis B. Liver Transpl 2000;6(4):429-33. Perrillo R, Schiff E, Yoshida E et al: Adefovir dipivoxil for the treatment of lamivudine-resistant hepatitis B mutants. Hepatology 2000;32(1): 129-34. Dominguez M, Barcena R, Garcia M et al: Vaccination against hepatitis B virus in cirrhotic patients on liver transplant waiting list. Liver Transpl 2000;6(4):440-2. Villeneuve E, Vincelette J, Villeneuve JP: Ineffectiveness of hepatitis B vaccination in cirrhotic patients waiting for liver transplantation. Can J Gastroenterol 2000;14 Suppl B:59B-62B. Lau GK, Yuen ST, Au WY et al: Histological changes during clearance of chronic hepatitis B virus infection by adoptive immunity transfer. J Gastroenterol Hepatol 1999;14(3):262-8. Lau GK, Lok AS, Liang RH et al: Clearance of hepatitis B surface antigen after bone marrow transplantation: role of adoptive immunity transfer. Hepatology 1997;25(6):1497-501. Wedemeyer H, Boker KH, Pethig K et al: Famciclovir treatment of chronic hepatitis B in heart transplant recipients: a prospective trial. Transplantation 1999;68(10):1503-11. Andreone P, Caraceni P, Grazi GL et al: Lamivudine treatment for acute hepatitis B after liver transplantation. J Hepatol 1998;29(6):985-9. Dodson SF: Prevention of de novo hepatitis B infection after liver transplantation with allografts from hepatitis B core antibody positive donors. Clin Transplant 2000;14 Suppl 2:20-4. Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn Immunmodulering som framtida behandling av kroniska hepatit B virus infektioner M ATTI SÄLLBERG Inledning Immunmodulering har under lång tid indirekt använts vid terapi av kroniska hepatit B virus (HBV) infektioner i samband med αIFN terapi. Försök på möss som uttrycker hepatit B virus e antigen (HBeAg) i levern har visat att αIFN kan modulera det HBeAg-specifika immunsvaret (1). Förutom denna effekt, vars antivirala betydelse är oklar, modulerar αIFN uttrycket av olika cellytemarkörer inom immunsystemet, som till exempel uttryck av humant leukocytantigen (HLA) klass I och klass II. Generell immunmodulering Man kan generellt indela immunmodulering i två delar, generell och specifik. En generell immunmodulering kan uppnås via ett flertal substanser med en dokumenterad effekt på celler eller mediatorer inom immunsystemet. En rådande dogm är att immunsvar innehållande Tceller som producerar IL-2 och γIFN betecknas som antivirala immunsvar, eller T helper-1 (Th1)-liknande. Ofta ställs Th2-liknande, med T-celler som producerar IL-4, IL-5, och IL-10, i ett motsatsförhållande till Th1-svar och tros ej besitta samma antivirala karaktär. Mycket av denna lite förenklade världsbild är baserat på fynd från olika musmodeller. Som exempel kan anges en transgen musmodell vilken uttrycker hela HBV-genomet i levern och i vilken infektiöst virus produceras. Dock är viruscykeln i sig ej infektiös då virusreplikationen utgår från en kromosomalt integrerad transgen. I denna modell identifierades en extrem känslighet hos HBV för en lokal produktion av γIFN (2) vilken kan induceras via överföring av specifika T-celler (3-4) eller infektion med hepatotropa virus (5) eller parasiter (6-7). Senare studier visade att liknande icke-lytiska mekanismer kan operera vid kronisk hepatit B virus infektion hos schimpans (8). Dessa studier talar för att 1) γIFN är av stor betydelse och 2) att ospecifika T-celler i levern kan påverka infektionen. Beträffande terapi med γIFN har denna ej varit framgångsrik på människa delvis beroende på toxicitet. Dock vet vi att en patient med kronisk HBV-infektion vilken får en Info från Läkemedelsverket 4:2001 superinfektion med hepatit D virus kan på grund av immunaktiveringen mot HDV läka ut HBV-infektionen. Sammantaget är HBVs extrema känslighet för γIFN ännu oklar dock talar mycket för att en aktivering av specifika, och kanske ospecifika, T-celler lokalt i levern är gynnsamt för att läka ut infektionen. Nyligen har olika former av generell immunmodulerande terapi testats på kronisk HBV-infektion. IL-12 är en mycket potent immunmodulator vilken delvis antagonerar funktionen hos IL-10 och stimulerar γIFN produktion. IL12 produceras normalt av makrofager och professionella antigen presenterande celler. IL-12, αIFN och IL-18 kan aktivera γINF produktion (9). IL-12 har föreslagits korrelera till utläkning av HBV-infektion (10). På patienter med kronisk HBV-infektion har effekterna av IL-12 varit relativt goda med viss effekt samt låg toxicitet (11). Sammantaget så bör IL-12 utgöra ett intressant komplement till arsenalen av immunmodulerande substanser som stödjer antivirala immunsvar. En mycket intressant terapi av idag oklar betydelse är riktad mot natural killer (NK) celler. Studier har visat att histamin kan blockera den inhibitoriska effekten av väteperoxid från monocyter på NK celler (12). Detta leder till en potentiering av γIFN produktionen från NKceller. Idag är sannolikt betydelsen av NK-celler vid kroniska hepatiska infektioner underskattad. Specifik immunmodulering Specifik immunmodulering innebär att man selektivt aktiverar/inhiberar immunsvaret mot ett virus eller virus protein. Tydliga exempel på detta är terapeutisk vaccination med ett eller flera virala protein i syfte att ge detta antigen under mer immunogena förhållanden. Intressanta försök har gjorts på människa med en kombination av anti-HBs hyperimmunglobulin och vaccination som profylax mot relaps vid levertransplantation (13). Vaccination med HBsAg har även givits personer med kronisk HBV-infektion i kombination med eller utan antiviral terapi (14-15). Dessa studier har givit ett tveksamt resultat. Man har även utan framgång testat att vaccinera patienter med kronisk HBV-infektion med syntetiska peptider innehållande epitoper från HBcAg i syfte att akti- 47 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn vera specifika cytotoxiska T-celler. I schimpans har preliminära försök med genetisk immunisering med HBcAg vid kronisk HBV-infektion visat att viss effekt kan erhållas (17). En intensiv utveckling pågår med olika typer av genetisk immunisering. Problemen med dessa är idag dålig immunogenicitet (DNA-vaccin) och tveksam säkerhet (virusvektorer). Dock bör dessa problem lösas inom en överskådlig framtid varvid dessa kan utgöra viktiga kandidater för terapeutisk genetisk vaccination. Sammanfattning Sammanfattningsvis så har man under årtionden relativt framgångsrikt behandlat kronisk HBV-infektion med immunmodulerande substanser som αIFN. Nya substanser till exempel IL-12, IL-18, som effektivt stödjer det defekta endogena antivirala immunsvaret får sägas vara av stort intresse och kommer i framtiden sannolikt att utgöra en naturlig del i en kombinationsterapi. Avseende specifik immunmodulering finns det egentligen inga riktigt goda grunder att välja terapeutisk vaccination med HBsAg. Endast en dålig korrelation föreligger mellan utläkning av infektion och T-cells svar mot HBsAg (18). Dock finns det vederlagt i ett flertal studier att T-cells svaret mot HBcAg korrelerar till utläkning av kronisk infektion (1819). Således bör detta vara ett bättre alternativ till dagens HBsAg-vaccin vid terapeutiskt bruk. Dock råder stora oklarheter i vilken form vaccinet skall ges (rekombinant protein/genetisk immunisering) och när/hur detta bäst administreras. Sannolikt kan en framtida effektiv antiviral terapi för kronisk HBV-infektion bestå av en eller flera nukleosidanaloger, en generell immunmodulerande substans och ett terapeutiskt vaccin. Referenser 1. Milich DR, Schodel F, Hughes JL, Jones JE, Peterson DL. The hepatitis B virus core and e antigens elicit different Th cell subsets: antigen structure can affect Th cell phenotype. J Virol 1997;71:2192-201. 2. Tsui LV, Guidotti LG, Ishikawa T, Chisari FV. Posttranscriptional clearance of hepatitis B virus RNA by cytotoxic T lymphocyte-activated hepatocytes. Proc Natl Acad Sci USA 1995;92: 12398-402. 3. Guidotti LG, Ishikawa T, Hobbs MV, Matzke B, Schreiber R, Chisari FV. Intracellular inactiva- 48 tion of the hepatitis B virus by cytotoxic T lymphocytes. Immunity 1996;4:25-36. 4. Franco A, Guidotti LG, Hobbs MV, Pasquetto V, Chisari FV. Pathogenetic Effector Function Of CD4-Positive T Helper 1 Cells In Hepatitis B Virus Transgenic Mice. J Immunol 1997;159: 2001-8. 5. Guidotti LG, Borrow P, Brown A, McClary H, Koch R, Chisari FV. Noncytopathic clearance of lymphocytic choriomeningitis virus from the hepatocyte. J Exp Med 1999;189:1555-64. 6. McClary H, Koch R, Chisari FV, Guidotti LG. Inhibition of hepatitis B virus replication during schistosoma mansoni infection in transgenic mice. J Exp Med 2000;192:289-94. 7. Pasquetto V, Guidotti LG, Kakimi K, Tsuji M, Chisari FV. Host-Virus Interactions during Malaria Infection in Hepatitis B Virus Transgenic Mice. J Exp Med 2000;192:529-36. 8. Guidotti LG, Rochford R, Chung J, Shapiro M, Purcell R, Chisari FV. Viral clearance without destruction of infected cells during acute HBV infection. Science 1999;284:825-9. 9. Sareneva T, Julkunen I, Matikainen S. IFN-alpha and IL-12 induce IL-18 receptor gene expression in human NK and T cells. J Immunol 2000;165:1933-8. 10. Rossol S, Marinos G, Carucci P, Singer MV, Williams R, Naoumov NV. Interleukin-12 induction of Th1 cytokines is important for viral clearance in chronic hepatitis B. J Clin Invest 1997; 99:3025-33. 11. Carreno V, Zeuzem S, Hopf U, Marcellin P, Cooksley WG, Fevery J et al. A phase I/II study of recombinant human interleukin-12 in patients with chronic hepatitis B. J Hepatol 2000; 32:317-24. 12. Asea A, Hansson M, Czerkinsky C, Houze T, Hermodsson S, Strannegard O et al. Histaminergic regulation of interferon-gamma (IFN-gamma) production by human natural killer (NK) cells. Clin Exp Immunol 1996;105:376-82. 13. Sanchez-Fueyo A, Rimola A, Grande L, Costa J, Mas A, Navasa M et al. Hepatitis B immunoglobulin discontinuation followed by hepatitis B virus vaccination: A new strategy in the prophylaxis of hepatitis B virus recurrence after liver transplantation. Hepatol 2000;31:496-501. 14. Pol S, Driss F, Michel ML, Nalpas B, Berthelot P, Brechot C. Specific vaccine therapy in chronic hepatitis B infection. Lancet 1994;344:342. 15. Couillin I, Pol S, Mancini M, Driss F, Brechot C, Tiollais P et al. Specific vaccine therapy in chronic hepatitis B: induction of T cell proliferative Info från Läkemedelsverket 4:2001 Bakgrundsdokumentation Behandling av kronisk hepatit B hos vuxna och barn responses specific for envelope antigens [published erratum appears in J Infect Dis 1999 Nov;180(5):1756]. J Infect Dis 1999;180:15-26. 16. Heathcote J, McHutchison J, Lee S, Tong M, Benner K, Minuk G et al. A pilot study of the CY-1899 T-cell vaccine in subjects chronically infected with hepatitis B virus. The CY1899 T Cell Vaccine Study Group. Hepatol 1999;30:5316. 17. Sällberg M, Hughes J, Javadian A, Ronlov G, Hultgren C, Townsend K et al. Genetic immunization of chimpanzees chronically infected with the hepatitis B virus (HBV) using a recom- Info från Läkemedelsverket 4:2001 binant retroviral vector encoding the HBV core antigen. Hum Gene Ther 1998;9:1719-30. 18. Ferrari C, Penna A, Bertoletti A, Valli A, Antoni AD, Giuberti T et al. Cellular immune response to hepatitis B virus-encoded antigens in acute and chronic hepatitis B virus infection. J Immunol 1990;145:3442-9. 19. Jung MC, Diepolder HM, Spengler U, Wierenga EA, Zachoval R, Hoffmann RM et al. Activation of a heterogeneous hepatitis B (HB) core and e antigen-specific CD4 + T-cell population during seroconversion to anti-HBe and anti-HBs in hepatitis B virus infection. J Virol 1995;69:3358-68. 49