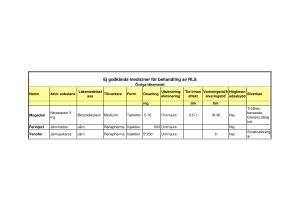
Jrnsackaros Rechon sol for injection or conc for sol for inf SmPC
advertisement

Läkemedelsverket 2014-06-23 PRODUKTRESUMÉ 1. LÄKEMEDLETS NAMN Järnsackaros Rechon 20 mg/ml injektionsvätska/koncentrat till infusionsvätska, lösning. 2. KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING En ampull Järnsackaros Rechon à 5 ml innehåller 100 mg järn i form av järnsackaros (järn(III)hydroxid-sackaroskomplex) motsvarande 20 mg järn per ml. För fullständig förteckning över hjälpämnen, se avsnitt 6.1. 3. LÄKEMEDELSFORM Injektionsvätska/koncentrat till infusionsvätska, lösning. Järnsackaros Rechon är en mörkbrun, ogenomskinlig vattenlösning. 4. KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Järnbrist vid följande indikationer: • Kliniskt behov av att snabbt leverera järn till järndepåer. • Då perorala järnpreparat inte tolereras av patienten och vid bristande följsamhet. • Aktiv inflammatorisk tarmsjukdom hos patienter då perorala järnpreparat är ineffektiva. Diagnosen järnbrist skall baseras på laboratorieprover (t.ex. Hb, serumferritin, serumjärn, transferrinmättnad, hematokrit, erytrocytvärde och röda blodkroppar (MCV, MCHC, MCH)). 4.2 Dosering och administreringssätt Övervaka patienter noga med avseende på tecken och symptom på överkänslighetsreaktioner under och efter varje administrering av Järnsackaros Rechon. Järnsackaros Rechon ska endast administreras när personal som är utbildad i att bedöma och hantera anafylaktiska reaktioner finns tillhands, i en miljö där lokaler och utrustning för återupplivning garanterat är tillgängliga. Patienten ska observeras med avseende på biverkningar under minst 30 minuter efter varje injektion av Järnsackaros Rechon (se avsnitt 4.4). Dosering Total kumulativ dos av Järnsackaros Rechon, motsvarande den totala järnbristen (mg), bestäms utifrån hemoglobinvärde och kroppsvikt. Dosen Järnsackaros Rechon måste fastställas individuellt för varje patient utifrån det totala järnunderskottet beräknat med följande formel: Totalt järnunderskott (mg) = kroppsvikt (kg) x (mål-Hb - aktuellt Hb) (g/l) x 0,24* + depåjärn (mg) Kroppsvikt <35 kg: mål-Hb = 130 g/l + depåjärn = 15 mg/kg kroppsvikt Kroppsvikt ≥ 35 kg: mål-Hb = 150 g/l + depåjärn = 500 mg * Faktor 0,24 = 0,0034 x 0,07 x 1000 (Järnhalten i hemoglobin ca 0,34 % / blodvolym ca 7 % av kroppsvikt / faktor 1000 = omvandling från g till mg) 1 Läkemedelsverket 2014-06-23 Den totala mängd Järnsackaros Rechon som behövs bestäms utifrån någon av ovanstående ekvationer eller enligt följande tabell: Kroppsvikt (kg) Totalt antal Järnsackaros Rechon-ampuller Hb 60 g/l Hb 75 g/l Hb 90 g/l Hb 105 g/l 30 9,5 8,5 7,5 6,5 35 12,5 11,5 10 9 40 13,5 12 11 9,5 45 15 13 11,5 10 50 16 14 12 10,5 55 17 15 13 11 60 18 16 13,5 11,5 65 19 16,5 14,5 12 70 20 17,5 15 12,5 75 21 18,5 16 13 80 22,5 19,5 16,5 13,5 85 23,5 20,5 17 14 90 24,5 21,5 18 14,5 För att omvandla Hb (mM) till Hb (g/l) multipliceras det förstnämnda värdet med 16,1145. Den totala engångsdosen skall inte överskrida 200 mg järn, och denna dos får ges högst tre gånger i veckan. Om den totala nödvändiga dosen överskrider den största tillåtna engångsdosen, måste den delas upp i flera administreringar. Pediatrisk population Järnsackaros har inte undersökts tillräckligt hos barn. Därför rekommenderas Järnsackaros Rechon inte till barn. Administreringssätt Järnsackaros Rechon skall endast ges som långsam intravenös injektion eller som intravenös infusion. Järnsackaros Rechon skall inte injiceras intramuskulärt. Intravenös infusion Järnsackaros Rechon skall endast spädas med steril natriumkloridlösning 9 mg/ml. • 5 ml Järnsackaros Rechon (100 mg järn) skall spädas med max. 100 ml steril natriumkloridlösning 9 mg/ml. • 10 ml Järnsackaros Rechon (200 mg järn) skall spädas med max. 200 ml steril natriumkloridlösning 9 mg/ml. Av stabilitetsskäl är spädning av Järnsackaros Rechon till lägre koncentrationer inte tillåtet. Spädning måste utföras omedelbart före infusion och lösningen bör administreras enligt följande: • 100 mg järn (5 ml Järnsackaros Rechon) under minst 15 minuter • 200 mg järn (10 ml Järnsackaros Rechon) under minst 30 minuter 2 Läkemedelsverket 2014-06-23 Intravenös injektion Järnsackaros Rechon kan ges som långsam intravenös injektion med en hastighet av 1 ml outspädd lösning per minut (dvs. 5 minuter per ampull) och högst 2 ampuller Järnsackaros Rechon (200 mg järn) per injektion. Vid dialys Järnsackaros Rechon kan administreras under en hemodialysbehandling direkt i blodslangen på vensidan av dialysatorn på samma sätt som beskrivits för intravenös injektion. Försiktighetsåtgärder före hantering eller administrering av läkemedlet Kontrollera före användning att det inte finns fällning i ampullerna och att de inte är skadade. Använd endast ampuller där lösningen är homogen och utan fällning. Den utspädda lösningen skall vara brun och klar till utseende. Se även avsnitt 6.3. 4.3 Kontraindikationer • • • • 4.4 Överkänslighet mot den aktiva substansen, Järnsackaros Rechon eller mot något hjälpämne som anges i avsnitt 6.1 Konstaterad allvarlig överkänslighet mot andra parenterala järnprodukter Anemier som inte orsakats av järnbrist Överbelastning av järn eller rubbningar i kroppens användning av järn Varningar och försiktighet Parenteralt administrerade järnpreparat kan ge upphov till överkänslighetsreaktioner inklusive allvarliga och potentiellt dödliga anafylaktiska/anafylaktoida reaktioner. Överkänslighetsreaktioner har även rapporterats när tidigare doser av parenterala järnkomplex inte har resulterat i några oönskade effekter. Risken är större för patienter med konstaterade allergier inklusive läkemedelsallergier, däribland patienter med svår astma, eksem eller andra atopiska allergier i anamnesen. Det finns även en ökad risk för överkänslighetsreaktioner mot parenterala järnkomplex hos patienter med immunologiska eller inflammatoriska tillstånd (t.ex. systemisk lupus erythematosus, reumatoid artrit). Järnsackaros Rechon ska endast administreras när personal som är utbildad i att bedöma och hantera anafylaktiska reaktioner finns tillhands, i en miljö där lokaler och utrustning för återupplivning garanterat finns tillgängliga. Varje patient ska observeras avseende biverkningar under minst 30 minuter efter varje injektion av Järnsackaros Rechon. Om överkänslighetsreaktioner eller tecken på intolerans uppkommer under administreringen måste behandlingen stoppas omedelbart. Lokaler för hjärt-lungräddning och utrustning för hantering av akuta anafylaktiska/anafylaktoida reaktioner ska finnas tillgängliga, inklusive en injicerbar 1:1 000 adrenalinlösning. Ytterligare behandling med antihistaminer och/eller kortikosteroider ges efter behov. Till patienter med nedsatt leverfunktion skall parenteralt järn administreras endast efter noggrann bedömning av nytta/risk. Administrering av parenteralt järn skall undvikas till patienter med nedsatt leverfunktion när järnöverskott är en utlösande faktor, i synnerhet vid Porfyria Cutanea Tarda (PCT). Noggrann övervakning av järnstatus rekommenderas för att järnöverskott skall undvikas. Parenteralt järn skall användas med försiktighet vid fall av akut eller kronisk infektion. Det rekommenderas att administrering av järnsackaros avbryts till patienter med pågående bakteriemi. För patienter med kronisk infektion skall bedömning av nytta/risk utföras, varvid suppression av erytropoes skall beaktas. 3 Läkemedelsverket 2014-06-23 Hypotensiva reaktioner kan uppträda om injektionen ges alltför snabbt. Allergi-liknande reaktioner, ibland inkluderande artralgi, har varit vanligare när den rekommenderade doseringen har överskridits. Extravasalt läckage måste undvikas, eftersom läckage av Järnsackaros Rechon vid injektionsstället kan leda till smärta, inflammation, vävnadsnekros och brun missfärgning av huden. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Som övriga parenterala järnpreparat bör Järnsackaros Rechon inte ges tillsammans med perorala järnpreparat, eftersom detta minskar absorptionen av peroralt järn. Därför bör peroral järnbehandling inte påbörjas förrän tidigast 5 dagar efter den sista Järnsackaros Rechon-injektionen. 4.6 Fertilitet, graviditet och amning Graviditet Det finns inga adekvata och välkontrollerade studier av järnsackaros till gravida kvinnor. Därför krävs en noggrann risk/nytta-bedömning före användning under graviditet. Järnsackaros Rechon skall användas under graviditet endast då det är absolut nödvändigt (se avsnitt 4.4). Järnbristanemi som uppträder under graviditetens första trimester kan i många fall behandlas med peroralt järn. Behandling med Järnsackaros Rechon ska begränsas till andra och tredje trimestern om nyttan bedöms uppväga den potentiella risken för både modern och fostret. Data från ett begränsat antal exponerade graviditeter visade inga skadliga effekter av järnsackaros vid graviditet eller på fostrets/det nyfödda barnets hälsa. Studier på djur visade inga direkt eller indirekt skadliga effekter med avseende på graviditet, embryonal/fetal utveckling, förlossning eller postnatal utveckling. Amning Icke-metaboliserad Järnsackaros Rechon går sannolikt inte över i modersmjölk. Inga välkontrollerade kliniska studier finns tillgängliga till dags dato. Djurstudier tyder inte på direkt eller indirekt skadliga effekter på barn som ammas. Fertilitet Studier på djur visade inga direkt eller indirekt skadliga effekter med avseende på fertilitet eller parningsbeteende. 4.7 Effekter på förmågan att framföra fordon och använda maskiner I fall av yrsel, förvirring eller omtöckning efter administrering av Järnsackaros Rechon, skall patienten inte köra bil eller använda maskiner förrän symtomen har avtagit. 4.8 Biverkningar Sammanfattningsvis var de vanligaste biverkningarna (ADRs) för järnsackaros i kliniska prövningar övergående smakrubbningar, hypotension, feber och frossa, reaktioner på injektionsstället och illamående hos 0,5 till 1,5 % av patienterna. Anafylaktoida reaktioner, som inte var av allvarlig karaktär, var sällsynta. Anafylaktoida reaktioner är generellt sett de potentiellt allvarligaste biverkningarna (4.4 Varningar och försiktighet). 4 Läkemedelsverket 2014-06-23 I kliniska prövningar har följande biverkningar rapporterats i samband med administrering av järnsackaros med åtminstone ett möjligt orsakssamband: Vanliga (≥1/100, <1/10) Hjärtat Centrala och perifera nervsystemet Övergående smakrubbningar (speciellt metallsmak) Andningsvägar, bröstkorg och mediastinum Magtarmkanalen Hud och subkutan vävnad Muskuloskeletala systemet och bindväv Blodkärl Allmänna symtom och/eller symtom vid administreringsstället Mindre vanliga (≥1/1 000, <1/100) Takykardi, hjärtklappning Huvudvärk, yrsel Sällsynta (≥1/10 000, <1/1 000) Parestesi, synkope, medvetslöshet, brännande känsla Bronkospasm, dyspné Illamående, kräkningar, buksmärtor, diarré Pruritus, urtikaria, hudutslag, exantem, erytem Muskelkramper, myalgi Hypotension, kollaps Feber, frossa, blodvallning, bröstsmärtor och andnöd. Reaktioner på injektionsstället såsom ytliga flebiter, brännande känsla och svullnad. Immunsystemet Hypertension Artralgi, perifert ödem, trötthet, asteni, sjukdomskänsla, värmekänsla, ödem Anafylaktoida reaktioner Dessutom har följande biverkningar rapporterats spontant: Enstaka fall: sänkt medvetandegrad, omtöckning, förvirring, angioödem, ledsvullnad, hyperhidros, ryggsmärta, bradykardi, kromaturi. Rapportering av misstänkta biverkningar Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till (se detaljer nedan). Läkemedelsverket Box 26 751 03 Uppsala Webbplats: www.lakemedelsverket.se 4.9 Överdosering Överdosering kan orsaka en akut järnöverbelastning och hemosideros. Överdosering bör vid behov behandlas med ett järnkelatkomplexbildande preparat. 5. FARMAKOLOGISKA EGENSKAPER 5 Läkemedelsverket 2014-06-23 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Järn, parenterala preparat. ATC-kod: B03AC De ferrokinetiska egenskaperna hos järnsackaros har undersökts i en isotopstudie (59Fe och 52Fe) hos 5 patienter med anemi och kronisk njursvikt. Plasmaclearance för 52Fe var 60 till 100 minuter. 52Fe distribuerades till levern, mjälten och benmärgen. Två veckor efter administreringen var det maximala upptaget av 59Fe i de röda blodcellerna 62 % till 97 %. 5.2 Farmakokinetiska egenskaper Distribution Efter intravenös injektion av en engångsdos av järnsackaros innehållande 100 mg järn till friska frivilliga uppnåddes maximal järnkoncentration, i genomsnitt 538 μmol/l, 10 minuter efter injektionen. Distributionsvolymen för järnsackaros var ungefär likvärdig med plasmavolymen (ca 3 liter). Eliminering Injicerat järn eliminerades snabbt ur plasma, med en halveringstid av ca 6 timmar. Distributionsvolymen vid ”steady state” var ca 8 liter, vilket tyder på en låg distributionsgrad av järn i kroppsvätskorna. Eftersom järnsackaros är mindre stabilt än transferrin, sågs en konkurrerande bindning av järn till transferrin. Detta ledde till en järntransport av ca 31 mg järn/24 timmar. Eliminationen av järn via njurarna under de första 4 timmarna efter injektion motsvarade mindre än 5 % av kroppens totala clearance. Efter 24 timmar hade järnkoncentrationen i plasma återgått till de nivåer som rådde före behandlingen och ca 75 % av sackarosdosen hade eliminerats. 5.3 Prekliniska säkerhetsuppgifter Det finns inga prekliniska data som den förskrivande läkaren bör känna till utöver den information som lämnas i andra avsnitt i denna produktresumé. 6. FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen Vatten för injektionsvätskor Natriumhydroxid 6.2 Inkompatibiliteter Järnsackaros Rechon skall endast blandas med steril natriumkloridlösning 9 mg/ml. Inga andra lösningar eller läkemedel skall användas, då risk för fällning och/eller interaktion föreligger. Kompatibiliteten med andra behållare än glas, polyetylen och PVC har inte dokumenterats. 6.3 Hållbarhet 3 år. Hållbarhet i öppnad förpackning Från mikrobiologisk synpunkt skall produkten användas omedelbart. Hållbarhetstid efter spädning med steril natriumkloridlösning 9 mg/ml Mikrobiologiskt sett bör produkten användas omedelbart efter spädning med steril natriumkloridlösning 9 mg/ml. 6 Läkemedelsverket 2014-06-23 6.4 Särskilda förvaringsanvisningar Får ej frysas. Förvaringsanvisningar för läkemedlet efter spädning och öppnande finns i avsnitt 6.3. 6.5 Förpackningstyp och innehåll 5 ml lösning i glasampull Typ I i förpackningar om 5 ampuller. 6.6 Särskilda anvisningar för destruktion och övrig hantering Kontrollera före användning att det inte finns fällning i ampullerna och att de inte är skadade. Använd endast ampuller där lösningen är homogen och utan fällning. Den utspädda lösningen ska vara brun och klar till utseendet. Se även avsnitt 6.3. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar. 7. INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Rechon Life Science AB Box 60043 216 10 Limhamn 8. NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 41988 9. DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE Datum för det första godkännandet: 8 mars 2012 10. DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 2014-06-23 7