EGENSKAPER F¨OR ENHETLIGA¨AMNEN Enhetligt ämne (eng
advertisement

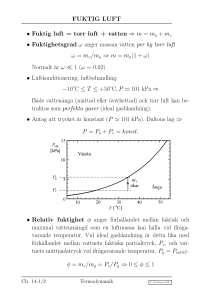
EGENSKAPER FÖR ENHETLIGA ÄMNEN Enhetligt ämne (eng. pure substance): ett ämne som är homogent och som har enhetlig kemisk sammansättning, även om fasomvandling sker. Vid jämvikt för ett system av ett enhetligt ämne kan endast tre faser (aggregationstillstånd) existera samtidigt: fast, flytande och gasformig fas. Luft i gasform kan betraktas som ett enhetligt ämne, däremot inte en jämviktsblandning av luft i både vätske- och gasform (vätskan innehåller mer kväve än gasen). I den fasta fasen är molekylerna, via starka intermolekylära krafter, ordnade i ett fixerat tredimensionellt mönster (gitter). Om trycket hålls konstant och temperaturen höjs kommer molekylerna till slut att bryta sig ur detta mönster (sublimation eller smältning). I vätskefasen så flyter det omkring stora grupper av molekyler i ett visst mått av inre ordnad struktur. I gasfasen är molekylerna i medeltal mycket långt ifrån varandra. Molekylerna susar omkring mer eller mindre oordnat och oberoende av varandra. Ch. 4-1/2 Termodynamik C. Norberg, LTH VÄRMNING AV VATTEN Experiment: värmning av vatten vid konstant tryck • Inneslut m = 0.10 kg is med temperaturen −20◦C i en isolerad behållare med rörlig kolv. Trycket är konstant, säg P = 101 kPa. • Värm långsamt behållaren på en elektrisk värmeplatta med konstant (låg) effekt, säg 100 W; kvasistatisk process. • Registrera temperatur, tid, volym samt närvarande faser (F/V/G = Fast/Vätska/Gas). Ch. 4-3 Termodynamik C. Norberg, LTH VÄRMNING AV VATTEN. . . Noterat längs vägen: temperaturen konstant under fasomvandling; volymminskning vid smältning (ovanligt, gäller nästan bara vatten); ca. dubbelt så lång tid att värma flytande vatten ett visst gradantal jämfört med is och ånga; förångning ca. 7 gånger långsammare än smältning; extremt stor volymökning vid förångning, ca. 1600 ggr! Temperatur och fassammansättning s.f.a. tid: Försöket upprepat vid olika tryck: Ingen smältning vid tillräckligt lågt tryck, direkt omvandling fast fas – ånga (sublimation); smälttemperaturen minskar något med ökande tryck (−1.9◦ C vid 25 MPa); kokpunkten (förångningstemperaturen) ökar med ökande tryck, försvinner vid tillräckligt höga tryck! Ch. 4-3 Termodynamik C. Norberg, LTH FASDIAGRAM (P -T –DIAGRAM) Ch. 4-4 Termodynamik C. Norberg, LTH FASDIAGRAM. . . Trippelpunkt: alla tre faserna i jämvikt Ämne H2O CO2 Hg Zn Ch. 4-4 Ttp Ptp 1 atm, 20◦C 0.01◦C 0.612 kPa vätska −57◦C 517 kPa gas ◦ −39 C 0.0002 Pa vätska 420◦C 65 Pa fast Termodynamik C. Norberg, LTH T -v–DIAGRAM Ch. 4-4 Termodynamik C. Norberg, LTH SPECIFIK ÅNGMÄNGD P –v-diagram • Fuktiga området (eng. wet region) Vätska och gas i jämvikt; isobarer och isotermer sammanfaller. Volymitet, mättad vätska: vf Volymitet, mättad ånga: vg • Specifik ångmängd (eng. quality) x = massinnehåll ånga per kg, x = mg /m Volymitet, mättnadsblandning: vavg = V/m = (mf vf +mg vg )/m vavg = (1 − x) vf + x vg = vf + x (vg − vf ) = vf + x vfg x= Ch. 4-5 vavg − vf vavg − vf = vg − vf vfg Termodynamik C. Norberg, LTH P –v–T -samband, expansion vid stelning Gäller nästan bara vanligt vatten Ch. 4-4 Termodynamik C. Norberg, LTH P –v–T -samband, kontraktion vid stelning Gäller nästan alla ämnen utom vatten Ch. 4-4 Termodynamik C. Norberg, LTH ENTALPI Entalpi, H = U + P V [ J ] Entalpi per massenhet, h = u + P v [ J/kg ] Entalpi = inre energi + “flödesenergi” • Användandet av entalpi är speciellt lämpligt vid kontrollvolymsanalys (öppna system). Ex. adiabatisk turbin (försumbart värmeutbyte), massflöde ṁ Axeleffekt: ẆT ≃ ṁ (h1 − h2) • Ångbildningsentalpi (förångningsvärme) = hg − hf = hfg — motsvarar det värme (per kg) som måste “tillföras” under konstant tryck för att en mättad vätska helt skall förångas; minskar med ökande tryck, noll vid kritiska punkten (CP). Ch. 4-5 Termodynamik C. Norberg, LTH IDEALA OCH REALA GASER En gas är ideal om inga krafter verkar mellan dess molekyler, utom då de kolliderar. Uppnås för alla gaser vid tillräckligt låga tryck (oberoende av temperatur). Gäller också med god noggrannhet vid tillräckligt hög temperatur, utom vid extremt höga tryck. IDEAL GAS: P v/(RT ) = 1 REAL GAS: P v/(RT ) = Z(P/Pcr, T /Tcr ) = Z(PR, TR) (Principen om korresponderande tillstånd) Ch. 4-6/7∗ Termodynamik C. Norberg, LTH ÄR VATTENÅNGA EN IDEAL GAS? Z= Pv , |Z − 1| < 1% → “IDEAL GAS” RT T -v–diagram för vatten; relativ avvikelse i procent från ideala gaslagen, 100×|vexakt−videal|/vexakt , videal = RT /P , R = 461.5 J kg−1K−1 . I markerat område är avvikelsen < 1%. Mättad vattenånga är en ideal gas upp till ca. 51 kPa (82◦C). Ch. 4-6/7∗ Termodynamik C. Norberg, LTH