Termodynamik F3
advertisement

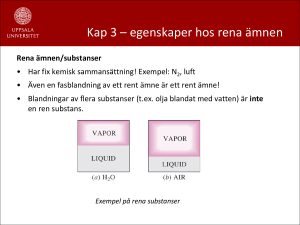
Termodynamik – Föreläsning 3 Rena Ämnens Egenskaper Jens Fjelstad 2010–09–07 1 / 26 Innehåll Rena ämnens egenskaper: faser, fasövergångar, tillståndsdiagram, tillståndstabeller • TFS 2:a upplagan (Çengel & Turner) ◦ 3.1–3.5 • TFS 3:e upplagan (Çengel, Turner & Cimbala) ◦ 4.1–4.5 • TD 6:e upplagan (Çengel & Boles) ◦ 3.1–3.5 2 / 26 Förra veckan • Grundbegrepp ◦ system; öppet, slutet, isolerat ◦ egenskap/tillståndsfunktion; T , P, E, V , m, ... ◦ tillstånd ◦ process; kvasistatisk process, kretsprocess • Temperatur T • Tryck P • Inre Energi U • Värme • Arbete; moving boundary work (PV–arbete) • Termodynamikens 1:a huvudsats (TD1) för slutna system ◦ ∆U = Q − W ◦ dU = δQ − δW ◦ ∆u = q − w ◦ du = δq − δw 3 / 26 Faser hos Rena/Enhetliga Ämnen • Rent/Enhetligt ämne: ämne med välbestämd och enhetlig kemisk sammansättning ◦ inkluderar t.ex. blandning av vatten i ångform och vätskeform ◦ inluderar ej blandning av luft i gas och vätskeform • Fas: tillstånd med karakteristiskt mått av ordning mellan molekyler (alt. karakteristisk bindning mellan molekyler) ◦ grafit & diamant: två olika (fasta) faser hos kol ◦ vattenånga, flytande vatten: två olika faser hos H2 O 4 / 26 Faser forts. styrkan hos intermolekylära krafter/“ordning” a) Fast fas (solid): atomer/molekyler på relativt fixa platser, inkompressibelt, fix form och storlek b) Flytande fas (liquid): molekyler starkt bundna till varandra, men inte i fixa relativa positioner, inkompressibelt, ej fix form c) Gas (ånga) (gas/vapor): molekyler svagt bundna, fri relativ rörelse, kompressibelt, varken fix form eller storlek 5 / 26 Fasomvandlingar Ex: vattenkokning vid konstant tryck 1 fas 1 fas värm −→ trycket P hålls konstant, specifika volymen v förändras (ökar) långsamt 6 / 26 vid trycket 1atm och temperaturen 20◦ C befinner sig vatten i flytande fas, och är inte nära att börja förångas vid trycket 1atm och temperaturen 100◦ C är vattnet fortfarande flytande, men på gränsen att börja förångas Underkyld vätska Compressed liquid Mättad vätska Saturated liquid värm −→ kokning vid konstant tryckt forts. 2 faser 1 fas värm värm −→ −→ tryck och temperatur förändras ej, all värme går åt till att omvandla vätska till gas, volymen ökar märkbart med mängden ånga en del av vätskan har förångats, en del är fortfarande flytande all vätska har förångats, ångan befinner sig på gränsen till att kondensera Mättad blandning Saturated liquid–vapor mixture Mättad ånga Saturated vapor 7 / 26 kokning vid konstant tryck forts. 1 fas värm −→ vid fortsatt värmning hålls trycket konstant, temperaturen ökar, och volymen ökar (snabbare än vid upphettning av vätska) hela systemet är fortfarande i gasfas (ånga), och är inte nära att kondensera Överhettad ånga Superheated vapor 8 / 26 värm −→ Kokning i Tillståndsdiagram (T–v) 1 fas • T –v diagram över kokning @ 1 atm, isobar • inverterad process: kondensation vid konstant tryck, Qkond = Qförångn 2 faser • Tsat (Tsat @1atm ): mättnadstemperatur @ 1atm (den temperatur vid vilken ämnet byter fas vid givet tryck) 1 fas • Psat (Psat @ T ): mättnadstryck vid T (det tryck vid vilket ämnet byter fas vid given temperatur) • isobarer vid P1 > 1atm, P2 < 1atm 9 / 26 Kokning i Tillståndsdiagram (T–v) 1 fas • T –v diagram över kokning @ 1 atm, isobar • inverterad process: kondensation vid Tsat 1 fas 2 faser konstant tryck, Qkond = Qförångn • Tsat (Tsat @1atm ): mättnadstemperatur @ 1atm (den temperatur vid vilken ämnet byter fas vid givet tryck) • Psat (Psat @ T ): mättnadstryck vid T (det tryck vid vilket ämnet byter fas vid given temperatur) • isobarer vid P1 > 1atm, P2 < 1atm 9 / 26 Kokning i Tillståndsdiagram (T–v) P1 • T –v diagram över kokning @ 1 atm, isobar P2 • inverterad process: kondensation vid konstant tryck, Qkond = Qförångn • Tsat (Tsat @1atm ): mättnadstemperatur @ 1atm (den temperatur vid vilken ämnet byter fas vid givet tryck) • Psat (Psat @ T ): mättnadstryck vid T (det tryck vid vilket ämnet byter fas vid given temperatur) • isobarer vid P1 > 1atm, P2 < 1atm 9 / 26 Mer om Tsat och Psat Mättnadskurva Psat = f (Tsat ) tryck och temperatur är inte oberoende egenskaper under en fasomvandling 1atm koka genom att sänka trycket 10 / 26 Latent Värme • Latent värme: mängden värme som absorberas eller frigörs vid en fullständig fasomvandling • Ångbildningsvärme (latent heat of vaporization): mängden värme som absorberas under en förångningsprocess, ekvivalent mängden värme som frigörs under en kondensationsprocess ◦ ångbildningsvärmet för vatten vid 1 atm: 2256,5kJ/kg • Smältvärme (latent heat of fusion): mängden värme som absorberas under en smältprocess, ekvivalent mängden värme som frigörs under en frysprocess (stelningsprocess) ◦ smältvärmet för vatten vid 1 atm: 333,7kJ/kg • Tryck– och temperaturberoende 11 / 26 Tillämpningar och Konsekvenser • Vakuumkylning & vakuumfrysning • Frystorkning (sublimering: fasövergång Fast→Gas) • ... Flytande Kväve • Tsat @1atm = −196◦ C • sluten testkammare nedsänkt i flytande kväve • kvävet i “termos” med liten öppning ut • all värme testkammaren absorberar från omgivningen går åt att förånga kväve, temperaturen är konstant Tsat 12 / 26 Tillståndsdiagram – Kritisk Punkt • Vid något tryck får isobaren en terasspunkt (inflektionspunkt): Kritiska punkten (critical point) • Ett tillstånd: Tcr , Pcr , vcr , ... • För vatten: ◦ Tcr = 373,95◦ C ◦ Pcr = 22,06MPa ◦ vcr = 0,003106m3 /kg • Ämnesspecifik egenskap • I kritiska punkten sammanfaller två faser (här: mättad vätska och mättad ånga) 13 / 26 Kritisk Punkt forts. • En kritisk punkt är förknippad med väldigt viktiga, speciella och intressanta fenomen • Stor del av forskningen i statistisk fysik (och därmed fasta tillståndets fysik, kemi, etc. etc) direkt relaterad till “kritiska fenomen” • Finns för många typer av fasövergångar, i många system • Vatten visar s.k. kritisk opalescence vid kritiska punkten • Filmklipp: kritisk opalescence i metanol–cyclohexan 14 / 26 Tillståndsdiagram – Tv forts. överhettad ånga underkyld vätska mättad blandning, tvåfasområde 15 / 26 Tillståndsdiagram – Pv överhettad ånga underkyld vätska mättad blandning, tvåfasområde 16 / 26 Tillståndsdiagram – Inklusive Fast Fas Pv–diagram: ämne som krymper vid stelning (frysning) • Trippellinje: serie tillstånd med 3 faser (fast, vätska, ånga) • • • • fix temperatur Ttp fixt tryck Ptp Trippelpunkt: Ttp , Ptp Vatten: Ttp = 0,01◦ C, Ptp = 0,6117kPa Pv–diagram: ämne som expanderar vid stelning (frysning) 17 / 26 Fasdiagram Sublimering: direkt övergång Fast → Gas Pressure krymper solid phase expanderar critical pressure Pcr Ptp compressible liquid liquid phase triple point gaseous phase I @ sublimering critical point superheated vapour deposition R @ supercritical fluid ex: kolsyreis i rumstemp. & atmosfärstryck Ttp critical temperature Tcr Temperature 18 / 26 Fasdiagram – Vatten många fasta faser! 19 / 26 P–v–T yta ämne som krymper vid frysning 20 / 26 P–v–T yta ämne som expanderar vid frysning Entalpi H • Entalpi: H=U+PV (kJ) • Specifik entalpi: h = u + Pv (kJ/kg) • Används ofta för öppna system 21 / 26 Termodynamiska Tabeller • Tillståndspostulatet: tillståndet fullständigt bestämt av två oberoende intensiva egenskaper • Via tabeller kan vi få värdet på alla egenskaper om vi känner värdet på två oberoende • Vissa egenskaper ej direkt mätbara • Resultat av mätningar och beräkningar • Finns i Appendix i boken (alla versioner och upplagor) ◦ vatten ◦ kylmedel 134a • Referenstillstånd vatten: mättad vätska vid T = 0,01◦ C ◦ u=s=0 • Referenstillstånd 134a: mättad vätska vid T = −40◦ C ◦ h=s=0 22 / 26 Mättad Ånga och Mättad Vätska • Temperaturtabell (Table A–4, A–11 i TFS3) • Trycktabell (Table A–5, A–12 i TFS3) yf : specifik egenskap y för mättad vätska yg : specifik egenskap y för mättad ånga yfg = yg − yf y = u, v , h, s hfg = hg − hf : förångningsentalpi = ångbildningsvärmet per massenhet för ämnet vid givet tryck och temperatur 23 / 26 Mättad Ånga och Mättad Vätska • Temperaturtabell (Table A–4, A–11 i TFS3) • Trycktabell (Table A–5, A–12 i TFS3) yf : specifik egenskap y för mättad vätska yg : specifik egenskap y för mättad ånga yfg = yg − yf y = u, v , h, s hfg = hg − hf : förångningsentalpi = ångbildningsvärmet per massenhet för ämnet vid givet tryck och temperatur TD1: ∆u = q − P∆v ⇒ q = ∆u + P∆v = ug − uf + P(vg − vf ) = (ug + Pvg ) − (uf + Pvf ) = hg − hf = hfg 23 / 26 Mättad Blandning • Ånghalt (Quality): x = många mtotal ◦ förhållandet mellan ångans massa och blandningens totala massa ◦ mtotal = många + mvätska ◦ 0 ≤ x ≤ 1, x = 0: vätska, x = 1: ånga ◦ en ny oberoende intensiv egenskap ◦ (T , x) eller (P, x) oberoende egenskaper för mättad blandning • Ångans resp. vätskans egenskaper är oförändrade av blandningen 24 / 26 Mättad Blandning många mtotal • Ångans resp. vätskans egenskaper är oförändrade av blandningen • Ånghalt (Quality): x = ◦ tvåfassystem behandlas för enkelhets skull som homogen blandning ◦ egenskaperna för blandningen är då viktade medelvärden yavg ◦ yavg = yf + x · yfg ◦ yf ≤ yavg ≤ yg ◦ y = v , u, h, s • Förenkling: vavg , uavg , havg , savg 7→ v , u, h, s 24 / 26 Mättad Blandning många mtotal • Ångans resp. vätskans egenskaper är oförändrade av blandningen • Ånghalt (Quality): x = ◦ tvåfassystem behandlas för enkelhets skull som homogen blandning ◦ egenskaperna för blandningen är då viktade medelvärden yavg ◦ yavg = yf + x · yfg ◦ yf ≤ yavg ≤ yg ◦ y = v , u, h, s v = vf + x · vfg u = uf + x · ufg h = hf + x · hfg s = sf + x · sfg ånghalten beräknas enligt x = 24 / 26 Överhettad Ånga Tabell A–6, A–13 i TFS3 Typiska egenskaper jämfört med mättad ånga: • lägre tryck vid given temperatur (P < Psat ) • högre temperatur vid givet tryck (T > Tsat ) • större specifik volym vid givet P el. T (v > vg ) • u > ug vid givet P el. T • h > hg vid givet P el. T 25 / 26 y −yf yfg Underkyld Vätska Tabell A–7 i TFS3 Typiska egenskaper jämfört med mättad ånga: • högre tryck vid given temperatur (P > Psat ) • lägre temperatur vid givet tryck (T < Tsat ) • mindre specifik volym vid givet P el. T (v < vg ) • u < ug vid givet P el. T • h < hg vid givet P el. T En underkyld vätska kan approximeras som mättad vätska vid samma temperatur y ≈ yf @T h ≈ hf @T + vf @T (P − Psat@T ) 26 / 26