Jonföreningar
advertisement

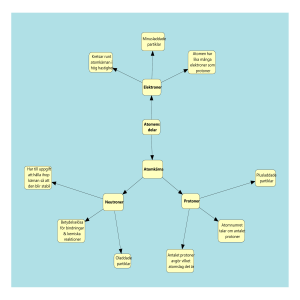
Jonföreningar Salter och metalloxider Kap 5 Laborationen vi gjorde • Vi tog två ämnen som var för sig är livsfarliga. • Saltsyra, HCl är en stark syra som är frätande • Natriumhydroxid, NaOH är en stark bas som också är frätande. Starka baser löser upp fett. Därför är natriumhydroxid särskilt farligt att få i ögonen. • Om man skulle dricka en koncentrerad lösning av något av dessa ämnen skulle det vara stor risk att man dog. Neutralisation • När vi genomför en neutralisation av saltsyra och natriumhydroxid uppstår nya ämnen som inte alls är farliga, snarare livsnödvändiga. • Vatten och salt • En förutsättning för att det ska bli en neutralisation är att vi har lika mycket av varje. • Saltsyra har pH 1 och natriumhydroxid har pH 14 • Alltså väldigt surt och väldigt basiskt • Men i rätt proportioner blir lösningen neutral, pH 7 Reaktionsformel • HCL + NaOH • Vi skriver först ämnena i jonform • H+ + CL- +Na+ + OH• H2O + NaCL • Använd reaktionspilar • HCL + NaOH H+ + CL- +Na+ + OH- H2O + NaCL • Ämnena som har bildats är vatten och salt Indunstning • Om vi låter den neutrala lösning stå några dagar kommer vattenmolekylen att dunsta bort. • Det som blir kvar är saltet • Vanligt bordssalt • Ett salt är en förening av två joner • En jonförening Många olika jonföreningar, salter • Många jonföreningar är vita. • De är fasta kristaller. • Men de kan ha många olika färger • Kopparsulfat är t.ex. blått • Många finns naturligt i marken. • Salter kan bildas på många olika sätt. • Natriumklorid, NaCL kan t.ex. bildas av natrium (metall) och klorgas Kristaller • Natriumklorid bildar kristaller. • Det är egentligen inte en molekyl. Snarare en formelenhet. • Ett mönster av lika många natriumjoner som hydroxidjoner. Namnge ett salt • Metaller bildar oftast en positiv jon. T.ex. Na+, Cu+ • Sätt den positiva jonen först och den negativa jonen sist. • Om den negativa jonen kommer från en atom får den ändelsen –id • Natriumklorid eller kopparklorid • Om den negativa jonen är en sammansatt jon , t.ex. SO42- får den istället ändelsen –at eller -it • T.ex. kopparsulfat eller nitrit Negativa joner • Saltsyra HCL • Svavelsyra H2SO4 • Salpetersyra HNO3 • Kolsyra H2CO3 CLSO42NO3CO32- kloridjon sulfatjon nitratjon karbonatjon Vad är det som håller ihop en jonförening • Natrium är ett grundämne med atomnummer 11 • I kärnan finns 11 positivt laddare protoner. Runt kärnan kretsar 11 negativt laddade elektroner. Den totala laddningen är 0 eller neutral, dvs oladdad. • En natriumjon har 11 protoner men har tappat en elektron dvs 10 e• Laddning blir positiv Na+ Klorjonen • Klor är också ett grundämne med atomnummer 17 • Dvs 17 protoner och 17 elektroner, total laddning = 0 • Klor saknar en elektron i sitt yttersta skal och tar gärna upp en elektron. • Då får den fler elektroner (18e-) än protoner (17p+), dvs laddningen blir negativ. När dessa möts • När Na+ och CL- möts uppstår en skillnad i laddning som håller ihop jonerna. Plus dras mot minus. Elektrostatiska krafter. Jonföreningar är starka • Jonföreningar hålls samman av elektriska krafter. • Det krävs höga temperaturer för att bryta en jonförening, • Natriumklorid smälter vid 801° C och kokar vid 1413 ° C • Men det går ganska lätt att lösa natriumklorid i vatten. • Vatten har en negativ och en positiv sida, dipol. • Vatten molekylen lägger sig mellan Na+ och Cl• De elektrostatiska krafterna bryts så att fria natriumjoner och kloridjoner bildas igen. Sid 354