Repetition av grundbegrepp för kursen i Kemi (TFKE16).
advertisement

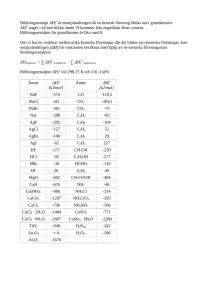
IFM-Kemi TFKE16 100802 Repetition av grundbegrepp för kursen i Kemi (TFKE16). (Motsvarar en del av gymnasieskolans A-kurs i kemi.) Grundbegrepp och stökiometri. Atomer består av kärna och elektroner. Kärnan, i sin tur, är uppbyggd av protoner med laddningen 1 elementarladdning (= 1,602176⋅10−19 As) och neutroner, som är neutrala. Kärnans laddningstal, som samtidigt är atomens atomnummer är detsamma som antalet protoner. Kärnans masstal är summan av antalet neutroner och protoner och uppgår till ca. masstalet gånger atomära massenheten u som är 1,66054⋅10−27 kg. (Skillnaden beror på relativistiska effekter av energiavgången när kärnan byggs upp av de enskilda nukleonerna.) Antalet elektroner i den neutrala atomen är det samma som antalet protoner i kärnan (atomnumret), och de har var och en laddningen 1 elementarladdning. Isotoper är atomer med samma atomnummer, men olika antal neutroner. De har samma kemiska egenskaper med god approximation i de flesta fall. Grundämnen är materia som består av endast ett slags atomer. De har alltså samma atomnummer, men kan dock innehålla mer än en isotop av grundämnet i fråga. Till exempel innehåller naturligt förekommande klorgas ungefär 25 % av isotopen 37 17 Cl och 35 75 % av isotopen 17 Cl . Deras genomsnittliga atommassa räknad i u blir då 35,45. Grundämnen anges med sina symboler enligt Berzelius system, som är första och ev. andra bokstaven i ämnets latinska namn. De ställs upp i bestämd ordning efter stigande atomnummer i det periodiska systemet. Den periodiska uppställningen uppkom genom observationen att vissa kemiska egenskaper återkom med regelbundna mellanrum. Detta beror på att ämnesegenskaperna beror av antalet elektroner ytterst i atomen, valenselektronerna, vilket kommer att gås igenom i kursen. Kemiska föreningar som inte är rena grundämnen består oftast av molekyler som är uppbyggda av kemiska bindningar mellan enskilda atomer av minst två grundämnen. Ett rent ämne innehåller bara ett slags molekyler. Molekyler med samma antal av och proportioner mellan de ingående grundämnena kan ha olika kemiska och fysikaliska egenskaper. De utgör två isomerer. Exempel är etanol C2H5OH och dimetyleter CH3OCH3. Kemiska formeln för ett ämne anger sammansättningen för en molekyl av ämnet. Ibland, när ämnet i fast fas består av stora aggregat som hålls samman av kemiska bindningar talar man om formelenheter av ämnet. Exempel är natriumkloridkristaller (NaCl) eller diamant (C). Formler där man bara vet relativa sammansättningen kallas ibland empirisk formel. För ättiksyra gäller sålunda att den empiriska formeln är CH2O, medan molekylformeln (kemiska formeln) är C2H4O2 eller CH3COOH. Den senare formeln ger förutom rätt sammansättning dessutom ett begrepp om hur molekylen är uppbyggd och kan därmed betecknas som en enkel strukturformel. 1 En jon är en atom eller en molekyl som har färre eller fler elektroner än vad som behövs för att neutralisera kärnladdningarna (= totala antalet protoner). En positiv jon kallas en katjon, en negativ för en anjon. I formeln skrivs laddningstalet följt av + resp. −, ex. Na+ eller SO42− för natriumjon resp. sulfatjon. Man säger eller skriver alltid –jon efter namnet på jonen. En mol av ett ämne är lika stor massa av ämnet i g som dess molekylmassa uttryckt i atommasseenheter, u. Det kan också uttryckas så att antalet formelenheter/molekyler är det samma som Avogadros tal (NA = 6,02214⋅1023 mol−1). Antalet mol = substansmängden av ämnet kan räknas ut enligt formeln: n= m M (1) där n = substansmängden, m = massan i g av ämnet och M = molmassan i g/mol. Kemiska reaktionsformler skrivs med de reagerande ämnena först, följda av en pil varpå kommer produkterna längst till höger. De skall, förutom att ange rätt ämnen eller joner, balanseras så att det finns lika många atomer av alla grundämnen på reaktantsidan som på produktsidan. Om joner förkommer skall summan av laddningarna på reaktantsidan vara densamma som på produktsidan. Jonladdningen anges med en siffra följd av laddningens tecken snett upp till höger om ämnessymbolen. Ex. 2 H2 + O2 → 2 H2O Ag+ + Cl− → AgCl I kemiska reaktioner som avstannar innan åtminstone något av de reagerande ämnena helt verkar ha försvunnit, s.k. jämviktsreaktioner, ersätts enkelpilen med en dubbelpil: HOOCCH3 + H2O ⇌ H3O+ + OOCCH3 − som visar hur ättiksyra står i jämvikt med vatten i vattenlösning (protolysjämvikt, mer härom sedan). Aggregationstillstånd anger om ämnet är fast flytande eller gasformigt. Detta sätts ofta ut i reaktionsformlerna inom parentes för att ange i vilket tillstånd de ingående reaktanterna och produkterna är. Fast fas behåller sin form därför att atomerna/molekylerna är starkt bundna till varandra med riktade krafter. Fasta ämnen blandar sig sällan eller löser sig i varandra. Många grundämnen har olika fasta faser, t.ex. kan kol förekomma både som grafit och diamant. I vätskor är de intermolekylära krafterna svagare och mindre riktade så de ändrar form efter det kärl de förvaras i, dock med konstant volym. Många vätskor är blandbara åtminstone inom vissa koncentrationsintervall. Gaser, slutligen har inga eller mycket obetydliga intermolekylära krafter och fyller ut de kärl som de förvaras i. De blandar sig också obehindrat. De olika aggregationstillstånden betecknas i kemiska formler (s) för fast fas, (l) för vätska och (g) för gas. En speciell beteckning gäller särskilt för ämnen eller joner i 2 vattenlösning, (aq). Exempelvis kan brom löst i vatten skrivas Br2(aq). De tidigare givna formlerna kan då förtydligas: 2 H2(g) + O2(g) → 2 H2O(l) Ag+(aq) + Cl−(aq) → AgCl(s) Fasövergångar eller fysiska förändringar av ett ämne innebär att det ändrar sitt aggregationstillstånd. Det sker vid en viss kombination av tryck och temperatur för varje ämne, och vid konstant tryck, t.ex. atmosfärstryck, är temperaturen konstant så länge båda faserna existerar. De vanligaste som kräver energitillförsel är: (s) → (l) smältning. Omvänt = stelnande, frysning. (l) → (g) förångning, kokning. Omvänt = kondensation. (s) → (g) sublimering. Omvänt = deposition. Förloppen åt vänster avger samma energi som upptas för dem som går åt höger. Koncentrationer av ämnen i lösningar eller blandningar kan anges på olika sätt. Det mest vanliga inom kemin, i varje fall i lösningar, är molaritet som anger antal mol av det lösta ämnet per liter lösning. Det får alltså dimensionen mol/L alternativt mol/dm3, vilket ofta tecknas M. Enheten är särskilt praktisk vid spädningsberäkningar och –förfaranden samt vid stökiometriska beräkningar (se nedan). Ofta betecknas molara koncentrationen med ämnet inom hakparentes, så att t.ex. [NaCl] betecknar NaCl-koncentrationen i mol/L. [X ] = nX V eller n X = V ⋅ [X ] (2) Molalitet är en koncentrationsenhet, som används mindre ofta, men som har viss relevans i termodynamiken. Den definieras som antalet mol löst ämne per kg lösningsmedel. Den betecknas ofta med b. bX = n X ⋅ 1000 mL där L betecknar lösningsmedlet och mL är massan av lösningsmedlet i g. För utspädda vattenlösningar kommer molala och molara koncentrationerna att närma sig varandra eftersom lösningens densitet är nära 1 kg/dm3 eller 1 kg/L. För starkare lösningar måste man känna till deras densitet för att kunna räkna om koncentrationer mellan molara och molala värden. Fördelen med molalitet är att den inte beror av temperaturen ens i exakta beräkningar. En annan koncentrationsenhet som används i gas- och vätskeblandningar är molbråk. Den anger den andel av den totala substansmängden i en blandning som utgörs av ett visst ämne: n (3) xA = N A ∑ nJ A 3 där xA är molbråket av ämne A, nJ är substansmängden av ämne J och summan löper över alla i blandningen ingående ämnen A till N. Molbråket är dimensionslöst. Ex. 1. Hur mycket koppar(II)sulfatpentahydrat, CuSO4⋅5H2O, skall man väga in för att tillreda 500 mL av en 0,400 M lösning? Lösning: Vi behöver n mol CuSO4⋅5H2O, vilket motsvarar m g CuSO4⋅5H2O. n = V⋅ [CuSO4] = 0,500 ⋅ 0,400 = 0,200 mol M = 63,5 + 32,1 + 4 ⋅ 16,0 + 5(2 ⋅ 1,01 + 2 ⋅ 16,0) = 249,7 g/mol m = n ⋅ M = 0,200 ⋅ 249,7 = 49,9 g SVAR: 49,9 g Man kan också ha sin utgångskemikalie i en koncentrerad lösning som skall spädas till önskad koncentration. Då är den molara koncentrationen praktisk. Ex. 2. Koncentrerad svavelsyra är ca. 38 vikts-% HCl i vatten och en sådan lösning har densiteten 1,19 g/cm3. a) Vilken är lösningens molara koncentration? b) Hur mycket av denna lösning skall man ta och späda med vatten för att få 1,00 L av en 0,5 M lösning? Lösning: a) Betrakta 100 g av den koncentrerade syran. Den innehåller 38 g HCl. m 38 n HCl = HCl = = 1,04 mol HCl M HCl 36,46 m syra 100 V syra = = = 84,0 cm3 = 0,084 L d syra 1,19 [HCl] = nHCl 1,04 = 12,4 M V syra 0,084 b) Antalet mol HCl skall vara samma före och efter spädningen, dvs. = [HCl]syra ⋅ Vsyra = [HCl]lösn ⋅ Vlösn V syra = [HCl]lösn ⋅ Vlösn [HCl]syra = 0,50 ⋅ 1000 = 40,3 mL 12,4 SVAR: a) 12 M b) 40 mL 4 Stökiometri innebär att man räknar ut hur mycket av olika reagerande ämnen man (minst) behöver blanda ihop för att få en önskvärd mängd av någon produkt. Man följer en beräkningsgång enligt nedanstående: Känd massa → substansmängd ⇔ substansmängd → Massa av sökt ämne av utgångsämnet av sökt ämne ur detta ämnes ur molmassan ur reaktionsformeln molmassa Förfaringssättet visas med ett exempel: Ex. 3. Hur hur stor mängd (massa) krom kan framställas ur 19 kg dikromtrioxid (eller krom(III)oxid) och aluminium i överskott enligt följande formel (termitsyntes)? 2 Al + Cr2O3 → Al2O3 + 2 Cr Beräkna också hur mycket aluminium som minst förbrukas. Lösning: M(Cr2O3) = 2 ⋅ 52,0 + 3 ⋅ 16,0 = 152 g/mol; M(Cr) = 52,0 g/mol; M(Al) = 27,0 g/mol 2 mol Al ⇔ 1 mol Cr2O3 ⇔ 2 mol Cr 19000 = 125 mol. Då blir n(Cr) = 250 och 152 m(Cr) = 250 ⋅ 52,0 = 13000 g = 13 kg Cr. n(Cr2O3) = Det kommer att förbrukas 2 ⋅ 125 ⋅ 27,0 = 6750 g = 6,8 kg Al. Ibland framställer man önskade kemikalier genom utfällningsreaktioner ur lösningar genom att låta två joner från lättlösliga salter bilda en fällning av ett svårlösligt salt som då bildar en fast fas på kärlets botten. Exempel 4. Man vill framställa kalciumfluorid (CaF2) genom att blanda ihop en 0,1 M lösning av natriumfluorid (NaF) med en 0,2 M lösning av kalciumnitrat (Ca(NO3)2) . Hur stora volymer av vardera lösningen måste man ta för att få 500 g CaF2? Vi antar att CaF2 är ett så svårlösligt salt att man kan bortse från den mängd som stannar kvar i lösningen. Lösning: Ca2+(aq) + 2 F−(aq) → CaF2(s) 5 1 mol Ca2+(aq) ⇔ 2 mol F−(aq) ⇔ 1 mol CaF2(s) M(CaF2) = 40,1 + 2 ⋅ 19,0 = 78,1 g/mol; n(CaF2) = 500 = 6,40 mol 78,1 6,40 = 32,0 L Ca(NO3)2-lösning. 0,200 6,40 ⋅ 2 Det behövs också 2 ⋅ 6,40 mol F−(aq) vilket motsvarar = 128 L NaF-lösning. 0,100 Då behövs 6,40 mol Ca2+(aq) vilket motsvarar I ovanstående exempel han det förutsatts att de båda reagerande ämnena har blandats ihop i stökiometriska mängder, d.v.s. förhållandena mellan substansmängderna motsvarar reaktionsformeln. I andra fall blandar man till reagensen så att något ämne blir i överskott, t.ex. därför att man har brist på det andra ämnet. Nedanstående exempel visar hur man kan behandla ett sådant fall. Ex. 5. Man löser 10 g kalciumklorid (CaCl2) och 20 g silvernitrat (AgNO3) var för sig i vatten. När man blandar ihop dessa lösningar kommer svårlösligt silverklorid att falla ut. Hur mycket väger silverkloriden? Lösning: Här är det lämpligt att skriva ut hela formeln för de reagerande salterna, eftersom vi behöver molmassorna för hela salternas formelenheter. CaCl2(aq) 1 mol m(g) + → 2 Ag NO3(aq) ⇔ ⇔ 2 mol 10 g 2 AgCl(s) 2 mol 20 g 16,9 M (g/mol) 111,1 170,0 143,5 n (mol) 0,118* 0,118* 0,090* + ⇔ Ca(NO3)2(aq) 1 mol * Eftersom 0,118/2 < 0,090 är det silvernitrat som är i underskott och därmed kan inte mer än 0,118 mol silverklorid bildas. Massan av denna fås sedan genom att multiplicera med molmassan för AgCl. SVAR: 17 g silverklorid bildas. 6 Gaslagar. Vi räknar i denna kurs endast med ideala (perfekta) gaser som antas följa den ”allmänna” gaslagen: p⋅ V = n⋅ R ⋅ T där p är trycket, V är volymen, n är substansmängden gas, R är allmänna gaskonstanten och t är temperaturen, uttryckt i Kelvin. Värdet på R beror på vilka enheter som används och olika siffervärden finns i exempelsamlingen och i formelsamlingen. För komponenter i gasblandningar gäller att summan av partialtrycken är lika med totaltrycket och för partialtrycket för varje komponent gäller p J = x J ⋅ p tot där pJ är partialtrycket resp. molbråket för komponenten J och ptot är totaltrycket. Som framgår av allmänna gaslagen är volymen av en gas beroende av tryck och temperatur. För att ha jämförbara värden anges ofta volymer vid STP (äldre beteckning NTP, 0 oC, 1 atm) eller modernare SATP (= standard ambient temperature and pressure = 25 oC, 1 bar). Det är lätt att övertyga sig om att volymen av en mol (molvolymen) för en gas blir 22,414 L/mol resp. 24,789 L/mol. För tryckenheter gäller att 1 atm = 1,01325 bar = 760 torr och att 1 bar = 105 Pa. 1 Pa = 1 N/m2. Jämviktslära. Som nämnts tidigare finns det reaktioner som avstannar utan att något av de reagerande ämnena helt förbrukats. Dessa reaktioner kallas förenklat för jämviktsreaktioner eller ”reaktioner som går till jämvikt”. För en sådan reaktion a⋅A + b⋅B ⇌ c⋅C + d⋅D gäller massverkans lag för de ingående ämnenas koncentrationer, tryck m.m. [A]a ⋅ [B]b [C]c ⋅ [D]d = Kc där Kc är jämviktskonstanten med avseende på koncentration (oftast i molara enheter). För gasreaktioner ersätts molara koncentrationen med gasens partialtryck uttryckta bar (i äldre litteratur i atm). Om fasta ämnen eller rena vätskor ingår i reaktionsformeln sätter man in en etta. De jämviktsreaktioner som blir aktuella i denna kurs är gasjämvikter, syra-basjämvikter och löslighetsjämvikter. 7 Syror och baser. Vi begränsar oss här till syrabegreppet enligt Brønsted: Ett ämne som kan avge vätejoner (protoner) är en syra. Motsvarande definition på en bas blir då ett ämne som kan ta upp vätejoner. Vid upplösning av en syra i vatten sker alltså följande, helt eller delvis (protolys av syran): HA(aq) + H2O(l) ⇄ H3O+(aq) + A −(aq) Om reaktionen går fullständigt åt höger har vi en stark syra, om bara en bråkdel reagerar är syran svag. Jämviktsekvationen blir: [H O ]⋅ [A ] = K + 3 - [HA] a där Ka är den s.k. syrakonstanten. Vissa syror är flerprotoniga, t.ex. svavelsyra (A = SO4), så att man har två eller flera successiva jämvikter: H2A(aq) + H2O(l) ⇄ H3O+(aq) + HA−(aq) HA−(aq) + H2O(l) ⇄ H3O+(aq) + A2−(aq) I exemplet med svavelsyra är den första jämvikten helt förskjuten åt höger, så svavelsyra är en stark syra. Den andra jämvikten är dock en jämviktsreaktion så att vätesulfatjonen är en svag syra. För en bas (enligt Brønsted) gäller vid upplösning i vatten: B(aq) + H2O(l) ⇄ HB+(aq) + OH−(aq) och baskonstanten definieras ur denna jämvikt: [HB ]⋅ [OH ] = K + [B] - b Ett exempel på en svag bas är ammoniak: NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH−(aq) där baskonstanten är ca. 2⋅10−5. Motsvarande syra blir ammoniumjonen, NH4+. Vatten kommer alltså att spela basens roll vid upplösningen av en syra och syrans roll vid upplösning av en bas. Vatten dissocierar till liten del av sig själv: 2 H2O(l) ⇄H3O+(aq) + OH−(aq) 8 med jämviktskonstanten Kw, som kallas vattnets jonprodukt: [H3O+]⋅[OH−] = Kw Vid rumstemperatur räknar man oftast med ett värde på Kw = 10−14, dvs. i rent vatten är [H3O+] = [OH−] = 10−7. Den anjon som vi fick vid upplösningen av den svaga syran HA i början uppträder som en bas om man löser upp saltet NaA i vatten: A−(aq) + H2O(l) ⇄ HA(aq) + OH−(aq) Baskonstanten blir [HA ]⋅ [OH - ] = K [A ] - b Det är nu lätt att se att produkten av syra- och baskonstanterna blir detsamma som vattnets jonprodukt: Ka ⋅ Kb =Kw Detta är ett exempel på ett syra-baspar, HA - A−. Vid en syras protolys har vi i själva verket två syra-baspar: HA + H2O ⇄ H3O+ + A− syra 1 bas 2 syra 2 bas 1 Samma resonemang gäller för en basprotolys. Molekyler eller joner som kan uppträda både som syror och baser, kallas amfolyter. Exempel vi mött är vatten (H3O+ - H2O OH−) eller jonen HA− i den tvåprotoniga syran (H2A - HA− - A2−). Vätejonkoncentrationen i vattenlösningar anges ofta i pH-enheter. Den exakta definitionen är numera operationell, men för våra krav räcker det med att sätta pH = - 10log[H3O+] I en 0,001 M lösning av saltsyra är då pH = 3 och i absolut rent vatten, fritt från koldioxid är pH = 7. p-operatorn används mycket i kemin, sålunda kan man använda pKa-värden vilket innebär att om en syrakonstant är 4⋅10−5 är pKa = 4,4. Vi får också följande samband: pH + p(OH) = pKw = 14 9 och pKa + pKb = pKw = 14 Energi i kemiska reaktioner. Kemiska reaktioner sker under avgivande eller upptagande av energi. I det förra fallet är reaktionen exoterm i det senare är den endoterm. Den energiskillnad man får när reaktionen sker vid konstant tryck motsvarar skillnaden i entalpi mellan produkter och reaktanter (∆Hr) för reaktionen. För en exoterm reaktion är sålunda ∆Hr < 0 medan för en endoterm reaktion är sålunda ∆Hr > 0. Entalpiförändringen med omvänt tecken motsvarar den värmemängd som avgår vid konstant tryck ner den kemiska reaktionen sker. Ex. Vid förbränning av kol i syrgas till koldioxid frigörs 394 kJ/mol C: C(s, grafit) + O2(g) → CO2(g) ∆Hr1 = − 394 kJ/mol (1) När en mol av en kemisk förening bildas ur sina grundämnen i deras stabila faser vid trycket en bar och vid någon given temperatur (ofta 25 oC) blir entalpiförändringen vid den reaktionen det samma som standardbildningsentalpin för det ämnet. Reaktionen (1) ovan är alltså standardbildningsentalpin för koldioxid. Kol kan förbrännas stegvis: C(s, grafit) + ½ O2(g) → CO(g) ∆Hr2 = − 110 kJ/mol (2) CO(g) + ½ O2(g) → CO2(g) ∆Hr3 = − 284 kJ/mol (3) Vi kan här konstatera att summan av reaktion (2) och (3) blir reaktion (1). Enligt Hess´ lag skall det då gälla att ∆Hr1 = ∆Hr2 + ∆Hr3 , vilket ju också är fallet. Hess lag kan formuleras så att entalpiförändringen för en summareaktion är summan av entalpiförändringarna för delreaktionerna. Den är en följd av termodynamikens första huvudsats som säger att energi varken kan nyskapas eller försvinna, den bara ändrar form, i detta fall mellan kemisk energi och värme. Vissa kemiska reaktioner sker spontant under upptagande av energi, t.ex. upplösning av vissa salter. Detta utesluter att den avgörande drivkraften för att en kemisk reaktion skall ske är att energi (värme) skall frigöras. Det som avgör spontaniteten hos en kemisk reaktion enligt termodynamikens andra huvudsats är i stället hur slumpmässigheten eller oordningen hos tillståndet ändras från före till efter reaktionen. Ju fler sätt ett tillstånd kan realiseras på ju större är slumpmässigheten och ju större sannolikhet har det tillståndet. Man säger att den totala entropin (S) hos systemet och omgivningen ökar för en spontan reaktion. Detta sammanfattas med en storhet som kallas fria energin och denna skall minska för en spontan process. ∆G = ∆H − ∆S och ∆G < 0 för en spontan process. H och S gäller här för systemet enbart, Omgivningens entropi ökas av det värme som avges vid reaktionen (= −∆H). 10