Laboration 3
advertisement

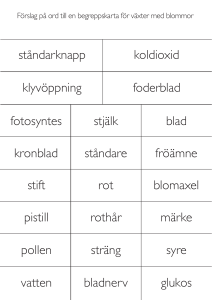
Laboration 3 1 Organisk kemi - modeller och begreppskarta. Följande molekyler är byggda: Propan Propen Propyn 1-propanol 2-propanol 2-metyl-2-propanol Propanal Propanon Propansyra Etylpropanoat Placera dem på rätt ställe på det stora arket! Skriv in molekylernas strukturformel och ämnesklasser på din egen begreppskarta. På begreppskartan finns det pilar mellan ämnesklasserna. Dessa pilar visar möjliga reaktionsvägar mellan de olika ämnesklasserna. De olika reaktionerna som kan tänkas ske är beskrivna nedan. Bestäm vilken typ av reaktion som sker mellan ämnesklasserna (i pilens riktning). Rita på pilarna i din egen begreppskarta vad som kommer till eller "försvinner". Skriv också vilken typ av reaktion som sker. Observera att 2-metyl-2-propanol inte kan bildas av propen. Vilken utgångssubstans skulle behövas för att få just denna alkohol. a) b) c) d) e) f) g) Kemiska reaktionstyper: (Organisk) reduktion: reaktion som antingen ökar antalet väteatomer på molekylen eller minskar antalet syreatomer. (Organisk) oxidation: reaktion som antingen minskar antalet väteatomer på molekylen eller ökar antalet syreatomer. Substitutionsreaktion: en atom eller atomgrupp byts ut mot en annan atom eller atomgrupp. Additionsreaktion: en molekyl adderas till en dubbel-eller trippelbindning. Eliminationsreaktion: två atomer eller atomgrupper tas bort under bildning av en dubbel-eller trippelbindning. Kondensationsreaktion: två eller flera molekyler kopplas samman samtidigt som det avspjälkas en liten molekyl, t ex. vatten. Polymerisationsreaktion: flera små molekyler med dubbelbindning eller trippelbindning kopplas samman utan att det avspjälkas någon molekyl. Dubbelbindningarna övergår i enkelbindningar och trippelbindningarna i dubbelbindningar. 2 Analys Du har fem vita föreningar i burkar markerade 1 - 5. Burkarna innehåller natriumklorid, natriumvätekarbonat, kalciumklorid, glukos eller stärkelse. Gör lämpliga försök för att komma underfund med i vilka burkar de olika föreningarna finns. Beskriv dina tankar. 3 Maillardreaktioner Blanda en sked glukos och en sked glycin i en liten bägare. Rör om och upphetta försiktigt. Iaktta färgförändringar och doft. Beskriv varför denna typ av reaktion är viktig. Vad krävs för att en Maillardreaktion ska ske? 4 Kinetik Ställ en 8 brunnars remsa ovanpå ovanstående två streck och numrera brunnarna direkt på pappret från 1 till 8. (Du kan också rita två streck på ett annat papper och använda det.) Fyll i lösningar enligt tabellen nedan. Brunn 0,15M Na2S2O3 H2O 1 2 3 4 5 6 7 8 10 droppar 9 8 7 6 5 4 3 0 droppar 1 2 3 4 5 6 7 Tag en annan 8 brunnars remsa och droppa i 2 droppar 0,1 M HCl i varje brunn. Tag den första remsan i handen och vänd den andra remsan upp och ner ovanpå den. Ställ remsorna på pappret så att linjerna syns genom brunnarna. Notera och skriv ner tiden för varje brunn då strecken försvinner, sett uppifrån. När försöket är färdigt diskas brunnarna och ”skrubbas” med Topz. Presentera resultatet med en graf som visar tiden för avfärgningen som funktion av koncentrationen tiosulfat. Försök också med erhållna data få fram en linjär funktion och skriv en formel som visar sambandet mellan koncentrationen av tiosulfat och tiden för avfärgningen. 5 Diffusion i 2-D Gasformiga ämnen sprider sig så fort de kommer i frihet. Den lättaste gaspartikeln, vätgasmolekylen rör sig vid rumstemperatur med en hastighet av en mile (ca 1600 m) per sekund. Gasen som sådan sprider sig inte så snabbt eftersom partikelkollisioner får gaspartiklarna att ständigt ändra riktning, Brownsk rörelse. I medel sker en kollision för varje sträcka motsvarande 200 atomradier. I denna laboration ska du bland annat undersöka vad som bestämmer olika gasers diffusionshastigheter. De gaser vi ska jämföra är klorgas och ammoniak samt saltsyra och ammoniak. a) Sätt en droppe fenolftalein och en droppe kaliumjodid på var och en av rutorna på plastfolien utom de som är markerade A och B. Placera ett plastlock över folien så att dropparna innesluts. Sätt tre droppar klorin (natriumhypoklorit) till rutan markerad A. Sätt därefter samtidigt till en droppe koncentrerad saltsyra till rutan, markerad A och en droppe koncentrerad ammoniak till rutan, markerad B. Notera tiden. Studera vad som händer under fem minuter och förklara resultatet. a) Gör, på motsvarande sätt, ett experiment för att ta reda på vilken av gaserna väteklorid eller ammoniak som diffunderar snabbast! Vad ska finnas i dropparna? Studera vad som händer under fem minuter och förklara resultatet.