Pargitan mite 2 mg tablet
advertisement

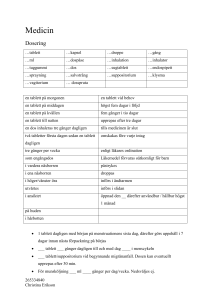
Läkemedelsverket 2013-08-13 PRODUKTRESUMÉ 1 LÄKEMEDLETS NAMN Pargitan mite 2 mg tablett 2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING 1 tablett innehåller: Trihexyfenidylhydroklorid 2 mg Hjälpämne: Laktosmonohydrat 42 mg För fullständig förteckning över hjälpämnen se avsnitt 6.1 3 LÄKEMEDELSFORM Tablett Vita, plana tabletter med skåra, diameter 6 mm. 4 KLINISKA UPPGIFTER 4.1 Terapeutiska indikationer Parkinsonism (arteriosklerotisk, postencefalitisk och idiopatisk). Neuroleptikainducerad parkinsonism. Spastiska tillstånd hos barn. 4.2 Dosering och administreringssätt Doseringen bör vara individuell. Lämplig begynnelsedos är 1 tablett per dag, därefter gradvis ökning till 7-10 tabletter per dag. I vissa fall kan dock dosen behöva ökas ytterligare. Om biverkningar uppträder, minskas dosen till den högsta dos som tolereras. Vid spastiska tillstånd hos barn bör initialdosen vara ¼ tablett Pargitan mite per dag, därefter gradvis ökning upp till en slutdos av en ¼ tablett Pargitan mite 6 gånger dagligen eller ½ tablett 4 gånger dagligen. Om biverkningar uppträder, minskas dosen till den högsta dos som tolereras. Vid omställning från andra preparat mot parkinsonism ökas doseringen av Pargitan mite gradvis, samtidigt som doseringen av det andra preparatet gradvis minskas. Då lämplig dos uppnåtts, inträder bättring snabbt och ytterligare förbättring erhålls i regel icke genom att dosen ökas. Äldre: Försiktig dosering rekommenderas vid behandling av äldre patienter. Lägsta möjliga dos ska eftersträvas. Äldre patienter är mer känsliga för antikolinergika. Vid behov kan Pargitan mite även kombineras med andra preparat mot parkinsonism. Läkemedelsverket 2013-08-13 4.3 Kontraindikationer Överkänslighet mot det aktiva innehållsämnet eller mot något hjälpämne. Tardiv dyskinesi. 4.4 Varningar och försiktighetsmått Attack av akut glaukom, orsakad av pupillutvidgning kan utlösas hos en person med grund främre kammare och trång kammarvinkel. Detta tillstånd är dock ovanligt. Äldre: Behandling av äldre patienter bör ske med försiktighet. Effekt och behov av behandling bör utvärderas kontinuerligt. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda tabletterna eftersom de innehåller laktos: galaktosintolerans, total laktasbrist eller glukosgalaktosmalabsorption. 4.5 Interaktioner med andra läkemedel och övriga interaktioner Vid samtidig administrering av klorpromazin misstänks trihexyfenidyl kunna minska absorptionen av klorpromazin. 4.6 Graviditet och amning Graviditet Klinisk erfarenhet från gravida kvinnor är begränsad. Djurexperimentella data talar inte för ökad risk för fosterskada. Amning Uppgift saknas om trihexyfenidyl passerar över i modersmjölk. 4.7 Effekter på förmågan att framföra fordon och använda maskiner Inga effekter har noterats. 4.8 Biverkningar För detta preparat finns inte modern klinisk dokumentation som kan tjäna som underlag för bedömningen av biverkningsfrekvensen. Biverkningarna av trihexyfenidyl är farmakologiskt betingade och därmed i stor utsträckning dosberoende. Vanliga (≥1/100, <1/10) Mindre vanliga (≥1/1 000, <1/100) Ögon: Synstörningar. Magtarmkanalen: Muntorrhet. Hjärtat: Takykardi. Ögon: Minskat tårflöde. Magtarmkanalen: Illamående, obstipation, torrhet i svalget. Njurar och urinvägar: Urinretention. Allmänna symtom: Matthet. Psykiska störningar: Förvirringstillstånd. Risk för psykiska biverkningar (i form av förvirringstillstånd) föreligger främst hos äldre patienter, speciellt med begynnande eller manifest demens. Försiktighet bör därför iakttas vid Läkemedelsverket 2013-08-13 behandling av denna patientgrupp. Torrhet i ögonen kan medföra besvär för kontaktlinsbärare. Vid längre tids bruk kan muntorrhet medföra risk för tand- och munslemhinneskador. Biverkningarna försvinner då dosen minskas eller behandlingen avbryts. 4.9 Överdosering Toxicitet 42-300 mg till vuxna gav måttlig intoxikation. Symtom Dåsighet, förvirring, ataxi, yrsel, torrhet i munnen, illamående, kräkningar, mydriasis, dimsyn. Ibland orostillstånd, hallucinationer. Vid massiv intoxikation kramper, andningsdepression. Behandling Om befogat ventrikeltömning, kol. Vid hallucinationer, uttalad excitation och delirium kan fysostigmin prövas. Diazepam vid oro och kramper. Syrgas, eventuellt assisterad andning. Mörkt och tyst rum. Symtomatisk behandling. 5 FARMAKOLOGISKA EGENSKAPER 5.1 Farmakodynamiska egenskaper Farmakoterapeutisk grupp: Medel mot parkinsonism, ATC-kod: N04AA01 Det farmakologiska verkningsområdet sammanfaller i stort sett med atropinets. Den spasmolytiska effekten är ca hälften så stor. Långvarig tillförsel av Pargitan mite inverkar enligt djurförsök inte på blodtrycks- och andningscentra, lever, njurar eller benmärg. 5.2 Farmakokinetiska uppgifter Formella farmakokinetiska studier har inte utförts. 5.3 Prekliniska säkerhetsuppgifter Det finns inga prekliniska data av relevans för säkerhetsbedömningen utöver vad som redan har beaktats i produktresumén. 6 FARMACEUTISKA UPPGIFTER 6.1 Förteckning över hjälpämnen 1 tablett innehåller: Laktosmonohydrat 42 mg, mikrokristallin cellulosa, magnesiumstearat och vattenfri kolloidal kiseldioxid. 6.2 Inkompatibiliteter Ej relevant. 6.3 Hållbarhet 3 år. Vid maskinell dosdispensering är hållbarheten 2 månader. Läkemedelsverket 2013-08-13 6.4 Särskilda förvaringsanvisningar Inga särskilda förvaringsanvisningar. 6.5 Förpackningstyp och innehåll Plastburk 100 st 6.6 Anvisningar för användning och hantering samt destruktion Inga särskilda anvisningar. Ej använt läkemedel och avfall skall hanteras enligt gällande anvisningar. 7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING Leyh Pharma GmbH Im Baierstal 6 98596 Trusetal Tyskland 8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING 4107 9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE 1953-01-02/2009-01-01 10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN 2013-08-13