Utbyte av sällsynta koder i DNA kan ge bättre
advertisement

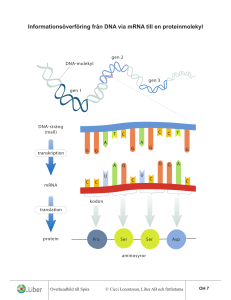
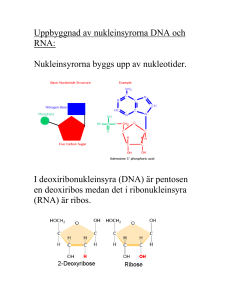
Edvard Rask Utbyte av sällsynta koder i DNA kan ge bättre proteinproduktion Arkeaer är ett släkte av organismer som delvis är besläktade med bakterierna och delvis med de högre eukaryota organismerna. Inom detta släkte finns majoriteten av de organismer som kan leva under extrema temperaturer, de s.k. hypertermofila organismerna. Detta arbete har inriktats på att förbättra produktionen av ett värmetåligt enzym från den hypertermofila arkean Archaeoglobus fulgidus. Enzymet som kallas för cylodextrin glukanotransferas (CGTas) har förmågan att modifiera amylos (en av beståndsdelarna i kolhydraten stärkelse) på ett antal olika sätt. Bland annat har enzymet förmågan att glykosylera, dvs. sätta på sockergrupper på, många olikartade molekyler. Liknande varianter av detta enzym finns även hos andra mikroorganismer. Fördelen med CGTaset från A. fulgidus (AfCGTas) är att det är aktivt och stabilt även vid 90 °C. Vid denna höga temperatur kan reaktionshastigheten ökas samtidigt som andelen biprodukter minskar. Man studerar nu AfCGTaset för att försöka förbättra det ytterligare med avseende på bl.a. reaktionsspecificitet. Många av de analysmetoder som behövs för att studera AfCGTaset kräver stora kvantiteter av enzym för att fungera. I detta arbete vill vi därför få större mängder av enzymet genom att modifiera dess gen till att bättre passa in i den Escherichia coli stam som vi använder för att producera enzymet i. Man använder E. coli eftersom man med denna bakterie kan kontrollera produktionen av CGTas på ett bra sätt. Men trots detta lyckas man inte få en hög produktion av enzymet. Arvsmassan (dvs. DNA:t) består av koder som, via mellansteget av en mRNA molekyl, kodar för aminosyrorna i det färdiga enzymet. Den dåliga produktionen tros bero på att koderna i DNA:t inte används i samma utsträckning i E. coli jämfört med i A. fulgidus. Jag har därför, med hjälp av mutationer, ändrat specifika koder i början av DNA:t till koder som fortfarande kodar för samma aminosyror, fast som gör detta i en högre takt. Resultaten ger viss antydan på att produktionen av enzymet kan ha ökat efter mutationerna. Det ser däremot ut som att de ändrade baserna samtidigt ändrar strukturen av mRNA:t (dvs. den molekyl som för information mellan DNA:t och det färdiga proteinet) och gör det mer ostabilt. Detta gör i sin tur att mRNA:t snabbare faller sönder och det kan därför inte användas lika länge för att producera vårt enzym. Handledare: Eva Nordberg-Karlsson, Catherine J. Paul Examensarbete, 30 hp i Biokemi, 2009 Avdelningen för Bioteknik, LTH, Lunds universitet Edvard Rask Exchanging rare codons in the 5’-end of the Archaeoglobus fulgidus cyclodextrin glucanotransferase gene affects protein expression in Escherichia coli Cyclodextrin glucanotransferase (CGTase) is used for catalytic production of cyclodextrins and various glycosylated products. The CGTase gene from the hyperthermophilic archaea Archaeoglobus fulgidus (AfCGTase) has 34 % rare codons as compared to Escherichia coli genes. As an attempt to increase expression in E. coli, AfCGTase was analyzed after changing rare codons in the beginning of the gene into preferred E. coli codons. Site directed mutagenesis with three primer pairs was used to exchange a maximum of seven codons in constructs where either each single primer, the two primers nearest the 5’-end or all three primers had been used for mutagenesis. These constructs were expressed in BL21(DE3) and three derivative strains carrying genes for rare codon tRNA:s and/or deletions in the RNaseE gene (leading to increased RNA-stability). SDS-PAGE and a starch hydrolyzing enzyme activity assay showed that expression levels were lowered for the mutants in BL21(DE3) and the tRNA compensating strain. As suggested by activity analysis, expression levels might have been increased in mutated compared to wild-type CGTases in the strains containing the RNaseE deletion. The results indicate that secondary structural changes might destabilize the mutant mRNA:s, leading to decreased expression levels, if RNaseE is active. The higher expression levels seen for the mutants in the RNaseE deletion strains further underscores the importance of mRNA secondary structure and stability in recombinant expression. Further results indicate inclusion body formation upon the high expression aided by the compensating tRNA:s. Also mistranslational events in the form of N-terminal truncations were observed. This might have been possible if secondary structural changes exposed the Shine-Dalgarno-like sequence present eight base pairs upstream to an AUG-codon within the coding region of mRNA. Supervisors: Eva Nordberg-Karlsson, Catherine J. Paul Master Thesis project, 30 credits in Biochemistry, 2009 Department of Biotechnology, LTH, Lund University