Kemiska hävningsmedel
advertisement

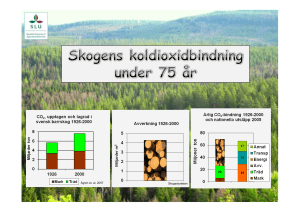
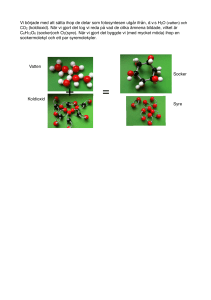
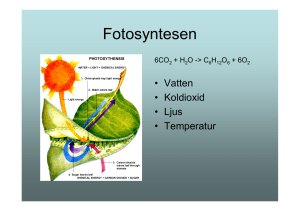
Kemiska hävningsmedel Introduktion: Vid bakning används ofta olika former av så kallade hävningsmedel(eller jäsmedel) för att göra bakverket poröst och ge det volym. Det finns tre typer av kemiska jäsmedel: bikarbonat(NaHCO3), hjorthornssalt(NH4HCO3) och bakpulver. Jäst som är en jästsvamp är ett biologiskt hävningsmedel. Bakpulver är en blandning av bikarbonat, någon syra och något ämne som motstånd för fukt. Vid kontakt med vätska reagerar bikarbonaten med syran och koldioxid bildas. Detta ger då jäseffekten. Bakpulver blandas i mjölet, så snart du har tillsatt degspadet och blandat ordentligt bör degen in i den förvärmda ugnen. Bikarbonat är ett kemiskt jäsmedel som framställs ur koksalt och koldioxid på kemisk väg. Bikarbonaten reagerar med en syra som frigör koldioxid då uppstår jäskraften. Därför fungerar bikarbonat bäst tillsammans med någon syrlig ingrediens som till exempel yoghurt eller filmjölk. Det finns även hjorthornssalt som används för sprödare konsistens i småkakor och kubbar. Denna laboration vill försöka visa på vid vilket tillfälle man skall ha vilket hävningsmedel. Material: En våg, tre provrör, ett mätglas(25 ml)ett provrörsställ, en tesked, en pipett, linser, bikarbonat, hjorthornssalt, bakpulver, ättika Utförande, del 1: 1. 2. 3. Fyll tre provrör med 17 ml vatten i vardera provrör Tillsätts en lins i varje rör. Tillsätt 4 g av bikarbonat, hjorthornssalt, och bakpulver i vardera provrör Studera gasutvecklingen med hjälp av linserna. Hypotes: Resultat: Utförande, del 2: 1. 2. 3. 4. Skölj av provrören. Tillsätt 4g av bikarbonat och hjorthornssalt i varsitt torrt provrör Droppa några droppar ättika i provrören Skölj av allt noga. Häng mätglasen upp och ned på väggstället, ställ provrören i ett provrörställ på diskbänken. Vågarna kan få stå kvar till nästa grupp. Hypotes: Resultat: Slutsatser av försök 1 och 2: De kemiska reaktionerna vid hävningen Bikarbonat, dvs natriumvätekarbonat (NaHCO3), framställs genom att man leder ner koldioxid (CO2) i en kall sodalösning (natriumkarbonat, Na2CO3). I naturen finns det lagrat med soda i sodasjöar. Genom att koldioxid frigörs vid upphettning av saltet används det i pulverbrandsläckare. 2 NaHCO3 + värme Na2CO3 + H2O + CO2 Hjorthornssalt, dvs ammoniumkarbonat, (NH4)2CO3, framställdes förr genom torrdestillation av horn, därav namnet. Det luktar ammoniak och användes förr som luktsalt. Jämför tyngdlyftare som sniffar ammoniak. Sönderdelningen i gaser vid upphettning gör att det används som bakpulver. (NH4)2CO3 + värme NH4HCO3 + NH3 + värme 2 NH3 + CO2 + H2O Bakpulver är en blandning av natriumvätekarbonat, sura fosfater (NaH 2PO4, Na2HPO4) och risstärkelse. Koldioxiden Vid hävning av olika bakverk utnyttjas koldioxid. Koldioxid är gasen som vi har i utandningsluften därför att det är en restprodukt då vi bryter ner organiskt material (födan) i matsmältningssystemet. När en organisk molekyl förbränns (inkluderat den långsamma förbränningsprocessen i levande celler som kallas för metabolism) binds kolet till två syremolekyler och bildar koldioxid. Om det inte finns tillräckligt med syre vid förbränningen bildas det kolmonoxid (benämns även koloxid) istället. Fotosyntesen Koldioxid är en död form av kol, men den är inte overksam. Gröna växter använder solenergin till att dra till sig koldioxiden som finns i luften. Koldioxiden använder växterna tillsammans med vatten för att bilda sina egna kolhydrater. Detta fenomen är känt som fotosyntesen. Jäsning, kolsyrade drycker Koldioxid bildas också vid jäsning av kolhydrater med alkohol som restprodukt. Det är koldioxid som är i skummet på ölet och champagnens "bubblor". För att koldioxiden skall frigöras från lösningen så måste flaskan öppnas så att trycket i flaskan lättar. Koldioxid i vatten är känt som sodavatten och tillsätter man olika smaker får man vanlig läsk. Koldioxid löst i vatten bildar en svag syra, kolsyra. Det är kolsyran som "kittlar" på tungan då man dricker läsk. Kolsyran är också lite bakteriedödande medel. Kolsyran sägs också befrämja flödet från magsäcken till tarmarna. Detta är förmodligen förklaringen till att champagnen har så snabb berusningseffekt. Koldioxid i solsystemet Koldioxid är det fjärde mest vanliga ämnet i den torra atmosfären och den vanligaste gasen på planeterna Mars och Venus. En stor del av koldioxiden flyttades från den tidiga atmosfären. Detta skedde då de stora oceanerna bildades. Koldioxiden löste sig i vattnet. Nu återfinns stora delar av den tidigare koldioxiden som karbonater i berggrunden. Uträkningar har gjorts på mängden koldioxid på jorden (inklusive den koldioxid som är bundet i form av karbonater och det som är löst i vatten) och jämförts med mängden koldioxid på Venus. Det har visat sig att mängderna är ungefär lika stora. Koldioxiden i atmosfären har till uppgift att fånga in den infraröda strålningen som utsänds från jordens varma yta. Koldioxid är genomsläppligt för solens strålning. Det gör att ljuset passerar genom atmosfären till jordens yta. Samtidigt som ytan värms upp så bildas det infraröd strålning som inte tar sig tillbaka till rymden därför att koldioxidmolekylerna absorberar den. Denna infångade energi värmer upp atmosfären i en process som kallas för växthuseffekten. Koldioxiden i luften kan liknas vid glaset i ett växthus. De energirika, kortvågiga solljuset (gult i figuren) passerar glaset/koldioxiden och omvandlas till värme när det absorberas i växtligheten och marken. Värmen återutsänds som långvågig värmestrålning (orange i figuren) men denna strålning förmår inte tränga genom glas/koldioxid och hålls därför kvar. Atmosfärens koldioxid fungerar på samma sätt som glaset i ett växthus.