Organisk kemi - Hembergsskolan
advertisement

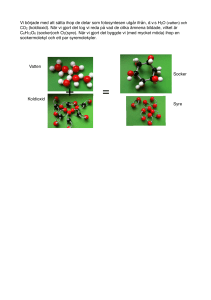
Organisk kemi Kolets och kolföreningarnas kemi Du tar dig framåt i presentationen genom att klicka med musen. Ta det lugnt och stressa inte. © Hans Lundgren Kol i naturen. Rent kol förekommer i tre former. Det är: ► Diamant ► Grafit ► Fullerener © Hans Lundgren Livets byggsten Kol har pga. sin atomuppbyggnad förmågan att på fyra olika ”håll” binda sig till andra ämnen. Denna egenskap är grunden till att bygga upp de kolföreningar som ingår i en levande organism. Visst inser du att allt levande innehåller kol? Om inte kan du ju fundera på vad som händer om du eldar på en vedpinne, eller vad som händer då du grillat korven för länge. Visst blir det kol. Den mat vi stoppar i oss är kolföreningar ( proteiner, kolhydrater och fetter) och dessa bryts sönder i vår mage och i våra tarmar till mindre kolföreningar som vår kropp behöver för att fungera, bl.a. druvsocker. Våra cellers ”bensin” är druvsocker och det förbränns med hjälp av syre till ”avgaserna” koldioxid och vatten som vi sedan andas ut i utandningsluften. Den koldioxid och det vatten som vi och andra organismer avgett omvandlar växterna med hjälp av sitt klorofyll och solljuset till nya kolföreningar (socker) som bygger upp växten till kanske just en björk. Vid processen blidas ”avgasen” syre. Dessa fenomen kallar vi för cellandning och fotosyntes. © Hans Lundgren Kol Väte Syre Fotosyntesen Druvsocker (C6H12O6) Koldioxid (CO2) Klorofyll i bladen Syre (O2) Vatten (H2O) Den koldioxid och det vatten som vi och andra organismer avgett omvandlar växterna med hjälp av sitt klorofyll och solljuset till nya kolföreningar (socker) som bygger upp växten till kanske just en björk. Vid processen blidas ”avgasen” syre. © Hans Lundgren Cellandningen syre Druvsocker + Våra cellers ”bensin” är druvsocker och det förbränns med hjälp av syre till ”avgaserna” koldioxid och vatten som vi sedan andas ut i utandningsluften. © Hans Lundgren Fotosyntes & cellandning Socker (C6H12O6) Koldioxid (CO2) Klorofyll i bladen Syre (O2) Vatten (H2O) © Hans Lundgren Kol i vardagen ► Träkol Om du upphettar trä utan tillförsel av syre sönderdelas det till bland annat brännbara vätskor och gaser som kan antändas, träsprit, tjära mm. Kvar blir träkol som kan användas i grillen. Kanske har du varit med om att se en tjärdal eller kolmila, där sker just detta. ► Tekniskt kol Om man torrdestillerar slakteriavfall och socker bildas sockerkol benkol och blodkol. Ett samlingsnamn för denna typen av kol är tekniskt kol. ► Aktivt kol Om du upphettar pulveriserat tekniskt kol med vattenånga bildas ett väldigt poröst och sprött kol. Detta kol kallas för aktivt kol och har den egenskapen att det kan binda till sig doft och smakämnen. Aktivt kol används därför som filter i gasmasker, filterfläktar och andra reningsanordningar. På laboration har du renat Coca Cola till sockervatten. Processen att hetta upp något utan syretillförsel så att brännbara gaser och vätskor bildas kallas torrdestillation. © Hans Lundgren Kol i kemiska föreningar ► Kolväten (gasol, bensin, diesel, parrafin m.fl.) ► Alkoholer (metanol, etanol, glykol, glycerol m.fl.) ► Organiska ► Estrar syror (myrsyra, ättiksyra, citronsyra m.fl.) (Nitroglycerin, smaksättare, doftämnen plast) ► Kolhydrater ► Proteiner ► Fetter ”karboxylsyror” (socker, stärkelse och cellulosa) (Enzymer, äggviteämnen m.fl.) (Animaliskt fett, vegetabiliskt fett) © Hans Lundgren Mättade kolväten Kolatomen har förmågan att binda sig till fyra andra atomer. Om kolatomerna binder sig till endast väte bildas föreningar som kallas kolväten. Du har bekantat dig med våra åtta enklaste kolväten och nedan visas strukturen för de fyra första. Alkaner Kolväte Metan Strukturformel H H C H Molekylformel (summaformel) Etan CH4 H H Propan H H C C H H C2H6 H H Butan H H H C C C H H H C3H8 H H H H H H C C C C H H H H H C4H10 © Hans Lundgren Omättade kolväten Ibland finns inte tillräckligt med väte att binda sig till för kolatomen och då måste den binda till kol igen. Då bildas alkener eller alkyner. Du ser nedan några exempel på sådana föreningar. Alkener Kolväte Strukturformel Molekylformel (summaformel) Eten Alkyn Propen H H C C H H C2H4 H Etyn H H H C C C H H C C H H C3H6 C2H2 Kolväten med dubbel eller trippelbindningar kallas för omättade kolväten © Hans Lundgren Alkoholer Alkoholer är en grupp ämnen som är vattenlösliga och antändningsbara. En alkohol bildas då en eller flera OH-grupper binder sig till ett stamkolväte. Du kommer nu få några exempel på olika alkoholer. 1-värda alkoholer Metanol Etanol H H OH C H H CH3OH H C C H H C2H5OH 2-värd alkohol Etandiol (glykol) H H H H C C OH OH C2H4(OH)2 H Propanol OH H H H H C C C H H H Butanol OH H H H H H C C C C H H H H C3H7OH OH C4H9OH 3-värd alkohol Propantriol (glycerol) H H H H C C C OH OH OH C3H5(OH)3 H © Hans Lundgren Organiska syror Då en alkohol oxideras (reagerar med syre) bildas en organisk syra samtidigt som vatten avspjälkas enligt följande exempel. + Etanol H H H C C H H Syrgas Etansyra + O2 OH H (ättiksyra) H O C C OH + Vatten + H2 O + H2 O H + O2 C2H5OH CH3COOH Nedan presenteras några organiska syror O H C OH H H O C C OH H Metansyra (myrsyra) HCOOH Etansyra (ättiksyra) CH3COOH H H H O C C C H H Propansyra C2H5COOH OH H H H H O C C C C H H H Butansyra OH (smörsyra) C3H7COOH © Hans Lundgren Estrar Estrar är kan dofta och smaka gott och används därför bland annat vid parfymtillverkning eller vid framställning av smaksättare. Estrar kan också kopplas ihop flera stycken och då bildas polyester (plast). En ester bildas då en organisk syra får reagera med en alkohol. Då bildas en ester samtidigt som vatten avspjälkas. Förloppet går sakta men kan påskyndas med hjälp av en katalysator. Under skollaborationen används svavelsyra som katalysator. Etansyra H (ättiksyra) H O C C OH svavelsyra + + H Etanol HO H H C C H H + Etylacetat svavelsyra H H H O C C H O H H C C H H H svavelsyra CH3COOH + C2H5OH CH3COOC2H5 Vatten + H2O + H2O En katalysator är ett ämne som påskyndar en reaktion utan att själv delta. Reaktionen då vatten avspjälkas kallas kondensationsreaktion © Hans Lundgren Isomerer En kolförening t.ex kolvätet butan kan inta olika strukturformler enligt nedan. Två kolföreningar med samma molekylformel men med olika stukturformler säger man har olika isomerer. H H H H H C C C C H H H H H Olika strukturformel H H H H C C C H H C H H H H Butan C4H10 Iso-butan Lika molekylformel C4H10 Funktionella grupper När vi delat in kolföreningarna har vi grupperat dem efter dess uppbyggnad. Kolföreningar med liknade uppbyggnad har liknande egenskaper och för att skilja dem åt har vi gett dem olika namn och ändelser. T.ex slutar alla alkoholer med ol och alla alkener (dem med dubbelbindningar) med en osv. Man säger att dessa ämnen har olika funktionella grupper. Nedan visas olika funktionella grupper utifrån stamkolvätet etan. De olika funktionella grupperna kommer att ringas in. Etan H Eten H H C C H H H Alkan (enkelbindning) H O C C OH H Organisk syra H C C H H H H C C H H Alkohol C H Alkyn (Trippelbindning) Etanol H C H Alken (dubbelbindning) Etansyra H H Etyn Etylacetat OH H H O C C O H Ester H H C C H H H Vill du veta mera? Nedan följer några matnyttiga länkar som kommer att ge dig fördjupade kunskaper inom organisk (kolföreningarnas) kemi. Övning Distansgymnasiet Presentation © Hans Lundgren