2013-års tenta med lösningsförslag - IFM
advertisement

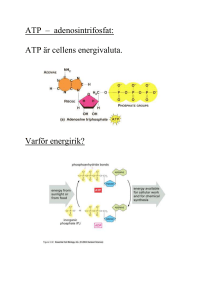
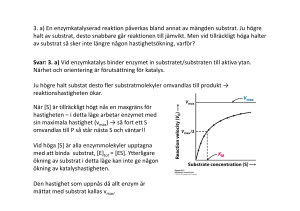
LINKÖPINGS UNIVERSITET IFM/Kemi TENTAMEN I BIOKEMI 1 NKEA08, 92KE21 2014-01-17 kl. 08.00-12.00 Skriv endast en uppgift per blad. Redovisa beräkningar och motivera svar. Besvara delfrågor i tur och ordning. Hjälpmedel: miniräknare Ansvariga lärare: Magdalena Svensson (285686, 0704-090999) och Helena Herbertsson (285605, 070-5669944) 1.a) Rita följande tetrapeptid: Thr-Ile-Arg-Glu vid pH 7. Rita/markera huvudkedja, sidokedjor, α-kol, N- och C-terminal. Ange även vilken nettoladdning tetrapeptiden har vid pH 7. (4p) b) Nästa alla peptidbindningar i proteiner har trans konfiguration. Men en aminosyra finner man någorlunda ofta i cis form, vilken och varför? 2p c) Vilken information om ett proteins struktur kan du få genom att studera en Ramachandranplot? 1p d) Vilken typ av bindningar stabiliserar en α–helix? Ange även två faktorer som destabiliserar en α–helix. 3p 2.a) Du har med hjälp av gelfiltreringskromatografi renat fram ett protein Q, från en blandning av proteiner. Se tabell nedan. Protein A B C Q Mw 14 000 28 000 42 000 56 000 Visa hur ett kromatogram skulle kunna se ut efter detta reningssteg. Ange enhet på axlarna i kromatogrammet samt indikera var i kromatogrammet som protein Q återfinns. (3p) b) För att kontrollera renheten av protein Q körs en SDS-PAGE. Hur förväntar du dig att gelen ser ut under förutsättning att protein Q är ett heterodimert protein? (2p) c) Protein Q har ett pI på 4,3 . Vilken typ av aminosyror är troligen vanliga i detta protein? (2p) d) Du har ett vattenlösligt globulärt enzym. För att närmare studera den katalytiska aktiviteten hos detta enzym muterar du en Lys i aktiva ytan till i tur och ordning Asn, Glu och Arg. Vilken effekt av enzymaktiviteten förväntar du dig vid: i) Lys→Asn ii) Lys→Glu iii)Lys→Arg (3p) 3. a) Reaktionshastigheten för en enzymkatalyserad reaktion mättes vid olika temperaturer, se figur nedan. Förklara varför reaktionshastigheten först ökar med ökande temperatur för att sedan drastiskt avta. (3p) b) Förklara följande två begrepp: i) koenzym ii) produktinhibering (4p) c) ATP-syntas är ett multienzymkomplex som katalyserar ATP-syntes. i) Vilken/vilka subenheter är direkt involverade i katalysen? ii) De subenheter hos ATP-syntas vilka är lokaliserade till membranet består mestadels av α-helixstruktur. Varför är α-helixstruktur fördelaktigare för membranproteiner än β-flak? (3p) 4. a) i) Hur är triacylglycerol uppbyggd? ii) Vad har triacylglycerol respektive fosfolipider för funktion i kroppen? (2p) b) Vilken molekyl kan kallas kroppens energivaluta och varför är denna molekyl så energirik? (2p) c) Vad har NAD+ och FAD för funktion i kroppen? (1p) d) Var i cellen sker glykolysen och vilken är glykolysens slutprodukt? (1p) e) i) Vad omvandlas glykolysens slutprodukt till i det direkt påföljande steget då O2 finns tillgängligt och ange en process där den molekylen förbrukas? ii) Ge ett exempel på vad som kan bildas i frånvaro av O2. (2p) f) I glykolysen bryts glukos ner medan processen då glukos bildas kallas glukoneogenesen. Glukoneogenesen brukar ibland kallas för en ”omvänd glykolys”. Det är inte helt sant för vissa av reaktionsstegen är olika. Ge exempel på ett steg som skiljer sig åt, beskriv på vad sätt det skiljar sig åt och varför är det inte helt omvända processer? (2p) 5. a) Glukosmetabolismens totalreaktion kan skrivas C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + energi. i) I vilken process krävs egentligen O2 och till vad? ii) Ge exempel på ett steg där CO2 frigörs. (2p) b) i) Hur kopplas elektrontransporten i andningskedjan till ATP-syntes? ii) Beskriv elektronernas vandring i elektrontransportkedjan. (1p) (2p) c) Under vilka betingelser bildas ketonkroppar och vilket ämne fungerar som utgångsmaterial? (2p) d) Vad menas med att citronsyracykeln är en amfibol process? (1p) e) Då en mättad fettsyra, dodekansyra/laurinsyra, som innehåller 12 kolatomer bryts ner bildas motsvarande 78 ATP. i) Motsvarande hur mycket ATP bildas i de första delstegen då den här fettsyran bryts ner till acetylCoA? ii) Motsvarande hur mycket ATP fås sedan när all acetylCoA bryts ner i citronsyracykeln? (2p) 6. a) Skissa översiktligt på händelseförloppet från att en ligand binder till en receptor, som exempelvis -adrenerga receptorn som diskuterats under kursen, tills proteinkinas A (PKA) aktiveras. (2p) b) Fosforyleringar är ett vanligt sätt att ändra ett enzyms aktivitet, antingen ökar aktiviteten efter forforylering eller så minskar den. i) Vad kallas ett enzym som fosforylerar ett annat enzym? ii) Ge en förklaring till hur fosforylering kan ha så stor betydelse för ett enzyms aktivitet. (2p) c) Ofta är energistatus ett viktigt kontrollkriterium. Borde fettsyrasyntes eller -oxidation aktiveras om [ATP] är hög? Motivera. (1p) d) i) Processen då nukleotidsekvens i DNA omvandlas till aminosyrasekvens i ett protein delas upp i två delprocesser. Vilka och vad sker vid respektive delprocess? ii) tRNA-molekyler spelar en avgörande molekyl i en av dessa delprocesser. Beskriv deras funktion. (3p) e) Varför finns det DNA-polymeraser med s k exonukleasfunktion medan motsvarande inte finns hos några RNA-polymeraser och vad innebär exonukleasfunktionen? (1p) f) Vad är en intron och vad kallas processen då exoner och introner separeras? (1p) Svar: 1.a) Nettoladdning=0 samt fullständig struktur. b) Pro, pga Pro´s struktur är trans konfiguration endast något mer gynsamt än cis konfiguration. (för övriga aa är trans betydligt fördelaktigare än cis). c) Vilka vinkelkombinationer av fi och psi som är möjliga samtidigt. Vilken sekundärstruktur ett protein innehåller. d) H-bindningar, α-helix destabiliseras av: 2 eller flera aa intill varandra i primärstrukturen grenade på β-kolet i sidokedjan (Ile, Val, Thr). 2 eller flera aa intill varandra i primärstrukturen med samma laddning (ex: Asp, Glu). 2.a) Gelfiltreringskromatografi, separation efter storlek. Störst först!. Kromatogram med A280nm på y-axel och elueringsvolym/fraktionsnummer på x-axeln. b) Vid SDS-PAGE är proteinerna denaturerade och ev. S-S är klyvda. All struktur utom primär förstörd. Protein Q kommer att ge upphov till 2 band på gelen. c) pI det pH där ett proteins nettoladdning =0. Ett lågt pI tyder på många Glu och Asp i proteinet. d) Lys positivt laddad vid pH 7. Troligtvis är denna laddning viktig för katalysen. i) Asn polär, ingen eller låg aktivitet ii) Glu negativt laddad, ingen aktivitet iii) Arg positivt laddad, troligtvis ganska hög aktivitet. 3.a) Enzymer ökar reaktionshastigheten genom att minska aktiveringsenergin för transition state. Vid högre temperatur finns mer energi tillgänglig för reaktanter och fler når transition state. Vid ”för hög” temp. värmedenaturerar enzymet. b) i: någon småmolekyl som enzymet behöver för aktivitet som inte är en metall. ii: Då slutprodukten i en syntesväg inhiberar enzymet som katalyserar den första delreaktionen. Binder till regulatoriskt site – specialfall av allosterisk kontroll. c) i: β subenter, finns 3 st. ii: En α-helix kan helt täckas av opolära sidokedjor då samtliga sidokedjor är på utsidan av helixen. Β-flak pga transkonfiguration ger ”mellanrum” mellan sidokedjor där polära peptidgrupper kommer i kontakt med opolärt membran. 4. a) i) Triacylglycerol består av tre fettsyror som är förestrade till en glycerolmolekyl. ii) Triacylglycerol är en förvaringsfom för metabol energi medan fosfolipider bygger upp biologiska membran. b) ATP; Energirik p g a 4 negativa laddningar i närheten av varandra i strukturen. För att hålla samman molekylen krävs mycket energi som kan frisättas då ATP omvandlas till ADP eller AMP. c) NAD+ och FAD är oxidationsmedel. d) Glykolysen sker i cytosolen och dess slutprodukt är pyruvat. e) i) Vid aeroba förhållanden bildas acetylCoA som huvudsakligen går in i citronsyracykeln eller används som utgångsmaterial vid fettsyrasyntesen. ii) I våra muskler: Laktat I jästceller: Etanol f) Det första steget i glukoneogenesen då pyruvat ska bli fosfoenolpyruvat sker i två steg via oxaloacetat jämfört med det sista steget i glykolysen då fosfoenolpyruvat direkt omvandlas till pyruvat. Detta kräver andra enzymer. Även i två av de sista reaktionerna i glukoneogenesen (fruktos-1,6-bisfosfat blir fruktos-6-fosfat och glukos-6-fosfat blir glukos) är andra enzymer involverade. Detta är viktigt så att man ska kunna kontrollera att när den ena processen är aktiv så stängs den andra av. 5. a) i) O2 krävs i andningskedjan och är mottagare av elektronerna i elektrontransportkedjan. ii) CO2 avspjälkas då pyruvat omvandlas till acetylCoA, då isocitrat blir aketoglutarat och då a-ketoglutarat omvandlas till succinylCoA. b) i) Då elektronerna i elektrontransportkedjan passerar vissa proteinkomplex (elektroner från NADH: I, III och IV; elektroner från FADH2: III och IV) pumpas protoner från matrix till mellanmembransutrymmet och en protongradient byggs upp. Enda sättet att utjämna protongradienten är att protoner går tillbaka till matrix via ATP-syntas varvid ATP bildas. ii) Elektronerna från NADH lämnas vid proteinkomplex I och vandrar sedan via komplex III till IV där de överförs till O2 och vatten bildas. Elektronerna från FADH2 ges till proteinkomplex II och vandrar sedan via III till IV. Mellan proteinkomplex I resp. II och III fungerar Q som en mobil bärare och mellan III och IV bärs elektronerna av cytokrom c. c) Ketonkroppas bildas då för mycket fett bryts ner i förhållande till kolhydrater (exempel vid fasta eller vid diabetes typ II). [AcetylCoA] blir då hög och fler acetylCoA reagerar med varandra och bildar s k ketonkroppar. d) En amfibol process kan både fungera för anabola (nedbrytande) och katabola (biosyntetiska) syften. Citronsyracykeln är viktig för nedbrytning av kolhydrater samtidigt som flera av dess intermediärer är viktiga utgångsämnen för exempelvis aminosyror och nukleotider. e) Dodekansyra = 12 C ger 6 acetylCoA efter 5 varv i fettsyranedbrytningen. i) Fettsyra → 6 acetylCoA; 5 · 1.5 ATP från FADH2 + 5 · 2.5 ATP från NADH = 20 ATP ii) 6 acetylCoA ger i citronsyracykeln: 6 · 1.5 ATP från FADH2 + 6 · 3 · 2.5 ATP från NADH + 6 GTP(ATP) direkt = 60 ATP Man får alltså ut 80 ATP men det finns en kostnad motsvarande 2 ATP förknippad med att få in fettsyran i mitokondrien så totalvinsten blir 78 ATP. 6. a) När liganden binder till receptorn aktiveras G-proteiner. G-GTP aktiverar i sin tur adenylatcyklas som producerar cAMP. Två cAMP binder till de regulatoriska enheterna i PKA och dessa släpper då från de katalytiska enheterna som kan bidra till fosforylering av andra enzymer. b) i) Kinas eller fosforylas ii) Någon av nedanstående förklaringar: Negativa laddningar introduceras → ändrade elektrostatiska förhållanden → ändrad 3D-struktur → ändrad aktivitet Ändrade vätebindningsmönster → ändrad 3D-struktur → ändrad aktivitet Tillförsel av energi → förskjutning av jämvikter mellan proteinets olika konformationer → ändrad aktivitet c) Om [ATP] är hög finns gott om energi i kroppen och då är det bättre att lagra energin till ett senare tillfälle så då blir fettsyrasyntesen aktiv. d) i) Transkription: Nukleotidsekvens i DNA överförs till nukleotidsekvens i mRNA. Translation: Nukleotidsekvens i mRNA överförs till aminosyrasekvens i proteiner. ii) Då tRNA-molekylerna interagerar med mRNA i ena änden (antikodonloopen) och bär en aminosyra i andra änden (3’) så är de ansvariga för att rätt aminosyra kommer på rätt plats i sekvensen. e) Då DNA är vårt genetiska arv och ska fortleva i generationer så är replikationen rigoröst kontrollerad. Inför celldelning är det viktigt att alla dotterceller får samma genuppsättning som modercellen så därför har vissa DNA-polymeraser som katalyserar bildandet av nytt DNA s k exonukleasaktivitet. Detta innebär att de har förmåga att ta bort en felaktigt inkorporerad nukleotid så den kan ersättas med korrekt variant. Det är inte lika allvarligt om det blir fel vid transkriptionen. f) Introner innehåller icke-kodande genmaterial och processen då intronerna klipps bort och exonerna sammanfogas kallas splitsning eller ’splicing’.