1 - IFM - Linköpings universitet
advertisement

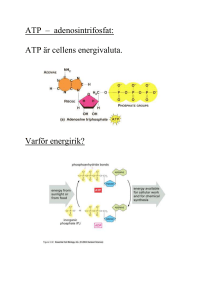
LINKÖPINGS UNIVERSITET IFM/Kemi TENTAMEN I BIOKEMI 1 NKEA08, 9KE221, 9KE361 2009-12-17, Kl. 08.00-13.00 Skriv endast en uppgift per blad. Redovisa beräkningar och motivera svar. Besvara delfrågor i tur och ordning. Hjälpmedel: miniräknare Ansvariga lärare: Magdalena Svensson (285686, 0704-090999) och Helena Herbertsson (285605, 070-5669944) 1.a) Rita en tetrapeptid innehållande Phe, Glu, Lys och Ser vid pH 7. Rita/markera huvudkedja, sidokedjor, α-kol, N- och C-terminal. Ange vilken nettoladdning tetrapeptiden har vid pH 7. (4p) b) Du har en lösning innehållande en peptid med följande sekvens: Ala-Phe-Arg-TyrGln-Gly. Du tillsätter trypsin – vad händer? (2p) c) Vilka typer av β-strukturer känner du till och hur stabiliseras denna typ av struktur? (2p) d) Med vilka interaktioner stabiliseras tertiärstrukturen i proteiner? Ge exempel (med struktur) på en stabiliserande interaktion samt ange mellan vilka atomer den återfinns. (2p) 2.a) Du har mha gelfiltreringskromatografi renat fram ett protein P, från en blandning av proteiner. Alla fyra proteinerna i blandningen har olika Mw. Tyvärr visar kromatogrammet inte fyra distinkta toppar, vilket betyder att du inte lyckats separera proteinerna. Vad skulle detta kunna bero på? Motivera! (2p) b) Hur går du till väga för att bestämma molekylvikten (Mw) för ett protein utifrån en SDS-PAGE analys? Skulle du kunna använda dig av enbart PAGE-analys för bestämning av Mw för ett protein? Motivera! (4p) c) Ange någon vanlig kemikalie som används vid denaturering av proteiner i samband med unfolding/refolding-studier (uppvecknings-/återveckningsstudier). (1p) d) Vad avses med uttrycken apoenzym respektive holoenzym? (1p) e) För att studera ett enzym kinetiskt väljer du att vid en bestämd enzymhalt stegvis öka substrathalten. Vilken information kan du erhålla från detta experiment? (2p) 3.a) Vilken påverkan av ett proteins aktivitet förväntar du dig av följande aminosyrautbyten ( Förutsättning: vattenlösligt globulärt protein): i) Ala → Phe ii) Lys → Arg (2p) b) Förklara vad som menas med begreppet allosterisk reglering. (2p) c) Många reaktioner i cellen är energetiskt ogynnsamma. Vad innebär detta termodynamiskt? (1p) d) Hur kan ATP driva en ogynnsam reaktion så att den blir gynnsam? Visa med allmänna reaktionsformler hur detta går till. (2p) e) Protontransport driver ATPsyntesen. Beskriv (eller rita) vilka delar av ATPsyntas som är direkt inblandade i protontransporten och förklara hur själva transporten sker. En sidokedja till en Asp spelar en central roll vid protontransporten, vilken? (3p) 4. a) I vilken del av cellen sker glykolysen och vilken är processens slutprodukt? (1 p) b) När glykogenreserverna uttömts vid t ex svält eller kraftig fysisk aktivitet finns andra ämnen som kan fungera som utgångsämnen för glukoneogenesen. Nämn ett ämne som kan fungera som utgångsämne för glukoneogenes vid (i) svält respektive vid (ii) fysisk aktivitet. (2 p) c) Varför är det så viktigt att kroppen ska kunna producera glukos? (1 p) d) ATP är cellens ”energivaluta”. Vad gör ATP till en så energiinnehållande molekyl? (2 p) e) Glukoneogenes och glykolys får aldrig ske samtidigt. Vilken process är aktiv om [ATP] är låg? Motivera. (2 p) f) Glykolysens reaktioner knyts samman med citronsyracykelns reaktioner via en speciell reaktion. Vilken reaktion åsyftas och vilket enzym katalyserar reaktionen? (2 p) 5. a) Var äger citronsyracykelns reaktioner rum? (1 p) b) Succinat omvandlas i citronsyracykeln till oxaloacetat via fumarat och malat. (i) Vilken av nedanstående reaktionstyper sker när succinat omvandlas till fumarat? (ii) Vilken av nedanstående reaktionstyper sker när fumarat omvandlas till malat? Krebs cykel är ett annat namn för citronsyracykeln. Reaktionstyper: Oxidation Reduktion Hydratisering Dehydratisering Karboxylering Dekarboxylering (1 p) c) Ange ett viktigt kontrollsteg i själva citronsyracykeln och ange ett ämne som inhiberar enzymet som katalyserar detta steg. (2 p) d) Triacylglycerol och fosfolipider tillhör båda ämnesgruppen lipider. Vad skiljer dem åt i struktur och funktion? (2 p) e) Ange hur fettsyran CH3(CH2)8COOH betecknas på det sätt man normalt använder för fettsyror samt beräkna hur mycket ATP som totalt frigörs vid fullständig nedbrytning. (4 p) 6. a) Fettsyrasyntesens hastighet regleras av acetylCoAkarboxylaskomplexet. Enzymet katalyserar bildandet av malonylCoA. (i) Varför är just detta enzyms aktivitet så viktigt för att kontrollera hela fettsyrasyntesen? (ii) Aktiviteten hos enzymkomplexet påverkas av bl.a. a. citrat b. insulin Ange hur aktiviteten påverkas i närvaro av ovanstående och förklara varför aktiviteten ökar eller minskar i vart och ett av fallen. (3 p) b) Hormonet adrenalin binder till -adrenerga receptorn på cellytan. Detta leder till aktivering av G-proteiner som i sin tur leder till aktivering av adenylatcyklas. Beskriv kortfattat den fortsatta signalvägen fram till att ett enzym fosforyleras. (1 p) c) Vad kallas den typ av bindning som binder samman nukleotiderna i en DNA- eller RNA-kedja? (1 p) d) Virus kan innehålla enkelsträngat eller dubbelsträngat DNA. Vid analys av virus stammen X1377 fann man följande baskomposition; A=32, G=16, T=40, C=12. Vilken slutsats kunde man dra om huruvida virusets arvsmassa var enkel- eller dubbelsträngat? Förklara. (1 p) e) Nedan visas sekvensen för en kedja i en dubbelsträngad oligonukleotid. Om denna kedja används som mall vid transkriptionen, vilken blir då motsvarande mRNAsekvens och vilken primärstruktur har oligopeptiden som bildas vid translationen? 5’-ACCGTAAGGCTTTAG-3’ (2 p) f) Om ovanstående DNA muteras så att den 4:e nukleotiden från 5’-änden blir C i stället för G, hur påverkar det peptidens utseende och vad kallas en sådan form av mutation? (2 p) SVAR 2009-12-17: 1.a) nettoladdning 0 (N-terminal och Lys + laddade, C-terminal och Glu – laddade). Ritad struktur b) Trypsin klyver C-terminalt om Arg och Lys. Så denna peptid klyvs i 2 delar. Ala-Phe-Arg , Tyr-Gln-Gly c) Antiparallell β-struktur parallell β-struktur hårnålsöglor (β-turns) Strukturen stabiliseras av H-bindnigar mellan peptidgrupper. d) Tertiärstruktur i stabiliseras av interaktioner mellan sidokedjor som kan vara av följande slag: H-bindning, jonbindning, van der Waal och disulfidbryggor. Rita sidokedjor för lämpligt par samt ange mellan vilka atormer interaktionen sker. 2.a) Proteinerna har snarlika Mw. Provvolym är mcyket viktig vid gelfiltrering (bör vara max 5% av kolonnvolymen för god separation). En mindre lyckad provapplicering där provet inte går in i gelen som ett smalt band ger sämre separation (provvolymen ökar). b) Proteiner separerar vid SDS-PAGE efter storlek, minst vandrar längst. Referensprov innehållande ett antal proteiner med känd Mw. En plot med logMw avsatt mot vandringslängd. Mät vandringslängden för ditt protein och läs av Mw i plot. Vid PAGE är proteiner nativa och separerar efter form, laddning och storlek. Exempelvis två proteiner med identisk Mw men med olika form kommer att vandra olika långt. Så svaret är nej, PAGE kan inte användas för Mw bestämning. c) urea d) holoenzym enzym med cofaktor – apoenzym enzym som normalt behöver kofaktor för aktivitet men nu saknar denna. e) Vid tillräckligt hög substrathalt kommer alla enzymer att binda en subsratmolekyl, dvs allt E som ES komplex. Vi har nu nått maximal reaktionshastighet, dvs ytterligare tillsatts av substrat kommer inte att påverka hastigheten. Vi har nått Vmax. Vmax och KM kan bestämmas från dessa experimentella data. 3.a) i) Stor påverkan - då liten opolär aminosyra till en betydligt större. Detta ”extra ” utrymme finns inte inuti proteinet. ii) + laddad till + laddad. Laddade ofta på utsidan storleksskillnader spelar mindre roll (i detta fall inte någon stor storleksskillnad heller). Så troligtvis liten påverkan. b) Enzym som då de binder någon regleringsmolekyl ändrar konformation och därmed funktion. Regleringsmolekylen binder till regleringssite (inte till aktiva ytan). Men det är aktiva ytan som påverkas av inbindningen. (allosteri – påverkan på annan plats). Antingen blir de mer aktiva eller mindre. Produktinhibering är ett specialfall av negativ allotsterisk kontroll. c) G´o >0 d) A + B + ATP ↔ AB + ADP + Pi A + ATP ↔ AP + ADP AP + B ↔ AB +Pi Totalt: A + B + ATP ↔ AB + ADP + Pi Mekanism: e) Protoner binder till deprotoniserad Asp-sidokedja i c (finns 10 st i cirkel). Till c kommer de genom en halvkanal i a. c-ringen roterar ett hack. Proton lämnar c genom halvkanal i a. Transporten sker från innermitokondriutrymme till matrix. 4. a) Glykolysen sker i cytosolen och dess slutprodukt är pyruvat. b) Svält: Glycerol eller aminosyror Fysisk aktivitet: Laktat c) Glukos är hjärnans främsta energikälla. d) I ATP-molekylen sitter fyra negativa laddningar i närheten av varandra. Det krävs energi för att hålla ihop molekylen och denna energi kan frisläppas när ATP omvandlas till ADP eller AMP som innehåller färre negativa laddningar. e) Om [ATP] är låg så behöver kroppen energi och då bör glykolysen vara aktiv för att ge utgångsmaterial för citronsyracykel och oxidativ fosforylering. f) Glykolysens slutprodukt pyruvat omvandlas till acetylCoA som sedan går in i citronsyracykeln. Reaktionen katalyseras av pyruvatdehydrogenas. 5. a) I mitokondriematrix b) (i) Oxidation (ii) Hydratisering c) Isocitrats omvandling till -ketoglutarat Enzym: Isocitratdehydrogenas Enzymet inhiberas av: - ATP (hög energinivå) - NADH (kan ge ATP i förlängningen) -ketoglutarats omvandling till succinylCoA Enzym: -ketoglutaratdehydrogenas Enzymet inhiberas av: - ATP - NADH - SuccinylCoA (mycket av produkten finns redan) d) Triacylglycerol består av tre fettsyror förestrade till glycerol och fungerar som lagringsform för metabol energi. Fosfolipider består av två fettsyror och en fosforylerad alkohol som är kopplade till glycerol. Fosfolipider bygger upp biologiska membraner. e) Fettsyran betecknas 10:0. Trivialnamnet är kaprinsyra 5 mol acetylCoA, 4 mol FADH2 samt 4 mol NADH+H+ från fettsyraoxidationen. När acetylCoA bryts ner i citronsyracykeln erhålls 5 mol FADH2, 15 mol NADH+H+ och 5 mol GTP. Kostnad för bildande av acylCoA = 2 ATP. ATPtotalt: (4+5)∙1,5 + (4+15)∙2,5 + 5-2 = 64 Efter nedbrytning av kaprinsyra erhålls alltså 64 mol ATP. 6. a) (i) Enzymet katalyserar det initiala steget i fettsyrasyntesen så ändras dess aktivitet ändras förutsättningen för hela fettsyrasyntesen (”flaskhals”). (ii) a. Citrat: Komplexet aktiveras – finns mycket citrat är energistatusen god och energi kan lagras till ett senare tillfälle. b. Insulin: Komplexet aktiveras genom att enzymet defosforyleras. b) När adenylatcyklas aktiveras bildas cAMP (cykliskt AMP) som i sin tur reglerar (ökar) aktiviteten hos PKA (proteinkinas A). Proteinkinas A fosforylerar andra proteiner. c) Fosfodiesterbindning d) X1377 måste innehålla enkelsträngat DNA annars skulle inehållet av A=T och C=G. e) mRNA: 5’-CUAAAGCCUUACGGU-3’ aa-sekvens: Leu-Lys-Pro-Tyr-Gly f) Mutationen som är en substitution kommer att innebära att en stoppkod bildas och därmed blir peptiden förkortad med två aminosyror, alltså en tripeptid bildas.