a) Från värdena på olika G-parameterar kan man få värdefull
advertisement

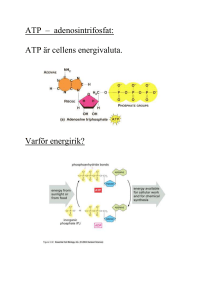
LINKÖPINGS UNIVERSITET IFM/Kemi TENTAMEN I BIOKEMI 1 NKEA08, 9KE221, 9KE321 2010-12-16 kl. 14.00-18.00 Skriv endast en uppgift per blad. Redovisa beräkningar och motivera svar. Besvara delfrågor i tur och ordning. Hjälpmedel: miniräknare Ansvariga lärare: Magdalena Svensson (285686, 0704-090999) och Helena Herbertsson (285605, 0705-669944) 1. a) Rita följande tetrapeptid: Thr-Arg-Val-Asp vid pH 7. Rita/markera huvudkedja, sidokedjor, α-kol, N- och C-terminal. Ange även vilken nettoladdning tetrapeptiden har vid pH 7. (4p) b) Du vill sekvensera ett relativt stort protein. Du väljer att använda kymotrypsin för att klyva polypeptidkedjan. Antag att en del av sekvensen ser ut som följer: Ala-Ser-Phe-Gln-Lys-Asp-Gly i) Varför måste långa polypeptidkedjor klyvas till kortare fragment för fullständig sekvensering? (2p) ii) Var i ovanstående sekvens kommer klyvning att ske? (1p) c) Nedan ser du ett antal peptidsekvenser. Vilken/vilka av dessa har möjlighet att bilda α-helix-struktur? Motivera. i) Ala-Phe-Ser-Lys-Asp-Ala-Gly ii) Val-Gly-Gln-Pro-Ala-Trp-Ser iii) Ile-Ala-Phe-Lys-Arg-His-Gly iv) Leu-Ala-Ser-Trp-Gly-Ala-Met v) Cys-Gly-Ala-Ile-Val-Thr-Glu vi) Gly-Gln-Asn-Tyr-Leu-Ala-Ser (3p) 2. a) Du har med hjälp av gelfiltrering separerat tre proteiner med följande molekylvikter: 50 000, 37 000 respektive 14 000. Rita hur ett kromatogram skulle kunna se ut efter denna kromatografi. Skriv ut enheter på axlarna samt visa var i kromatogrammet respektive protein återfinns. (3p) b) Proteinet med molekylvikt 50 000 visade sig vid analys med SDS-PAGE ge upphov till ett band med en vandringslängd motsvarande en molekylvikt av 25 000. Vad beror detta på? (2p) c) Vilken påverkan förväntar du dig av kymotrypsins aktivitet vid följande aminosyrautbyten. Kymotrypsin är ett vattenlösligt globulärt enzym. Motivera! i) Gly (lokaliserad i det inre av proteinet) → Met ii) Asp (lokaliserad i aktiva ytan) → Glu iii) Leu (lokaliserad i det inre av proteinet) → Ile iv) Asn (lokaliserad till ytan av proteinet) → ? Här får du föreslå två olika aminosyror: Ett utbyte som du förväntar dig resulterar i stor negativ påverkan av aktiviteten och ett med mindre, eller ingen, påverkan. (5p) 3. a) Förklara begreppen: i) allosterisk kontroll (= allosterisk reglering). ii) produktinhibering. iii) zymogenaktivering. (5p) b) Från värdena på olika G-parametrar kan man få värdefull information om reaktionerna i cellen. Vad kan sägas om en reaktion, om i) G´ är större än 0? ii) G´ är större än 0? (2p) c) Definiera vad primtecknet (´) ovan står för. (1p) d) Definiera begreppet oxidativ fosforylering. (2p) 4. a) Följande ämnen spelar en viktig roll vid metabolismen. I vilken katabol process återfinns de? i) ubiquinon (Q) ii) dihydroxyacetonfosfat iii) malat iv) succinylCoA (2p) b) Första delen av ett enzymnamn speglar oftast vilket substrat ett enzym verkar på och den andra delen speglar vilken typ av reaktion enzymet katalyserar. Vilket bör vara den andra delen av enzymnamnet för ett enzym som katalyserar följande reaktioner? (i) (ii) (1p) c) Vilken molekyl är cellens främsta ”energivaluta” och varför är den molekylen så energiinnehållande? (2p) d) Vid anaeroba förhållanden bildas i musklerna laktat (mjölksyrans anjon). i) Vad händer med det bildade laktatet när förhållandena återgår till det normala? ii) Hur stor procentandel energi utvinns från glykolysen vid anaeroba förhållanden jämfört med aeroba förhållanden då ATP även kan bildas genom oxidativ fosforylering? Räkna med att varje ATP motsvarar 3 ATP och redovisa dina beräkningar. (3p) e) Ange två processer eller reaktioner som bidrar till att pH i matrix ökar relativt pH i mellanmembransutrymmet och vilket syfte tjänar denna protongradient? (2p) 5. a) Glykolysen och glukoneogenesen är aldrig aktiva samtidigt. För att kunna kontrollera processerna separat så skiljer de sig åt lite. Ange ett kontrollsteg i början av respektive process och beskriv hur processerna skiljer sig åt i dessa steg. (2p) b) Under vilka förhållanden bildas ketonkroppar och varför? (2p) c) Fettsyrasyntas är ett enzymkomplex som katalyserar många av reaktionerna i fettsyrasyntesen. i) Vad finns det för fördel med att många enzymaktiviteter är samlade i ett komplex? (1p) ii) Beskriv schematiskt fettsyrasyntasets tre domäner och vad respektive domän har för funktion. (3p) d) Kontroll av de metabola processerna är rigorös. Vilket enzym är viktigast för att kontrollera fettsyrasyntesens hastighet, varför just detta och hur bör detta enzym reagera på halten ATP/ADP? (2p) 6. a) Fosforyleringar är viktiga kovalenta modifieringar för att kunna kontrollera enzymaktiviteter. i) Ange två aminosyror som kan fosforyleras? (1p) ii) Hur kan en fosforylering ändra ett enzyms aktivitet på ett drastiskt sätt? Ange minst två sätt. (2p) b) Skissa schematiskt på signaltransduktionen från en aktiverad receptor till fosforylering av ett enzym. (2p) c) Beskriv de två huvudsakliga strukturella skillnaderna mellan DNA och RNA förutom att DNA är dubbelsträngat och RNA enkelsträngat. (1p) d) Vilken funktion har tRNA och vilka antikoder bär en tRNA-molekyl för isoleucin? (2p) e) Hur startar respektive avslutas translationen? (2p) Lösningsförslag: 1. a) Nettoladdning = 0 b) i) Edmandegradering ej 100% så efter 30-40 klyvningar omöjligt att identifiera specifik aminosyra. ii) Kymotrypsin klyver C-terminalt om stora opolära sidokedjor, i detta fall Phe. c) i, iv, vi .Övriga straffar ut sig pga: Pro, 2 eller flera grenade vid beta-kolet intill varandra, 2 eller flera med samma laddning intill varandra. 2. a) Förslagsvis A280nm på y-axeln och fraktionsnummer på x-axeln. Separation efter storlek – störst först. b) Dimert protein bestående av 2 lika stora subenheter. c) i) stor negativ påverkan då Met mycket större än Gly ii) Alt 1: Liten påverkan då snarlika sidokedjor, Alt 2: Negativ påverkan då utbyte av aminosyra direkt inblandad i katalysen. iii) Liten påverkan då snarlika sidokedjor iv) ex. något stort opolärt eller Pro. Liten påverkan – Gln 3. a) i) Enzymer som ändrar konformation (och därmed funktion) då någon regleringsmolekyl binder in dock inte till aktiva ytan. ii) Specialfall av allosterisk kontroll där regleringsmolekylen är slutprodukten i en reaktionskedja och med sin inbindning inaktiverar enzymet. iii) zymogen = en inaktiv enzymform som aktiveras genom klyvning av den egna polypeptidkedjan. b) i) Reaktionen går ej ii) Jämviktskonstanten (K) för reaktionen är mindre än 1 eller jämvikten är förskjuten mot vänster. c) Referenstillståndet inom biokemin ändrad till pH 7 (dvs [H+] = 10-7 M, annars är ju koncentrationen 1 M vid standardbetingelser, dvs pH = 0). d) En serie av reaktioner där reducerade föreningar oxideras i närvaro av syre och ATP genereras från ADP och Pi. 4. a) i) ubiquinon (Q) – oxidativ fosforylering = andningskedjan ii) dihydroxyacetonfosfat - glykolysen iii) malat - citronsyracykeln iv) succinylCoA – citronsyracykeln b) i) (malat)dehydrogenas ii) (hexo)kinas c) ATP = adenosintrifosfat. Molekylen är så energiinnehållande för trifosfatdelen innehåller 4 negativa laddningar i omedelbar närhet av varandra. Det ”kostar” alltså väldigt mycket energi att hålla samman molekylen och denna energi kan frisättas då molekylen omvandlas till ADP resp. AMP. d) i) Laktatet omvandlas tillbaka till pyruvat då situationen normaliseras och fortsatt nedbrytning kan ske i citronsyracykeln. ii) Anaerobt: 2 ATP genom substratnivåfosforylering Aerobt: 2 ATP genom substratnivåfosforylering + 3∙2 ATP från 2 NADH = 8 ATP. Anaerobt bildas alltså ¼ så mycket energi = 25% av vad som bildas vid aeroba förhållanden. e) Protonpumpning från matrix till mellanmembransutrymmet då elektroner från NADH och FADH2 vandrar genom elektrontransportkedjans proteinkomplex samt reaktionen 4H+ + O2 + 4e- 2H2O då elektronerna ges till syrgas vid proteinkomplex IV. Protongradienten driver ATP-syntesen via ATP-syntas. 5. a) Pyruvat Fosfoenolpyruvat Pyruvat fosfoenolpyruvat är det första steget i glukoneogenesen och det sker i två steg (Pyruvat oxaloacetat och oxaloacetat fosfoenolpyruvat) och katalyseras av olika enzymer. I glykolysen utgör reaktionen fosfoenolpyruvat pyruvat det sista steget och katalyseras av ett annat enzym. Reaktionerna glukos glukos-6-fosfat och fruktos-6-fosfat fruktos-1,6bisfosfat inleder glykolysen och katalyseras av olika enzymer. b) Ketonkroppar bildas då vi bryter ner för mycket fett relativt kolhydrater. Då koncentrationen acetylCoA blir hög kan dessa börja reagera med varandra varvid acetoacetat och aceton bildas. c) i) Syntesen blir effektivare i och med att den blir koordinerad och samordnad och risken förbireaktioner minskar. ii) Kondensationsenheten: Sammanslagning av den växande fettsyran med ny malonylCoA varvid CO2 avgår. Reduktionsenheten: Katalyserar reduktionsreaktionerna samt dehydratisering Tioesterasenheten: Frisätter fettsyran när den är 16C lång. d) Enzymet är acetylCoAkarboxylas som katalyserar bildande av malonylCoA vilket är en förutsättning för hela fettsyrasyntesen. Enzymet bör stimuleras om [ATP] är hög och hämmas om [ATP] är låg. 6. a) (i) Aminosyror med hydroxylgrupper; Thr, Ser, Tyr (ii) -Fosforylering två negativa laddningar införs i strukturen de elektrostatiska interaktionerna inom proteinet störs ändrad proteinstruktur AKTIVITETEN PÅVERKAS -En fosfatgrupp kan bilda tre eller flera vätebind-ningar förändrad struktur AKTIVITETEN PÅVERKAS -ATP är donator av fosfatgruppen energi tillförs jämvikten mellan proteinets olika konformationer kan förskjutas AKTIVITETEN PÅVERKAS b) Receptorn aktiveras aktivering av ett G-protein. G aktiverar adenylatcyklas cAMP bildas. cAMP aktiverar proteinkinas A genom att binda till de regulatoriska enheterna varvid de katalytiska enheterna frigörs och kan fosforylera andra enzymer. c) -DNA innehåller kvävebaserna C, T, A, G medan RNA innehåller C, U, A, G -I DNA är sockret deoxyribos och i RNA ribos. d) tRNA hämtar en aminosyra i cytosolen och bär den till ribosomen där tRNA interagerar med mRNA och ser till att rätt aminosyra hamnar i rätt position i proteinet. Antikoder på tRNA för Ile; 5’-AAU-3’, 5’-GAU-3’, 5’-UAU-3’ e) Translationen startar med startkoden AUG till vilken en formylmetionin binds. Start-AUG skiljs från internt AUG genom att det föregås av en s k SHINEDALGARNO-sekvens. Translationen avslutas då en av stoppkoderna (UAG, UGA, UAA) exponeras i A-sitet. Till dessa binder en s k ”release”-faktor med associerad vattenmolekyl som kan göra en nukleofil attack på bindningen mellan tRNA och den C-terminala aminosyran vilket ledet till frisättning av den färdiga polypeptidkedjan.