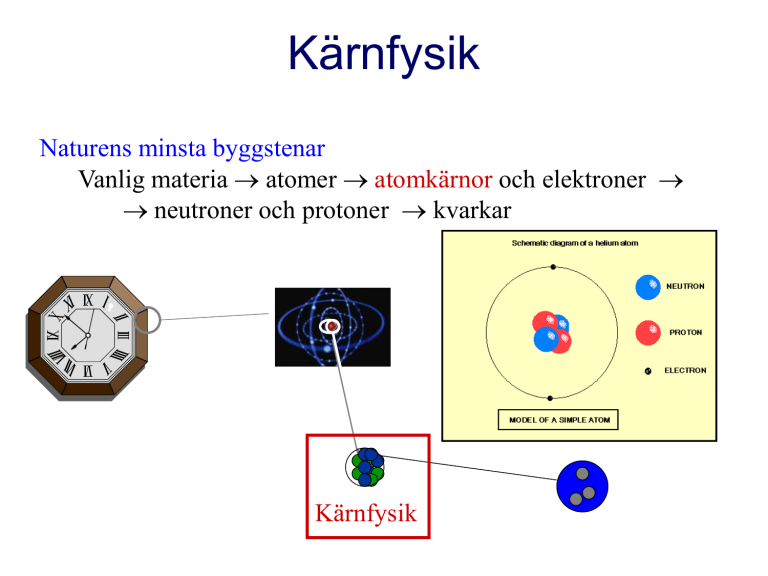
Kärnfysik
Naturens minsta byggstenar
Vanlig materia atomer atomkärnor och elektroner
neutroner och protoner kvarkar
Kärnfysik
Atommassor
Atommassor är mycket små. Därför använder man en egen
atommassenhet som har fått symbolen u. Enheten u definieras
som 1/12 av massan för nukliden 12C.
u = 1,66∙10-27 kg
Atomkärnan
En atomkärna består av ett antal neutroner och protoner,
dessa kallas tillsammans kärnpartiklar, eller nukleoner.
Partikel
Neutron
Proton
(Elektron
Laddning
0
+e
Massa
1,008665 u
1,007276 u
+ +
+
+ +
+++
+
++ +
1u = 1,66·10-27 kg
5,485799·10-4 u)
-e
• Antalet protoner betecknas Z och kallas atomnummer.
• Antalet neutroner betecknas N.
• Antalet kärnpartiklar betecknas A och kallas masstal.
En specifik kärna betecknas:
Periodisk tabell
A
27
13
Al
Kemisk beteckning
Z
Exempel på atomkärnors storlek
Obs! Kärnpartiklarnas
placering i kärnan är
inte statisk, de rör sig
hela tiden kring varandra.
Dessutom är det en grov
förenkling att representera
kärnpartiklarna som
”små bollar”, vad vi
egentligen känner är
deras vågfunktioner, dvs
en sannolikhet att hitta
dem på olika platser.
Atomkärnan
Utgör ca 11%
av naturligt
Magnesium
Kärnor med samma antal protoner, men olika antal
neutroner kallas för isotoper, t ex: Utgör ca 10%
24
12
Mg
Utgör ca 79%
av naturligt
Magnesium
25
12
Mg
Kärnpartiklarna hålls i kärnan
ihop i en sfärisk form.
Kärnans radie ges av
r r0 A1/3, r0 1,2·10-15 m
av naturligt
Magnesium
26
12
+ +
+ +
+ +++ +
++ +
2r
Mg
Den starka kärnkraften
Vad får neutroner och protoner att hålla samman i en atomkärna?
Det finns en elektrostatisk repulsion mellan protonerna.
Den kraft som håller samman atomkärnan kallas för den
starka kärnkraften och är en av de 3 fundamentala krafterna
i naturen (de andra är gravitation och elektrosvag kraft).
Den starka kärnkraftens exakta form är ej känd, men följande
egenskaper är välkända:
• Oberoende av laddning (i stort sett).
• Kort räckvidd, ca 10-15 m.
• Beror på kärnpartiklarnas spinn.
Bindningsenergi
Två empiriska fakta leder oss till begreppet bindningsenergi
• För att frigöra en kärnpartikel från en atomkärna så
måste energi tillföras (kärnpartiklarna hålls samman
av den starka kärnkraften som måste övervinnas).
• För en given atomkärna så är summan av de individuella
kärnpartiklarnas massor större än kärnans massa.
+++
+
++++++
++
+ bindningsenergi
Bindningsenergi = m c2
+ +
+
+
+
+ + + +
+ +
+
Skillnaden i massa Δm = mefter-mföre
kallas för massdefekt
För att få en bekväm omvandling mellan atommassenheten u
och eV (tänk på att massa = energi) kan vi beräkna
massenergin hos 1 u.
1 u = 931,49 MeV
Bindningsenergi
• Ju större bindningsenergi en atomkärna har, ju svårare är
det att sönderdela den.
• För att kunna jämföra olika
atomkärnor brukar man
presentera massan per
nukleon som funktion
av masstalet.
Figuren visar att vi kan
vinna energi genom att
slå ihop lätta kärnor (fusion)
eller genom att sönderdela
tunga kärnor (fission).
Bindningsenergi
Exempel:
Bestäm bindningsenergin för tritium (= 31H).
Lösning:
Tritium består av två neutroner och en proton. Deras sammanlagda massor
är (inkluderande elektronmassor)
mindv 2·1,008665 + 1,007824 = 3,025154 u
Masskillnaden blir
m = mindv - mtritium 3,025154 - 3,016050 = 0,009104 u
Bindningsenergin blir (1u 931,5 MeV)
’Bindningsenergi’ 931,5 · 0,009104 = 8,480 MeV
Bindningsenergin per nukleon blir
’Bindningsenergi’/A 8,480 / 3 2,827 MeV
Naturligt förekommande kärnor
Balansen mellan den starka kärnkraften,
med dess korta räckvidd, och den
elektrostatiska repulsionen mellan
protonerna, gör att atomkärnor endast
existerar naturligt för vissa givna
kombinationer av antalet neutroner
och protoner.
Vissa kärnor i naturen är instabila
och bryts spontant upp i delar.
Radioaktivitet
Sönderfallskedjor
• När en radioaktiv
kärna sönderfaller
så är ofta den nya
kärnan också
radioaktiv.
• Därför finns det
sönderfallskedjor,
dessa slutar på en
stabil kärna.