TESTIKELCANCER
advertisement

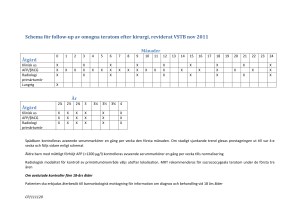
TESTIKELCANCER Olof Ståhl Onkologen, SUS T E S T I K E L C A N C E R Greek όρχις orchis, meaning "testicle“ from the appearance of the paired subterranean tuberoids (an underground storage organ formed by the swelling of a root; occurs in many orchids) SWENOTECA • Sedan 1981 • Binationellt- hela Norge sedan 2008 • Behandlingsprotokoll • SW I-SW IX, nu gällande SW VIII (NS) och SW IX (S) • Register: Non-seminom sedan 1995 • Seminom sedan 2000 • Svenska testikelcancerregistret 2009 • Extragonadala fr o m 2016 • Gemensamt fr o m 2016 • SWENOTECA • Behandlingsprotokoll och studier • Register • Sammanställning av data- publikationer • Diskussionsgrupp för kniviga fall • Arbetsgruppmöten • Årsmöte Registrets huvudsyfte • Ge underlag för optimalt omhändertagande av patienter med TC. • TC utgör en liten tumörgrupp med mycket skiftande sjukdomspanorama. • Inte ens vid ett stort regionsjukhus finns tillräcklig erfarenhet eller möjlighet att samla den kunskap som erfordras för ett optimalt omhändertagande av den enskilde patienten. • Ett nationellt samarbete och tillgång till detaljerat kvalitetsregister är nödvändigt. Bakgrund • 7 /100 000/ år, 40 % ökning senaste 20 åren • 95 % könscellsursprung • 60 % seminom, drygt 40 % non seminom • Viss ärftlighet, 1-3 %, 3-12 ggr ökad risk hos bror • Okänd etiologi • Geografisk variation Testicular dysgenesis syndrome Skakkebæk et al Human Reproduction 2001 Geografisk variation, ökande incidens www-dep.iarc.fr/NORDCAN/SW/frame.asp Testikelcancer debut • Växande, hård testikel • 30-50 % ”pain in the pang” • Generaliserad sjukdom Ryggsmärta • Gynekomasti • Testistumör – vad visade utredningen? Germinalcellstumörer 95 % • Seminom 60 % - stad I: 85% • Nonseminom 40 % embryonal cancer, choriocarcinom (βhCG), gulesäckstumör (AFP), teratom, blandtumörer - stad I: 60 % - stad II-IV: 40 %, (50 %, 5 %, 45 %) Leydig/Sertolicellstumör, Lymfom 5% Utredning testikeltumör • U-ljud Från Till Tid Misstanke Beslut välgrundad misstanke eller ej 5 kalenderdagar Välgrundad misstanke – remiss mottagen 1 kalenderdag • Markörer- AFP, β-HCG ochBeslut LDvälgrundad misstanke • Om misstanke om tumör • Spermienedfrysning • Orchiektomi + biopsi Välgrundad misstanke – remiss mottagen Första besök i specialiserad vård (block 5 kalenderdagar A) Första besök i specialiserad vård (block Orkidektomi (block C) A) 7 kalenderdagar Orkidektomi (block C) MDK (block D) 10 kalenderdagar MDK (block D) Information om diagnos/utredningsresultat (block E) 1 kalenderdag • Sjukdomsutbredning Information om diagnos/utredningsresultat (block E) • CT thorax, buk • Postop markörer Information om diagnos/utredningsresultat, spridd • Ev CT skalle (skyhöga markörer sjukdom (block E) • Massiv lungmetastasering) Information om diagnos/utredningsresultat, spridd sjukdom (block E) Besök hos onkolog för upprepad 10 kalenderdagar stadieindelning, expektans eller information om adjuvant behandling* Start av första behandling, läkemedel 7 kalenderdagar Start av första behandling, strålbehandling 14 kalenderdagar S:N född 1989 • Tidigare frisk • 4/10 Inlagd • Vänstersidiga buksmärtor med ischiasinslag • Hydronefros med kreatininpåverkan • Trombos i v iliaca com • Urologkonsult- JJ-stent • Kärlkonsult- LMWH • Biopsi, prel. svar 18/10 • AFP 12000, tas först den 20/10! Markörer • normala markörer utesluter inte testikelcancer • seminom med förhöjt AFP klassificeras som icke-seminom oavsett histologi • diagnostisera ockulta tumörer utan synliga metastaser (Mk+) • prognostiskt och för att följa behandlingseffekt ffa vid avancerat icke-seminom • tidig upptäckt av recidiv vid uppföljning Stadieindelning CS I: markörnegativ postorchiektomi och ingen extratestikulär sjukdom CS Mk+ :kvarstående markörer, ingen påvisbar extratestikulär sjukdom CS II: Abdominell lymfadenopati • IIA < 2cm • IIB-D 2-5 cm, 5-10, > 10 cm CS III: Körtlar ovan diafragma CS IV: extralymfatisk metastasering Enligt RMH (Royal Marsden hospital classification) Tveksamma körtlar skall utredas ! Kliniskt stadium II A markörnegativ: • Observationsperiod 8 veckor om inte biopsi verifierar metastas beta-HCG var 14:e dag Klinisk stadieindelning 2: 8 v från op : • CT! • AFP, beta-HCG, LDH, (and PLAP) PET-CT kan bidra med information men ej pålitligt vid små körtlar • Om PET-CT visar ökat upptag: biopsera om möjligt Om fortsatt tveksamhet efter 8 v: ytterligare obsperiod, eller eventuellt laparaskopisk kirurgi Behandling skall inte påbörjas utan att metastatisk sjukdom är otvetydig (tillväxt eller positiv biopsi) Kliniskt stadium 2011-2015 per tumörtyp. FÖRDELNING AV SEMINOM OCH NONSEMINOM I KVALITETSREGISTRET ÅR 20112015. SWENOTECA FRAMGÅNG Totalöverlevnad per tumörtyp under perioden 2005-2014. Totalöverlevnaden 5 år efter diagnos 97.5 % Behandlingsprinciper stadium 1 • Alla botas • Adjuvant behandling eller ej? • Typ av adjuvant behandling Cytostatika, 1 eller 2 kurer • Strålbehandling- (seminom) ? • Kirurgi?? • • SWENOTECA: Patientval, ”patient autonomy” Ex: Personalizing, not patronizing: the case for patient autonomy by unbiased presentation of management options in stage I testicular cancer Oldenburg et al, Ann Oncol.2015 May;26(5):833-8 •Benmärgstoxicitet •Alopeci •Trötthet, illamående •Hörselpåv •Perifera neuropatier •Lung och hudbiverkn •Infertilitet •Testosteronsvikt Non-seminom • Embryonal cancer, choriocarcinom, teratom, yolk sac, mixed tumour • 25-30 år vid diagnos • 50 % generaliserade vid diagnos • Tumörmarkörer AFP 50-70 % • HCG 40-60 % • Behandlingsprinciper Non seminom stad I Swenoteca VI • Inga metastaser, normaliserade markörer • Ny stadieindelning 6-8 veckor efter den första +/- kärlinväxt +/- adjuvant BEP x 1 Riskadapterad behandlingnon seminom stad I • Slutgiltig stadiumindelning med normal CT och markörer efter 6 veckor • Vasc (+) patienter 50 % risk för recidiv (ca 25 %) • Adjuvant behandling rekommenderas • Vasc (-) patienter 10-20 % risk för recidiv • Patienten får välja 1995-2005 Populationsbaserad 360 norrmän och 618 svenskar, totalt 978 patienter Median FU 5.3 år 31.5 % vasc (+) 68 % vasc (-) 0.4 % osäkert Resultat- total överlevnad NS CS I 1.0 97.3% (K-M) 0.9 Probability of Survival 0.8 0.7 Ingen död i cancersjukdom, 1 död i lungemboli i samband med recidivbehandling 0.6 0.5 0.4 0.3 0.2 0.1 00 1 2 3 4 5 6 Follow up i years 7 8 9 10 11 Resultat efter 1 BEP Median FU 8.7 år Vasc (–) ,n= 255, 1.6 % Vasc (+), n= 258, 3.2 % Riskreduktion 90-95 % Andel patienter med non-seminom i kliniskt stadium I som erhållit adjuvant behandling under perioden 2010-2014. 55 % adjuvant behandling Väst endast 28 % variation enl. vårdprogram Seminom • Ren könscellstumör • Ökar i incidens • 30-40 års åldern vid diagnos • 85 % stad 1 eller IIA • tumörmarkörer: • HCG (20-30 %) PLAP ( 50- 60 %) obs AFP negativitet Swenoteca VII-Seminom sedan 2007 • Riskadapterad tumör≥ 4 cm • Inväxt i rete testis • • Låg risk= 0-1 riskfaktorer • Rekommenderas surveillance • Högrisk= 2 riskfaktorer • Rekommenderas 1 kur adjuvant karboplatin Riskfaktorer vid seminom stadium I: tumörstorlek >4 cm, inväxt rete testis Surveillance 4% 15.5 % Karboplatin AUC7 x 1 2.2 % 9.3 % Kaplan-Meyer curves for cumulative freedom from relapse (FFR) for (A) patients managed by surveillance (p=0.000), and (B) patients receiving one course of carboplatin AUC7 (p=0.001). Both compared according to the presence of risk factors. Swenoteca VII Tandstad et al, Ann Oncol.2016 Jul;27(7):1299-304 ABC-studien seminom CS I med riskfaktorer Rational • Relativt hög recidivfrekvens i SWENOTECA V & VII hos patienter med riskfaktorer • Utmärkt effekt med BEP x 1 för nonseminom stad I Endpoints • Primary endpoint: • Relapse rate • Secondary endpoints: Toxicitet akut • Långtidsbiverkningar • QoL • Total överlevnad • Vi tar en Behandling av metastatiskt nonseminom Bråttom? 13 /7-06 24/7-06 28/7-06 Figur 38. Dagar från orchiektomi tills start av cytostatikabehandling för non-seminom och seminom 2012-2013 uppdelat per prognosgrupp. 75 % av pat. i intermediär eller dålig prognosgrupp startar behandling inom 10 dagar efter orchiektomi SWENOTECA IV NSGCT, CS II – IV Behandlingsintensitet styrd av effekten av föregående kemoterapi. Effektmått är markör t1/2. Bedömning av respons • Tumörmarkörer: 2540 • Analyseras 1g/v under de första 2 BEP: AFP decline 1280 640 320 • Good response: • t½ AFP < 7 dagar och HCG < 3 dagar • Markör negativ: tumörminskning ≥ 25% • Poor response: • t½ AFP > 7 dagar och/eller β- HCG > 3 dagar • markör negativ: tumörminskning < 25% 160 Poor 80 40 20 Good 10 5 Day 15 22 29 36 43 50 57 64 71 Avancerad NSGCT – SWENOTECA IV Primär behanding lika för alla BEP × 2 Markör t½ tillfredsställande Markör t½ fördröjd BEP x 2 Intensifieringssteg 1 tillägg av ifosfamid Kirurgi Vital cancer PEI x 2 Markör t½ tillfredsställande PEI x 1-2 Kirurgi Vital cancer Stamcellsskörd Markör t½ fördröjd ev. kirurgi Intensifieringssteg 2 Högdosbehandling med stamcellsstöd × 2 Given behandling 29 (5%) 110 (18%) 464 (77%) Högdosbehandling med stamcellsstöd Tillägg av ifosfamid (BEP-if, PEI) BEP Generaliserad sjukdom – IGCCCG prognostiskt index • Good prognosis : • Testikulär eller retroperitoneal primärtumör • Ingen extrapulmonell metastasering • AFP < 1000 kIU/l och HCG< 5000IU/L, LD < 1.5x N • Alla seminom utan extrapulmonell visceral metastasering • Intermediate prognosis • Testikulär eller retroperitoneal primärtumör • Ingen extrapulmonell metastasering • AFP ≥ 1000 ≤ 10000 och HCG ≥ 5000 ≤ 50000 eller LD ≥ 1.5x N ≤ 10 x N • Seminom med extrapulmonell metastasering • Poor prognosis • Mediastinal primär eller • AFP > 10 000 eller HCG > 50000 eller LD > 10x N och NS • extrapulmonell visceral spridning och non seminom Behandlingsintensitet för patienter som blev tumörfria efter primärbehandling (prognostisk gruppindelning enligt IGCCCG) God prognos n=395 (65%) Standard BEP Ifosfamid tillägg Högdosbehandling Intermediär prognos n=114 (19%) Dålig prognos n=94 (16%) Totalöverlevnad Totalöverlevnad metastatiskt nonseminom 602 patienter, 1995-2003, median FU 72 mån, > 90 % > 3 års FU 10-år Alla patienter 90% God prognos 95% Intermediär prognos 90% Dålig prognos 67% SWENOTECA VIII Non-seminoma clinical stage Mk+, IIA marker positive – stage IV, Good prognosis BEP x 2 Response evaluation* t½ on time t½ delayed go to intermediate BEP x 1 Response evaluation t½ on time t½ delayed go to intermediate ±RPLND and other tumour resection No vital cancer FU Vital cancer PEI x 2 *Primarily Mk- at final staging: If radiological regression after 2 cycles is < 25% surgery Marker progress: see protocol for alternative strategies ReevaluateSanctuary met? (brain, bone) Other testis? Consider surgery RPLND if not CR (<1 cm) Other residual tumours should be resected if possible. Intermediate and poor prognosis SWENOTECA IV Intermediate Poor prognosis prognosis Testikulär Mediastinal eller primärtumör retroperitoneal primärtumör och eller inga icke-pulmonella icke-pulmonella viscerala viscerala metastaser metastaser och eller någon någon ”intermediär” “poor” marker markör AFP 1000 >10 000 - 10µg/L 000 µg/L ßHCG 5000 >50 000 - 50IU/L 000 eller IU/L LD 1.5 >10xxNN- 10 x N Intermediate prognosis (19 %) Antal 114 OS 10 år 90% (good prognosis 95% p=0.066) CSS 10 år 92% (good prognosis 96% p=0.045) Poor prognosis (15 %) Antal OS 10 år CSS 10 år 94 67% 68% p.g.a ”poor marker” 38 (40%) 82% 82% metastasutbredning (extrapulmonell visceral) 56 (60%) 58% p=0.032 60% SWENOTECA VIII Testicular non-seminoma Patients with intermediate prognosis and patients with poor prognosis due to “poor markers” only and no non-pulmonary visceral metastasis Marker t ½ on time: AFP ≤7 days ßHCG ≤3 days Marker t ½ delayed: AFP >7 days ßHCG >3 days BEP x 2 response evaluation delayed t½ on time BEP x 1 marker evaluation Stem cell harvest delayed PEI x 1 Stem cell harvest (if not performed) t½ on time BEP x 1 response evaluation * Surgery: PR marker neg Marker pos and t½ on time Marker slightly increased and stable (so called tail) No surgery: CR PR marker pos and t½ delayed: TIPx2 or HD, see page xx PD: individual treatment, discussion within SWENOTECA BEP-if x 1 * t½ on time PEI x 1 response evaluation FU HD 1 w stem cell support * ±RPLND ±resection of other rest tumors (see page xx) No vital germ cell cancer Response evaluation delayed Vital germ cell cancer TIPx2 FU HD 2 w stem cell support ± RPLND ± resection of other rest tumors FU Progress: Individual treatment Discussion within SWENOTECA SWENOTECA VIII Testicular non-seminoma poor prognosis Patients with non-pulmonary visceral metastasis Marker t ½ on time: AFP ≤7 days ßHCG ≤3 days BEP x 2 response evaluation Marker t ½ delayed: AFP >7 days ßHCG >3 days t½ on time BEP x 1 marker evaluation delayed Stem cell harvest delayed BEP x 1 response evaluation t½ on time TIP x 1 response evaluation * Pats. treated with BEP Vital germ cell cancer TIPx2 FU TIP x 1 Stem cell harvest (if not performed) t½ on time * Surgery: PR marker neg Marker pos and t½ on time Marker slightly increased and stable (so called tail) No surgery: CR PR marker pos and t½ delayed: TIPx2 or HD, see page xx PD: individual treatment, discussion within SWENOTECA TIP x 1 Response evaluation delayed HD 1 w stem cell support * ±RPLND ±resection of other rest tumors (see page xx) Pats. treated with TIP No vital germ cell cancer Vital germ cell cancer HD 2 w stem cell support ± RPLND ± resection of other rest tumors FU FU Individual treatment Discussion within SWENOTECA Progress: Individual treatment Discussion within SWENOTECA Responsevaluering • Följ markörer enligt halveringstid- glöm inte din kurva! • CT thorax buk efter cykel 2 och 3 • Om MK(-) och > CSIIA och radiologisk regress <25%: RPLND Progressiv sjukdom under behandling Om markörer stiger under behandling (ej surge) Uteslut: • Sanctuary site- hjärna, skelett • Kontralateral testikel • Överväg kirurgi för att bedöma tumörkomponenter Postkemo restsjukdom • Non-seminom • All synlig residual sjukdom ska reseceras om möjligt. • Om bilaterala rester i lungor, och kirurgi från ena lungan visar nekros, kan andra sidan sparas • Seminom • Resttumör < 3cm följes • >3 cm eller växande, PET och ev.resection Histologi ”Histology of residual masses after firstline chemotherapy will show necrosis, mature teratoma, and vital cancer in about 50%, 35% and 15% of patients, respectively.” Benignt Teratom Cancer 12% 32% 56% Tilläggsbehandling postkemo & kirurgi • Endast nekros eller teratom- färdigbehandlad • Om vitalcancer 2 cykler PEI som konsoliderande behandling adjuvant. Om minimalt fokus av vital cancer och radikal kirurgi, kan man överväga att skippa konsoliderande kemo. Figur 40 . Totalöverlevnad per diagnos och prognosgrupp, patienter med spridd tumörsjukdom. Non-seminom: God: 98 % Intermediär: 93 % Dålig: 74 % Seminom: God: 97 % Intermediär 73 % (19 pat) SALVAGEBEHANDLING RECIDIV AV TIDIGARE BEHANDLAD METASTATISK SJUKDOM SWENOTECA VIII Prognostiska faktorer recidiv • 1984 patienter som progredierade efter 1:a linjens behandling för metastatisk sjukdom •SWENOTECA bidrog med data •Målet var att identifiera prognostiska faktorer som korrelerade till överlevnad Prognostiska Faktorer Salvage IGCCCG-2 score Prognostiska Faktorer Salvage IGCCCG-2 score SWENOTECA VIII • Patienter i IGCCCG-2 “low risk” ser inte ut att ha vinst av högdos som första salvage behandling • TIP har visat god effekt for “low risk” gruppen • De andra grupperna synes ha en vinst av att få högdos som första salvage behandling Uppföljning There is no such thing as a free lunch ! Seneffekter • Lång uppföljning • Drog och dosberoende • Stor individuell variation Seneffekter – sjukdom och behandling • fertilitet • hypogonadism • metabolt syndrom & hjärt-kärlsjukdom • sekundärmalignitet Testikelcancer och fertilitet • Sjukdom i sig Skakkebæk et al Human Reproduction 2001 Cytostatika och fertilitet • Stor individuell variation • Standardbehandling temporär azoospermi de flesta återvinner spermieproduktion • 4 cykler BEP ökar risken för bestående azoospermi Drog (kumulativa doser) Förväntad effekt på spermatogenes Cyclofosfamid (10 g/ m2) Prokarbazin (4 g/ m2) Klorambucil (1.4 g/ m2) Melfalan ( 140 mg/ m2) BCNU (1 g/ m2) Cisplatin (500 mg/ m2) Ifosfamid (42 g/ m2) Testikulär stråldos ≥ 2.5 Gy Förlängd eller bestående azoospermi Karboplatin (2 g/ m2) Cisplatin ( ≤ 400 mg/ m2) Doxorubicin (770 mg/ m2) Vinblastin (50 g/ m2) Vinkristin (8 g/ m2) Bleomycin, dacarbazin, epirubicin,etoposide, methotrexate,5-Fu Oxaliplatin, irinotecan, monoklonala ak, tyrosinkinashämmare Övergående azoospermi Tillfälligt nedsatt spermieproduktion Okänd effekt Strålbehandling och fertilitet • > 2.5 Gy - stor risk för sterilitet • Adjuvant RT seminom, ≤ 0.5 Gy till kvarvarande testikel temporär azoospermi/ påverkan på spermieproduktion • Cancer in situ, 16-20 Gy, sterilitet Kirurgi • RPLND- retrograd ejakulation • Nervsparande, uni- eller bilateral? • Risken varierar, upp till 30 % beroende på ingrepp och kirurg • Bilateral cancer • Enukleation, fr. a med tanke på hormonell funktion (< 20 mm, mulitpla biopsier, postop strålbehandling) Hypogonadism • Sjukdom i sig • mikroförkalkningar • Behandlingsorsakat • Cytostatikabehandling ökad risk om > 4 BEP • Strålbehandling Nord et al, Eur. Urology, 2003 Vem ska substitueras? • Manifest biokemisk hypogonadism • Symptomgivande hypogonadism • Trötthet, initiativlöshet • Nedsatt sexuell lust/aktivitet • Erektil dysfunktion • Obesitas? Metabolt syndrom, hypertoni? • Ev avvakta 1-2 år efter avslutad behandling • Resten då? Gränsvärde testosteron, LH? Metabolt syndrom kardiovaskulär sjukdom • Relation till hypogonadism • Ökad risk för: • Hypertoni • Kardiovaskulär sjukdom (≤ dubblad risk) • Metabolt syndrom ( OR ≤ 2.8) • Relaterat till: • Behandlingsintensitet • Störst risk om > 4 BEP eller kemo + strålbehandling Neurologisk och perifer vaskulär toxicitet • Raynaud likn 20-40% Bleomycin, Cisplatin mätbara resp självrapporterade • Hörsel,audiogram • Neuropatier • Parestesier • Tinnitus 20% 20-30% 20-30% 20% Dos Cisplatin Ålder Ökad risk: rökning, dosintensiv regim, >4 kurer, ålder Signifikanta symptom hos 10% Brydoy et al JNCI 2009 ,Glendenning et al Cancer 2010 Metabolt syndrom kardiovaskulär sjukdom • Relation till hypogonadism • Ökad risk för: • Hypertoni • Kardiovaskulär sjukdom (OR 2-3) • Metabolt syndrom ( OR ≤ 2.8) • Relaterat till: • Behandlingsintensitet • Störst risk om > 4 BEP eller kemo + strålbehandling Sekundär malignitet Travis et al, JNCI 2005 • lunga, colon, pancreas, ventrikelcancer • Högre stråldoser än idag • Störst riskökning för ”in field” cancer efter strålbehandling Hemminki et al, Ann Oncol 2010 • 5533 patienter följda i Sverige sedan 1980, (3001 seminom) • 370 second cancers: 6.4% efter seminom 3.2% efter nonseminom • Blåscancerrisk efter nonseminombehandling Sammanfattning av sjukdomsförlopp och behandling • När man fått behandling för testikelcancer kan det efter lång tid dyka upp seneffekter av den givna behandlingen. Dessa seneffekter kan till exempel vara brist på manligt könshormon (testosteron), nedsatt fruktsamhet (fertilitet) samt påverkan på njurar. • Behandlingen kan även ge en liten ökad risk för hjärt-kärlsjukdom. Detta kan yttra sig som förhöjt blodtryck, kärlkramp och förhöjda blodfetter, och du bör avstå från rökning och också försöka undvika övervikt. • Det är bra att du vid kontakter med läkare i framtiden nämner att du varit behandlad för testikelcancer, och denna lapp med information om din genomgångna behandling kan vara till hjälp för dig att komma ihåg. • Du opererades år _________ för testikelcancer av typen: • Seminom • Icke-seminom • Biopsiprov togs även från den friska testikeln • Ingen spridning konstaterades • Spridning konstaterades till _______________, ________________, _________________ • Kompletterande behandling: • Ingen • Kirurgi (förutom operation av den sjuka testikeln) _______________, _______________ Cytostatika (totalt antal behandlingar ______) Strålbehandling Har ni nå’t mot testikelcancer?