Biokemisk Analys och Separationsteknik
advertisement

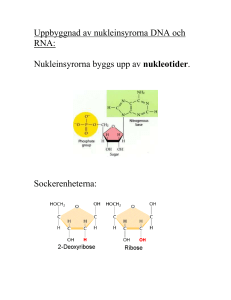
Biokemisk Analys och Separationsteknik Human Protein Atlas Proteinlokalisation i human vävnad Förarbete Produktion och kvalitetskontroll av detektionsreagens - I detta fall antikroppar Biokemisk Analys och Separationsteknik Förarbete - bl a Proteinrening IMAC-rening Analys av renhetsgrad med SDS-PAGE Inbindningsstudier Imaging av cancertumörer mha Affibody-molekyler Biacore-data Immunohistokemi Biokemisk Analys och Separationsteknik Förarbete - bl a Proteinrening IMAC – rening SDS-PAGE - analys Strukturstudier Scanning Electron Microscopy Utveckling av ”spiber” – spindelfibrer Hjälp vid odling av mänsklig hud Biokompabilitet Immunohistokemi Biokemisk Analys och Separationsteknik Koncentrationsbestämning av IgG exempelvis vid autoimmun sjukdom mha Gyrolab Bioaffy assay Förarbete Rening, inmärkning och kvalitetskontroll av detektionsreagens - I detta fall proteinet ”z” Valet av metod Förutsättningarna hos analyten / provet / frågeställningen Exempel: Hur ta Biomarkör från att vara kandidat till klinisk tillämpning? Hur många prover resp. analyter krävs? Vilka tekniker kan över huvud taget användas? Leigh Andersson, PepTalk, San Diego 2007 Kvalitativ och kvantitativ analys (Kap 1.6) Välja metod – vad avgör? Tillgång på utrustning Detektionsgränser metod/prov Antal prover Graden av komplexitet i provet Tänkbara risker metod/prov Kända/publicerade metoder Förutsättningarna hos analyten / provet Graden av komplexitet i provet – Human Plasma som exempel •Human plasma mycket komplext prov. Dock användbart i såväl forskning som diagnostik och monitorering av behandlingsförlopp. Man tror att plasma innehåller kroppens alla proteiner • Extremt dynamiskt fönster! Koncentrationsskillnader i storleksordningen 1012 •Totalmängden protein är ca 100 mg/ml protein, varav Albumin utgör drygt 50% • Upptäkt, validering, diagnostisering, monitorering ställer olika tekniska krav (mg/ml till <<pg/ml) Kvalitativ och kvantitativ analys (Kap 1.6) Metodens kvalitet Reproducerbarhet / precision Noggrannhet – Accuracy Detektionsgräns – LOD – Limit of Detection Analytiskt fönster – Detection range Specificitet – Specificity Selectivitet – Selectivity Robusthet – Robustness Kvantitativ analys (Kap 1.6) Experimentella fel Slumpmässiga eller systematiska Beror på Noggrannhet hos - laboranten instrumentet - metoden Minskas med - Blankprov - Referens - Mer än en metod - SOP Analytens omgivning - Buffertval (Kap 1.4) Önskvärda egenskaper hos en buffert Vattenlöslig Inte giftig Buffertkapacitet vid önskat pH-intervall och temperatur Hög renhet hos ingående kemikalier Ej absorbera UV eller synligt ljus Buffertkapacitet mycket viktig Koncentrations och temperaturberoende Konduktivitets [mS/cm] beroende Analytens omgivning - Modellsystem In vivo modeller (vivus-levande) Man försöker studera händelser i ett “normalt” system hela organismer cellkulturer In vitro modeller (vitrum-glasflaska, glaskärl) Förenklade, cellfria system används för att studera ett visst förlopp cellhomogenat delar av organ Produktion – Odling – Cellkulturer Vad odla Mikrobiella kulturer (jäst, svampar, bakterier) Vävnadskulturer av växter Mammaliecellkulturer Hur odla Batch Fed-batch Kontinuerlig Cellkulturer – att slå sönder cellen Mammalieceller (≈10 µm) är sköra och lätta att slå sönder Växtceller (≈100 µm) har rigida cellväggar, deras storlek gör att de ändå är rel. lätta att slå sönder Bakterier (≈1-4µm) tåliga och ganska svåra att förstöra Grampositiva Gramnegativa Svampar och jästceller är också relativt tåliga Cellkulturer – att slå sönder cellen Metoder för att krossa cellerna (1) Mixa i ”hushållsmaskin” Vävnadsdelar blandas med lämplig buffert. Både för stor och liten skala Krossa tillsammans med slipmedel, sand eller dylikt i en mortel (växtceller och bakterier) Liten skala Glaskulekvarn Mellan och stor skala Tryckförändring French press Liten skala HPH Mellan och stor skala Cellkulturer – att slå sönder cellen Metoder för att krossa cellerna (2) Enzymatiska metoder Lysozyme används för att bryta ner peptidoglycan Gramnegativa bakterier behöver även behandlas med detergent och EDTA (Ca+) Liten skala Lyticase eller zymolyase används till jästceller Kompletteras med osmotisk shock Liten skala Sonikering Ultraljud, >20kHz, skjuvkrafter Liten skala ty hög värmeutveckling Osmotisk shock Cellerna utsätts för hög osmotisk potential och sedan mycket låg, membranet går sönder. Periplasmatiska proteiner Liten och mellan skala Cellkulturer – att få ut proteinet Metoder för att extrahera sitt målprotein (1) Extraktionsbuffert Isoton lösning: jonstyrka 0.1-0.2 M, pH 7-8 Antioxidant, förhindra oxidation av fria S-grupper DTT, b-merkaptoetanol, cystein, GSH Enzyminhibitorer för att undvika nedbrytning av protein/DNA/RNA PMSF, DFP, IAA, Cystatin Låg temperatur (4°C) hämmar också enzymatisk aktivitet Enzymsubstrat – co-faktorer tillsätts för att stabilisera målproteinet EDTA för att förhindra oxidation av thioler, -SH Fällning av fenolinnehållande ämnen – PVP, används till växtceller Natriumazid, lösningar som ska sparas under längre perioder Cellkulturer – att få ut proteinet Metoder för att extrahera sitt målprotein (2) Membranproteiner kräver särskild omtanke: Perifera membranproteiner binder till ytan genom elektrostatiska interaktioner och vätebindningar - Går att få loss genom att öka salthalten (≈1M NaCl) Integrerade sträcker sig genom membranet, långa sekvenser med hydrofoba aminosyror - Detergenter behövs, oftast får man prova sig fram till vad som passar målproteinet (SDS, CTAB, CHAPS, Nonidet-40, Triton-X) Koncentrationsbestämning – ett flertal metoder Absorbansmätning – UV-ljus Peptidbindning l=190 nm Aromatiska sidogrupper l=280 nm Korrektionsfaktor för det önskade proteinet kan användas, förutsätter relativt rent material. Nukleinsyror absorberar också (260nm/280nm) Lowry - Beroende av peptidbindningar och aromatiska aminosyror (Cu2+=> Cu+) BCA - Bicinchoninic acid, liknar Lowry (Cu2+=> Cu+) Bradford - Coomassie Brilliant Blue, binder till arg och lys. Absorbtionsmax ändras vid inbindning. Bra standardkurva nödvändig Aminosyra analys - Provet degraderas till aminsyror och mängden av varje komponent bestäms mha kromtografi. Den mest noggranna metoden. Assays baserade på Immunologiska metoder – ELISA, Gyrolab Bioaffy... – Proteinmängden ofta viktig vid tolkning av resultat! Mikroskopering Olika förstoringsgrader och upplösningar 1 500 ggr (0.2µm) Ljusmikroskopi Faskontrastmikroskopi Polariserat ljus Konfokalmikroskopi 200 000 ggr (1nm) Elektronmikroskopi Transmissions elektronmikroskopi (TEM) (l≈4*10-3 nm) tungmetaller Scanning elektronmikroskopi (SEM) Ny teknik Atomic force mikrosopi (AFM) lateralt 0.5-1 nm, vertikalt 0.1-0.2 nm Mikroskopering Val av metod utifrån studieobjektets storlek 0.1nm 1nm 10nm 100nm 1µm Viruses Small molecules 10µm 100µm 1mm Yeast Bacteria Embryos Globular proteins Ribosomes Plant cells QuickTime™ and a TIFF (Uncompressed) decompressor are needed to see this picture. Organelles Animal cells Electron microscope Light microscope MRI Human eye Confocal microscopy Labeled Antibody binding to the protein HER-2 Subcellular localisation: plasma membrane RT4 Human epithelial urinary bladder carcinoma Elektronmikroskopbild av rER Separation och analys av DNA/RNA Bygger på laddning och storlek. DNA och RNA negativt laddat Aminosyror är optiskt aktiva undantag glycin Aminosyror i proteiner har alltid L-form Aminosyror har flera pKa Glycin katjon zwitterjon anjon pI där aminosyran är oladdad Alifatiska aminosyror Aromatiska aminosyror Laddade aminosyror Polära aminosyror Peptidbindning Peptidbindning Endast ett pKa relevant för de flesta aminosyrorna Undantag är de Noch C-terminala Disulfider stabiliserar proteinstrukturer Primär, sekundär, tertiär, kvartenär