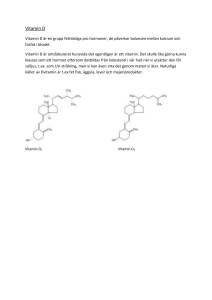
Information från Läkemedelsverket nr 4, 2007
advertisement

Information från Läkemedelsverket Årgång 18 • NummeR 4 • JUNI 2007 Ny behandlingsrekommendation – Behandling av osteoporos........................19 Monoklonala antikroppar – biologiska läkemedel på frammarsch................................4 Foto: Sjöberg Bild Den uppdaterade rekommendationen för behandling av osteoporos har föranletts av bland annat nya läke­medel och läkemedelsberedningar samt ny kunskap om sjukdomen. Syftet med behandlingen av osteoporos har också förskjutits från att förebygga osteoporos i sig, till att förebygga frakturer, det vill säga utvecklingen av manifest osteoporos. Biverkningsnytt................................................. 60 Många av dagens nya läkemedel är biologiska produkter. Utvecklingen av monoklonala antikroppar är ett exempel som illustrerar vägen till effektiva och säkra biologiska läkemedel. Rapporter om leverpåverkan av viktminsknings­ preparatet CUUR Läkemedelsverket har tagit emot sex rapporter om kraftig leverpåverkan hos patienter som använt viktminskningspreparatet CUUR. Farliga ämnen i flera bantningsmedel på Internet.............................................................7 Hyperkalemi av glukosaminpreparat En del glukosaminprodukter innehåller kalium. Risken för hyperkalemi hos vissa patienter bör beaktas. Hälften av de 34 bantningsmedel som Läkemedelsverket och Livsmedelsverket har undersökt innehöll farliga ämnen. Hälso- och sjukvården bör känna till att preparaten används och kan ge upphov till biverkningar. Indikationen primär nattlig enures borttagen för nasala beredningsformer av desmopressin.............................................. 15 Nässpray och näsdroppar som innehåller läkemedlet desmopressin ska inte användas mot säng­ vätning på grund av risken för hyponatremi och vattenintoxikation. Dextropropoxifen – uppföljande rapport över säkerheten 2000–2006 De åtgärder som vidtagits de senaste åren för att stävja problem med överdosering och missbruk av dextropropoxifen har varit framgångsrika, enligt rapporten. Nya veterinärmedicinska läkemedel.......... 66 Draxxin (tulatromycin) Yarvitan (mitratapid) LFN informerar.................................................. 74 Prenumerera på nyheter från Läkemedelsverket www.lakemedelsverket.se 1 Information från Läkemedelsverket NN:2004 Läkemedelsverkets webbplats – www.lakemedelsverket.se Innehåll Observanda Monoklonala antikroppar – biologiska läkemedel på frammarsch........................................4 Ifrågasatt innehåll i bantningsmedel och liknande produkter.................................................7 Om bantningsmedel.............................................12 Indikationen primär nattlig enures borttagen för nasala beredningsformer av desmopressin.........15 Olaglig försäljning av mangostanjuice....................15 Reglerna om utbytbarhet ändras den 1 juli 2007.....................................................16 Hiv-läkemedlet Viracept dras in............................16 Inga belägg för att acetylkolinesterashämmare har bromsande effekt vid Alzheimers sjukdom.......17 Behandling av osteoporos – Behandlingsrekommendation....................... 19 – Bakgrundsdokumentation............................ 30 Hur definieras hög risk för fraktur? Vem bör få behandling för osteoporos?...................................30 Vitamin D............................................................34 Hormonbehandling efter menopaus......................38 Hur länge skall man behandla med skelettspecifika farmaka? ..............................................................44 Behandling med paratyreoideahormon . ...............49 Strontiumranelat (Protelos) til behandling af postmenopausal osteoporose.............................56 Information från Läkemedelsverket Box 26, 751 03 Uppsala Telefon 018-17 46 00 Telefax 018-54 85 66 E-post: [email protected] Ansvarig utgivare: Gunnar Alvan Biverkningsnytt Rapporter om leverpåverkan av viktminskningspreparatet CUUR................................60 Reductil ska inte användas vid graviditet................61 Likartad risk för blodpropp med alla kombinerade p-piller.............................................61 Hyperkalemi av glukosaminpreparat......................62 Dextropropoxifen – uppföljande rapport över säkerheten 2000–2006..........................................63 Läkemedelsmonografier Draxxin (tulatromycin).........................................66 Yarvitan (mitratapid) . ..........................................71 Läkemedelsförmånsnämnden informerar Flera hostmediciner försvinner ur högkostnadsskyddet..............................................74 Begränsad subvention för vaccin mot livmoderhalscancer . .............................................75 Enklare hantering av licensläkemedel föreslås.........75 Snabbguide till LFN:s beslut.................................76 Biverkningsblanketter Biverkningsblankett..............................................77 Vad skall rapporteras.............................................78 Biverkningsblankett för djur..................................79 Rapportering av läkemedelsbiverkningar................80 Redaktion: Fredrik Brounéus, Kristina Bergström, Christina Brandt och Christina Hambn Ytterligare exemplar kan rekvireras från: Kommunikationsenheten, Medicinsk information ISSN 1101-7104 AB Danagårds Grafiska 2007 2 Information från Läkemedelsverket 4:2007 Observanda Prenumerera på nyheter från Läkemedelsverket! Anmäl dig till vår prenumerationstjänst på www.lakemedelsverket.se och få akut och aktuell biverkningsinformation, behandlingsrekommendationer och monografier med mera direkt till din e-postadress. Information från Läkemedelsverket 4:2007 3 Observanda Monoklonala antikroppar – biologiska läkemedel på frammarsch Många av dagens nya läkemedel är så kallade biologiska eller bioteknologiska produkter. Till biologiska läkemedel räknas bland annat rekombinanta proteiner, monoklonala antikroppar, hepariner och vac­ ciner. Den fleråriga utvecklingen av monoklonala antikroppar är ett exempel som illustrerar frågor som måste lösas för att nå målet – effektiva och säkra biologiska läkemedel. Många av dagens nya läkemedel är så kallade biologiska eller bioteknologiska produkter. Banbrytande upptäckter inom immunologin som nu ligger 15–20 år bakåt i tiden, men också en genomgripande teknikutveckling har möjliggjort nya sätt att ”tillverka” denna typ av läkemedel. Läkemedlen kan angripa specifika målmolekyler som identifierats med immunologiska metoder och som spelar en nyckelroll vid utvecklingen av olika sjukdomar. Andelen läkemedel som betecknas som biologiska kommer sannolikt att öka i framtiden och också omfatta nya administrationsformer (exempelvis via inhalation eller dermalt). Till biologiska läkemedel räknas bland annat rekombinanta proteiner, monoklonala antikroppar, hepariner och vacciner. Typiskt är inte bara dessa substansers biologiska ursprung utan också att metoderna som används för framställningen är komplicerade och kräver särskild kvalitetskontroll utöver vad som gäller för vanliga läkemedel. Läkemedelsmyndigheternas farmaceutiska/bioteknologiska granskning av dessa produkter är därför särskilt viktig. Den typ av bioteknologisk produkt som hittills gett flest användbara läkemedel är den monoklonala antikroppen. Den fleråriga utvecklingen av dessa antikroppar är ett belysande exempel på den dynamiska utvecklingen inom detta läkemedelsområde men även på problem som måste övervinnas för att nå målet – ett effektivt och säkert biologiskt läkemedel. Om antikroppar Antikroppar (immunoglobuliner) är proteiner som produceras av immunsystemets B-lymfocyter som svar mot främmande antigen. Antikroppar fungerar som markörer som binder till antigenet så att antigenet kan kännas igen och förstöras av fagocyter. Den del av antigenet som antikroppen binder till kallas epitop. Strukturellt består antikroppar av fyra polypeptidkedjor; två identiska tunga kedjor (H; cirka 445 aminosyror) som sammanbinds via disulfidbryggor, och två identiska lätta kedjor (L; cirka 215 aminosyror) som binds till varsin tung kedja via en disulfidbrygga. Både de tunga och lätta kedjorna består av en variabel region (V) och en (lätt kedja) eller tre (tung kedja) konstanta (C) regioner. De variabla regionerna binder till antigenen och är ansvariga för den enorma diversitet och specificitet som kännetecknar immunoglobuliner. Denna diversitet baseras på rekombination av många gensegment följt av somatiska mutationer. Tre hypervariabla regioner (CDRs) finns i varje VL och VH. VL och VH sammanbinds via kovalenta och 4 Information från Läkemedelsverket 4:2007 icke-kovalenta interaktioner av lätt och tung kedja och CDRs bildar en yta som binder antigenet. Varje antikropp är bivalent och har därför möjlighet att binda två identiska antigen vilket ökar antikroppens affinitet för antigenet. Figur 1. Struktur IgG. De tunga konstanta regionerna, framför allt CH2 och CH3, är inblandade i de funktioner hos antikroppen som inte har att göra med antigenbindning. De binder till komplementfaktorer vilket resulterar i fagocytos eller komplementberoende cytotoxicitet (CDC). De binder också till Fc-receptorer, vilket kan resultera i fagocytos eller antikroppsberoende cellulär cytotoxicitet (ADCC). Polyklonala och monoklonala antikroppar Varje B-cell syntetiserar bara en sorts antikropp, och i en organism finns en hel population av olika B-celler och deras respektive antikroppar som producerats som svar mot antigen som organismen exponerats för. För att vara användbar som terapeutiskt eller diagnostiskt verktyg behövs dock stora mängder av en specifik antikropp. Därför behöver man kunna massframställa B-celler identiska med en enda specifik Bcell. Antikroppar från ett sådant system kallas monoklonala antikroppar, till skillnad från antikroppar från blod eller immuniserade djur, som är polyklonala. Tekniker för att framställa monoklonala antikroppar År 1975 publicerade Köhler och Milstein det arbete som de senare (1984) skulle belönas med Nobelpri- Observanda set för. I detta beskrev de en teknik att framställa kontinuerliga celler som uttryckte en specifik antikropp. Tekniken de använde var följande: Möss immuniseras med ett specifikt antigen och B-lymfocyter isoleras sedan från mössens mjältar. Dessa B-celler blandas med myelomceller (malignt omvandlade plasmaceller). Myelomcellerna kan fås att fusera med olika tekniker som till exempel tillsats av polyetylenglykol, virus eller elektroporering. De fuserade cellerna kallas hybridom. Nästa steg är att selektera för de önskade hybridomen. HGPRT (hypoxantin-guanin-fosforibosyltransferas) är ett enzym som är involverat i nukleotidsyntes från aminosyran hypoxantin. Myelomcellerna är HGPRT-negativa (HGPRT-), medan B-cellerna är HGPRT-positiva (HGPRT+). Kulturen odlas i HAT-medium (hypoxantin-aminopterin-tymidin) som bara tillåter växt av HGPRT+ celler. Myelomceller som fuseras med en annan myelomcell kan inte växa i detta medium. B-celler som fuserar med en annan B-cell kan förvisso växa men kan inte dela sig kontinuerligt, vilket ett hybridom kan, och bara dessa senare celler överlever flera passager. Efter detta vidtar screening för att hitta de celler som uttrycker den önskade antikroppen. Antikroppen odlas sedan vidare antigen via odling in vivo på möss i ascitesvätska eller in vitro i cellkultur. Även andra tekniker har använts för att framställa immortiliserade B-cellinjer. De allra första antikropparna som testades kliniskt och som kom ut på marknaden var framställda på detta sätt och producerades in vivo genom att hybridomen injicerades intraperitonealt i möss och ascitesvätskan tappades av och renades. Även om produkter framställda på detta sätt fortfarande finns kvar på marknaden (till exempel Orthoclone OKT 3), så används inte tekniken i nyare produkter. Detta beroende på djuretiska aspekter samt större risk för virusöverföring jämfört med nyare tekniker. Ett annat bekymmer som tidigt sågs med de murina monoklonala antikropparna var uppkomst av humana antimusantikroppar (HAMA). Denna uppkomst ändrade kraftigt den farmakokinetiska profilen genom att den monoklonala antikroppen eliminerades mycket snabbare och omöjliggjorde upprepad dosering. För att undvika HAMA har man i stort sett helt övergått till konstruktion av chimära antikroppar där de variabla regionerna i antikroppen, cirka 30 %, är av musursprung, medan resten överensstämmer med humana sekvenser, eller till humaniserade antikroppar där bara de hypervariabla regionerna (CDR), cirka 5–10 %, är av musursprung medan resten är av humant ursprung. Ytterligare ett steg har tagits med de humana antikropparna där sekvensen till 100 % överensstämmer med humana antikroppar. Det finns på marknaden idag en produkt med en helt human antikropp, Humira (adalimumab). De flesta produkterna på marknaden idag framställs med rDNA-teknik, där man isolerat genen som uttrycker antikroppen, till exempel från ett hybridom, och överfört denna till en cellinje som uttrycker önskat protein genom odling i normal cellkultur. För att minska risken för virussmitta och annan smitta från mammalieceller har material från däggdjur, exempelvis bovint serum, i princip slutat användas vid sådan framställning. Typer och derivat av monoklonala antikroppar Flertalet av de marknadsförda produkterna är fullängdsantikroppar av typ IgG. Dock kan man också se ett antal andra typer av antikroppsderiverade produkter: • Antikroppsfragment: Fabfragment, enkel-Fvkedje-antikroppar (ScFv) och andra F-fragment och deras multivalenta former är minimaliserade antikroppar, som behåller moderantikroppens antigenbindande förmåga och dess specificitet men inte dess komplementaktiverande funktioner. Sådana antikroppar framställs antingen genom rDNA-teknik eller genom kemisk modifiering av en fullängdsantikropp. • Fusionsproteiner: Ett fusionsprotein uttrycks som ett sammanhållet protein där genen innehåller delar av eller hela den kodande regionen för IgG tillsammans med genen för ett annat protein. • Konjugerade monoklonala antikroppar: Terapeutisk och diagnostisk användning av monoklonaler kan ökas genom kemisk konjugering av en antikropp eller delar av den med till exempel följande: – konjugering av ett toxin eller annat protein för målsökning där mindreterapeutisk dos kan ges beroende på att bara avsedd vävnad behöver exponeras – konjugering av en radioaktiv isotop för radioaktiv märkning för användning vid diagnostiska undersökningar – konjugering med kemisk substans för förlängd halveringstid (exempelvis pegylering) – kemisk bindning av två antikroppsmolekyler eller deras derivat för att skapa en bispecifik antikropp Förutom att användas terapeutiskt eller diagnostiskt används också monoklonala antikroppar ofta som ligander i affinitetskromatografi där ett visst protein selektivt kan bindas till en kolonn medan resten går rakt igenom. Detta har till exempel ofta använts för faktor VIII-preparat. De preparat innehållande monoklonala antikroppar som finns godkända på den svenska marknaden framgår av Tabell I. Information från Läkemedelsverket 4:2007 5 Observanda Tabell I. I Sverige registrerade läkemedel innehållande monoklonala antikroppar. Reg. år 1989 1994 Preparatnamn Aktiv substans Värdcell/typ Indikationsområde Orthoclone OKT 3 Reopro 1997 CEA-Scan (avregistrerat) Tecnemab-K-1 (avregistrerat) Indimacis (avregistrerat) Leucoscan musascites, murin SP2/0-celler, chimär mus/human mushybridom immunosuppression antitrombos 1996 muromonab (anti-CD3) abciximab (anti-GP IIb/IIIa) Fabfragment arcitumomab (anti-CEA) fabfragment antimelanom antikropp 1998 Mabthera rituximab (anti-CD20) Humaspect (avregistrerat) votumumab Simulect basiliximab (anti-IL2-R) Zenapax daclizumab (anti-IL2-R) Synagis palivizumab (anti-RSV) Remicade infliximab (anti-TNF-alfa) Enbrel etanercept (extracellulär ligand-bindande del av TNF-alfa kopplat till human Fc-del från IgG1) trastuzumab (anti-HER2) CHO-celler, humaniserad alemtuzumab (anti-CD-52) CHO-celler, humaniserad adalimumab (anti-TNF) CHO-celler human cetuximab (anti-EGFR) SP2/0-Ag-14 chimär human/mus efalizumab (anti-CD11a) CHO-celler, humaniserad ibritumomab tiuxetan (IgG CHO-celler, murin kappa anti-CD-20Ab kopplat till tiuxetan) bevacizumab (anti-VEGF) CHO-celler, humaniserad omalizumab, (anti-IgE) CHO-celler, humaniserad natalizumab (anti-VLA-4) NS0-celler, humaniserad ranibizumab (anti-VEGF-A) E. coli, humaniserad Fabfragment abatacept (extracellulär domän CHO-celler, Fc-del av humant CTLA-4 kopplat till human human IgG1 Fc-del 1999 2000 Herceptin 2001 MabCampath 2003 Humira/Trudexa 2004 Erbitux Raptiva Zevalin 2005 Avastin Xolair 2006 Tysabri Lucentis 2007 6 Orencia diagnostikum igovomab sulesomab Information från Läkemedelsverket 4:2007 diagnostikum diagnostikum mushybridom, ascites. Fabfragment CHO-celler, chimär mus/human human B-lymfocytcellinje från rektal adenocarcinom SP2/0-celler, mus/ human chimär NS0-celler, humaniserad NS0-celler, humaniserad SP2/0-celler, chimär human/mus CHO-celler diagnostikum för osteomyelit onkologi onkologi immunosuppression immunosuppression antiviral (RSV) kronisk inflammatorisk sjukdom kronisk inflammatorisk sjukdom onkologi onkologi reumatoid artrit onkologi psoriasis onkologi onkologi astma MS neovaskulär åldersrelaterad makuladegeneration reumatoid artrit Observanda Ifrågasatt innehåll i bantningsmedel och liknande produkter Hälften av 34 bantningsmedel som Läkemedelsverket och Livsmedelsverket har analyserat innehöll far­ liga substanser. Bantningsmedlen är inköpta på Internet. Hälso- och sjukvården behöver vara medveten om att dessa okontrollerade bantningsmedel används och kan ge upphov till biverkningar som kanske annars kopplas samman med annan samtidig medicinering. Bakgrund Synefrin har i viss mån ersatt efedrin i bantningsprodukter. Synefrin är ett ämne som till sin struktur liknar efedrin och som liksom efedrin stimulerar det sympatiska nervsystemet och kan ge hjärt-kärlbiverkningar. Även det har tidigare använts vid hypotensiva tillstånd. Synefrin kan utvinnas ur skal och omogen frukt av pomerans (Citrus aurantium). På Internet marknadsförs extrakt från pomerans som uppges innehålla 4–95 % synefrin. Livsmedelsverket har vid upprepade tillfällen varnat för synefrin i bantningsoch sportprodukter. Extrakt från Citrus aurantium med högt innehåll av synefrin finns listat i Livsmedelsverkets vägledning över Växter och växtdelar som är Olämpliga i Livsmedel (VOLM, se artikel om bantningsmedel på Läkemedelsverkets och Livsmedelsverkets webbplatser). I Sverige klassificeras i dagsläget produkter som ger en dygnsdos synefrin som överstiger 160 mg som läkemedel. Extrakt av grönt te finns i många bantningspreparat, som enda beståndsdel eller i kombination med andra beståndsdelar. När det gäller extrakt av grönt te har det vid upprepade tillfällen kommit rapporter om allvarlig leverpåverkan utan att man ännu kunnat fastställa vad i extrakten som åstadkommer detta (1). Även svenska fall har rapporterats (2). I många bantningsmedel ingår koffein, antingen renframställt eller som del i växtextrakt. Koffein kan förstärka effekten av efedrin och synefrin. Usninsyra har orsakat flera fall av allvarliga leverbiverkningar. Ett fall av akut hepatit efter intag av ett hälsokostpreparat som innehåller usninsyra har beskrivits i Sverige (3). Livsmedelsverket har varnat för usninsyra i bantningspreparatet Termoxical. Amfetamin förekom tidigare i läkemedel mot övervikt. Även besläktade substanser, som fenfluramin och fentermin, ingår i läkemedel som är eller har varit godkända för behandling av övervikt i vissa länder. Från andra länder har det förutom om hjärt-kärlbiverkningar på senare år rapporterats om bindvävs­ inväxt i hjärtklaffarna och utveckling av pulmonell hypertension (förhöjt blodtryck i lungkretsloppet) vid medicinering med fenfluramin och fentermin. Andra ämnen som tidigare identifierats i olagligt försålda viktminskningspreparat och på grund av detta bedömdes som lämpliga att analysera är orlistat (som ingår i läkemedlet Xenical) och sibutramin (som ingår i läkemedlet Reductil). Vidare har sköldkörtelhormon tidigare befunnits ingå i bantningspreparat. Bantningsmedel är produkter som kan vara antingen läkemedel eller livsmedel beroende på innehåll, verkningsmekanism, syftet med produkten och vilka påståenden som görs för produkten. Många bantningsmedel regleras under livsmedelslagstiftningen men visst innehåll som till exempel efedrin leder till läkemedelsklassificering. Vissa livsmedel avsedda att användas i energibegränsad kost för viktminskning regleras specifikt i livsmedelslagstiftningen. Det gäller ”komplett kostersättning för viktkontroll” och ”måltidsersättning för viktkontroll” samt så kallade VLCD (very low calorie diets). Dessa produkter, som ersätter vanlig mat, ingår inte i denna studie. De flesta bantningsmedel försäljs till konsumenter utan att först ha genomgått myndighetskontroll. Denna situation har varit incitament till att genomföra den studie vars resultat rapporteras i denna artikel. Syfte Vi ville analysera innehållet av bestämda beståndsdelar som i vissa fall kan utgöra en säkerhetsrisk för konsumenter. Vidare önskade vi ta reda på hur vanligt det är att dessa substanser ingår i bantningsprodukter utan att detta innehåll deklarerats på förpackningen. En annan avsikt med studien var att kartlägga vilka substanser i övrigt som anges ingå i de inköpta preparaten och göra en bedömning av om detta innehåll påverkar säkerheten med produkterna. För analysen har använts modern och kraftfull analysmetodik som tagits fram i syfte att kunna användas också för framtida behov. Metoder Urval av innehållsämnen för analys Efedrin är ett ämne som stimulerar det sympatiska nervsystemet och påverkar hjärt-kärlsystemet, andningsvägarna och centrala nervsystemet. Medicinskt används efedrin främst som bronkvidgande medel vid astma och i hostmediciner. Tidigare har det också använts för att höja blodtrycket vid hypotensiva tillstånd men har numera ersatts av andra substanser. I ”hälsoprodukter” ingår efedrin bland annat för att ge viktminskning och som prestationshöjande medel. Livsmedelsverket har vid flera tillfällen varnat för efedrin i sportpreparat och bantningsprodukter. I Sverige klassificeras sedan den 1 september 2005 alla produkter som innehåller efedrin (efedraalkaloider) som läkemedel. Information från Läkemedelsverket 4:2007 7 Observanda Samtliga dessa substanser kan ge allvarliga biverkningar och är olämpliga att inta för vissa personer. Urval av produkter Inköp av produkter har skett i samband med förfrågningar om klassificering och anmälningar om biverkningar av preparat inköpta på Internet. Rapporter från andra länders myndigheter om produkter har även föranlett inköp. Produkter har också köpts in efter internetsökning på sajter som tillhandahåller viktminskningsmedel, prestationshöjande och kroppsbyggarpreparat. Inköp av de 34 preparat som analyserades laborativt har skett via Läkemedelsverkets rutiner. I ett par fall har inköp av samma produkt gjorts från två olika Internetadresser, nämligen Extra Stark Lepigen och Complete Diet Boost. En produkt, Ephidril, har inköpts via postorder. Av de 46 produkter som beställdes var det tolv som inte inkom till Läkemedelsverket. De produkter som köpts in och analyserats listas i Tabell I. Uppföljning av tillgängligheten ett halvår senare visade att fem av de produkter som analyserats inte längre marknadsfördes hos de tidigare försäljningskällorna. Analysmetoder Samtliga produkter har undersökts beträffande förpackning, utseende, storlek och vikt. Innehållet har analyserats med egenutvecklade metoder med modern och kraftfull analysmetodik (NMR, HPLC, GC, MS). Stickprov av produkterna har jämförts mot referensmaterial för efedrin, pseudoefedrin, synefrin, koffein, fenfluramin, N-nitrosofenfluramin, sibutramin, orlistat, levotyroxin, liotyronin, amfetamin, usninsyra, grönt te, 2,4-dinitrofenol, metylfenidat, hordenin, bergenin och salicin. Halten efedrin, pseudoefedrin, synefrin och koffein bestämdes med NMR och HPLC. Likvärda analysresultat erhölls med de bägge metoderna, vilket visar att resultaten är tillförlitliga. Fenfluramin, N-nitrosofenfluramin, levotyroxin och liotyronin eftersöktes i mycket låga nivåer med GCMS och LC-MS. Resultat Resultaten av NMR- och HPLC-analyserna beträffande efedrin, pseudoefedrin, synefrin, koffein och usninsyra redovisas i tabellen på nästa sida, tillsammans med eventuellt deklarerat innehåll. Typiska mönster i NMR-spektra indikerade innehåll av grönt te för ett tiotal produkter. N-nitrosofenfluramin, fenfluramin och amfetamin (GC-MS), levotyroxin och liotyronin (LC-MS) påvisades inte i någon av produkterna, inte heller orlistat eller sibutramin. De beståndsdelar som valts ut för analys har i flertalet fall deklarerats på förpackningen. Undantag är innehåll av pseudoefedrin. För de flesta beståndsdelarna överensstämmer den angivna mängden på förpackningen med den analyserade mängden. För 8 Information från Läkemedelsverket 4:2007 vissa av produkterna är mängden efedrin/synefrin framräknad från en angiven procentsats av respektive växtextrakt. Efedrinalkaloiderna efedrin och pseudoefedrin har totalt fyra olika stereoisomera former. Analys med kapillärelektrofores påvisade endast de naturligt förekommande formerna, dvs. eventuella föroreningar från de syntetiska formerna påvisades inte. Detta indikerar att efedrin och pseudoefedrin härstammar från växtmaterial och inte är syntetiserade. Efedrinextrakt innehåller i allmänhet både efedrin och pseudoefedrin. I sex av de 34 produkter som analyserades fanns det efedrin. För fem av dessa produkter återfanns uppgift om efedrininnehåll i deklarationen på förpackningen. Även pseudoefedrin återfanns i de sex produkterna varav i en produkt i betydligt högre mängd än efedrin. De produkter som innehöll högst mängd efedrin/pseudoefedrin var Stacker 7 (78 mg per dygn vid maximal dosering) och Extra Stark Lepigen (två produkter: 184 mg respektive 160 mg per dygn vid maximal dosering). Dessa doser är i samma storleksordning som den dos efedrin som rekommenderas för att uppnå bronkvidgande effekt. Synefrin Analyserna visade att elva av 34 produkter innehöll synefrin. Mängderna i de olika produkterna varierade kraftigt. Det är anmärkningsvärt att några produkter med högt synefrininnehåll kan ge ett dagsintag av synefrin som, vid den av tillverkaren rekommenderade doseringen, ligger avsevärt högre än den dosering som rekommenderats kliniskt för synefrintartrat vid hypotensiva tillstånd (100 mg, 3 gånger dagligen). Det är också värt att notera att innehållet av synefrin i vissa produkter angetts som ”bitter orange” (pomerans), det vill säga innehållet av synefrin är maskerat i ingrediensförteckningen. För nio av de produkter som visade sig innehålla synefrin deklarerades ”rent” synefrin, för övriga två deklarerades ”bitter orange”. Grönt te Innehåll från grönt te återfanns i ett tiotal av de analyserade produkterna. Då det inte rör sig om renframställda substanser kan ingen jämförelse av mängd i de olika produkterna göras. Inte heller har det undersökts om innehållet kommer från pulveriserade teblad, indunstat extrakt etc. Koffein Koffein återfanns i varierande mängd i majoriteten av de analyserade bantningsmedlen. Att notera är att rekommenderat maximalt intag av ett av preparaten (Synerlin) ger tillförsel av cirka 1 000 mg koffein per dag enligt analyserna. För ett par preparat ger maximalt dagligt intag omkring 900 mg koffein. Som jämförelse kan nämnas att mängden koffein i en kopp (150 mL) bryggt kaffe kan uppskattas till ungefär 100 mg. 40 0,3 3 20 eph.sin 15 20 eph.sin Funnet Namn Animal Cuts a Complete Diet Boostb Dymetadrine Xtreme Ephidril 600 b Extra Stark Lepigen c Extra Stark Lepigen c Fat Burners Box Fatburner Boost Hoodia gordo­ nii X-strong HydraCut HydroBurn Hydroxy Free Lean Lean Stack Lepigen 4 in1 Lepigen Xstrong Letigen Maxielit Eat and Lose 3 Dekl. Efedrin Produkt 1 20 5 Funnet – – – Dekl. Pseudoefedrin 2 10 105 125 40 Funnet 20 Synefrin 3 8 bitter orange 100 125 50 Dekl. 20 165 140 40 55 70 95 110 95 110 4 50 95 Funnet 165 125 Koffein 200 – 50 55 guarana 100 92 100 100 117 – 117 caffeine Dekl. 200 125 Funnet Usninsyra Dekl. 3 tabl 6 kaps 2 tabl 12 kaps 4 tabl 3 kaps 6 kaps 4 tabl 4 tabl 3 tabl 3 kaps 6 tabl 8 tabl 3 kaps 8 tabl 6 kaps Dekl. max dygnsdos Tabl/kaps 2 påsar a 6 kaps Tabell I. Innehåll av ett urval ämnen i de analyserade produkterna. Halterna är angivna i mg per tablett eller kapsel och är medelvärden av NMR- och HPLC-analys. Kursiv text betyder att angivelsen är framräknad från ett extrakt. Observanda Information från Läkemedelsverket 4:2007 9 10 Information från Läkemedelsverket 4:2007 40 eph.sin 36 ma-huang – Funnet 0,5 35 2d Namn Maxielit Eat and Lose 4 Stacker 2 Fat­ burner Stacker 7 Fat­ burner Syneburn Synephrine Synephrine Dynamite Synephrine Fatburner Synerlin Termoxical Thermal Rage Thermo Stack ThermoShred TrimSpa TX Burn 2d 4 0,2 Funnet – – Dekl. Pseudoefedrin < 0,1 5 50 8 190 370 Funnet Synefrin – 4 bitter orange 30 10 200 500 Dekl. 250 125 20 100 100 190 95 115 40 Funnet 120 Koffein 125 125 44 guarana 100 100 220 koffein kola nut kola nut Dekl. caffeine 10 d Funnet Usninsyra 10 Dekl. 4 tabl 10 tabl 4 kaps 8 kaps 9 kaps 4 tabl 2 kaps 6 kaps 3 kaps 2 tabl 3 tabl 2 kaps 4 tabl Dekl. max dygnsdos Tabl/kaps 6 kaps a Animal Cuts innehåller sex stycken tabletter och tre stycken kapslar per dos förpackade i en liten plastpåse. Varje kapsel respektive tablett har analyserats var för sig; totalhalten per påse redovisas. b Produkten har inköpts från två olika adresser och har analyserats var för sig. Analysen gav samma resultat. c Produkten har inköpts från två olika adresser och har analyserats var för sig. Burkarna var olika men etiketterna lika. Samma tillverkare var angiven på etiketten. Tabletternas utseende skilde sig åt och innehållet visade sig också vara olika. d Halten har endast bestämts med NMR. Dekl. Efedrin Produkt Tabell I. Forts. Observanda Observanda Usninsyra Läkemedelsverkets och Livsmedelsverkets webbplats. En produkt med sådant innehåll klassificeras som läkemedel liksom också produkter som innehåller synefrin i dygnsdos över 160 mg samt efedrin inklusive växtextrakt innehållande efedraalkaloider. Om produkter av denna typ säljs utan att vara godkända som läkemedel betraktas det som olaga läkemedelsförsäljning. Efedrin i bantnings- och prestationshöjande medel har under senare år uppmärksammats på grund av inträffade biverkningar, framför allt inom hjärt-kärlområdet men också vad gäller psykiska effekter/förändrat beteende. Synefrin, som har kommit att ersätta efedrin i bantningsprodukter, anses kunna ge samma biverkningar. Alkoholextrakt av grönt te har rapporterats kunna ge allvarlig leverpåverkan. Det har hittills inte klarlagts vilka ämnen som har gett upphov till leverbiverkningarna. Många av de analyserade produkterna innehåller koffein i betydande mängder. Om man dessutom intar drycker som innehåller koffein kan det dagliga intaget av koffein bli mycket högt. Detta kan för känsliga personer medföra risk för biverkningar i form av till exempel sömnsvårigheter, huvudvärk, hjärtklappning, illamående etc. Det är viktigt att påpeka att det i vissa av produkterna samtidigt förekommer flera substanser som var för sig kan belasta framför allt hjärt-kärlsystemet och också i vissa fall kan förstärka effekten av varandra (4). Så kan till exempel koffein förstärka de skadliga effekterna av efedrin och synefrin. Flera av de växter, som enligt innehållsdeklarationer ingår i de analyserade preparaten, ingår i Livsmedelsverkets vägledning över Växter och växtdelar som är Olämpliga i Livsmedel (VOLM). Anledningen till att de förts in där är att de förknippas med säkerhetsproblem. Exempel på detta är Garcinia cambogia, Coleus forskohlii och Pausinystalia yohimbe. Många andra beståndsdelar ingår också i de analyserade produkterna enligt deras innehållsdeklarationer. Analys av huruvida produkterna verkligen innehåller dessa beståndsdelar (eller substanser i extrakt från beståndsdelarna) har inte ingått i projektet. I vissa fall har Livsmedelsverket bedömt att de är olämpliga att ingå i livsmedel, medan Läkemedelsverket inte har gjort någon säkerhetsbedömning. I andra fall medför innehållet att produkterna klassificeras som läkemedel. Usninsyra identifierades endast i en produkt. Innehållet av detta var deklarerat. Andra ämnen som analyserades i preparaten Ett antal andra ämnen än de som primärt utvaldes har också analyserats. Dessa ämnen är mindre vanligt förekommande i viktminskningsprodukter eller så har de rapporterade säkerhetsproblemen varit få eller svårtolkade. Salicin är ett ämne som förekommer i Salix-arter (vide och pil). Salicin omvandlas till salicylsyra i kroppen och har antiinflammatoriska, smärtstillande och febernedsättande egenskaper. Salicin har deklarerats i fjorton av produkterna som salicin, white willow eller white & purple willow extract. I åtta av dessa produkter påvisades med NMR innehåll av salicin. Dessutom innehöll en produkt salicin utan att detta var deklarerat. Hoodia gordoni är en växt med traditionell användning i södra Afrika för att dämpa hunger. Hoodia har deklarerats i tre produkter. Två av dessa uppvisade likheter i NMR-spektra medan spektra för den tredje avvek. Ytterligare tre produkter uppvisade Hoodiamönster i NMR-spektra utan att Hoodia deklarerats. Effekt och biverkningar av extrakt från denna växt har inte bedömts. Bergenin återfanns i en produkt där detta deklarerats medan varken hordenin eller 2,4-dinitrofenol påträffades i någon produkt. Tyska myndigheter varnade 2006 för dödsfall i sambande med viktminskningsprodukter som innehöll 2,4-dinitrofenol. Även finska myndigheter har varnat för 2,4-dinitrofenol, sedan detta påträffats i analyser av produkter som importerats via Internet till Finland (2003). Diskussion I den studie av innehållsämnen i bantningsmedel, som Läkemedelsverket och Livsmedelsverket har genomfört, har i ett antal av de 34 preparat som analyserats efedrin inklusive pseudoefedrin, synefrin och usninsyra identifierats. I många av produkterna har man funnit grönt te och koffein. För efedrin, pseudoefedrin, synefrin och koffein bestämdes halten med två analysmetoder (NMR och HPLC). På grund av likvärda analysresultat med de bägge metoderna kunde slutsatsen dras att resultaten är tillförlitliga. Varken amfetamin eller besläktade substanser återfanns i preparaten, inte heller läkemedelssubstanserna sibutramin, orlistat, levotyroxin eller liotyronin. Ett stort antal andra substanser med olika verkningsmekanismer, som teoretiskt kan utnyttjas i syfte att åstadkomma viktminskning, ingår också i de aktuella bantningsmedlen. Exempel på detta är ämnen som motverkar övervikt genom att hämma fett-, kolhydrat- eller proteinnedbrytande enzymer. Några av dessa ämnen beskrivs i artikel om bantningmedel på Slutsats Ett gediget arbete har utförts för att undersöka innehållet i utvalda bantningsmedel. Hälften av de 34 bantningspreparat som Läkemedelsverket och Livsmedelsverket undersökte innehöll ämnen som medför hälsorisker för konsumenten, såsom synefrin, efedrin, pseudoefedrin och usninsyra. För fem av sex produkter som innehöll efedrin hade detta innehåll deklarerats på förpackningen. Innehåll av pseudoefedrin hade inte deklarerats för någon produkt. Vad gäller synefrin har innehåll därav deklarerats, dock Information från Läkemedelsverket 4:2007 11 Observanda som ”bitter orange” i två fall. Usninsyra fanns deklarerat på förpackningen till den enda produkt där den ingick. I många av produkterna påträffades också extrakt av grönt te och koffein. Några produkter har vid analys befunnits innehålla andra ämnen (salicin, Hoodia, bergenin, hordenin, 2,4-dinitrofenol) som i vissa sammanhang bedömts utgöra säkerhetsproblem. Även många andra innehållsämnen med effekter som leder till läkemedelsklassificering av produkten påträffades i innehållsdeklarationerna. Efedrin kan orsaka hjärt-kärlbiverkningar, men också psykiska biverkningar. Synefrin anses kunna ge samma biverkningar. Extrakt av grönt te liksom usninsyra kan ge leverbiverkningar. För mycket koffein medför risk för till exempel sömnsvårigheter, huvudvärk, hjärtklappning och illamående. Koffein kan förstärka effekten av efedrin och synefrin. Det är lätt att betrakta bantningsmedel som uppges innehålla örter och marknadsförs som hälsobringande, som riskfria. Det är dock viktigt att vara medveten om riskerna som finns förknippade med sådana produkter, framför allt vad gäller deklarerat eller odeklarerat innehåll av efedrin och synefrin. Referenser 1. 2. 3. 4. Molinari M, et al. Liver Transplantation 12 (2006). Information från Läkemedelsverket 2003:3. Arneborn, et al. Läkartidningen 2005-06-13). Chavez ML, et al. Life Sciences 78(2006)2146–57. Om bantningsmedel Tillgången på bantningsmedel och liknande produkter såsom kroppsbyggarprodukter och prestations­ höjande medel med olika innehållsämnen är god. Framför allt finns många produkter i dag att köpa via Internet. Det är okänt hur stor användningen av sådana produkter är i Sverige. För vissa beståndsdelar som ingår i bantningsmedel och liknande produkter har säkerhetsproblem identifierats. Många bantningsmedel regleras under livsmedelslagstiftningen men visst innehåll leder till läkemedelsklassificering. Klassificeringen beror på innehåll, verkningsmekanism för ingående beståndsdelar, syftet med produkten och vilka påståenden som görs för produkten. Se Faktaruta 1 angående klassificering som läkemedel. Sedan den 1 september 2005 klassificeras också alla produkter som innehåller efedrin (efedraalkaloider) som läkemedel i Sverige. Det innebär att det är olagligt att sälja produkter med de beskrivna egenskaperna och produkter som innehåller efedrin utan godkännande från Läkemedelsverket. Se Faktaruta 2 angående bantningsmedel som är livsmedel. Angående de ämnen som analyserats i studien Bland de ämnen som har uppmärksammats i bantningsprodukter har framför allt efedrin väckt intresse, inte minst på grund av de biverkningar som har rapporterats, ibland med dödlig utgång. I USA förbjöds försäljning av efedrin i kosttillskott (dietary supplements) 2004. Kanada har begränsat mängden efedrin per dos till 8 mg och dygnsmängden till 32 mg och förbjudit försäljningen av kombinationsprodukter med innehåll av efedrin och stimulantia samt efedrinprodukter för bantning och som prestationshöjande medel. Även andra ämnen återkommer i innehållsförteckningarna för viktminskningspreparat. Ett exem- 12 Information från Läkemedelsverket 4:2007 Faktaruta 1. Angående klassificering av bantningsprodukter. Med läkemedel avses enligt 1§ läkemedelslagen, varje substans eller kombination av substanser, som tillhandahålls med uppgift om att den har egenskaper för att förebygga eller behandla sjukdom hos människor eller djur (första punkten) eller som kan användas på eller tillföras människor eller djur i syfte att återställa, korrigera eller modifiera fysiologiska funktioner genom farmakologisk, immunologisk eller metabolisk verkan eller för att ställa diagnos (andra punkten). Ur Läkemedelsverkets föreskrifter (LVFS 1995:9): Med stöd av 2§ läkemedelsförordningen (1992:1752) meddelar Läkemedelsverket att läkemedelslagen i sin helhet skall tillämpas beträffande följande varor som i fråga om egenskaper eller användning står nära läkemedel, nämligen medel avsedda att motverka övervikt dels genom att födans passage genom tarmen påskyndas, smaksinnet bedövas eller aptiten nedsätts, dels genom att i mag-tarmkanalen hos människa hämma verkan av fett, kolhydrat- eller proteinnedbrytande enzymer. Observanda Faktaruta 2. innehåller extrakt av Hoodia gordoni, bedöms ha en aptitnedsättande verkan via effekt på centrala nervsystemet och klassificeras därigenom som läkemedel. De bantningsmedel som inte klassificeras som läkemedel är definitionsmässigt livsmedel. Tillverkare, importörer och återförsäljare är föremål för offentlig livsmedelskontroll. Det är deras ansvar att endast säkra livsmedel släpps ut på marknaden. Om livsmedel som inte är säkra släpps ut på marknaden kan berörd kontrollmyndighet förbjuda detta, och vidta nödvändiga åtgärder. Kontrollmyndighet är oftast kommunerna. Det betyder att eventuella åtgärder måste vidtas av respektive kommun för varje företag som inte frivilligt drar tillbaka en icke säker produkt från marknaden. Det kan tilläggas att företagare har en skyldighet att uppfylla krav på spårbarhet och att de självmant ska vidta åtgärder för att informera myndigheten och allmänheten om risker i de fall livsmedel som inte är säkra släppts ut på marknaden. Angående övriga beståndsdelar enligt innehållsdeklarationerna för de analyserade produkterna Många andra beståndsdelar ingår också i de analyserade produkterna enligt deras innehållsdeklarationer. Analys av huruvida produkterna verkligen innehåller dessa beståndsdelar har inte ingått i studien. I vissa fall har Livsmedelsverket bedömt att dessa övriga beståndsdelar är olämpliga att ingå i livsmedel, medan Läkemedelsverket inte har gjort någon säkerhetsbedömning. I andra fall medför innehållet att produkterna klassificeras som läkemedel. Enligt innehållsdeklarationerna finns till exempel i produkterna: • växter som tillskrivs vätskedrivande egenskaper (maskros, mjölon, enbär, Ortosiphonis-arter) samt substanser utvunna ur vissa av dessa växter som till exempel taraxol och arbutin • växter som har laxerande egenskaper som till exempel loppfrö (Psyllium) • Coleus forskohlii, en växt med traditionell användning inom Ayurvedisk medicin. Forskolin, ett ämne som är farmakologiskt välstuderat, ingår i extrakt från C forskohlii. De farmakologiska effekterna ger inga ledtrådar till mekanismen för viktminskning, men innehåll av C forskohlii gör att ett preparat klassificeras som läkemedel. C forskohlii finns också på Livsmedelsverkets VOLM-lista • Phase2® brand with kidney bean extract (Phaseolus vulgaris) som innehåller phaseolamin, ett ämne som inhiberar alfa-amylas (”stärkelseblockerare”), vilket innebär att det klassificeras som en läkemedelssubstans • Cassia nomame som uppges vara lipashämmare, vilket gör att också denna beståndsdel läkemedelsklassificeras • Sceletium tortuosum som är en sydafrikansk växt som innehåller mesembrin, ett ämne som bland annat visats vara en serotoninåterupptagshämmare i likhet med SSRI-läkemedel mot depression. • johannesört vilket leder till läkemedelsklassificering. • yohimbin som är ett läkemedelsklassificerat ämne som kan extraheras ur Pausinystalia yohimbe. Det är en alfa-adrenerg blockerare som bland annat ger ökad hjärtfrekvens och höjer blodtrycket. Ångest och maniska reaktioner har rapporterats i samband med intag. Yohimbin har använts vid manlig impotens men dess effekt mot detta finns inte visad • Garcinia cambogia som är en växt som inte är läkemedelsklassificerad. Verkningsmekanismen har påståtts vara att minska fettdepåerna i kroppen via verkan av hydroxicitrat (HCA). Denna växt finns på Livsmedelsverkets VOLM-lista. pel är synefrin som i viss mån har ersatt efedrin. Den kanadensiska läkemedelsmyndigheten (Health Canada) har varnat för risken för hjärt-kärlbiverkningar i samband med intag av synefrin, en risk som kan öka vid kombination med andra stimulantia som koffein. Synefrin kan utvinnas ur skal och omogen frukt av pomerans (Citrus aurantium). Extrakt från Citrus aurantium med högt innehåll av synefrin finns listat i Livsmedelsverkets vägledning över Växter och växtdelar som är Olämpliga i Livsmedel (VOLM). För uppgifter om åtgärder vidtagna i övrigt i Sverige, var god se artikel om resultat från studie av bantningsmedel på Läkemedelsverkets och Livsmedelsverkets webbplatser. Angående VOLM VOLM är en förkortning som står för en förteckning över ”Växter och växtdelar som är Olämpliga i Livsmedel”. Förteckningen finns på Livsmedelsverkets webbplats (www.slv.se). Växterna som är listade är bedömda som olämpliga i livsmedel, till exempel på grund av att något ämne som finns i växten är hälsofarligt och kan ha en negativ verkan på kroppen. Förteckningen bygger på frågor som inkommit till Livsmedelsverket, och den är alltså inte uttömmande. För extrakt av grönt te och usninsyra har allvarliga leverbiverkningar rapporterats, inklusive svenska fall. I många bantningsmedel ingår koffein, antingen renframställt eller som del i växtextrakt. I vissa fall är mängden koffein betydande. Koffein kan förstärka effekten av efedrin och synefrin. Analys på innehåll av amfetamin, fenfluramin, fentermin, orlistat, sibutramin och sköldkörtelhormon utfördes, men ingen av dessa beståndsdelar återfanns i de analyserade bantningsmedlen. Salicin, som omvandlas till salicylsyra i kroppen, är läkemedelsklassificerat. Bantningsprodukter som Information från Läkemedelsverket 4:2007 13 Observanda Vissa av de analyserade produkterna innehåller specialblandningar med flera av dessa substanser in­gående. Spårämnen som krom och vanadin, till exempel i form av krompiccolinat, krompolynicotinat och vanadylsulfat, förekommer också i vissa produkter. Krom, som deltar i kroppens omsättning av glukos och samverkar med insulin, har liksom vanadin använts som antidiabetikum. Ett extra tillskott av vanadin förefaller inte vara nödvändigt eller ha några bevisade positiva hälsoeffekter för friska personer, samtidigt som det inte kan uteslutas att biverkningar kan uppstå. Med dagens kunskapsläge anser därför Livsmedelsverket att det inte är tillrådligt, att konsumenter exponeras för de ofta mycket höga doser vanadin som förekommer i hälsokostpreparat. Risker med inköp och intag av okända produkter Konsumenterna betraktar ofta ”hälsokostprodukter”, inklusive bantningsmedel som innehåller örter och marknadsförs som hälsobringande, som riskfria. Det är dock viktigt att vara medveten om de risker som kan förknippas med intag av sådana produkter, framför allt vad gäller deklarerat eller odeklarerat innehåll av efedrin och synefrin. Det är också viktigt att känna till att även andra beståndsdelar i produkterna kan utgöra säkerhetsproblem, såsom usninsyra och extrakt av grönt te som rapporterats ge allvarliga leverbiverkningar. Effekten och biverkningarna av de produkter som i stor utsträckning tillhandahålls via Internet har inte bedömts av vare sig Läkemedelsverket eller Livsmedelsverket. Hälso- och sjukvården måste också vara medveten om att intag av dessa produkter förekommer och om de möjliga negativa effekterna av ingående beståndsdelar. Frågor om intag av denna typ av preparat och andra liknande bör ingå i läkemedelsanamnesen. Ett ytterligare skäl till detta är att 14 Information från Läkemedelsverket 4:2007 det kan finnas risk för interaktioner mellan vissa av de funna substanserna/örterna i bantningspreparat och läkemedel. Exempel är möjlig interaktion mellan grönt te och warfarin samt känd interaktion mellan johannesört och ett stort antal läkemedel (4). Rättsläget Produkter som klassificeras som läkemedel enligt reglerna i 1§ läkemedelslagen eller enligt bestämmelserna i Läkemedelsverkets föreskrifter (LVFS 1992:859) om tillämpning av läkemedelslagen på vissa varor får endast säljas om de godkänts för försäljning. Läkemedelsverket kan ingripa mot försäljning av läkemedel som inte är godkända. Detta kan ske antingen genom att Läkemedelsverket polisanmäler försäljningen eller genom att Läkemedelsverket uppmanar företaget att sluta med försäljningen. Läkemedelsverket har också möjlighet att vid vite förbjuda försäljningen av läkemedel som inte är godkända. Produkter som är livsmedel får endast släppas ut på marknaden om de är säkra, dvs. inte skadliga för hälsan eller otjänliga som människoföda. Om ett livsmedel är säkert eller ej beror inte endast på dess innehåll utan även på den mängd som man konsumerar. Livsmedel ska vid försäljning till konsumenter uppfylla vissa märkningskrav. För kosttillskott gäller till exempel att produkten ska märkas med bland annat namnet på de ämnen som kännetecknar produkten och rekommenderad daglig dos av produkten. Även kontaktuppgifter för säljaren eller tillverkaren ska finnas med i märkningen. Det är företagens ansvar att se till att deras produkter uppfyller kraven i livsmedelslagstiftningen. I de fall företagen inte självmant ser till att produkterna uppfyller kraven kan kontrollmyndigheten, som i de flesta fall är den kommunala miljö- och hälsoskyddsnämnden, ingripa. Observanda Indikationen primär nattlig enures borttagen för nasala beredningsformer av desmopressin Nasala beredningsformer av desmopressin är inte längre godkända för primär nattlig enures (sängvät­ ning). Indikationsändringen berör de i Sverige godkända preparaten Minirin, Desmopressin Nordic och Desmopressin Alpharma. användas för PNE. Biverkningarna var vanligare hos barn än hos vuxna och inkluderar fall av hyponatremi, vattenintoxikation och kramper. Det finns också en risk för svår hyponatremi när de nasala beredningsformerna används vid behandling av central diabetes insipidus. I samverkan med övriga medlemsländer inom EU har följande ändringar av produktresumén införts för nasala beredningsformer av desmopressin: • Borttagande av indikationen: behandling av PNE (från och med sex års ålder) när enureslarm inte givit önskad effekt hos patienter med normal förmåga att koncentrera urin. • Tillägg av säkerhetstext under avsnitt ”Varningar och försiktighet”: erfarenhet från klinisk användning indikerar risk för svår hyponatremi vid behandling av patienter med central diabetes insipidus. Hälso- och sjukvården kommer även att få skriftlig information om dessa förändringar. Indikationen primär nattlig enures (PNE) utgår för nasala beredningformer (spray och droppar) av desmopressin på grund av allvarliga biverkningar. Risknyttaprofilen bedöms mer fördelaktig för de orala beredningsformerna. Indikationsändringen berör de i Sverige godkända preparaten Minirin, Desmopressin Nordic och Desmopressin Alpharma. Desmopressin är en syntetisk vasopressinanalog med kraftigare antidiuretisk effekt och längre verkningsduration än den naturliga peptiden. Den nasala beredningsformen har större biotillgänglighet än den orala. Båda beredningsformerna minskar urinproduktionen och osmolaliteten, vilket kan resultera i hyponatremi och vattenintoxikation. Det är okänt om dessa biverkningar är dosrelaterade, men det finns ett klart samband med typ av beredningsform. Eftersom majoriteten av fall med hyponatremi vid behandling på indikation PNE är associerade med användning av den nasala beredningsformen, ska denna inte längre Olaglig försäljning av mangostanjuice Mangostanjuicen Xango säljs med påståenden om medicinska effekter på internetsidor riktade till svens­ ka konsumenter. Då Läkemedelsverket inte har fått någon ansökan om godkännande om läkemedel för mangostanjuice är försäljningen olaglig. De egenskaper som tillskrivs mangostan anges ha samband med innehåll av så kallade xantoner. De är antioxidanter men uppges också ha effekt mot parasiter, virus och svamp samt vid inflammation. Läkemedelsverket har inte tagit ställning till studier som gäller effekten av mangostan eller xantoner. Mangostanjuicen Xango finns till försäljning på flera internetsidor riktade till svenska konsumenter. På internetsidorna görs påståenden om juicens medicinska effekter, till exempel mot cancer, allergi och smärta. Påståendena är av sådan art att juicen klassificeras som läkemedel. Då Läkemedelsverket inte har fått någon ansökan om godkännande om läkemedel för mango­ stanjuicen innebär påståendena att försäljningen av mangostanjuice är olaglig. Information från Läkemedelsverket 4:2007 15 Observanda Reglerna om utbytbarhet ändras den 1 juli 2007 Den 1 juli 2007 träder ändringar av reglerna om utbytbarhet i läkemedelslagen och lagen om läkeme­ delsförmånerna i kraft. De nya reglerna innebär bland annat att Läkemedelsverket kan fatta beslut om utbytbarhet redan i samband med godkännande av ett läkemedel, och att beslutet gäller direkt. Riksdagen beslutade den 10 maj 2007 att införa vissa ändringar av reglerna om utbytbarhet i lagen om läkemedelsförmåner. De nya reglerna börjar gälla den 1 juli 2007. De nya reglerna innebär att Läkemedelsverket inte behöver invänta beslut från Läkemedelsförmånsnämnden (LFN) om det aktuella läkemedlet ska ingå i läkemedelsförmånen. Läkemedelsverket kan istället redan i samband med godkännandet fatta beslut om utbytbarhet för läkemedel. Beslutet om utbytbarhet kommer att gälla direkt eftersom handläggningen av utbytbarhetsärenden har flyttats från lagen om läkemedelsförmåner till läkemedelslagen. De nya reglerna innebär dessutom att Läkemedels- verket kan fatta beslut om utbytbarhet för läkemedel som inte kommer att tas upp i förmånen. Vad innebär utbytbarhet? Lagen om läkemedelsförmånerna m.m. innebär att läkemedel ska bytas ut mot det billigaste, likvärdiga läkemedlet som finns tillgängligt på det enskilda apoteket. Byte genomförs inte om förskrivaren av läkemedlet motsatt sig utbyte eller om patienten väljer att betala merkostnaden för det dyrare läkemedlet. Mer information Mer information om utbytbara läkemedel och om regelförändringen finns att läsa på Läkemedelsverkets webbplats, www.lakemedelsverket.se. Hiv-läkemedlet Viracept dras in Alla förpackningar av Viracept, ett läkemedel för behandling av hiv-infektion, dras omedelbart in från patienter, apotek och sjukvård i EU, då det skadliga ämnet etylmesylat (metansulfonsyraetylester) upp­ täckts i läkemedlet. Patienterna uppmanas ta kontakt med behandlande läkare innan Viracept returneras till apoteket. Sjukvården uppmanas ta kontakt med patienter som behandlas med Viracept för att ta ställning till byte av behandling. Företaget Roche, som tillverkar Viracept, analyserade Viracepttabletter då en obehaglig lukt hade konstaterats. Analysen visade oförutsett en hög koncentration av etylmesylat. Det är en förorening som bedöms ha samband med tillverkningsmetoden för nelfinavir, som är den aktiva substansen i Viracept. Etylmesylat är ett genotoxiskt ämne, som är skadligt för DNA. Patienterna uppmanas ta kontakt med behandlande läkare innan Viracept returneras till apoteket. Sjukvården uppmanas ta kontakt med patienter som behandlas med Viracept för att ta ställning till att sätta in annat anti-retroviralt läkemedel anpassat till patientens resistenssituation och övrig pågående behandling. Risken för de patienter som behandlats med Viracept innehållande etylmesylat är svår att värdera i det 16 Information från Läkemedelsverket 4:2007 enskilda fallet. En speciell riskgrupp bedöms ofödda barn till mödrar som behandlats med Viracept under graviditeten utgöra. I Sverige behandlas numera gravida kvinnor i första hand med andra läkemedel än Viracept. Beslutet att dra in alla förpackningar av Viracept i EU har fattats utifrån försiktighetsprincipen. Även så kallat parallelldistribuerat Viracept dras in. Parallelldistribuerade läkemedel tillverkas av originalföretaget men säljs av ett annat företag. Viracept är ett läkemedel för behandling av hivinfektion. Det kombineras med andra antivirala läkemedel i behandlingen av vuxna, ungdomar och barn över tre års ålder med hiv-infektion. I Sverige har användningen av Viracept minskat under senare år till att gälla ett par hundra patienter år 2006. Observanda Inga belägg för att acetylkolinesterashämmare har bromsande effekt vid Alzheimers sjukdom Det finns inga belägg för att demensläkemedlen Aricept, Exelon och Reminyl, som ofta betecknas som ”bromsmediciner”, har en bromsande effekt på Alzheimers sjukdom. Läkemedlen är godkända för att de har visats ha en symtomlindrande effekt som kan vara av värde för patienter med Alzheimers sjukdom. Figur 1. Effekt av acetylkolinesterashämmare i placebokontrollerade studier vid Alzheimers sjukdom. Resultat av poolade analyser. Det finns ännu inte något läkemedel som bromsar upp det progressiva sjukdomsförloppet vid demenssjukdomar. Såväl acetylkolinesterashämmarna (Aricept, Exelon och Reminyl) som NMDA-receptorantagonisten Ebixa är godkända för symtomatisk behandling av Alzheimers sjukdom. Icke desto mindre talas det ofta om ”bromsmediciner”, vilket antyder att de tillgängliga läkemedlen skulle ha en bromsande effekt på det underliggande sjukdomsförloppet. Denna föreställning tycks bygga på enskilda fallrapporter eller okontrollerade uppföljningar i klinisk praxis. Några kontrollerade studier som visar på en bromsande effekt finns dock inte. Figur 1 a, b och c visar utfallet i de sexmånaders placebokontrollerade studier som låg till grund för godkännandet av Aricept, Exelon och Reminyl (1). Effektmönstret är gemensamt för de tre produkterna. Initialt ses i genomsnitt en förbättring för såväl patienter på aktiv behandling som för placebobehandlade patienter (att den initiala förbättringen ej ses för placebopatienterna i Exelonstudierna torde bero på att någon effektmätning inte gjordes före tre månader). Storleken på den initiala effekten är 2,5–3 poäng på den kognitiva delskalan av Alzheimer´s Disease Assessment Scale (ADAS-Cog). Efter tre månader slår dock det underliggande sjukdomsförloppet igenom och patienterna försämras. Denna försämring sker parallellt i behandlingsgrupp och placebogrupp för alla tre produkterna. En positiv effekt på progressionen borde ha manifesterat sig i en divergerande utveckling över tid. För Aricept gjordes ett försök att visa på en bestående effekt av behandlingen, vilket skulle vara förenligt med en bromsande effekt. Efter sex månader sattes patienterna i den aktiva behandlingsgruppen singelblint över på sex veckors placebobehandling. Som framgår av Figur 1 a kunde någon bestående effekt ej påvisas. Efter godkännandet har två placebokontrollerade ettårsstudier genomförts med Aricept. Resultaten i dessa är konsistenta med resultaten beskrivna ovan. I en studie undersökte Mohs et al. tiden till en kliniskt relevant funktionsnedsättning (2). Upp till 18 veckor divergerade kurvorna för tid till relevant försämring för att sedan löpa parallellt till 52 veckor. Även kurvorna för symtomskattningarna löper parallellt. I studien av Winblads et al. ses en svag tendens till divergerande kurvor (3). I denna studie uppnåddes dock ej formell statistisk signifikans i den primära analysen. Förhoppningen om en positiv effekt på progressionen utgör vidare grund för påståenden om att det är viktigt att sätta in behandlingen tidigt. För alla acetylkolinesterashämmare har försök gjorts att behandla förstadier till Alzheimers sjukdom, så kallad Mild Cognitive Impairment (MCI). Någon positiv effekt vid MCI har dock ej kunnat påvisas i tvååriga placebokontrollerade studier. Sammanfattningsvis har symtomatisk effekt visats för kolinesterashämmarna vid Alzheimers sjukdom. Information från Läkemedelsverket 4:2007 17 Observanda Några belägg för att denna effekt ökar över tid, därmed indikerande en effekt på den underliggande progressionen, finns ej. Den symtomatiska effekten motsvarar en förskjutning i symtomatologin i 4–8 månader (Figur 2). Referenser 1. Till Läkemedelsverket insänd dokumentation. 2. Mohs RC, Doody RS, Morris JR, et al. A 1-year, placebo-controlled preservation of function survival study of donepezil in AD patients. Neurology 2001;57:481–6. 3. Winblad B, Engedal K, Soininen H. A 1-year, randomized , placebo-controlled study in patients with mild to moderate AD. Neurology 2001;57:489–95. 18 Information från Läkemedelsverket 4:2007 Figur 2. Schematisk bild av effekten av acetylkolin esterashämmare i placebokontrollerade studier vid Alzheimers sjukdom. Behandling av osteoporos – Behandlingsrekommendation Inledning 2,5 SD under medelvärdet för friska unga vuxna kvinnor (T-score < – 1 till > – 2,5 SD). Osteoporos: Bentäthet 2,5 SD eller mer under medelvärdet för friska unga vuxna kvinnor (T-score ≤ –2,5 SD). Manifest osteoporos: Bentäthet 2,5 SD eller mer under medelvärdet för friska unga vuxna kvinnor och en eller flera lågenergifrakturer (osteoporosfraktur + Tscore ≤ – 2,5). Definitionen gäller mätning med DXA i höft eller rygg. Det finns ingen motsvarande operationell definition för osteoporos hos män (se för övrigt nedan). Osteoporos betraktas enligt denna definition som en riskfaktor för fraktur och inte som en sjukdom i sig. Förekomsten av osteoporos framgår av Tabell I. Diagnostiken av osteoporos hos kvinnor i åldersgruppen 80–89 år avseende ländryggen påverkas sannolikt av degenerativa förändringar med reaktiva benpålagringar, vilket ger ett vilseledande utfall av bentäthetsmätningen och därmed en skenbart minskad prevalens av osteoporos. Läkemedelsverket anordnade i månadsskiftet januari/februari 2007 ett expertmöte för att uppdatera rekommendationer från 2004 om be­ handling av osteoporos. Orsakerna till denna uppdatering är bland annat tillkomst av nya lä­ kemedel och läkemedelsberedningar samt ny kun­ skap om sjukdomen. Syftet med behandlingen av osteoporos har med tiden förändrats från förebyggande av osteo­ poros som sådan till förebyggande av frakturer, det vill säga utveckling av manifest osteoporos. Definitioner Osteoporos är en av flera riskfaktorer för frakturer och definieras som en systemisk skelettsjukdom, karakteriserad av reducerad benhållfasthet på grund av minskad benvävnad och/eller förändrad benkvalitet. Den kliniska manifestationen av osteoporos är ”lågenergifraktur” (oftast fraktur vid fall i samma plan). De vanligaste lågenergifrakturerna är kot-, höft- och handledsfraktur. Världshälsoorganisationen (WHO) lanserade 1994 följande operationella definitioner baserade på bentäthetsmätning. Observera att dessa endast gäller för postmenopausala kvinnor. Normal bentäthet: Bentäthet (BMD; g/cm2) över – 1 standardavvikelse (SD) från medelvärdet hos friska unga vuxna kvinnor (T-score ≥ – 1). Låg bentäthet (osteopeni): Bentäthet mellan 1 och Frakturepidemiologi Förekomsten av frakturer har ökat dramatiskt under de senaste femtio åren i västvärlden och detta gäller de flesta frakturtyper, huvudsakligen på grund av en demografisk förändring med ökat antal äldre. Flera studier talar även för att det funnits en incidensökning av flertalet osteoporosfrakturer från 1950-talet Faktaruta 1. Ordförklaringar BMD: Bone mineral density (g/cm2), DXA: Dual X-ray absorptiometry. BMI: Body mass index = vikt/längd2. T-score = antalet standardavvikelser (SD) från medelvärdet i en ung frisk population av samma kön. Z-score = antalet standardavvikelser (SD) från medelvärdet i en åldersmatchad population av samma kön. Primär osteoporos: postmenopausal och åldersrelaterad benskörhet. Sekundär osteoporos: benskörhet orsakad av bakomliggande sjukdom eller läkemedel. Hos män under 50 år samt hos barn skall åldersmatchat Z-score användas. Tabell I. Andelen kvinnor i Sverige med diagnosen osteoporos (efter WHO:s definition). Källa: SBU-rapport 127. 50–59 år Åldersgrupp 60–69 år 70–79 år 80–89 år Mätning i lårbenshals 7 % 22 % 31 % 36 % Mätning i ländrygg 13 % 36 % 43 % 33 % Information från Läkemedelsverket 4:2007 19 Behandlingsrekommendation Behandling av osteoporos till slutet av 1980-talet med en dryg fördubbling av risken, men nyare data tyder på att den åldersstandardiserade höftfrakturincidensen har planat ut och eventuellt även minskat något för postmenopausala kvinnor. Förekomsten av de flesta typer av lågenergifrakturer ökar kraftigt med åldern hos både män och kvinnor. Inom varje åldersgrupp är förekomsten av höftfrakturer högre bland kvinnor än bland män. Skandinavien är det område i världen som har högst incidens av höft- och kotfrakturer. Orsakerna till detta har inte tillfredsställande klarlagts. I Sverige inträffar årligen 18 000 höftfrakturer och cirka 25 000 handledsfrakturer. Incidensen av kotkompressioner – förmodligen den vanligaste och viktigaste frakturen ur ett profylaktisk perspektiv – är sannolikt kraftigt underskattad. Etiologi Etiologin till fraktur kan grovt delas in i fyra huvudgrupper, alla relaterade till ålder. 1. Faktorer som ökar sannolikheten för ett trauma/ fall, till exempel yrsel, användning av sedativa och alkohol, dålig balans men också faktorer i miljön som hala gångytor, lösa mattor och ställen att snubbla på, såsom trösklar. Akuta och kroniska sjukdomar leder ofta till nedsatt balans och ökad falltendens. 2. Själva traumat: energiberoende mekanism – ju högre energi, desto högre frakturrisk. Ett trauma mot höften från sidan medför till exempel högre risk för höftfraktur än ett fall framåt som ofta avvärjs något. 3. Skelettets förmåga att motstå ett trauma. Denna beror av skelettets massa, kvalitet, geometri och storlek; samtliga till stor del bestämda av genetiska faktorer. Faktaruta 2. 4. Skydd: Energiabsorption genom till exempel mjukdelar eller polstring och skyddande neuromuskulära reflexer som parerar och dämpar fall. Patofysiologi Benvävnaden genomgår under hela livet en kontinuerlig remodellering som medverkar till att bibehålla och anpassa den biomekaniska styrkan till belastningen. Den maximala benmassan uppnås vid 20–30-årsåldern hos både kvinnor och män. Därefter minskar benmassan kontinuerligt på grund av en obalans i remodelleringsprocessen genom att benresorptionen är större än bennybildningen. Vid primär osteoporos hos kvinnor är den negativa remodelleringsbalansen förstärkt genom en ökad omsättning av skelettet som omedelbart postmenopausalt är relaterad till östrogenbortfall. Det föreligger då ett ökat resorptionsdjup och en ökad utbredning av resorptiva ytor samtidigt som det föreligger en relativ formativ obalans. De osteoporotiska förändringarna är mest uttalade i det trabekulära benet, dvs. den metabolt mest aktiva vävnaden. Irreversibel benförlust uppstår vid perforation av trabeklerna. Trabekulärt ben förekommer i kotor och ändarna av de långa rörbenen, varför dessa är vanliga lokaler för osteoporosrelaterade frakturer. Förlusten i både trabekulärt och kortikalt ben efter 65-årsåldern sker i samma utsträckning hos båda könen. I denna åldersgrupp kan bristande D-vitaminsyntes och -aktivering samt förändringar i andra hormonsystem som minskning av könshormoner och IGF I vara av betydelse. Sekundär osteoporos är osteoporos förorsakad av underliggande sjukdomar (till exempel celiaki eller hypertyreos) eller av läkemedelsbehandling med till exempel glukokortikoider. Se avsnittet Sekundär osteoporos. Riskfaktorer för fraktur Kvinnor har högre frakturrisk än män. Starka riskfaktorer • Hög ålder. • Tidigare lågenergifraktur hos individer efter 50 års ålder, främst höft-, kot-, handleds-, överarms- och bäckenfraktur. • Bentäthet < – 2,5 SD. • Höftfraktur eller kotfraktur hos någon förälder. • Systemisk glukokortikoidbehandling under minst tre månader. Svaga riskfaktorer • BMI < 20 kg/m2. • Vikt hos kvinna < 55 kg vid genomsnittslängd. • Rökning. • Ofrivillig viktförlust mer än 5 kg sista året. • Inaktivitet. • Menopaus före 45 års ålder. • Ökad fallbenägenhet. Frakturrisken och därmed indikationen för utredning och behandling ökar med ökande antal riskfaktorer. Man kan idag inte ange ett entydigt riskscore på grundval av de nämnda riskfaktorerna, men de kan ge en antydan om patientens frakturrisk. 20 Information från Läkemedelsverket 4:2007 Behandlingsrekommendation Behandling av osteoporos för att utesluta differentialdiagnoser såsom kotdestruktioner. Vid misstanke om kotkompression utförs ryggröntgen lämpligen före bentäthetsmätning. Diagnostik Målsättning Syftet med utredningen är: 1. att kvantifiera risken för frakturer i framtiden. 2. att diagnostisera osteoporos och påvisa eventuella orsaker. Laboratoriediagnostik vid osteoporosutredning Klinisk bedömning Laboratoriediagnostik för att utesluta sekundär osteoporos Det är viktigt att ta ställning till om sekundär osteoporos föreligger, exempelvis myelom, hyperparatyreoidism, Cushings syndrom, tyreotoxikos, D-vitaminbrist eller malabsorption. Följande laboratorieprover bör regelmässigt analyseras vid osteoporosutredning: Hb, SR, S-kalcium, TSH, S-ALP och S-kreatinin. Hos äldre med misstänkt D-vitaminbrist bör joniserat kalcium och paratyreoideahormon samt eventuellt 25-hydroxi-vitamin D analyseras. Vid progredierande sjukdom och kraftigt minskad bentäthet bör alltid sekundär osteoporos övervägas och laboratorieundersökningar riktas mot specifik sjukdom. Metabola benmarkörer Det finns inga laboratorietester avseende blod eller urin (benmarkörer) som kan användas för diagnostik av osteoporos eller som entydigt kan hänföra en enskild patient till en högriskgrupp på grund av stor biologisk och analytisk variation. Metabola benmarkörer har därför ingen plats i rutinsjukvården. De används däremot i studier för att skilja grupper med olika frakturrisk, för uppföljning av behandling (compliance) samt för studier avseende läkemedels farmakodynamik. • Anamnes innefattande genomgångna frakturer och andra relevanta riskfaktorer för fraktur. Eventuell förekomst av ryggsmärta och funktionsnedsättning. • Klinisk undersökning bör omfatta mätning av längd och vikt samt fysikalisk undersökning och bedömning av rörelseorganens funktion, inklusive rygg och leder. • Klinisk utredning bör utesluta bakomliggande sjukdomsorsaker (sekundär osteoporos) och innefatta bedömning av allmäntillståndet samt uppmärksamma frakturdisponerande läkemedel, t.ex. sedativa och neuroleptika. Mätning av bentäthet Mätning med DXA i höft och ländrygg rekommenderas vid osteoporosutredning, eftersom denna metod är bäst validerad. Perifera bentäthetsmätningar kan ej ersätta DXA-mätning i höft- och ländrygg för diagnostik och prevention av fraktur hos enskilda patienter. Det saknas vetenskaplig grund för att rekommendera generell screening avseende bentäthet. Det är motiverat att undersöka individer med ökad frakturrisk (Faktaruta 2). Mätning av bentäthet bör endast utföras om patienten kan förväntas medverka till behandling eller frakturförebyggande åtgärder. Resultat av bentäthetsmätningar bör alltid värderas i relation till förekomst av andra riskfaktorer för fraktur. Uppföljande mätning rekommenderas i normalfallet efter tidigast två år, men kan vara motiverad tidigare. Vid anabol behandling, kortisonbehandling och vid t.ex. uppföljning av transplantationspatienter kan kortare intervall vara indicerat. Fortsatt minskning av bentäthet kan tala för bakomliggande sjukdom eller bristande compliance. Icke-farmakologisk behandling Viktiga påverkbara riskfaktorer för osteoporosrelaterade frakturer är fysisk inaktivitet, låg vikt, tobaksrökning, hög alkoholkonsumtion, fallbenägenhet, nedsatt syn och brist på vitamin D. Vid behandling av patienter med osteoporos är det viktigt att identifiera och, om möjligt, påverka förekomst av dessa riskfaktorer. Bland dessa riskfaktorer framstår fallbenägenhet som en av de allra viktigaste. För att minska antalet fall hos äldre har följande åtgärder visat sig ha betydelse: träning av muskelstyrka och balans samt åtgärder riktade mot fallrisker inklusive undvikande av framför allt sederande läkemedel. Bruk av höftskydd förefaller minska risken för höftfraktur hos de allra äldsta (Evidensgrad 1a), men bristande följsamhet är ett problem. Röntgenundersökning av bröst- och ländrygg Röntgenundersökning av bröst- och ländrygg bör göras hos patienter med misstanke om kotfraktur vid till exempel längdminskning mer än 3 cm före 70 års ålder eller mer än 5 cm efter 70-årsåldern och/eller påtagliga nytillkomna ryggsmärtor hos medelålders och äldre personer. Röntgenundersökning är också av värde när man skall bedöma resultaten av bentäthetsmätning i ländryggen, eftersom bentätheten där ofta kan vara svårvärderad på grund av kotfrakturer, spondylartros och deformiteter. Röntgenundersökning är också viktig Farmakologisk behandling Endast de läkemedel som i kontrollerade studier visats minska risken för frakturer kan rekommenderas för behandling av osteoporos. Dessa läkemedel benämns i det följande som benspecifika läkemedel. Preparat som uppfyller detta kriterium är kalcium och vitamin D, bisfosfonater, strontiumranelat, SERM (selektiva Information från Läkemedelsverket 4:2007 21 Behandlingsrekommendation Behandling av osteoporos östrogenreceptormodulerare), östrogen/tibolon och paratyreoideahormon (PTH) och PTH-analoger. Kalcium och vitamin D Kalciumabsorptionen och bildning av D-vitamin i huden avtar med ökande ålder. Varierande D-vitaminnivåer och bristtillstånd förekommer ofta efter 80 års ålder. • Behandling med vitamin D och kalcium i kombination minskar risken för icke-vertebrala frakturer hos institutionsboende äldre kvinnor (Evidensgrad 1a). Det är rimligt att överväga behandling av kvinnor över 80-årsåldern oavsett boendeform, framför allt om de är allmänt sköra eller har bristfällig nutrition och sällan vistas utomhus (Rekommendationsgrad A). Dessa faktorer ökar risken för brist på vitamin D. Behandling av män kan också övervägas, eftersom de har en hög risk för höftfraktur efter 80 års ålder. • Vitamin D och kalcium bör förskrivas vid behandling med benspecifika läkemedel, eftersom behandlingsstudierna med bisfosfonater, selektiva östrogenreceptormodulatorer, strontiumranelat och PTH har samtliga innefattat samtidig behandling med kalcium och i de flesta fall vitamin D (Rekommendationsgrad A). • Behandling med vitamin D och kalcium minskar förlust av benmassa vid långvarig peroral kortisonbehandling och rekommenderas, trots att frakturdata saknas (Rekommendationsgrad B). • Behandling med vitamin D och eller kalcium är motiverad vid påvisad brist och till vissa grupper med risk att utveckla brist på vitamin D och kalcium (se bakgrundsdokumentationen, Rekommendationsgrad C). • Kalcium eller vitamin D givna var för sig har inte visats minska frakturrisken hos gamla kvinnor eller män (Evidensgrad 1a). • Primärprevention med vitamin D och kalcium i kombination har inte visats minska risken för fraktur hos personer under cirka 80 år (Evidensgrad 1a). Detta gäller även vid osteopeni. Rekommenderade doser: • Kalcium 500–1 000 mg/dag och • Vitamin D 400–800 IE/dag (motsvarar 10–20 mikrogram). I rekommenderade doser har kalcium och vitamin D inga allvarliga biverkningar, men serumkalcium bör kontrolleras före behandling. Man bör också vara försiktig vid behandling av personer som tidigare haft njursten. Bisfosfonater Bisfosfonater är syntetiska pyrofosfatanaloger, som retineras i benvävnaden under mycket lång tid. Bisfosfonater hämmar osteoklasternas förmåga att resorbera ben och ökar benmassan i ländrygg och höft. Patienter som får bisfosfonater bör också ges tillskott av kalcium och vitamin D. Absorptionen efter peroralt intag är mycket låg 22 Information från Läkemedelsverket 4:2007 och minskas starkt av samtidigt intag av mat och dryck (förutom vatten) och andra läkemedel, framför allt kalcium. Det är viktigt att bisfosfonater tas enligt instruktioner. Alendronsyra Den frakturförebyggande effekten är tydligt visad vad gäller kotfrakturer och perifera frakturer hos kvinnor med postmenopausal osteoporos (Evidensgrad 1a). Studieresultaten tyder också på att behandlingen förebygger höftfraktur men data är inte lika säkra då antalet höftfrakturer i studierna är lågt (Evidensgrad 1b). Den frakturförebyggande effekten tycks vara störst hos patienter med tidigare frakturer eller mycket låg benmassa (T-score < – 2,5) (Evidensgrad 1a). Frakturreduktion är dokumenterad för daglig dosering med 10 mg. Veckotabletten (70 mg) är godkänd baserat på bentäthetsdata – frakturdata saknas. Det finns en randomiserad placebokontrollerad studie där alendronsyra 10 mg per dag under två år ökade bentätheten samt resulterade i signifikant färre frakturer (Evidensgrad 1b). I denna studie hade 30 % av männen tecken på hypogonadism, men detta påverkade inte behandlingseffekten. Etidronat Etidronatbehandling minskar risken för kotfraktur hos postmenopausala kvinnor med osteoporos (Evidensgrad 2b). Minskad risk för perifera frakturer har inte visats. Dokumentationen är svag, varför läkemedlet inte kan rekommenderas. Ibandronat Den frakturförebyggande effekten är tydligt visad vad gäller kotfrakturer hos kvinnor med postmenopausal osteoporos (Evidensgrad 1b). Minskad risk för perifera frakturer har inte visats. Månadstabletten (150 mg) är godkänd baserat på bentäthetsdata, men ingår för närvarande inte i läkemedelsförmånen. Risedronsyra Den frakturförebyggande effekten är tydligt visad vad gäller kotfrakturer och perifera frakturer hos kvinnor med postmenopausal osteoporos (Evidensgrad 1a). Vad gäller höftfraktur finns för risedronsyra en randomiserad kontrollerad prövning som visar frakturreduktion vid behandling av äldre med uttalat låg bentäthet (Evidensgrad 1b). Frakturreduktion är dokumenterad för daglig dosering med 5 mg. Veckotabletten (35 mg) är godkänd baserat på bentäthetsdata. I en placebokontrollerad tvåårsstudie ökade 35 mg risedronsyra en gång i veckan bentätheten i ländrygg, lårbenshals, trokanter och höft jämfört med placebo hos män med osteoporos (Evidensgrad 1b). Effekt mot frakturer sågs inte i denna studie. Zoledronsyra Administreras intravenöst en gång årligen. Den frakturförebyggande effekten är tydligt visad vad gäller kotfrakturer och perifera frakturer hos kvinnor med postmenopausal osteoporos (Evidensgrad 1a). Studieresultaten tyder också på att behandlingen fö- Behandlingsrekommendation Behandling av osteoporos med östrogenbehandling beslöt den europeiska läkemedelsnämnden (2003) att indikationen för östrogenpreparat och tibolon avseende frakturprevention skall lyda: ”förebyggande av osteoporos hos postmenopausal kvinna med hög risk för framtida fraktur, om hon inte tål eller har kontraindikationer mot andra läkemedel godkända för att förebygga osteoporos”. Frakturreducerande effekt Behandling med medelpotenta östrogenpreparat, med eller utan gestagentillägg, minskar risken för höft-, kotoch andra osteoporotiska frakturer (Evidensgrad 1a). Såväl observationsstudier som experimentella studier visar resultat i samma riktning, och resultaten stöds av data från studier avseende endast bentäthetsmätning. Resultat föreligger främst för primärprevention, medan studier med fraktur som primärt effektmått hos kvinnor med hög risk för fraktur saknas. Det är emellertid rimligt att anta att den frakturreducerande effekten finns även hos kvinnor med ökad risk för osteoporosrelaterad fraktur. Data från observationsstudier tyder på att östrogenets skyddseffekt mot frakturrisk försvinner inom något år efter utsatt behandling (Evidensgrad 2b). Risker vid östrogenbehandling Cancerrisk Behandling med medelpotenta östrogenpreparat medför en måttligt ökad risk för bröstcancer (Evidensgrad 1b). Risken ökar med behandlingstidens längd och förefaller återgå till utgångsrisken inom några (högst fem) år efter utsättning. Riskökningen har visats vara större vid kombinerad östrogen-gestagenbehandling än med östrogen enbart, oavsett om gestagenet tillförts sekventiellt eller kontinuerligt och oavsett typ av gestagen (Evidensgrad 2b). Data föreligger även, som kan tala för ökad mortalitet i bröstcancer vid östrogenbehandling (Evidensgrad 2b). Östrogenbehandling av kvinnor med kvarvarande uterus innebär en durationsberoende riskökning för endometriehyperplasi och endometriecancer, som minskar påtagligt vid sedvanlig kombinationsbehandling med gestagen (Evidensgrad 2a). Skyddseffekten mot endometriehyperplasi och endometriecancer tycks bli större ju fler dagar per 28-dagarscykel som gestagenet ges. Resultat från epidemiologiska studier och från en randomiserad kontrollerad studie talar för att långvarig hormonsubstitution kan ge en något ökad risk för ovarialcancer (Evidensgrad 2b). Vad gäller ovarial cancerrisk är associationer med gestagentillägg, typ av östrogen eller östrogen-gestagenkombination och administrationssätt oklara samt mortalitet i ovarialcancer. Det finns stöd för att östrogensubstitution minskar risken för kolorektal cancer (Evidensgrad 1b). Hjärtinfarkt, stroke och venös tromboembolism (VTE) En randomiserad studie (WHI) visade att kombinationsbehandling med östrogen och gestagen med- rebygger höftfraktur men data är inte lika säkra, då antalet höftfrakturer i studierna är lågt (Evidensgrad 1b). Zoledronsyra kan eventuellt komma att godkännas för behandling av postmenopausal osteoporos under 2007. Hur länge bör behandling med bisfosfonater fortgå? Tillförlitliga data för säkerhet och effekt finns för tre års behandling (Evidensgrad 1a). Förlängd behandling med alendronsyra upp till tio år och risedronsyra upp till sju år har visat fortsatt ökning av benmassan i ländryggen (Evidensgrad 2b). Det är oklart hur denna ökning av benmassan är relaterad till skelettets hållfasthet och frakturrisken. Efter utsättning förefaller den antiresorptiva effekten kvarstå under flera års tid. På grund av den långa retentionstiden av bisfosfonater i ryggen bör man överväga att utsätta behandlingen tillfälligt eller permanent efter tre till fem år. Detta beslut bör grundas på patientens frakturrisk och ålder (Rekommendationsgrad D). Biverkningar av bisfosfonater Gastrointestinala biverkningar förekommer vid behandling med alla bisfosfonater. Allvarliga esofagusbiverkningar är rapporterade för alendronsyra i daglig dosering och man måste därför vid insättning och uppföljning lägga stor vikt vid instruktionen för tablettintag. Långtidseffekterna av bisfosfonater på benvävnad är ofullständigt kända och detta bör medföra en restriktivitet i användningen hos yngre individer. Eftersom bisfosfonater retineras i benvävnad under lång tid finns det en teoretisk risk att skelettet efter ett antal år blir skörare på grund av anrikning av mikrofrakturer. Det måste betonas att denna biverkan inte har observerats i kliniska studier. Särskild försiktighet bör iakttas avseende behandling av fertila kvinnor. En mycket sällsynt biverkan, osteonekros i käkbenet, har beskrivits vid behandling med intravenösa bisfosfonater, företrädesvis vid högdosbehandling av patienter med maligna sjukdomar, ofta myelom. Data avseende den eventuella förekomsten av denna biverkan hos patienter som behandlas mot osteoporos är otillräckliga. Östrogener och tibolon Östrogenets verkningsmekanism på benmassa är antiresorptiv. Vid östrogensubstitution efter menopausen normaliseras den ökade benomsättningen. Tibolon har östrogenliknande effekter och lindrar typiska klimakteriesymtom och ökar bentäthet i motsvarande grad som östrogenbehandling (Evidensgrad 1a). De flesta östrogenpreparat (konjugerade ekvina östrogener och östradiol) har tidigare haft indikationen: ”förebyggande av osteoporos hos kvinnor med ökad risk för framtida benskörhetsfrakturer”. Eftersom östrogenbehandling visats medföra effekter även på ett flertal andra organsystem, har nytta-riskbalansen för östrogen och tibolon vid frakturprevention omprövats. Vid en sammanvägning av nyttan och risken Information från Läkemedelsverket 4:2007 23 Behandlingsrekommendation Behandling av osteoporos förde en viss riskökning för hjärtinfarkt och stroke under första behandlingsåret (Evidensgrad 1b). Subgruppsanalyser talade för att risken för hjärtinfarkt möjligen inte var ökad om behandlingen påbörjades i nära anslutning till menopaus. En hittills opublicerad studie med tibolon i dosen 1,25 mg per dag, avseende frakturprevention hos äldre kvinnor (medelålder 68 år) avbröts i förtid på grund av en ökad risk för stroke i behandlingsgruppen. Oralt östrogen och östrogen-gestagen i kombination innebär en nära trefaldig ökning av risken för venös tromboembolism, VTE (Evidensgrad 1b). Risken för VTE vid transdermal tillförsel av östrogen är ofullständigt känd. Raloxifen Raloxifen verkar via östrogenreceptorer och har agonist/antagonistegenskaper beroende på målorgan. Information angående frakturreducerande effekt kommer från en stor multicenterstudie. Pågående behandling med raloxifen minskar risken för kotfraktur hos kvinnor med osteoporos och minskad risk har visats efter fyra års behandling. Effekten på frakturincidens vid långtidsbehandling är oklar, men ökningen i bentäthet kvarstod efter sju års behandling. Däremot har ingen skyddseffekt på övriga frakturer visats (Evidensgrad 1b). Data talar för att effekten på bentätheten avtar inom första året efter utsättning. Raloxifen ger minskad risk för östrogenreceptorpositiv bröstcancer (Evidensgrad 1a). För endometriecancer har förändrad risk ej påvisats. Risken för trombos och lungemboli har visats öka i motsvarande grad som vid östrogenbehandling, medan risken för hjärt-kärlsjukdom inte påverkas (Evidensgrad 1a). Raloxifen kan förstärka vasomotoriska postmenopausala symtom. Paratyreoideahormon Två preparat finns på marknaden. Teriparatid (PTH 1–34) är ett bioteknologiskt framställt fragment av naturligt förekommande paratyreoideahormon. PTH 1–84 (parathormon) är rekombinant intakt paratyreoideahormon. Läkemedlen tillförs som dagliga subkutana injektioner. Till skillnad från bisfosfonater och östrogener verkar dessa läkemedel inte antiresorptivt utan genom att stimulera osteoblaster till ökad benbildning, dvs. har anabol effekt. Teriparatid En randomiserad, kontrollerad studie med teriparatid hos kvinnor med manifest postmenopausal osteoporos har visat ökad benmassa i ländrygg och höft samt frakturreduktion vad gäller kotfrakturer och perifera frakturer (Evidensgrad 1b). Data saknas avseende höftfrakturer. En studie på män visade liknande ökning av benmassa. Studien var liten med kort uppföljningstid, och frakturdata är otillräckliga. Teriparatid är godkänt i EU för behandling av manifest osteoporos hos postmenopausala kvinnor. 24 Information från Läkemedelsverket 4:2007 Parathormon (PTH 1–84) En randomiserad, kontrollerad studie med PTH 1– 84 hos kvinnor med postmenopausal osteoporos har också visat goda effekter på bentäthet i rygg och höft, men frakturreduktion enbart avseende kotfrakturer (Evidensgrad 1b). Jämförande studier med andra osteoporosläkemedel saknas. PTH 1–84 är godkänt för behandling av osteoporos hos postmenopausala kvinnor med hög risk för frakturer. Kalcium och vitamin D skall ges som basbehandling liksom vid övrig benspecifik behandling. Rekommenderad behandlingstid för teriparatid bör ej överstiga 18 månader. För PTH 1–84 är rekommenderad behandlingstid 18 månader, baserat på studien som ligger till grund för dess registrering, men erfarenhet av behandling upp till 24 månader finns. Efter behandlingen får individuella bedömningar avgöra ifall patienten bör fortsätta behandling med antiresorptiva läkemedel. Flera studier har visat att förlust av benmassa efter utsättning av PTH-behandling kan förhindras av antiresorptiv behandling. Erfarenheter av kombinationsbehandling och cyklisk behandling är otillräckliga. Det måste framhållas att erfarenheterna av dessa läkemedel i dagsläget är begränsade, varför preparaten bör vara förbehållna specialkunniga läkare med stor erfarenhet av osteoporosbehandling. Det är också önskvärt med en systematisk uppföljning av användningen, t.ex. i form av ett kvalitetsregister. Användningen bör vara individualiserad och läkemedlen bör endast ges vid uttalad manifest postmenopausal osteoporos eller postmenopausal osteoporos med hög risk för fraktur. Läkemedlen är inte godkända för användning hos män. Enligt beslut i Läkemedelsförmånsnämnden är teriparatid och parathormon förmånsberättigade för behandling av postmenopausala kvinnor: 1) som andra- eller tredjehandsbehandling vid bentäthet med T-score mindre än – 2,5 och då: a) Patienten haft minst en klinisk kotfraktur och det dokumenteras att patienten på grund av biverkningar eller kontraindikationer inte tolererar annan benskörhetsbehandling (bisfosfonat, raloxifen eller strontiumranelat); b) patienten drabbats av upprepade (minst två) kliniska kotfrakturer under pågående behandling med bisfosfonat, raloxifen eller strontiumranelat. 2) som förstahandsbehandling endast för patienter som har T-score < – 3 och har haft upprepade (minst två) kliniska kotfrakturer samt efter utredning bedöms ha mycket hög risk för ny kotfraktur. Strontiumranelat Strontiumranelat är ett salt av tvåvärt strontium och den flervärda organiska syran ranelsyra. Strontium retineras i benvävnad genom adhesion och inlagring i hydroxiapatitkristaller. Verkningsmekanismen för strontiumranelat är inte helt klarlagd. Strontiumbehandling har en tydlig antiresorptiv effekt, men det Behandlingsrekommendation Behandling av osteoporos att farmakologisk behandling av patienter med hög risk för fraktur är kostnadseffektiv, varför att nyttan överväger riskerna. Tydligast konsekvenser får detta resonemang när man beaktar kvinnor tidigt efter menopaus. Hos dessa är det oftast inte nödvändigt att intervenera farmakologiskt enbart på basen av ett lågt bentäthetsvärde. Med stigande ålder ökar frakturrisken och vid en viss absolut risk för fraktur blir det kostnadseffektivt att behandla med farmaka. kan även föreligga en viss benuppbyggande effekt. I kliniska studier har behandling med strontiumranelat visat sig öka benmineralinnehållet i rygg och höft samt reducera förekomsten av vertebrala och ickevertebrala frakturer. Hos högriskpatienter sågs också reduktion av risken för höftfraktur (Evidensgrad 1b). Det är knappast meningsfullt att följa BMD under behandling med läkemedlet på grund av att strontium inlagras i skelettet, vilket medför falskt förhöjt BMD-värde. Kliniska studier med strontiumranelat har visat minskad frakturrisk hos personer över 80 års ålder, medan dokumentationen avseende behandlingseffekt av övriga läkemedel mot osteoporos hos personer i denna åldersgrupp är bristfällig. Strontiumranelat är godkänt för behandling av postmenopausal osteoporos. Kalcium- och vitamin D-tillskott bör ges i samband med behandlingen. Det finns data på effekt och biverkningar upp till tre år och femårsdata beräknas komma 2007. Strontiumranelat är inte studerat för behandling av osteoporos hos män eller vid glukokortikoidinducerad osteoporos. Strontiumranelat ingår i läkemedelsförmånerna för benskörhetsbehandling av postmenopausala kvinnor. Subventionen är begränsad till kvinnor som inte kan behandlas med bisfosfonater och till kvinnor som vid behandlingsstart är 74 år eller äldre. Övriga medel Utöver de ovan nämnda läkemedlen förekommer dokumentation av varierande kvalitet för ett flertal andra läkemedel som t.ex. kalcitonin och fluorider. För närmare värdering av dessa hänvisas till SBU-rapporten 2003 (www.sbu.se). Behandlingsindikationer Indikationerna för behandling baseras på en sammanvägd bedömning av individen och innefattar de starka riskfaktorerna – hög ålder, hereditet (förälder med fraktur i höft eller kota), tidigare fraktur och låg bentäthet – samt en bedömning av de svaga riskfaktorerna. Åldersaspekten måste alltid vägas in, eftersom frakturrisken ökar betydligt allt eftersom åldern ökar. Vid mycket hög risk för kotkompressioner bör å andra sidan behandlingen inte fördröjas, eftersom antalet förlorade kvalitetsjusterade levnadsår blir större ju tidigare patienten drabbas av multipla kotkompressioner. För kvinnor under cirka 60 år bör man därför vara mer restriktiv med att behandla när enbart låg benmassa föreligger. I övrigt rekommenderas följande behandling avseende primär osteoporos: • Vid tidigare osteoporosrelaterad fraktur och låg bentäthet (T-score < – 2,0) • Vid låg bentäthet (T-score < – 2,5) samt minst en annan stark riskfaktor eller minst två svaga riskfaktorer. Hos gamla kvinnor med multipla kotkompressioner (två eller fler) kan behandling med specifik antiresorptiv terapi eventuellt inledas utan föregående bentäthetsmätning. En behandlingsplan bör upprättas och behandlingstiden specificeras när behandlingen inleds. En kontakt med patienten ett par månader efter insatt behandling kan vara effektivt för att säkra att preparatet tas på rätt sätt och inte ger besvärande biverkningar. Rekommendationer avseende läkemedelsval framgår av Tabell II. Indikationer för farmakologisk behandling av postmenopausala kvinnor Behovet av läkemedelsbehandling bör baseras på en sammanvägd riskvärdering och inte uteslutande på bentäthetsmätningar. Ju fler riskfaktorer som föreligger, desto starkare är indikationen för behandling. En av de starkaste riskfaktorerna är att patienten tidigare har haft lågenergifraktur och här är kotkompression kanske den starkaste indikationen för fortsatt utredning. Fragilitetsfraktur kan sägas vara ett biologiskt test både av skelettets styrka och fallbenägenheten. Tyvärr saknas ännu det skattningsinstrument som krävs för att behandlingsindikationen i större utsträckning skall kunna bygga på patientens tioåriga absoluta risk för fraktur. Riskfaktorer som leder till mätning av benmassan (se avsnitt Mätning av bentäthet) samt resultatet av bentäthetsmätningen utgör oftast basen för indikationsbedömning. Att behandla enbart låg bentäthet hos en patient som i övrigt inte uppvisar riskfaktorer för fraktur är inte hälsoekonomiskt motiverat och balansen mellan nytta och risk är svårvärderad. Omvänt gäller Rekommendationer avseende användningen av andrahandsläkemedlen Raloxifen Behandling med raloxifen kan framför allt övervägas hos kvinnor med hög risk för framtida fraktur och ökad risk för bröstcancer, som inte tål eller har kontraindikationer mot andra läkemedel godkända för att förebygga osteoporos. Stontiumranelat Stontiumranelat kan övervägas som alternativ till bisfosfonater om kvinnan inte tål eller har kontraindikationer mot dessa läkemedel. Detta gäller speciellt kvinnor över 60 års ålder. Information från Läkemedelsverket 4:2007 25 Behandlingsrekommendation Behandling av osteoporos Teriparatid och PTH 1–84 Teriparatid och PTH 1–84 skall vara förbehållet kvinnor med mycket låg bentäthet och mycket hög risk för nya kotkompressioner. För indikationer v.g. se tidigare avsnitt om paratyreoideahormon samt FASS och LFN! Preparatet bör bara användas av läkare med stor erfarenhet av osteoporosbehandling. Östrogen Det finns inget stöd för frakturförebyggande behandling med östrogen eller tibolon till friska postmenopausala kvinnor utan ökad risk för fraktur och utan klimakteriesymtom (Rekommendationsgrad A). Prevention av benförlust på grund av förtidig östrogenbrist Kvinnor med tidig menopaus, < 45 år, kan erbjudas sedvanlig hormonsubstitution till normal menopausålder (Rekommendationsgrad D). Till yngre kvinnor med för åldern låg benmassa på grund av långvarig amenorré till följd av undervikt eller överträning kan vanliga kombinerade lågdoserade p-piller eller preparat som används vid hormonsubstitution i klimakteriet användas. Dessa medel kombinerade med förbättrad nutrition och viktuppgång skyddar sannolikt mot benförlust, men dokumentationen är sparsam (Rekommendationsgrad D). Frakturprevention med östrogen Postmenopausala kvinnor upp till 60 års ålder med behandling med östrogen eller tibolon på grund av klimakteriesymtom och som har hög frakturrisk behöver inte ges annan samtidig läkemedelsbehandling för att förebygga fraktur (Rekommendationsgrad A). Hormonsubstitution bör ges under kortast möjliga tid och endast så länge östrogenbristsymtom kvarstår. För postmenopausala kvinnor utan klimakteriesymtom, men med hög frakturrisk, är risk-nyttabalansen för östrogen och tibolon sannolikt negativ, varför dessa läkemedel ej kan rekommenderas. Östrogenbehandling under cirka tre till fem år kan dock övervägas till kvinnor < 60 år som inte tolererar eller har kontraindikationer mot andra behandlingsmetoder mot osteoporos (Rekommendationsgrad A). Män med osteoporos Även män drabbas av osteoporos och frakturer. Män och kvinnor med fragilitetsfraktur bör i princip utredas lika. Livstidsrisken för fraktur hos medelålders män är cirka 25 %. Riskfaktorer för åldersrelaterad osteoporos och frakturer är huvudsakligen desamma för män och kvinnor. Sekundära former av osteoporos utgör sannolikt en större andel av osteoporosfallen hos män än hos kvinnor, särskilt före 65 års ålder. Förhållandet mellan bentäthet och frakturrisk förefaller vara detsamma hos både män och kvinnor. Det råder ej konsensus angående den operationella (T-score-baserade) definitionen av osteoporos hos män, men i klinisk praxis används tills vidare samma definition som för kvinnor. Vid T-score < –2,5 SD och förekomst av lågenergiutlöst fraktur ställs diagnosen manifest osteoporos. Som referenspopulation används då unga friska mäns bentäthetsvärde. Behandling Specifik osteoporosbehandling, i första hand alendronsyra eller risedronsyra (Rekommendationsgrad A), är indicerad hos män med fragilitetsfrakturer och låg benmassa, eller glukokortikoidbehandling (se nedan). Tillskott med 0,5–1,0 g kalcium och 20 mikrogram vitamin D kan utgöra hela behandlingen hos de biologiskt äldsta männen. Sekundär osteoporos Sjukdomar som leder till ökad risk för sekundär osteoporos och fraktur är exempelvis inflammatorisk reumatisk sjukdom, inflammatorisk tarmsjukdom, malabsorption (t.ex. celiaki), primär hyperparatyreoidism, kroniskt obstruktiv lungsjukdom (KOL) och hypogonadism. Även vid Parkinsons sjukdom och efter stroke är frakturrisken hög på grund av sänkt bentäthet och ökad falltendens. Den viktigaste åtgärden är att diagnostisera och behandla grundsjukdomen. Detta kan i vissa fall som vid celiaki och primär hyperparatyreoidism räcka för Tabell II. Terapival vid behandling av patienter med hög risk för fraktur. Patientkategori Förstahandsval Kvinnor med hög frakturrisk Bisfosfonat * Män med hög frakturrisk Alendronsyra * Risedronsyra* Kalcium + vit D Män och kvinnor > 80 år med hög frakturrisk och som ej bedöms lämpliga för annan aktiv behandling Andrahandsval (ej rangordnade) (teriparatid och PTH 1–84)* Raloxifen* Strontiumranelat* Östrogen* Kommentar Vid uttalad risk för kotkompression kan teriparatid och PTH 1–84 övervägas som förstaeller andrahandsval *Vid all behandling med skelettspecifika läkemedel rekommenderas kalcium och vitamin D som basbehandling. 26 Information från Läkemedelsverket 4:2007 Behandlingsrekommendation Behandling av osteoporos att bentätheten skall normaliseras efter två till tre år. När bästa möjliga behandling av grundsjukdomen inte räcker för att motverka osteoporos kan behandling med osteoporosläkemedel bli aktuell. Samma läkemedelsval som vid behandling av primär osteoporos kan övervägas (Rekommendationsgrad D) (se ovan). Läkemedel som medför ökad risk för sänkt benmassa är exempelvis glukokortikoider (se nedan) vissa anti­ epileptika, långtidsbehandling med heparin, läkemedel som sänker könshormonnivåerna (aromatashämmare vid bröstcancer och GnRH-behandling vid prostatacancer) samt immunsupprimerande läkemedel. Nyligen har visats att typ 2-diabetesläkemedlen tiazolodindioner (pioglitazon och rosiglitazon) ökar frakturrisken hos kvinnor men ej hos män. Verkningsmekanismen är okänd. Användning av dessa läkemedel skall vägas in i den övergripande behandlingsstrategin vid såväl primär som sekundär osteoporos. Glukokortikoidinducerad osteoporos Den vanligaste orsaken till sekundär osteoporos är oral glukokortikoidbehandling. Mekanismerna är bland annat hämning av benformationen, ökning av benresorptionen, sänkt absorption av kalcium i tarmen samt ökad risk för hypogonadism. Förlusten av bentäthet är störst de första tre till sex månaderna av behandlingsfasen, men känsligheten är individuell och det finns ingen säker lägsta dos. Såväl den dagliga som den kumulativa dosen är av betydelse. Varannandagsbehandling minskar inte risken för osteoporos. Glukokortikoider i inhalationsform i höga doser medför ökad risk för osteoporos (Evidensgrad 2b). Vid glukokortikoidbehandling finns hög risk för fraktur redan vid T-score < – 1,0 SD. När behandling med glukokortikoid inleds skall patienten värderas även avseende övriga riskfaktorer för osteoporos och fraktur (se Faktaruta 2). Om möjligt görs bentäthetsmätning, men om tillgång till DXA saknas kan aktiv osteoporosbehandling ändå starkt övervägas utifrån övriga riskfaktorer. Bentäthetsvärdet ska bedömas som ytterligare en riskfaktor. Man bör överväga antiresorptiv behanding parallellt med insättande av glukokortikoider, särskilt till patienter med andra riskfaktorer. • Patient med tidigare lågenergifraktur bör erhålla behandling med bisfosfonat när glukokortikoidbehandling ges (Rekommendationsgrad A). • Till patienter utan tidigare fraktur rekommenderas bentäthetsmätning och insättande av bisfosfonat vid T-score ≤ – 1,0 SD. Behandlingen bör fortgå så länge patienten medicinerar med glukokortikoider. Tillskott av kalcium och vitamin D bör ges (Rekommendationsgrad A), eftersom detta motverkar förlust av benmassa (Evidensgrad 1a). Smärtbehandling Det finns inga hållpunkter för att osteoporos i sig orsakar kroniska smärtor. Symtomen uppkommer efter akuta frakturer eller som sviter efter tidigare frakturer. Flera studier har visat att ju fler radiologiskt påvisade kotkompressioner som föreligger, desto större sannolikhet är det att patienten har eller har haft ryggsmärtor. Kotkompressioner är en ovanlig orsak till ryggvärk hos yngre friska patienter. Bland äldre kvinnor och kortisonbehandlade patienter är ryggvärk däremot ofta orsakad av kotkompressioner (Evidensgrad 2b). Det finns inga skäl att frångå vanliga principer för smärtlindrande behandling vid osteoporosfrakturer. Ofta underskattas smärtproblematiken i denna patientgrupp; den kan vara så svår att behandling med opiater kan bli nödvändig. Vad gäller icke-farmakologisk behandling av smärta finns studier som talar för gynnsamma effekter av träning vid ryggont hos kvinnor med osteoporosrelaterade kotfrakturer (Evidensgrad 2b). Vad gäller ortoser finns det otillräckliga data för att avgöra huruvida korsetter eller dylikt kan användas för att lindra smärta. Vertebro- och kyfoplastik Under det senaste decenniet har vid osteoporotiska kotkompressioner två nya behandlingsmetoder introducerats, perkutan vertebro- och kyfoplastik. Vid vertebroplastik fixeras en smärtande frakturerad kotkropp med bencement. Vid kyfoplastik införs en ballong i kotkroppen, varefter ballongen blåses upp för att försöka återställa kotkroppens höjd, innan cementering utförs. En extensiv litteratur av lågt bevisvärde samt ett fåtal kontrollerade studier indikerar samfälligt att metoderna medför en i det närmaste omedelbar såväl smärtlindring som funktionell förbättring hos en hög andel av patienterna (Evidensgrad 3). Effekterna på längre sikt är otillräckligt studerade (Evidensgrad 4). I sällsynta fall har det inträffat mycket allvarliga komplikationer i anslutning till ingreppen. I avsaknad av adekvata randomiserade kontrollerade studier måste manas till återhållsamhet med cementering av kotfrakturer. Ingreppen bör utföras på strikta indikationer där man vägt nyttan mot risken för komplikationer och osäkerheten beträffande långtidsrisker. Ingreppen förefaller leda till en ökad risk att drabbas av nya kotfrakturer, främst i anslutning till den stabiliserade kotan, men även här råder osäkerhet. Information från Läkemedelsverket 4:2007 27 Behandlingsrekommendation Behandling av osteoporos Kvalitetsgradering av evidens (efter NHS Research and Developement, 1999; http://www.cebm.net/levels_of_evidence.asp#levels). 1 a Systematisk analys av randomiserade kontrollerade studier med homogenicitet 1 b Minst en stor randomiserad kontrollerad studie 1 c ”Allt eller intet” uppfylls när alla patienter dog innan behandlingen blev tillgänglig men några överlever med behandlingen, eller – några överlevde utan behandling men med behandling överlever alla 2 a Systematisk analys av kohortstudier med homogenicitet 2 b Individuella kohortstudier inklusive randomiserade kontrollerade studier med lågt bevisvärde (låg kvalitet, vida konfidensintervall, låg inklusion av vissa subgrupper i en studie etc.) 2 c ”Utfallsstudier” (”Outcomes Research”) 3 a Systematisk analys av fall-kontrollstudier med homogenicitet 3 b Individuella fall-kontrollstudier 4 Fallserier med fall-kontrollstudier och kohortstudier med låg kvalitet 5 Expertsynpunkter utan kritiska analyser eller baserade på fysiologi etc. Gradering av rekommendationer A Baseras på evidensgrad 1a, b eller c B Baseras på evidensgrad 2a, b och c samt 3a och b C Baseras på evidensgrad 4 D Baseras på evidensgrad 5 Deltagarlista Deltagarnas jävsförhållanden kan erhållas från Läkemedelsverket. Professor Björn Beermann Läkemedelsverket Box 26 751 03 Uppsala Distriktsläkare Håkan Bergh Vårdcentralen Gruebäck 311 22 Falkenberg Assistent Cristina Bergström Läkemedelsverket Box 26 751 03 Uppsala Kursusreservelæge, Dr med Nina Bjarnason Klinisk Farmakologisk Enhed, opg. 4B KAS-Gentofte Niels Andersensvej 65 2900 Hellerup Danmark Distriktsläkare Åsa Bläckberg Mariehems Vårdcentral 906 51 Umeå Overlege Johan Halse Osteoporoseklinikken Pilestredet Park 7 N-0176 Oslo Norge Professor Magnus Karlsson Ortopediska kliniken Universitetssjukhuset MAS 205 02 Malmö Farmaceut Karin Klintberg Läkemedelsverket Box 26 751 03 Uppsala Överläkare Bente Langdahl Endokrin avd C Århus sjuhus Tage Hansens Gade 2 8000 Aarhus C Danmark Docent Kerstin Claesson Läkemedelsverket Box 26 751 03 Uppsala Univ lektor, Professor Östen Ljunggren Onkologi, Thorax och Medicin Specialmedicin Metabolmottagningen Akademiska sjukhuset 751 85 Uppsala Överläkare Bo Freyschuss SBU Box 5650 114 86 Stockholm Professor Dan Mellström Osteoporosmottagningen, geriatriska kliniken Sahlgrenska Universitetssjukhuset/Östra 411 32 Göteborg 28 Information från Läkemedelsverket 4:2007 Behandlingsrekommendation Behandling av osteoporos Univ lektor, Docent Tord Naessen Kvinnokliniken Akademiska sjukhuset 751 85 Uppsala Professor Olle Svensson Ortopediska kliniken Norrlands Universitetssjukhus 901 85 Umeå Överläkare Britt-Marie Nyhäll-Wåhlin Reumatologkliniken Falu lasarett 791 82 Falun Överläkare, Docent Göran Toss Endokrin- och magtarmmedicin Universitetssjukhuset 581 85 Linköping Professor Viveca Odlind Läkemedelsverket Box 26 751 03 Uppsala Univ lektor, Docent Ove Törring Sektionen för endokrinologi Vo Medicin Södersjukhuset 118 83 Stockholm Docent, Överläkare Mats Palmér Kliniken för metabolism och endokrinologi Karolinska Universitetssjukhuset, Huddinge 141 86 Stockholm Överläkare Ewa Waern Geriatriska kliniken Sahlgrenska Universitetssjukhuset/Mölndal 431 80 Mölndal Med dr Anna Ramnemark Medicinkliniken Norrlands Universitetssjukhus 901 85 Umeå Univ lektor, Överläkare Kristina Åkesson Ortopediska kliniken Universitetssjukhuset MAS 205 02 Malmö Distriktsläkare Christina Rönnmark Kvarnholmens Vårdcentral 391 26 Kalmar Information från Läkemedelsverket 4:2007 29 Bakgrundsdokumentation Behandling av osteoporos Behandling av osteoporos – Bakgrundsdokumentation Artiklar publicerade under rubriken Bakgrundsdokumentation är författarens enskilda manuskript. Budskapet i dessa delas därför inte alltid av expertgruppen i sin helhet. Hur definieras hög risk för fraktur? Vem bör få behandling för osteoporos? Östen Ljunggren, Dan Mellström Antalet fragilitetsfrakturer i samhället är mycket högt, uppskattningsvis 70 000 per år enbart i Sverige. I takt med att befolkningen åldras kommer detta problem att öka om inget görs. Primärpreventiva åtgärder i samhället såsom att befrämja motion och att implementera sunt leverne kan mycket väl få stora effekter, men det är svårt att leda i bevis nyttan av dessa åtgärder. Skelettspecifika läkemedel har å andra sidan övertygande visat sig kunna minska förekomst av fraktur i högriskgrupper. Problemet är nu snarast ett hälsoekonomiskt, nämligen vem som skall få dessa läkemedel och hur mycket det får kosta. Det är mot denna bakgrund som riskfaktorer för osteoporos bör ses. De används i kliniken för att värdera patientens risk för fraktur, och ligger till grund för en sammanfattande bedömning huruvida patienten skall erbjudas skelettspecifik behandling eller inte. I denna artikel summeras kunskapsläget vad gäller riskfaktorer för fraktur. Vidare förklaras begreppen absolut versus relativ risk för fraktur. En uppdatering över hur långt den absoluta riskbedömningen har nått i kliniken ges också. Riskfaktorer för fraktur Det råder en viss förvirring vad det gäller riskfaktorbegreppet. Ibland nämns riskfaktorer för osteoporos, ibland för fraktur. Viktigt att slå fast är att osteoporos i sig inte är att betrakta som en sjukdom utan mera som en central riskfaktor för fraktur. Epidemiologiska studier har påvisat ett stort antal faktorer som kan predisponera för fraktur. SBU sammanfattade kunskapsläget 2003 och sedan dess har det endast tillkommit mindre förändringar (1). I Tabell I återfinns de riskfaktorer vars dokumentation befanns ha högt bevisvärde. Nedan kommenteras de tyngst vägande riskfaktorerna. Hög ålder Stigande ålder är den enskilt starkaste riskfaktorn för fragilitetsfraktur. Ålder är emellertid en svår riskfaktor att arbeta med då den ej går att påverka. Till viss del kan man dock bortse från den i och med att de övriga riskfaktorerna tenderar att ackumuleras vid hög 30 Information från Läkemedelsverket 4:2007 ålder. Bentätheten minskar och prevalenta frakturers antal ökar (2). Detta faktum gör att man inte nödvändigtvis måste inkludera hög ålder som en oberoende riskfaktor. Tabell I. Riskfaktorer med högt bevisvärde. Icke påverkbara Hög ålder Tidigare fraktur Kvinnligt kön Tidig menopaus Ärftlighet Etnicitet Kroppslängd Påverkbara Fysisk inaktivitet Låg vikt/lågt BMI Kortisonbehandling Låg bentäthet Fallbenägenhet Tobaksrökning Hög alkoholkonsumtion Låg solexposition Nedsatt syn Tidigare fraktur Förekomst av tidigare fraktur ger en relativ riskökning på uppemot två (1). Särskilt tydlig är denna när man betraktar det prediktiva värdet av en prevalent kotkompression för prospektiva kotkompressioner. Detta är naturligt och förståeligt, eftersom en tidigare fraktur på något sätt inkluderar samtliga riskfaktorer – de vi kan mäta samt eventuellt andra. Just fraktur har dessutom en särskild valör. Målsättningen med osteoporosbehandling är att förebygga frakturer. Om en patient har haft en fraktur är det att likna vid sekundärpreventiv medicinering att förebygga nästa, medan en samling relativa riskfaktorer i sig kan medföra hög risk för fraktur, men detta är att betraktas som primärpreventiv behandling. 30 Bakgrundsdokumentation Behandling av osteoporos Kvinnligt kön Kvinnor har en klart ökad risk för fraktur. Detta tillskrivs dels en lägre maximal benmassa, dels en ökad förlusthastighet efter menopaus. Eftersom postmenopausala kvinnor kommer att behandlas utefter en egen algoritm, och äldre män troligtvis efter en egen, behöver man inte beakta just kön i den individuella riskbedömningen (1). Osteoporos Låg benmassa är en central riskfaktor för fraktur. Denna faktor reproduceras i alla frakturepidemiologiska studier som finns tillgängliga. Det tycks finnas ett samband där 10 % nedgång i bentäthet – vilket motsvarar ungefär en standarddeviation – medför en dubblerad risk för fraktur (3). Detta tycks gälla för både postmenopausala kvinnor och äldre män. Givet det centrala värdet av att mäta just bentätheten, har denna riskfaktor varit den centrala i kliniken. Det har dock diskuterats huruvida andra faktorer såsom vikt i princip kan förklara riskökningen vid lågt BMD eftersom vikt och BMD är starkt kopplade. I denna problematik ligger naturligtvis svårigheten att mäta bentäthet på ett pålitligt sätt. Klart är att en optimal mätteknik vad gäller skelettets hållfasthet vore det bästa måttet. Som det nu är används DXA av främst rygg och höft. Detta ger en tvådimensionell bild av skelettet och har ofta kritiserats för att rymma storleksartefakter i sig. Emellertid är BMD mätt enligt DXA ett av de mest pålitliga måtten av ökad risk för fraktur. Just detta mått avspeglar skelettets hållfasthet tämligen väl och har bland annat använts för att selektera patienter till läkemedelsprövningarna som visat på frakturreduktion. Detta har medfört att, vad gäller riskfaktorn låg bentäthet, så använder vi idag DXA-värden enligt T-score i behandlingsalgoritmer. Den operativa definitionen av osteoporos baseras på denna teknik. Sammanfattningsvis vad gäller bentäthet så är det enda måttet vi kan erhålla med rimlig standardisering som speglar skelettets hållfasthet. Som sådant har det en avgörande roll när man beslutar om behandling. Kortisonbehandling Kortisonbehandling i tablettform, 5 mg prednisolon eller mer i tre månader eller mer, är för en enskild individ en tung riskfaktor för fraktur (4). Eftersom detta är en relativt ovanlig företeelse i populationen så innebär det att kortisonets totala effekt på frakturförekomst i samhället är begränsad. Vidare medför kortisonbehandling en riskökning som inte fullt ut kan förklaras med en nedgång i bentäthet, dvs. kortisonbehandling är dels en bakomliggande orsak till osteoporos, dvs. låg benmassa, dels medför det en oberoende risk för fraktur. Kanske medieras detta av bakomliggande sjukdomar eller av effekter på muskel. Ärftlighet Arvet spelar en avgörande roll för individens framtida risk att få en fraktur. Bentätheten kan vara så 31 Information från Läkemedelsverket mycket som till 70 % beroende på genetiska variationer och således är diagnosen osteoporos baserad på bentäthetsmätning något som ofta ses i släkter. Det finns emellertid faktorer i arvet utöver bentäthet som predisponerar för fraktur. Detta kan vara saker som balans och muskelstyrka, och övriga kroppsmått såsom längd. Tillsammans medför detta att fraktur hos förälder leder till en dubblerad risk för fraktur hos postmenopausala kvinnor och äldre män (5). Tidig menopaus Tidig menopaus, före 45 års ålder, är starkt förknippad med låg bentäthet vid högre ålder. Generellt gäller att en postmenopausal kvinna förlorar benmassa årligen och antal år med adekvat östrogennivåer är en skyddsfaktor (1). Låg vikt Lågt BMI eller låg absolut vikt hos postmenopausala kvinnor är starkt förknippade med risk för osteoporosrelaterad fraktur (6). Mekanismen tros vara en kombination av att låg vikt medför låg belastning på skelettet som därför adapterar till en mindre bentäthet. Vidare medför låg fettmassa hos postmenopausala kvinnor att de har lägre nivåer av östrogen. Slutligen tros en rent mekanisk skyddseffekt av att ha fettmassa runt till exempel höftleden leda till lägre frakturrisk. Rökning Rökning är en riskfaktor vars inflytande har varierat något mellan olika studier (7). Troligtvis medför rökning multipla negativa effekter på benvävnaden – dels indirekta via köns- och steroidhormoner, dels direkta effekter på benceller. Övriga riskfaktorer Utöver de ovan nämnda faktorerna finns ett antal relativa riskfaktorer vars enskilda värde som frakturprediktor kan vara svårt att avgöra, antingen på grund av att de är svårbestämda eller på grund av olikheter mellan rapporter. Hit hör till exempel faktorer som ökad falltendens, nedsatt syn, låg fysisk aktivitetsnivå etc. Sjukdomar och läkemedel Det finns ett flertal läkemedel och sjukdomar som starkt predikterar fraktur. Hit hör, förutom kortison, bland annat heparin, aromatashämmare etc. Bland sjukdomar räknas ofta KOL, njursjukdom, hyperparatyreoidism, tyreoideasjukdom, celiaki. Dessa är emellertid inte att betrakta som riskfaktorer i sig utan som orsaker till sekundära osteoporosformer. I de behandlingsalgoritmer för osteoporos som utvecklats ligger fokus på att värdera risken för primär osteoporos. Ett läkemedel, kortison, har dock en så tydlig negativ effekt och är relativt vanlig, så exposition för kortison brukar tas med i bedömningen. I kliniskt bruk anges ofta peroralt bruk av 5 mg prednisolon eller mer för mer än tre månader. Synergieffekter av riskfaktorer En central aspekt vad gäller riskfaktorer för fraktur är att de oberoende riskfaktorerna synergerar i sin Information från Läkemedelsverket 4:2007 31 Bakgrundsdokumentation Behandling av osteoporos förmåga att prediktera fraktur. Detta är bland annat visat tydligt i SOF-studien, där låg bentäthet i sig endast gav en relativt lindrig ökad risk för fraktur, men om denna riskfaktor kombinerades med en eller flera andra, icke-medierade via bentäthet, erhölls en markant ökad risk för prospektiva frakturer. Det är så riskfaktorer kommer att användas i kliniken; de som insamlas kommer att kombineras med bentäthet för att erhålla olika riskfaktorprofiler. Till exempel värderas tidigare fraktur + låg bentäthet annorlunda än enbart låg bentäthet. Riskfaktorer för fraktur hos äldre män Fragilitetsfrakturer är vanliga hos äldre män. En man löper cirka tredjedelen av risken som en kvinna löper att drabbas av en osteoporosrelaterad fraktur. I kliniken är det vanligtvis höftfrakturer och inte så ofta kotkompressioner som är det kliniska problemet. Observera att definitionen av osteoporos såsom den är definierad för kvinnor enligt DXA inte gäller för män. Överhuvudtaget är riskfaktorer för fraktur mindre etablerade för män. Dock har det stora WHO-arbetet med en världskohort visat på stora likheter vad gäller mäns och kvinnors riskfaktorer för fraktur. Således tycks värdet av en tidigare fraktur, låg bentäthet och ärftlighet för fraktur ha identisk inverkan på risken att drabbas av ny fraktur (8). Det är därför möjligt att vi framgent kommer att ha liknande algoritmer för män och kvinnor vad gäller riskbedömning, men att det kanske krävs starkare uttalade riskfaktorer för män eftersom incidensen av fraktur är lägre. Riskbedömning, relativ versus absolut risk Synen på hur man skall arbeta med riskfaktorer för fraktur varierar stort. Två läger kan skönjas, dels de som bygger sina beslut huvudsakligen på bentäthetsmätningar och dels de som företrädesvis baserar sina kliniska beslut på förekomst av olika riskfaktorer. Som ett led i den senare synen har det under de senaste åren pågått ett intensivt arbete i WHO:s regi för att utarbeta algoritmer för ett globalt skattande av frakturrisk. I dessa algoritmer skall i stort sett alla förekommande riskfaktorer kunna inkluderas och frakturrisken därefter anges i tio års risk för fraktur. Detta är något av ett paradigmskifte ifall det lanseras. Dagens behandlingsrekommendationer baseras i huvudsak på en kombination av vissa riskfaktorer såsom tidigare fraktur och kortisonbehandling samt en fix bentäthet. Detta ger en relativ risk för patienten, medan den absoluta risken för fraktur kan variera avsevärt. Begreppet absolut risk har många teoretiska fördelar. Det medför en likriktning i kliniken. De patienter som ställs in på läkemedel har alla samma risk att få en fraktur. Det är ett relativt enkelt sätt att arbeta på, där riskfaktorer samlas in systematiskt och en patient kan komma upp i en hög risk utan att alltid behöva genomgå bentäthetsmätning, till exempel ärftlig- 32 Information från Läkemedelsverket 4:2007 het i kombination med fraktur och hög ålder. Det finns dock en rad teoretiska och praktiska svårigheter med att införa begreppet absolut risk inom osteoporosområdet. Till att börja med är inte algoritmerna lanserade ännu. Enorma kohortmaterial är insamlade med sammanlagt cirka 90 000 i databasen för närvarande. Arbetet är dock mycket komplext och trots att insamlandet och beräknandet nu pågått mer än fem år visar det sig vara svårt att erhålla tydliga algoritmer som är globala. När så dessa algoritmer väl presenteras måste de naturligtvis granskas i respektive länder. Det kan mycket väl vara så att olika riskfaktorer visar sig ha olika valör i olika befolkningar. Slutligen måste detta sätt att arbeta accepteras av verksamma kliniker. Kommer vi att nöja oss med ett risk-score utan att till exempel mäta bentäthet om vi vill intervenera med ett läkemedel. Hur monitorerar vi effekten och – inte minst nu när det finns olika farmaka – hur väljer vi? Sammantaget gör allt detta att begreppet absolut risk för närvarande måste anses avlägsen i kliniken. Riskfaktorerna för fraktur är många och väl dokumenterade. Möjligt är att vi i framtiden har tillgång till genetiska tester, att biokemiska markörer kan användas eller att andra mätmetoder för benstyrka kan användas. Bortsett från detta kommer det troligen inte att dyka upp fler riskfaktorer att ta hänsyn till i kliniken. Vi måste således lära oss att arbeta med de befintliga. Begreppet absolut risk är tilltalande ur en akademisk synvinkel, men de praktiska svårigheterna med att utfärda dessa har gjort att vi för närvarande inte kan överblicka när dessa kommer att lanseras. De indikationer för behandling vi arbetar med idag är dock otydliga. Att initiera skelettspecifik behandling lämnas alltför mycket upp till den enskilda läkarens bedömning av olika faktorer. Denna otydlighet kan leda till underbehandling och eventuellt även behandling av patienter med mycket låg risk för fraktur. Det är författarnas övertygelse att vi inte längre kan vänta på att begreppet absolut risk har slagit igenom i kliniken. Vi måste därför besluta om behandlingsrekommendationer enligt bästa förmåga. Dessa kan därefter modifieras i takt med att begreppet absolut risk eventuellt lanseras i kliniken. Vilka hårda data har vi då att tillgå? En hel del faktiskt. Frakturrisk finns väl dokumenterad inte bara i olika epidemiologiska studier utan även från placeboarmarna i fas III-studier med skelettspecifika läkemedelsprövningar. Utifrån dessa kan vi värdera åtminstone två centrala faktorer: tidigare fraktur och låg bentäthet. Förslagsvis fokuseras behandlingsrekommendationerna på ett mindre antal riskfaktorer utöver fraktur och BMD (8). Dessa faktorer skall användas för att dels eventuellt beställa en bentäthetsmätning, dels för att avgöra ifall behandlingsindikation föreligger (Faktaruta 1). Slutligen skall naturligtvis förekomst av vissa riskfaktorer diskuteras som del i patientbehandlingen. Bakgrundsdokumentation Behandling av osteoporos Faktaruta 1. Vilka riskfaktorer skall utvärderas i anamnes och status? Låg bentäthet enligt DXA, tidigare fraktur, kortisonbehandling, ärftlighet för fraktur är de viktigaste riskfaktorerna i kliniken Riskfaktorer vägs samman för att avgöra om det föreligger en behandlingsindikation. Absolut risk för fraktur är ett begrepp under utveckling. För närvarande finns det inte i kliniken. Referenser Starka riskfaktorer: Tidigare fraktur: Skilj mellan kotkompressioner och perifera frakturer Kortisonbehandling Ärftlighet Relativa riskfaktorer: Lågt BMI Rökning Tidig menopaus 1. Hagenfeldt K, et al. Osteoporos – prevention, diagnostik och behandling.The Swedish Council on Technology Assessment in Health Care 2003. ISBN 91–87890–86–0. 2. Kanis, et al. Ten year probabilities of osteoporotic fractures according to BMD and diagnostic thresholds. Osteoporos Int 2001;12:989–95. 3. Johnell, et al. Predictive value of BMD for hip and other fractures. J Bone Miner Res 2005;20:1185–94. 4. Kanis, et al. A meta-analysis of prior corticosteroid use and fracture risk. J Bone Miner Res 2004;19:893–9. 5. Kanis J, et al. A family history of fracture and fracture risk: a meta-analysis. Bone 2004;35:1029–37. 6. De Laet C, et al. The impact of the use of multiple risk indicators for fracture on case finding strategies: a mathematical approach. Osteoporos Int 2005;16:313–8. 7. Kanis J, et al. Smoking and fracture risk: a meta-analysis. Osteoporos Int 2005;16:155–62. 8. Kanis J, et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos Int 2007;24(Epub ahead of print). Vem skall erbjudas bentäthetsmätning? Förekomst av riskfaktorer enligt ovan. Förekomst av annan sjukdom eller medicinering som kan orsaka osteoporos. OBS! En bentäthetsmätning utan egentlig indikation går ej att tolka utifrån befintliga behandlingsalgoritmer. Individuell bedömning av ansvarig doktor krävs i de fall en patient endast uppvisar låg bentäthet och inga andra riskfaktorer. Sammanfattning Det finns ett antal väl definierade riskfaktorer som kan prediktera risk för fraktur hos postmenopausala kvinnor och äldre män. Dessa riskfaktorer har tydliga synergieffekter på risken för fraktur. Information från Läkemedelsverket 4:2007 33 Bakgrundsdokumentation Behandling av osteoporos Vitamin D Bo Freyschuss Det råder en förvirring i nomenklaturen kring vitamin D. I denna skrift är vitamin D ett samlingsnamn och innefattar vitamin D i någon av dess former. Med vitamin D3 åsyftas kolekalciferol. I de fall kalcidiol eller kalcitriol åsyftas, så framgår det av texten. Vitamin D bildas med hjälp av ultraviolett ljus B (UVB) från solen. Vitamin D kan också intas via födan, men endast få födoämnen innehåller vitamin D i större mängd. Detta är feta animaliska födoämnen såsom fet fisk (ål, lax), feta mejeriprodukter och lever. Lättmjölk är i Sverige berikat med vitamin D3, men i låg koncentration. 1,2 liter lättmjölk innehåller cirka 200 E eller 5 mikrogram vitamin D3. Under inverkan av UVB bildas vitamin D3 (kolekalciferol) i huden och därefter sker en automatisk 25-hydroxylering i levern till 25-hydroxivitamin D3 även kallat kalcidiol i vilken form vitamin D lagras i kroppen (huvudsakligen fettväv och lever samt i mindre grad via vitamin D-bindande serumproteiner). Därefter sker en reglerad 1α-hydroxylering av kalcidiol till aktivt vitamin D3 även kallat kalcitriol i njurtubuli. Denna aktivering regleras av ett flertal faktorer där paratyroideahormon och serumkoncentrationerna av fosfat och kalcium sannolikt är viktigast. Den låga vinkeln på solen under vintern i Sverige gör att vi inte kan bilda tillräckligt med vitamin D från september–oktober till mars–april. Denna tidsperiod förlängs ju längre norrut man befinner sig. Vitamin D utövar sin effekt via vitamin D-receptorn (VDR), som tillhör en familj av receptorer kallad tyreoidea- och steroidhormonreceptorfamiljen. Dessa receptorer är lokaliserade intracellulärt, till skillnad från bland annat peptidhormonernas receptorer, som är lokaliserade i cellmembranet. När kalcitriol – den aktiva formen av vitamin D – bundits till VDR sker en samverkan med andra proteiner. Detta leder till aktivering och transkription av specifika gener och följs av syntes av proteiner. VDR är påvisade i stort sett i alla kroppens celler och sannolikt har vitamin D effekter utöver dem som har betydelse för skelettet. Man har diskuterat betydelsen av vitamin D vid ett flertal sjukdomstillstånd utan tydlig relation till kalciumbalans eller skelett, men säkra bevis för en essentiell betydelse av vitamin D avseende dessa har inte påvisats (1). Vitamin D har föreslagits vara viktig för neuromuskulär funktion och en metaanalys innefattande 5 RCT visade minskad fallrisk vid behandling med vitamin D (i någon form inklusive analoger) jämfört med placebo (2). Brist på vitamin D Vitamin D är nödvändig för en normal utveckling och tillväxt av skelettet samt upprätthållande av normal skelettfunktion. Utan vitamin D sker inte mine34 Information från Läkemedelsverket 4:2007 ralisering av skelettet (inbyggnad av kalcium och fosfat i form av hydroxiapatit) på ett adekvat sätt och vid uttalad brist på vitamin D under uppväxten kan rakit, även kallad engelska sjukan, uppstå. Rakit var mycket ovanligt före industrialiseringen, men förekomsten ökade kraftigt i Europas industristäder på grund av bristfällig kost och att man till stor del vistades inomhus. Först på 1930-talet kunde man framställa vitamin D industriellt i stora mängder och populationsbaserade program gjorde att rakit praktiskt taget utplånats i Europa och andra industrialiserade länder. I svåra fall kan rakit medföra kortvuxenhet, frakturer samt även mjuka ben med deformation av skelettet som följd. Vid uttalad brist på vitamin D i vuxen ålder kan osteomalaci uppstå. Vid svår osteomalaci föreligger sänkt benmassa, ökad frakturbenägenhet och generella skelett- och muskelsmärtor. Båda dessa tillstånd botas med vitamin D, men resttillstånd kan kvarstå i form av kvarstående låg benmassa och skelettdeformation. Det är inte fullständigt klarlagt vid vilken koncentration av 25-hydroxivitamin D3 i blodet som brist föreligger. Olika gränser tillämpas. I Norden är kroppens lager av vitamin D och intaget av vitamin D via kosten normalt sett inte tillräckliga för att upprätthålla en konstant serumkoncentration under vintern utan halten av 25-hydroxivitamin D3 i blodet sjunker och är som lägst i februari. Hos friska personer med normalt kostintag och som vistas ute sommartid förblir nivåerna av vitamin D i blodet normala även vintertid, men för personer som närmast aldrig vistas utomhus och har ett lågt intag av kalcium och vitamin D via födan finns en stor risk att utveckla brist på vitamin D (1). Risken för brist på vitamin D ökar med åldern och blir särskilt stor efter cirka 80 års ålder. I en svensk studie förelåg brist på vitamin D hos 35 % av en population boende på sjukhem med medelålder 84 år (3) och hos 6 % i en grupp hemmaboende personer med medelålder 84 år (4). Förekomsten av sekundär hyperparatyreoidism som tecken på otillräckligt intag av vitamin D och kalcium var dock betydligt större. Förekomsten av brist på vitamin D bland åldringar i andra delar av Europa förefaller vara minst lika hög (1). Risken är större vid institutionsboende (5). Tämligen lite är känt angående förekomsten av brist på vitamin D bland svenskar under 80 års ålder och större populationsstudier saknas. I en nylig studie var förekomsten av svår brist på vitamin D (< 23 nmol/L [9 ng/mL]) 0 % i en kohort svenska kvinnor med osteoporos (medelålder 70 år) och förekomsten av vitamin D lägre än 38 nmol/L 3 %. 13 % hade nivåer under 50 nmol/L (6). Förekomsten av låga vitamin D var högre i samtliga andra europeiska länder inklusive Spanien än i Sverige. Då bör man Bakgrundsdokumentation Behandling av osteoporos ställande av mild brist på vitamin D. Dels föreligger en stor variation bland olika mätmetoder för serumkoncentrationen av kalcidiol (1) och dels föreligger en individuell skillnad i individens reaktion på låga halter av vitamin D, delvis beroende på andra samverkande faktorer. Till exempel är konsekvenserna av brist på vitamin D allvarligare vid ett samtidigt lågt intag av kalcium. Det är inte klart fastställt vid vilken serumnivå av kalcidiol symtomgivande brist föreligger. En serumkoncentration lägre än 9 ng/mL eller 23 nmol/L brukar definieras som brist på vitamin D, men vid osteomalaci föreligger som regel ännu lägre koncentrationer. Vad som är en otillräcklig serumnivå av vitamin D är mycket oklart, men vid nivåer under cirka 38–75 nmol/L (15–30 mikrogram/dL) har man sett biokemiska tecken i form av ökande PTHvärden och sekundär hyperparatyreoidism (HPT) (1). Det finns ett samband mellan koncentrationen av vitamin D i blod och benmassa påvisat i epidemiologiska studier. Skillnaden i benmassa mellan dem med serumkoncentration av kalcidiol på 20 nmol/L (8 mikrogram/dL), dvs. brist, och dem med fem gånger så höga värden (100 nmol/L) var i en amerikansk stor populationsstudie endast 6 % mätt med DXA (9). Vid sekundär HPT föreligger förhöjda PTH-värden till följd av låga nivåer av kalcium och vitamin D. Högt PTH leder till en ökad nedbrytning (resorption) av skelettet, framför allt kortikalt ben via osteoklaster, och kan resultera i minskad benmassa, osteoporos och ökad frakturrisk. Det är troligt att den huvudsakliga orsaken till sjunkande benmassa vid brist på vitamin D beror på sekundär hyperparatyreoidism (1). Detta styrks av det faktum att man vid diagnos av primär hypoparatyreoidism har brist på kalcium och kalcitriol, men snarast högre benmassa än åldersmatchade kontroller (10). dock beakta att flertalet av de studerade behandlades med kalcium och vitamin D på grund av samtidig behandling med t.ex. bisfosfonater. Risken för brist på vitamin D är större hos pigmenterade personer, då en större exposition för UVB behövs för att åstadkomma bildning av vitamin D och solens vinkel på norra breddgrader sällan är tillräcklig. En hög förekomst av vitamin D-brist har påvisats i vissa invandrarpopulationer i Skandinavien (7). Populationsbaserade data ifrån USA visar att risken för brist på vitamin D är vanligare bland människor med afrikanskt ursprung än bland vita (8). Vid ett flertal sjukdomstillstånd föreligger ökad risk för brist på kalcium och vitamin D. Malabsorption, t.ex. vid glutenintolerans, cystisk fibros eller kronisk inflammation i bukspottkörteln, ökar risken för brist. Njursvikt minskar aktiveringen av vitamin D i njurarna och medför därmed brist på aktivt vitamin D. Detta i kombination med förhöjda fosfatvärden på grund av en oförmåga att utsöndra fosfat via urinen leder till sekundär hyperparatyreoidism och minskad benmassa. Vitamin D, PTH och kalciumbalansen Vitamin D är viktig för en normal utveckling samt bibehållande av skelettets funktion direkt, men även indirekt. Vitamin D påverkar utmognaden av osteo­blaster och påverkar deras syntes av ett flertal olika proteiner inblandade i skelettmetabolismen. I vuxen ålder är dock vitamin D tveklöst viktigast för sin roll i regleringen av kalciumjonernas koncentration i blodet. Kalciumjonen är central i många viktiga cellulära funktioner utöver dess funktion i skelettet och dess koncentration i blodet är noga reglerad. Både förhöjda och för låga koncentrationer av kalcium medför symtom och uttalad hyperkalcemi såväl som uttalad hypokalcemi kan vara direkt livshotande. Den viktigaste funktionen för vitamin D i vuxen ålder är sannolikt dess positiva effekt på upptaget av kalcium via tarmen. Kalcitriol stimulerar bildningen av kalbindin i tarmens mukosaceller och ökar därmed det aktiva upptaget av kalcium från födan. Även upptaget av fosfat stimuleras av kalcitriol. Kroppens kalciumbalans är reglerad via ett samspel mellan i första hand paratyreoideahormon (PTH) och vitamin D. Vid sjunkande serumkalcium frisätts PTH, som via flera mekanismer höjer serumkalcium. Dels ökar återabsorptionen av kalcium från urinen i njurtubuli, dels ökar 1α-hydroxyleringen (aktiveringen av vitamin D) i njuren. Ökningen av aktivt vitamin D medför ett ökat upptag av kalcium och fosfat i tarmen och den ökade fosfatkoncentrationen stimulerar i sin tur frisättning av PTH. PTH ökar också frisättning av kalcium genom en ökad osteoklastaktivering som leder till nedbrytning, även kallad resorption av skelett. Betydelsen av brist på vitamin D för utveckling av osteoporos i populationen Benmassan ökar till cirka 20 års ålder och ligger därefter tämligen stabilt i ett antal år för att därefter sjunka. Hos kvinnor sjunker benmassan snabbast i samband med menopausen på grund av östrogenbortfallet. Fem till tio år efter menopaus avtar hastigheten av benförlusten och den fortsatta benförlusten sker därefter i långsammare takt. Hos män sjunker benmassan linjärt från cirka 50 års ålder. Osteoporos är vanligt vid hög ålder och bland svenska kvinnor över 80 års ålder är förekomsten nästan 50 %. Faktorer som i populationsbaserade studier påvisats medföra risk för låg benmassa är hög ålder, låg kroppsvikt, tidig menopaus samt immobilisering. Brist på kalcium och vitamin D är vanligt bland de allra äldsta, men utgör inte en betydande orsak till benskörhet i populationen i allmänhet. Vid behandling av patienter med osteomalaci på grund av vitamin D-brist ser man oftast en betydande ökning av benmassan, ofta Brist på vitamin D Den bästa kliniska metoden att detektera brist på vitamin D är via analys av 25-OH vitamin D3 i serum (kalcidiol). Flera problem föreligger dock vid fast Information från Läkemedelsverket 4:2007 35 Bakgrundsdokumentation Behandling av osteoporos i storleksordningen 10–20 %, men behandling med kalcium och vitamin D har en liten effekt på benmassan i normalfallet. I de flesta läkemedelsstudier i populationer med benskörhet och hög risk för fraktur där placebogruppen erhållit substitution med vitamin D och kalcium har man sett en ökning av benmassan i placebogruppen (som erhållit kalcium och vitamin D) med i storleksordningen 1 % i ländryggen, men en minskning med cirka 0,5 % i lårbenshalsen (11,12). De studier där man sett en något större ökning av benmassan (> 2 %) vid behandling med vitamin D och kalcium har innefattat populationer med hög förekomst av vitamin D-brist (13,14). I WHIstudien randomiserades cirka 20 000 kvinnor till vitamin D (400 E/d) och kalcium (1 000 mg/d) i kombination eller placebo. Efter i genomsnitt sju års uppföljningstid förelåg 1 % högre benmassa i höften i behandlingsgruppen än i placebogruppen (15). I denna studie var dock såväl kalciumintaget som 25OH vitamin D-intaget normalt redan vid inklusion i studien. En kraftig effekt av ytterligare tillskott var därför knappast att förvänta sig. Sammanfattning Brist på vitamin D och kalcium är i normalfallet inte en betydande orsak till den benförlust som sker med ökande ålder. Behandling medför en liten ökning av benmassan undantaget de fall där en brist på vitamin D föreligger, där effekten av vitamin D-tillskott är betydande. Vitamin D som singelbehandling Behandling med vitamin D med eller utan kalcium i avsikt att minska risken för fraktur – vad säger de kliniska studierna? I Avenells systematiska översikt ingår även behandling med aktiva former av vitamin D. Det vetenskapliga underlaget är begränsat och studierna få och små. Den största studien (23) påvisade en signifikant minskad risk för kotfraktur efter behandling med kalcitriol (0,5 mikrogram/dag) jämfört med placebo till en kohort kvinnor med tidigare en till fem kotfrakturer. På grund av betydande borfall och att man räknat antal frakturer snarare än patienter med fraktur kan studien inte tillmätas högt bevisvärde. Denna patientkategori skulle idag också erhållit behandling med skelettspecifika farmaka i första hand, varför relevansen av studien måste ifrågasättas. Några säkra slutsatser beträffande effekterna kan inte dras utan större studier behövs för att besvara denna frågeställning. Metaanalyserna talar för att det finns en påtagligt ökad risk för hyperkalcemi vid behandling med kalcitriol (RR = 15, CI 3,0–76). Denna risk är dosberoende och ökar vid samtidigt högt kalciumintag. Sammanfattning vitamin D-analogerna alfakalcidol och kalcitriol Några säkra slutsatser beträffande frakturriskreduktion kan inte dras, då studierna är få och små. En ökad risk för hyperkalcemi föreligger vid behandling med framför allt kalcitriol. Risken är dosberoende och ökar vid högt kalciumintag. Ett flertal systematiska översikter som studerat den eventuellt frakturreducerande effekten av behandling med vitamin D ensamt eller i kombination med kalcium har publicerats under senare år (16–18). Den nyaste översikten av hög kvalitet publicerades juni 2005 i Cochrane Database of Systematic Rewiews ”Vitamin D and Vitamin D Analogues for Preventing Fractures Associated with Involutional and Postmenopausal osteoporosis” (18) och innehåller ett flertal metaanalyser. Den innefattar alla relevanta randomiserade prövningar i ämnet som publicerats fram till mars 2005. Något senare publicerades en systematisk översikt av SBU (SBU 2006) innefattande även resultaten från den mycket stora WHI-studien (15), där 36 000 kvinnor med medelålder av 62 år vid inklusion randomiserats till placebo eller vitamin D plus kalcium (400 E resp 1 000 mg). Cirka 25 % dem eller cirka 8 000 hade dessutom randomiserats till östrogen. Sammanfattningen nedan baseras på Avenells översikt (18), men en litteratursökning har skett mellan datumen 2005-04-01 och 2006-12-31 för att identifiera eventuell senare tillkommen viktig kunskap. Ingen studie publicerad efter översikten motsäger dess resultat. 36 Information från Läkemedelsverket 4:2007 Studierna där man givit vitamin D eller placebo omfattar sammanlagt nästan 20 000 försökspersoner. De tre viktigaste studierna (19–21) har högt bevisvärde och innefattar relevanta målgrupper för behandling med medelålder på de inkluderade om 75, 80 och 78 år. En av dem har endast inkluderat personer med tidigare fraktur, vilket resulterat i en högre frakturincidens i denna studie (21). De tre omfattar sammanlagt cirka 15 000 patienter. I en av dem med en uppföljningstid om fem år (19) uppnåddes en nätt och jämnt signifikant minskad risk för icke-kotfraktur, dock inte för höftfraktur. I de övriga två sågs inte någon minskad tendens till frakturer. I metaanalysen, dvs. i det sammanlagda resultatet av alla inkluderade studier, såg man inte minskad frakturrisk hos äldre kvinnor vid behandling med vitamin D ensamt (Avenell). En nyligen publicerad öppen studie från Storbritannien dock, med kort medeluppföljningstid – tio månader – visade inte minskad risk för fraktur vid behandling med ergokalciferol (22) och stöder således resultatet av metaanalysen. Sammanfattning Behandling med Vitamin D (ergo- eller kolekalciferol) ensamt har inte visats minska risken för frakturer hos äldre kvinnor. Behandling med vitamin D-analogerna alfakalcidol eller kalcitriol Bakgrundsdokumentation Behandling av osteoporos Behandling med vitamin D och kalcium i kombination Referenser 1. Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 2001;22:477–501. 2. Bischoff-Ferrari HA, Dawson-Hughes B, Willett WC, et al. Effect of Vitamin D on falls: a meta-analysis. JAMA 2004;291:1999–2006. 3. Toss G, Almqvist S, Larsson L, et al. Vitamin D deficiency in welfare institutions for the aged. Acta Med Scand 1980;208:87–9. 4. Melin A, Wilske J, Ringertz H, et al. Seasonal variations in serum levels of 25-hydroxyvitamin D and parathyroid hormone but no detectable change in femoral neck bone density in an older population with regular outdoor exposure. J Am Geriatr Soc 2001;49:1190–6. 5. Reginster JY. The high prevalence of inadequate serum vitamin D levels and implications for bone health. Curr Med Res Opin 2005;21:579–86. 6. Lips P, Hosking D, Lippuner K, et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med 2006;260:245–54. 7. Holvik K, Meyer HE, Haug E, et al. Prevalence and predictors of vitamin D deficiency in five immigrant groups living in Oslo, Norway: the Oslo Immigrant Health Study. Eur J Clin Nutr 2005;59:57–63. 8. Bischoff-Ferrari HA, Dietrich T, Orav EJ, et al. Positive association between 25-hydroxy vitamin D levels and bone mineral density: a population-based study of younger and older adults. Am J Med 2004;116:634–9. 9. Bischoff-Ferrari HA, Giovannucci E, Willett WC, et al. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr 2006;84:18–28. 10. Laway BA, Goswami R, Singh N, et al. Pattern of bone mineral density in patients with sporadic idiopathic hypoparathyroidism. Clin Endocrinol (Oxf). 2006;64:405–9. 11. Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 1999;282:637–45. 12. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434–41. 13. Chapuy MC, Arlot ME, Duboeuf F, et al. Vitamin D3 and calcium to prevent hip fractures in the elderly women. N Engl J Med 1992;327:1637–42. 14. Chapuy MC, Pamphile R, Paris E, et al. Combined calcium and vitamin D3 supplementation in elderly women: confirmation of reversal of secondary hyperparathyroidism and hip fracture risk: the Decalyos II study. Osteoporos Int 2002;13:257–64. 15. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006;354:669–83. 16. Papadimitropoulos E, Shea B, Wells G, et al. Vitamin D with or without calcium for treating osteoporosis in postmenopausal women (protocol). Papadimitropoulos E, Shea B, Wells G, et al. Vitamin D with or without calcium for treating osteoporosis in postmenopausal women (Protocol for a Cochrane Review). In: The Cochrane Library, Issue 3, 2005. Chichester, UK: John Wiley & Sons, Ltd. Canada Inc,3650 Danforth Avenue,Scar borough,Ontario,CANADA,M1N-2E8,Telephone: +1 416693-3473,Facsimile: +1 416-699-7352,E-mail: manny@lilly. com preparation. Please contact the author of the review using the contact details provided for more information. authors. The copyright of The Cochrane Database of Systematic Reviews is held by The Cochrane Collaboration, PO Box 777, Oxford OX3 7LF, England. 17. Bischoff-Ferrari HA, Willett WC, Wong JB, et al. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005;293:2257–64. Studierna där man givit kalcium och vitamin D i kombination är mycket olika beträffande både inkluderade patienter och dos av vitamin D. Ovanstående systematiska översikt omfattar även studier gällande behandling med vitamin D och kalcium (18). I en studie där man inkluderat 3 270 sjukhemsboende allmänt sköra kvinnor med medelålder 84 år påvisades en signifikant minskad risk för höftfraktur och icke-kotfraktur vid behandling med vitamin D och kalcium (800 E resp 1 200 mg dagligen) (13). Resultaten av denna studie styrktes senare av en liknande mindre studie från samma forskargrupp (14). Patienterna i dessa två studier hade genomsnittligt låga halter av kalcidiol i serum och höftfrakturincidensen i placebogrupperna var 11 % över 18 månader, alltså fem gånger högre än i den studie där man haft den näst högsta incidensen (21). Denna sjukhemsboende population kan därför inte anses representativ för hemmaboende äldre kvinnor i Sverige utan den uppdelningen av metaanalyserna som skett i institutionsboende och hemmaboende populationer förefaller adekvat. Endast i en studie där man inkluderat något yngre hemmaboende kvinnor och män (24) påvisades en signifikant minskad risk för andra frakturer utom kotfraktur, men inte för höft- eller kotfrakturer. Trots att patienterna var 71 år och inte hade brist på vitamin D, så förelåg en ganska hög frakturincidens. Studien var liten och antalet frakturer i studien var litet i förhållande till det samlade kunskapsunderlaget. Resultaten tillmäts därför inte någon stor betydelse i den slutliga bedömningen, då övriga studier och metaanalysen (18) inte visar minskad risk för någon frakturtyp. Den stora WHI-studien (se ovan) påvisade inte heller någon minskning av risken för fraktur trots sju års medeluppföljningstid (15). Däremot såg man en lätt ökad risk för njursten i behandlingsgruppen, möjligen beroende på ett högt intag av kalcium och vitamin D redan vid inklusion. Beträffande effekten av behandling med vitamin D och kalcium på risken för kotfraktur kan man inte dra några säkra slutsatser. Kotfrakturer har i flertalet studier inte efterfrågats utan endast spontanrapporterats, vilket får bedömas medföra en betydande underrapportering. Det vetenskapliga underlaget gällande behandling av män är otillräckligt. Sammanfattning behandling med vitamin D och kalcium i kombination Vitamin D och kalcium i kombination har visats minska risken för höftfraktur och andra frakturer utom kotfraktur hos institutionsboende äldre kvinnor. Däremot har samma behandling inte visats minska risken för fraktur hos kvinnor under 80 års ålder i eget boende. Information från Läkemedelsverket 4:2007 37 Bakgrundsdokumentation Behandling av osteoporos 18. Avenell A, Gillespie W, Gillespie L, et al. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and post-menopausal osteoporosis. Cochrane Database Syst Rev 2005(3):CD000227. 19. Trivedi DP, Doll R, Khaw KT. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ 2003;326:469. 20. Smith H, Anderson F, Raphael H, et al. Effect of annual vitamin D supplementation on fracture risk: population based, randomized, double-blind, placebo-controlled trial. Ost Int 2004;15 (suppl):8. 21. Grant AM, Avenell A, Campbell MK, et al. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet 2005;365:1621–8. 22. Law M, Withers H, Morris J, et al. Vitamin D supplementation and the prevention of fractures and falls: results of a randomised trial in elderly people in residential accommodation. Age Ageing 2006;35:482–6. 23. Tilyard MW, Spears GF, Thomson J, et al. Treatment of postmenopausal osteoporosis with calcitriol or calcium. N Engl J Med 1992;326:357–62. 24. Dawson-Hughes B, Harris SS, Krall EA, et al. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med 1997;337:670–6. Hormonbehandling efter menopaus Tord Naessen Inledning Synen på postmenopausal hormonbehandling i allmänhet och som osteoporosprofylax har under senare år genomgått en stark omvärdering. Den ändrade inställningen till östrogenbehandling startade i samband med publikationen av två stora randomiserade studier, HERS (1) och WHI (2). Försäljningen av medelpotenta östrogenpreparat har därefter totalt minskat med cirka 70 %. SBU, Statens beredning för medicinsk utvärdering, publicerade 2003 en systematisk översikt i SBU-rapporten Osteoporos, prevention, diagnostik och behandling (3) samt en rapport om Behandling med östrogen, 2002 (4). Därefter har Läkemedelsverket (LV) publicerat rapporten Osteoporosprofylax för att förebygga frakturer, 2004 (5). Den korta sammanställning som presenteras här fokuserar på effekter av östrogenbehandling (med eller utan gestagener) och är endast ett komplement till tidigare omfattande översikter (3–5) och utgör ett diskussionsunderlag i en fortlöpande utvärdering och sammanvägning av positiva och negativa effekter av hormonbehandling efter menopaus. Effekt av hormonbehandling på frakturrisk och benmassa Tidigare gedigna utvärderingar (3–5) sammanfattade att östrogenbehandling kombinerad med gestagen har en primärpreventiv effekt vad gäller risken för höftfraktur, kotfrakturer och övriga osteoporosbetingade frakturer, med reducerad frakturrisk för respektive frakturtyp med 34 %, 34 % och 24 %. Avseende frakturdata fann WHI-studien (randomiserad placebokontrollerad med en medelålder av 63 år vid studiestart) en trettiotreprocentig minskad risk för höftfraktur i behandlingsgruppen, jämfört med placebo, HR = 0,67 (0,47; 0,96) (6). Stora randomiserade kontrollerade studier saknas vad gäller frakturutfall vid hormonbehandling av patienter med 38 Information från Läkemedelsverket 4:2007 osteoporos. Hormonbehandling efter menopaus har också en primärpreventiv effekt vad gäller förlust av benmassa (3) och ger en ökad benmassa i kotor och höft även hos grupper av kvinnor med medelålder över 60 år (6). Betydelsen av låg benmassa minskar med stigande ålder Låg benmassa har ett klart samband med ökad frakturrisk. Med ökad ålder blir dock andra faktorer viktigare, medan betydelsen av låg benmassa minskar som förklaring till ökad risk för höftfraktur. I en tidigare studie uppskattades att endast 13 % av den ökade frakturrisken mellan 60 och 80 års ålder kunde förklaras av minskad benmassa (7). Även om låg benmassa är associerad med ökad frakturrisk drabbar majoriteten av alla frakturer individer som ej har osteoporos. I den välkända studien, Study of Osteoporotic Fractures (SOF), inträffade 80 % av alla frakturer hos individer som ej hade osteoporos vid perifer mätning av benmassa (8). Likaså, i den s.k. Rotterdamstudien inträffade mer än hälften av alla icke-vertebrala frakturer bland individer utan osteoporos, enligt mätning med DXA av höften (9). Man har uppskattat att över 90 % av alla höftfrakturer inträffar i samband med ett falltrauma (10). I den tidigare rapporten från Läkemedelsverket om osteoporos (5) redovisades resultaten från en stor metaanalys baserad på 22 randomiserade studier avseende effekt av hormonbehandling på risken för icke-kotfrakturer (11). Huvudsakligen redovisades resultaten för totalmaterialet oavsett ålder vid insättande av behandling. Effekter av ålder vid insättandet av hormonbehandling Den metaanalys som nämns ovan fann att postmenopausal hormonbehandling har en starkare skyddseffekt på risken för höft- och radiusfrakturer (14 rando- Bakgrundsdokumentation Behandling av osteoporos Trend mot allt lägre östrogendoser vid hormonbehandling efter menopaus Man ser en trend mot allt lägre östrogendoser i hormonbehandling efter menopaus. Preliminärdata från en ännu opublicerad klinisk multicenterstudie talar för att en låg östrogendos (0,5 mg estradiol) i kombination med gestagen bevarar flera önskvärda effekter av behandlingen utan att ge ökad brösttäthet, så även i åldrar strax efter menopaus. Hos äldre kvinnor förefaller även ultralåga östrogendoser ha viss systemeffekt med positiv inverkan på bland annat serumlipider (17), benmassa och skelettmarkörer (18). Östrogendosen i dessa studier med ”ultra-low dose” är så låg att tillägg av gestagen ej bedömts nödvändigt. Tibolon I en nyligen publicerad studie (OPAL) var endometriesäkerheten för tibolon jämförbar med den vid sedvanlig amerikansk hormonbehandling (CEE + MPA). För effekten på kärl visade varken tibolon eller CEE + MPA någon (vad som tolkades) gynnsam effekt på progressionen av den intermediära endpoint som användes, carotid intima-media thickness (19). Sedan Läkemedelsverkets tidigare rapport har en treårsuppföljning publicerats avseende effekter av tibolon på frakturrisk (LIFT). Risken för kotfrakturer ungefär halverades, medan risken för stroke fördubblades jämfört med placebo, (RR = 2,59; P = 0,01). Studien har avbrutits på grund av den ökade risken för stroke (20). SERMs (Selective Estrogen Receptor Modulators) I den tidigare MORE-studien, som primärt studerade den frakturskyddande effekten av Raloxifen hos äldre kvinnor med osteoporos, hade kvinnor med högst risk för CHD en fyrtioprocentig reducerad risk för CHD och 60 % minskad risk för stroke (21). I den fyraåriga fortsatta behandlingsuppföljningen (MORECORE) fann man dock ingen tydlig skyddseffekt på hjärt-kärlsjukdom av raloxifen jämfört med placebo (22). I en studie på cirka 10 000 postmenopausala kvinnor med CHD eller flera riskfaktorer för CHD och en medelålder av 68 år (RUTH-studien) fann man en fyrtiofyraprocentigt reducerad risk för invasiv bröstcancer (HR = 0,56; 0,38; 0,83), ingen effekt på insjuknande i koronarsjukdom men en ökad risk för venösa tromboser och stroke (23). miserade studier) när behandlingen påbörjas före 60 års ålder (RR = 0,45; 0,26; 0,79), jämfört med efter 60 års ålder (RR = 0,88; 0,47; 1,59) (11). Dessa fynd stämmer bra med data från tidigare observationsstudier (12,13). En starkare frakturskyddande effekt hos yngre, jämfört med äldre individer, kan te sig paradoxal, eftersom benmassan är vanligtvis ”normal” strax efter menopaus. Ökningen i benmassa efter hormonbehandling är också mer uttalad vid behandling i högre åldrar med lägre benmassa från början. Frakturskyddande effekten av hormonbehandling en ”färskvara” – kommer och försvinner snabbt Effekten av hormonbehandling vad gäller höftfrakturrisk tycks vara ”färskvara”. Effekten kommer snabbt efter insatt behandling, men verkar också försvinna snabbt efter dess utsättande (12–14). Stark primärpreventiv frakturskyddande effekt även hos icke-osteoporotiska individer Hormonterapi efter menopaus har sedan länge en dokumenterad effekt att substantiellt och signifikant reducera risken för fraktur, inklusive höft- och radiusfrakturer, även hos individer med ”normal” benmassa (3). Hormonterapi skiljer sig därvid från andra preparatgrupper, t.ex. bisfosfonater, som ej har samma klara effekt i detta avseende. En frakturprofylaktisk effekt hos individer med närmast ”normal” benmassa talar för att hormonterapi påverkar andra faktorer av betydelse för att fraktur skall inträffa. En viktig faktor för frakturrisk är, förutom låg benmassa, dålig postural balans och en tendens att falla. Hormonbehandling – frakturskydd delvis medierat via effekter på hjärna och balansfunktion? I en nyligen publicerad randomiserad studie med 100 deltagande kvinnor gav hormonbehandling, insatt strax efter menopaus, redan efter tre månader signifikant förbättrad balansfunktion (posturografi) och minskad känsla av yrsel, jämfört med placebo. Efter sex månader uppnåddes värden för balans i nivå med dem som tidigare noterats hos kvinnor mellan 20 och 30 års ålder (15). Resultaten i en tidigare gruppjämförande studie talar för att långvarig och pågående östrogenbehandling som påbörjas i nära anslutning till menopaus kan bibehålla en bra balansfunktion upp i hög ålder (16). Om hormonterapi kan bibehålla eller förbättra balansförmågan skulle detta kunna vara en orsak till ovan nämnda särdrag för effekter av hormonbehandling: att frakturskyddet inträder och försvinner snabbt i relation till behandlingen, att ett kraftigare frakturskydd ofta noteras hos yngre jämfört med hos äldre, att hormonbehandling har primärpreventiv effekt hos individer med ”normal” benmassa samt möjligen också hormonbehandlingens tydliga frakturskydd på perifera frakturer (höft- och radiusfrakturer) jämfört med effekten av t.ex. bisfosfonater. Kommentarer om övriga effekter av hormonbehandling efter menopaus Bröstcancer Sedan de tidigare rapporterna från SBU och Läkemedelsverket (3–5) finns nu ytterligare utvärderingar avseende effekten på bröstcancerrisk från WHI-studien. Östrogenbehandling kombinerad med gestagen tycks öka risken för bröstcancer med 24 % jämfört med placebo (HR = 1,24; P < 0,001) och öka andelen abnorma mammogram signifikant (24). I en senare rap- Information från Läkemedelsverket 4:2007 39 Bakgrundsdokumentation Behandling av osteoporos port från WHI, 2004, redovisades effekten på bröstcancerrisk av enbart östrogen (CEE). Ingen ökad risk för bröstcancer noterades för behandling med enbart östrogen hos tidigare hysterektomerade kvinnor, utan om något en antytt sänkt risk (HR = 0,77; 0,59; 1,01) (25). Resultaten i den senaste WHI-rapporten, 2006, tyder på att behandling med östrogen enbart (CEE) under i genomsnitt sju år till hysterektomerade kvinnor inte ökar risken för bröstcancer (26). I den subgrupp som verkligen tog medicineringen var risken för bröstcancer minskad med 33 % (HR = 0,67, 95 % CL 0,47; 0,97; P = 0,03) jämfört med placebo. Data från WHI-studien har också visat att tidigare hormonanvändning accentuerade riskökningen för bröstcancer (27). I Nurses’ Health Study, där 28 835 sjuksköterskor följts under två decennier, fann man att bröstcancerrisken ökade med duration av östrogenbehandling. Efter 20 år med behandlingen var risken ökad med 42 % (28). I en stor populationsbaserad fall-kontrollstudie från Seattle, USA, innefattande 975 bröstcancerfall och 1 007 kontroller, fann man en ökad bröstcancerrisk efter östrogen-gestagenkombinerad behandling, OR = 1,7 (1,3; 2,2). Ingen ökad risk för bröstcancer noterades för behandling med enbart östrogen som innefattade exponering över 25 år (29). Resultaten från flera studier finner således en ökad risk för bröstcancer efter behandling med östrogen kombinerat med gestagen, medan risken förefaller mindre efter behandling med östrogen enbart. Bröstcancer är en allvarlig och ibland livshotande sjukdom förknippad med mycket ångest och oro. Andra viktiga endpoints i avvägningen mellan positiva och negativa effekter av hormonbehandling är effekter på hjärt-kärlsjuklighet. Efter den tidigare rapporten och värderingen från Läkemedelsverket (5) har det kommit ytterligare data från WHI-studien samt resultat från epidemiologiska studier och två meta­ analyser som belyser effekter av hormonbehandling på insjuknande i koronarsjukdom (CHD) och på totalmortalitet. Risken för kardiovaskulär sjuklighet WHI-studiens ”slutliga” rapport över effekter på incidens av koronar sjuklighet redovisade totalt en ökad risk, HR = 1,24; 1,00; 1,54 (adjusted CI, 0,97, 1,60). Man fann, trots den höga medelåldern, också en signifikant trend för skyddseffekt med ökad behandlingslängd (P = 0,02 för trend) (30). Stratifierade analyser med avseende på antal år efter menopaus visade att kvinnor som var < 10 år efter menopaus när behandlingen påbörjades, hade en ”Hazard ratio” under ett (HR = 0,89). Endast kvinnor som var > 20 år efter menopaus hade en signifikant ökad risk H = 1,71 (30). WHI-data har också analyserats avseende effekter av enbart östrogen (CEE). För hela gruppen fann man ingen effekt av enbart CEE; HR = 0,95 (0,79; 1,16). Hos kvinnor som var mellan 50 och 59 år vid start av hormonbehandling fann 40 Information från Läkemedelsverket 4:2007 man tecken på en möjlig skyddseffekt för insjuknande i koronarsjukdom HR = 0,63 (0,36; 1,08) och ett signifikant minskat behov av koronar revaskularisering HR = 0,55 (0,35; 0,86) (31). I den prospektiva långtidsuppföljningen av amerikanska sjuksköterskor, the Nurses’ Health Study (NHS) hade kvinnor som påbörjade hormonbehandling nära menopaus (inom fyra år) en signifikant minskad risk för koronarsjukdom (CHD) både för enbart östrogen (RR = 0,66; 0,54; 0,80) och för östrogen plus gestagen (RR = 0,72; 0,56; 0,92) (32). En metaanalys avseende hormonbehandling och effekter på koronarsjukdom finns publicerad i en ”Brief Report”. Denna metaanalys baseras på 23 randomiserade studier med över 39 000 deltagare och mer än 190 000 personår av uppföljning. En signifikant minskad risk för insjuknande i koronarsjukdom noterades hos kvinnor som var under 60 år då hormonbehandlingen inleddes (OR = 0,68; 0,48; 0,96). Hos kvinnor över 60 år fann man ingen effekt overall (OR = 1,03), men en ökad risk under första året (OR = 1,47; 1,12; 1,92) och därefter sänkt risk för behandlingstider över två år (OR = 0,79; 0,67; 0,93), Tabell I. Dessa fynd och punktestimat visar stor samstämmighet med resultaten i stora observationsstudier som Nurses’ Health Study (32). Avseende effekten av hormonbehandling på komponenter i det metabola syndromet finns det en färsk metaanalys av 107 RCTs med över 33 000 deltagare och kring 50 000 personår av uppföljning (33). Resultaten visar att hormonbehandling minskar abdominellt fett, insulinresistens, insjuknande i diabetes, blodtryck, adhesionsmolekyler, prokoagulationsfaktorer samt förbättrar lipidprofilen hos kvinnor utan diabetes. Hos kvinnor med diabetes förbättras insulinresistens och fasteblodsocker (33). Den tidigare diskuterade diskrepansen mellan resultat från observationsstudier respektive RCTs har ibland hänförts till en eventuell bias i observationsstudier med bland annat ”healthier user effect” (5). Diskrepansen i resultat förefaller dock mindre än vad som tidigare uppfattats. Budskapen är i princip desamma i RCTs och observationsstudier. RCTs speglar ofta mer kortsiktliga effekter, medan observationsstudier ofta speglar overall-effekter över längre tid. I senare rapporter från observationsstudier, bland annat från ’Nurses’ Health Study’ (32,34), redovisas resultaten även efter de första åren av hormonterapi och för olika åldrar vid baseline. Dessa analyser fångar även mer kortsiktiga effekter och resultaten stämmer förbluffande väl med data från WHI (2) och meta­ analyser av randomiserade studier (35). I båda typerna av studier framträder en signifikant eller antydd skyddseffekt på CHD (34,35) och mortalitet (36,37) för hormonbehandling som insätts tidigt efter menopaus, oftast före 60 års ålder. Likaledes ser man i båda typerna av studier en initialt ökad risk för CHD under de första 1–2 åren, när hormonbehandling ges till Bakgrundsdokumentation Behandling av osteoporos Table I. Results from meta-analyses addressing the effect of hormone therapy (HT) on afracture risk, bcoronary heart disease (CHD) and ctotal mortality during therapy, all with regard to age at start of therapy. Outcome Age at start of HT Odds ratio (95 % Confidence Interval) a Hip and Wrist fracture Hip and Wrist fracture < 60 yrs > 60 yrs RR = 0,45 (0,3; 0,8) RR = 0,88 (0,5; 1,6) b CHD CHD CHD CHD < 60 yrs > 60 yrs > 60 yrs; 1st yr > 60 yrs; > 2 yrs 0,68 (0,48; 0,96) 1,03 (0,91; 1,16) 1,47 (1,12; 1,92) 0,79 (0,67; 0,93 Total mortality Total mortality < 60 yrs > 60 yrs 0,61 (0,39; 0,65) 1,03 (0,90; 1,18) c Torgerson and Bell-Syer. JAMA 2001;285:2891–7. Salpeter, et al. J Gen Intern Med 2006;21:363–6. c Salpeter, et al. J Gen Intern Med 2004;19:791–804. a b med något bättre överlevnad än högre doser, men båda nivåerna var enskilt signifikant bättre än för obehandlade (37). Effekter på kärlsystemet – initierade studier/ kommande rapporter Huvudresultaten i WHI-studien (med en medelålder kring 65 år) speglar effekter av hormonbehandling med höga östrogendoser insatta i åldrar över 60. Detta scenario skiljer sig starkt från vår kliniska vardag. Vanligtvis behöver kvinnor hormonbehandling för sina klimakteriebesvär med början kring menopaus och några år därefter. Två prospektiva randomiserade studier, KEEPS och ELITE, har startats i USA för att studera effekter på kärlsystemet av hormonbehandling som insätts kring eller strax efter menopaus, för att utvärdera en eventuell primärpreventiv effekt på kärlen. Antalet planerade deltagare i bägge studierna är begränsat, cirka 500–700 kvinnor, varför man i första hand kommer att utvärdera intima-mediatjocklek i karotisartären ”Carotid-IMT”. Denna variabel är ”Gold Standard” och surrogatvariabel för hjärtkärlstatus och hjärt-kärlrisk. I KEEPS planerade man att inkludera 720 kvinnor under 2005 med planerad avslutning 2010. I studien ELITE (Early Versus Late Intervention Trial With Estrogen) pågår rekryteringen och uppföljning planeras under fem år. Kognition och demens En systematisk översikt från Cochrane Collaboration 2002, baserad på 5 RCT, sammanfattade att östrogenbehandling (med eller utan gestagener) ej kan rekommenderas för att förbättra eller bevara kognitionsförmågan hos kvinnor med Alzheimers sjukdom (AD) (38). Samma slutsats framfördes i SBU-rapporten 2002 (4). I WHI memory study (WHIMS) studerades kvinnor som var över 65 år och hade en medelålder kring kvinnor över 60 (35). Med ökad längd av behandling finner man ofta en trend för signifikant skyddseffekt, både i randomiserade studier och observationsstudier (1,30,32,37). Noteras bör att dessa resultat, inklusive de från WHI, grundar sig på tidigare gängse östrogendoser, som här i Sverige sedan länge betraktats som mycket höga, speciellt för äldre kvinnor. Trenden går mot användning av allt lägre östrogendoser med i många fall bibehållen positiv effekt. Resultat från observationsstudier, i likhet med dem från metaanalyser och stratifierade analyser i WHI-studien, talar samstämmigt för att tidpunkt för insättande av behandling i relation till menopaus kan påverka risken för koronar sjuklighet. Effekter på total mortality I en metaanalys grundad på 30 randomiserade studier (26 700 kvinnor), dock med mycket olika patientgrupper inkluderande även cancer, gav hormonbehandling, som initierats före 60 års ålder och vid en medelålder av 54 år, en signifikant (39 %) reducerad totalmortalitet under behandling jämfört med placebo (OR = 0,61; 0,39; 0,95). Däremot, om hormonbehandlingen påbörjats efter 60 års ålder, fann man ingen signifikant skillnad i totalmortalitet mellan behandling med hormon respektive placebo (OR = 1,03; 0,90; 1,18) (36). I den amerikanska”Leisure World Cohort”-studien följdes 8 801 kvinnor med en medianålder på 73 år vid början av uppföljning. Man fann under en medeluppföljningstid av 22 år att långtidsanvändning av östrogen var förenat med en minskad åldersjusterad mortalitet, RR = 0,91 (0,87; 0,96). Den minskade risken att dö var signifikant associerad med längden av östrogenbehandling och närhet till avslutad behandling (P för trend < 0,001), talande för ett orsakssamband. Lägre östrogendoser (< 0,625 mg/d av CEE) var förenat Information från Läkemedelsverket 4:2007 41 Bakgrundsdokumentation Behandling av osteoporos 75 år vid behandlingsstart. Effekten av östrogen (CEE) kombinerat med gestagen gav en signifikant försämring av kognition (39) och i en senare utvärdering fann man för olika kognitiva funktioner tecken på både positiva och negativa effekter (40). Östrogenbehandling (CEE) utan gestagentillägg ökade den kombinerade risken för demens och ”Minimal Cognitive Impairment” (MCI), (HR = 1,38; 1,01; 1,89) (41) och för kognition, med kraftigast försämring hos kvinnor med låg kognition vid studiestart (42). I en nyligen publicerad systematisk översikt fann man lite stöd för några positiva effekter av östrogen (med eller utan gestagener) hos äldre kvinnor (> 65år). Hos yngre kvinnor (< 65 år) fann man potentiella fördelar av hormonbehandling på specifika kognitiva domäner och speciellt hos kvinnor strax efter menopaus (43). Utifrån resultat från grundvetenskapliga studier, djurmodeller samt mönstret av positiva respektive negativa effekter i relation till ålder när hormonbehandling initieras har man föreslagit ett begrepp som benämns ”Window of Opportunity”, dvs. att hormonbehandling inom ett tidsfönster kring och ej alltför långt efter menopaus skulle ha potentiella möjligheter att ge positiva effekter på t.ex. neuro­ degeneration, kognition och eventuellt senare risk för demens. Dessa tankegångar finner visst stöd i nyligen publicerade studier. I ett danskt material baserat på deltagarna i tidigare genomförda randomiserade studier undersökte man 10–15 år senare de 261 kvinnor som efter avslutad ursprungsstudie inte haft någon hormonbehandling. Man fann att kvinnor som 10–15 år tidigare randomiserats till hormonbehandling under två till tre år hade 64 % mindre risk för kognitiv försämring jämfört med de kvinnor som randomiserats till behandling med placebo (OR = 0,36; 0,15; 0,90) (44). Avseende Alzheimers sjukdom (AD) är det osannolikt att man i en RCT skulle kunna påvisa eventuella effekter av hormonbehandling på risken att utveckla AD. Avståndet förefaller alltför långt mellan ålder då hjärnan tycks kunna påverkas positivt av hormonbehandling och ålder då insjuknande i AD blir vanligt. Intressanta data avseende effekter på risk för AD finns dock. Den amerikanska ”Cash County Study” är en prospektiv uppföljningsstudie i en population med hög utbildning och ”healthy” livsstil. I denna studie fann man minskad incidens av Alzheimers sjukdom (AD) i hög ålder efter hormonbehandling flera decennier tidigare, HR = 0,33; 0,21; 0,52 och Adj. HR = 0,59; 0,36; 0,95. Skyddseffekten ökade med antal år av hormonbehandling direkt efter menopaus. För tidigare hormonanvändning över tio år var risken att drabbas av AD reducerad med 80 %, HR = 0,17; 0,01; 0,80 (45). 42 Information från Läkemedelsverket 4:2007 Sammanfattning • Hormonbehandling insatt tidigt efter menopaus är förenad med en ökad risk för upptäckt av bröstcancer, men förefaller minska risken för hjärt-kärlsjukdom (CHD) samt totalmortalitet. Vissa data tyder också på minskad risk för kognitionsförsämring. • WHI-studien är en utomordentlig studie, men resultaten speglar i huvudsak effekter av postmenopausal hormonbehandling med höga östrogendoser som initieras vid hög ålder (medelålder 63 vid start). Denna medelålder är långt från de åldrar och klinisk verklighet där initiering av hormonbehandling vanligtvis kommer ifråga, dvs. kring menopaus och åren därefter. • Ålder vid insättande av behandling förefaller påverka effekten på hjärt-kärlsystem och effekter på hjärna/kognition. Behandling insatt tidigt efter menopaus tycks förenad med tendens till positiva effekter, medan behandling som insätts senare (ofta > 60 års ålder) är förenad med negativa effekter på kognition och initialt ökade hjärt-kärlrisker. Med längre behandlingstider i den äldre åldersgruppen finner man positiva kärleffekter, detta trots behandling med vad som idag bedöms som ”höga” hormondoser. • Östrogenbehandling kombinerad med gestagen motverkar förlust av benmassa och har en primärpreventiv effekt vad gäller risken för höftfraktur, kotfrakturer och övriga osteoporosbetingade frakturer. • Flertalet frakturer drabbar dock personer som inte har osteoporos. • Hormonbehandling och behandling med bisfosfonater ger likvärdig ökning av benmassa. Hormonbehandling tycks dock ge en snabbare och tydligare minskning av risken för perifera frakturer (höftfraktur) jämfört med bisfosfonater. Möjligen kan hormonbehandling påverka frakturrisk via andra mekanismer än ökad benmassa, t.ex. via effekter på balansfunktionen. • Det är en trend mot allt lägre östrogendoser i postmenopausal hormonbehandling med bibehållande av önskvärda effekter. Referenser 1. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. Jama 1998;280:605–13. 2. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. Jama 2002;288:321–33. 3. Osteoporos – prevention, diagnostik och behandling. SBUrapport Nr 165/1+2 2003. 4. Behandling med östrogen. SBU-rapport Nr 159 2002. 5. Behandling av osteoporos för att förebygga frakturer. Information från Läkemedelsverket 2004;15:11-60. 6. Cauley JA, Robbins J, Chen Z, et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Initiative randomized trial. Jama 2003;290:1729–38. Bakgrundsdokumentation Behandling av osteoporos 7. De Laet CE, van Hout BA, Burger H, et al. Bone density and risk of hip fracture in men and women: cross sectional analysis. Bmj 1997;315:221–5. 8. Siris ES, Chen YT, Abbott TA, et al. Bone mineral density thresholds for pharmacological intervention to prevent fractures. Arch Intern Med 2004;164:1108–12. 9. Schuit SC, van der Klift M, Weel AE, et al. Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study. Bone 2004;34:195–202. 10. Cummings SR, Melton LJ. Epidemiology and outcomes of osteoporotic fractures. Lancet 2002;359:1761–7. 11. Torgerson DJ, Bell-Syer SE. Hormone replacement therapy and prevention of nonvertebral fractures: a meta-analysis of randomized trials. Jama 2001;285:2891–7. 12. Naessen T, Persson I, Adami HO, et al. Hormone replacement therapy and the risk for first hip fracture. A prospective, population-based cohort study. Ann Intern Med 1990;113:95–103. 13. Cauley JA, Seeley DG, Ensrud K, et al. Estrogen replacement therapy and fractures in older women. Study of Osteoporotic Fractures Research Group. Ann Intern Med 1995;122:9–16. 14. Banks E, Beral V, Reeves G, et al. Fracture incidence in relation to the pattern of use of hormone therapy in postmenopausal women. Jama 2004;291:2212–20. 15. Naessen T, Lindmark B, Lagerstrom C, et al. Early postmenopausal hormone therapy improves postural balance. Menopause 2007;14:14–9. 16. Naessen T, Lindmark B, Larsen HC. Better postural balance in elderly women receiving estrogens. Am J Obstet Gynecol 1997;177:412–6. 17. Naessen T, Rodriguez-Macias K, Lithell H. Serum lipid profile improved by ultra-low doses of 17 beta-estradiol in elderly women. J Clin Endocrinol Metab 2001;86:2757–62. 18. Ettinger B, Ensrud KE, Wallace R, et al. Effects of ultralowdose transdermal estradiol on bone mineral density: a randomized clinical trial. Obstet Gynecol 2004;104:443–51. 19. Bots ML, Evans GW, Riley W, et al. The effect of tibolone and continuous combined conjugated equine oestrogens plus medroxyprogesterone acetate on progression of carotid intima-media thickness: the Osteoporosis Prevention and Arterial effects of tiboLone (OPAL) study. Eur Heart J 2006;27:746–55. 20. Cummings SR. LIFT study is discontinued. Bmj 2006;332:667. 21. Barrett-Connor E, Grady D, Sashegyi A, et al. Raloxifene and cardiovascular events in osteoporotic postmenopausal women: four-year results from the MORE (Multiple Outcomes of Raloxifene Evaluation) randomized trial. Jama 2002;287:847–57. 22. Ensrud K, Genazzani AR, Geiger MJ, et al. Effect of raloxifene on cardiovascular adverse events in postmenopausal women with osteoporosis. Am J Cardiol 2006;97:520–7. 23. Barrett-Connor E, Mosca L, Collins P, et al. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med 2006;355:125–37. 24. Chlebowski RT, Hendrix SL, Langer RD, et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women’s Health Initiative Randomized Trial. Jama 2003;289:3243–53. 25. Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. Jama 2004;291:1701–12. 26. Stefanick ML, Anderson GL, Margolis KL, et al. Effects of conjugated equine estrogens on breast cancer and mammography screening in postmenopausal women with hysterectomy. Jama 2006;295:1647–57. 27. Anderson GL, Chlebowski RT, Rossouw JE, et al. Prior hormone therapy and breast cancer risk in the Women’s Health Initiative randomized trial of estrogen plus progestin. Maturitas 2006;55:103–15. 28. Chen WY, Manson JE, Hankinson SE, et al. Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med 2006;166:1027–32. 29. Li CI, Malone KE, Porter PL, et al. Relationship between long durations and different regimens of hormone therapy and risk of breast cancer. Jama 2003;289:3254–63. 30. Manson JE, Hsia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med 2003;349:523–34. 31. Hsia J, Langer RD, Manson JE, et al. Conjugated equine estrogens and coronary heart disease: the Women’s Health Initiative. Arch Intern Med 2006;166:357–65. 32. Grodstein F, Manson JE, Stampfer MJ. Hormone therapy and coronary heart disease: the role of time since menopause and age at hormone initiation. J Womens Health (Larchmt) 2006;15:35–44. 33. Salpeter SR, Walsh JM, Ormiston TM, et al. Meta-analysis: effect of hormone-replacement therapy on components of the metabolic syndrome in postmenopausal women. Diabetes Obes Metab 2006;8:538–54. 34. Grodstein F, Manson JE, Stampfer MJ. Postmenopausal hormone use and secondary prevention of coronary events in the nurses’ health study. a prospective, observational study. Ann Intern Med 2001;135:1–8. 35. Salpeter SR, Walsh JM, Greyber E, et al: Coronary heart disease events associated with hormone therapy in younger and older women. A meta-analysis. J Gen Intern Med 2006;21:363–6. 36. Salpeter SR, Walsh JM, Greyber E, et al. Mortality associated with hormone replacement therapy in younger and older women: a meta-analysis. J Gen Intern Med 2004;19:791–804. 37. Paganini-Hill A, Corrada MM, Kawas CH. Increased longevity in older users of postmenopausal estrogen therapy: the Leisure World Cohort Study. Menopause 2006;13:12–8. 38. Hogervorst E, Yaffe K, Richards M, et al. Hormone replacement therapy to maintain cognitive function in women with dementia. Cochrane Database Syst Rev 2002(3):CD003799. 39. Rapp SR, Espeland MA, Shumaker SA, et al. Effect of estrogen plus progestin on global cognitive function in postmenopausal women: the Women’s Health Initiative Memory Study: a randomized controlled trial. Jama 2003;289:2663–72. 40. Resnick SM, Maki PM, Rapp SR, et al. Effects of combination estrogen plus progestin hormone treatment on cognition and affect. J Clin Endocrinol Metab 2006;91:1802–10. 41. Shumaker SA, Legault C, Kuller L, et al. Conjugated equine estrogens and incidence of probable dementia and mild cognitive impairment in postmenopausal women: Women’s Health Initiative Memory Study. Jama 2004;291:2947–58. 42. Espeland MA, Rapp SR, Shumaker SA, et al. Conjugated equine estrogens and global cognitive function in postmenopausal women: Women’s Health Initiative Memory Study. Jama 2004;291:2959–68. 43. Maki PM. A systematic review of clinical trials of hormone therapy on cognitive function: effects of age at initiation and progestin use. Ann N Y Acad Sci 2005;1052:182–97. 44. Bagger YZ, Tanko LB, Alexandersen P, et al. Early postmenopausal hormone therapy may prevent cognitive impairment later in life. Menopause 2005;12:12–7. 45. Zandi PP, Carlson MC, Plassman BL, et al. Hormone replacement therapy and incidence of Alzheimer disease in older women: the cache county study. Jama 2002;288:2123–9. Information från Läkemedelsverket 4:2007 43 Bakgrundsdokumentation Behandling av osteoporos Hur länge skall man behandla med skelettspecifika farmaka? Ewa Waern Den mest etablerade behandlingen av osteoporos är sedan många år bisfosfonat, en antiresorptiv behandling som i flera stora kliniska studier visat en signifikant ökning av bentäthet i rygg och höft och en minskad incidens av frakturer hos osteoporospatienter (1–4). Andra behandlingsalternativ är selektiva estrogenmodulerare (SERM), strontiumranelat samt intermittenta injektioner med PTH. Behandlingen syftar till att minska framtida frakturrisk; för att uppnå den önskade effekten kan behandlingen behöva pågå lång tid. Andelen något yngre kvinnor som behandlas med bisfosfonat kan tänkas öka då användningen av HRT som osteoporos-fraktur-prevention senaste åren minskat till följd av rapporter om oönskade effekter vid långtidsbehandling med östrogen (WHI). Detta gör frågan om behandlingstidens längd ännu viktigare. Vid beslut om hur länge en antiresorptiv behandling skall pågå måste flera faktorer vägas in: effekten av en förlängd terapi, förloppet efter avslutad behandling samt eventuell risk för oönskade effekter efter långtidsbehandling. När det gäller behandling med bisfosfonater kommer data från långtidsbehandling nästan uteslutande från förlängningar av de kliniska fas III-studierna av alendronat och risedronat. För raloxifen, det enda använda SERM i dag, finns data från förlängning av studien som gjordes med syfte att utvärdera raloxifens effekt som prevention mot mammarcancer. Bisfosfonater Minskning av benomsättningen är en av huvudmekanismerna bakom bisfosfonaternas frakturminskande effekt. Bisfosfonaterna utövar en direkt effekt på osteo­ klasterna, som minskar benresorptionen, bromsar förändringar i mikroarkitekturen i benet och förlust av benmassa. De binder selektivt till aktiv, mineraliserad benyta. När en antiresorptiv behandling påbörjas kommer en tidig reduktion av ”remodelling space”, färre nya remodelleringsenheter initieras och existerande resorptionskaviteter fylls med nytt ben. Detta ger en snabb initial ökning av benmassan (5). Bisfosfonater absorberas dåligt – mindre än 1 % av intaget läkemedel absorberas. De utsöndras snabbt via njurarna utan vidare metabolisering – 20–60 % kvarstannar bundet till benvävnad. De aminobisfosfonater som idag främst används vid behandling av osteoporos är alendronat och risedronat. 44 Information från Läkemedelsverket 4:2007 Långtidsstudier För alendronat finns data från tio års studier (6,7,31). De kliniska studierna av alendronat, där postmenopausala kvinnor randomiserade till behandling med 5; 10; 20 mg alendronat eller placebo, har förlängts i tre omgångar efter de första initiala tre åren (Fracture Intervention Trial, FIT). Första förlängningen, år 4 till 5, fick alla i placebogruppen 10 mg alendronat och avslutades därefter. De som tidigare fått 5 eller 10 mg fick fortsätta med oförändrad behandling och de som de första två åren fått 20 mg alendronat behandlades år 3 till 5 med 5 mg. Under den andra förlängningen, år 6 till 7, fortsatte behandlingen oförändrat förutom för gruppen som från början fått 20 mg alendronat. Dessa fick under år 6 till 10 placebo (8) Under år 8 till 10 fortsatte grupperna som behandlades med 5 eller 10 mg med oförändrade doser. 247 kvinnor fullföljde alla tio år och de hade alla fått minst fem års behandling med alendronat (6). I en studie, FLEX (FIT Long-Term extension) randomiserades kvinnor till fortsatt behandling med alendronat eller placebo i fem år för att jämföra effekt av fortsatt behandling mot avslutad (31). Alla kvinnor som randomiserades hade behandlats i minst tre år med alendronat under och efter FIT-studien. En interimsanalys gjordes efter tre år i studien (7). I genomsnitt behandlades alla kvinnor med alendronat i fem år. För risedronat finns data från sju års behandling (9,10) De kvinnor som fullföljt de första tre åren i studien erbjöds att fortsätta i ytterligare två år med bibehållen randomisering och blindning. 265 kvinnor deltog (130 i placebogrupp och 135 i 5 mg-risedronatgrupp). Totalt 220 kvinnor fullföljde studien. I nästa tvååriga förlängning, år 6 till 7, togs placebogruppen bort och alla behandlades med risedronat 5 mg/dag. 136 kvinnor fortsatte i sju år. Långtidseffekter Frakturer Det har diskuterats om lång tids nedpressad benomsättning kan leda till försämrad reparation av mikroskador i skelettet och ”hypermineralisering”. Detta har visats i djurstudier med mycket höga doser bisfosfonat (11). Detta skulle i sin tur kunna försvaga benet och leda till ökad frakturrisk. Ingen ökad incidens av frakturer kunde ses hos de patienter som behandlats upp till tio års tid med alendronat jämfört med obehandlade patienter. Det har framkommit funderingar angående eventuell ökad frekvens av vertebrala frakturer vid förlängd behandling med alendronat jämfört med antalet frakturer i Bakgrundsdokumentation Behandling av osteoporos tidigare delar av studien (år 0 till 3 respektive 6 till 7) (12), men detta har inte kunnat säkerställas. Metoderna för att finna nya vertebrala frakturer skilde mellan de olika studierna, vilket gör den beräknade skillnaden osäker (13). Ingen påverkan på frakturläkning eller insufficiensfrakturer sågs under de treåriga kliniska studierna av alendronat och risedronat som omfattade ett stort antal patienter (1–4). Det föreligger tyvärr inga placebokontrollerade studier avseende frakturer efter långtidsbehandling med bisfosfonat. Behandling med alendronat har placebokontrollerat visat frakturreducerande effekt upp till drygt tre år för postmenopausala kvinnor med låg bentäthet (1,2). I de förlängda studierna av alendronat (4–10 år) samlades data in på morfometriska kotfrakturer, kliniska frakturer och kroppslängd som ”safety endpoints”. Några direkta jämförelser mellan grupperna när det gäller incidens av fraktur är inte möjlig, dels på grund av för få individer i studien, dels beroende på att alla ingående i studien under någon del fått behandling med alendronat. Ingen ökning av frakturer i gruppen som avslutat behandlingen kunde dock ses efter sju år jämfört med dem som fortsatte behandling (8). Risedronatstudien fortsatte upp till fem år med en placebokontrollerad studie av frakturincidens i en subgrupp från den initiala vertebrala studien. Den frakturskyddande effekten när det gäller vertebrala frakturer kvarstod efter fem års behandling med risedronat. Ingen skillnad sågs mellan grupperna när det gäller icke-vertebrala frakturer med en reduktion av frakturincidens på 59 % under år 4 till 5 (14). Incidensen av vertebrala frakturer var samma under år 6 till 7 av risedronatbehandling som under år 0 till 3 (4,7 %) och ingen skillnad i incidens jämfört med år 4 till 5 (5,2 %), vilket skulle kunna indikera att den frakturskyddande effekten kvarstår också efter sju års behandling. Den årliga incidensen av nya vertebrala frakturer var lika i de båda behandlingsgrupperna (3,8 %). Andelen vertebrala frakturer i gruppen som bytt från placebo till aktiv behandling var lägre jämfört med placebobehandlade. Ingen signifikant skillnad sågs mellan grupperna när det gäller ickevertebrala frakturer 10). BMD Efter fem års behandling med alendronat eller placebo i FLEX-studien, där alla kvinnor behandlats i genomsnitt i fem år med alendronat, sågs en minskning av BMD i gruppen som bytt till placebo, – 2,4 % i höft och – 3,7 % i ländrygg, men värdena var fortsatt högre än före påbörjad behandling tio år tidigare. I behandlingsgruppen sågs en fortsatt ökning av BMD i ländryggen, 5,26 %, och BMD-värdet i höften stabiliserades. Den största ökningen av BMD sågs under de första fem årens behandling (31). I grupperna från FIT-studien som fortsatt behandling med alendronat sågs under år 7 till 10 en fort- satt ökning av BMD i ländryggen och stabila värden i höftmätningarna utan signifikanta förändringar. Ökningen efter tio år var i ländryggen 13,7 % och 10,3 % i trokanter och 5,4 % i femur neck jämfört med baseline (6,8,15). Också med risedronat sågs en fortsatt bentäthetsökning i ländryggen efter fem år, medelökningen från baseline var 9,3 %. Även efter sju års behandling sågs en viss ökning av bentätheten i ländryggen, dock ej signifikant mellan år 5 och 7; även här var mätvärden i höften stabila (14). Den fortsatta ökningen efter lång tids bisfosfonatbehandling ses framför allt i det axiala skelettet. Denna ökning skulle kunna förklaras av den ökning av bentätheten som ofta ses i ryggen med ökad ålder till följd av ökad mängd degenerativa förändringar i ryggen. I placebogruppen i risedronatstudien fick man en viss ökning av bentätheten i ryggen, men denna var långt mindre än i behandlingsgruppen. Detta talar för att effekten på bentätheten är en sann effekt av behandlingen med risedronat. Biokemiska benmarkörer Biokemiska benmarkörer är ett indirekt mått på benomsättningen vars betydelse är oklar när det gäller att värdera behandlingseffekt och frakturrisk. De resorptionsmarkörer som analyserats i samband med dessa studier är N-telopeptid typ I-kollagen (NTX) och serumbenspecifikt ALP (BSAP). Under behandling med både alendronat och risedronat ser man inom sex månader en sänkning av benmarkörerna som ett tecken på en minskad benomsättning. Denna minskning fortsätter. Under de första tre årens behandling med alendronat sjönk benmarkörerna till värden normala för premenopausala kvinnor. Effekten kvarstod under sex till sju och tio års behandling med alendronat. NTX sjönk från 66,6 nmol vid baseline till 22,0 nmol efter tio år, BSAP sjönk från 17,8 ng/mL till 9,1 ng/mL (6,15). Samma effekt ses efter sju års behandling med risedronat. Sänkningen för BSAP var 23,9 % efter fem års behandling (5,9 % i placebogruppen) med en kvarstående sänkning efter sju år (10). Benmarkörer börjar stiga sakta ett år efter utsatt behandling av alendronat men når inte nivåer som ses hos obehandlade och ligger kvar under gränsen för normalvärden hos postmenopausala kvinnor (6,7,8,31). Det finns data som talar för att återgången av benmarkörer till högre värden går snabbare efter behandling med risedronat än efter alendronat (16). Om detta är en sann skillnad mellan de olika bisfosfonaterna skulle det kunna tala för en skillnad i bindningsgrad till benet och i graden av påverkan av benomsättningen. Histomorfometri Behandling med äldre typer av bisfosfonat, såsom etidronat, har i vissa fall associerats med defekt mineralisering och osteomalaci. För de nyare bisfosfonaterna, med en aminogrupp i en sidokjedja, är den antiresorptiva effekten dominerande och den Information från Läkemedelsverket 4:2007 45 Bakgrundsdokumentation Behandling av osteoporos mineralisationshämmande effekten mycket låg. Benbiopsier under behandling syftar till att mäta förändringar i mikroarkitektur och mineralisering genom att jämföra vissa parametrar före och efter behandling. Kvalitativa förändringar som kan ses är osteomalaci, peritrabekulär fibros och ”woven bone”. Antalet biopsier efter långtidsbehandling med bisfosfonat är begränsad, men det finns ett mindre antal efter tio respektive fem års behandling. Parade benbiopsier (före och efter behandling) från 55 postmenopausala kvinnor efter tre års behandling med risedronat visade ingen negativ påverkan på histomorfometriska parametrar eller tecken på osteomalaci (17). Liknande resultat ses i biopsier efter fem års behandling. Parade biopsier från sju kvinnor som behandlats med 5 mg risedronat och tolv kvinnor ur placebogruppen visade minskad benomsättning, normal mineralisering och bevarad trabekulär arkitektur. Dubbel tetracyklin-märkning talar för pågående remodellering (9,18). Undersökning med 3-D mikroCT visar att också mikroarkitekturen är välbevarad efter behandling (19). Benbiopsier efter tre års behandling med alendronat visade ingen påverkan på mikroarkitekturen i benet, benomsättningen var reducerad men mineraliseringen normal (20). På kvinnor behandlade med alendronat (5 eller 10 mg/dag) i fem år och därefter alendronat eller placebo i fem år gjordes transilikal biopsi. Biopsier från 31 kvinnor efter tio års behandling visade normal kortikal och trabekulär benvävnad, där man också kunde observera dubbel fluorescens (tetracyklininlagring), som talar för en pågående benremodellering och mot ”frozen bone” (21). I en studie av ett litet antal patienter (n = 9) med ovanliga typer av fragilitetsfrakturer och fördröjd frakturläkning, under behandling med alendronat, visade biopsier på ”kraftigt minskad benremodellering”, överensstämmande med bilden av så kallat adynamiskt ben. Dessa patienter hade dock normala till förhöjda nivåer av benmarkörer för benomsättning. Fem av dessa patienter behandlades också med glukokortikoider eller östrogen, vilket kan ha betydelse på utfallet. De fyra som behandlades med enbart alendronat hade en behandlingstid mellan sex och åtta år. Fem av de nio patienterna läkte sina frakturer tre till åtta månader efter utsatt bisfosfonatbehandling (22). Biverkningar Gastrointestinala I kliniska studier har de gastrointestinala biverkningarna inte avvikit signifikant mellan behandlingsgrupper och placebogrupp. Den kliniska erfarenheten säger dock att det är en relativt vanlig biverkan att drabbas av någon form av gastrointestinala besvär. Denna skillnad kan bero på att högriskpatienter för gastrointestinala besvär exkluderades ur de kliniska studierna 46 Information från Läkemedelsverket 4:2007 för alendronat. I den patientgrupp som framför allt blir föremål för bisfosfonatbehandling – äldre kvinnor – finns en ökad förekomst av gastrointestinala besvär såsom ulcus och refluxesofagit. Användningen av NSAID-preparat är också relativt hög i denna patientgrupp, vilket kan bidra till att förekomsten GIbesvär vid bisfosfonatbehandling är vanligare i kliniken än i studierna. Osteonekros Rapporter har kommit om fall med avaskulär bennekros i käkbenet, ”osteonecrosis of the jaws”, ONJ, hos patienter med behandling med potenta bisfosfonater. Det har diskuterats ett samband med en alltför nedpressad benomsättning. Det stora flertalet (94 %) av de patienter som drabbats är patienter med intravenös bisfofonatbehandling på grund av olika maligna sjukdomar. Flera behandlades också samtidigt med andra läkemedel såsom kortikosteroider och kemoterapi (23). Predisponerande faktorer är dentala sjukdomar, tandkirurgi, orala trauma, peridontit och dålig tandhygien (24–26). Sannolikt har den betydligt högre potensen hos de intravenösa bisfosfonaterna betydelse för risken att utveckla ONJ. Andra identifierade riskfaktorer är långtidsbehandling, typ av bisfosfonat samt hög ålder. Bland det stora antal patienter som behandlats med perorala bisfosfonater mot osteoporos har bara ett litet antal fall av ONJ rapporterats; det rör sig ännu så länge om cirka 50 patienter (23). Inte heller i de kliniska studierna av dessa läkemedel, som omfattar mer än 60 000 patientår av exponering, har något fall av ONJ rapporterats. Möjligheten att expositionstiden spelar stor roll för risken att insjukna i OJN lyfter frågan om patienter som behandlas med bisfosfonat på grund av osteoporos inte bör behandlas längre än fem år i sträck och därefter göra uppehåll minst ett år innan behandlingen påbörjas igen. Ytterligare data behövs för att klarlägga betydelsen av behandlingstid, doser och administrationsväg innan klara rekommendationer kan utfärdas. Tills detta finns bör man ha en ökad uppmärksamhet när det gäller dentala ingrepp och skador framför allt under behandling med intravenösa bisfosfonater. Det finns idag inget som talar för att bisfosfonater behöver seponeras i samband med rutinmässig tandvård, men det diskuteras om behandlingen skall sättas ut i samband med mer omfattande dentala ingrepp vilket, i avsaknad på mer data, verkar vara en rimlig åtgärd. Bisfosfonaten bör då inte återinsättas förrän fullständig läkning efter tandingreppet skett. Det är idag oklart om detta förhållningssätt påverkar risken för ONJ, framför allt med tanke på bisfosfonaters långa halveringstid i skelettet. Övriga Efter absorption försvinner bisfosfonaten snabbt från cirkulationen – en del binder till benet och resterande utsöndras via njurarna och metaboliseras inte Bakgrundsdokumentation Behandling av osteoporos Data talar för att effekten på bentätheten försvinner relativt fort efter utsatt behandling. Vid beslut om fortsatt behandling bör också vägas in den ökade risken för tromboemboliska sjukdomar med stigande ålder, vilket gör behandlingen olämplig för äldre kvinnor. vidare i kroppen. Detta gör att förekomsten av effekt på andra organ i kroppen är låg. Förutom mag-tarmkanalen, före absorption, är icke-skelettala vävnader exponerade för mycket låga nivåer bisfosfonat. Efter utsättning Efter utsättning av alendronat sågs efter fem år ingen signifikant minskning av BMD i ryggen, men en långsam förlust sågs i total höft, femur neck och underarm. Värdet låg dock högre än baseline. Markörerna för benomsättning ökade inom ett år men också medelvärdet för dessa förblev under baselinevärdena (6,7). När bisfofonaten inkorporerats med benet har det mycket lång halveringstid. Med en halveringstid på över tio år det är dock oklart huruvida de är fortsatt biologiskt aktiva. Enligt farmakokinetiska modeller beräknas skelettet innehålla 75 mg alendronat efter tio års kontinuerlig behandling med 10 mg/dag alternativt 70 g/ vecka (5). Den beräknade mängd alendronat som skulle lösgöras från skelettet är cirka 6 mikrogram/ dag, motsvarande en oral dos av 2,5 mg/dag. Detta är sannolikt en förklaring till att man ser en kvarvarande effekt av alendronat efter fem års behandling med relativt små förändringar i benomsättning och bentäthet. Raloxifen Raloxifen är ett SERM (Selektiv Estrogen Receptor Modulator) med antiresorptiv verkan med liknande effekt på benvävnaden som östrogen men sannolikt med något mindre ökning av bentätheten än östrogen. Behandling i fyra års tid visar en signifikant sänkning av incidensen av vertebrala frakturer men ingen signifikant sänkning av icke-vertebrala frakturer (27). En förändring ses i BMD ett år efter utsättning av Raloxifen efter fem års behandling. Ett år efter utsatt behandling var BMD signifikant lägre i lumbar spine och femoral neck jämfört med värden efter fem års behandling (28). Ur CORE-studien (Continuing Outcomes Relevant to Evista) som gjordes som en förlängning av den ursprungliga kliniska studien för att undersöka raloxifen och bröstcancer har man också kunnat undersöka effekter på skelettet efter åtta års kontinuerlig behandling med raloxifen (29). Risken för icke-vertebrala frakturer var densamma i behandlingsgrupp (22,8 %) och placebogrupp (22,9 %). Efter sju års behandling var bentätheten i ländryggen och femur neck högre än i placebogruppen, 1,7 % respektive 2,4 %. Ökningen från baseline efter sju års behandling var 4,3 % i ländryggen och 1,9 % i femur neck. Bentäthetsökningen är alltså bestående efter sju års behandling. Ingen effekt sågs på icke-vertebrala frakturer. Studien var inte designad för att utvärdera effekt på vertebrala frakturer. Behandlingstiden med raloxifen bör i första hand avgöras av den aktuella frakturrisken hos patienten. Slutsats Studier visar fortsatt ökning av BMD i ryggen efter tio års behandling med alendronat och sju år med risedronat och ingen signifikant sänkning av bentätheten på övriga mätlokaler. Placebokontrollerade frakturdata finns för drygt tre års behandling med alendronat och fem år med risedronat. Det finns alltså evidens för en frakturförebyggande effekt av fem års behandling och tio års effekt på bentätheten. Effekten på frakturrisk av förlängd behandling får baseras helt på förändringar i bentäthet och benmarkörer i frånvaro av frakturdata. Det finns sannolikt ett samband mellan bentäthet och minskad frakturrisk visad i djurstudier och i de stora RCT. Teoretiskt talar detta för att också hållfastheten kan fortsätta att öka efter fem års behandling (30). Behandlingstidens längd måste avgöras utgående från frakturrisken hos den behandlade patienten. Hos yngre postmenopausala kvinnor förefaller fem år vara en rimlig behandlingstid under förutsättning att BMD hållit sig stabilt och patienten inte frakturerat upprepade gånger under pågående behandling. Möjligen kan man tänka sig ny behandlingsperiod senare i livet om behov uppstår på grund av ökad benförlust och frakturer. För äldre kvinnor med hög frakturrisk och en väl fungerande behandling kan det vara aktuellt att utsträcka behandlingstidens längd upp till i alla fall tio år. Inför ett beslut angående eventuell seponering av behandlingen bör en bentäthetsmätning göras. I de fall man beslutar att avsluta behandlingen bör uppföljande mätning av BMD göras efter ett till två år. Resultat och eventuella nya frakturer får avgöra behovet av ny behandlingsperiod med bisfosfonat alternativt byte till annan behandlingsregim. Viktigaste faktorerna idag att väga in vid långtidsbehandling med bisfosfonat är risken för att alltför kraftig nedpressning av benomsättningen leder till ett adynamsikt ben och ökad risk för fraktur samt risken för osteonekros av käkbenet. Referenser 1. Black DM, Cummings SR, Karpf DB, et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996;348:1535–41. 2. Cummings SR, Black DM, Thompson DE, et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures. Results from the Fracture Intervention Trial. JAMA 1998;280:2077–82. 3. Reginster J, Minne HW, Sorenson OH, et al. Randomised trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteoporos Int 2000;11:83–91. Information från Läkemedelsverket 4:2007 47 Bakgrundsdokumentation Behandling av osteoporos 4. McClung MR, Geusen P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. N Engl J Med 2001;344:333–40. 5. Rodan G, Reszka A, Golub E, et al. Bone safety of long term bisphosphonate treatment. Curr Med Res Opinion 2004:20:1291–300. 6. Bone HG, Hosking D, Devogelaer JP, et al. Ten years experience with alendronate for osteoporsis in postmenopausal women. N Engl J Med 2004;350:1189–99. 7. Ensrud KE, Barret-Connor EL, Schwartz A, et al. Randomized trial of effect of alendronate continuation versus discontinuation in women with low BMD: Results from the Fracture Intervention Trial Long-term Extension. J Bone Miner Res 2004;19:1259–69. 8. Tonino RP, Meunier PJ, Emkey R, et al. Skeletal benefits of alendronate: 7-year treatment of postmenopausal osteoporotic women. J Clin Endocrinol Metab 2000;85:3109–15. 9. Ste-Marie LG, Sod E, Johnson T, et al. Five years of treatment with risedronate and its effects on bone safety in women with postmenopausal osteoporosis. Calcif Tissue Int 2004;75:469–76. 10. Mellström D, Sörenson OH, Goemaere S, et al. Seven years of treatment with risedronate in women with postmenopausal osteoporosis. Calcif Tissue Int 2004;75:462–8. 11. Mashiba T, Mori s, Burr DB, et al. The effects of suppressed bone remodeling by bisphosphonates on microdamage accumulation and degree of mineralization in the cortical bone of dog rib. J Bone Miner Metab 2005;23(Suppl):36–42. 12. Ott SM. Fractures after long-term alendronate therapy. J Clin Endocrinol Metab 2001;86:1835. 13. Tonini RP, Santora A, Ross PD. Safety of long-term alendronate. J Clin Endocrinol Metab 2001;86:1835. 14. Sorensen OH, Crawford GM, Mulder H, et al. Long-term efficacy of risedronate: a 5-year placebo-controlled clinical experience. Bone 2003;32:120–6. 15. Sambrook PN, Rodriguez JP, Wasnich RD, et al. Alendronate in the prevention of osteoporosis: 7-year follow-up. Osteoporos Int 2004;15:483–8. 16. Mortensen L, Charles P, Pirow J, et al. Risedronate increases bone mass in an early postmenopausal population: Two years of treatment plus one year of follow-up. J Clin Endocrinol Metab 1998;83:396–402. 17. Eriksen EF, Melsen F, Sod E, et al. Effects of long-term risedronate on bone quality and bone turnover in women with postmenopausal osteoporosis. Bone 2002;31:620–5. 18. Borah B, Dufresne TE, Ritman EL, et al. Long-term risedronate treatment normalizes mineralization and continues to preserve trabecular architecture: Sequential triple biopsy studies with micro-computed tomography. Bone 2006;39:345–52. 48 Information från Läkemedelsverket 4:2007 19. Borah B, Dufrense TE, Chmielewski PA, et al. Risedronate preserves bone architecture in osteoporotic postmenopausal women measured by 3-DF micro-computed tomography. J Bone Miner Res 2002;17:1139–45. 20. Chavassieux PM, Arlot ME, Reda C. Histomorphometric assessment of the long-term effects of alendronate on bone quality and remodeling in patients with osteoporosis. J Clin Invest 1997;100:1475–80. 21. Recker R, Ensrud K, Diem S, et al. Normal bone histomorphometry and 3 D microarchitecture after 10 years alendronate treatment of postmenopausal women [abstract]. J Bone Miner Res 2004;19(suppl 1):45. 22. Odvina C, Zerwekh JE, Sudhaker R, et al. Severly suppressed bone turnover: A potential complication of alendronate therapy. J Clin Endocrinol Metab 2005;90:1294–1301. 23. Woo SB, Hellstein JW, Kalmar JR. Systemic review: Bisphosphonates and osteonecrosis of the jaw. Ann Intern Med 2006;144:753–61. 24. Bilezikian JP. Osteonecrosis of the jaw – do bisphoshonates pose a risk? N Engl J Med 2006;355:2278–81. 25. Marx RE. Pamidronate and zoledronate induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003;61:1115–8. 26. Ruggiero SL, Mehrotra B, Roseberg TJ, et al. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004;62:527–34. 27. Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifen: Results from a 3-year randomised clinical trial. JAMA 1999;282:637–45. 28. Neele SJ, Evertz R, DeValk-De Roo, et al. Effect of 1 year of discontinuation of raloxifen or estrogen therapy on bone mineral density after 5 years of treatment in healthy postmenopausal women. Bone 2002;30:599–603. 29. Siris ES, Harris ST, Eastell R, et al. Skeletal effects of raloxifen after 8 years: Results from the continuing outcomes relevant to Evista (CORE). J Bone Miner Res 2005;20:1514–24. 30. Wasnich RD, Miller PD. Antifracture efficacy of antiresorptive treatments are related to changes in bone density. J Clin Endocrinol Metab 2000;85:231–6. 31. Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment. The fracture Intervention Trial Long-term Extension (FLEX): A randomized trial. JAMA 2006;296:2927–38. Bakgrundsdokumentation Behandling av osteoporos Behandling med paratyreoideahormon Ove Törring PTH-metabolism Paratyreoideahormon (PTH) är kroppens viktigaste kalciumreglerande hormon och har under senare år använts vid behandling av osteoporos. I denna sammanställning ges en kort fysiologisk bakgrund samt genomgång av behandlingseffekter och resultat. Av cirkulerande PTH är cirka 8 % intakt PTH 1–84, vilket tas upp i leverns Kupfferceller och metaboliseras till N-terminala och C-terminala fragment (12). N-terminala fragment metaboliseras i cellerna medan C-terminala fragment recirkulerar och metaboliseras genom utsöndring via njurarna (13–15). Bioaktivitet av Cterminala PTH-fragment är påvisad in vitro och djurstudier och antas hos människa kunna ha fysiologisk betydelse vid höga koncentrationer som vid sekundär hyperparatyreoidism på grund av njursvikt (16). Specifika receptorer för C-terminala PTH-fragment har dock ännu ej identifierats hos människa (17). I kliniska studier har såväl hela PTH-molekylen (1– 84) som olika fragment av PTH (1–34,1–38) använts (18–22). En direkt jämförelse mellan PTH 1–34 och PTH 1–84 med avseende på bland annat histomorfometri, benkvalitet och biomekanik hos människa saknas men är utförd på råtta. PTH 1–34 och PTH 1–84 ökade benkvaliteten i vertebralt och kortikalt ben samt den mekaniska styrkan (23–25). Båda peptider ökade endostal och periostal benformation samt dimension av kortikalt ben (25). Ingen skillnad mellan PTH 1–34 och PTH 1–84 kunde påvisas. Sammantaget är det mindre sannolikt att skillnader i molekyllängd och metabolism mellan PTH 1–34 och PTH 1–84 har terapeutisk relevans för behandlingen av patienter med primär osteoporos och normal njurfunktion. Effekter av PTH-tillförsel Två PTH-preparat är godkända av EU. Rekombinant PTH 1–34 (teriparatid), som är identiskt med de första 34 aminosyror av humant PTH registrerades 2003 för injektion i dosen 20 mikrogram dagligen subkutant i 18 månader. Rekombinant PTH 1–84 (parathormon) är identiskt med humant PTH 1–84 och registrerades 2006 för injektion i dosen 100 mikrogram dagligen subkutant i 18 månader. Av dessa två preparat har teriparatid den mest omfattande dokumentationen. Den följande genomgången omfattar effekterna av PTH-behandling på human benvävnad. Avseende BMD och frakturreduktion är tonvikten lagd på behandlingsresultat från kliniskt kontrollerade studier där daglig subkutan injektion av terapeutiskt relevanta doser av teriparatid (20 mikrogram) och PTH 1–84 (100 mikrogram) har redovisats. Bakgrund PTH frisätts från bisköldkörtlarna när kalciumkoncentrationen i blodet sjunker. Frisättningen hämmas när kalciumjonen (Ca ++) stiger. Serum Ca ++ hålls mycket konstant genom denna feedback-mekanism. PTH frisätts dels som intakt PTH (1–84aa), dels som olika C-terminala molekylfragment. Kvoten mellan dessa varierar och bestäms av serumkalcium (1). De biologiska effekterna utövas genom att N-terminalt PTH binder sig till, och aktiverar, PTH/PTHrP typ1-receptorer i njure och skelett. Ytterligare PTH/ PTHrP-receptorer för N-terminal PTH har beskrivits, men deras fysiologiska roll är otillräckligt klarlagd hos människan (2). I njurarna stimuleras dels enzymet 25-hydroxyvitamin D 1-alfa-hydroxylas och därmed bildningen av 1,25 vitamin D (kalcitriol), dels återresoptionen av kalcium i tubuli. I skelettet stimuleras aktiviteten av osteoklaster och därmed ökad benresorption. Kalcitriol spelar en viktig roll för benformation och mineralisering bland annat genom att öka tarmabsorptionen av kalcium och fosfat. Kontinuerlig vs intermittent PTHtillförsel Hos normokalcemiska friska är serumkoncentrationen av PTH relativt konstant, men med en regelbunden kortvarig, intermittent ökning som sannolikt har fysiologisk betydelse. Det har visat sig att kontinuerlig ökad serum-PTH-koncentration bland annat stimulerar produktionen av RANKL, som ökar rekrytering och aktivitet av osteoklaster och benresorption samt minskar osteoprotegerin (OPG), som hämmar osteo­ klastogenesen (3–5). Ett kliniskt exempel är primär hyperparatyreoidism, som medför nedsatt bentäthet i trabekulärt ben och något mera i kortikalt ben såsom radius (6). Om däremot serum-PTH ökas intermittent är effekten på RANKL/OPG kortvarig och man får i stället anabola effekter. Orsaken är inte fullständigt klarlagd men anses bland annat bero på minskad apoptos av osteoblaster samt ökad rekrytering och differentiering av preosteoblaster, produktion av anabola tillväxtfaktorer, som TGFβ, IGF-1 och IGF-2, och av osteokalcin och typ-1-kollagen på grund av ökad benformation (7–9). Kontinuerlig PTH-tillförsel medför en markant ökning i genexpression i benceller jämfört med intermittent tillförsel (10,11). Farmokinetik av PTH Teriparatid absorberas snabbt efter subkutan injektion av 20 mikrogram och uppvisar högsta serumkoncentration efter 30 minuter och återgång inom cirka tre timmar och halveringstid på cirka en timme (26). Information från Läkemedelsverket 4:2007 49 Bakgrundsdokumentation Behandling av osteoporos Biotillgängligheten efter subkutan injektion är cirka 95 % (27). Efter injektion av PTH 1–84 100 mikrogram i abdomen ses en snabb ökning av plasma-PTH som når en topp efter en till två timmar; halveringstiden är cirka 1,5 timme. Biotillgängligheten efter subkutan injektion är cirka 55 % (28). Benkvalitet och struktur Utöver mineralinnehåll har kvalitet och struktur avgörande betydelse för benvävnadens hållfasthet. PTH ökar benkvaliteten genom påverkan på benomsättningen och stimulering av benformation, bentäthet, bendimension och mikroarkitektur (29). De anabola effekterna av PTH-behandling ses främst i trabekulärt ben och medför ökad styrka i kotkroppar. I kortikalt ben är PTH-effekten mindre uttalad och av annan karaktär. Behandling av postmenopausala kvinnor med teriparatid ökar trabekulär volym och konnektivitet samt kortikal tjocklek. Dessutom ändras trabekelstrukturen mot mera plåtliknande strukturer (30). Benbiopsier på postmenopausala kvinnor efter 18 månaders behandling visar att också PTH 1–84 ökar benformationen speciellt i spongiöst ben (31). Det nybildade benet har normal lamellstruktur och trabeklerna ökar i volym, antal, tjocklek samt konnektivitet, vilket sammantaget leder till förbättrad mikroarkitektur. Ökat antal trabekler och konnektivitet anses uppstå bland annat på grund av att PTH orsakar att trabeklerna blir tjockare och genomgår tunnelering, som till slut medför längsgående delning (31–33). I kortikal vävnad medför teriparatidbehandling ökad kortikal tjocklek, mindre endosteal benresorption, men oförändrat kortikal porositet (33). Effekten på kortikal vävnad har med hjälp av perifer kvantitativ CT (pQCT) även studerats i distala radius hos en grupp postmenopausala kvinnor som behandlats med teriparatid i 18 månader (21,34). Benmineral samt total- och kortikal area och periostal cirkumferens ökade signifikant med teriparatid jämfört med placebo. Digital bearbetning och geometrisk strukturanalys av DXA-resultat från samma studie visade att den axiala styrkan, ”bending strength”, kortikal tjocklek samt stabilitet och strukturgeometri i lårbenshals och intertrokanterregion ökade signifikant med teriparatid jämfört med placebo (21,35). Sammantaget blir resultatet av PTH 1–34- och PTH 1–84-behandling i spongiöst ben således bättre kvalitet och struktur och i kortikalt ben ökad tjocklek och area på grund av periostal bennybildning och mindre endosteal resorption. Tillsammans med ökat mineralinnehåll leder dessa förändringar till ökad styrka och hållfasthet i spongiöst och kortikalt ben (36). I kortikalt ben ändras dimensionerna, vilket kan medföra lägre BMD trots oförändrat eller ökat mineralinnehåll på grund av sättet att beräkna area BMD (se nedan). I nedanstående genomgång avser ”BMD” areaBMD om annat ej anges. 50 Information från Läkemedelsverket 4:2007 Benmarkörer I samband med benformationsprocessen frisätts bland annat osteokalcin, benspecifik alkalisk fosfatas och prokollagenpeptider (PINP), och i samband med resorptionsprocessen nedbrytningsprodukter av kollagen typ 1 (NTX, CTX, ICTP) och hydroxypyridiner/-oliner. Dessa produkter kan mätas i serum eller urin och används som markörer på aktiviteten i benomsättningen. Intermittent behandling med teriparatid och PTH 1–34 leder till ökning av benmarkörer för formation och resorption hos både kvinnor och män samt vid glukokortikosteroidinducerad osteoporos (37–41). Även behandling med PTH 1–84 leder till ökning av markörer för benformation och benresorption (42,43). Benformationen ökar snabbt, inom en månad, och kommer några veckor före ökningen av resorption (43–45). Benmarkörerna fortsätter att stiga och toppar efter cirka ett års behandling, för att därefter sjunka successivt till utgångsvärdet efter 18 månader. Hos män är formationsmarkörerna fortfarande förhöjda efter 18–24 månader (39). Sammanfattningsvis leder PTH-behandling till tidiga ökningar av benformation åtföljt av resorption som sammantaget medför dominans av anabola effekter under hela behandlingstiden. BMD Hos postmenopausala kvinnor med osteoporos blev anabola egenskaper av intermittent PTH-behandling rapporterade redan 1980 (18). Ökning av BMD är korrelerad till ökad hållfasthet och lägre frakturrisk (36). PTH-effekten på BMD i ländryggen är dosrelaterad hos postmenopausala kvinnor och män, både för intermittent teriparatid (20 och 40 mikrogram) och PTH 1–34 (50, 100 och 200 IE), (21,41,46) samt PTH 1–84 (50, 75 och 100 mikrogram) (42). Samma dos-effektrelation har också noterats i lårbenshalsen och i mitten av radius med teriparatid (21) samt i lårbenshalsen, men ej radius, hos män (41). Effekten har ej varit lika entydig i höften hos postmenopausala kvinnor som behandlats med PTH 1–84 (42). Postmenopausala kvinnor Neer och medarbetare har utfört den största studien med teriparatid. Den omfattar kvinnor med postmenopausal osteoporos och ligger till grund för preparatets registrering (21). I studien ingick 1 637 kvinnor (69,3 år i genomsnitt) med minst en medelsvår kotfraktur eller minst en kotfraktur och BMD i höft eller ländrygg ≤ – 1 SD. 444 kvinnor fick en daglig subkutan injektion av 20 mikrogram, 40 mikrogram, (n = 434) eller placebolösning (n = 448) med observationstid på 21 månader (median). Alla fick 1 000 mg kalcium. Om serum 25-hydroxyvitamin D var lågt fick kvinnorna även tillskott av D-vitamin. Bakgrundsdokumentation Behandling av osteoporos Patienterna fick utfört röntgen av kotkropparna samt mätning av bentäthet av ländrygg, höft och radius. Dessutom bestämdes bland annat serumkalcium regelbundet. T-score i ländryggen var – 2,6 SD i genomsnitt för alla grupper vid inklusion. Endast resultaten för den terapeutiska dosen av teriparatid, 20 mikrogram, redovisas här. BMD ökade i ländryggen med 9,7 % i PTH-gruppen och 1,1% i placebogruppen (p < 0,001) efter 18 månader. I lårbenshalsen, där andelen kortikalt ben är högre, steg BMD med 2,8 % i PTH-gruppen men minskade i placebogruppen med 0,7 % (p < 0,001). I trokanterregionen, som innehåller relativt mer trabekulärt ben jämfört med lårbenshalsen, föll BMD med 0,2 % men steg med 3,5 % i teriparatidgruppen (p < 0,001). Motsvarande siffror för hela höften (total hip) var – 1,0 % respektive + 2,6 % (p < 0,001). I kortikalt ben (mitten av radius) minskade BMD, men var ej signifikant skild mellan placebo (– 1,3 %) och teriparatid (– 2,1 %) (21). Att BMD minskade i mitten av radius, som nästan uteslutande består av kortikalt ben och steg mera blygsamt i lårbenshalsen än i ländryggen beror bland annat på att PTH ökar periostal bennybildning, kortikal tjocklek och perimeter och därmed areal av kortikalt ben. BMD beräknas som benmineralinnehåll (BMC) dividerat med areal på mätningsstället. I en annan studie har 203 kvinnor (65,9 år) med postmenopausal osteoporos och T-score ≤ – 2,5 till – 4,0 i ländrygg (– 2,8 SD i genomsnitt) eller höft randomiserats till behandling med 20 mikrogram teriparatid dagligen i 18 månader (n = 102) eller 10 mg alendronat (n = 101) (44). Alla fick 1 000 mg kalcium och 400–800 IE vitamin D-tillskott. I teriparatidgruppen steg BMD i ländryggen med 10,3 % och i alendronatgruppen med 5,5 % (p < 0,001 jämfört med teriparatid). I lårbenshalsen var ökningen lika, 3,9 % respektive 3,5 % (n.s.). Volumetrisk BMD (QCT) i ländryggen steg med teriparatid 19,0 % mot 3,8 % i kontrollgruppen (p < 0,01) (44). Ökar bentätheten i ländryggen hos alla som behandlas? Nya data från studier av postmenopausala kvinnor med osteoporos visar att 91 % av patienterna som behandlas med 20 mikrogram PTH 1–34 dagligen under 18 månader får en signifikant ökning av BMD, det vill säga mer än > 3 % (47). Det har dock ej varit möjligt att i förväg identifiera patienter som svarar positivt på behandlingen. Kontroll av benmarkörer PINP under teriparatidbehandling och tidig ökning av PICP och PINP tycks kunna prediktera ökning av BMD (48,49). Effekten av behandling med PTH 1–84 i tolv månader har rapporterats i två studier (42,22). I den ena studien fick 205 postmenopausala kvinnor med osteoporos (64 år) PTH 1–84-behandling med 50 mikrogram (n = 50), 75 (n = 52) eller 100 mikrogram (n = 51) eller placebo (n = 53) (42). Alla fick 500–1 000 mg kalcium samt 400 IE vitamin D. BMD i ländryggen ökade signifikant med 7,8 % och BMC 10 % i 100-mikrogramgruppen jämfört med 0,9 % i placebogruppen. I lårbenshalsen var ökningen av 100 mikrogram modest, 0,5 % mot – 0,7 % i kontrollgruppen (ns.). I ländryggen var BMD-ökningen dosrelaterad. Resultat från radius har ej redovisats. I den andra studien behandlades 238 kvinnor med postmenopausal osteoporos (69 år) med PTH 1–84 100 mikrogram (n = 119), PTH + 10 mg alendronat dagligen (n = 59) eller alendronat (n = 60). BMD-steg i PTH-gruppen med 6,3 %, 6,1 % i kombinations- och 4,6 % i alendronatgruppen (ns.) (22). I lårbenshalsen var BMD väsentligen oförändrad men sjönk signifikant, – 3,4 % i distala radius jämfört med kombinationsgruppens – 1,1 %. Effekten av PTH 1–84 på BMD under 18 månaders behandling har studerats i en randomiserad studie (50). I denna inkluderades 2 056 postmenopausala kvinnor utan tidigare kotfraktur och i åldern 45–54 år ett T-score ≤ – 3,0 eller T-score ≤ – 2,5 om de var ≥ 55 år (51). Även kvinnor med tidigare kotfraktur inkluderades oberoende av T-score (n = 471 kvinnor). Alla fick 700 mg kalcium och 400 IE vitamin D. BMD steg i PTH 1–84-gruppen med 6,5 % versus 0,3 % i placebogruppen (p < 0,001) och i lårbenshalsen 1 % vs. – 1,1 (p < 0,001) (50). Sammanfattningsvis medför både teriparatid och PTH 1–84-behandling signifikanta ökningar av BMD, framför allt i ländryggen hos postmenopausala kvinnor med osteoporos. I lårbenshalsen och kortikalt ben i radius är effekten på areaBMD lägre med båda preparaten, vilket delvis kan bero på dimensionsändringar. PTH-behandling medför signifikant högre BMD i ländryggen än behandling med alendronat. Män Orwoll och medarbetare studerade effekten av elva månaders behandling med teriparatid hos 437 män i åldern 30–85 år och T-score < – 2 SD i antingen ländrygg eller höft (41). 151 patienter fick 20 mikrogram teriparatid subkutant dagligen, 139 fick 40 mikrogram och 147 fick placeboinjektion. Alla fick 1 000 mg kalcium och 400–1 200 IU vitamin D. BMD i ländryggen steg 5,9 % i teriparatidgruppen (20 mikrogram) mot 0,5 % i kontrollgruppen (p < 0,001) och i lårbenshalsen 1,5 % mot 0,3 % (p = 0,03). I kortikalt ben (radius) sjönk BMD med – 0,5 % i teriparatidgruppen mot – 0,2 % i kontrollgruppen (ns.) Glukokortikoidinducerad osteoporos Behandlingsdata från tillräckligt stora kontrollerade kliniska studier på patienter med glukokortikoidinducerad osteoporos där man har använt de registrerade terapeutiska doserna av teriparatid eller PTH 1–84 saknas. I en studie av 51 kvinnor, som var i östrogen- och Information från Läkemedelsverket 4:2007 51 Bakgrundsdokumentation Behandling av osteoporos glukokortikoidbehandling, gavs injektion av 25 mikrogram PTH 1–34 dagligen (n = 28) eller placebo (n = 23) under tolv månader. PTH medförde en ökning av BMD i ländryggen på 11 % men ej signifikant i lårbenshalsen (38). Bedömd med QCT ökade volumetrisk BMD i ländryggen med 35 %, delvis beroende på att även tvärsnittsarealet av kotkropparna ökade med 5 %. Under de följande tolv månaderna fortsatte BMD och volumetrisk BMD i ländryggen att öka tvärsnittsarealet förblev delvis ökad trots att PTH sattes ut (52,53). Tidigare antiresorptiv behandling Patientens osteoporosbehandling fram till PTH-behandling påbörjas spelar också en viktig roll för resultatet. Den gynsamma effekten av PTH-behandling fördröjs således i tre till sex månader om patienten har stått på alendronat en längre tid och denna sätts ut i samband med start av PTH. Effekter påverkas däremot ej om patienten har stått på östrogen eller raloxifen (37,54,55). Dessa skillnader beror bland annat på att alendronats och östrogens farmakokinetik och cellulära effekter i skelettet är olika. Alendronat binds till hydroxyapatiten och retineras i benvävnaden i många månader till år efter dess utsättning. Data från tidigare risedronatbehandlade patienter är ofullständiga. Kombination och cyklisk behandling Eftersom PTH stimulerar benformation så skulle en samtidig hämning av benresorption med bisfosfonat teoretiskt kunna potentiera effekten av PTHbehandlingen. Samtidig behandling med alendronat nedsätter effekten av PTH 1–34 på BMD. Studier med olika doser av PTH 1–34 eller PTH 1–84 hos postmenopausala kvinnor och män med osteoporos visar att man får sämre ökning av BMD när aledronat ges tillsammans med PTH än med enbart PTH (20,43,56,57,58). Det samma gäller när behandling med PTH 1–34 ges växelvis med alendronat i tremånaderscykler (57). Sammanfattningsvis medför kombination och cyklisk behandling med PTH och alendronat inte några fördelar i form av högre bentäthet än PTH enbart och frakturdata saknas också. Frakturer Flera randomiserade kliniska studier med avseende på BMD och frakturriskreduktion har utförts med PTH 1–34 hos postmenopausala kvinnor och män med osteoporos samt vid glukokortikoidinducerad osteoporos. Studierna varierar bland annat med avseende på patientantal, inklusions- och exklusionskriterier, dos, producent av PTH 1–34, behandlingstid, studiedesign med mera (59,60). Nedanför redovisas frakturdata från kliniska studier där terapeutisk dos av teriparatid (20 mikrogram subkutant dagligen) har använts. Frakturdata för intermittent PTH 1–84- 52 Information från Läkemedelsverket 4:2007 behandling i terapeutisk dos (100 mikrogram subkutant dagligen) föreligger i preliminär form. Postmenopausala kvinnor I studien av Neer och medarbetare med teriparatid (se ovan) var incidensen av nya kotkompressioner 14,3 % i kontrollgruppen och 5,0 % i teriparatidgruppen (20 mikrogram) (p < 0,001) (21). Den absoluta riskreduktionen (ARR) var 9,3 %. Den relativa risken att drabbas av minst en ny kotkompression med teriparatid var 0,35 (0,22–0,55) jämfört med placebo och relativ riskreduktion (RRR) 65 %. Den absoluta risken för en non-vertebral fragilitetsfraktur var 5,5 % i kontrollgruppen jämfört med 2,6 % i teriparatidgruppen (p < 0,02), (ARR 2,9 % och RRR 53 %). Den frakturreducerande effekten av teriparatid är oberoende av nivån på benomsättningen innan behandling insätts eller om patienten är äldre än 75 år (61,62). Reduktion av frakturrisken tycks kvarstå upp till 30 månader efter utsättning när patienten har behandlats med teriparatid i 19 månader (median) (63). I studien av McClung och medarbetare (se ovan) på 102 teriparatid och 101 alendronatbehandlade kvinnor gjordes ingen uppföljning med röntgenundersökning av ryggen och patientantalet var otillräckligt för att detektera eventuella skillnader i frakturincidens (44). Effekten av PTH 1–84 på frakturreduktion efter 18 månader har studerats hos postmenopausala kvinnor som randomiserades mellan PTH 1–84, 100 mikrogram subkutant dagligen och placebo (se ovan) (51,50). Data redovisat som ITT-analyser visar att incidensen av kotfraktur efter 18 månader var 3,37 % i kontrollgruppen och 1,32 % i PTH-gruppen (ARR 2,1 %, RRR 61 %) (p = 0,001) (50). I gruppen utan tidigare kotfraktur var incidensen av en ny kotfraktur 2,08 % i kontrollgruppen och 0,67 % i PTH-gruppen (p = 0,006) (ARR 1,4 %, RRR 68 %). I gruppen med tidigare kotfraktur var incidensen av en ny kotfraktur 8,94 % i kontrollgruppen och 4,24 % i PTH-gruppen (p < 0,04) (ARR 5,7 %, RRR 53 %) (51). I per protokoll-analys var incidensen av en ny vertebralfraktur 3,33 % i kontrollgruppen och 1,14 % i PTH 1–84-gruppen (p = 0,002) (ARR 2,2 %, RRR 66 %). Det var ingen skillnad i incidensen av non-vertebrala frakturer (50). Män Adekvata studier av frakturreduktion på män som har behandlats med registrerad terapeutisk dos av teriparatid eller PTH 1–84 saknas. Studien med teriparatid av Orwoll och medarbetare var ej designad för bedömning av frakturincidens (41). Glukokortikoidinducerad osteoporos Adekvata studier av frakturreduktion för teriparatid och PTH 1–84-behandling saknas. Bakgrundsdokumentation Behandling av osteoporos Smärtor som regel under de första tre till sex månaderna av behandlingen. I studierna fick patienterna även kalcium och vitamin D-tillskott. Tillsammans med ökning av serum 1,25 dihydroxykolekalciferol, som PTH-behandling medför, bidrar detta till utveckling av hyperkalcemi. Hyperkalcemin normaliserades efter reduktion eller utsättning av PTH och kalcium/vitamin D i studierna. PTH-behandling kan medföra lätt hyperkalcuri, ökning av serumurat samt minskning av serummagnesium (21,22,41). Parametrarna normaliseras efter det att behandlingen upphör. Njurfunktionen spelar en mycket viktig roll i kalciummetabolismen och behandling med PTH. Hos postmenopausala kvinnor med osteoporos och medelsvår nedsatt njurfunktion (GFR över ≥ 30 mL/ min) orsakade teriparatidbehandling ej försämring av denna (69) och ökningen av BMD i ländryggen samt riskreduktionen för kotfraktur var ej lägre (69). Däremot var ökningen av BMD i lårbenshalsen lägre än hos friska. Antikroppar utan neutraliserande effekt har rapporterats med teriparatid hos enstaka procent av patienterna (21). Hos råttor har man sett att teriparatidbehandling kan medföra en dos- och durationsrelaterad utveckling av osteosarkom (70,71). Denna risk har dock inte observerats hos människa. Teriparatid har förskrivits till mer än 250 000 osteoporospatienter i USA utan att osteosarkom har utvecklats (72). Teriparatidbehandling av postmenopausala kvinnor med osteoporos medför färre ryggsmärtor. I studien av Neer och medarbetare förekom nya eller förvärrade ryggsmärtor således hos 23 % i placebogruppen och hos 17 % i teriparatidgruppen (20 mikrogram) (p < 0,007) (21). I studien av McClung hade något färre patienter ryggsmärtor under teriparatidbehandling (26 %) än med alendronat (39 %) (p = 0,05) (44). Andra studier har bekräftat smärtreduktion med teriparatidbehandling (64). Risken för nya eller förvärrade ryggsmärtor tycks vara lägre med teriparatidbehandling jämfört med alendronat och östrogenbehandling. Riskreduktionen har rapporterats kvarstå 30 månader efter att teriparatid har utsatts (65,66). Indikationer och behandling I Sverige är indikationen för daglig subkutan injektion av teriparatid (20 mikrogram)-behandling av manifest osteoporos hos postmenopausala kvinnor och för PT 1–84 (100 mikrogram) osteoporos hos postmenopausala kvinnor med hög risk för fraktur. Behandlingstiden är 18 månader för båda preparat och kalcium samt vitamin-D tillskott skall ges under behandlingstiden om födointag av dessa är otillräckligt. Kontraindikationer Teriparatid och PTH 1–84 skall ej ges vid allvarlig eller gravt nedsatt njurfunktion (i praktiken GFR < 30 mL/min), överkänslighet mot preparatet, tidigare strålbehandling mot skelettet, andra metabola skelettsjukdomar än primär osteoporos som primär hyperparatyreoidism och Mb Paget samt ospecifik förhöjning av alkalisk fosfatas. För teriparatid gäller vidare skelettumörer eller skelettmetastaser samt för PTH 1–84 gravt nedsatt leverfunktion (FASS online, 20070127). Behandling efter utsättning av PTH Efter utsättning av PTH-behandling förloras ett par procent av BMD i ländryggen under tolv månader, men förlusten är lägre i höft och radius (43). Insätts alendronat direkt efter utsättning av PTH ökar i stället BMD i ländryggen med cirka 5 % och i höften cirka 4 % (43). Vikten av att starta antiresorptiv behandling med bisfosfonat har också rapporterats efter utsättning av teriparatid (73). Referenser Biverkningar Biverkningarna av teriparatid och PTH 1–84 är likartade och består bland annat av illamående, yrsel, huvudvärk och muskelkramper (21,22,51,67). Efter injektion av teriparatid och PTH 1–84 ses en lätt stegring av serumkalcium, som i genomsnitt uppgår till 0,07–0,12 mmol/L med maximum efter 4–8 timmar (21,22). Efter tre till sex månader har serumkalcium i genomsnitt ökat obetydligt (0,07–0,09 mmol/L)(22,68). En dosrelaterad hyperkalcemi kan ses både vid teriparatid 20 mikrogram och PTH 1–84 100 mikrogram. Med teriparatid förekom hyperkalcemi någon gång, det vill säga > 2,64 mmol/L hos 6 % av män och hos 11 % hos postmenopausala kvinnor (21,41). Med PTH 1–84 noterades hyperkalcemi (> 2,62 mmol/L) någon gång under tolv månaders behandling hos 12 % och hos 28 % under 18 månaders behandling (22,51). Hyperkalcemi utvecklas 1. D’Amour P, Palardy J, Bahsali G, et al. The modulation of circulating parathyroid hormone immunoheterogeneity in man by ionized calcium concentration. J Clin Endocrinol Metab 1992;74:525–32. 2. Potts JT. Parathyroid hormone: past and present. J Endocrinol 2005;187:311–25. 3. Rodan GA, Martin TJ. Therapeutic approaches to bone diseases. Science 2000;289:1508–14. 4. Ma YL, Cain RL, Halladay DL, et al. Catabolic effects of continuous human PTH (1–38) in vivo is associated with sustained stimulation of RANKL and inhibition of osteoprotegerin and gene-associated bone formation. Endocrinology 2001;142:4047–54. 5. Poole KE, Reeve J. Parathyroid hormone – a bone anabolic and catabolic agent. Curr Opin Pharmacol 2005;5:612–7. 6. Dempster DW, Parisien M, Silverberg SJ, et al. On the mechanism of cancellous bone preservation in postmenopausal women with mild primary hyperparathyroidism. J Clin Endocrinol Metab 1999;84:1562–6. 7. Jilka RL, Weinstein RS, Bellido T, et al. Increased bone formation by prevention of osteoblast apoptosis with parathyroid hormone. J Clin Invest 1999;104:439–46. Information från Läkemedelsverket 4:2007 53 Bakgrundsdokumentation Behandling av osteoporos 8. Martin TJ, Quinn JM, Gillespie MT, et al. Mechanisms involved in skeletal anabolic therapies. Ann N Y Acad Sci 2006;1068:458–70. 9. Ma YL, Zeng Q, Donley DW, et al. Teriparatide increases bone formation in modeling and remodeling osteons and enhances IGF-II immunoreactivity in postmenopausal women with osteoporosis. J Bone Miner Res 2006;21:855–64. 10. Onyia JE, Helvering LM, Gelbert L, et al. Molecular profile of catabolic versus anabolic treatment regimens of parathyroid hormone (PTH) in rat bone: an analysis by DNA microarray. J Cell Biochem 2005;95:403–18. 11. Partridge NC, Li X, Qin L. Understanding parathyroid hormone action. Ann N Y Acad Sci 2006;1068:187–93. 12. D’Amour P. Circulating PTH molecular forms: what we know and what we don’t. Kidney Int Suppl 2006:29–33. 13. Bringhurst FR, Stern AM, Yotts M, et al. Peripheral metabolism of PTH: fate of biologically active amino terminus in vivo. Am J Physiol 1988;255:886–93. 14. Daugaard H, Egfjord M, Olgaard K. Metabolism of parathyroid hormone in isolated perfused rat kidney and liver combined. Kidney Int 1990;38:55–62. 15. Daugaard H, Egfjord M, Lewin E, et al. Metabolism of Nterminal and C-terminal parathyroid hormone fragments by isolated perfused rat kidney and liver. Endocrinology 1994;134:1373–81. 16. D’Amour P, Brossard JH. Carboxyl-terminal parathyroid hormone fragments: role in parathyroid hormone physiopathology. Curr Opin Nephrol Hypertens 2005;14:330–6. 17. Murray TM, Rao LG, Divieti P, et al. Parathyroid hormone secretion and action: evidence for discrete receptors for the carboxyl-terminal region and related biological actions of carboxyl- terminal ligands. Endocr Rev 2005;26:78–113. 18. Reeve J, Meunier PJ, Parsons JA, et al. Anabolic effect of human parathyroid hormone fragment on trabecular bone in involutional osteoporosis: a multicentre trial. Br Med J 1980;280:1340–4. 19. Hodsman AB, Fraher LJ. Biochemical responses to sequential human parathyroid hormone (1-38) and calcitonin in osteoporotic patients. Bone Miner 1990;9:137–52. 20. Cosman F, Nieves J, Woelfert L, et al. Alendronate does not block the anabolic effect of PTH in postmenopausal osteoporotic women. J Bone Miner Res 1998;13:1051–5. 21. Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1–34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434–41. 22. Black DM, Greenspan SL, Ensrud KE, et al. The effects of parathyroid hormone and alendronate alone or in combination in postmenopausal osteoporosis. N Engl J Med 2003;349:1207–15. 23. Mosekilde L, Sogaard CH, Danielsen CC, et al. The anabolic effects of human parathyroid hormone (hPTH) on rat vertebral body mass are also reflected in the quality of bone, assessed by biomechanical testing: a comparison study between hPTH(1–34) and hPTH-(1–84). Endocrinology 1991;129:421–8. 24. Ejersted C, Andreassen TT, Oxlund H, et al. Human parathyroid hormone (1–34) and (1–84) increase the mechanical strength and thickness of cortical bone in rats. J Bone Miner Res 1993;8:1097–101. 25. Oxlund H, Ejersted C, Andreassen TT, et al. Parathyroid hormone (1–34) and (1–84) stimulate cortical bone formation both from periosteum and endosteum. Calcif Tissue Int 1993;53:394–9. 26. Quattrocchi E, Kourlas H. Teriparatide: a review. Clin Ther 2004;26:841–54. 27. FDA. URL:http://www.fda.gov/cder/foi/label/2004/ 21318s004bl.pdf. (20070127 ). 28. EMEA. Scientific discussion. URL:http://www.emea.eu.int/ humandocs/PDFs/EPAR/preotact/PreotactEparScientificDen.pdf (20070127). 29. Bilezikian JP, Rubin MR, Finkelstein JS. Parathyroid hormone as an anabolic therapy for women and men. J Endocrinol Invest 2005;28:41–9. 54 Information från Läkemedelsverket 4:2007 30. Jiang Y, Zhao JJ, Mitlak BH, et al. Recombinant human parathyroid hormone (1-34) [teriparatide] improves both cortical and cancellous bone structure. J Bone Miner Res 2003;18:1932–41. 31. Fox J, Miller MA, Recker RR, et al. Treatment of postmenopausal osteoporotic women with parathyroid hormone 1–84 for 18 months increases cancellous bone formation and improves cancellous architecture: a study of iliac crest biopsies using histomorphometry and micro computed tomography. J Musculoskelet Neuronal Interact 2005;5:356–7. 32. Jerome CP, Burr DB, Van Bibber T, et al. Treatment with human parathyroid hormone (1-34) for 18 months increases cancellous bone volume and improves trabecular architecture in ovariectomized cynomolgus monkeys (Macaca fascicularis). Bone 2001;28:150–9. 33. Dempster DW, Cosman F, Kurland ES, et al. Effects of daily treatment with parathyroid hormone on bone microarchitecture and turnover in patients with osteoporosis: a paired biopsy study. J Bone Miner Res 2001;16:1846–53. 34. Zanchetta JR, Bogado CE, Ferretti JL, et al. Effects of teriparatide [recombinant human parathyroid hormone (1–34)] on cortical bone in postmenopausal women with osteoporosis. J Bone Miner Res 2003;18:539–43. 35. Uusi-Rasi K, Semanick LM, Zanchetta JR, et al. Effects of teriparatide [rhPTH (1–34)] treatment on structural geometry of the proximal femur in elderly osteoporotic women. Bone 2005;36:948–58. 36. Bouxsein ML. Determinants of skeletal fragility. Best Pract Res Clin Rheumatol 2005;19:897–911. 37. Lindsay R, Nieves J, Formica C, et al. Randomised controlled study of effect of parathyroid hormone on vertebral-bone mass and fracture incidence among postmenopausal women on oestrogen with osteoporosis. Lancet 1997;350:550–5. 38. Lane NE, Sanchez S, Modin GW, et al. Parathyroid hormone treatment can reverse corticosteroid-induced osteoporosis. Results of a randomized controlled clinical trial. J Clin Invest 1998;102:1627–33. 39. Kurland ES, Cosman F, McMahon DJ, et al. Parathyroid hormone as a therapy for idiopathic osteoporosis in men: effects on bone mineral density and bone markers. J Clin Endocrinol Metab 2000;85:3069–76. 40. Body JJ, Gaich GA, Scheele WH, et al. A randomized doubleblind trial to compare the efficacy of teriparatide [recombinant human parathyroid hormone (1–34)] with alendronate in postmenopausal women with osteoporosis. J Clin Endocrinol Metab 2002;87:4528–35. 41. Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res 2003;18:9–17. 42. Hodsman AB, Hanley DA, Ettinger MP, et al. Efficacy and safety of human parathyroid hormone-(1-84) in increasing bone mineral density in postmenopausal osteoporosis. J Clin Endocrinol Metab 2003;88:5212–20. 43. Black DM, Bilezikian JP, Ensrud KE, et al. One year of alendronate after one year of parathyroid hormone (1-84) for osteoporosis. N Engl J Med 2005;353:555–65. 44. Mc Clung MR, San Martin J, Miller PD, et al. Opposite bone remodeling effects of teriparatide and alendronate in increasing bone mass. Arch Intern Med 2005;165:1762-8. 45. Rubin MR, Bilezikian JP. Parathyroid hormone as an anabolic skeletal therapy. Drugs 2005;65:2481-98. 46. Fujita T, Inoue T, Morii H, et al. Effect of an intermittent weekly dose of human parathyroid hormone (1-34) on osteoporosis: a randomized double-masked prospective study using three dose levels. Osteoporos Int 1999;9:296-306. 47. Gallagher JC, Rosen CJ, Chen P, et al. Response rate of bone mineral density to teriparatide in postmenopausal women with osteoporosis. Bone 2006;39:1268–75. 48. Chen P, Satterwhite JH, Licata AA, et al. Early changes in biochemical markers of bone formation predict BMD response to teriparatide in postmenopausal women with osteoporosis. J Bone Miner Res 2005;20:962-70. Bakgrundsdokumentation Behandling av osteoporos 49. Eastell R, Krege JH, Chen P, et al. Development of an algorithm for using PINP to monitor treatment of patients with teriparatide. Curr Med Res Opin 2006;22:61–6. 50. Moen MD, Scott LJ. Recombinant full-length parathyroid hormone (1–84). Drugs 2006;66:2371–81. 51. Greenspan SL, Bone HG, Marriott TB, et al. Preventing the first vertebral fracture in postmenopausal women with low bone mass using PTH (1–84): Results from the TOP Study. J Bone Miner Res 2005;20:56. 52. Lane NE, Sanchez S, Modin GW, et al. Bone mass continues to increase at the hip after parathyroid hormone treatment is discontinued in glucocorticoid-induced osteoporosis: results of a randomized controlled clinical trial. J Bone Miner Res 2000;15:944–51. 53. Rehman Q, Lang TF, Arnaud CD, et al. Daily treatment with parathyroid hormone is associated with an increase in vertebral cross-sectional area in postmenopausal women with glucocorticoid-induced osteoporosis. Osteoporos Int 2003;14:77–81. 54. Cosman F, Nieves J, Woelfert L, et al. Parathyroid hormone added to established hormone therapy: effects on vertebral fracture and maintenance of bone mass after parathyroid hormone withdrawal. J Bone Miner Res 2001;16:925–31. 55. Ettinger B, San Martin J, Crans G, et al. Differential effects of teriparatide on BMD after treatment with raloxifene or alendronate. J Bone Miner Res 2004;19:745–51. 56. Finkelstein JS, Hayes A, Hunzelman JL, et al. The effects of parathyroid hormone, alendronate, or both in men with osteoporosis. N Engl J Med 2003;349:1216–26. 57. Cosman F, Nieves J, Zion M, et al. Daily and cyclic parathyroid hormone in women receiving alendronate. N Engl J Med 2005;353:566–75. 58. Finkelstein JS, Leder BZ, Burnett SA, et al. Effects of teriparatide, alendronate, or both on bone turnover in osteoporotic men. J Clin Endocrinol Metab 2006;91:2882–7. 59. Hodsman AB, Bauer DC, Dempster DW, et al. Parathyroid hormone and teriparatide for the treatment of osteoporosis: a review of the evidence and suggested guidelines for its use. Endocr Rev 2005;26:688–703. 60. Cranney A, Papaioannou A, Zytaruk N, et al. Parathyroid hormone for the treatment of osteoporosis: a systematic review. CMAJ 2006;175:52–9. 61. Delmas PD, Licata AA, Reginster JY, et al. Fracture risk reduction during treatment with teriparatide is independent of pretreatment bone turnover. Bone 2006;39:237–43. 62. Boonen S, Marin F, Mellstrom D, et al. Safety and efficacy of teriparatide in elderly women with established osteoporosis: bone anabolic therapy from a geriatric perspective. J Am Geriatr Soc 2006;54:782–9. 63. Prince R, Sipos A, Hossain A, et al. Sustained nonvertebral fragility fracture risk reduction after discontinuation of teriparatide treatment. J Bone Miner Res 2005;20:1507–13. 64. Miller PD, Shergy WJ, Body JJ, et al. Longterm reduction of back pain risk in women with osteoporosis treated with teriparatide compared with alendronate. J Rheumatol 2005;32:1556–62. 65. Nevitt MC, Chen P, Kiel DP, et al. Reduction in the risk of developing back pain persists at least 30 months after discontinuation of teriparatide treatment: a meta-analysis. Osteoporos Int 2006;17:1630–7. 66. Nevitt MC, Chen P, Dore RK, et al. Reduced risk of back pain following teriparatide treatment: a meta-analysis. Osteoporos Int 2006;17:273–80. 67. Brixen KT, Christensen PM, Ejersted C, et al. Teriparatide (biosynthetic human parathyroid hormone 1-34): a new paradigm in the treatment of osteoporosis. Basic Clin Pharmacol Toxicol 2004;94:260–70. 68. Deal C, Omizo M, Schwartz EN, et al. Combination teriparatide and raloxifene therapy for postmenopausal osteoporosis: results from a 6-month double-blind placebo-controlled trial. J Bone Miner Res 2005;20:1905–11. 69. Miller PD, Schwartz EN, Chen P, et al. Teriparatide in postmenopausal women with osteoporosis and mild or moderate renal impairment. Osteoporos Int 2007;18:59–68. 70. Vahle JL, Sato M, Long GG, et al. Skeletal changes in rats given daily subcutaneous injections of recombinant human parathyroid hormone (1–34) for 2 years and relevance to human safety. Toxicol Pathol 2002;30:312–21. 71. Vahle JL, Long GG, Sandusky G, et al. Bone neoplasms in F344 rats given teriparatide [rhPTH(1–34)] are dependent on duration of treatment and dose. Toxicol Pathol 2004;32:426–38. 72. Gold DT, Pantos BS, Masica DN, et al. Initial experience with teriparatide in the United States. Curr Med Res Opin 2006;22:703–8. 73. Kurland ES, Heller SL, Diamond B, et al. The importance of bisphosphonate therapy in maintaining bone mass in men after therapy with teriparatide [human parathyroid hormone(134)]. Osteoporos Int 2004;15:992–7. Information från Läkemedelsverket 4:2007 55 Bakgrundsdokumentation Behandling av osteoporos Strontiumranelat (Protelos) til behandling af postmenopausal osteoporose Bente L Langdahl Strontium er et alkalisk jordmetal, som er placeret i gruppe 2 i det periodiske system sammen med blandt andet calcium. Strontium’s atomvægt er ca. den dobbelte af calcium’s og ionradius er også større: 1,13 Å mod 0,99 Å ved calcium. Ioniseret strontium: Sr2+ absorberes fra tyndtarmen efter samme principper som ioniseret calcium. I duodenum og jejunum foregår en aktiv transport via calcium og strontium bindende proteiner i mucosacellerne. Denne transport stimuleres af vitamin D. I ileum optages både calcium og strontium via en passiv diffusion. Diffusionen er afhængig af koncentrationsgradienten mellem tarmlumen og serum. Absorptionen af strontium reduceres hvis indtaget af calcium er højt (1). Strontium elimineres primært renalt, men også med fæces. Den renale clearence af strontium er højere end clearence af calcium på grund af at strontium ikke reabsorberes i proximale tubuli i samme omfang som calcium (2). Protelos er strontiumranelat, som består af 2 strontium ioner koblet til ranilinsyre. Strontium udgør 34,1 % af strontiumranelat. Biotilgængeligheden er 25 % og ved indtagelse af 2 gram strontiumranelat dagligt opnås en steadystate plasma koncentration på 0,13 mM. Ranilinsyre optages også og udskilles uomdannet renalt. Dyreforsøg med natriumranelat viste at ranilinsyre ikke har nogen selvstændig effekt på knoglevævet (2). Virkningsmekanisme Strontium er knoglesøgende og indbygges primært i nydannet knoglevæv, men også i mindre grad i ældre knogle. Mængden af strontium, der indbygges er proportionalt med plasma koncentrationen. Strontium indbygges i knoglevævets mineralsubstans ved adsorption til overfladen, ved ombytning med ioner i krystaloverfladen og ved ion substitution med calcium i hydroxyapatit krystallerne (3,4). Strontium cleares igen fra knoglevævet via 3 forskellige mekanismer: hurtig udskiftelig pool af strontium i knoglevævet (T½ = 41 dage), udskiftning af strontium bundet 56 Information från Läkemedelsverket 4:2007 i hydroxyapatit krystaller med calcium og endelig frigives strontium i forbindelse med knogleresorption af knoglevæv indeholdende strontium (T½ = 3 år) (5). I in vitro-studier af både humane og dyre osteo­ blaster og preosteoblaster er det vist at strontium både øger proliferation af osteoblasterne, men samtidig deres produktion af kollagen. In vitro-studier af humane og dyre osteoklaster har vist at strontium ikke hæmmer rekruttering af osteo­ klasterne, men hæmmer differentiering og dannelse af ruffled border og dermed den resorptive aktivitet af osteoklasterne. Der er to fremherskende teorier om hvorledes strontium virker på molekylært niveau. Den første teori er at strontium udøver sin effekt via calciumsensing receptor (CaSR) på osteoblasterne. Den anden teori er at strontium udøver sin effekt via OPGRANK-RANKL systemet. Der er påvist CaSR i osteoblaster, præosteoblaster og i præosteoklaster, men ikke i modne osteoklaster (6,7). In vitro-studier tyder på at koncentationen af strontium skal være betydelig højere end hvad der ses i plasma ved behandling med strontiumranelat 2 gram dagligt for at få en aktivering af CaSR, imidlertid kendes koncentrationen af strontium lokalt i knoglevævet ikke og den kan være højere end plasma koncentrationen på grund af strontiums knoglesøgende effekt. Andre in vitro-studier har imidlertid vist at både osteoblastlignende celler med og uden CaSR responderer på stimulation med både calcium og strontium, således at der også er tale om CaSR uafhængige mekanismer (8). In vitro-forsøg har vist at stimulation af osteoblaster med strontium medfører signifikant øget ekspression af OPG på mRNA niveau. OPG kan via hæmning af interaktionen mellem RANK og RANKL hindre dannelse og aktivitet af osteoklaster og dermed hæmme resorptionen (9). I rotter hæmmer strontium knogleresorption og stimulerer knogleformation. Dette medfører en øget mængde trabekulær knogle, øget knoglemineraltæthed og øget knoglestyrke. Tilsvarende virkninger er set hos aber, og hos ovariectomerede og immobiliserede dyr (2). Effekten af strontium på mineralisering er hovedsagelig undersøgt i et stort studie med behandling af aber (3). Som tidligere nævnt indbygges strontium ion i hydroxyapatit krystaller på calcium ionernes plads i forholdet 1:1, dog ses selv ved behandling med meget høje doser strontium ikke udskiftning af mere end hver 10. calcium ion med strontium ion. Man fandt i samme studie at indbygningen af strontium er 1,5–2,5 gange højere i nydannet knoglevæv Bakgrundsdokumentation Behandling av osteoporos end i gammelt knoglevæv. Efter et års behandling af aber med forskellige doser af strontium observeredes at indbygning og adhesion af strontium i knoglevævet er en reversibel proces, idet 40–50 % af strontium i knoglevævet forsvandt igen i løbet af 10 ugers behandlingspause. Selve mineraliserings processen og graden af mineralisering i knoglevævet var uafhængig af strontium behandlingen. Indbygning af strontium i knoglevævet påvirker DXA undersøgelse af knoglemineralindholdet (BMD). Udfra knoglebiopsier i både humane og dyre studier estimeres at 50–70 % af de målte værdier skyldes det indbyggede strontium, mens resten kan tilskrives effekten af strontium på knoglevævet (10,11) knogleformation) og et fald i CTX (serum markør for knogleresorption). Strontiumranelat reducerede risikoen for nye vertebrale frakturer med 49 % og 41 % efter henholdsvis ett og tre års behandling (p < 0,001). Behandling med strontiumranelat medførte en stigning i BMD på henholdsvis 12,7 % i columna (p < 0,001) og 8,6 % i femoral neck (p < 0,001) i forhold til baseline svarende til en forskel på henholdsvis 14,4 % i columna og 9,8 % i femoral neck i forhold til placebo (p < 0,001). Disse stigninger skyldes som tidligere beskrevet delvis indbygningen af strontium i knoglevævet. I dette studie forsøgtes korrektion for strontium indholdet udfra data fra knoglebiopsier. Den korrigerede stigning i BMD i columna i den strontium behandlede gruppe var 6,8 % i forhold til et fald i BMD i den placebobehandlede gruppe på 1,3 % (p < 0,001). Knoglebiopsier viste at behandling med strontiumranelat ikke forårsagede osteomalaci eller andre mineraliseringsdefekter. Materialet er desværre for sparsomt til at der kan gennemføres regelret histomorfometrisk vurdering de eventuelle effekter af strontiumranelat på knogleformation. TROPOS-studiet havde som formål at undersøge effekten af strontiumranelat på non-vertebrale frakturer (13). Der inkluderedes 5 091 postmenopausale kvinder (femoral neck BMD T-score < – 2,5 og ≥ 74 år eller 70–74 år og mindst én klinisk risiko faktor for fraktur). Kvinderne var i gennemsnit 76,7 år, altså godt 7 år ældre end kvinderne i SOTI-studiet. Kvinderne blev randomiseret til placebo eller stontium ranelat 2 g dagligt i fem år. Alle kvinder fik desuden calcium og vitamin D. Cirka 65 % af kvinderne i det to grupper gennemførte de første tre år af studiet. Efter tre års behandling med strontiumranelat fandtes en stigning i hofte BMD på 5,7 % i den behandlede gruppe i forhold til baseline (p < 0,001), dette svarer til en forskel på 8,2 % i forhold til de placebo behandlede kvinder. Efter tre år fandtes en reduktion af non-vertebrale frakturer på 16 % (p < 0,001) i den strontiumranelat behandlede gruppe i forhold til de placebo behandlede kvinder. I den samlede studiepopulation var der ingen signifikant forskel på forekomst af hoftefraktur. I planlægningen af studiet havde man på forhånd besluttet også at undersøge forekomsten af non-vertebrale frakturer herunder specielt hoftefrakturer i en subgruppe af kvinder med højere risiko for frakturer end hele studiepopulationen, nemlig kvinder ældre end 74 år og med hofte BMD T-score mindre end – 3. I denne gruppe fandtes 39 % reduktion i forekomsten af hoftefraktur i forhold til placebogruppen (p < 0,05). I en anden subgruppe i dette studie havde kvinderne fået foretaget røntgen af columna thoracolumbalis ved inklusion og igen efter tre år. I denne gruppe fandtes 39 % reduktion i forekomsten af vertebrale frakturer i den strontiumranelat behandlede Strontiumranelat behandling af postmenopausal osteoporose De 4 kliniske studier af effekten af strontiumranelat på postmenopausal osteoporose er summeret i Tabel I. Meunier, et al. rapporterede i 2002 fra det største af de to studier, der gennemførtes for at finde den optimale dosis af stontiumranelat til behandling af postmenopausal osteoporose (10,12). I STRATOS inkluderes 353 kvinder med postmenopausal osteoporose (minimum 1 vertebral fraktur og BMD lumbar spine T-score ≤ 2,4). Kvinderne randomiseredes til henholdsvis placebo, 0,5 g, 1 g og 2 g strontiumranelat dagligt i 2 år. Cirka 77 % af kvinderne i de 4 grupper gennemførte studiet. Ved vurdering af ændringen i BMD efter behandling, korrigeredes for knoglevævets indhold af strontium bedømt ud fra knoglebiopsier. Efter denne korrektion fandtes at BMD kun steg efter behandling med 2 g strontiumranelat dagligt. Efter ett års behandling fandtes ingen effekt på forekomsten af vertebrale frakturer, men efter 2 års behandling observeredes en reduktion på 49 % og 44 % (p < 0,01) i forhold til placebogruppen for kvinder behandlet med henholdsvis 0,5 g og 2 g strontiumranelat dagligt. Man valgte på baggrund af resultaterne på BMD og frakturreduktion at fortsætte i fase 3 med en dosis på 2 g dagligt. Der er gennenført 2 fase 3 studier: SOTI og TROPOS. SOTI havde som formål at undersøge effekten af strontiumranelat på vertebrale frakturer (11). Der inkluderedes 1 649 postmenopausale kvinder (≥ 50 år, ≥ 5 år efter menopause, minimum 1 vertebral fraktur og lumbar spine BMD T-score ≤ – 2,4). Kvindernes gennemsnitlige alder var 69,3 år. Kvinderne blev randomiseret til enten placebo eller strontiumranelat 2 g dagligt i tre år. Alle kvinder fik et dagligt tilskud af op til 1 000 mg calcium og 400–800 IE vitamin D. Cirka 76 % af kvinderne i begge grupper gennemførte studiet. I den strontium behandlede men også i den placebo behandlede gruppe sås initialt en stigning i knoglespecifik alkalisk fosfatase (serum markør for Information från Läkemedelsverket 4:2007 57 Bakgrundsdokumentation 39 % gruppe i forhold til den placebo behandlede gruppe (p < 0,001). I endnu en forud planlagt analyse af resultaterne af SOTI og TROPOS fandtes blandt 1 488 kvinder mellem 80 og 100 år at risikoen for vertebral, nonvertebral og klinisk frakturer blev reduceret med henholdsvis 32 %, 31 % og 22 % hos kvinder behandlet med strontiumranelat i tre år i forhold til placebo behandlede kvinder (p < 0,05) (14). Bivirkninger Stontiumranelat tåles generelt godt. De fleste bivirkninger er milde og forbigående (Faktabox 1). I de kliniske studier fandtes kvalme (7,2 % versus 4,4 %), diaré (6,7 % versus 5,0 % i TROPOS og 6,1 % versus 3,6 % i SOTI), hovedpine (3,4 % versus 2,4 %), dermatitis og eksem (5,1 % versus 4,1 %) hyppigere hos kvinder i behandling med strontiumranelat end hos kvinder, der modtog placebo. Forskellen i hyppighed af disse bivirkninger var dog kun tilstede i de første tre måneder af studierne. 500–1000 Faktabox 1. Bivirkninger. Bivirkninger, der forekommer hos 1–10 % • Kvalme • Diaré • Hovedpine • Hukommelsesbesvær • Sedering • Eksem • Forhøjet kreatininkinase Bivirkninger, der forekommer hos 0,1–1 % • Dyb venetrombose • Kramper Konklusion : højeste dosis. : p < 0,001 58 Information från Läkemedelsverket 4:2007 *** # 5 091/3 320 TROPOS (13) 77 0 og 2 FN + 5,7*** 3 (5) 400–800 41 % 500–1000 0 og 2 1 649/1 260 SOTI (11) 69 500 353/272 STRATOS (10) 66 0; 0,5; 1 og 2 LS + 14,4*** 3 (5) 400–800 44 % LS + ca. 14*** 2 800 Ingen data LS + 5,5*** 2 500 160/128 PREVOS (12) 54 0; 0,125; 0,5 og 1 0 Ændring i BMD# (procent) Varighed (år) Vit. D (IE/dag) Calcium (mg/dag) Dosis (g/dag) Alder (år) Antal kvinder (inkl/gennemført) Studie Tabel I. Randomiserede, placebokontrollerede studier af effekten af strontiumranelat på BMD og fraktur hos postmenopausale kvinder. Reduktion i forekomst af vertebrale frak­ turer Behandling av osteoporos Stontium er det knogleaktive stof i strontiumranelat. Strontium har både i dyre- og humane studier vist at kunne hæmme osteoklaster og knogleresorption. I dyrestudier er strontium også vist at kunne stimulere osteoblaster, dette er dog ikke med sikkerhed vist i humane studier. Indtil videre kan strontium ranelat derfor bedst rubriceres som en antiresorptiv behandling af osteoporose i lighed med østrogen, SERM og bisfosfonater. Strontiumranelat er veldokumenteret til behandling af postmenopausal osteoporose. Der er solide data på forebyggelse af vertebrale frakturer (cirka 40 % reduktion) allerede efter ett år og vedvarende i de følgende 2 år – også hos meget gamle kvinder. Der er desuden evidens for reduktion af non-vertebrale frakturer (16 % reduktion) og reduktion af hoftefrakturer i en subgruppe med høj risiko for fraktur. Der er ingen data vedrørende behandling af mænd med osteoporose, glucocorticoid-induceret osteoporose hos hverken kvinder eller mænd eller som behandling efter PTH (1–34) eller PTH (1–84). Bakgrundsdokumentation Behandling av osteoporos Strontiumranelat kan have oftest lette og forbigående bivirkninger i opstartsfasen af behandlingen. Den samlede dokumentation for effekt af strontiumranelat er fortsat mindre end for bisfosfonaterne, men strontiumranelat kunne være et alternativ hos patienter med øvre dyspepsi eller som af andre grunde har svært ved at overholde forholdsreglerne ved indtagelse af bisfosfonater. Behandlingsvarigheden er fortsat uafklaret. Referenser duction of calcium-sensing receptors in cartilage and bone. Endocrinology 1999;140:5883–93. 8. Pi M, Quarles LD. A novel cation-sensing mechanism in osteoblasts is a molecular target for strontium. J Bone Miner Res 2004;19:862–9. 9. Brennan T, Rybchyn MS, Conigrave AD, et al. Strontium Ranelate Effect on Proliferation and OPG Expression in Osteoblasts. Calcif Tissue Res 2006. 10. Meunier PJ, Slosman DO, Delmas PD, et al. Strontium ranelate: dose-dependent effects in established postmenopausal vertebral osteoporosis--a 2-year randomized placebo controlled trial. J Clin Endocrinol Metab 2002;87(5):2060–6. 11. Meunier PJ, Roux C, Seeman E, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004;350:459–68. 12. Reginster JY, Deroisy R, Dougados M, et al. Prevention of early postmenopausal bone loss by strontium ranelate: the randomized, two-year, double-masked, dose-ranging, placebo-controlled PREVOS trial. Osteoporos Int 2002;13:925–31. 13. Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005;90:2816–22. 14. Seeman E, Vellas B, Benhamou C, et al. Strontium ranelate reduces the risk of vertebral and nonvertebral fractures in women eighty years of age and older. J Bone Miner Res 2006;21:1113–20. 1. Apostoaei AI. Absorption of strontium from the gastrointestinal tract into plasma in healthy human adults. Health Phys 2002;83:56–65. 2. Reginster JY, Deroisy R, Jupsin I. Strontium ranelate: a new paradigm in the treatment of osteoporosis. Drugs Today (Barc ) 2003;39:89–101. 3. Farlay D, Boivin G, Panczer G, et al. Long-term strontium ranelate administration in monkeys preserves characteristics of bone mineral crystals and degree of mineralization of bone. J Bone Miner Res 2005;20:1569–78. 4. Boivin G, Meunier PJ. The mineralization of bone tissue: a forgotten dimension in osteoporosis research. Osteoporos Int 2003;14(Suppl 3):19–24. 5. Dahl SG, Allain P, Marie PJ, et al. Incorporation and distribution of strontium in bone. Bone 2001;28:446–53. 6. Kanatani M, Sugimoto T, Kanzawa M, et al. High extracellular calcium inhibits osteoclast-like cell formation by directly acting on the calcium-sensing receptor existing in osteoclast precursor cells. Biochem Biophys Res Commun 1999;261:144–8. 7. Chang W, Tu C, Chen TH, et al. Expression and signal trans- Information från Läkemedelsverket 4:2007 59 Biverkningsnytt Biverkningsnytt Rapporter om leverpåverkan av viktminskningspreparatet CUUR Läkemedelsverket har tagit emot sex rapporter om kraftig leverpåverkan hos patienter som använt vikt­ minskningspreparatet CUUR. I fem fall tillfrisknade patienterna sedan CUUR-intaget avslutats. I det sjätte fallet har levervärdena sjunkit från maxvärden. Läkemedelsverket bedömer att det föreligger tro­ ligt eller möjligt samband mellan CUUR och de rapporterade leverbiverkningarna. CUUR är ett preparat mot övervikt som marknadsförs som ett kosttillskott av Medtech Pharma AB, som ingår i Hela Pharma AB. CUUR innehåller extrakt av grönt te, björkblad, Yerba maté och Coleus forskohlii. Kliniska effektstudier har genomförts, men Läkemedelsverket har inte bedömt resultaten. Rapporter om leverbiverkningar Läkemedelsverket har fått sex rapporter om kraftig leverpåverkan hos patienter som tagit CUUR mot övervikt. I fem av sex fall har levervärdena normaliserats sedan CUUR-intaget avslutats. I det senast rapporterade fallet har information om normalisering inte inkommit, men levervärdena har sjunkit från maximal nivå. I tre av fallen är Läkemedelsverkets bedömning att troligt samband med intag av CUUR föreligger, i övriga tre fall möjligt samband. Det är inte klarlagt vilket innehållsämne i CUUR som kan ha orsakat leverbiverkningarna. Läkemedelsverket vill uppmärksamma allmänheten och sjukvården på de hittills kända fallen av leverpåverkan i samband med intag av CUUR. Om ytterligare fall kommer till sjukvårdens kännedom uppmanas till rapportering till Regionala Biverkningscentra. Fallrapporter Fall 1 56-årig gallopererad kvinna med frivillig viktnedgång 30 kg det senaste året. Behandlad med Voltaren och Losec av och till på grund av buksmärtor. Under cirka tre månader intagit CUUR. Sedan tre veckor ledbesvär. Gastroskoperad på grund av positivt feces-Hb utan fynd av malignitet. Inför deltagande i läkemedelsstudie upptäcktes patienten ha förhöjda levervärden med max ASAT 8,6, ALAT 31, GT 6,8, LD 6,1, ALP 8,4. Ultraljud visade ingen gallstas, levern bedömdes vara steatotisk. Hepatitserologi (A, B, C) negativ. CMV, EBV positiv IgG. Inga tecken till autoimmunt inslag i sjukdomsbilden. Diagnos hepatocellulär reaktion. Levervärdena var normala två månader efter avbrutet CUUR-intag. Fall 2 64-årig kvinna med hjärtinfarkt i början av 1990-talet, därefter behandlad med simvastatin, Seloken, Cozaar Comp Forte (som sattes ut under leverreaktionen), Trombyl och Atarax, sporadiskt intag av Pronaxen. Efter cirka 2,5 månaders intag av CUUR fick patienten illamående och ikterus. Vid kontroll förhöjda leverfunktionsprover med maxvärden för ASAT 33, ALAT 57, bilirubin 493, GT 16, LD 17,9, ALP 8. Hepatitserologi anti-HAV negativ. Diagnos hepatocellulär reaktion. Glukokortikoidbehandling gavs på initial misstanke om inslag av autoimmun hepatit, dock inga hållpunkter för detta i efterhand. Utläkning skedde inom sex veckor sedan patienten slutat med CUUR. Fall 3 35-årig tidigare frisk kvinna som tagit CUUR fram till tre dagar innan insjuknande med smärtor i övre delen av buken och mörk urin. Patienten hade ikterus. Ultraljud visade sekundära gallblåseförändringar. Vid provtagning förhöjda leverfunktionsprover med maxvärden för ASAT 47, ALAT 68, bilirubin 643, GT 4,7, LD 13, ALP 2,4. Hepatitserologi (A, B, C) negativ. Diagnos hepatocellulär reaktion. Leverproverna hade normaliserats vid kontroll två månader efter det att patienten hade slutat med CUUR. Fall 4 60-årig kvinna med enalaprilbehandlad hypertoni. Hon intog CUUR under två månader, hade också ätit Ledizym (enzympreparat) under okänd tid. Patienten blev inremitterad till sjukhus på grund av ikterus. Två veckor dessförinnan hade hon blivit trött och lätt illamående samt haft huvudvärk. Konstaterades ha leverpåverkan med ASAT 37, ALAT 55, bilirubin 161, GT 10, LD 9,3. Hepatitserologi (A, B, C) negativ, serologi för cytomegalvirus och EBV visade på tidigare genomgången infektion. Diagnos hepatocellulär reaktion. Medicinering inklusive CUUR och Enalapril sattes ut. Efter två månaders behandling med Prednisolon och Omeprazol hade patienten normaliserade levervärden. 60 Information från Läkemedelsverket 4:2007 Biverkningsnytt Fall 5 50-årig kvinna som behandlas med Mestinon på grund av myasthenia gravis. Hon tog CUUR i bantningssyfte under nio dagar. Under denna tid tillkom förhöjda levervärden med max ALAT 13,6, ASAT 3, ALP 4,3, bilirubin 11. Inga uppgifter om virusserologi. Diagnos hepatocellulär reaktion. Normalisering av levervärdena konstaterades två veckor efter utsättande av CUUR. Fall 6 27-årig kvinna som tog CUUR under tre månader. Patienten inkom till sjukhus ikterisk. Hon hade haft mörk urin tre veckor, var trött och hade klåda sedan en vecka tillbaka. Patienten hade månaden innan inkomsten intagit tablett Eeze (diklofenak) vid två tillfällen. Provtagning visade förhöjda leverfunktionsprover med maxvärden för ASAT 16,4, ALAT 20,7, bilirubin 206, ALP 2,8. Hepatitserologi negativ. Inga tecken till autoimmun genes. Ultraljud lever var utan anmärkning. Vid tidpunkten för rapportering hade patienten sjunkande levervärden efter insatt glukokortikoidbehandling och efter att ha slutat med CUUR. Reductil ska inte användas vid graviditet Bantningsmedlet Reductil ska inte användas av gravida kvinnor. Kvinnor i fruktsam ålder bör skydda sig mot graviditet så länge de tar Reductil. missbildning, vilket är lite mer än dubbelt så många som förväntat. Antalet kvinnor som använt Reductil är dock alldeles för litet för att det ska gå att fastställa om det finns ett samband mellan läkemedlet och missbildning. Fyndet kan vara rent slumpmässigt. Forskning har visat att Reductil kan orsaka fosterskador i djurförsök. Det finns dock nästan ingen kunskap om hur läkemedlet påverkar mänskliga foster. Bantningsmedlet Reductil innehåller den aktiva substansen sibutramin. Läkemedelsverket vill påminna om att gravida kvinnor inte ska använda Reductil. Kvinnor i fruktsam ålder bör också vara noga med att skydda sig mot graviditet under pågående behandling med Reductil. Till det Medicinska Födelseregistret rapporteras bland annat uppgifter om kvinnors läkemedelsanvändning under graviditet. Enligt registret har 90 kvinnor uppgivit att de använt Reductil i början av graviditeten. Av dessa 90 kvinnor föddes nio barn med en Likartad risk för blodpropp med alla kombinerade p-piller I början av juni diskuterades i massmedia risken för att få blodpropp vid behandling med Yasmin efter biverkningsrapporter i Danmark. Två stora studier i flera länder i Europa respektive i USA visar att risken vid Yasminbehandling är i samma storleksordning som vid användning av andra kombinerade p-piller. Yasmin, som innehåller 30 mikrogram etinylestradiol och 3 mg drospirenon, har funnits på marknaden sedan år 2000. Drospirenon är ett gestagent hormon, som var nytt vid tiden för godkännandet. Läkemedelsmyndigheterna i Europa ställde därför krav på att tillverkaren skulle följa upp säkerheten med särskilt fokus på risken för blodpropp. En stor kontrollerad studie, European Active Surveillance Study (EURAS), genomfördes och har nyligen granskats av de europeiska läkemedelsmyndigheterna. Därutöver har ytterligare en stor studie genomförts i USA. Båda studierna är avslutade och värderade. Båda studierna visar samstämmigt att risken att drabbas av blodpropp för en kvinna som behandlas med Yasmin är jämförbar med risken vid behandling med andra kombinerade p-piller. Av kvinnor som inte har några riskfaktorer för blodpropp (till exempel ärftlighet, kraftig övervikt, diabetes, högt blodtryck) och som använder p-piller med lågt östrogeninnehåll (mindre än 50 mikrogram etinylestradiol) drabbas mellan 20 och 40 kvinnor/100 000 kvinnoår av blodpropp. Detta skall jämföras med 5–10 fall av blodpropp per 100 000 kvinnoår hos kvinnor som inte använder p-piller. Risken för att få blodpropp med Yasmin är ungefär lika stor som vid användning av andra kombinerade ppiller. Sammanfattningsvis ger inte de nya biverkningsrapporterna anledning att ändra rekommendationerna efter uppgifter om biverkningar för kvinnor som använder p-pillret Yasmin. Information från Läkemedelsverket 4:2007 61 Biverkningsnytt Hyperkalemi av glukosaminpreparat Några glukosaminprodukter (till exempel Comfora, Glukosamin Copyfarm) innehåller kalium. Risken för hyperkalemi bör beaktas av patienter med nedsatt njurfunktion vid samtidig behandling med andra läkemedel som ger risk för hyperkalemi (till exempel ACE-hämmare eller angiotensin-II-receptoranta­ gonister) eller av patienter som har ordinerats kaliumfattig kost. Läkemedelsverket vill uppmana sjuk­ vården att rapportera alla misstänkta biverkningar av glukosaminprodukter. Comfora, Glukosamin Copyfarm, Glukosamin Pharma Nord och Samicop är godkända läkemedel som innehåller glukosamin för symtomlindring vid lätt till måttlig knäartros. I dessa produkter ingår glukosamin i form av glukosaminsulfat-kaliumklorid. Comfora innehåller motsvarande 595 mg glukosamin och 130 mg kalium per tablett. I den godkända produktinformationen anges att ”Comfora innehåller 3,3 mmol (130 mg) kalium per tablett”. Vid rekommenderad dosering 1 × 2 får man således i sig 6,6 mmol kalium per dag (att jämföra med en tablett kaliumklorid 750 mg, som motsvarar 10 mmol kalium). Detta bör beaktas av patienter med reducerad njurfunktion eller av patienter som har ordinerats kaliumfattig kost. Av de övriga glukosaminpreparaten som är godkända i Sverige innehåller Glukosamin Pharma Nord, Samicop, Glukosamin Copyfarm också kalium (observera dock att alla inte är marknadsförda). Kaliummängden per tablett är mindre i dessa glukosaminsulfat-kaliumklorid-produkter (2,2 mmol = 87 mg kalium), men den dagligen intagna mängden av kalium blir densamma som med Comfora eftersom dessa doseras 1 × 3. Flera glukosaminpreparat som är godkända i Sverige innehåller inte kalium, till exempel glukosaminhydrokloridprodukter (Artrox, Aussiamin, Glucomed, Glufan, Novamin, OsteoEze) och glukosaminsulfat-natriumkloridkomplex produkter (Donacom, Glucosine). Patienter med ökad risk för hyperkalemi Många patienter som har artros är äldre och har reducerad njurfunktion. Många står även på ACE-hämmare eller angiotensin-II-receptorantagonister, vilket ytterligare kan öka risken för hyperkalemi. Exempel på andra läkemedel som kan ge upphov till hyperka- 62 Information från Läkemedelsverket 4:2007 lemi är kaliumsparande diuretika och NSAID. Risken för hyperkalemi ökar i kombination med andra riskfaktorer (till exempel dehydrering). Vid godkännandet av Comfora har inga interaktionsstudier utförts. I produktinformationen rekommenderas försiktighet om glukosamin kombineras med andra läkemedel, eftersom interaktionsdata saknas. En fallrapport Ett misstänkt fall av hyperkalemi i samband med Comfora har nyligen identifierats. En 96-årig kvinna behandlades med Atacand 4 mg 1 × 1 och Furix Retard 30 mg 1 × 1 för hjärtsvikt. Hon fick Comfora 595 mg 1 × 2 på grund av knäartros. Fyra veckor efter det att hon börjat med Comfora hade kaliumnivån stigit från 4,6 till 5,4 mmol/L och efter sex veckor till 5,9 mmol/L. Comfora sattes ut och hon fick istället Glucosine 400 mg 1 × 2. En vecka senare hade kaliumvärdet gått ned till 5,2 mmol/L och efter två veckor låg det på 4,7 mmol/L. Under hela perioden låg kreatinin stabilt på 82–86 mmol/L. Detta är det första misstänkta fallet av hyperkalemi i samband med glukosaminprodukter som innehåller kalium. Läkemedelsverket vill uppmana sjukvården att vara uppmärksam och rapportera alla misstänkta biverkningar av glukosaminprodukter via de regionala biverkningsenheterna. Om kalium Kalium är ett grundämne som behövs för kroppens funktioner. Rekommenderat dagligt intag är från cirka 3 g (76 mmol) för kvinnor och upp till 3,5 g (89 mmol) för män. Kaliumöverskott kan leda till hyperkalemi (s-kalium > 5,6 mmol/L) på grund av ökad tillförsel (till exempel via kost, kaliumsalt, blodtransfusion, hemolys, GI-blödning) och minskad utsöndring (till exempel vid nedsatt njurfunktion). Biverkningsnytt Dextropropoxifen – uppföljande rapport över säkerheten 2000–2006 Antalet dödsfall till följd av förgiftningar med dextropropoxifen har minskat med tre fjärdedelar under åren 2000–2006. Giftinformationscentralen får färre förfrågningar relaterade till läkemedlet och för­ säljningen av dextropropoxifenpreparat har minskat med två tredjedelar under samma period. Samman­ fattningsvis anser Läkemedelsverket att åtgärderna som vidtagits de senaste åren för att stävja problem med överdosering och missbruk av dextropropoxifen har varit framgångsrika. Bakgrund tioårsperiod. Olycksfallen är få och suicidfallen utgör under alla år mer än hälften av samtliga fall; 2006 var andelen så hög som 68 %. Den trappstegsformade nedgång av antalet dödsfall som syns i Figur 1 skulle kunna förstås som effekten av de vidtagna åtgärderna. Den särskilda receptblankettens införande 2001 ledde till en kraftig minskning, ytterligare varningar och information åren 2003–2005 och kombinationspreparatens försvinnande 2006 hade samma effekt. Fynd av dextropropoxifen i rättsmedicinska obduktioner, alltså fall där substansen påvisats i allt ifrån terapeutiska till letala doser, visar en liknande nedgång under samma period. År 2000 noterades 330 fall, vilket förra året hade reducerats till 93. De ovan beskrivna fallen utgör alltså en delmängd av dessa. 2. Giftinformationscentralen – förfrågningar angående dextropropoxifen Det totala antalet förfrågningar, som kan gälla allt från en smärre feldosering till letal intoxikation, framgår av Figur 2. Även här noteras en minskning under 2000-talet. Nedgången, en knapp halvering under perioden 2000–2006 är mindre markant än för det rättsmedicinska materialet. Minskningen beror nästan helt på att antalet frågor relaterade till kombinationspreparaten, som ju alltså avregistrerades 2004–2005, har minskat. Trots detta var dessa preparat källan till en förfrågan i mer än vart femte fall 2006. Den enskilt vanligaste orsaken till en förfrågan är relaterad till ett suicidförsök; dessa utgör nästan två tredjedelar av samtliga frågor rörande dextropropoxifen. Även innevarande år har man haft ett antal förfrågningar om kombinationspreparaten. Uppenbarligen finns det fortfarande en hel del av dessa läkemedel kvar i hemmen. 3. Försäljningsstatistik Försäljningsutvecklingen under åren 2000–2006 för läkemedel innehållande dextropropoxifen framgår av Figur 3. Kombinationspreparaten Paraflex comp, Distalgesic och Doleron presenteras tillsammans och enkelpreparaten Dexofen och Doloxene tillsammans. Bland kombinationspreparaten var Distalgesic den dominerande produkten – bland enkelpreparaten hade och har Dexofen den ställningen. År 2000 omfattade försäljningen av samtliga preparat innehållande dextropropoxifen omkring 24 000 DDDM (antalet definierade dygnsdoser under tolvmånadersperioden). Av detta utgjorde ungefär två tredjedelar Dextropropoxifen (DXP) har sedan länge varit ett ifrågasatt analgetikum och 1999 manade Läkemedelsverket till stor försiktighet vid förskrivning (1). Anledningen var bland annat risk för allvarliga symtom vid överdosering, speciellt i kombination med alkohol, liksom det stora antalet dödsfall som relaterades till intag av DXP. De informationsinsatser som initierades hade en tydlig positiv effekt vad avser bland annat förekomst av förgiftningsfall. Sedan 2001 måste läkemedel som innehåller DXP – i likhet med andra narkotiska läkemedel – förskrivas på en särskild receptblankett. Ytterligare åtgärder bedömdes dock som nödvändiga för att förbättra säkerheten. Dessa innefattade bland annat upprepad information om restriktiv förskrivning och att riskfaktorer som missbruk eller anamnes på depression måste beaktas (2,3). Under hösten 2005 avregistrerades de kvarvarande kombinationspreparaten Paraflex comp och Distalgesic, då de bedömts som icke ändamålsenliga; ett år tidigare hade Doleron avregistrerats. Kvar på den svenska marknaden sedan dess är de rena DXPpreparaten Doloxene och Dexofen, eftersom dessa fortfarande bedömts ha en plats vid behandling av medelsvår till svår smärta hos vissa noggrant utvalda patienter (4). Syfte Syftet med denna rapport är att följa upp säkerheten för DXP-preparat genom att studera utvecklingen av förgiftningsfall och dödsfall relaterade till DXP under åren 2000–2006. Resultat 1. Dödsfall – dextropropoxifen i rättsmedicinskt material År 2000 registrerades 205 förgiftningsdödsfall med fynd av DXP – en årlig incidens som hade varit relativt konstant under slutet av 90-talet. Som framgår av Figur 1 sjönk antalet fall förhållandevis snabbt åren därpå och från år 2003 varierade antalet mellan 80 och 86 per år. Förra året, 2006, noterades 56 dödsfall, det lägsta antalet hittills (omkring en fjärdedel jämfört med slutet av 90-talet). Rättsmedicin klassificerar dödsfallen antingen som suicid, oklara fall, eller olycksfall. Fördelningen mellan dessa kategorier förändrades inte på något markant sätt under denna Information från Läkemedelsverket 4:2007 63 Biverkningsnytt kombinationspreparat och en tredjedel enkelpreparat. År 2006 såldes drygt 8 600 DDDM – allt i form av enkelpreparat naturligtvis. Försäljningen verkar ha stabiliserat sig på den nivån även om en lätt uppgång för enkelpreparaten kan noteras efter kombinationspreparatens försvinnande. Sammanfattning Förra året, 2006, var försäljningen av läkemedel innehållande dextropropoxifen enbart en tredjedel av försäljningen år 2000. På samma sätt hade dödsfall relaterade till DXP i det rättsmedicinska materialet minskat till en fjärdedel och förfrågningarna till Giftinformationscentralen halverats. Sammanfattningsvis Figur 1. Dödsfall – DXP i rättsmedicinskt material. 64 Information från Läkemedelsverket 4:2007 måste de åtgärder som vidtagits de senaste åren för att stävja problem med överdosering och missbruk anses ha varit framgångsrika. Frågan om det finns andra preparat som intagit DXP:s plats som ”problembarn” behöver emellertid belysas ytterligare. Referenser 1. Dextropropoxifen – ett komplicerat läkemedel. www.lakemedelsverket.se/dextropropoxifen 14 december 1999. 2. Dextropropoxifeninnehållande produkter – Läkemedelsverkets värdering av den medicinska ändamålsenligheten. www. lakemedelsverket.se/dextropropoxifen 15 juni 2004 3. Läkemedel som innehåller dextropropoxifen (DXP). www.lakemedelsverket.se/dextropropoxifen 23 februari 2005. 4. Fasta kombinationer av smärtstillande läkemedel innehållande dextropropoxifen försvinner från marknaden hösten 2005. www.lakemedelsverket.se/dextropropoxifen 20 maj 2005. Biverkningsnytt Figur 2. Förfrågningar till GIC angående DXP. Figur 3. Försäljningsdata från Swedis. Information från Läkemedelsverket 4:2007 65 Monografier Veterinärmedicinska läkemedel Draxxin (tulatromycin) ATC-kod: QJ01FA94 Lösning för injektion 100 mg/mL Pfizer Ltd Sammanfattning Draxxin (tulatromycin) är en makrolid avsedd för behandling och förebyggande behandling av luftvägsinfektion hos svin orsakad av Actinobacillus pleuropneumoniae, Pasteurella multocida samt Mycoplasma hyopneumoniae, för behandling och förebyggande behandling av luftvägsinfektion orsakad av Pasteurella haemolytica, Pasteurella multocida samt Hemophilus somnus hos nötkreatur samt behandling av infektiös bovin keratokonjunktivit orsakad av Moraxella bovis. Då läkemedlet elimineras mycket långsamt är engångsbehandling tillräcklig för att terapeutiska koncentrationer skall upprätthållas under den tid som krävs för avläkning. Denna egenskap gör samtidigt att karenstiden är lång för såväl svin (33 dagar) som nötkreatur (49 dagar). Dräktiga mjölkkor ska inte behandlas nära kalvningen och då MRL inte fastställts för mjölk ska preparatet inte användas till nötkreatur som producerar mjölk för humankonsumtion. Kliniska studier har visat att effekten vad avser behandling av luftvägsinfektion hos nöt och svin, mätt som minskade kliniska symtom, är jämförbar med de preparat man använt som jämförelser i fältstudier. I nötkreaturs- och svinbesättningar som drabbats av ett ”utbrott” av luftvägssjukdom har man i fältstudier visat att förebyggande behandling av kliniskt friska djur som står i direktkontakt med sjuka individer minskar risken för insjuknande i viss utsträckning. För att minska risken för att förebyggande behandling inleds utan att ett utbrott av de för indikationen aktuella bakteriespecies föreligger skall förekomst av aktuella sjukdomsframkallande bakterier ha konstaterats i besättningen. Effektdurationen är cirka tre dagar, vilket innebär att den förebyggande effekten är kortvarig. Behandling av nökreatur med infektiös keratokonjunktivit har god effekt. Hos både nötkreatur och svin uppkommer ofta lokal smärta och en vävnadsreaktion vid injektionsplatsen och spår av denna kan identifieras histologiskt upp till 30 dagar efter injektion. Godkännandedatum: 2003-11-11 samt utökad indikation 2007 (central procedur). Läkemedelsverkets värdering Draxxin anses ha ett stort värde för behandling av bovin infektiös keratokonjunktivit på grund av att en behandling är tillräcklig och att ingen produkt finns registrerad för denna indikation. Makrolider utgör i Sverige inte förstahandsval vid behandling av luftvägsinfektion hos svin och nöt och det faktum att makrolider har stor benägenhet att driva resistensutveckling innebär att produkten skall användas restriktivt vid dessa indikationer. Tulatromycins farmakokinetiska egenskaper gör att subterapeutiska koncentrationer förekommer under en relativt lång tid efter behandling. Draxxin är det första läkemedlet med indikationen förebyggande behandling av luftvägsinfektion hos nötkreatur. Förutsatt att användningen ses som ett komplement till etablerade strategier för förebyggande sjukdomsbekämpning och att den används endast i samband med plötsliga sjukdomsutbrott (på grund av kort effektduration) kan produkten vara av värde som förebyggande behandling för såväl nötkreatur som svin. Verksam beståndsdel Tulatromycin. Indikationer Nöt (luftvägsinfektion) Behandling och förebyggande behandling av luftvägsinfektion (BRD) förorsakade av Mannheimia (Pasteurella) haemolytica, Pasteurella multocida samt Haemophilus somnus känsliga för tulatromycin. Innan förebyggande behandling i en besättning skall alltid sjukdomsframkallande bakterier ha konstaterats. 66 Information från Läkemedelsverket 4:2007 Nöt (ögoninfektion) Behandling av infektiös bovin keratokonjunktivit (IBK) förorsakad av Moraxella bovis. Svin Behandling och förebyggande behandling av luftvägsinfektioner hos svin (SRD) orsakade av Actinobacillus pleuropneumoniae, Pasteurella multocida samt Mycoplasma hyopneumoniae känsliga för tulatromycin. Innan förebyggande behandling i en besättning skall alltid sjukdomsframkallande bakterier ha konstaterats. Draxxin ska endast användas om det kan Monografier förutses att grisarna kommer att insjukna inom två till tre dagar. eller Mycoplasma bovis konstaterats genom provtagning vid försökets början. Kalvarna injicerades med en engångsdos av Draxxin eller en positiv kontroll (tilmikosin eller florfenikol). Därefter undersöktes kalvarna i tre av besättningarna avseende kliniska symtom på luftvägsinfektion dagligen under 14 dagar efter behandlingen, medan man i den fjärde studien följde dem i 62 dagar. Bakteriologisk provtagning genomfördes inte under uppföljningsperioden. En signifikant förbättring vad avser de kliniska symtomen på luftvägsinfektion noterades under försöksperioden och effekten var jämförbar med de läkemedel som använts som positiv kontroll (tilmikosin eller florfenikol). Eftersom effekten inte verifierats på ett tillfredsställande sett avseende Mycoplasma bovis godkändes inte Draxxin för behandling av detta bakteriespecies. I Tabell I presenteras för alla fältstudier andelen behandlade kalvar med positivt behandlingsresultat (inga luftvägssymtom samt ej feber [kroppstemperatur < 40ºC ] under två på varandra följande dagar under dag 2 till 14 efter behandling). Produktens förmåga att förebygga luftvägsinfektion utvärderades i tre fältstudier som genomfördes i Frankrike och Italien. I dessa besättningar hade ”utbrott” konstaterats vid försökets början (mellan 12,6 % och 16,5 % av samtliga djur i besättningen uppvisade symtom på luftvägsinfektion vid försökets början). Studierna innefattade upp till 30 månader gamla kliniskt friska nötkreatur som var i direktkontakt med djur som uppvisade kliniska tecken på luftvägsinfektion och där förekomst av infektion verifierats mikrobiologiskt. Försöksdjuren behandlades med en engångsdos Draxxin eller med placebo (koksaltlösning). I en av studierna inkluderades dessutom en positiv kontroll (tilmikosin). Behandlingseffekten värderades genom att studera hur stor andel av djuren som insjuknade med symtom på luftvägsinfektion under den 12–14 dagar långa uppföljningstiden (Ta- Dosering Nöt (luftvägsinfektion och ögoninfektion) 2,5 mg tulatromycin/kg kroppsvikt injiceras subkutant som engångsdos. Om kroppsvikten överstiger 300 kg fördelas dosen på två injektionsställen. Svin 2,5 mg tulatromycin/kg kroppsvikt injiceras intramuskulärt i nacken som engångsdos. Om kroppsvikten överstiger 80 kg fördelas dosen på flera injektionsställen så att maximalt 2 mL injiceras på varje ställe. Djuren skall behandlas i ett tidigt stadium av sjukdomen och effekten skall utvärderas inom 48 timmar efter behandling. Vid kvarstående eller aggraverande symtombild eller i fall av recidiv vid denna tidpunkt, skall annan relevant antibiotikaterapi inledas. Klinik Klinisk effekt Nötkreatur (luftvägsinfektion) Lämplig dos fastställdes i fem fältstudier där effekten av två olika doser (1,25 mg och 2,5 mg/kg kroppsvikt) utvärderades vid behandling av luftvägsinfektion orsakad av de species som anges i indikationen för produkten. Bäst behandlingseffekt noterades vid den högre dosen. Produktens effekt vid behandling av kalvar med konstaterad lunginflammation utvärderades i fyra fältstudier som genomfördes i kalvbesättningar i Frankrike, Tyskland, Italien och England. Studierna inkluderade kalvar i åldersintervallet tre veckor till 15 månader från besättningar där utbrott av lunginflammation orsakad av Mannheimia haemolytica, Pasteurella multocida, Haemophilus somnus och/ Tabell I. Andel kalvar med positivt behandlingsresultat. Studie 1 Studie 2 Studie 3 Studie 4 Draxxin (2,5 mg/kg × 1 dag) 81,6 % (39) 93,1 % (59) 93,8 % (67) 84,6 % (26) Tilmikosin (10 mg/kg × 1 dag) 89,5 % (19) 100 % (30) 87,5 % (34) – Florfenikol (40 mg/kg × 1 dag) – – – 78,3 % (25) Tabell II. Andel djur som insjuknade med symtom på luftvägsinfektion under den 12–14 dagar långa uppföljningstiden (%). Studie 1 Studie 2 Studie 3 a, b Draxxin (2,5 mg/kg × 1 dag) 28,7 a (100) 5,2 a (98) 0 a (113) Tilmikosin (10 mg/kg × 1 dag) – – 7,1 a (113) Placebo (koksalt) 79,6 b (102) 29,0 b (94) 21,5 b (66) Tal med olika bokstavsmarkering i samma rad, skiljer sig signifikant. Information från Läkemedelsverket 4:2007 67 Monografier bell II). Skillnaden mellan den Draxxinbehandlade gruppen och placebogruppen var signifikant i samtliga studier. Nöt (ögoninfektion) Preparatets effekt värderades i en experimentell studie där korneasår inducerades hos 49 Holsteinkalvar, varefter M bovis instillerades i konjunktivalsäcken. Hälften av kalvarna behandlades en gång med tulatromycin (2,5 mg/kg kroppsvikt) och effekten värderades dag 21. En signifikant (p = 0,0020) högre andel av de behandlade kalvarna (100 %) uppvisade avläkning av korneasåren dag 21 jämfört med kontrollgruppen (50 %). Sjukdomsagens isolerades dock dag 21 i ögonen hos en relativt stor andel av de behandlade djuren, vilket indikerar att återinfektion kan ske kort efter behandlingens avslutande och vidare att sjukdomen är multifaktoriell. Resultaten från två fältstudier med spontant uppkomna fall av infektiös bovin keratokonjunktivit hos totalt 200 kalvar bekräftar resultaten från den experimentella studien. Dag 21 var avläkningsfrekvensen hos behandlade kalvar 94 % respektive 100 %. Det kan dock noteras att den spontana avläkningsfrekvensen i dessa studier var hög (35 % respektive 88 %). I en tredje fältstudie sågs ingen skillnad i avläkningsfrekvens mellan behandlade (76 %) och obehandlade (71 %) djur. Grisar Genom inledande experimentella studier fastställdes att 2,5 mg tulatromycin/kg kroppsvikt utgjorde effektiv dos vid infektion med Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae och Pasteurella multocida. För indikationen behandling av luftvägsinfektion verifierades dosen dessutom i fyra fältstudier som genomfördes i Frankrike, Holland och England. Grisar med kliniska symtom på luftvägsinfektion och där förekomst av för indikationen aktuella bakterier verifierats mikrobiologiskt och/eller patologanatomiskt vid slakt av ett mindre antal sjuka djur, behandlades med en engångsdos Draxxin (2,5 mg/kg eller 5 mg/kg kroppsvikt) eller med positiv kontroll (tiamulin eller florfenikol). Draxxinbehandlade grisar uppvisade signifikant förbättring vad avser kliniska sjukdomssym- tom under den tio dagar långa uppföljningstiden. Kroppsvikten ökade under uppföljningstiden i samtliga grupper och den dagliga tillväxten var högst i den Draxxinbehandlade gruppen. Förekomst av kliniska sjukdomssymtom skiljde sig inte under uppföljningsperioden mellan de Draxxinbehandlade grisarna och dem som fick positiv kontroll. Det var ingen skillnad i behandlingseffekt mellan de två doserna 2,5 mg/kg respektive 5 mg/kg. Två ytterligare fältstudier genomfördes i Tyskland för att verifiera behandlingseffekten. Förekomst av luftvägssjukdom fastställdes på samma sätt som i de tidigare nämnda fältstudierna. Resultaten uppvisade samma positiva effekter som de tidigare studierna, men man såg ingen skillnad mellan dem som behandlats med Draxxin respektive positiv kontroll (tiamulin eller florfenikol). I Tabell III presenteras, för alla fältstudier, andelen behandlade grisar med positivt behandlingsresultat (inga luftvägssymtom samt ej feber [kroppstemperatur < 40ºC] under två på varandra följande dagar under dag 3 till 10 av den tio dagar långa uppföljningstiden). Vad avser indikationen förebyggande behandling av luftvägsinfektion, genomfördes sex stycken randomiserade och placebokontrollerade fältstudier i England, Italien, Spanien, Tyskland, Slovenien och Danmark för att utvärdera behandlingseffekten. Försöken utfördes då ett utbrott av luftvägsinfektion konstaterats (minst 25 % av djuren i en box uppvisade typiska kliniska symtom) och diagnosen verifierades genom patologanatomisk och mikrobiologisk undersökning av ett mindre antal drabbade grisar. Alla grisar med kliniska symtom behandlades med tulatromycin, medan de kliniskt friska slumpvis fördelades i försöks-, respektive kontrollgrupp. I försöksgruppen injicerades grisarna, som var i åldern fem till tolv veckor, med 2,5 mg tulatromycin per kg kroppsvikt som engångsdos, medan kontrollgrisarna fick koksaltlösning. Behandlingseffekten utvärderades genom att fastställa hur stor andel av grisarna som inte drabbades av kliniska symtom på luftvägsinfektion under 21 dagar (två studier) respektive 42 dagar (fyra studier). Tabell III. Studie 1 Studie 2 Studie 3 Studie 4 Studie 5 Studie 6 a, b Draxxin (5 mg/kg × 1 dag) Draxxin (2,5 mg/kg × 1 dag) 70,5 a (43) 58,5 a (41) 90,0 a (40) 97,3 a (40) 89,7 a (81) 68,2 a (44) 71,4 a (45) 68,3 b (41) 84,6 a (40) 92,1 a (40) Tal med olika bokstavsmarkering i samma rad, skiljer sig signifikant. 68 Information från Läkemedelsverket 4:2007 Tiamulin (15 mg/kg × 3 dagar) 40,9 b (22) 35,0 a (20) Florfenikol 15 mg/kg × 2 dagar) 95,0 a (20) 81,2 (20) 82 a (40) a 84,2 a (38) Monografier Dessutom noterades viktutvecklingen under uppföljningstiden. Resultaten framgår av Tabell IV. Vad avser andel som ej fick kliniska symtom sågs endast i två av studierna en signifikant positiv effekt av behandlingen, medan man i fyra studier såg en förbättrad tillväxt hos behandlade djur. En metaanalys genomfördes och i den Draxxinbehandlade gruppen noterades då dag 21 en något högre (p = 0,0002) andel grisar som inte hade kliniska symtom (80 %) jämfört med kontrollgruppen (69 %). Dag 42 var motsvarande siffror 78 % respektive (65 %), (p = 0,0007). geografiska spridningen av insamlade prover beräknas spegla cirka 60–80 % av de europeiska ländernas svin- och nötpopulation. För dessa prover fastställdes MIC90 enligt Tabell V. Efter administration av rekommenderad dos uppnåddes endast i undantagsfall serumnivåer över 1 mikrogram/mL hos såväl nötkreatur som svin. Vad avser indikationen keratokonjunktivit så har koncentrationen av läkemedlet i tårvätska inte fastställts. MIC-värden för olika stammar av M bovis som isolerats i fält i olika europeiska länder fastställdes till mellan 0,25 och 1 mikrogram/mL. Indikationen omfattar inte infektion med Neisseria spp, eftersom ingen mikrobiologisk dokumentation förelåg för detta agens. Eftersom varken serumhalterna eller den totala vävnadskoncentrationen av makrolider kan förutsättas spegla den aktiva koncentrationen i målvävnaden kan den förväntade effekten av dessa läkemedel inte skattas genom jämförelse av serum/vävnadshalterna och MIC-värden utan värderingen av läkemedlet grundar sig för samtliga indikationer i huvudsak på den kliniska effekt som visats i fältstudier. Substansens farmakokinetiska egenskaper gör att subterapeutiska koncentrationer förekommer under en relativt lång tid efter behandling, vilket kan vara problematiskt ur resistensutvecklingssynpunkt. Farmakodynamik och farmakokinetik Tulatromycin är ett antibiotikum i gruppen halvsyntetiska makrolider med den specifika egenskapen att eliminationen är långsammare än för andra substanser i denna grupp. Substansen absorberas snabbt och närmast fullständigt och elimineras sedan med en halveringstid hos såväl nöt som svin på cirka 90 timmar. Vävnadsanalyser talar för att substansen ansamlas i lungan men det är inte fastställt vilka koncentrationer av farmakologiskt aktiv substans som verkligen uppnås i den infekterade lungvävnaden in vivo. Vävnadskoncentrationerna kvarstår dock höga under längre tid hos svin än nöt, vilket förklarar att den fastställda karenstiden för kött är längre hos nöt (49 dagar) än hos svin (33 dagar). Makrolider utövar en bakteriostatisk effekt genom hämning av bakteriernas proteinsyntes. För att fastställa känsligheten hos de patogener som vanligen isoleras från nötkreatur och svin med luftvägssjukdom (dessa framgår av den godkända indikationen) insamlades prover från kliniska sjukdomsfall. Den Säkerhetsvärdering Hos både nötkreatur och svin uppkommer ofta en vävnadsreaktion vid injektionsplatsen och spår av denna kan identifieras histologiskt upp till 30 dagar efter injektion. Vid subkutan administrering till kalv ses en snabbt övergående smärtreaktion och en lokal Tabell IV. Fältstudie nummer Antal grisar Uppföljningstid (dagar) Andel som ej fick kliniska symtom Tillväxt (kg) Draxxin Kontroll 1 72 72 2 86 90 3 85 82 4 85 84 5 84 78 6 77 86 Draxxin Kontroll Draxxin Kontroll 42 86 % 86 % 28 32* 42 60 % 45 % 24 27* 42 85 % 65 % * 25 28* 42 82 % 70 % 14 15* 21 88 % 74 %* 8 9 21 70 % 67 % 10 10 * Signifikant (p < 0,05) skillnad mellan test- och kontrollgrupp. Tabell V. MIC (mikrogram/mL) MIC90 Nötkreatur Mannheimia haemolytica Pasteurella multocida Haemophilus somnus Svin Actinobacillus pleuropneumoniae Pasteurella multocida Mycoplasma hyopneumoniae 2 1 4 16 2 0,125 Information från Läkemedelsverket 4:2007 69 Monografier svullnad som kan kvarstå cirka en månad. Motsvarande kliniska symtom uppkommer inte hos svin vid intramuskulär injektion. Laboratoriestudier på råttor och kaniner har inte visat några teratogena, foetotoxiska eller maternotoxiska egenskaper, men eftersom motsvarande studier inte genomförts på nötkreatur eller svin skall dräktiga djur endast behandlas när ansvarig veterinär bedömer att nyttan överväger den eventuella risken. Vid överdosering upp till tio gånger den rekommenderade dosen har man hos nötkreatur noterat övergående tecken på obehag på injektionsstället samt rastlöshet, huvudskakningar samt kortvarigt minskat foderintag. Lindrig myokarddegeneration har observerats hos nötkreatur som givits fem till sex gånger rekommenderad dos. Hos unga grisar som väger omkring tio kilo och 70 Information från Läkemedelsverket 4:2007 som fått tre till fem gånger den rekommenderade dosen har man sett övergående tecken på obehag från injektionsstället, hälta samt förändrat beteende. Eftersom resthaltsbestämning i mjölk inte genomförts och då den relevanta karenstiden för kött är lång beslutades att produkten inte får användas till kor som producerar mjölk avsedd för humankonsumtion eller till kor och kvigor inom två månader innan kalvning. Om den injicerade volymen kommer att överstiga 2 mL för svin och 7,5 mL för nötkreatur skall dosen fördelas på flera injektionsställen. Orsaken är att resthaltsbestämningarna genomförts på relativt små djur och den injicerade volymen översteg därigenom inte dessa värden. Referens EPAR (http://www.emea.eu.int/) Monografier Yarvitan (mitratapid) ATC-kod: QA08AB Oral lösning Janssen Animal Health B.V.B.A. Sammanfattning Yarvitan är ett läkemedel för behandling av övervikt och fetma hos vuxna hundar vars övervikt ej är orsakad av någon systemisk sjukdom. Den aktiva substansen (mitratapid) hämmar triglyceridtransferprotein i enterocyterna, vilket medför ett minskat fettupptag via tarmen. Genom läkemedlets aptitsänkande effekt minskar dessutom foderkonsumtionen under behandlingstiden. Resultat från fältstudier visade att man efter en avslutad behandlingsperiod om totalt åtta veckor uppnådde en viktminskning på i genomsnitt 6–7 %. Den kliniska betydelsen av denna viktminskning har inte undersökts. Vanliga biverkningar är kräkningar, diarré eller lös avföring och letargi samt mindre förändringar i vissa blodkemiska parametrar såsom ALAT och ASAT. Biverkningarna är dosberoende och avklingar vanligen inom en kort tid efter avslutad behandling. För bestående effekt skall behandlingen alltid kombineras med förändringar i kost- och motionsvanor. Godkännandedatum: 2006-11-17 (central procedur). Läkemedelsverkets värdering Yarvitan är det första läkemedlet till hund för behandling av övervikt och fetma. Behandlingen resulterar i en relativt blygsam viktminskning. Gastrointestinala biverkningar är relativt vanligt förekommande. Användningen av farmakologisk terapi vid övervikt hos hund rymmer en etisk dimension, där djurägarens ansvar för att upprätthålla normal vikt genom anpassad foderranson och motion måste betonas. Behandlingen kan endast anses meningsfull om den utgör ett led i en långsiktig strategi för viktkontroll som måste inkludera anpassat foderintag och ökad motion. Verksam beståndsdel Klinisk effekt Mitratapid Den viktreducerande effekten utvärderades i två kliniska randomiserade och placebokontrollerade fältstudier som genomfördes i USA respektive EU och som omfattade totalt 360 hundar. Studierna omfattade hundar vars hull översteg sex på en niogradig skala, vilket motsvarar en kroppsvikt > 20 % över den optimala vikten. De led inte av någon systemsjukdom som kunde förklara övervikten. Under den första behandlingsperioden om tre veckor erbjöds hundarna samma foderranson som innan försöket, medan de därefter utfodrades med ett kommersiellt foder enligt sitt underhållsbehov av energi. Under den totalt åtta veckor långa behandlingsperioden minskade hundarna i den behandlade gruppen i genomsnitt 6,9 (± 0,4) % (EU-studien) respektive 6,7 (± 0,4) % (USA-studien) av den initiala kroppsvikten, medan viktminskningen i placebogruppen var 3,1 (± 0,6) % respektive 3,3 (± 0,8) %. Skillnaden mellan placebo och behandlad grupp var statistiskt signifikant, men det kan noteras att nettoeffekten av behandlingen var en viktminskning på endast cirka 3,6 %, eftersom även hundarna i kontrollgruppen minskade i vikt. Oberoende studier indikerar att en viktminskning på omkring 10 % kan medföra positiva hälsoeffekter för överviktiga hundar (Impellizeri, et al. 2000). I den ena fältstudien noterades att en signifikant större andel av de mitratapidbehandlade hundarna (23,1 %) förlorade minst 10 % av sin ursprung- Indikationer Hjälp vid behandling av övervikt och fetma hos vuxna hundar. Skall användas som en del av ett totalt viktbehandlingsprogram, som även omfattar lämpliga dietförändringar. Införandet av lämpliga förändringar i livsföringen (t.ex. ökad motion) kan, tillsammans med detta viktbehandlingsprogram, ge ytterligare fördelar. Dosering Läkemedlet ges oralt tillsammans med föda, en gång per dag under två perioder om 21 dagar med ett 14 dagar långt behandlingsuppehåll mellan dessa perioder. Dosen (0,63 mg mitratapid/kg kroppsvikt) justeras efter hundens vikt i början av varje behandlingsperiod. Under de första 21 dagarnas behandling kan fodermängden förbli oförändrad, medan ransonen därefter skall justeras till underhållsbehovet av energi. Information från Läkemedelsverket 4:2007 71 Monografier liga kroppsvikt jämfört med placebogruppen (6,7 %). I den andra fältstudien sågs dock ingen skillnad mellan grupperna avseende hur stor andel av hundarna som förlorade minst 13 % av sin kroppsvikt. Hos en del av hundarna noterades en viktökning under den behandlingsfria perioden och under en fyra veckor lång uppföljning efter avslutad behandling. Detta markerar att en korrekt anpassning av foderransonen till underhållsbehovet är av avgörande betydelse för bestående viktreduktion. Någon ytterligare uppföljning utöver dessa fyra veckor genomfördes inte och den långsiktiga effekten av behandlingen kan därmed inte bedömas. Efter avslutad behandling förelåg det enligt ägarnas bedömning ingen skillnad mellan placebogruppen och den behandlade gruppen, vad avser hundarnas ”vitalitet”. Den föreslagna behandlingsstrategin (två behandlingsperioder om vardera tre veckor, åtskilda av en två veckor lång behandlingsfri period) motiveras av att man i inledande studier inte noterade någon ytterligare viktminskning efter fyra veckors kontinuerlig behandling och att viktminskningen under den fjärde veckan dessutom var mycket begränsad. Då behandlingen återupptogs efter fyra behandlingsfria veckor noterades dock ytterligare viktminskning, och uppföljande studier visade att effekten under den andra behandlingsperioden var lika stor om det behandlingsfria intervallet reducerades till två veckor. Farmakodynamik och farmakokinektik Mitratapid hämmar mikrosomalt triglyceridtransferprotein (MTP) i tarmepitelet. Administrering av läkemedlet medför en ökad förekomst av triglyceridinnehållande droppar i enterocyterna och ett minskat upptag av fetter från födan, vilket man antar orsakas av att MTP hämmas i enterocyterna. Mitratapid har dessutom en viss aptitnedsättande effekt. Mekanismen bakom denna effekt är inte helt klarlagd. Företagets studier visar att foderkonsumtionen minskar hos hundar även då läkemedlet inte administreras i samband med utfodring, och foderkonsumtionen minskar bara om fetthalten i fodret är över en viss nivå. Dessutom har man visat att läkemedlet inte passerar blod-hjärnbarriären. Dessa fakta talar för att den minskade foderkonsumtionen inte beror på att hunden upplever fodret som mindre smakligt utan snarare beror på en lokalt utlöst aptitsänkande signal till följd av den ansamling av triglycerider som sker i enterocyterna. Laboratoriedjur och hundar absorberar snabbt oralt administrerat mitratapid och det binds i stor utsträckning (> 99 %) till plasmaproteiner. Utsöndringen sker snabbt och huvudsakligen via feces. Säkerhetsvärdering Enligt resultaten från de två fältstudierna var den vanligaste biverkningen kräkningar, vilket sågs hos 26–34 % av de behandlade hundarna och hos 4–11 % 72 Information från Läkemedelsverket 4:2007 av hundarna i kontrollgruppen. I majoriteten av fallen kräktes hundarna mindre än tre gånger under hela behandlingsperioden. Anorexi förekom oftare i den behandlade gruppen, vilket kan ses som en förväntad effekt av behandlingen och inte en biverkning. I EU-fältstudien skilde sig ej diarréfrekvensen mellan grupperna, medan den var högre bland mitratapidbehandlade hundar (11 %) jämfört med placebobehandlade hundar (2 %) i USA-studien. I båda studierna var varje diarréepisod längre hos de behandlade hundarna. I den säkerhetsstudie som genomförts på hundar där man givit tre gånger respektive fem gånger den rekommenderade dosen (0,63 mg/kg/dag) under 63 dagar såg man en rad effekter som kan förklaras av läkemedlets farmakologiska egenskaper. Exempel på dessa är, förutom viktförlust och minskad foderkonsumtion, sänkta serumnivåer av fosfolipider, triglycerider och kolesterol. Förutom detta noterades biverkningar såsom kräkningar, diarré, anorexi, minskade serumnivåer av albumin, globulin, totalprotein, kalcium och ALP, ökade nivåer av ALAT och ASAT samt vakuolisering och ansamling av fettdroppar i hepatocyterna. Man såg dock inga tecken på degenerativa förändringar i levercellerna. Vid många av dessa biverkningar sågs ett dosberoende samband och förändringarna försvann i de flesta fall inom 14 dagar efter avslutad behandling. De minskade serumnivåerna av protein beror sannolikt på ett minskat upptag från tarmen och de lägre kalciumnivåerna kan förklaras av att en stor andel av serumkalcium är proteinbundet. De sänkta halterna av ALP antas bero på att läkemedlet hämmar gallsyrasekretionen samt upptaget av långkedjiga fettsyror, men man noterade inga patologanatomiska förändringar som kan förknippas med den noterade förändringen i ALP. Förhöjda nivåer av ALAT och ASAT sågs först då dosen ökades till tre gånger rekommenderad dos. Orsaken är inte klarlagd, men då man inte noterade tecken på degenerativa leverförändringar och värdena normaliserades efter avslutad behandling är de förhöjda nivåerna sannolikt av mindre betydelse. Fynden motiverar dock en kontraindikation för patienter med nedsatt leverfunktion. Hos hundar som behandlades kontinuerligt under åtta veckor sågs ingen signifikant sänkning av serumhalten avseende vitamin A och E. Eventuell påverkan på serumhalterna av vitamin D och K har inte studerats, men i toxikologiska studier som genomfördes på unga hundar sågs inte någon påverkan på koaguleringsförmåga, hematologiska parametrar eller benmatrixstruktur, vilket talar för att halten av dessa vitaminer inte påverkas i någon omfattning av klinisk betydelse. Eventuell påverkan på upptaget av essentiella fettsyror har inte studerats. Man har inte studerat läkemedlets effekter på växande hundar och eftersom man inte kan utesluta att behandlingen kan påverka upptaget av för den växande hunden viktiga Monografier näringsämnen, är en kontraindikation för behandling av hundar yngre än 18 månader motiverad. Man har i två studier undersökt huruvida behandling med mitratapid påverkas av samtidig behandling med NSAID (karprofen respektive meloxikam) och ACE-hämmare (benazepril respektive enalapril). Dessa studier var små och resultaten därmed något osäkra, men man noterade inte någon ökad risk för biverkningar. Referenser Impellizeri JA, Tetrick MA, Muir P. Effect of weight reduction on clinical signs of lameness in dogs with hip osteoarthritis. J Am Vet Med Assoc 2000;216:1089-91. EPAR (http://www.emea.eu.int/) Av företaget insänd dokumentation. Information från Läkemedelsverket 4:2007 73 Läkemedelsförmånsnämnden Läkemedelsförmånsnämnden, LFN, är den myndighet som beslutar vilka läkemedel och förbruknings­ artiklar som ska subventioneras av samhället. Besluten fattas av en nämnd som finns inom myndigheten. Nämnden består av en ordförande och tio ledamöter. Ledamöterna har tillsammans en bred medicinsk, såväl praktisk som vetenskaplig, och hälsoekonomisk kompetens. Två av ledamöterna har erfarenhet från brukargrupper. Flera hostmediciner försvinner ur högkostnadsskyddet LFN har beslutat att flera hostmediciner ska ute­ slutas ur högkostnadsskyddet eftersom det inte är rimligt att samhället ska subventionera läkemedel mot kortvariga och lindriga besvär. Svåra sjukdo­ mar där behoven är stora ska prioriteras. LFN har granskat subventionerna för läkemedel som används mot astma, hosta, kroniskt obstruktiv lungsjukdom (KOL) och cystisk fibros. Under 2006 hade läkemedlen i genomgången ett försäljningsvärde på 1,8 miljarder kronor, varav astmainhalatorer stod för 60 procent av försäljningen. Åtta av de 45 läkemedel som granskats förlorar sin subvention, däribland fyra hostmediciner. Besluten i den nu aktuella granskningen innebär att 40 miljoner kronor per år frigörs. Pengarna kan användas till angelägna områden inom sjukvården. LFN:s arbete syftar till att få ut så mycket hälsa som möjligt för de skattepengar som går till läkemedel. LFN anser att hosta och slem i luftvägarna till följd av en förkylning ger upphov till så kortvariga och lindriga besvär att det inte är rimligt att subventionera läkemedel mot dessa symtom. Dessutom är effekten av läkemedlen generellt sett svag och otillfredsställande dokumenterad. Patienter som vill använda dessa läkemedel får därför stå för kostnaden själv. De patientgrupper som har de största medicinska behoven ska ha mer av sjukvårdens resurser. Astma, kol och cystisk fibros är allvarliga sjukdomar som inte går att bota. Därför är det angeläget att samhället subventionerar ett stort antal läkemedel mot dessa sjukdomar. Fyra läkemedel mot astma förlorar dock sina subventioner. Det beror på att det finns billigare alternativ med lika bra eller bättre medicinsk effekt. Som exempel kan nämnas att läkemedlet Asmanex förlorar sin subvention. Asmanex är 60–70 procent dyrare än andra snarlika preparat. Besluten börjar gälla från den 1 oktober 2007, om de inte överklagas. Det innebär att patienterna med hänsyn tagen till sommarmånaderna får drygt fyra månader på sig att kontakta sin läkare och ändra sin behandling. Därefter subventioneras inte de läkemedel som lyfts ur förmånerna. Om några beslut överklagas kommer de aktuella läkemedlen att vara fortsatt subventionerade till dess att domstol beslutat annat. En lista över vilka beslut som överklagas kommer att finnas tillgänglig på www.lfn.se omkring den 15 juni 2007. På LFN:s webbplats finns en slutrapport och en sammanfattning av genomgången. Slutrapporten innehåller bland annat en redovisning av kunskapsläget för de aktuella läkemedlen. LFN granskar kontinuerligt hela läkemedelssortimentet och omprövar därmed subventionerna i förmånerna. Tidigare har magsyra- och migränläkemedel granskats. Tabell I. Följande åtta läkemedel kommer får inte behålla sin subvention: • Asmanex (mometason) • Efedrinhydryklorid APL (efedrinhydroklorid) • Efedrinhydroklorid i Quilla Simplex APL (efedrinhydroklorid) • Lepheton – Desentol APL (efedrin, etylmorfin och difenhydramin) • Lomudal som inhalationspulver (natriumkromoglikat) • Mollipect (bromhexin och efedrin) • Teovent i tablettform (kolinteofyllinat) • Theo-Dur (teofyllin) Tabell II. Ett läkemedel får begränsad subvention. • Bisolvon Bisolvon kommer att subventioneras bara för patienter med cystisk fibros eller primär ciliär dysfunktion. För dessa sidor ansvarar LFN: Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna, Telefon: +46 8 56 84 20 68, e-post: [email protected], www.lfn.se 74 Information från Läkemedelsverket 4:2007 Läkemedelsförmånsnämden Avsnitt Underrubrik av något slag Begränsad subvention för vaccin mot livmoderhalscancer Livmoderhalscancer är en livshotande sjukdom, som vid sen upptäckt leder till både mänskligt lidande och höga behandlingskostnader. Därför är det angeläget att begränsa insjuknandet i denna cancerform. Socialstyrelsen utreder för närvarande om HPVvaccin ska ingå i det allmänna vaccinationsprogrammet för barn. En eventuell vaccinering med HPV-vaccin inom det nationella barnvaccinationsprogrammet kommer sannolikt att ske före tolv års ålder. Att Gardasil eventuellt ingår i vaccinationsprogrammet i framtiden utgör därmed inget hinder mot att låta vaccinet ingå i läkemedelsförmånerna för unga kvinnor i åldrarna 13–17 år. LFN kan komma att ompröva detta beslut när Socialstyrelsen tagit ställning i frågan. Läkemedelsförmånsnämnden har beslutat att HPV-vaccinet Gardasil ska ingå i läkemedelsför­ månerna, men bara för unga kvinnor i åldrarna 13–17 år. Läkemedel som ingår i läkemedelsför­ månerna får räknas in i högkostnadsskyddet för läkemedel. Gardasil är ett vaccin mot humant papillomvirus (HPV), som kan leda till livmoderhalscancer. Maximal effekt av Gardasil uppnås hos unga kvinnor som ännu inte sexualdebuterat och därmed inte utsatts för HPV-virus. Sexuell debut är emellertid inte liktydigt med HPV-infektion och en majoritet av tonåringarna är inte infekterade. Det är därmed även motiverat att vaccinera sexuellt aktiva unga kvinnor. LFN har därför beslutat att Gardasil ska subventioneras för unga kvinnor i åldrarna 13–17 år. Enklare hantering av licensläkemedel föreslås LFN, Sveriges Kommuner och Landsting (SKL) samt Apoteket AB lämnar idag in ett förslag om enklare hantering av så kallade licensläkemedel till regeringen. De tre organisationerna föreslår bland annat att licensläkemedel automatiskt ska omfattas av läkemedelsförmånerna efter det att Läkemedelsverket beviljat licens. Idag måste LFN först fatta beslut om att läkemedlet ska ingå i förmånerna, vilket innebär att det kan ta lång tid från det att läkemedlet skrivs ut av en läkare tills patienten kan hämta ut läkemedlet på apoteket. – Förslaget ger en snabbare och säkrare hantering av licensläkemedel för patienterna. Det blir tydligare och effektivare för alla inblandade parter, säger AnnChristin Tauberman, generaldirektör på LFN. Förslaget som lämnas till regeringen idag gör hanteringen av licensansökningar enklare och snabbare. Läkarna kommer att få bättre information om läkemedlens effekt, pris och tillgänglighet, i ett nytt informationssystem som föreslås utvecklas. – För patienterna innebär detta att säkerheten ökar och att de får bättre service, i och med att tiden från det att läkemedlet skrivs ut till dess att man kan hämta ut det på apoteket förkortas, säger Håkan Sörman, VD på SKL. Förslaget underlättar också för läkemedelsföretagen som inte behöver ansöka om subvention för licensläkemedel. Med förslaget blir ett licensläkemedel automatiskt subventionerat när en licens godkänts av Läkemedelsverket. Ett licensläkemedel är ett läkemedel som ännu inte blivit godkänt av Läkemedelsverket för försäljning i Sverige, men som ändå beviljats försäljningstillstånd för att tillgodose särskilda behov hos enskilda patienter eller patientgrupper. Det är läkaren som efter en medicinsk bedömning skriver ut ett licensläkemedel och motiverar licensansökan. Men det är idag apoteket som ansöker om licens hos Läkemedelsverket. Hela förslaget finns att läsa på LFN:s webbplats, www.lfn.se. För dessa sidor ansvarar LFN: Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna, Telefon: +46 8 56 84 20 68, e-post: [email protected], www.lfn.se Information från Läkemedelsverket 4:2007 75 Avsnitt Läkemedelsförmånsnämnden Underrubrik av något slag Snabbguide till LFN:s beslut Beviljas generell subvention Bravelle – Läkemedel som används vid behandling av infertilitet hos kvinnor. Prexige – Prexige är ett antiinflammatoriskt läkemedel som är godkänt för symtomatisk lindring vid behandling av artros i knä och höft. Reyataz – Hiv-läkemedel som även fortsättningsvis ska ingå i förmånerna. Risperdal Consta – Schizofreniläkemedel som även fortsättningsvis ska ingå i förmånerna. Serevent Evohaler – Långverkande luftrörsvidgare av typen betastimulerare i form av inhalationsspray, som sedan tidigare finns som inhalationspulver. Beviljas begränsad subvention Gardasil – HPV-vaccin som ingår i läkemedelsförmånerna för unga kvinnor i åldrarna 13–17 år (se artikel ovan). De nya läkemedelsförmånerna – ett produktinriktat system med två subventionsmöjligheter. • Generell subvention innebär att ett läkemedel är subventionerat för hela det godkända användningsområdet. • Begränsad subvention innebär att ett läke- medel bara är subventionerat för ett visst användningsområde. För dessa sidor ansvarar LFN: Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna, Telefon: +46 8 56 84 20 68, e-post: [email protected], www.lfn.se 76 Information från Läkemedelsverket 4:2007 Datum Uppgift om biverkning Rapportörens namn Patient (efternamn, förnamn, personnummer) Läkemedel, Naturläkemedel, Kosmetika/Hygienprodukter Titel Adress Telefon Biverkningens diagnos Datum då biverkningen uppträdde Man Kvinna Grundsjukdom Förlopp (eller kopia av epikris inkl. labdata) Följder av biverkan: Biverkan har medfört: Okänt Ännu ej tillfrisknat Patienten avled Tillfrisknat utan men Livshotande reaktion Återställd med funktionsnedsättning Upphörde reaktionen vid utsättning? Dödsorsak: Sjukskrivning Tidigare läkemedelsreaktioner: Okänt Ja Okänt Nej Ej utsatt Nej Ej återinsatt Läkemedelsform/likn Form Övriga läkemedel/preparat BIV 2003-10 Intensivvård Inget av ovanstående Ja Bilagor: Journalanteckning Epikris Förlängd sjukhusvistelse Datum: Återkom reaktionen vid återinsättning? Misstänkt läkemedel/preparat (för vacciner även batchnr.) Sjukhusvistelse Styrka Dosering Behandlingens varaktighet Fr.o.m. T.o.m. Indikation (om annan än grundsjukdom) Inga andra läkemedel/preparat Lablista Läkemedelslista Blanketten insändes till regionalt biverkningscentrum. För adress, se Läkemedelsverkets webbplats www.mpa.se eller FASS. Vad skall rapporteras? * Nya läkemedel (se förteckning i FASS kapitel om biverkningar eller Information från Läkemedels­verket) Alla misstänkta biverkningar förutom de som återfinns som “vanliga” i FASS-texten * För samtliga läkemedel skall rappor­teras misstänkta biverkningar som leder till: . Dödsfall . Livshotande tillstånd . Perma­nent ska­da eller lån­g­v­arig f­unkt­ion­sne­dsä­ttn­ing . Sjukhusvård eller förlängning därav . Nya oväntade biverkningar eller interaktioner . Biverkningar som tycks öka i frekvens eller allvarlighetsgrad Däremot behöver banala biverknin­gar av äldre läke­medel inte rappor­teras. - - Som biverkningar räknas vad gäller rapporteringskrav enligt EUs regler även förgiftningar med och missbruk av nya läkemedel. Samma rapporteringsregler gäller biverkningar av naturläkemedel och läkemedel anänvda till djur. För kosmetika hygienprodukter är det önskvärt att nya eller allvarliga biverkningar rapporteras. Rapportera redan vid misstanke om biverkning. Vem rapporterar? Ansvaret för rapportering av biverkningar åligger den huvudman (såväl offentlig som privat) som bedriver verksamhet inom hälso- och sjukvården (LVFS 2001:12). I biverkningsregistret införs rapporter från läkare, tandläkare samt sjuksköterskor. Vid frågor som gäller sjuksköterskornas rapportering av biverkningar, vänligen kontakta Regionalt Biverkningscentrum. Hur rapporterar man? enklast genom att: - blanketthuvudet på blanketten ifylles - biverkningens art (diagnos) ifylles - kopia medsändes på epikris/slutanteckning eller rele­vanta daganteckningar + annan relevant infor­mation, ex labora­torielistor - alternativt kan man skicka en epikris och kontakta regionalt centrum per telefon Vart skickas blanketten? Norra regionen Län: AC, BD, Y och Z Biverkningsenheten Avd för klin farmakologi Norrl Universitetssjukhus 901 85 UMEÅ Tel 090-785 39 08 Fax 090-12 04 30 Stockholmsregionen Syd Län AB och I Biverkningsenheten Avd för klin farmakologi Karolinska sjukhuset-Huddinge 141 86 HUDDINGE Tel 08-585 811 80 Fax 08-585 811 85 Stockholmsregionen Norr Län AB och I Biverkningsenheten Avd för klin farmakologi Karolinska sjukhuset-Solna 171 76 STOCKHOLM Tel 08-51773009 Fax 08-517 715 33 Uppsala/Örebro regionen Län C, D, S, T, U, W och X Biverkningsenheten Avd för klin farmakologi Akademiska sjukhuset 751 85 UPPSALA Tel 018-611 29 29 Fax 018-611 42 01 [email protected] [email protected] [email protected] [email protected] Västra regionen Län N (Norra),O, P, R Biverkningsenheten Avd för klin farmakologi Sahlgrenska Universitetsjh 413 45 GÖTEBORG Tel 031-342 27 20 Fax 031-82 67 23 Östra regionen Län E, F och H Biverkningsenheten Avd för klin farmakologi Universitetssjukhuset 581 85 LINKÖPING Tel 013-22 44 20 Fax 013-10 41 95 Södra regionen Län G,K,L,M,N (Södra) Biverkningsenheten Avd för klin farmakologi Universitetssjukhuset 221 85 LUND Tel 046-17 53 38 Fax 046-211 19 87 [email protected] [email protected] [email protected] Produkter som betraktas som kosmetika/hygienprodukter Ansikts make-up Bad- och duschprodukter Brun-utan-sol-produkter Handdesinfektionsmedel Hårborttagningsprodukter Hårvårdsprodukter Hudkrämer och hudrengöringsmedel Massagekrämer Munvårdsprodukter Nagelprodukter Parfymprodukter Puder Rakprodukter Rengöringsmedel för yrkesmässig användning (ej ytrengöring) Skyddskrämer (barriärkrämer) Solskyddsprodukter Transpirationsmedel Rapporterade uppgifter behandlas i ett register i enlighet med förordningen 2001:710 om biverkningsregister angående läkemedel hos Läkemedelsverket Datum UPPGIFT OM BIVERKNING HOS DJUR Veterinärens namnteckning Behandlat djur (djurslag, ras, ålder, vikt, kön) Veterinärens adress och telefonnummer Djurägarens namn, adress och telefonnummer Biverkningens diagnos och datum då den uppträdde Misstänkt läkemedel Läkemedelsform Form Styrka Dosering Behandlingens varaktighet Fr o m Tom Övriga läkemedel som använts FÖLJDER AV REAKTIONEN: Tillfrisknat utan men Livshotande reaktion Indikation för behandlingen Inga andra läkemedel Ännu ej tillfrisknat Djuret avled Återställd med funktionsnedsättning Datum: Dödsorsak: Förlopp (eller kopia av journalanteckning) Blanketten insändes till: BIVERKNINGSFUNKTIONEN Läkemedelsverket, Box 26, 751 03 UPPSALA Fax: 018-54 85 66 Tel: 018-17 46 00 ......st blanketter rekvireras till ovanstående adress. Information från Läkemedelsverket 4:2007 79 Posttidning B LÄKEMEDELSVERKET BOX 26 Rapportering av läkemedelsbiverkningar hos människa 751 03 UPPSALA Läkemedel för vilka alla misstänkta biverkningar skall rapporteras som inte står upptagna som ”vanliga” i FASS Godkända 2005 Preparat Aftasol Aloxi Alvesco/Amavio/Freathe Aptivus Avastin Azilect Corlentor/Procoralan Duac Eligard FDG Mallinckrodt Fendrix Fosavance Indocyaningrön Pulsion Inegy/Vytorin Kepivance Litiumklorid Lidico Medicinsk Oxygen AGA Mekostest Nixema Noxafil/Posaconazole SP Octanate Orfadin Prialt Protaminsulfat Leo Pharma Purimune Quintanrix Revatio Ritalin Serdolect Tamiflu Trileptal Tarceva Truvada Vacciflu Vasovist Vivaglobin Xolair Xyrem Zonegran Substans Amlexanox Palonosetron Ciklesonid Tipranavir Bevacizumab Rasagilin Ivabradin Klindamycin + bensoylperoxid Leuprorelin Fludeoxyglukos Vaccin mot hepatit B Alendronsyra, kolekalciferol Indocyaningrön Ezetimib + simvastatin Palifermin Litiumklorid Oxygen Allergitest Allergitest Posakonazol Koagulationsfaktor VIII Nitisinon Ziconotid Protaminsulfat Immunoglobulin, humant Vaccin mot difteri, stelkramp, kikhosta, hepatit B och Haemophilus influenzae B Sildenafil Metylfenidat Sertindol Oseltamivir (Ny indik: Barn från 1 år) Oxkarbazepin (Ny indik: Barn från 1 månad) Erlotinib Emtricitabin + tenofovir Vaccin mot influensa Gadofosveset Immunoglobulin, humant Omalizumab Hydroxismörsyra Zonisamid Godkända 2006 Preparat Acomplia Avaglim Baraclude Bravelle Byetta Cardioxane/Savene Champix Substans Rimonabant Glimepirid+rosiglitazon Entekavir Urofollitropin Exenatid Dexrazoxan Vareniklin Combigan Cubicin DuoTrav Evoltra Exjade Exubera Ganfort Gardasil Glypressin Kiovig Macugen Medicinsk luft M-M-Rvaxpro Myozyme Naglazyme Neupro Nexavar Niontix Preotact ProQuad Remodulin Rotarix RotaTeq Silgard Sprycel Strattera Suboxone Sutent Thelin Tygacil Tysabri Zimulti Timolol + brimonidin Daptomycin Timolol+travoprost Klofarabin Deferasirox Insulin Timolol+bimatoprost Vaccin mot humant papillomvirus Terlipressin Humant immunglobulin Pegaptanib Medicinsk luft Vaccin mot mässling, påssjuka, röda hund Alglukosidas alfa Galsulfase Rotigotin Sorafenib Nitrous oxid Paratyroidhormon Vaccin mot mässling, påssjuka, röda hund och vattkoppor Treprostinil Vaccin mot rotavirus Vaccin mot rotavirus Vaccin mot humant papillomvirus Dasatinib Atomoxetin Buprenorfin + naloxon Sunitinib Sitaxentan Tigecyklin Natalizumab Rimonabant Godkända till och med 1 mars 2007 Preparat Copalia/Dafiro/Exforge/Imprida Diacomit Elaprase Inovelon Lucentis Mydriasert Prexige Prezista Rapydan Substans Amlodipin + valsartan Stiripentol Idursulfas Rufinamid Ranibizumab Tropikamid + Fenylefrinhydroklorid Lumiracoxib Darunavir Lidokain + tetrakain OBS! Alla preparat marknadsförs inte i Sverige. Hur rapporterar man? Rapportering till Läkemedelsverket bör ske på särskild blankett. Enklast kan rapportering ske genom att: • blanketthuvudet på blanketten ifylles • biverkningens art (diagnos) ifylles • kopia medsändes på epikris + annan relevant information. Adresskällor: LV:s adressregister samt Cegedim AB HAR DU ÄNDRAT ADRESS? Är adressen fel ber vi dig klippa ur etiketten med den gamla adressen och skicka den tillsammans med din nya adress till Läkemedelsverket, Informationsskrif­ ten, Box 26, 751 03 Uppsala 80 Information från Läkemedelsverket 4:2007