Periodiska systemet
advertisement

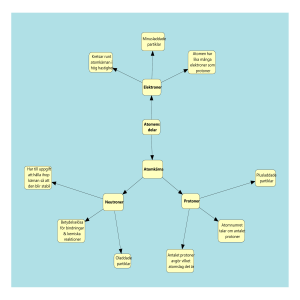
Atomen och periodiska systemet Atomens byggnad Göran Sellberg och Annika Adolfsson Historia Fem män Demokritos Dalton Joseph John Thomson Ernest Rutherford James Chadwick Göran Sellberg och Annika Adolfsson 400-t f.Kr. ”Atomos”=odelbar Allt uppbyggt av osynliga smådelar Stort motstånd! Göran Sellberg och Annika Adolfsson • • • • 1700-t Demokritos idéer återuppstod Massiva kulor Olika tunga kulor Göran Sellberg och Annika Adolfsson Joseph John Thomson 1856-1940 Upptäckte elektroner 1897 Nobelpriset 1906 Göran Sellberg och Annika Adolfsson Ernest Rutherford Atomen har en positivt laddad kärna Elektronerna bildar ett hölje Göran Sellberg och Annika Adolfsson James Chadwick Upptäckte neutronen 1932 Fick Nobelpriset i fysik 1935 Göran Sellberg och Annika Adolfsson Niels Bohr Dansk fysiker Nobelpriset 1922 för sin modell av atomen (Bohr-modellen) Förbättrade Rutherfords teori - elektronskal Göran Sellberg och Annika Adolfsson Atomens byggnad Består av tre olika partiklar (elementarpartiklar) Protoner laddning +1 Neutroner ingen laddning 0 Elektroner laddning -1 Göran Sellberg och Annika Adolfsson Var finns vad? Atomkärnan Protoner (+1) Neutroner (0) Atom kärna Höljet (skalen, molnet) Elektroner (-1) Göran Sellberg och Annika Adolfsson Atomen är neutral I en atom finns alltid lika många protoner (plusladdade) som elektroner (minusladdade). Atomen är alltså elektriskt neutral. Göran Sellberg och Annika Adolfsson Atomnummer Antalet protoner bestämmer vilket ämne det är. Väte har 1 proton Helium har 2 protoner Antalet protoner kallas atomnummer Göran Sellberg och Annika Adolfsson 92U Atomnummer 6 C Atomnumret är antalet protoner i kärnan. Varje grundämne har ett eget antal protoner. Elektronerna ska vara lika många som protonerna i en atom. Atomnummer = antalet protoner = antalet elektroner. 24 Mg Masstal 20 Ne Masstalet är summan av neutroner och protoner i atomen. Antalet neutroner kan vara olika hos varje grundämne. Atomer av samma grundämne men med olika antal neutroner Göran Sellberg och Annika Adolfsson kallas isotoper Atommassa Atommassan = Summan av protonernas och neutronernas massa i en atom. Eftersom antalet neutroner är olika i ett grundämnes isotoper så är g.rundämnets atommassa = medelvärdet av isotopernas atommassa Göran Sellberg och Annika Adolfsson Isotoper Antalet neutroner kan variera hos varje grundämne. Vissa isotoper är radioaktiva exempelvis kol-14 14 Vätets isotoper C 6 1 1 H 2 1 H Göran Sellberg och Annika Adolfsson 3 1 H Atommassa i praktiken Alla grundämnen har flera isotoper 12 Kol består t.ex. till 99 % av 6C 13 och till 1 % av 6C Den genomsnittliga massan hos ett stort antal kolatomer är därför 12,01 g Göran Sellberg och Annika Adolfsson Atommassa i praktiken Klor består till 75 % av 37 och till 25 % av Cl 35 17 Cl 17 Atommassan för Cl är 0,75 35 g + 0,25 37 g = 35,5 g x x Göran Sellberg och Annika Adolfsson Atommassa 600 000 000 000 000 000 000 000 väteatomer (6x1023 st) väger 1 gram Gram är alltså ingen praktisk enhet här! Enhet för atommassa är u= unit 1 atom 12C väger 12 u Göran Sellberg och Annika Adolfsson Formelmassa En väteatom väger 1 u En syreatom väger 16 u Vad väger en vattenmolekyl? Svar: 2 x 1 + 16 = 18 u (2 väteatomer + en syreatom) Vattnets formelmassa är 18 u. Göran Sellberg och Annika Adolfsson Mol När man väger används mol. Massan av 6 x 1023 atomer kallas 1 mol. 1 mol kol= 6 x 1023 kolatomer=12 g 1 mol järn= 6 x 1023 järnatomer=55,8 g Göran Sellberg och Annika Adolfsson Bohrs atommodell Elektronerna kan bara finnas i vissa bestämda banor eller skal runt kärnan Det ryms bara ett visst antal elektroner i varje skal Det innersta skalet kallas K-skalet sedan kommer Lskalet, M-skalet o.s.v. K-skalet rymmer 2 eL-skalet rymmer 8 eM-skalet rymmer 18 eN-skalet rymmer 32 eo.s.v. (Formeln är 2n2) Göran Sellberg och Annika Adolfsson Elektroner Elektronerna bestämmer de kemiska egenskaperna: De visar varför vissa ämnen reagerar med varandra. De visar varför vissa ämnen liknar varandra. Göran Sellberg och Annika Adolfsson Valenselektroner Innersta skalet (K-skalet) har som mest 2 elektroner. De andra skalen kan ha som mest 8 elektroner om de är det yttersta skalet. Elektronerna i yttersta skalet kallas för valenselektroner. Förutom i K-skalet strävar alla atomer att ha 8 elektroner i sitt yttersta skal. Göran Sellberg och Annika Adolfsson Heliumatomen Väteatomen Kolatomen Göran Sellberg och Annika Adolfsson Syreatomen Att rita en atom enligt Bohrs atommodell masstal 16 atomnummer 8 O Antal neutroner = masstal – atomnummer Dvs 16 – 8 = 8 Göran Sellberg och Annika Adolfsson