Periodiska systemet
advertisement

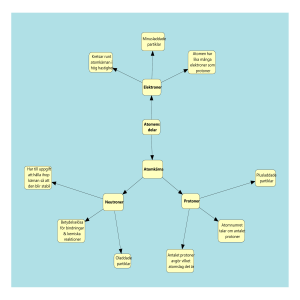
Periodiska systemet • • • • • Historia Atomens byggnad Periodiska systemet Jonbindning Molekylbindning Historia Sex män Demokritos Dalton Joseph John Thomson Ernest Rutherford James Chadwick Niels Bohr 400-t f.kr. Odelbar • 1700-t • Massiva kulor Joseph John Thomson 1856-1940 Upptäckte elektroner 1897 Nobelpriset 1906 Ernest Rutherford Atomen har en positivt laddad kärna Elektronerna bildar ett hölje James Chadwick Upptäckte neutronen 1932 Fick Nobelpriset i fysik 1935 Niels Bohr Dansk fysiker Nobelpriset 1922 för sin modell av atomen (Bohr-atomen) Förbättrade Rutherfords teori Atomens byggnad Består av tre olika partiklar (elementarpartiklar) Protoner laddning +1 Neutroner ingen laddning 0 Elektroner laddning -1 Var finns vad? Atomkärnan Protoner (+1) Neutroner (0) Atom kärna Elektronhöljet Elektroner (-1) 92U Atomnummer 6 C Atomnumret är antalet protoner i kärnan. Varje grundämne har ett eget antal protoner. Elektronerna ska vara lika många som protonerna i en atom. Atomnummer = antalet protoner = antalet elektroner. 24 Mg Masstal 20 Ne Masstalet är summan av neutroner och protoner i atomen. Antalet neutroner kan vara olika hos varje grundämne. Atomer av samma grundämne men med olika antal neutroner kallas isotoper Atommassa Atommassan = Summan av protonernas och neutronernas massa i en atom. Eftersom antalet neutroner är olika i ett grundämnes isotoper så är grundämnets atommassa = medelvärdet av isotopernas atommassa Isotoper Antalet neutroner kan variera hos varje grundämne. Vissa isotoper är radioaktiva exempelvis kol-14 14 Vätets isotoper C 6 1 1 H 2 1 H 3 1 H Molmassa i praktiken Alla grundämnen har flera isotoper 12 Kol består t.ex. till 99 % av 6C 13 och till 1 % av 6C Den genomsnittliga massan hos ett stort antal kolatomer är därför 12,01 g 13 Sellberg 2011 Molmassa i praktiken Klor består till 75 % av 37 och till 25 % av Cl 35 17 Cl 17 Atommassan för Cl är 0,75 35 g + 0,25 37 g = 35,5 g x x Sellberg 2011 14 Formelmassa Formeln för en kemisk förening talar om vilka atomer som finns i molekylen och hur den är uppbyggd. Formelmassan berättar vad molekylen väger. Så här räknar du ut formelmassan. Använd dig av ett periodiskt system H2O 2 x 1,01 + 16,0 = 18,02 u NH3 14,0 + 3 x 1,01 = 17,03 u De olika skalen K, L, M o.s.v. Max 2 elektroner i det innersta Sedan max 8, 18, 32 o.s.v. (Formeln är 2n2) K L M Elektroner Elektronerna bestämmer de kemiska egenskaperna: De visar varför vissa ämnen reagerar med varandra. De visar varför vissa ämnen liknar varandra. Sellberg 2011 17 Valenselektroner Innersta skalet (k skalet) har som mest 2 elektroner. De andra skalen kan ha som mest 8 elektroner om de är det yttersta skalet. Elektronerna i yttersta skalet kallas för valenselektroner. Förutom i k-skalet strävar alla atomer att ha 8 elektroner i sitt yttersta skal. Bohrs atommodell Elektronerna kan bara finnas i vissa bestämda banor eller skal runt kärnan Det ryms bara ett visst antal elektroner i varje skal Det innersta skalet kallas K-skalet sedan kommer Lskalet, M-skalet o.s.v. K-skalet rymmer 2 eL-skalet rymmer 8 eM-skalet rymmer 18 eN-skalet rymmer 32 eo.s.v. Sellberg 2011 19 Heliumatomen Väteatomen Kolatomen Syreatomen Grupp Period Liknande ämnen under varandra Mendelejev försökte gruppera ämnena så att de som liknar varandra också kommer nära varandra för att se om han kunde hitta något system H He Li Be B C N O F Ne NaMg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn GaGe As Se Br Kr Rb Sr Y Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg La Ce Pr NdPmSmEu Gd Tb Dy Ho Er TmYb Lu Ac Th Pa U Np PuAmCmBk Cf EsFmMdNo Lr Sellberg 2011 22 Ädelgaser -Reagerar inte med andra ämnen He Ne Ar Kr Xe Rn Sellberg 2011 23 Ädelgaser nr 2, helium, He, har ett fullt K-skal (2 st) nr 10, neon, Ne, har ett fullt K-skal (2) och ett fullt L-skal (8 st) alla övriga har 8 i sina yttersta skal detta gör dem stabila He Ne Ar Kr Xe Rn 2 10 18 36 54 86 2 2+8 2+8+8 2+8+18+8 2+8+18+18+8 2+8+18+32+18+8 Sellberg 2011 24 Alkalimetaller -tappar gärna en elektron... H Li Na K Rb Cs Fr Sellberg 2011 25 ...och bildar en positiv jon H Li Na K Rb Cs 1 3 11 19 37 55 1 2+1 2+8+1 2+8+8+1 2+8+18+8+1 2+8+18+18+8+1 Alla har en ensam elektron i det yttersta skalet. genom att bli av med den får de 8 elektroner i sina yttersta skal. Na Na e K K+ + eSellberg 2011 26 Vissa släpper två elektroner Be Mg Ca Sr Ba Ra Sellberg 2011 27 ...och får två elektroner mindre än antalet protoner i kärnan Be Mg Ca Sr Ba Ra 4 12 20 38 56 88 2+2 2+8+2 2+8+8+2 2+8+18+8+2 2+8+18+18+8+2 2+8+18+32+18+8+2 Alla har två ensamma elektroner i det yttersta skalet de här ämnena bildar gärna tvåvärda positiva joner Ca Ca 2 2e Sellberg 2011 28 Halogenerna tar upp en elektron F Cl Br I At Sellberg 2011 29 för att få ett fullt yttersta skal Genom att ta upp en elektron får halogenerna ett ”fullt” yttersta skal Samtidigt får de förstås en negativ laddning för mycket: de bildar en negativ jon Sellberg 2011 F Cl Br I 9 17 35 53 2+7 2+8+7 2+8+18+7 2+8+18+18+7 Cl e Cl 30 Elektronerna bestämmer egenskaperna H He Li Be B C N O F Ne NaMg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn GaGe As Se Br Kr Rb Sr Y Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg La Ce Pr NdPmSmEu Gd Tb Dy Ho Er TmYb Lu Ac Th Pa U Np PuAmCmBk Cf EsFmMdNo Lr Sellberg 2011 31 Metaller och icke-metaller Lila=metaller blå=halvmetaller gul= ickemetaller H He Li Be B C N O F Ne NaMg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn GaGe As Se Br Kr Rb Sr Y Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg La Ce Pr NdPmSmEu Gd Tb Dy Ho Er TmYb Lu Ac Th Pa U Np PuAmCmBk Cf EsFmMdNo Lr Sellberg 2011 32 Vid rumstemperatur Vit=fast ämne blå=flytande turkos=gas H He Li Be B C N O F Ne NaMg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn GaGe As Se Br Kr Rb Sr Y Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg La Ce Pr NdPmSmEu Gd Tb Dy Ho Er TmYb Lu Ac Th Pa U Np PuAmCmBk Cf EsFmMdNo Lr Sellberg 2011 33 Ädelgasstruktur Ädelgasstruktur är när yttersta skalet är fullt, dvs. 8 elektroner (förutom k-skalets 2 elektroner). Detta har grupp nr 8 i periodiska systemet (dvs. helium, neon, argon). Alla andra grundämnen eftersträvar ädelgasstruktur, vilket de får genom att ge eller ta elektroner. Detta medför att alla ämnen i grupp 1 vill ge en elektron och alla ämnen i grupp i grupp 7 vill ta en elektron. Detta medför att de helst vill vara i jonform POSITIVA JONER En atom med en valenselektron i sitt yttersta skal avger gärna denna för att få yttersta skalet fullt. Ex: Natrium Natriumatom Na Natriumjon Na + NEGATIVA JONER Ämnen med 7 valenselektroner tar lätt upp en elektron. Ämnen med 6 tar upp 2 elektroner . O.s.v. . Ex: Fluor + Fluor arom F Fluorjon F- JONFÖRENINGAR Jonbindning Förening mellan metall och ickemetall som hålls ihop av elektriska krafter. (Olika laddningar dras mot varandra) Ex. Natriumklorid, NaCl Na+ + Cl - • Dessa föreningar kallas salter • Bildar kristaller • Löses upp i vattenlösningar och i smälta NaCl Joner bygger kristaller Cl- Na+ Molekylföreningar Molekylbindning I molekylbindningar delar två atomer på ett eller flera elektronpar och på så vis får 8 valenselektroner