Kemi - Leteboskolan
advertisement

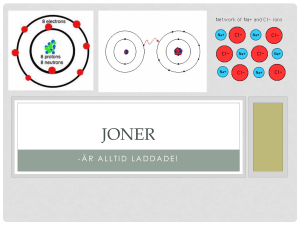
Kemisk Bindning Allt i vår värld är upp byggt av ATOMER ATOMENS BYGGNAD Kärna Positiva Protoner Neutrala Neutroner Runt om Negativa Elektroner ATOMENS SKAL K L L-skal högst 2 eK-skal högst 8 eM-skal högst 8 e- ( om det är ytterst) M Antal e- = antal protoner = atomnummer ex. Kol = 6C Natrium = 11Na Valenselektroner = Det elektroner i atomens yttersta skal kallas Ädelgasstruktur = Att atomens yttersta skal är fullt (nöjd atom). Så de atomer som saknar elektroner för att få sitt yttersta skal fullt vill gärna ta upp elektroner. De som har få valenselektroner gör sig gärna av med dem så de får fullt skal. K O 8 Mg 12 17Cl 6C 20Ca L 2 6 2 2 2 2 8 8 4 8 M N 2 7 8 2 Hur många elektroner vill atomerna ha? • • • • • Syre Magnesium Klor Kol Kalcium 7 MOLEKYLFÖRENINGAR Molekyler kan bildas så att elektroner delas mellan atomer. De vill ju känna att deras yttersta skal är fullt! Ex Vätemolekylen H2 H H2 Genom att slå sig ihop får bägge atomerna sitt yttersta skal fullt = ädelgasstruktur. Detta kallas elektronparbindning eller kovalent bindning. Molekylföreningar • Nästa exempel är Kol. Kol vill ha fyra extra elektroner för att få ett fullt yttre skal. Då reagerar kol med väte (4st) och får ett fullt skal samtidigt som väte också får ett fullt skal. Metan (CH4) 9 MOLEKYLFÖRENINGAR Ex Vattenmolekylen H2 O Vatten och väte delar två elektroner. Det blir till en enkelbindning. MOLEKYLFÖRENINGAR • ex. koldioxidmolekylen CO2. Se att kol i mitten har åtta elektroner och det har syre till höger och vänster oxå. • Kol och syre delar fyra elektroner med varandra och därför så blir det en dubbelbindning. En ganska stark bindning. 11 MOLEKYLFÖRENINGAR • Sista exemplet är kväve som är den gas atmosfären består mest av. Kväve delar 6 elektroner med varandra och det krävs 2 elektroner för en bindning. Alltså blir det tre bindningar. Det blir väldigt starkt och därför så reagerar inte kväve nästan inte alls med andra ämnen. 12 POSITIVA JONER En atom med en valenselektron i sitt yttersta skal avger gärna denna för att få yttersta skalet fullt. Ex: Natrium Natriumatom Na Natriumjon Na + NEGATIVA JONER Ämnen med 7 valenselektroner tar lätt upp en elektron. Ämnen med 6 tar upp 2 elektroner . O.s.v. . Ex: Fluor + Fluor arom F Fluorjon F- JONFÖRENINGAR Förening mellan metall och ickemetall som hålls ihop av elektriska krafter. (Olika laddningar dras mot varandra) Ex Na+ + Cl - NaCl Den positiva jonen i regel en metall , annars är det väte. Salter är jonföreningar. Då du löser upp ett salt delar det upp sig i joner. Ex. vanligt koksalt NaCl löser upp sig i jonerna Na + och Cl - Cl Na + Kemiska egenskaper • En saltlösning har egenskapen att den kan leda ström. • Saltvatten fryser även till is vid en lägre temperatur än sötvatten. Att molekyler och kemiska föreningar har olika egenskaper beror på elektronerna. 17 Kemiska egenskaper fortsättning I stort sett alla ämnen kan antingen vara flytande vätskor, gaser eller fasta och hårda. Men i princip kan oxå alla ämnen kan också ändra form. Koldioxid (CO2) Smältpunkt: -78 grader Kväve (N2) Smältpunkt: -210 grader, Kokpunkt -196 grader Vatten (H2O) Smältpunkt 0 grader, Kokpunkt 100 grader 18 PERIODISKA SYSTEMET En tabell med alla grundämnen indelade efter egenskaper. Vi kommer att gå igenom en del av hur det är uppbyggt. Kallas för period Kallas för en grupp PERIODISKA SYSTEMET Lodrätt = GRUPPER Alla har lika många valenselektroner i yttersta skal. Grupp 1 har 1 valens eGrupp 2 har 2 valens eGrupp 17 har 7 valens eGrupp 18 har 8 valens e- PERIODISKA SYSTEMET Vågrätt = PERIOD Alla i en period har lika många skal. Helium Period 1 Period 1 har 1 skal. Period 2 Period 2 har 2 skal. GRUNDÄMNESFAMILJER Grundämnen i samma grupp har liknande egenskaper . Dessa kallas en grundämnesfamilj Grupp 1 Alkalimetallerna ( Väte undantaget) Ex Litium ,Natrium Egenskaper Reagerar lätt - Vill gärna lämna ifrån sig sin valenselektron. Bildar +1 joner. Ex. Litium Grupp 17 Halogener Ex Klor Fluor Brom Jod Egenskaper Bildar lätt föreningar med andra ämnen. Vill gärna ta upp en elektron och fylla sitt yttersta skal . Bildar -1 joner Ex. Klor -bleker & är bakteriedödande Fluor - Bra för tänderna Grupp 18 Ädelgaser Egenskaper Har sitt yttersta skal fullt = mycket stabila. Vill inte reagera. Ex Helium -i ballonger . Argon - I glödlampor så glödtråden ej ska brinna av . Neon - i färgade lysrör.