Tentamen med svarsmallar Biokemi BI1032, 12:e jan 2012, 0915
advertisement

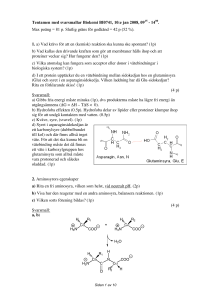
Tentamen med svarsmallar Biokemi BI1032, 12:e jan 2012, 0915 - 1400. Max poäng = 100 p. Slutliga betygsgränser: 3 = 54p; 4 = 70p; 5 = 85p. 1. a) Vilka är de 6 vanligaste grundämnena (atomslagen) i levande organismer? (1.5p) b) Vilka av dessa atomslag är mest respektive minst elektronegativa? (1p) c) Vilka atomslag brukar fungera som acceptor eller donor i vätebindningar i biologiska system? (1p) d) Ange de tre olika typer av icke-kovalenta bindningar som förekommer i proteiner och andra makromolekyler, i ordning från starkast till svagast (för ett bindningsavstånd i vattenlösning på 3.5 Å) (1.5p) (5 p) Svarsmall: a) De 6 vanligaste grundämnena (atomslagen) är H,C,N,O,P,S. (6x0.25p=1.5p) b) O är mest och H och C är minst elektronegativa. (1p) c) O,N,(S) brukar fungera som acceptor eller donor i vätebindningar. (1p) d) Elektrostatisk interaktion/saltbrygga/jon-par-bindning > Vätebindning > van der Waals-interaktion (1.5p) 2. a) Ange minst tre typer av funktioner som proteiner kan ha i och utanför celler. (3p) b) Proteiners struktur kan beskrivas i fyra nivåer: primär, sekundär, tertiär och kvartenär. Förklara vad som avses med respektive begrepp. (4p) c) Aminosyrorna Cys, Gly och Pro har speciella egenskaper som är betydelsefulla för strukturen hos det veckade proteinet. Ange för var och en av dessa tre aminosyror vilken egenskap och vilken strukturell funktion aminosyran ofta har i proteiner. (3p) (10 p) Svarsmall: a) Minst tre av följande: enzymer/katalysera kemiska reaktioner; transport (t.ex. hemoglobin, myoglobin); reglering (hormoner, inflammatoriska cytokiner); receptorer; struktur (keratin, elastin, kollagen); försvar (antikroppar, immunoglobulin); motorproteiner (aktin och myosin i muskler); membrankanaler, pumpar. Max 3 p. b) Primärstruktur är aminosyrasekvensen (1p). Sekundärstruktur bildas när avsnitt av polypeptidkedjan veckar ihop sig med regelbundna vätebindingar i sekundärstruktur-elementen alfa-helix, beta-sträng, betaböj (1p). Tertiärstruktur beskriver hela polypeptidkedjans veckning, hur sekundärstrukturelement och sidokedjor är packade (1p). Kvartenärstruktur beskriver hur olika subenheter sitter ihop i ett oligomert protein/proteinkomplex (1p). c) Cystein (Cys) kan para ihop sig och bilda disulfidbryggor (0.5p) som binder ihop olika delar av polypeptidkedjan och stabiliserar proteinets tertiär-struktur (0.5p). Glycin (Gly) har ingen egentlig sidokedja utan bara väte på alfa-kolet vilket ger större vridbarhet runt alfa-kolet (phi och psi-vinklarna) (0.5p). Gly sitter ofta där det är trångt (där större sidokedja inte får plats) eller där det behövs en kraftig böj i huvudkedjan (0.5p). Prolin (Pro) har en sidokedja som är kovalent bunden till peptidkvävet så att den bildar en ringstruktur där phi-vinkeln är fixerad och inte kan rotera (0.5p). Detta ger minskad flexibilitet och stabilisering av huvudkedjan (0.5p). Prolin passar inte i alfaSidan 1 av 9 helix och hindrar dess bildning. Pro kan fungera som "helix-brytare" i änden av en helix och förekommer ofta i böjar tillsammans med Gly. 3. Du har fått i uppgift att rena ett cellulas (cellulosanedbrytande enzym) från ett extrakt från svampen Aspergilllus niger vilken är en organsim som ofta används vid framställning av enzymer och andra biologiska substanser. Du har fått veta att den isoelektriska punkten för cellulaset är 4.2 och att molekylvikten är 90 000 Da. a) Du tänker dig att som ett första reningssteg prova jonbyteskromatografi. Vilka principer bygger metoden på? Beskriv också kortfattat hur du kan utföra ett sådant experiment i proteinreningssammanhang. (2p) b) På en hylla i labbet hittar du en jonbytarsubstans med en negativt laddad ligand. Tror du att proteinet cellulas kommer att binda till denna jonbytare vid pH 7.0? Förklara kortfattat. (1p) c) I experimentet med jonbytaren samlar du fraktioner och för att se om provrören möjligen innehåller protein så mäter du absorbansen vid 280 nm. Varför? (1p) d) För att kontrollera renheten analyserar du ditt cellulas med hjälp av elektrofores på en s.k. SDS-polyakrylamidgel. SDS är en s.k. anjonisk detergent, vilken funktion har den i detta sammanhang? (1p) (5 p) Svarsmall: a) I jonbyteskromatografi utnyttjar man förmågan hos laddade molekyler, i detta fall proteiner, att binda reversibelt till immobiliserade laddade grupper. Beroende på proteinets laddning vilket i sin tur beror av pH så väljer man positivt eller negativt laddade ligander. (1p) Ett experiment kan gå till så att man packar en kolonn med önskad jonbytare och jämviktar denna i en buffert med låg jonstyrka och lämpligt pH. Provet appliceras och kolonnen tvättas i ett första steg med bufferten med låg jonstyrka så att obundet material får möjlighet att passera genom kolonnen. Därefter kan bundet material elueras genom att jonstyrkan höjs eller pH ändras. (1p) b) Ett protein som befinner sig vid ett pH ovanför sin isoelektriska punkt bör få en negativ nettoladdning. Cellulas med isoelektriska punkten 4.2 bör alltså få en negativ nettoladdning och sålunda INTE binda till den aktuella jonbytaren. (1p) c) Proteiner absorberar ultraviolett ljus med ett maximum vid 280 nm. Den främsta orsaken till det är att de innehåller aminosyror med aromatiska ringar som absorberar ljus vid denna våglängd. (1p) d) Upphettad SDS binder till proteiner och bryter icke-kovalenta bindningar (t.ex. väte-bindningar) vilket gör att proteinet denatureras (0.5p) och samtidigt får en negativ nettoladdning som är proportionell mot dess massa (0.5p). 4. a) Hur många kodon (1p) och nukleotider (1p) behöver avläsas för att bilda ett protein som är uppbyggt av 233 aminosyror? b) Varför kan man förutsäga ett proteins aminosyrasekvens om man känner genens nukleotidsekvens, men ej bestämma en gens nukleotidsekvens om man känner proteinets aminosyrasekvens? (2p) (4 p) Svarsmall: a) Ett protein som består av 233 aminosyror behöver 233 kodon (1p) som består av 699 nukleotider (1p). Sidan 2 av 9 b) Varje kodon i gensekvensen svarar mot en enda aminosyra (1p), därför kan vi förutsäga proteinets sekvens från gensekvensen. Däremot så finns det mer än ett kodon för de flesta aminosyrorna (1p), dvs. flera alternativa sekvenser är möjliga. 5. Vad kallas a) den region av DNA som sitter framför en gen och reglerar dess transkription (1p), b) de DNA-element/regioner som kodar för (avläses till) hela proteinsekvensen (gäller för både pro- och eukaryoter och kodoner avses ej) (1p), c) den sekvens i tRNA som basparar med kodonet i mRNA (1p)? (3 p) Svarsmall: a) Promotorn (1p) sitter framför genen och styr dess transkription. b) Open reading frame/öppen läsram (1p) innehåller informationen för vilka aminosyror som proteinet innehåller. c) Antikodonet (1p) i tRNA basparar med kodonet i mRNA. 6. Du ligerar in din favoritgen i en plasmid varefter du transformerar in plasmiden i E. coli. a) Vad tillsätter du till odlingsmediet för att bara E. coli-celler som innehåller plasmiden skall överleva (1p)? b) Vad på plasmiden gör att celler som innehåller plasmiden överlever (1p)? (2 p) Svarsmall: a) Antibiotika (1p) tillsätts för att döda plasmidfria bakterier. b) Plasmiderna innehåller gen för antibiotikaresistens (1p) som motverkar den tillsatta antibiotikans funkion. 7. Hemoglobin. a) Vilken prostetisk grupp finns i hemoglobin? (1p) b) Syre binder till en metalljon i denna grupp. Vilken metalljon? (1p) c) Beskriv kortfattat vad positiv kooperativitet innebär, hur det uppkommer hos hemoglobin och vad mekanismen kallas. (3 p) d) Myoglobin är mycket likt hemoglobin, men uppvisar inte positiv kooperativitet i binding av syre. Varför? (1p) (6 p) Svarsmall: a) Hemoglobin har heme/hem/häm som prostetisk grupp (1p). b) Syret binder till en järnjon som sitter i heme-gruppen (1p). c) Positiv kooperativitet innebär att affiniteteten (bindningsstyrkan) för syre ökar med ökad koncentration av syre (1p). Hemoglobin består av fyra subenheter. De kan anta två olika former, en som binder syre starkt (R) och en som binder svagare (T). Bindingen mellan subenheterna styr dem att anta samma form. När syre binds till en av subenheterna så stabiliseras R-formen, även hos de andra subenheterna, så att de lättare binder syre (1p). Mekanismen kallas för allosteri (1p). d) Myoglobin består bara av en subenhet (1p). 8. Enzymet E som följer Michaelis-Menten-kinetik har Km = 40 µM (mikromolar). Initiala reaktionshastigheten v0 är 20 µM/min (mikromolar/minut) vid en Sidan 3 av 9 substratkoncentration på 20 mM (millimolar) och enzymkoncentrationen [E]tot 2 nM (nanomolar). Vad blir den initiala hastigheten v0 a) om vi dubblar substratkoncentrationen vid samma enzymkoncentration, [S] = 40 mM (millimolar)? (1p) b) om substratkoncentrationen [S] är 40 µM (mikromolar) vid samma enzymkoncentration? (1p) c) om substratkoncentrationen [S] är 10 µM (mikromolar) vid samma enzymkoncentration? (1p) d) om vi istället dubblar enzymkoncentrationen vid samma substratkoncentration, ([S] = 20 mM, [E]tot = 4 nM)? (1p) e) Hur påverkar enzymets Km respektive kcat förhållandet mellan koncentrationerna av substrat och produkt vid jämvikt? (1p) (5p) Svarsmall: När [S] = 20 mM gäller [S] >> Km (substratkonc är mycket större än Km), och alltså är v0 ≈ Vmax = 20 µM/min a) v0 = 20 µM/min (1p). För varje substratkoncentration större än 20 mM gäller fortfarande att v0 ≈ Vmax = 20 µM/min. b) v0 = 10 µM/min (1p). När [S] = Km gäller att v0 = Vmax/2 , dvs. 10 µM/min. c) v0 = 4 µM/min (1p). Eftersom Km och Vmax är kända, kan Michaelis-Menten ekvationen användas för att beräkna v0 vid varje substratkoncentration: v0 = Vmax [S] / ( Km + [S] ). För [S] = 10 µM gäller: v0 = (20 µM/min) (10 µM) / (40 µM + 10 µM) = 200/50 µM/min = 4 µM/min. d) v0 = 40 µM/min (1p). Hastigheten är proportionell mot enzymkoncentrationen. Dubbelt så hög enzymkoncentration ger dubbel hastighet. e) Inte alls (1p). Förhållandet mellan koncentrationerna av substrat och produkt vid jämvikt bestäms av den termodynamiska skillnaden i fri energi mellan substrat och produkt, medan Km och kcat är uttryck för förhållanden mellan hastighetskonstanter. 9. Enzymatiska processer är reglerade för att de ska ske vid rätt tid och på rätt plats. Genom kontroll av genuttryck, dvs hur ofta en gen läses, bestäms hur många molekyler som bildas av ett visst enzym. Dessutom kan aktiviteten hos enskilda enzymmolekyler regleras med olika mekanismer. De tre viktigaste är: a) Alloster reglering b) Protein-fosforylering c) Proteolytisk aktivering. Beskriv kortfattat för var och en hur den fungerar och ange om den är reversibel eller irreversibel (2p för varje korrekt svar). d) Vilka steg i en metabolisk väg brukar vara reglerade? (1p) (7 p) Svarsmall: a) Alloster reglering. Allosteriska enzymer har flera substrabindingställen och består oftast av flera subeneheter. De kan ändra konformation mellan mer och mindre aktiv form. Den reglerande molekylen binder på särskild regulatorisk plats i enzymet och stabiliserar den ena formen. Allosteriska inhibitorer förskjuter jämvikten mot mindre aktiv form, medan allosteriska aktivatorer förskjuter jämvikten mot mer aktiv form (1.5p). Reversibel (0.5p). b) Fosforylering. Genom att sätta på (kinaser) och plocka bort (fosfataser) fosfatgrupper kan enzymets aktivitet påverkas (1.5p). Reversibel (0.5p). c) Proteolytisk aktivering. Enzymet syntetiseras som ett inaktivt proenzym (zymogen) Sidan 4 av 9 och blir aktivt först när en del av peptidkedjan hydrolyserats/klyvts av ett proteas/peptidas (1.5p). Irreversibel (0.5p). d) Metaboliskt irreversibla steg brukar regleras, dvs reaktioner som frigör mycket energi. Många förbrukar ATP. (1p) 10. a) Ange rätt namn på lipidmolekylerna nedan, av följande: 1) Kolesterol; 2) Fosfolipid; 3) Triacylglycerol; 4) Sphingolipid. (2p) b) Vilken av dessa lipider finns INTE i biologiska membran (1p)? (3p) Lipidmolekyl Namn A 4) Sphingolipid B 3) Triacylglycerol C 2) Fosfolipid D 1) Kolesterol Svarsmall: a) A = 4) Sphingolipid; B = 3) Triacylglycerol; C = 2) Fosfolipid; D = 1) Kolesterol (2p) b) Triacylglycerol finns inte i biologiska membran (1p) 11. När hormonet Adrenalin (epinephrine) binder till ett receptorprotein i cellers membran induceras en respons inuti cellen, som innefattar aktivering av enzymet adenylylcyklas till att syntetisera cykliskt AMP. Signalen överförs via s.k. G-proteinaktivering. a) Hur är G-protein-komplexet uppbyggt (när inget hormon binds till receptorn)? (1p) b) Hur aktiveras adenylylcyklas av G-protein-komplexet, när det stimulerande hormonet bundit till receptorproteinet i membranet? (2p) c) Vilken mekanism i G-proteinets alfa-subenhet stänger av signaleringen? (1p) (4 p) Sidan 5 av 9 Svarsmall: a) G-protein består av 3 subenheter, α, β, γ, som bildar ett trimert komplex och binder till receptorn i viloläge (när inget stimulerande hormon är bundet) (1p) b) När ett stimulerande hormon binder till receptorn induceras en konformationsförändring som gör att GDP byts ut till GTP (1p) i alfasubenheten (Gα). Gα dissocierar från trimera komplexet och från membranreceptorn, och binder istället till adenylylcyklas (1p) som därmed aktiveras. c) GTP hydrolyseras långsamt till GDP i Gα-proteinet (1p). Då lossnar Gα från adenylylcyklas och produktionen av cAMP stannar. Ga associerar med β och γ till trimert komplex som återigen kan binda till ett receptor-protein. 12. Hur tar kroppen hand om den mjölksyra (laktakt) som bildas i muskler vid kraftig fysisk aktivitet när syre inte räcker till? (3 p) Svarsmall: Mjölksyra (laktat) transporteras till levern (1p). Där omvandlas laktat till glukos via glukoneogenesen (1p). Därpå transporteras nybildat glukos tillbaka till musklerna (Cori cykeln) (1p). 13. a) Var i cellen sker citronsyracykelns reaktioner? (1p) b) Vilken enzymatisk reaktion länkar glykolysen till citronsyracykeln? (1p) c) Beskriv förenklat vad citronsyracykeln gör, dess nettoreaktion. Vilka produkter har bildats efter ett varv? (2p) (4 p) Svarsmall: a) Citronsyracykelns reaktioner äger rum i mitokondriens matrix. (1p) b) Oxidativ dekarboxylering av pyruvat till acetyl-CoA (1p), som katalyseras av PDH-komplexet. c) En tvåkolskropp i acetyl-CoA omvandlas till CO2 (1p) Produkter: CO2 + NADH + FADH2 el QH2 + ATP el GTP (+ H+ + CoA) (1p) 14. Oxidativ fosforylering. a) Vad driver det ATP-syntetiserande enzymet? (1p) b) Vad innebär frikoppling av andningskedjan och vilken naturlig funktion har den i brun fettväv, som bl.a. förekommer hos nyfödda djur? (2p) (3 p) Svarsmall: Sidan 6 av 9 a) Proton-gradienten (skillnad i pH och laddning) över mitokondriens inner-membran driver det s.k. F1-ATPaset (1p) b) Protoner som pumpats ut av andningkedjan släpps tillbaka genom membranet utan syntes av ATP. Protongradienten över membranet förstörs, så att ATP inte bildas (1p) utan energin frigörs i form av värme. Naturlig funktion är att producera värme (1p). 15. Flera grisar i en besättning, som utfodrats med mögelangripet foder, har dött. De har visat symptom, som liknar cyanid förgiftning. Man misstänker att de förgiftats genom ett mykotoxin (mögelgift), som förmodas ha verkat på andningskjedjan. Mykotoxinet har extraherats från fodret och koncentrerats i en fysiologisk lösning. Beskriv kortfattat hur du skulle gå tillväga (utifrån dina kunskaper från biokemikursen) för att experimentellt visa om och hur mykotoxinet stör andningskjedjan. Alla nödvändiga ingredienser (apparatur, substrat, mm) och tillvägagångssätt måste anges samt tolkning av resultatet efter tillsats av respektive substans. (10 p) Svarsmall: Motsvarande laborationen oxidativ fosforylering. Till en suspensionen innehållande mitokondrier (1p), buffert, substrat (glutatmat, NADH) (1 p) och ADP (eller ADP-genererande system) (1p). Förändring i syrgaskonsumtion registreras (1p). Tillsätt en liten del av mykotoxin lösningen. Ökar eller inhiberas inte syrgas konsumtionen, så är mykotoxinet inte en inhibitor av andningskjedjan. Om den ökar kan toxinet vara en frikopplare. (1p) Om inhibering sker tillsätts nästa substrat (Succinat (FADH2)(1p) Om syrgaskonsumtionen ökar efter tillsatts av succinat sker inhiberingen vid Komplex 1 (1p). Om andningen inte ökar tillsätts askorbat/TMPD (1p). Om andningen ökat vid tillsatts av askorbat/TMPD sker inhibering vid komplex 3. (1p) Om ingen ökning av syrgas-konsumtionen sker inhiberas överföringen av elektroner från komplex 4 till O2. (1p) 16. a) Vilka två produkter från pentosfosfatshunten anses som viktigast och vad används de till i cellen? (4p) b) Nämn minst två vävnader där pentosfosfatshunten har hög aktivitet? (2p) (6 p) Svarsmall: a) NADPH (1p) används som reduktionsmedel (elektrodonator) i anaboliska (uppbyggande) vägar (ofta vid biosyntes, t.ex. fettsyra syntes) (1p). Ribos-5-fosfat (1p) används som byggsten för syntes av nukleotider till RNA och DNA (1p). b) Pentosfosfatshunten har hög aktivitet i fettväv, lever, mjölkkörtlar, binjure, testikel, ovarie och röda blodkroppar (2p). 17. Varför kan inte det glykogen som finns lagrat i skelettmusklerna användas av andra vävnader? Jämför med glykogen-utnyttjandet i levern. (2 p) Svarsmall: Sidan 7 av 9 Till skillnad mot leverceller har muskelcellerna ingen möjlighet att defosforylera glukos-6-fosfat eftersom muskelcellerna saknar enzymet glukos-6-fosfatas. Muskeln använder därför sitt upplagrade glykogenförråd själv. (2p) 18. a) Vid vissa situationer ökar koncentrationen av ketonkroppar i blodet även hos friska människor. När, var, varför och hur produceras dessa ketonkroppar? (4p) b) Till vad används ketonkroppar och av vilka organ (ange minst 2)? (3p) (7 p) Svarsmall: a) Ketonkroppar produceras exempelvis vid svält (både korttid och långvarig svält) (1p). Ketonkropparna bildas i levern (1p) då fettsyrorna från fettdepåerna bryts ned via beta-oxidationen till acetyl-CoA. Eftersom behovet av glukos är högt prioriterar levern att producera glukos (via glukoneogenesen) vilket leder till oxaloacetatbrist (1p). Eftersom oxaloacetat finns i begränsad omfattning kommer 2 stycken molekyler av acetyl-CoA att kondensera och bilda acetoacetyl-CoA och så småningom bilda acetoacetat (ketonkropp) (1p). b) Ketonkropparna används till energi (1p). De används med fördel i skelettmuskeln, hjärtmuskel och njure, men även av hjärnan efter en längre tids svältperiod för att spara på glukosanvändningen. (2p) 19. a) Vad menas med glukogena respektive ketogena aminosyror? (2p) b) Hur använder kroppen ett överskott av aminosyror (exempelvis vid proteinrik diet)? (1p) c) Var i kroppen sker den huvudsakliga nedbrytningen av överskott av aminosyror? (1p) (4 p) Svarsmall: a) Ketogena aminosyror bryts ner till acetyl-CoA eller till acetoacetyl-CoA (1p). ”Rena” ketogena aminosyror kan inte användas till nettosyntes av glukos. Glukogena aminosyror bryts ned till intermediärer som kan användas till glukossyntes i glukoneogenesen (1p). b) Vid ett överskott av aminosyror används kolskeletten till produktion av energi. (1p) c) Överskott av aminosyror bryts ned mest i levern. (1p) 20. Fotosyntes a) I vilken organell och var i organellen sker fotosyntesens ljusreaktion hos växter? (1p) b) Vad heter det viktigaste ljusinfångande ämnet hos växter? (1p) c) Från vilket ämne tas elektronerna till elektrontransporten vid icke-cyklisk fotofosforylering? (1p) d) Tre huvudsakliga produkter bildas vid ”normal” (icke-cyklisk) fotofosforylering. Vilka? (3p) e) Vilken produkt bildas vid cyklisk fotofosforylering? (1p) (7 p) Sidan 8 av 9 Svarsmall: a) Fotosyntesen sker i kloroplasternas (0.5p) tylakoidmembran (0.5p). b) Klorofyll (1p). c) Från vatten (1p). d) Syrgas/O2 (1p), ATP (1p) och NADPH (1p) bildas vid icke-cyklisk fotofosforylering. e) ATP (1p) bildas vid cyklisk fotofosforylering, men inte syrgas eller NADPH. Fotosystem 2 kopplas bort och elektroner som exciterats av Fotosystem 1 transporteras av ferredoxin till Cytokrom bf som lämnar dem till plastocyanin samtidigt som protoner pumpas över membranet. Plastocyanin lämnar sedan tillbaka elektronerna till Fotosystem 1, se skiss. Det bildas en Cyklisk fotofosforylering protongradient som driver syntes av ATP, men det bildas inte NADPH (till skillnad från icke-cyklisk fotofosforylering). Cyklisk fotofosforylering förekommer därför att växten behöver mer ATP än NADPH. Sidan 9 av 9