Tentamen med svarsmallar Biokemi BI1032, 14:e jan 2010, 09
advertisement

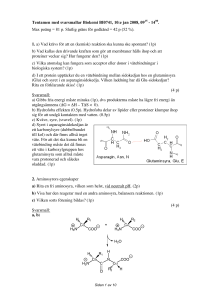
Tentamen med svarsmallar Biokemi BI1032, 14:e jan 2010, 0915 - 1500. Max poäng = 100 p. Betygsgränser: 3 = 50%; 4 = 68%; 5 = 84%. 1. a) Vilka är de 6 vanligaste grundämnena (atomslagen) i levande organismer? (1.5p) b) Vilka av dessa atomslag är mest respektive minst elektronegativa? (1p) c) Vilka atomslag brukar fungera som acceptor eller donor i vätebindningar i biologiska system? (1p) d) Ange de tre olika typer av icke-kovalenta bindningar som förekommer i proteiner och andra makromolekyler, i ordning från starkast till svagast (för ett bindningsavstånd i vattenlösning på 3.5 Å) (1.5p) (5 p) Svarsmall: a) De 6 vanligaste grundämnena (atomslagen) är H,C,N,O,P,S. (6x0.25p=1.5p) b) O är mest och H och C är minst elektronegativa. (1p) c) O,N,(S) brukar fungera som acceptor eller donor i vätebindningar. (1p) d) Elektrostatisk interaktion/saltbrygga/jon-par-bindning > Vätebindning > van der Waals-interaktion (1.5p) 2. Utan biologiska membran skulle inget liv kunna existera. a) Beskriv med en enkel skiss uppbyggnaden av ett biologiskt membran. (1p) b) Vad kallas den drivande kraften som gör att membraner hålls ihop (och som gör att proteiner veckar sig) (1p)? Hur fungerar den (1p)? c) Ge två exempel på energialstrande processer där biologiska membran är av central betydelse. (1p) (4 p) Svarsmall: a) Membranfigur: Dubbellager, hydrofila huvuden utåt, hydrofoba svansar inåt (1p). b) Hydrofoba effekten (1p). Hydrofoba delar av t.ex. lipider eller proteiner klumpar ihop sig med varandra för att undgå kontakt med vatten (1p). c) Membranet har en central betydelse vid oxidativ fosforylering (0.5p) och vid fotosyntes (0.5p). 3. Nedan visas kemiska formler för de två aminosyrorna Glycin och Lysin, tillsammans med typiska pKa värden för deras joniserbara grupper. NH3+ (CH2)4 + H3N-CH2-COO- +H Glycin (Gly, G) pKa(N-term) = 9.0 pKa(C-term) = 2.5 3N CH COO- Lysin (Lys, K) pKa(N-term) = 9.0 pKa(C-term) = 2.5 pKa(Lys) = 10.8 Sidan 1 av 10 a) Rita dipeptiden Gly-Lys vid pH 7. Markera alfa-kol, huvudkedja, sidokedjor, peptidbinding, N-terminal och C-terminal. (3p) b) Vilken nettoladdning har dipeptiden vid pH 7? Varför! (1p) c) Vilken nettoladdning har dipeptiden vid pH 12? Varför! (1p) (5 p) Svarsmall: a) b) Vid pH 7 är N- och C- terminal laddade (pKaN-term = 9.0, pKaC-term = 2.5), dessa laddningar tar ut varandra. Nettoladdningen beror sedan på sidokedjorna. Vid pH 7 är lysin protonerad (positivt laddad)( pKaLys = 10.8) och glycin oladdad. => Nettoladdningen = +1 c) Vid pH 12 är N- terminal oprotonerad (oladdad), C- terminal oprotonerad (negativt laddad), lysin oprotonerad (oladdad) och glycin oladdad. => Nettoladdningen = -1 NH2 H2N H2 C C H N (CH2)4 CH COO- O 4. När man beskriver ett proteins struktur talar man om primär-, sekundär-, tertiäroch kvartenär struktur. a) Vilka är de (två) viktigaste typerna av sekundärstruktur i proteiner? Beskriv hur de ser ut! (2p) b) Sekundärstruktur stabiliseras framför allt av en speciell typ av bindning. Vilken bindning och mellan vilka atomer i polypeptidkedjan? (2p) c) Definiera och förklara begreppen tertiär- och kvarternär struktur. (2p) (6 p) Svarsmall: a) Alfa-helix (0.5p) och beta-sträng/beta-flak (0.5p). I alfa-helix veckas peptidkedjan till en högervriden helix, (0.5p) medan en betasträng är en fullständigt utdragen peptid, där strängarna bildar flak (0.5p). b) Sekundärstruktur stabiliseras av vätebindningar (1p) mellan karbonylsyre (0.5p) i en peptidbinding och amidkväve (alt. amidväte) (0.5p) i en annan peptidbindning. c) Tertiärstruktur = rumsligt arrangemang av alla atomer i en polypeptidkedja (även aminosyror som ligger långt ifrån varandra i aminosyraskvensen), dvs. hur hela peptidkedjan veckar sig i tre dimensioner. (1p) Kvarternärstruktur = rumsligt arrangemang av monomerer/subenheter i ett oligomert protein. (1p) 5. Du arbetar med ett nytt protein kallat Z och en av dina arbetskamrater har bestämt molekylvikten på detta med hjälp av gelfiltrering. Du tycker emellertid inte hans data är riktigt pålitliga och vill göra ett kontrollexperiment. För detta måste du rena fram Z Sidan 2 av 10 och befinner dig nu i slutstadiet av reningsprocessen där du måste bli av med ett par andra förorenande proteiner (A och B) i din blandning. Tidigare analyser har visat att Z, A och B har följande isoelektriska punkter: Protein Z A B Isoelektrisk punkt 5.4 8.2 8.8 a) Du bestämmer dig för att köra en jonbyteskromatografikolonn. Beskriv principen för den metoden och hur du i detta specifika fall skulle kunna göra för att isolera Z. (2 p) b) När Z är renframställt bestämmer du aminosyrasekvensen för protein Z och finner att det består av 223 aminosyror. En annan av dina kollegor tror sig veta att man från detta teoretiskt även kan beräkna den ungefärliga molekylvikten men är lite osäker på hur man gör och kommer därför upp med flera förslag: 25.000 Dalton, 100.000 Dalton eller 250.000 Dalton. Du får hjälpa henne, vilken av de beräknade molekylvikterna är troligen rätt? Motivera svaret! (2 p) c) Nämn ytterligare två metoder som du kan använda för att bestämma molekylvikten hos ditt protein. Tillsammans ger dessa metoder också information om huruvida proteinet har eventuella subenheter. Förklara kortfattat hur. (3 p) d) Du fortsätter dina studier av Z och upptäcker att proteinet kan binda till ribos. Skulle du kunna utnyttja det separationstekniskt? Motivera kortfattat. (1 p) (8 p) Svarsmall: a) I jonbyteskromatografi utnyttjar man förmågan hos molekyler att binda reversibelt till immobiliserade laddade grupper. Beroende på proteinets laddning vilket i sin tur beror av pH väljer man positivt eller negativt laddade ligander. (1 p) I detta fall bör du använda en anjonbytare d.v.s. en separationsgel som är positivt laddad vid pH ~7 för att binda Z som bör bli negativt laddat vid neutralt pH. Z kan senare kan eleueras från kolonnen med t.ex. NaCl alternativt kan du eluera med pHförändring. (1 p) b) 25.000 Dalton (1p) då varje aminosyra i genomsnitt väger c:a 110 Dalton (1p). c) Du kan köra en gelfiltreringskolonn (1p) (storleksseparation) och med hjälp av standardproteiner få en uppfattning om nativ dvs. icke-denaturerad molekylvikt. På motsvarande sätt kan en SDS-Polyakrylamidgelelektrofores (SDS-PAGE) (1p) ge den denaturerade molekylvikten för ditt protein. Genom att jämföra dessa värden kan man få en uppfattning om proteinet förekommer i en multimer form. (1p) Exempel: Om SDS-PAGE:n ger molekylvikten x för ditt protein och gelfiltreringen molekylvikten 2x så antyder det att proteinet är en dimer. d) Konstruera en affinitetsgel till vilken ribos irreversibelt binds. Därefter kan man packa en kolonn med denna gel som vidare används för att binda upp/rena Z. 6. a) Definiera och beskriv kortfattat de tre stegen i molekylärbiologins "centrala dogma", flödet av den genetiska informationen. (3p) b) Varför kan man förutsäga ett proteins aminosyrasekvens om man känner genens nukleotidsekvens, men ej bestämma en gens nukleotidsekvens om man känner proteinets aminosyrasekvens? (2p) (5 p) Svarsmall: Sidan 3 av 10 a) DNA -> DNA = replikering (0.5p). DNA kopieras genom att varje kedja bildar mall för komplementär kopiering (0.5p). DNA -> RNA = transkription (0.5p). Vissa delar av DNA kopieras till RNA. En kedja i DNA är mall för komplementär kopiering (0.5p). RNA -> protein = translation (0.5p). mRNA används som mall för syntesen av protein på ribosomen (0.5p). För varje aminosyra som inkorporeras i proteinet passas tre baser i mRNA (kodonet) ihop med antikodonet på den tRNA-molekylen som för in aminosyran till peptidsyntesen. b) Varje kodon i gensekvensen svarar mot en enda aminosyra (1p), därför kan vi förutsäga proteinets sekvens från gensekvensen. Däremot så finns det mer än ett kodon för de flesta aminosyrorna (1p), dvs. flera alternativa sekvenser är möjliga. 7. Här följer en rad påståenden. Markera vid varje påstående om du anser det vara sant eller falskt. OBS – läs varje påstående noggrant (0.5p/rätt). 1) Promotor kallas den DNA-sekvens dit RNA-polymeraset binder. 2) Ribosomen kopplar ihop aminosyror i rätt ordning genom att avläsa informationen i mRNA. 3) tRNA bär med sig aminosyror vilka ribosomen länkar ihop till ett protein. 4) Öppen läsram (Open Reading Frame) innehåller information som bestämmer vilka aminosyror proteinet kommer att innehålla. 5) Ett kodon som avläses till aminosyran alanin i djur avläses till aminosyran prolin i bakterier. 6) DNA-polymeras replikerar RNA till DNA. (3 p) Svarsmall: 1 – sant, 2 – sant, 3 – sant, 4 – sant, 5 – falskt, 6 – falskt 8. PCR tekniken har revolutionerat molekylärbiologin. a) Vilka komponenter (förutom buffert, vatten och PCR maskin) behövs för en fungerande PCR, d.v.s. vad behöver ni tillsätta till PCR röret (2p)? b) Antag att ni med hjälp av PCR vill amplifiera (göra fler kopior av) en specifik gen och att ni utgår från en kopia av genen – hur många kopior har ni efter 2 respektive 4 PCR cykler? (Med cykel avses t.ex. 45 sekunder vid 95 oC, 1 minut vid 55 oC samt 1 minut vid 72 oC) (1p) (3 p) Svarsmall: a) För en lyckad PCR reaktion behövs DNA polymeras/Taq polymeras (0.5p), DNA som skall amplifieras (0.5p), 2 primers/korta oligonukleotider (som binder i båda ändar till det DNA som skall amplifieras) (0.5p) samt dNTPs/deoxynukleotider (dATP, dGTP, dCTP och dTTP). (0.5p) b) Eftersom PCR amplifierar DNA exponentiellt kan ni efter 2 cykler ha 4 gener (0.5p) och efter 4 cykler ha 16 gener (0.5p). 9. Enzymet E som följer Michaelis-Menten-kinetik har Km = 30 μM (mikromolar). Initiala reaktionshastigheten v0 är 10 μM/min (mikromolar/minut) vid en substratkoncentration på 20 mM (millimolar) och enzymkoncentrationen [E]tot 3 nM (nanomolar). Vad blir den initiala hastigheten v0 Sidan 4 av 10 a) om vi dubblar substratkoncentrationen vid samma enzymkoncentration, [S] = 40 mM (millimolar)? (1p) b) om substratkoncentrationen [S] är 30 μM (mikromolar) vid samma enzymkoncentration? (1p) c) om substratkoncentrationen [S] är 10 μM (mikromolar) vid samma enzymkoncentration? (1p) d) om vi istället dubblar enzymkoncentrationen vid samma substratkoncentration, ([S] = 20 mM, [E]tot = 6 nM)? (1p) e) Hur påverkar enzymets Km respektive kcat förhållandet mellan koncentrationerna av substrat och produkt vid jämvikt? (1p) (5p) Svarsmall: När [S] = 20 mM gäller [S] >> Km (substratkonc är mycket större än Km), och alltså är v0 Vmax = 10 μM/min a) v0 = 10 μM/min (1p). För varje substratkoncentration större än 20 mM gäller fortfarande att v0 Vmax = 10 μM/min. b) v0 = 5 μM/min (1p). När [S] = Km gäller att v0 = Vmax/2 , dvs. 5 μM/min. c) v0 = 2.5 μM/min (1p). Eftersom Km och Vmax är kända, kan Michaelis-Menten ekvationen användas för att beräkna v0 vid varje substratkoncentration: v0 = Vmax [S] / ( Km + [S] ). För [S] = 10 μM gäller: v0 = (10 μM/min) (10 μM) / (30 μM + 10 μM) = 100/40 μM/min = 2.5 μM/min. d) v0 = 20 μM/min (1p). Hastigheten är proportionell mot enzymkoncentrationen. Dubbelt så hög enzymkoncentration ger dubbel hastighet. e) Inte alls (1p). Förhållandet mellan koncentrationerna av substrat och produkt vid jämvikt bestäms av den termodynamiska skillnaden i fri energi mellan substrat och produkt, medan Km och kcat är uttryck för förhållanden mellan hastighetskonstanter. 10. Enzymatiska processer är reglerade för att de ska ske vid rätt tid och på rätt plats. Genom kontroll av genuttryck, dvs hur ofta en gen läses, bestäms hur många molekyler som bildas av ett visst enzym. Dessutom kan aktiviteten hos enskilda enzymmolekyler regleras med olika mekanismer. De tre viktigaste är: a) Alloster reglering b) Protein-fosforylering c) Proteolytisk aktivering. Beskriv kortfattat för var och en hur den fungerar och ange om den är reversibel eller irreversibel (2p för varje korrekt svar). d) Vilka steg i en metabolisk väg brukar vara reglerade? (1p) (7 p) Svarsmall: a) Alloster reglering. Den reglerande molekylen binder på särskild regulatorisk plats i enzymet och påverkar aktiviteten genom konformationsförändringar i aktiva ytan (1.5p). Oftast oligomera proteiner. Reversibel (0.5p). b) Fosforylering. Genom att sätta på (kinaser) och plocka bort (fosfataser) fosfatgrupper kan enzymets aktivitet påverkas (1.5p). Reversibel (0.5p). c) Proteolytisk aktivering. Enzymet syntetiseras som ett inaktivt proenzym (zymogen) och blir aktivt först när en del av peptidkedjan hydrolyserats/klyvts av ett proteas/peptidas (1.5p). Irreversibel (0.5p). d) Metaboliskt irreversibla steg brukar regleras, dvs reaktioner som frigör mycket Sidan 5 av 10 energi. (1p) 11. Kanaler, pumpar, signalöverföring: a) Vad är skillnaden mellan aktiv och passiv transport av små molekyler genom lipidmembraner? (1p) b) Vid hormonell kontroll och i många sinnesceller sker signalöverföring med 7TMreceptorer, G-proteiner och adenylatcyklas. Rita schematiskt hur proteinerna är organiserade vid cellmembranet, och beskriv kortfattat hur en signal produceras av receptor, trimert G-protein och adenylatcyklas? Hur sker signalförstärkningen i denna kedja? Vad kallas den typen av signalförstärkning? (3p) (4 p) Svarsmall: a) Aktiv transport sker över/genom ett membran mot en koncentrationsgradient (koncentrationen m.a.p. den typ av molekyl som skall transporteras) och kräver energi (0.5p). Passiv transport sker med en koncentrationsgradient, dvs koncentrationsutjämnande, och utnyttjar den lagrade energin i gradienten (0.5p). c) Korrekt skiss med 7TM-receptor integrerad i membranet, med G-protein bunden på insidan bestående av alfa, beta, gamma-subenheter, och adenylatcyklas integralt i membranet (0.5p). Aktivering av en receptor, t.ex. genom binding av epinefrin (adrenalin) leder till en förändring på insidan av membranet som aktiverar G-proteinet (0.5p). Den aktiverade receptorn fungerar som en G-nukleotidutbytare vilket medför att G-proteiner byter ut GDP mot GTP (0.5p) när alfasubenheten dissocieras från betagamma-subenheterna och kan röra sig längs membranet. Den aktiva alfasubenheten med GTP kan genom att binda till adenylatcyklas göra detta enzym aktivt varvid cAMP bildas (0.5p). Ökad mängd cAMP sätter igång flera olika processer i cellen, t.ex. aktiverar proteinkinas A. Vid varje steg kan flera molekyler aktiveras vilket åstadkommer en förstärkning. Varje receptor aktiverar flera G-proteiner, varje G-protein aktiverar flera adenylatcyklaser osv. (0.5p). Det kallas kaskadeffekt (0.5p). 12. Det har i massmedia framkommit misstankar om att ett speciellt vin kan ha innehållit cyanid eller något annat gift med snarlik funktion. Minst en person har uppvisat allvarliga symptom efter att ha konsumerat vinet. Beskriv kortfattat hur du skulle gå tillväga (utifrån dina kunskaper från biokemikursen) för att experimentellt påvisa om det finns höga halter av de misstänkta toxiska substanser i vinet. Alla nödvändiga ingredienser (apparatur, substrat, mm) och tillvägagångssätt måste anges samt tolkning av resultatet efter tillsats av respektive substans. Vilken metabolisk ”pathway” är det som påverkas och varför är cyanidförgiftning så allvarligt? (10 p) Sidan 6 av 10 Svarsmall: Motsvande laborationen oxidativ fosforylering. Till en suspensionen innehållande mitokondrier (1p), buffert, substrat (glutatmat, NADH) (1p) och ADP (eller ADP-genererande system) (1p) tillsätts en liten del vin. Förändring i syrgaskonsumtion registreras (1p). Om inhibering sker tillsätts nästa substrat (Succinat (FADH2)(1p) Om syrgaskonsumtionen ökat efter tillsatts av succinat sker inhiberingen vid Komplex 1 (1p). Om andningen inte ökar tillsätts askorbat/TMPD (1p). Om andningen ökat vid tillsatts av askorbat/TMPD sker inhibering vid komplex 3. (1p) Om ingen ökning av syrgas-konsumtionen sker inhiberas överföringen av elektroner från komplex 4 till O2. (1p) Cyannid blockerar överföringen av elektroner mellan komplex 4 och syre (den slutliga elektronacceptorn) vilket medför att det inte finns något energisubstrat som kan utnyttjas, jämför med rotenon som blockerar längre upp i andningskedjan. (1p) 13. a) Varför måste celler bilda etanol (jäst) eller laktat (mjölksyra; djurceller) vid glykolys under anaeroba förhållanden? (3p) b) Hur många mol ATP bildas netto vid anaerob nedbrytning av 1 mol glukos? (1p) (4 p) Svarsmall: a) I glykolysen reduceras NAD+ till NADH (1p) av glyceraldehyd-3-fosfatdehydrogenas. För att glykolysen ska kunna fortgå kontinuerligt måste NADH oxideras tillbaka till NAD+ (1p). I närvaro av syrgas så sker oxideringen i oxidativa fosforyleringen som förbrukar/kräver syre. Under anaeroba förhållanden så oxideras istället NADH till NAD+ genom att pyruvat reduceras till laktat eller till etanol (via acetaldehyd) (1p). b) Glykolysen ger 2 mol ATP per mol glukos (1p) 14. Vilka reaktioner katalyserar följande nyckelenzymer. Ange substrat och produkt (formel behöver ej anges) a) Hekokinas b) Pyruvatdehydrogenas-komplexet (PDH) c) Isocitrat-dehydrogenas d) Fosfofruktokinas e) Glykogenfosforylas f) Glukos-6-fosfatas (6 p) Svarsmall: a) glukos glukos-6-fosfat (hexokinas) b) pyruvat Acetyl CoA (PDH-komplex) c) isocitrat alfa-ketoglutarat (isocitrat-dehydrogenas) d) fruktos-6-fosfat fruktos-1,6-bisfosfat (fosfofruktokinas) e) glykogen glukos-1-fosfat (glykogenfosforylas) f) glukos-6-fosfat glukos (glukos-6-fosfatas) Sidan 7 av 10 15. Ange tre olika utgångssubstrat som används för glukoneogenes. (3 p) Svarsmall: Glycerol, laktat och aminosyror. (3p) 16. Inför vintern lägger de flesta djur upp ett reservförråd av energi i form av fett. Hur mycket mer energi i form av ATP-ekvivalenter erhålls då en mol palmitinsyra (C16:0) oxideras jämfört med en mol glukos. Endast den energi som erhålls i citronsyracykeln och via oxidativ fosforylering skall redovisas (inga tidigare steg). I citronsyracykeln genereras 3 NADH, 1 FADH2 och en GTP per varv. Visa hur du har räknat. (3 p) Svarsmall: Vid förbränning av 1 mol glukos erhålls 2 mol acetyl CoA Vid förbränning av palmitinsyra erhålls 8 mol acetyl CoA 3 NADH= 3x2.5= 7.5 ATP 1 FADH2= 1x1.5 =1.5 ATP 1 GTP =1x1= 1 ATP Summa :10 ATP per acetyl CoA 1 mol Glukos = 20 ATP (1p) 1 mol stearinsyra = 80 ATP (1p) Dvs. Från citronsyracykeln och oxidativ fosforylering utvinns 4 gånger mer energi från stearinsyra jmf. med glukos. (1p) 17. Vid fysisk ansträngning används stora mängder av ATP av skelettmusklerna. För att tillgodose musklernas energibehov används olika substrat för produktion av ATP beroende på den fysiska aktivitetens varaktighet. Markera i figuren nedan vilka substrat som används (1.5p) och ange om de används vid aerob eller anaerob metabolism (1.5p). (3 p) Svarsmall: Punktlinje: kreatinfosfat (0.5p), anaerob (0.5p) Streckad: glukos (0.5p), anaerob (0.5p) Streckad med punkt: fettsyror (0.5p), aerob (0.5) Sidan 8 av 10 18. a) Vid vissa situationer ökar koncentrationen av ketonkroppar i blodet även hos friska människor. När, var, varför och hur produceras dessa ketonkroppar? (4p) b) Till vad används ketonkroppar och av vilka organ (ange minst 2)? (3p) (7 p) Svarsmall: a) Ketonkroppar produceras exempelvis vid svält (både korttid och långvarig svält) (1p). Ketonkropparna bildas i levern (1p) då fettsyrorna från fettdepåerna bryts ned via beta-oxidationen till acetyl-CoA. Eftersom behovet av glukos är högt prioriterar levern att producera glukos (via glukoneogenesen) vilket leder till oxaloacetatbrist (1p). Eftersom oxaloacetat finns i begränsad omfattning kommer 2 stycken molekyler av acetyl-CoA att kondensera och bilda acetoacetyl-CoA och så småningom bilda acetoacetat (ketonkropp) (1p). b) Ketonkropparna används till energi (1p). De används med fördel i skelettmuskeln, hjärtmuskel och njure, men även av hjärnan efter en längre tids svältperiod för att spara på glukosanvändningen. (2p) 19. a) Vilka två produkter från pentosfosfatshunten anses som viktigast? (2p) b) Ge förslag på vad dessa två produkter används till i cellen? (2p) (4 p) Svarsmall: a) NADPH och ribos-5-fosfat (2p). b) NADPH används vid reduktiva processer (ofta vid biosyntes exempelvis fettsyra syntes). Ribos-5-fosfat används som byggsten för syntes av (nukleotider), RNA och DNA. (2p) Sidan 9 av 10 20. Fotosyntes a) I vilken organell och var i organellen sker fotosyntesens ljusreaktion hos växter? (1p) b) Vad heter det viktigaste ljusinfångande ämnet hos växter? (1p) c) Från vilket ämne tas elektronerna till elektrontransporten vid icke-cyklisk fotofosforylering? (1p) d) Vilket ämne är den slutliga elektron-mottagaren vid icke-cyklisk fotofosforylering? (1p) e) I vilken organell och var i organellen sker fotosyntetisk kolfixering (mörker-reaktion, Calvincykeln) hos växter? (1p) (5 p) Svarsmall: a) Fotosyntesen sker i kloroplasternas tylakoidmembran (1p). b) Klorofyll (1p). c) Från vatten (1p). d) NADP+ (1p). e) Fotosyntesens mörkerreaktion sker i kloroplasternas stroma (1p). Sidan 10 av 10