Fråga: Hur fungerar proteolytisk aktivering
advertisement

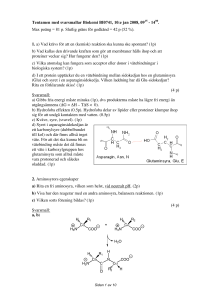
Frågor och svar till ordinarie tentamen för KE7001 period 4 (Biokemi, 10p) 2005-06-02 Totalpoäng: 70 p (24 frågor) Preliminär gräns för G: 37 p (53%) Fråga 1: Komplettera nedanstående dipeptid vid fysiologiskt pH. Ange R1 och R2 som sidokedjor. Markera phi och psi vinklarna med pilar på en av aminosyrorna. Markera även peptidbinding. Cα Cα (3p) Svarsmall: Rätt formel 1p, rätt laddningar 0.5p och 0.5p för varje korrekt vinkel. För rätt formel och peptidbindning se bild 3.18 i kursboken. Vid fysiologiskt pH, ca 7-7,5, då är både N-terminal och C-terminal joniserade (se samma bild). Phi och psi är rotations-vinklarna på vardera sidan om alfakolet (phi mellan N och C-alfa). Fråga 2: Sekundärstrukturelement har karatäristiska vätebindningsmönster. a) Mellan vilka atomer i huvudkedjan bildas vätebindningarna (0.5p)? b) Beskriv hur du, genom att titta på vätebindningsmönstret, kan skilja mellan parallella och antiparllella β-strängar (1p). c) Hur långt är det typiskt mellan donor och acceptor i en vätebindning (0.5p)? d) Vilken aminosyra kan inte delta i bildandet av vätebindning? Varför? (1p) (3p) Svarsmall: a) karbonylsyret och amidens väte C=O---H-N (0.5p) b) Antiparallella strängar har raka vätebindningar (0.5p), parvis. De parllella har snedställda, och därmed något längre, vätebindningar (0.5p), jämnt fördelade. c) 2.4-3.5 Å (0.5p) (2.7-3.2 Å vanligast) d) Prolin (0.5p) kan ej delta i bildandet av vätebindning därför att det inte finns något fritt amid-väte (0.5p) som hos de andra aminosyrorna. Sidokedjan binder tillbaka på kvävet i huvudkedjan. Fråga 3: Du intresserar dig för nukleotidmetabolismen i cellen och har isolerat ett ATP-bindande enzym som du vill undersöka närmare. a) Du vill rena ditt enzym på ett enkelt sätt. Hur kan du utnyttja det faktum att det binder ATP i detta sammanhang? (1 p) b) Det ATP-bindande enzymet visar sig ha en isoelektriskt punkt på 5,1. Vilken nettoladdning bör det då ha vid pH 7,0? (1p) c) Vid analys av enzymets storlek med hjälp av gelfiltering finner du att molekylvikten är c:a 50 kDa. Vidare kör du en SDS–polyakrylamidgelelektrofores 1 (SDS-PAGE) och finner då att proteinet vandrar som ett band men en molekylvikt på 25 kDa. Ge en möjlig förklaring till resultatet. (1 p) (3 p) Svarsmall: a) Tillverka en affinitetsgel/kolonn till vilken ATP bundits som ligand. Denna kan sedan användas för att binda upp ditt ATP-bindande enzym. (1 p) b) Vid pH 7,0 bör enzymet ha en negativ nettoladdning. (1p) c) Enzymet är troligen en dimer av två stycken likadana subenheter. Varje subenhet väger 25 kDa. (1p) (Resultatet från gelfiltreringen ger information om proteinets nativa molekylvikt, SDS-PAGE ger denaturerad molekylvikt och sålunda information om eventuell substruktur hos proteinet). Fråga 4: Hur fungerar proteolytisk aktivering? Ge två exempel på viktiga biokemiska processer som regleras genom proteolytisk aktivering. (3p) Svarsmall: Proteolytisk aktivering sker genom enzymkatalyserad hydrolys (klyvning) (0.5p) av (en eller några) peptidbindingar i icke-aktiva prekursorer som kallas zymogener eller proenzymer (0.5p). Klyvningen leder till konformationsförändringar som i sin tur leder till att den aktiva ytan formas (1p). Exempel: aktiveringen av matsmältningsenzymer (0.5p) som trypsin, eller av enzymerna i blodlevringskaskaden (0.5p). Fråga 5: Enzymet E som följer Michaelis-Menten-kinetik har ett Km på 1µM (mikromolar). Initiala hastigheten är 0.1 µM/min (mikromolar/min) vid en substratkoncentration på 1000 µM (mikromolar). Vad är den initiala hastigheten när [S] är lika med a) 2 mM (millimolar) (1p) b) 1 µM (mikromolar) (1p) c) 3 µM (mikromolar)? (1p) (3p) Svarsmall: När [S] = 1000 µM så gäller [S] >> Km, och alltså är v0 = Vmax = 0.1 µM/min a) för varje substratkoncentration större än 1000 µM , v0 = Vmax = 0.1 µ M/min (1p) b) [S] = Km så v0 = Vmax/2 , eller 0.05 µM/min (1p) c) Eftersom Km och Vmax är kända, kan Michaelis-Menten ekvationen användas för att beräkna v0 vid varje substratkoncentration. v0 = Vmax [S] / ( Km + [S] ) För [S] = 3 µM, v0 = (0.1 µM/min) (3 µM) / (1 µM + 3 µM) = = 0.3/4 µM/min = = 0.075 µM/min (1p) Fråga 6: Vad krävs för att en (kemisk) reaktion ska kunna ske spontant? (1p) 2 Svarsmall: Gibbs fria energi måste minska (1p), dvs produkterna måste ha lägre fri energi än utgångsämnena (∆G = ∆H – T∆S < 0). Fråga 7: Redogör med hjälp av den s.k. transition state teorin hur enzymer accelererar kemiska reaktioner (för full poäng krävs både text och förklarande figur(er)!). (3p) Svarsmall: Korrekt figur med S, P, TS, aktiveringsenergi markerade ger 1p. Hos (de flesta) enzymer finns en ficka (aktiv yta, eng ”active site”) där den reaktion som katalyseras sker. Fickan är specifikt konstruerad för att binda till substrat och de övergångsformer som passeras på vägen till produkt(er). Genom att fickan är konstruerad så att den binder starkast till övergångsformer (”transition states”) stabiliseras dessa mer än t.ex. substrat och produkter (1p). ”Puckeln” mellan substrat och produkt i energidiagrammet – som motsvarar aktiveringsenergin – blir då lägre och då sker det fler reaktioner per tidsenhet, d.v.s. reaktionen går snabbare (1p). Aktiveringsenergi Fråga 8: En del enzymer kräver ytterligare funktionella enheter än de aminosyror som ingår i polypeptidkedjan, s.k. coenzymer. Människor och högre djur saknar förmågan att själva syntetetisera många av de coenzymer som behövs. Istället måste vi få dem i oss via födan. De flesta essentiella ämnen som kallas vitaminer är prekursorer för sådana coenzymer. a) Ett coenzym kan fungera som cosubstrat eller prostetisk grupp. Vad är skillnaden? b) Vitaminet niacin (nikotinsyra) behövs till ett coenzym, vilket (förkortning är OK)? I vilken typ av reaktioner ingår detta coenzym och vilken funktion har det i cellen? c) Vitamin B2, riboflavin, behövs till ett annat coenzym, vilket (förkortning är OK)? Detta coenzym deltar i liknande reaktioner och har liknande funktion, men har en förmåga som ovanstående coenzym saknar. Vilken? (5p) Svarsmall: a) Ett cosubstrat lämnar enzymet efter reaktionen (0.5p) och en ny molekyl kan komma i dess ställe. Cosubstratet regenereas av ett annat enzym nån annanstans. En prostetisk grupp däremot sitter normalt bunden till enzymet hela tiden (0.5p) och måste regenereras på plats innan enzymet kan katalysera en ny reaktion. b) Niacin görs om till nikotinamid som ingår i NAD+ (Nikotinamid-AdeninDinukleotid) NADH, NADP+ och NADPH (1p, en räcker), som ingår i redoxreaktioner (oxidationer och reduktioner) och tar emot eller avger elektroner. Fungerar som elektronbärare (1p) och reduktionsmedel i cellen. c) Riboflavin behövs till FAD (Flavin-Adenin-Dinukleotid) och FMN (1p, en räcker). Ingår liksom NAD+/NADH i oxidationer och reduktioner och kan ta emot och avge två elektroner, men kan också ta emot och avge en elektron i taget (1p). 3 Fråga 9: Vilken huvudsaklig funktion har var och en av dessa kolhydrater i levande organismer: a) Glukos. b) Glykogen. c) Deoxyribos. d) Cellulosa. (2p) Svarsmall: a) Glukos används som energikälla (0.5p). b) Glykogen används för lagring av energi (0.5p). c) Deoxyribos ingår som byggsten i ryggraden hos DNA (0.5p). d) Cellulosa ger struktur och styrka åt växters cellväggar (0.5p). Fråga 10: Hur kan evolutionära samband påvisas med hjälp av aminosyrekvensen och av proteiners struktur? (2p) Svarsmall: Evolutionära samband visar sig i sekvenser som bevarat viktiga grupper för struktur och funtion (1p). Likheter i tredimensionell struktur kan bero på evolutionära samband (1p). Fråga 11: Vilken rörlighet har lipider och membranproteiner i ett membran? (2p) Svarsmall: Lipider rör sig i varje skikt av membranet, som i en två-dimensionell lösning (0.5), Utbyten mellan de båda membranskikten sker huvudsakligen inte (0.5p). Även vissa proteiner rör sig i membranet (0.5p) medan andra proteiner är fästa (0.5p). Fråga 12: I vilka processer medverkar G-proteiner. Namnet G-protein kommer av de molekyler som binder till proteinet i processen. Vilken av dessa molekyler binder i det aktiverade G-proteinet? (1.5p) Svarsmall: Vid signalöverföring över membran (1p). GTP (0.5p) (Aktivering av en receptor, t.ex. genom binding av epinefrin (adrenalin) leder till en förändring på insidan av membranet som aktiverar trimert G-protein. Den aktiverade receptorn fungerar som en G-nukleotidutbytare vilket medför att G-proteiner byter ut GDP mot GTP. Den GTP-aktiverade subenheten stimulerar vidare bildandet av cAMP). Fråga 13: Den aktiverade G-proteinsubenheten stimulerar bildandet av cAMP. Ökad mängd cAMP sätter igång flera olika processer i cellen, t.ex. aktiveras proteinkinaser och proteinfosfataser. Beskriv funktionen av proteinkinas och proteinfosfatas. Hur kan dessa enzymer påverka aktiviteten hos metaboliska processer? (3p) Svarsmall: Proteinkinas fosforylerar proteiner (1p) och proteinfosfataser tar bort fosfatgrupper från proteiner (1p). Fosforyleringer avgör om proteinet är aktivt eller inte (0.5p). Vissa proteiner är aktiva med fosfatgrupp, andra är inaktiva med fosfatgrupp (0.5p). Fråga 14: De funktionella enheterna i en skelettmuskel kallas för sarkomerer vilka huvudsakligen är uppbyggda av tunna (aktin) och tjocka (myosin) filament. Vid muskelkontraktion sker en förkortning av muskeln genom att dessa filament dras in i varandra. Detta sker med hjälp av motorproteiner som finns i en av filamenttyperna. 4 a) Ange vilken av de två filamentproteinerna, angivna ovan, som innehåller motormolekylerna? b) Vilken molekyl hydrolyseras av motorproteinerna för drift av kontraktionen? c) Vilket grundämne reglerar muskelkontraktionen? (2p) 2+ Svarsmall: a) Myosin (0.5p), b) ATP (0.5p), c) Ca (1p) Fråga 15: Vid ett friidrottspass uppmättes mjölksyrahalten i blodet, före under och efter ett 400- meters sprintlopp. a) Vad orsakar den snabba ökningen i mjölksyra koncentrationen i blodet? (1p) b) Vad orsakar nedgången av mjölksyra efter avslutat lopp? (1p) Lopp Koncentration av mjölksyra i blod, µM Före Efter 200 150 100 50 0 0 20 40 60 Tid, min (2p) Svarsmall: a) En kraftig glykolys under anaeroba förhållanden.(1p) b) När syretillgången ökar sker omvandling av laktat till glukos via glukoneogenes i levern. (1p). Fråga 16: Råa ägg innehåller proteinet avidin som hindrar upptaget av B-vitamin, speciellt vitaminet biotin. Vilka 2 metaboliska vägar påverkas av att avidin reducerar biotins medverkan i metaboliska processer? Motivera svaret. a) Laktat Glukos b) Fumarat c) Alanin d) Propionyl-CoA Malat Glukos Succinyl-CoA (3p) Svarsmall: I reaktion a, c och (d)(2p). Vid omvandling av pyruvat till oxaloacetat (katalyseras av pyruvat karboxylas) behövs biotin i karboyleringsprocessen (1p) Fråga 17: Vad vet du om glukosmetabolismen hos idisslare? Vad händer med stärkelsen/glukosen som djuret får via födan, vilka metaboliter erhålls, hur tillgodoser mjölkkon sitt glukosbehov och vilken är den viktigaste metaboliten? (4p) 5 Svarsmall: Kolhydraterna förjäses i vomen till flyktiga fettsyror, främst till acetat , butyrat och propionat (smärre mängd laktat) (2p). Korna är beroende av glukoneogenes (1p) där huvudsubstratet utgörs av propionsyra (1p), men även andra ämnen som glycerol, laktat och aminosyror används. Fråga 18: a) Vilka två aminosyror spelar en avgörande roll i transporten av amoniumjoner från perifiera vävnader till levern? b) Hur utsöndras överskottskvävet hos landlevande däggdjur (vilken metabolit)? (3p) Svarsmall: a) Glutamin och alanin (2p) b) Urea (1p) Fråga 19: Varför produceras mindre ATP av det NADH som genereras i cytosolen och sedan transporteras in imitokondrierna via glycerolfosfat skytteln jämfört med det NADH som produceras i mitokondrierna? Hur mycket energi i form av ATP erhålls? (3p) Svarsmall: NADH ekvivalenter från cytosolen transporteras in som glycerolfosfat i mitokondrierna (1p). Glycerolfosfat omvandlas till dihydroxyaceton av det membranbundna enzymkomplexet glycerolfofatdehydrogenas där överför två elektroner till FAD som reduceras till FADH2 som lämnar över till Q i andningskedjan. (1p) Dvs. endast 1.5 ATP bildas. (1p) Fråga 20: I fotosyntesens ljusreaktioner förs elektroner från vatten till NADP+ samtidigt som protoner pumpas över thylakoidmembranet. a) Beskriv de tre sätt på vilket en protongradient bildas över thylakoidmembranet. (3p) b) När NADP+ koncentrationen är låg sker en annan process i vilket ferredoxin reducerar cytokrom bf komplexet istället för NADP+. i) Vad heter denna process? (0.5p) ii) Vilka, om någon, av de tre steg som pumpar protoner över thylakoidmembranet kommer *inte* att bidra till protongradienten, och varför? (1 p) iii) Bildas syrgas under denna process? (0.5p) (5p) Svarsmall: a) När vatten reduceras till syrgas, frigörs protonerna endast på lumensidan av membranet (1p). Elektroner överförs från fotosystem II till cytokrom bf komplexet via en kinon/kinol cykel. När plastokinon reduceras till plastokinol hämtas protoner från stromasidan. När plastokinol återoxideras till plastokinon släpps protonerna från lumensidan av membranet (1p). Nar elektroner förs från plastokinol till plastocyanin av cytokrom bf komplexet, kan detta komplex pumpa ytterligare protoner över membranet (1p). c) i) Cyklisk fotofosforylering. (0.5p) ii) De första två stegen, utsläpp av protoner från vattenreduceringen samt från kinon/kinolcykeln, kommer inte att bidra till en proton gradient (0.5p). Detta för att 6 cytokrom bf komplexet hämtar sina elektroner ifrån ferredoxin istället för från fotosystem II (0.5p) via kinol. iii) Nej. (0.5p) Fråga 21: Under translationen avläses mRNA till protein. Aminosyrorna, som bygger upp proteinet, är först kopplat till en viss typ av RNA – vilket? Detta RNA ser till att rätt aminosyra hamnar på rätt plats genom att avläsa mRNA sekvensen. Beskriv hur detta går till – rita gärna. Du behöver ej redogöra för ribosomens eller translationsfaktorernas roll. (4p) Svarsmall: tRNA (1p) använder sitt antikodon (3 nt) (1p) för att avläsa kodoner/3 nt i mRNA (1p). Det tRNA som basparar med sitt specifika kodon bär på en specifik aminosyra som sätts in på rätt plats i den växande peptid/proteinkedjan, dvs ett kodon motsvara en specifik aminosyra (1p). Fråga 22: Beskriv replikeringen av den ledande DNA-strängen (leading strand). Vilka enzymer/proteiner behövs (3.5p) Svarsmall: Den ledande strängen replikeras kontinuerligt (0.5) av DNA-polymeras III (0.5p). Primas (0.5p) tillverkar kort RNA-primer i början (0.5p). Helikas (0.5) behövs för att bryta vätebindingarna mellan DNA-strängarna (0.5p). Dessutom behövs proteiner som binder till enkelsträngat DNA (SSB) för att stabilisera detta och topoisomeraser (t.ex. gyras) för att lösa upp spänningar i dubbelhelixen (0.5 för antingen gyras eller single strand binding proteins – SSB). Fråga 23: Markera om följande påstående är sant eller falskt. a) Sigma-faktorn är viktig för att rätt gen transkriberas vid rätt tillfälle. b) Lagging strand replikeras kontinuerligt. c) DNA-polymeras I är viktig vid lagging strand men ej vid leading strand replikation/syntes. d) PCR används för att klyva specifika DNA-sekvenser. e) Ribosomen består av både proteiner och RNA. f) Splicing används för att ”skära” bort ickekodande RNA-sekvenser i bakteriellt mRNA. g) Gelelektrofores används för att separera olika DNA-bitar med avseende på storlek (längd). h) RNA är uppbygt av nukleotiderna ATP, GTP, CTP och TTP (tot 4p) Svarsmall: a) sant, b) falskt – diskontinuerligt/ickekontinuerligt, c) sant, d) falskt, e) sant, f) falskt – endast hos eukryota organismer, g) sant, h) falskt - U istället för T. (0.5p för varje rätt svar) 7 Fråga 24: En gen, Mon, har skickats till dig. Genen har sticky ends där 5’ ändan har ett GATC överhäng och 3’ ändan ett TTAA överhäng. Du har blivit ombedd att ligera in genen i plasmiden pBMN-Z. Genen, plasmiden och restriktionsenzym finns beskrivna nedan. Beskriv momenten du måste utföra för att ligera in genen Mon till plasmiden pBMN-Z. Du behöver ej beskriva efterföljande steg (transformation etc.) (2p) Mon Svarsmall: Plasmiden pBMN-Z klipps upp med restriktionsenzymerna; BamHI (0.5p.) resp. EcoRI (0.5 p.). Därefter ligeras pBMN-Z och genen (Mon) samman med hjälp av enzymet ligas (1p.). 8