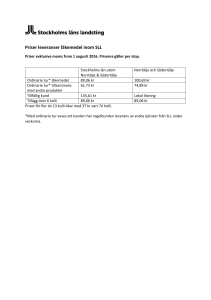
Rapport från Specialläkemedelsprojektet
advertisement

1(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Rapport från Specialläkemedelsprojektet RAPPORT FRÅN SPECIALLÄKEMEDELSPROJEKTET 1 1. SAMMANFATTNING OCH SLUTSATSER 3 1.1. Tidig identifiering av nya läkemedel. Samverkan med medicinska experter, industri och andra landsting 3 1.2. Prognosticering 4 1.3. Strukturerad introduktion och uppföljning 4 1.4. Användning av registerdata över läkemedelsförskrivning/försäljning 4 1.5. Nationella kvalitetsregister 5 1.6. Uppföljning med data från journalsystem 5 1.7. Prospektiv uppföljning 6 2. INLEDNING 7 3. FRAMTIDSSPANING OCH VÄRDERING 9 3.1. Horizon scanning 9 3.2. Läkemedelsvärdering efter godkännande 12 3.3. Nationell samverkan – konsekvens för framtidsspaning och läkemedelsvärdering 12 4. PROGNOSTISERING 13 5. KOMMUNIKATION INOM STRUKTURERAD UPPFÖLJNING 15 5.1. Information om projektet 16 5.2. Information kring delprojekten 16 5.3. Samarbetskontakter 17 5.4. Övriga kontakter 18 6. OLIKA SÄTT ATT TILLÄMPA STRUKTURERAD UPPFÖLJNING 18 6.1. Bevakning via läkemedelsstatistik 18 6.2. Individbaserade register över läkemedelsanvändning 20 6.3. Datainsamling ur journalsystem 21 6.4. Kvalitetsregisterstudier 23 6.5. Strukturerade mallar 25 6.6. Patientrapporterade data 27 6.7. Behov av god datakvalitet 28 2(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 6.8. Kommentar om incitament 28 7. MODELL FÖR STRUKTURERAD UPPFÖLJNING OCH STYRNING 29 7.1. Beskrivning av Strukturerad uppföljning 30 7.2. Organisation 31 8. NATIONELLT SAMARBETE 31 8.1. 4-länsgruppen 32 8.2. SKL och övriga landsting 32 8.3. Myndigheter 33 9. INDUSTRIKONTAKTER 33 9.1. Möten om läkemedel i pipeline 34 9.2. Hearing-möten 34 9.3. Möten om strukturerad uppföljning 34 10. INTERNATIONELLT SAMARBETE 35 10.1. Piperska gruppen 35 10.2. Hur bedrivs strukturerad introduktion av nya läkemedel i andra länder 35 11. HÄLSOEKONOMI 36 12. BESKRIVNING AV SPECIALLÄKEMEDELSPROJEKTET 39 12.1. Projektprocess 39 12.2. Övergripande projektplan 39 12.3. Kommunikation i projektet 41 12.4. Måluppfyllelse 42 Referenser 43 3(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 1. Sammanfattning och slutsatser Läkemedel blir allt viktigare i sjukvården, såväl medicinskt som ekonomiskt. Medicinska framsteg har gjorts under senare år inom praktiskt taget alla områden. De nya läkemedlen är emellertid ofta mycket dyra och står för en allt större del av såväl läkemedelskostnaderna som de totala sjukvårdskostnaderna. Den totala läkemedelskostnaden i SLL uppgick under 2009 till närmare 8 miljarder kronor. Specialläkemedel definierat som ”läkemedel som i normalfallet inte sätts in i primärvården” svarar för merparten av de senare årens kostnadsökning. Faktorer som bidrar till ökade kostnader är åldrande befolkning med ökad sjukdomsbörda, vidgade indikationer för behandling och läkemedelsföretagens marknadsföring, medan patentutgångar, förmånsbegränsningar och kostnadseffektiva läkemedelsval kan motverka trenden. Eftersom läkemedel får en allt större betydelse ekonomiskt och medicinskt behöver vi en bättre modell för att hantera specialläkemedlens introduktion i vården. Syftet med projektet var att ”åstadkomma en ur såväl medicinsk som ekonomisk synvinkel ändamålsenlig användning av specialläkemedel/fokusläkemedel.” Projektet organiserades i ett antal delprojekt för att utveckla nya metoder att prognostisera, värdera, introducera och följa upp användningen av nya läkemedel i landstinget. 1.1. Tidig identifiering av nya läkemedel. Samverkan med medicinska experter, industri och andra landsting En viktig del för förbättrad överblick är Horizon scanning eller framtidsspaning, d v s identifiering av kommande nya läkemedel/indikationer. Vår målsättning var att ta fram en procedur som möjliggör identifiering och bedömning av nya läkemedel minst sex månader innan godkännande. Processen består av identifiering via ett flertal olika källor, filtrering i en ackumulerad lista samt slutligen en kvalificerad bedömning av de nya läkemedlens potentiella medicinska och ekonomiska konsekvenser för vården. Hela denna strukturerade process har genomförts i nära samarbete med Läksaks expertgrupper. Detta samarbete har utvecklats till en grundbult i alla delar av specialläkemedelsprojektet. Värderingarna grundas på publicerade, randomiserade, kontrollerade studier och är en förutsättning för det fortsatta arbetet med strukturerad introduktion och uppföljning. Läkemedelsvärderingar (R2, rapport 2), görs efter godkännande för alla nya viktiga läkemedel och publiceras på janusinfo.se. I framtidsspaningen ingår ett samarbete med läkemedelsindustrin där vi vid gemensamma möten diskuterar företagens pipeline. Denna del kommer i framtiden att genomföras i nära samarbete med andra landsting och företrädesvis skötas av representanter för Västra Götaland (VGR). Även tidiga bedömningar kommer att fördelas mellan landstingen/regionerna. Detta underlättas av det faktum att en mer tydlig nationell samverkan 4(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 skapats i november 2009 via den av SKL organiserade gruppen Nya LäkemedelsTerapier (NLT). NLT utgör i praktiken en utvidgning av ett tidigare fyrläns-samarbete omfattande SLL, VGR, Skåne och LT Östergötland. Vi har också haft ett betydande internationellt samarbete, framför allt inom Europa och detta kan förväntas få stor betydelse i framtiden. 1.2. Prognosticering För att kunna ge stöd till bland annat landstingets budgeteringsprocess har vi utvecklat en metod för prognos av användning och kostnader för läkemedel i SLL. I prognosen har vi kommenterat både förmodad kostnadsutveckling och i vilken utsträckning den kan anses vara medicinskt och ekonomiskt ändamålsenlig. Samverkan med Läksaks expertgrupper har även här varit avgörande för att uppnå ett högklassigt resultat. Prognosen baseras på historiska data för läkemedelsförsäljningen i SLL under fyra föregående år med en trendframskrivning för de kommande två åren. Trenden justeras sedan för faktorer som kan förväntas påverka användningen (t.ex. patentutgångar, nya läkemedel eller nya behandlingsrekommendationer). Överrensstämmelsen mellan prognos och utfall har varit god för de flesta terapiområden, men det har förekommit avvikelser, främst beroende på svårigheter att förutspå introduktionshastigheten för nya läkemedel och datum för patentutgångar. 1.3. Strukturerad introduktion och uppföljning Fungerande metoder för strukturerad introduktion och uppföljning av nya läkemedel kommer att bli successivt mer angelägen när nya effektiva, men ofta dyra läkemedel introduceras. SLL:s modell för strukturerat införande består av: • tydliga rekommendationer, eller vid små förskrivargrupper en överenskommelse med berörda förskrivare, om kriterier för hur läkemedlet skall användas • saklig information och vid behov vidareutbildning kring terapin • datainsamling för att utröna i vilken utsträckning läkemedlet används på rekommenderat/överenskommet sätt • uppföljning av relevanta effekter och biverkningar. Flera uppföljningsmetoder har identifierats och testats inom projektets ram. Dessa beskrivs i punkterna 1.3-1.7 nedan. Med hänsyn till att nya läkemedel kan vara av påtagligt olika karaktär kan olika typer av metoder vara det mest adekvata. Vi föreslår en modell för hur man ska hantera detta och för varje nytt läkemedel komma fram till beslut om lämplig uppföljning. 1.4. Användning av registerdata över läkemedelsförskrivning/försäljning Sverige har sedan många år en mycket god läkemedelsstatistik, vilken utgör ett kraftfullt verktyg för att identifiera förbättringsområden och för att göra prioriteringar och prognostiseringar. I specialläkemedelsprojektet har aggregerad läkemedelsstatistik från landstingets egna datasystem använts som en bas i prognosarbetet och dessutom för löpande uppföljning av förskrivningen av nya läkemedel. Begränsningen är avsaknaden av kliniska data. Statistiken kan dock användas för att identifiera områden vilka kräver djupare uppföljning baserad på andra datakällor. Individbaserade data över befolkningens läkemedelsutköp finns sedan 2005 lagrade i Socialstyrelsens läkemedelsregister. Registret kan användas för att identifiera nyinsättningar, dubbelförskrivning, inadekvat polyfarmaci och patientens utköp över tid och därmed 5(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 analysera förskrivningens ändamålsenlighet på gruppnivå. Landstingens åtkomst till registret begränsas dock av rådande lagstiftning. Inom projektets ram studerades användningen av bantningsmedlet rimonabant med hjälp av läkemedelsregistret. Nyinsättningar, samtidig annan behandling inklusive antidepressiv behandling (som var kontraindicerat) och behandlingens längd identifierades. Resultaten, som publicerats i Läkartidningen, visade på påtagligt hög frekvens av inkorrekt förskrivning och korta behandlingstider. På liknande sätt följdes förskrivningen av nya diabetesmedel upp under 2007-09. Dessa data har utgjort en god grund för att bedöma behov av riktad information angående diabetes-behandling. Instrumentets styrka och användbarhet för läkemedelsuppföljning var uppenbar i båda studierna. Det är angeläget att landstiget får egna individbaserade data över uthämtade läkemedel eller ges ökad tillgång till Socialstyrelsens register. Läkemedelsdata kan efter godkännande från etisk kommitté även kopplas till andra hälsodata via personnummer. Samkörning mellan patientregistret och läkemedelsregistret har i projektet visats fungera väl för att studera i vilken grad nya perorala cancerläkemedel förskrivits off-label (utanför godkänd indikation). 1.5. Nationella kvalitetsregister Nationella kvalitetsregister är ytterligare en potentiell källa till uppföljning. De flesta register drivs av enskilda specialister eller specialistföreningar och är byggda för uppföljning av kvaliteten vid behandling av specifika sjukdomar eller kirurgiska åtgärder. En systematisk inventering som gjorts inom projektet visade att endast 61 av 109 register innehöll information om läkemedelsbehandling. Informationskvaliteten varierar stort och är generellt svår att utnyttja för läkemedelsuppföljning utan speciell anpassning. Data måste från början registreras på ett sådant sätt att de senare kan sammanställas och analyseras. Vi har studerat möjligheterna att följa användningen av TNF-antagonister och annan avancerad medikamentell behandling i det s k Pso-Reg registret och funnit detta vara ett möjligt underlag för en observationell studie. Logistiska problem har dock reducerat mängden bearbetbara data, men möjligheten till analys av mer intressanta data återstår även efter projektets avslutande. 1.6. Uppföljning med data från journalsystem Direkt koppling till journalsystem för lagring av information från externa mallar visade sig initialt alltför beroende av nära samarbete med journalsystemägare. Emellertid utgör de elektroniska datajournalernas läkemedelsmoduler en möjlig väg för att samla in information om läkemedelsanvändningen. Detta är särskilt viktigt för läkemedel som används inom slutenvården och sjukhusansluten dagvård då läkemedelsregistret endast omfattar receptförskrivna läkemedel. TakeCare (Profdoc®) används på hela Karolinska Universitetssjukhuset och planeras för användning inom hela SLL. Systemet har förbättrats under vårt projekts gång. Data i TakeCare hanteras numera dagligen av extraktionsverktyget Intelligence för att ackumuleras i databasen KarDa. Vi har nyligen kunnat visa att högklassiga data från KarDa kunnat extraheras och sammanställas genom att avkodat registrera användning av infliximab och immunoglobuliner. Fortsatt arbete behövs för att utveckla användbarheten. 6(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 På motsvarande sätt följdes förskrivningen av bantningsmedel upp genom dataextraktion från 15 vårdcentraler i Sydvästra Stockholm med hjälp av verktyget RAVE. Analysen visade på stora brister i journaldokumentationen av vikta data som patienternas längd och vikt, men även på bristande effekt av läkemedlet. Principiellt är dock detta en möjlig form av uppföljning. Rätt incitament för registrering av relevanta data är nödvändigt. Onkologiska läkemedel har hittills inte registrerats i vanliga läkemedelsmoduler. Samkörning av data från apotekets s.k. SALT-register med diagnosdata från TakeCare och/eller nationella hälsodataregistren skulle kunna ge tillgång till information om användning av onkologiska medel som ges som injektion/infusion. Juridiska frågor är dock ännu inte avklarade. 1.7. Prospektiv uppföljning Olika modeller för prospektiv uppföljning av användningen av några nya läkemedel har prövats inom projektet. Tidigt i projektet utvecklades en fristående teknisk lösning för prospektiv insamling av information för patienter som behandlades med bantningsläkemedel (Acomplia, Reductil och Xenical). Mallar för inmatning av relevant information konstruerades och gjordes tillgängliga för förskrivande läkare genom separat inloggning. Det visade sig dock att säkerhetsfrågor inte kunde lösas på ett tillfredsställande sätt, att det tog lång tid att logga in och registrera, att det saknades möjligheter för överföring av registrerad information till journalsystemet och att drift och förvaltning blev dyr. Någon vidare utveckling av detta koncept genomfördes därför inte. Inom projektets ram har vi således inte lyckats utveckla ett fungerande IT-stöd för prospektiv uppföljning. Vi kan konstatera att förskrivarna måste ha tillgång till en enkel applikation som tar minimalt med extra tid att fylla i eller aktivera. Den måste vara direkt knuten till journalsystemet så att man inte behöver göra dubbel registrering. Det är fortfarande oklart hur dessa frågor ska lösas. Vid projektets start genomfördes inte någon noggrann analys av tillgängliga alternativ och möjligheter innan en direkt metodapplikation prövades. Att detta inte genomfördes berodde troligen också på att projektgruppen rekryterades sent och efter hand när delprojekten redan var etablerade. Vidareutveckling av TakeCare verktygen ter sig lovande för framtiden, men betydande utvecklingsarbete återstår. Det behövs sannolikt även någon form av incitament för förskrivare för att få registreringen att fungera i vardagen. Insamling av data, som patienterna själva matat in via mina vårdkontakter är under utveckling och ter sig lovande, men uppgifterna som kan erhållas blir naturligtvis rätt begränsade. . Sammanfattningsvis så har specialläkemedelsprojektet levererat fungerande modeller för framtidsspaning, läkemedelsvärdering och prognostisering. Dessa har förts in i löpande förvaltning vid Medicinskt Kunskapscentrum, till stora delar i nationell och internationell samverkan. Projektet har även levererat en omfattande erfarenhetsbank kring olika möjligheter till strukturerad uppföljning. Fortsatt utvecklingsarbete krävs för att finna en modell som bäst tillgodoser landstingets krav i framtiden. 7(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 2. Inledning Läkemedel blir allt viktigare i sjukvården, såväl medicinskt som ekonomiskt. Många påtagliga medicinska framsteg har gjorts under senare år. Exempel är antiinflammatoriska och onkologiska läkemedel liksom preparat för behandling av HIV och kronisk hepatit, men betydelsefulla tillskott till behandlingsarsenalen finns inom praktiskt taget alla områden. Dessa nya läkemedel är emellertid ofta mycket dyra och står för en allt större del av såväl läkemedelskostnaderna som de totala sjukvårdskostnaderna i Stockholms läns landsting. Den totala läkemedelskostnaden i SLL uppgick 2009 till närmare 8 miljarder kronor. Specialläkemedel definierat som ”läkemedel som i normalfallet inte sätts in i primärvården” har svarat för merparten av kostnadsökningen under senare år. Det förklaras både av ett stort inflöde av nya dyra specialläkemedel, men också av effekter av generikareformen och patentutgångar vilka gjort att kostnaderna för basläkemedel trots ökade volymer varit oförändrade. Faktorer som medför ökad förskrivning är åldrande befolkning och därmed ökad sjukdomsbörda, vidgade indikationer för behandling såsom sänkta gränsvärden, tillkomst av nya läkemedel och nya behandlingsmetoder samt effekter av marknadsföring av receptbelagda läkemedel. Faktorer som påverkar i motsatt riktning är patentutgångar, begränsningar i läkemedelsförmånen, biosimilars (”generika” till bioteknologiska läkemedel), OTC switchar och kostnadseffektiva läkemedelsval. Alternativa terapier, konsensusrapporter och riktlinjer kan medföra både ökade och minskade läkemedelskostnader. Hur nya läkemedel i praktiken introduceras i vården påverkas av många olika faktorer såsom producentens marknadsföring, information från experter och expertorganisationer (som Läksak) samt hur olika förskrivare själva uppfattar läkemedlet (nytta vs risk, tidigare kunskaper inom området). Att belysa ett läkemedels medicinska långtidseffekter och hälsoekonomiska aspekter är oftast fullt möjligt först när det funnits på marknaden under en längre tid. Nya läkemedel innebär ofta betydande medicinska framsteg men kan också medföra väsentliga utmaningar vad gäller såväl kostnader som värdering av patientnytta/säkerhet. Vi behöver därför en bättre överblick över nya läkemedels medicinska effekter och kostnader. Specifikt behöver vi en modell för hantering av specialläkemedlens introduktion i vården. Syftet med projektet var att ta ett samlat grepp på specialläkemedel/fokusläkemedel för att uppnå en rationell och kostnadseffektiv användning med hög medicinsk kvalitet. Projektet förväntades bidra till ta fram metodik och rutiner, så att i framtiden alla nya läkemedel som 8(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 kan förväntas få en stor medicinsk eller ekonomisk effekt introduceras på ett kontrollerat och ändamålsenligt sätt. Metoder för att åstadkomma högklassig uppföljning ska prövas och utvärderas. Rationellt införande av specialläkemedel/fokusläkemedel kan även understödjas av producentobunden fortbildning, öppen redovisning av resultat och incitamentsstyrning. Huvudmålet är att åstadkomma en ur såväl medicinsk som ekonomisk synvinkel ändamålsenlig användning av specialläkemedel/fokusläkemedel. Arbetet inom Specialläkemedelsprojektet har utförts inom olika områden/delprojekt: • Horizon scanning för att identifiera nya substanser som förväntas komma att introduceras på läkemedelsmarknaden • Kritisk värdering av möjlig nytta av och tänkbara kostnader för nya läkemedel tidigt i processen (innan och i samband med introduktionen). • Prognostisering av utvecklingen av förskrivningen av läkemedel i SLL i samarbete med Läksaks expertgrupper. • Nationellt samarbete för att optimera användning av samlade resurser, inkluderande optimerad interaktion med läkemedelsindustrin. • Ta fram och testa alternativa modeller för strukturerad uppföljning av nya läkemedel. • Test av olika modeller för uppföljning av användningen av bantningsmedel, som exempel på öppenvårdsläkemedel med potentiellt stor användning. • Test av uppföljning via användning av kvalitetsregister för analys av effekter av behandling av svår psoriasis med TNF-anatagonist, som exempel på uppföljning av ny indikation för redan etablerat dyrt specialläkemedel. • Analys av möjligheter till uppföljning av onkologiska läkemedel. • Bedömning av hälsoekonomiska effekter vid introduktion av nya läkemedel. • Kommunikation med ett stort antal intressenter om projektet bedömdes vara väsentlig för möjligheterna till framgång. I figuren nedan illustreras projektets olika komponenter i relation till tidpunkter i läkemedelsutvecklingen inom industrin, se även artikel i Läkartidningen hösten 2008, ref [1]. Läkemedelsutvecklingen inom industrin Fas II Fas III Godkännande Fas IV TID Specialläkemedelsprojektets olika delar Horizon scanning Värdering 1 Prognosticering Värdering 2 Strukturerat införande Kvalitetsuppföljning Hälsoekonomisk uppföljning 9(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Bild 1. Läkemedelsutveckling 3. Framtidsspaning och värdering Horizon scanning, eller framtidsspaning, omfattar både identifiering av kommande nya läkemedel och nya indikationer för redan godkända läkemedel samt en bedömning av konsekvenserna om läkemedlet eller indikationen bli godkänd. Denna information är en förutsättning för att landstinget ska kunna arbeta proaktivt med strukturerat införande och uppföljning samt ett stöd för budgetering av kommande läkemedelskostnader i landstinget. Detta arbete har även tidigare gjorts i skiftande omfattning inom läkemedelskommittéorganisationen. I projektets regi har en formaliserads organisation skapats och arbetet systematiserats. En framgångsfaktor i detta arbete har varit samverkan med Läksaks expertgrupper. Vi strävade efter att ta fram en procedur som möjliggjorde att nya viktiga läkemedel och indikationer kunde bedömas senast sex månader innan godkännandet. För att detta ska vara möjligt krävs en organisation som stöder ett smidigt arbetssätt med beaktande av stoppdatum. Efter ett tidigt studiebesök vid National Horizon Scanning Centre (NHSC) i Birmingham fick vi en god bild av hur man kan arbeta med framtidsspaning gällande både process och urvalskriterier. De har utvärderat sitt arbete och vet att de fångar de viktiga nya läkemedlen och indikationerna. NHSC är en del av universitetet i Birmingham och finansieras via NHS. Delprojektet onkologi har avrapporterats i årsrapporter innehållande en relativt omfattande beskrivning av området cancerläkemedel med en beskrivning av tillgängliga läkemedel; vad som kommit in på marknaden under de senast åren och om vad som kan förväntas att komma in under den närmaste framtiden (se avsnitt 6.1.1). 3.1. Horizon scanning Framtidsspaningsprocessen består av fyra steg (bild 2). I första steget identifieras och dokumenteras alla fynd från olika källor i en för ändamålet särskilt utvecklad databas (Mimer). Denna stora bruttolista kondenseras i två filtreringssteg enligt uppsatta kriterier, [2] för att få fram de viktigaste nya läkemedlen eller indikationerna. Filtreringen baseras på mycket begränsade uppgifter om läkemedlet såsom indikation och verkningsmekanism. Slutligen skrivs en bedömningsrapport som ska ge en bättre bild av de potentiella konsekvenserna för vården om läkemedlet eller indikationen blir godkänd. För en detaljerad beskrivning av processerna se respektive SOP [3]. Identifiering Filtrering 1 Filtrering 2 10(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Bild 2. Processen för framtidsspaning Moment I. Identifiering Information om nya läkemedel och indikationer hämtas från: • Läksaks expertgrupper • Läkemedelsföretag – strukturerade pipelinemöten eller annan muntlig kontakt • Skrivna källor som nås via Internet, såsom - organisationer som bedriver horizon scanning (National Prescribing Centre i Liverpool, NHSC) - myndigheter (EMEA, Europeiska kommissionen, Läkemedelsverket, FDA) och - andra källor (till exempel nyhetsbrev, läkemedelsföretagens webbplatser, ClinicalTrials.gov). De skrivna källorna skannas månatligen. Möten med läkemedelsföretagen ordnas årligen och expertgruppernas information inhämtas samtidigt som de deltar i filtreringssteg 2. Samtidigt som fynden dokumenteras i databasen görs en bedömning av tid till förväntat godkännande. G -2 år NHSC G -1 år G -6 mån NPC EMEA G G +6 mån Europeiska kommissionen Läkemedelsverket FDA TLV Läkemedelsföretag Bild 3. Schematisk bild över när pipelineinformationen blir tillgänglig för oss. G = tidpunkt för försäljningsgodkännande av europeiska kommissionen. Litet förenklat kan man säga att de första signalerna kan fångas cirka 1,5 till 2 år innan godkännande genom NHSC, en något bättre uppfattning om godkännandedatum fås i senare 11(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 skede från aktuellt företag och bekräftelse på godkännande fås genom europeiska myndigheter där EMEA ger sitt utlåtande och Europeiska kommissionen ger det faktiska försäljningstillståndet. Värt att notera är att läkemedel som i huvudsak avses förskrivas på recept och omfattas av läkemedelsförmånen, i Sverige också ska passera TLV. Moment II. Filtrering, steg 1 Första filtreringssteget görs på Läkemedelscentrum, fyra gånger per år. Det syftar till att sålla bort de uppenbart mindre viktiga fynden. Fynd med beräknat godkännande 0 – 1,5 år framåt i tiden tas fram ur databasen och jämförs med de uppsatta kriterierna som baseras på NHSC:s. De syftar till att identifiera fynd som är innovativa, gäller svåra sjukdomar, eller stora patientpopulationer, ha potential att fylla terapeutiska behov, kan få ekonomiska eller organisatoriska konsekvenser eller komma få medial uppmärksamhet. Moment III. Filtrering, steg 2 Fynd som passerar första steget går vidare till andra filtreringssteget. Till detta används i princip samma kriterier som i första steget och med hjälp av Läksaks expertgrupper kan vi bättre bedöma potentialen för läkemedlet eller indikationen. Även detta steg görs fyra gånger per år. Resultaten från båda filtreringsstegen noteras för varje fynd i databasen. Läkemedel och indikationer som passerat andra filtreringssteget kan komma att listas. Moment IV. Bedömning Klinisk farmakolog får uppdrag av läkemedelscentrum att göra bedömningsrapporter, även kallade R1 (rapport 1), för de läkemedel och indikationer som fallit ut som viktiga. Leveransdatum sätts till cirka sex månader innan förväntat godkännande, om inte annat avtalas för en specifik rapport. Rapporten går därefter vidare till berörd(a) expertgrupper för ett så kallat preliminärt utlåtande och eventuella kompletteringar till exempel kring konsekvenser för vården om läkemedlet eller indikationen blir godkänd. Man bör notera att tillgången på publicerade, randomiserade, kontrollerade studier i detta stadium är begränsat. Bedömningsrapporten kan behöva baseras på mindre solida källor och R1-rapporterna måste alltid hanteras som internt arbetsmaterial. Mottagare till rapporterna är Läksak, expertgrupper, LK och HSN-f, det vill säga personer som har till uppgift att strategiskt tänka och planera för läkemedel och deras användning i landstinget Bedömningsrapporterna betraktas som internt arbetsmaterial och är utformade med NHSC:s rapporter som förlaga [4]. Under projektets gång har följande bedömningsrapporter tagits fram: • Denosumab vid osteoporos • Dabigatran som primär venös trombosprofylax vid knä- och höftkirurgi • Rivaroxaban som primär venös trombosprofylax vid knä- och höftkirurgi • Omega 3-fettsyreetylestrar (Omacor) som tilläggsbehandling till HMG CoAreduktashämmare vid kvarstående höga triglycerider • Sugammadex (Bridion) för reversering av neuromuskulär blockad 12(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin • • • • Datum 2010-02-10 Version p1.0-11 SPL-0038 Milnacipran vid fibromyalgi Indacaterol vid KOL Dabigatran (Pradaxa) som trombosprofylax vid förmaksflimmer Tolvaptan vid hyponatremi på grund av otillräcklig insöndring av antidiuretiskt hormon. 3.2. Läkemedelsvärdering efter godkännande Läkemedelsvärderingar har under flera år publicerats på janusinfo.se. Värderingarna grundas på publicerade, randomiserade, kontrollerade studier och är en förutsättning för det fortsatta arbetet med strukturerad introduktion och uppföljning. Klinisk farmakolog får i uppdrag att göra läkemedelsvärderingen och dokumentet kompletteras med expertgruppens utlåtande som innefattar plats i terapin. I princip görs läkemedelsvärderingar, även kallade R2 (rapport 2), för nya viktiga läkemedel som varit föremål för utredning i en bedömningsrapport och blivit godkända. Undantag kan göras om till exempel ett receptläkemedel inte blir rabattberättigat, om antalet förmodade förskrivare är få eller en värdering inte behövs för uppföljningsarbete. Värderingar publiceras numera i samband med att läkemedlet blir tillgängligt på svenska marknaden. De publicerade läkemedelsvärderingarna har också till uppgift att informera och stödja förskrivare i länet att göra kloka läkemedelsval. Under projektet har också utformningen av de publicerade värderingarna ändrats efter avstämning med en grupp primärvårdsläkare. I den nya utformningen [5] har sedan december 2008 följande dokument publicerats: • Melatonin (Circadin) – vid dålig sömnkvalitet hos personer över 55 år • Dabigatranetexilat (Pradaxa) – som venös trombosprofylax vid elektiv knä- och höftplastik • Rivaroxaban (Xarelto) – som venös trombosprofylax vid elektiv knä- och höftplastik • Cilostazol (Pletal) – vid claudicatio intermittens • Flutikasonfuroat (Avamys) – vid allergisk rinit • Prasugrel (Efient) – i samband med PCI vid akuta koronara syndrom 3.3. Nationell samverkan – konsekvens för framtidsspaning och läkemedelsvärdering För mer detaljerad information om arbetet se avsnitt 8. För att undvika parallellarbete i Sverige kommer Västra Götalandsregionen (VGR) ta hand om de flesta pipelinemötena med läkemedelsföretag då de redan har en upparbetad modell. Undantag utgör mindre företag som är baserade i Stockholmsregionen som vi även fortsättningsvis kommer att träffa. Informationen lägger VGR in i databasen, som blir gemensam med VGR, Skåneregionen och Östergötland från och med januari 2010. 13(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Den nationella samverkan utökades i slutet av november 2009 till att också omfatta övriga landsting genom SKL:s gruppering kring Nya LäkemedelsTerapier (NLT). Kontakten mellan NLT och fyrlänsgruppen går via en, tills vidare, projektanställd koordinator placerad i Region Skåne. SLL kommer även inom ramen för ett utvecklat nationellt samarbete att göra merparten av bedömningsrapporterna. Den nationella samverkan kommer dock att innebära att även till exempel särläkemedel, onkologiska läkemedel och antivirala läkemedel kommer att bedömas, vilket inte har gjorts under projektets gång. För läkemedelsvärderingar har vi inte hittat en gemensam plattform på grund av en alltför stor skillnad i intern organisation mellan landstingen/regionerna. Vi är överens om att det skulle vara möjligt att dela bakgrundsmaterial men har inte kommit fram till i vilken form detta skulle kunna ske. SLL har en överenskommelse med landstinget i Uppsala län om att kunna byta läkemedelsvärderingar med varandra. Detta har ännu inte prövats utan vi har hittills endast informerat varandra om vilka läkemedel vi planerar att göra läkemedelsvärderingar för. Den preliminära värderingen av dabigatran vid förmaksflimmer har förankrats i NLT-gruppen, som en första ansats till nationellt samarbete rörande läkemedelsvärdering. 4. Prognostisering För att kunna ge stöd till bland annat landstingets budgeteringsprocess har vi utvecklat en metod för prognos för användning och kostnader för läkemedel i SLL. I prognosen kommenteras både förmodad kostnadsutveckling och i vilken utsträckning den kan anses vara medicinskt och ekonomiskt ändamålsenlig. Under projektet har vi arbetat fram fyra prognoser [6-8]. Samverkan med Läksaks expertgrupper är avgörande för att uppnå ett högklassigt resultat vid bedömningen av trenderna (se nedan). Tidplanen för arbetet har justerats för att bättre passa HSN-f:s processer och den fjärde prognosen, gällande 2010/2011, levererades i början av februari 2010. Prognosen baseras på historiska data för läkemedelsförsäljningen i SLL under de fyra föregående åren med en trendframskrivning för de två kommande åren. Trenden justeras efter identifierade faktorer som skulle kunna påverka användningen av läkemedel såsom förändrade rekommendationer (Kloka listan, Kloka råd, vårdprogram och behandlingsrekommendationer), var i livscykeln läkemedlet befinner sig, patentutgångar, nya läkemedel och indikationer samt organisatoriska förändringar inom vården. Informationen hämtas från Janusinfo/Kloka listan, expertgrupper, läkemedelsstatistik, framtidsspaning inklusive bedömningsrapporter, personliga kontakter, samt en händelselista med information om patentutgångar, TLV-genomgångar och annan relevant information. Denna händelselista har tagits fram inom fyrlänssamarbetet och uppdateras kontinuerligt av medarbetarna, till exempel i samband med pipelinemöten med läkemedelsföretag. 14(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Framtagning av historiska data Gruppering av data och trendframskrivning Justering av trender skrivarbete Workshop med Läksaks expertgrupper Benchmarking med andra landsting skrivarbete Remiss till Läksak skrivarbete Leverans Uppföljning tertialvis Bild 4. Process för prognosarbete Arbetet påbörjas i mitten av oktober genom att statistik över användningen av läkemedel i SLL tas fram med hjälp av funktionen Läkemedelsstatistik på Läkemedelscentrum En arbetsgrupp med apotekare och inbjudna experter, representerande vissa smala, högspecialiserade terapiområdena, gör trendjusteringar under några arbetsdagar i början av november. I slutet av månaden går en första version av manus på remiss till expertgrupperna som sedan bjuds in till workshop en vecka in i december för diskussion. Prognosen benchmarkas även mot andra landstings prognoser. Den revideras av huvudförfattaren och går sedan på remiss till Läksak innan den levereras till HSN-f, Läksak med expertgrupper, LK-ordförande och chefer på Läkemedelscentrum. Även sjukhusens divisionschefer, samtliga verksamhetschefer, sjukhusens läkemedelsgrupper och läkemedelsråd, landstingsledningen och politiska sekreterarna samt som pressmeddelande till medicinska tidskrifter och medicinska journalister i övriga media har fått ta del av gjorda rapporter. Uppföljning av prognosen görs tertialvis. För en mer detaljerad beskrivning av processen se SOP [9]. I prognosen, som levererades i februari 2009 förutspåddes en kostnadsökning totalt för rekvisitions- och receptläkemedel exklusive vacciner på totalt 4,7 procent 2009 och 4,1 15(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 procent 2010, omkring 300 Mkr per år. En uppföljning av utfallet 2009 visar att ökningstakten i realiteten blev en dryg procentenhet lägre. Prognosen innan dess blev också en överskattning medan den första prognosen underskattade ökningstakten. Överrensstämmelsen mellan prognos och utfall har varit god för de flesta terapiområden, men det har förekommit en del större avvikelser, främst beroende på svårigheter att förutspå diffusionshastigheten för nya läkemedel och oklarheter kring när patentutgångar kommit att ske. De närmaste åren sker flera stora förändringar som kommer att få avsevärd påverkan på kostnadsutvecklingen. Det gäller främst avregleringen av Apotekets monopol och införandet av skarpt kostnadsansvar för öppenvårdsläkemedel. Parallellt med prognosen som innefattar alla läkemedel, har det inom delprojektet onkologi gjorts en riktad prognos för just detta område för perioden 2007-2009; denna har fallit väl ut. Kostnaderna för cancerläkemedel ökade kraftigt under början av decenniet (2000-2005), med en årlig ökningsgrad mellan 20-25%. Denna utveckling har nu brutits och för 2009 landade ökningen på 1%. Detta förklaras av tuffare prioriteringar i samband med ökat kostnadsansvar, att de kostnadsmässigt största läkemedlen nått sina förväntade patientpopulationer och av att flera stora cancerläkemedel har gått av patent under perioden (t.ex. oxaliplatin, irinotekan och bikalutamid). Flera patentutgångar är att vänta de närmaste två åren (docetaxel, anastrozole m fl) Detta innebär att cancerläkemedel inte kommer att växa snabbare än den genomsnittliga läkemedelsmarknaden under kommande år. Farhågor som uttrycktes t ex i Socialstyrelsens rapport 2007, att tillväxten av cancerläkemedel till höga kostnader skulle hota hela den svenska sjukvården verkar alltså inte vara korrekt. 5. Kommunikation inom Strukturerad uppföljning Kommunikation i syfte att påverka handlar om att förmedla ett budskap (”vad”) och samtidigt förklara anledning till en förändring (”varför”) och hur den ska gå till. Kommunikation leder till ökad förståelse och är en förutsättning för delaktighet och för att man ska kunna ta till sig nya förhållningssätt. Kommunikation handlar inte bara om vad intressenterna bör veta utan även deras känsla och vilja. Inom SLL finns redan etablerade kanaler för läkemedelsinformation genom läkemedelskommittéernas, Läksaks och Läkemedelscentrums etablerade verksamheter såsom fortbildningsorganisation, tidskrifter, webbplats, nyhetsbrev och nätverk. Projektet har haft indirekt kontakt med förskrivare, genom en nära kontakt med såväl läkemedelskommittéer som Läksak och dess expertgrupper. Vi har haft direkt kontakt med förskrivare vid ett stort antal föreläsningar runt om på sjukhusen i samband med lunchmöten och liknande till vilka alla förskrivare varit inbjudna. Ur specialläkemedelsprojektets perspektiv har kommunikationen främst handlat om att hålla intressenter uppdaterade om nuläget i projektet, men även kretsat kring konkreta sakfrågor i anslutning till uppföljningsprojekten. Kommunikation i syfte att ge feed-back på insamlade data och i syfte att påverka attityder har gjorts i mindre utsträckning. 16(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 5.1. Information om projektet Den första informationen om projektet kan sägas ha tagits fram genom skapande av projektdirektiv och –plan som delgivits bland annat styrgruppen. HSN-förvaltningen, SLL:s beställarorganisation, är projektägare och har varit representerad i projektets styrgrupp. Information om projektets syfte och upplägg har sedan spridits genom muntliga presentationer till Läksak, expertgrupper, läkemedelskommittéer och Karolinskas läkemedelsråd samt olika motsvarande grupperingar utanför länet. Även i kontakt med läkemedelsföretag har projektet beskrivits översiktligt. Under projekttiden har Läksak också utvecklat en mer övergripande kommunikationsform genom ”LIF-Stockholm”. Hjälpmedel i informationen har varit en webbplats med ingång från janusinfo samt en broschyr som beskriver projektets alla delar. Det har skrivits artiklar i läkemedelskommittétidskrift och information om projektet har gått ut i Läkemedelscentrums nyhetsbrev. Vi har skrivit en omfattande artikel för Läkartidningen och vi har haft tre posters på Riksstämman, som beskrivit projektet. En översiktsartikel om hur olika europeiska länder arbetar med introduktion av nya läkemedel är under sammanställning och planeras skickas in till vetenskaplig tidskrift våren 2010. 5.2. Information kring delprojekten Grundläggande information om delprojektens syfte och mål finns att hämta i delprojektdirektiv och –plan. Varje delprojekt har tagit de kontakter som behövts med till exempel kliniska experter för att driva delprojektet vidare. Arbetet med horizon scanning har beskrivits i Santé och PharmaIndustry – tidskrifter som vänder sig till läkemedelsindustrin samt presenterats för apotekare verksamma inom läkemedelskommittéer i Sverige men med anställning inom Apoteket Farmaci. Under projektets gång har ett antal bedömningsrapporter för läkemedel i pipeline tagits fram, se avsnitt 3.1. Prognosarbetet har beskrivits i artikel i Läkartidningen och även i internationella tidskrifter. Den framtagna prognosen har distribuerats till HSN-f , Läksak, expertgrupper, ordförande i Läkemedelskommittéer, chefer på Läkemedelscentrum, sjukhusens divisionschefer, samtliga verksamhetschefer, sjukhusens läkemedelsgrupper och läkemedelsråd, landstingsledningen och politiska sekreterarna samt som pressmeddelande till medicinska tidskrifter och medicinska journalister i övriga media. Prognosen har dessutom lagts ut på janusinfo. En engelsk artikel om prognosen har skrivits och är inskickad till vetenskaplig tidskrift för publicering. Muntliga presentationer av respektive års prognoser har gjorts på alla sjukhus i SLL och även för andra intressenter utanför SLL, t.ex. SKL, fyrlänsgruppen, läkemedelskommittén i Västernorrland och på Mellansvenska läkemedelsdagarna i Örebro. I delprojektet kring bantningsläkemedel såg man tidigt till att få en läkemedelsvärdering gjord för Accomplia där både expertgruppen för hjärt-kärlsjukdomar och expertgruppen för endokrina och metabola sjukdomar formulerade en gemensam värdering av läkemedlet. Vidare har man publicerat resultat av Accomplia både på janusinfo och i Läkartidningen samt ytterligare ett expertgruppsdokument i vilket man kommenterar eventuell nytta av Accompliaanvändning. Ytterligare en artikel om den journalstudie om bantningmedel som 17(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 gjordes i Sydvästra Stockholm har accepterats av Läkartidningen och kommer att publiceras våren 2010. Inom delprojekt onkologi har varje år sammanställts en rapport som beskrivit utvecklingen för användningen av onkologiska läkemedel med kommentarer angående pipeline inom området. Rapporten för 2009 kommer att bli klar under februari 2010 och efter synpunkter från projektgruppen att vara tillgänglig. Marie Persson, Björn Wettermark och Nils Wilking har även skrivit en artikel i tidningen Onkologi kring temat horizon scanning och strukturerad uppföljning. Denna tidning, som når landets alla onkologer och hematologer, kommer ut under tidig vår 2010. Dessutom kommer Läkartidningen i ett temanummer 21/4 2010 att behandla cancerläkemedel. Nils Wilking är huvudansvarig tillsammans med Ylva Böttiger på Läkartidningen för detta temanummer. Övriga medförfattare är Björn Wettermark, professor Jonas Bergh KI/Christie hospital Manchester, Bertil Jonsson Läkemedelsverket samt EMEA, professor Bengt Jönsson Handelshögskolan samt professor Arne Östman CCK,KI. 5.3. Samarbetskontakter Projektet har arbetat i mycket nära samarbete med Läksaks expertgrupper för att genomföra framtidsspaning, filtreringar, värderingar och prognostisering (se ovan). Även i delprojekt som arbetat med olika uppföljningsvägar har man haft nära samarbete med expertgrupperna och andra kliniker. Detta samarbete har utgjort en avgörande princip i vår arbetsprocess. Vi anser att samarbete med kvalificerade kliniska och farmakologiska experter är en omistlig del av ett högklassigt arbete med att hantera identifiering, värdering, strukturerad information, introduktion och uppföljning av nya läkemedel. Tillgång till oberoende experter blir än viktigare i framtiden om landstinget skall kunna göra bedömningar och fatta beslut innan läkemedlen nått marknaden. Vid den tidpunkten finns begränsat med publicerat material och inga expertutlåtanden från Läkemedelsverket, SBU eller TLV att tillgå. Vi har också haft nära samarbete med ett antal andra experter, representerande områden som delvis saknar expertis inom Läksak. Representanter för projektet har haft ett stort antal internationella kontakter med forskare och myndigheter (se nedan), vilket resulterat i viktigt kunskapsutbyte och grund för fortsatt samarbete kring nya läkemedel. Nationella kontakter har initierats med andra landsting och regioner i Sverige inom den så kallade 4länsgruppen för att hitta former för samarbete kring pipeline-information, bedömningar och värderingar samt prognosticering. I förlängningen dockades dessa diskussioner med SKL:s arbetsgrupp NLT. Nära kontakter har etablerats med Västmanlands läns landsting. Delprojekt onkologi har verkat inom det nationella samarbetsprojektet inom onkologi. Man har också haft kontakter med Apoteket Farmaci kring eventuella datauttag ur beredningsdatabas. Kvalitetsregister har en potential att användas för uppföljning av läkemedel (se nedan) och projektet har haft kontakt med representanter för Psoriasisregistret, Reumaregistret, Osteoporosregistret, Auricula (förmaksflimmer) m.fl. register, vilka initierats och sköts av kvalificerade experter inom sina respektive områden. 18(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 I olika delar av projektet har kontakter rörande IT varit en viktig del. Kontakter har tagits med SLL-IT, små och stora systemutvecklare, journalleverantörer, Medrave Software och Mina vårdkontakter. 5.4. Övriga kontakter Tidigt i projektet besöktes National Horizon Scanning Centre i Birmingham vilket gav en ovärderlig inblick i hur man kan arbete med pipelinespaning. Via alla medarbetare i projektet har vi haft betydande kontakter med Spesak och sjukhus- och klinikledningar. Vi har haft kontakt med Läkemedelsverket, Socialstyrelsen, Apoteket AB, SBU och TLV i specifika frågor. Vi har haft enstaka kontakter med patientföreningar. 6. Olika sätt att tillämpa Strukturerad uppföljning För att säkerställa att nya läkemedel används till de patienter som har störst nytta av behandlingen bör vissa preparat under de första åren introduceras enligt särskilt upprättade protokoll där man systematiskt undersöker i vilken grad fastställda indikationer följs och vilka effekter och biverkningar de nya läkemedlen åstadkommer i klinisk praxis. Protokollen kan även konstrueras för att besvara frågeställningar som är viktiga för sjukvården men som inte besvarats i de kliniska prövningar som legat till grund för godkännandet. De strukturerade uppföljningsstudier som gjorts inom ramen för specialläkemedelsprojektet fokuserade främst på att testa olika metoder för att bedöma i vilken utsträckning läkemedlen användes på rekommenderat/överenskommet sätt. Vissa studier fokuserade även på uppföljning av relevanta effekter och biverkningar. Olika metoder provades, både prospektiv datainsamling med strukturerade mallar och retrospektiva registeruttag av redan insamlade data. Erfarenheterna redovisas i detalj nedan. 6.1. Bevakning via läkemedelsstatistik Läkemedelsstatistik (registerdata över läkemedelsförskrivning/försäljning) är ett kraftfullt verktyg för att identifiera förbättringsområden, göra prioriteringar och prognostisera behov av sjukvårdsinsatser. Sverige började föra samlad statistik över läkemedelsförsäljningen i landet redan i mitten av 70-talet. I samband med läkemedelsreformen 1998 då landstingen tog över kostnadsansvaret för öppenvårdsläkemedel från staten utvidgades statistiken till att omfatta uppgifter om folkbokföringsort hos den som köpt ut läkemedel och arbetsplatskod varifrån receptet förskrivits. Det har gett nya möjligheter att t ex studera regionala variationer i läkemedelsanvändning och ge återkoppling till förskrivare på deras förskrivningsmönster. Från 1998 började också SLL få dessa data i rådatafiler från Apoteket och sedan 2001 finns dessa data åtkomliga via Janus. Under 2009 har en fortsatt utveckling skett av 19(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 läkemedelsstatistiken då läkemedel integrerats med SLL:s övriga uppföljning i SLL:s uppföljningsportal (www).uppfoljning.sll.se I specialläkemedelsprojektet har läkemedelsstatistiken använts som en bas i prognosarbetet (se avsnitt 4) samt för löpande uppföljning av förskrivningen av nya läkemedel. Statistiken ger en snabb information om regionala variationer (inom SLL eller jämfört med andra landsting) i t ex förskrivningen av ett nytt läkemedel, till vilka befolkningsgrupper läkemedlet förskrivits (ålder, kön) samt hur kostnaderna fördelat sig mellan recept och rekvisition. Den ger också information om vilka kliniker/vårdenheter som förskriver/rekvirerar nya läkemedel som underlag för planering av utbildningsinsatser och kontakter kring strukturerat införande. I projektet har läkemedelsstatistik t ex använts för att studera hur snabbt dabigatran och rivaroxaban börjat förskrivas efter ortopedisk kirurgi, vilka som förskrivit de nya diabetesmedlen exenatid & sitagliptin samt volyms- och kostnadsutvecklingen för obesitasmedel. I SLL:s framtida specialläkemedelsarbete bör läkemedelsstatistiken utnyttjas ännu mer strukturerat som tidigt beslutsunderlag. Den främsta begränsningen med läkemedelsstatistiken är avsaknaden av kliniska data som diagnos, labdata etc. för vilket det krävs data från andra källor och/eller samkörning mellan olika register. Statistiken skulle här kunna användas för en första bedömning av vilka läkemedel som är angelägna och vilka förskrivargrupper som skall prioriteras i en djupare uppföljning baserad på andra datakällor. 6.1.1 Årlig uppföljning inom onkologi Onkologiprojektet har tidigare avrapporterats i årliga rapporter, ref [10-11]. Dessa årsrapporter innehåller en relativt omfattande beskrivning av området cancerläkemedel med en beskrivning av tillgängliga läkemedel; vad som kommit in på marknaden under de senast åren och om vad som kan förväntas att komma in under den närmaste framtiden. I dessa rapporter samt i den planerade rapporten för 2009 redogörs för utvecklingen när det gäller användningen av cancerläkemedel i Sverige (nationellt och regionalt), samt hur den svenska användningen ser ut ur ett internationellt, europeiskt, perspektiv. Arbetet har även innefattat ett prognostiseringsarbete som under perioden 2007-2009 har fallit väl ut (se avsnitt 4). Ett centralt förslag från de tidigare rapporterna är att det behövs en ökad kunskap om hur cancerläkemedel används och att det är nödvändigt att sätta upp register och på så sätt få till stånd en strukturerad uppföljning. Detta är speciellt angeläget eftersom endast ca 5-8% av patienterna inom onkologin ingår i kliniska prövningar samtidigt som mycket av terapiutvecklingen sker efter registrering. Inom svensk onkologin har ett sådant projekt drivits fram av Nils Wilking, Ulrik Ringborg och Jonas Bergh. Ett nationellt registreringssystem skall nu komma på plats med registrering av individ, diagnos och läkemedel med vissa uppgifter om indikation, toxicitet och effektivitet. Detta arbete och denna databas kommer att hanteras via regionala onkologiska centra. Som en del av detta arbete utvecklas f n ett system för registrering av bröstcancerdata med stöd av en IT lösning från Health Solutions. Ett annat övergripande samarbete innefattande alla terapiområden pågår med en bas mellan SLL, Västra sjukvårdsregionen, region Skåne samt Östergötland. Detta arbete, i nära anslutning till NLT arbetet inom SKL, syftar till att tillvarata liknande registerdata och på så vis få uppgift om användning knutet till läkemedel, dock utan specifika effekt- och toxicitetsdata. 20(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 6.2. Individbaserade register över läkemedelsanvändning Sedan juli 2005 finns individbaserade data över befolkningens läkemedelsutköp lagrade i Socialstyrelsens läkemedelsregister. Med registret är det möjligt att separera nyinsättningar (incidens) från samtidiga användare (prevalens) och att studera förekomsten av troliga eller uppenbara kvalitetsbrister som dubbelförskrivning, inadekvat polyfarmaci (många läkemedel samtidigt) och interaktioner. Dessutom är det möjligt att studera i vilken ordning läkemedlen sätts in, med vilken dos och hur länge patienterna fortsätter att köpa ut sina läkemedel. Registret är ett viktigt verktyg för att studera introduktionen av nya läkemedel. Några studier där detta testats redovisas mer i detalj nedan. Personnumren gör även att läkemedelsregistret i princip kan kopplas till andra hälsodataregister, kvalitetsregister och journaldata, vilket innebär stora möjligheter att följa upp läkemedlens effekt och säkerhet. Detta kräver dock forskningsprotokoll och godkännande från etisk kommitté. Samkörning mellan patientregistret och läkemedelsregistret har inom ramen för specialläkemedelsprojektet provats för att studera på vilka diagnoser nya perorala cancermedel förskrivits. Projektet genomfördes hösten 2009 av apotekarstuderande Polin Bedro. För samtliga individer som köpt ut läkemedlen i SLL under 2008 studerades diagnoser i slutenvård och dagvård 20072008. Studien visade att totalt 455 patienter hade behandlats med ett eller flera av de aktuella cancerläkemedlen. I åldersgruppen 60-75 förekom den mest frekventa användningen. Överlag identifierades en större användning bland kvinnliga patienter. De flesta läkemedel förskrevs inom godkänd indikation. Ungefär hälften av de patienter som behandlades med erlotinib administrerades inte läkemedlet inpå slutskedet. Sex av åtta läkemedel var förmånsberättigade. 6.2.1 Datainsamling från Apotekets SALT-register Uppföljningsmöjligheterna har hittills varit särskilt begränsade för onkologiska medel. Dessa introduceras på sjukhusen där försäljningen från apoteken till stor del sker via rekvisition utan patientspecifik registrering. Behandlingen har hittills inte heller registrerats i de läkemedelsmoduler som utvecklats på sjukhusen, t ex TakeCare. För att följa upp hur nya cancerläkemedel använts har ett projekt initierats med samkörning av data från apotekets s.k. SALT-register. Detta register innehåller personnummerbaserade data för de onkologiska medel som ges som injektion/infusion och bereds vid samtliga sjukhusapotek i länet. Genom extraktion av patientdata och samkörning med diagnosdata från TakeCare och/eller nationella hälsodataregistren går det att få en uppfattning om på vilka indikationer de nya medlen ordinerats. Projektet har påbörjats efter tillstånd från Etikprövningsnämnden. Någon dataextraktion har dock ännu inte kunnat ske då ärendet för närvarande ligger för prövning hos stab juridik på Apoteket AB. Förhoppningsvis kommer detta under hösten att lösas så resultat kan tas fram i början av 2010. 6.2.2 Rapport om aromatashämmare I ett annat delprojekt och med hjälp av Monia El Mokrani har vi gjort en riktad genomgång av hur endokrin behandling av bröstcancer är utformad i Stockholm och i landet i övrigt. Vi har inom detta terapiområde tillgång till generiskt tamoxifen men även till nya väsentligen dyrare s k aromatashämmare (AI). Tilläggsvärdet av AI ser, i alla fall avseende överlevnad, ut att vara relativt begränsat. Trots detta har AI framför allt internationellt, men även nationellt, fått ett relativt starkt genomslag i terapin. Vi noterar att det föreligger stora internationella men även nationella skillnader i användningen. Vår målsättning är att komplettera detta material med data för 2009 och att sedan presentera våra resultat både 21(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 nationellt och internationellt. Till bilden hör att läkemedel inom AI gruppen börjar gå av patent under 2010, varför det också är av stort värde att bevaka att rätt preparat kommer till användning inom SLL. 6.2.3 Acompliarapport I november 2006 introducerades bantningsmedlet rimonabant (Acomplia) på svenska marknaden. Lanseringen föregicks av en stor massmedial uppmärksamhet vilket gjorde att risken för indikationsglidning och felanvändning var stor. Med hjälp av Socialstyrelsens läkemedelsregister studerades vilken behandling alla som nyinsattes på medlet hade fått tidigare, hur många av dem som samtidigt fick behandling med antidepressiva medel (depression/psykisk sjukdom var en kontraindikation) och hur länge de som påbörjade behandlingen fortsatte att köpa ut läkemedlet. Under det första halvåret behandlades 4.500 stockholmare (2.800 kvinnor & 1.700 män) med rimonabant till en kostnad av 11 miljoner kronor. Drygt var tredje (38%) hade sedan juli 2005 provat de andra registrerade bantningsmedlen Xenical och/eller Reductil. Av dem som fick läkemedlet hade 59% varken diabetesmedel eller lipidsänkare (kriterier på hög risk som medför subventionering av läkemedlet vid lägre BMI hos patienten) och hela 19% hade under samma period även köpt ut antidepressiva medel. Efter ett halvår kvarstod bara en tredjedel på behandlingen. Resultaten redovisades i Läkartidningen 2007, ref [12]. 6.2.4 Uppföljning av diabetesmedel Under 2007-2009 registrerades flera nya läkemedel för behandling av typ-2-diabetes, t ex. sitagliptin (Januvia) och exenatid (Byetta). I en studie undersöktes introduktionen av nya diabetesläkemedel i SLL, till vilka patientgrupper de förskrivits och om förskrivarna följt aktuella behandlingsrekommendationer. Data hämtades från Socialstyrelsens läkemedelsregister för alla som hämtat ut recept med sitagliptin eller exenatid under 20072008. I studien analyserades antal patienter som behandlats i SLL jämfört med andra landsting, vilka medeldoseringar de haft samt hur stor andel av dem som insattes på läkemedlen som hade behandlats med andra diabetesmedel tidigare. Analysen visade på en till stora delar rationell förskrivning. Under 2008 förskrevs sitagliptin till drygt 2% av alla patienter som behandlades med perorala diabetesmedel. Motsvarande siffra för exenatid var 0,5%. Hälften av de förskrivna recepten på sitagliptin kom från privata specialister och företagsläkare. Endast en mindre del 2 % respektive 1 % av patienterna nyinsattes på sitagliptin respektive exenatid utan att ha provat andra diabetesmedel tidigare. Merparten av patienterna använde sitagliptin och exenatid som tilläggsbehandling till andra diabetesmedel. Totalt 93 % respektive 91 % av patienterna köpte ut andra diabetesmedel samtidigt som utköp av exenatid respektive sitagliptin. Se Undersökning av introduktionen av två nya diabetesläkemedel - sitagliptin och exenatid, Somaya Salim, ref [13]. 6.3. Datainsamling ur journalsystem 6.3.1 Datainsamling med Rave3 ur Profdoc Journal III Rave3 är ett informationssystem från Medrave Software AB i Stockholm för att extrahera journaldata från ProfDoc och MediDoc, samt från juni 2009 även Swedestar och Take Care. Det används för närvarande på cirka 80 vårdcentraler i Stockholm och cirka 90 i övriga landet. Fler är på väg att ansluta. Vi har inom ramen för Acompliaprojektet testat 22(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 användbarheten av Rave3 i en retrospektiv journalgenomgång avseende förskrivningsrutiner för och uppföljning av bantningsläkemedlen rimonabant, orlistat och sibutramin. 300 slumpvis utvalda datajournaler (100 för vardera läkemedlet) vid 15 vårdcentraler i sydvästra läkemedelsområdet undersöktes. Resultaten återges kortfattat nedan, samt i ett manuskript som kommer att publiceras i Läkartidningen. I studien har metoden validerats genom manuell genomgång av datajournalerna. Rave3 visade sig vara ett bra verktyg för att utvinna data som dokumenterats under specifika sökord såsom diagnoskoder, laboratorievärden, blodtryck och läkemedelsförskrivningar. Rave3 kunde även underlätta sökandet efter data rörande t.ex. nikotinanvändning, vikt, längd, BMI, behandlingslängd och utsättningsdatum, men lämnade tyvärr många luckor eftersom journalföringen inte var enhetlig och variablerna ofta inte fanns dokumenterade under respektive sökord. Information rörande premisser vid insättning, initiativtagare, utsättningsorsaker, kost och motionsanamnes, livsstilsintervention, biverkningar och effekt kunde inte utläsas med någon större säkerhet av Rave3. Manuell komplettering krävdes därför för att dra slutsatser från materialet. Analysen visade att patienter som förskrevs bantningsläkemedel i primärvården var generellt sjuka. Många hade en uttalad fetma och många hade prövat flera andra bantningsläkemedel. Förskrivningen skedde till stor del på patientens initiativ. 2/3 hade fått läkemedlet förskrivet för kortare tid än 1 år. Utsättningsorsaker var sällan dokumenterade men bestod när de angavs vanligen av bristande effekt och/eller biverkningar. En stor del av patienterna vägdes inte före insättning av läkemedlet och följdes därefter inte upp inom ramen för en strukturerad kost- och livsstilsintervention. Sammanfattningsvis tyder genomgången på att bantningsläkemedel har en tveksam klinisk nytta på det sätt som de används i stora delar av primärvården. Studien pekar på ett stort behov av strukturerade uppföljningar i primärvården. Rave3 kan vara ett bra verktyg för retrospektiva läkemedelsuppföljningar i primärvården. Det krävs dock en noggrann kvalitetskontroll för att säkerställa att rätt information extraherats och en manuell komplettering för att dra säkrare slutsatser. Ett problem är att informationen från journalerna ofta är inkomplett. I den genomförda studien är avsaknaden av viktuppgifter (en nyckelvariabel för överviktiga) ett viktigt observandum och det går inte generellt att förvänta sig att man ska kunna dra några säkra slutsatser i andra fall då uppgifter saknas. Det är viktigt att användare av Rave3 anpassar sig till verktyget genom att registrera uppgifterna på rätt sätt i journalen. Hur detta skulle kunna gå till har diskuterats ovan (Kommentar om incitament). En artikel har accepterats för publicering i Läkartidningen (Forslund T, Hjemdahl P, Wettermark B, Raaschou P, Krakau I: Primärvårdsstudie tyder på tveksam nytta av bantningsläkemedel). Se Primärvårdsstudie tyder på tveksam nytta av bantningsläkemedel, ref [14] Efter godkännande av insänd etikansökan kommer analysen av studien att förfinas med en avidentifierad koppling av patientuppgifterna till Socialstyrelsens läkemedelsregister på individnivå för att komplettera bilden av patienternas medicineringsbeteeende, om de har fler förskrivare, etc. Detta avses publiceras i en internationell referentgranskad tidskrift. 23(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 6.3.2 Datainsamling ur Take Care med Intelligence – Karda Elektroniska läkemedelsmoduler är den viktigaste källan för information om de läkemedel som ordineras vid sjukhusens slutenvård eller dagvård. Inom ramen för specialläkemedelsprojektet bedrevs under 2009 ett projekt med datainsamling från journalsystemet TakeCare, se SPL-0039 Rapport LM-extraktioner TakeCare Final, ref [15]. TakeCare (Profdoc®) är ett system som utvecklats på Karolinska i Huddinge och som nu används av hela sjukhuset (Huddinge/Solna). I TakeCare går det enkelt att få fram data för en enskild patient men det har hittills varit mycket svårt att ta fram och sammanställa information om många patienter. Av denna anledning har extraktionsverktyget Intelligence nyligen utvecklats och kopplats direkt till TakeCare. Varje kväll extraheras information från Take Care till Intelligence, varur relevant information läses vidare till Karolinskas egna datalager, KarDa. Arbetet fokuserade initialt på en analys av vilka data som finns att tillgå samt databasstrukturer. Som pilotläkemedel valdes immunglobuliner och TNF-alfahämmaren infliximab (Remicade). Samtliga administreringar dessa under 2007 och 2008 extraherades av SLL-IT och levererades i form av dataset innehållande patienter (avkodat), samtliga ordinationer och administreringar av aktuella läkemedel samt koppling mellan läkemedelsadministrering och vårdhändelse. Analyserna lades sedan upp för att besvara nedanstående frågeställningar: - Hur många unika patienter har behandlats med läkemedlet under denna tidsperiod (periodprevalens) - Ålders – och könsfördelning - På vilken diagnos sker behandlingen - Vilken vårdavdelning har ordinerat läkemedlet - Genomsnittlig dosering - Hur många nya patienter har fått läkemedlet under 2008 som ej hade ordinationer av läkemedlet under 2007 (incidens) Projektet visade att det var fullt möjligt att extrahera relevanta läkemedelsdata för uppföljning av specialläkemedel i slutenvården. Sammanlagt analyserade data för 5647 respektive 3313 administreringar av infliximab respektive immunoglobuliner under tidsperioden 2007-2008. Det motsvarar drygt 600 patienter som fått infliximab och 300 patienter som fått immunglobulin. Dock saknades huvuddiagnos i flera fall, knappt 7 % (2007) respektive 12 % (2008) av alla läkemedelsadministreringar av infliximab. Motsvarande siffror för immunoglobuliner var hela 35,4 % (2007) respektive 28,3 % (2008). Fortsatt arbete behövs för att validera resultat samt att utvärdera möjligheterna till koppling till andra data (t ex labdata). Förutom på Karolinska Universitetssjukhuset används TakeCare idag av Södertälje samt Norrtälje sjukhus men beslut är taget att fler sjukhus i Stockholm ska få systemet. Det införs även vid samtliga primärvårdsenheter som tillhör SLSO. 6.4. Kvalitetsregisterstudier Specialläkemedelsprojektet identifierade tidigt de nationella kvalitetsregistren som samarbetspartners och potentiella källor till data för uppföljning av nya läkemedel. De flesta kvalitetsregister drivs av enskilda specialister eller specialistföreningar kring specifika sjukdomar eller kirurgiska åtgärder. Några erhåller nationellt stöd från Socialstyrelsen och 24(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 SKL. Då samlad information om registrens innehåll och omfattning saknats gjorde specialläkemedelsprojektet i samarbete med Läkemedelsverket och Karolinska Institutet sommaren 2008 en systematisk inventering av 109 kvalitetsregister med avseende på vilken information som finns om läkemedel, se SPL-0024 Läkemedel i kvalitetsregister, Desirée Loikas, ref [13]. Analysen fokuserade på följande frågeställningar: - Registreras läkemedlen som enskilda läkemedel? - Registreras ordinerad dos för de enskilda läkemedlen? - Registreras förskrivningsorsak? - Registreras behandlingstid? - Registreras behandlingseffekter? - Registreras biverkningar? - Används kvalitetsindikatorer för läkemedel i årsrapporten? Rapporten visade att enbart 61 av 109 register innehöll någon information om läkemedelsbehandling. Mängden läkemedelsinformation varierade stort mellan registren. Flera register registrerade t ex inte enskilda läkemedel som substans utan enbart som klass vilket begränsade deras värde för uppföljning av nya läkemedel. Ett generellt problem var även att kvalitetsregister endast täckte vissa somatiska diagnoser och bygger på frivillig inrapportering. Inom vissa områden, till exempel primärvård, psykiatri och tandvård, saknas nationella kvalitetsregister. Täckningsgraden i SLL varierade 2008 kraftigt mellan olika register. 6.4.1 PsoReg Projektet har samarbetat med Mona Ståhle, Hudkliniken, Karolinska Universitetssjukhuset och Marcus Schmitt-Egenolf vid Universitetssjukhuset i Umeå, vilka medverkat till att initiera ett kvalitetsregister (PsoReg) för uppföljning av läkemedelsbehandling vid allvarlig psoriasis. När delprojektet startades hade rekryteringen till registret precis startats. Specialläkemedelsprojektet bidrog genom delfinansiering av en assisterande sjuksköterska till stöd för fortsatt rekrytering samt medverkade vid informationsmöten om registret, projektet och läkemedelsbehandling vid psoriasis. Rekrytering av patienter har gått bra, särskilt i Stockholm. Dessvärre förelåg från början ingen tydlig plan för uttag av data avseende effekt, biverkningar, behandlingslängd och preparatbyten. En sådan utarbetas nu successivt, men hinner inte färdigställas innan projektet avslutas. Mera avancerade dataextraktioner har därför inte kunnat genomföras inom specialläkemedelsprojektets ram. Man har kunnat redovisa vilka systemiska läkemedel som givits som initial behandling efter registrering i PSOREG; tidigare systembehandling före registrets start kan dock ha förekommit. Av 503 patienter registrerade i SLL hade följande behandlingar registrerats: metotrexat (379), acitretin (Neotigason) (84), ciklosporin(17), thioguanin(Lanvis) (8) samt PUVA (15). TNF-alfa-antagonister registrerades som initialbehandling i 107 fall uppdelat på etanercept (Enbrel) 64, adalimumab (Humira) 27, infliximab (Remicade) 16. Efalizumab (Raptiva) som avregistrerades juni 2009 på grund av ökad risk för uppkomsten av progressiv multifokal leukoencefalopati samt begränsad klinisk effekt hade förskrivits som initial behandling till 16 patienter. 25(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Se även PSOREG strukturerad uppföljning cos 1.1, ref [17]. Generella slutsatser En fördel med att använda befintliga kvalitetsregister för uppföljning är att man snabbt kan komma igång för att på ett strukturerat sätt samla in patientdata. Dessutom har experter och förskrivare varit involverade både i att ta fram registret och sedan använda det, vilket borde öka möjligheten till att adekvata frågeställningar beaktas. En nackdel är att inmatningen av data blir tung om man inte kan se till att åtminstone en del extraheras automatiskt från patientjournaler. Det är också svårt att i efterhand påverka vilka data som kan inkluderas i en analys; man är hänvisad till de uppgifter som finns i registret. Kommunikation och tydliga avtal från början, inkluderande ekonomiska villkor, är ett krav innan projektet startas. Det måste från början vara tydligt klarlagt och avtalat vilken typ av data som skall extraheras och hur detta skall gå till rent praktiskt, inklusive vilka resurser som behövs för detta arbete. 6.4.2 Osteoporos Dan Mellström, Sahlgrenska, Kristina Åkesson, Malmö och Ove Törring, Stockholm medverkade under 2008 till att starta ett nationellt register för Speciella Läkemedel vid Osteoporos (SLO). Specialläkemedelsprojektet har lämnat ett ekonomiskt bidrag om 60000 kr för att registret skulle kunna etableras. Flera nya läkemedel för behandling av osteoporos vilka bygger på nya behandlingsprinciper har introducerats under senare år: paratyroidea hormon 1-34 (Forsteo®), paratyroidea hormon 1-84 (Preotact® ), strontium ranelat (Protelos®), bisfosfonat (zoledronsyra, Aclasta), monoklonala antikroppar (Denosumab), eventuellt kathepsin-K inhibitorer m.fl. Det är angeläget att registrera patienter som använder dessa läkemedel för att dokumentera behandlingseffekter, biverkningar och långsiktiga effekter med målsättningen att bidra till att kostnadskrävande läkemedel blir tillgängliga för de patienter som har störst nytta av dem och att behandlingen baseras på evidens. SLO-registret har placerats i Lund och administreras av Nationellt Kompetenscentrum Ortopedi (NKO). NKO sköter sen flera år flera andra register, såsom de väldokumenterade höft- och knä-plastikregistren. SLO-registret använder en enkel on-line registrering med minimal arbetsbörda för förskrivaren. 6.5. Strukturerade mallar Prospektiv insamling av strukturerade data är det bästa sättet att dokumentera nyttan och eventuella problem som användningen av ett nytt läkemedel i sjukvården medför. Det har sedan 1999, då FoUU-kommittén på Karolinska Sjukhuset beviljade startbidrag för JULIUSprojektet, funnits ett intresse att utveckla strukturerade mallar som kunde interagera med datajournalen på ett sätt så att dubbelinmatning av data kunde undvikas. Dessa mallars innehåll skulle även synkroniseras med behoven från berörda kvalitetsregister (t.ex. diabetesregistret) för att undvika dubbelinmatning. JULIUS-projektet lades ned efter att ha genomgått flera faser med ledningsbyte och problem relaterade till samordning med GVD 26(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 (Gemensam VårdDokumentation), men det har satt vissa spår i SLL:s fortsatta IT-strategi. Inom reumatologin har man framgångsrikt utvecklat en bra uppföljning av TNF-alfahämmare genom ett nationellt samarbete i form av ett kvalitetsregister som just syftar till att följa upp behandlingseffekter med nya dyra läkemedel. 6.5.1 Enkla fristående lösningar Med utgångspunkt från tankarna i JULIUS-projektet försökte specialläkemedelsprojektet utveckla en fristående webbaserad tillämpning för prospektiv insamling av information från vården. Den avsåg att användas för patienter som behandlas med bantningsläkemedel (Acomplia, Reductil och Xenical). Den utvecklades i SAS-miljö och använde inmatningsverktyget Pheedit, som tidigare använts i bl.a. kliniska prövningar. Mallar för inmatning av relevant information konstruerades inom delprojektet för Acomplia, vilket innefattade specialister inom diagnosområdet. Mallarna gjordes tillgängliga för förskrivande läkare genom separat inloggning i systemet. Efter en kort testperiod beslöts i projektet att inte fortsatta att använda Pheedit-tillämpningen. Det fanns fem skäl till beslutet: 1. Säkerhetsfrågorna kunde inte lösas på ett tillfredsställande sätt utan mycket stora utvecklingsinsatser. 2 Det tog för lång tid för förskrivarna att logga in och att registrera information vid förskrivningstillfället. 3 Det fanns ingen brygga som kunde föra in registrerad information i journalsystemet och/eller hämta i journalen befintlig information till mallen. Manuell dubbel inmatning i Pheedit-applikationen och i journalsystemet uppfattades som ett tidsödande dubbelarbete. 4 Drift och förvaltning av en fristående tillämpning blir förhållandevis dyr. 5 Frågan om lämpliga incitament för att utföra merarbete i vården var svårlöst. Slutsatsen i projektet är att en helt fristående, webbaserad lösning för prospektiv insamling av patientdata med Pheedit eller liknande verktyg inte är en framkomlig väg för strukturerad uppföljning. Fördelen hade annars varit att datainsamling skulle ha kunnat ske brett och vara (tämligen) oberoende av journalsystem. 6.5.2 Integrerade lösningar med Journalsystem mm När projektet inte lyckades komma fram med en helt fristående lösning enligt ovan, undersöktes olika möjligheter till integration med andra system för att skapa bättre förutsättningar för användning av systemen. Först studerades möjligheter att skapa en funktion som automatiskt skulle öppna ett sidofönster när läkaren förskrev ett visst läkemedel i sitt journalsystem. En brygga med hjälp av teknik från JANUS-fönster var en möjlig väg att gå, men vi fann att det skulle innebära ganska stora utvecklingsinsatser för att skapa en bra lösning och resurstillgången för att göra arbetet var begränsad. Dessutom skulle det krävas separata lösningar för varje journalsystem. Alternativet realiserades således ej. Vi undersökte också möjligheter till direkt koppling till journalsystemen för lagring av information från externa mallar, men på grund av att resurser inte kunde mobiliseras hos journalsystemleverantörerna (Take Care och Profdoc) genomfördes inga försök med sådana 27(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 kopplingar. Vid den tiden så fanns även osäkerhet om införande av journalsystem och vilket system som var lämpligt att vidareutveckla på längre sikt inom SLL. I stället gjorde vi en bred utredning om möjliga vägar att skapa integrerade lösningar för prospektiv datainsamling för strukturerad uppföljning. Utredningen finns i rapporten SPL0029 Specialläkemedel, Krav och förslag på teknisk lösning, referens [18]. Vi analyserade också grundligt vilket informationsinnehåll en sådan funktion skulle leverera, genom att ta fram en informationsmodell, SPL-0031 Informationsmodell inkl klassdiagramrapport, referens [19]. Rapporten påvisar att det kortsiktigt (februari 2009) inte fanns någon naturlig väg att gå för att skapa integrerade lösningar för prospektiv datahantering för strukturerad uppföljning. Däremot pågår annan utveckling inom SLL och nationellt för att skapa miljöer och plattformar, t ex KAISA-miljön, som på sikt kan utgöra grund för de system och funktioner som kan komma att behövas för prospektiva studier av läkemedelsbehandling. Därför beslöt styrgruppen att invänta annan utveckling av IT-systemstöd, innan specifikt stöd för prospektiva studier skapas. Det är viktigare att identifiera pågående utveckling och ansluta sig där. Noteras bör dock att en högkvalitativ uppföljning fordrar en lösning (t.ex. mallar/formulär) som efterfrågar komplett datainmatning avseende efterfrågade variabler. Uppföljning baserad på inventering av spontan och ostrukturerad inmatning av information i datajournalen (s.k. data mining) har klara begränsningar ur kvalitetssynpunkt. En sådan uppföljning gjordes dock av Acomplia-projektet i primärvården - se punkt 6.3.1. 6.6. Patientrapporterade data En stor möjlighet när det gäller att samla in information om hur läkemedelsbehandling har utfallit är att samla in information direkt från patienterna genom de verktyg på Internet som nu börjar användas. Ett framgångsrikt exempel på patientrapporterad data är Reumaregistret, där patienterna själva kan beskriva sin hälsostatus. 6.6.1 Patientrapporterade data med Mina Vårdkontakter Mina Vårdkontakter (MVK) är ett webbaserat system inom Vårdguiden som är infört på många vårdenheter inom SLL och även inom andra landsting. Användningen växer för närvarande kraftigt. Patienter kan bland annat hämta information och boka tider på sin vårdcentral. Vårdpersonal kan skicka ut resultat av provsvar och påminnelser olika meddelanden till patienterna. I projektet har vi genomfört prov med att låta patienter, med diagnos övervikt, dyspepsi eller reflux vid 3 vårdcentraler, att hemifrån besvara webbaserade frågeformulär angående sitt hälsotillstånd en månad efter vårdbesök och läkemedelsbehandling. Vi har varit noga med att informera om att provet tills vidare är ett komplement till annan behandling. Efter en mycket kort försöksperiod under hösten 2009, har vi konstaterat att • det tar tid att ställa om arbetssätt i vården • det tar tid för patienter att välja nya informationskanaler 28(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin • Datum 2010-02-10 Version p1.0-11 SPL-0038 ett fåtal patienter ser dock stora fördelar med webbaserad kommunikation med vårdpersonalen och anammar det snabbt Provet kommer att fortsätta i annan regi efter projektet och utvärderas djupare under 2010. se även utvärderingsrapport, ref [20]. Här finns stora möjligheter till vidareutveckling för att skapa kommunikation mellan patienter och vårdgivare på ett säkert och effektivt sätt. Inte minst när det gäller att få patientens egen syn om hur de svarar på läkemedelsbehandling. 6.7. Behov av god datakvalitet Alla typer av uppföljning av läkemedelsförskrivning är meningslösa om bortfallet blir avsevärt eller om de registrerade uppgifterna är av dålig kvalitet.. Det går då inte att få en tillräckligt korrekt bild av ett läkemedels användning, effekter och biverkningar för att en meningsfull analys ska kunna genomföras och slutsatser blir inte tillräckligt underbyggda för att ha något värde. I retrospektiva studier är kvaliteten beroende av hur väl de uppgifter man behöver noterats i journaler och liknande. Med utnyttjande av läkemedelsregister som sköts av Socialstyrelsen och Apoteket kan data av mycket hög kvalitet erhållas avseende patienternas utköp av läkemedel. Noteringar om förskrivning eller ordinationer bör finnas tillgängliga i datajournaler. Kompletterande kliniska uppgifter kan däremot vara svåra eller omöjliga att få tag på, vilket kan begränsa analysens värde. Information om läkemedelsutköp kan dock vara fullt tillräcklig om frågeställningen är begränsad. Dessutom kan, efter inhämtande av tillstånd från etikprövningsnämnd, samkörning av Läkemedelsregistret med andra register göras med avidentifierade data för övergripande frågeställningar men inte för riktade uppföljningar. Data från kvalitetsregister håller mycket olika kvalitet. Bortfallet är ofta stort både avseende inrapporterade patienter och deltagande kliniker/verksamheter. Dessutom föreligger ofta en selektion genom att endast vissa förskrivare eller vissa grupper av förskrivare registrerar patienter. De data som registreras avseende läkemedelsbehandlingen kan också vara ofullständiga eller svåranvändbara för uppföljning. En fördel är dock att man snabbt kan initiera en strukturerad uppföljning och att experter och förskrivare vanligen är involverade både i att utforma registret och att använda det. Det finns en potential för ackumulering av högklassiga data, vilket erfarenheter med några register visat. 6.8. Kommentar om incitament Prospektiva studier innebär alltid ett mycket betydande arbete. För att de resurser som satsats på en prospektiv studie ska stå i rimlig proportion till utbytet är det viktigt att de data som genereras är av hög klass, så att viktiga slutsatser kan dras. Samtidigt krävs goda incitament för att sjukvårdspersonalen skall medverka till att skapa tillförlitlig dokumentation för uppföljningssyftet. Analys av ett läkemedels användning, effekter och bieffekter är alltid beroende av kvaliteten på de data som analyseras. Alla eller ett representativt urval av de patienter som fått det 29(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 aktuella läkemedlet måste inkluderas och bortfallet måste vara begränsat. Vidare måste de parametrar som bedömts viktiga att följa för att analysera effekter och bieffekter på något sätt registreras i journalen (eller i mall/formulär), ånyo utan större bortfall och så att de är tillgängliga för senare analys. Vilken metod som än används för att registrera dessa parametrar måste den stödja en väsentligen fullständig registrering. Prov för laboratorieparametrar måste tas som planerat, blodtryck och andra kliniska parametrar måste mätas och registreras korrekt och som planerat och anamnestiska och undersökningsbaserade uppgifter måste registreras vid avsett tillfälle och på korrekt sätt och journalföras på ett entydigt sätt. Detta kräver god organisation och inte minst ett tydligt incitament för de medarbetare som ska utföra registreringen att fullgöra denna på ett fullt tillfredställande sätt. • • • • • En effektiv form av incitament är återkoppling av data, så att den förskrivande läkaren – och eventuellt även patienten - kan se resultatet av behandlingen för enskilda patienter och/eller för alla egna patienter, kanske i jämförelse med de patienter som behandlas av alla förskrivare inom ett definierat område, geografiskt eller inom samma specialitet. Incitament kan utgöras av tvingande lagar eller bestämmelser från myndigheter - som att skriva journal eller göra smittskyddsanmälan. De kan bestå av förordningar från huvudmän kopplade till ersättningen för sjukvårdsinsatsen. Ersättningen för given vård kan ökas om förskrivaren medverkar i strukturerad uppföljning av det aktuella läkemedlet. Den kan omvänt begränsas om förskrivaren inte medverkar. Slutligen kan naturligtvis ekonomisk ersättning till vårdenheten eller ren personlig ersättning i någon form användas som incitament. Incitament i form av ekonomiska medel har inte använts i projektet. Det är också värt att notera att incitamenten i sig kan snedstyra vården och försämra datakvaliteten, lite beroende på hur de utformas. Med hänsyn till det betydande arbetet vid genomförandet av läkemedelsstudier är det angeläget att skapa och utnyttja tekniska möjligheter för automatisk registrering av så mycket uppgifter som möjligt 7. Modell för Strukturerad uppföljning och styrning Modellen är beskriven i några flödesscheman med tillhörande textbeskrivning. Översiktligt redovisas fyra beslutspunkter och de aktiviteter som genomförs när man genomlöper modellen. Modellen anger också vilken grupp eller roll som tar beslut och genomför respektive aktivitet. Modellen har primärt skapats för att användas inom SLL, men under projekttiden har samarbetet med övriga landsting mognat, så att det nu är lämpligt att gå vidare och anpassa modellen till gemensam landstingsövergripande användning. 30(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 För utförlig beskrivning se SPL-0040 Modell för strukturerad uppföljning, ref [21]. Externa beslut LMV – EMEA Läkemedelsgodkännande Beslut Delprocesser Beslutsgrupp för nya läkemedel Beslut 0: Förbered SU Gör R2 Ansvarig för Framtidsspaning Beslutsgrupp för nya läkemedel Beslut 1: Variant av SU Ett eller flera alternativ väljs Görs av Bevaka förskrivningen Ansvarig för SU Genomför fortbildning Ansvarig för SU Genomför riktad uppföljning Ansvarig för SU Beslut 2: Fortsätt SU Beslutsgrupp för nya läkemedel Gör slutrapport Beslut 3: Avsluta SU Ansvarig för SU Beslutsgrupp för nya läkemedel Bild 5. Översikt strukturerad uppföljning. 7.1. Beskrivning av Strukturerad uppföljning Modellens övergripande syfte är att skapa en ur såväl medicinsk som ekonomisk synvinkel samordnad och ändamålsenlig användning av specialläkemedel/fokusläkemedel. Genom att följa en gemensam modell skapas bättre förutsättningar för terapiområdesövergripande erfarenhetsöverföring, resursfördelning och informationsutbyte. Det finns många olika möjligheter att genomföra strukturerad uppföljning. Inom Specialläkemedelsprojektet provades följande sätt: • • • Uttag av individbaserade data över befolkningens läkemedelsutköp lagrade i Socialstyrelsens läkemedelsregister. Samkörning av data från Socialstyrelsens förskrivningsdatabas med diagnoser från patientregistret för att koppla uppgift om läkemedel till diagnos. Datainsamling med Rave3 ur Profdoc Journal III. 31(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin • • • • • Datum 2010-02-10 Version p1.0-11 SPL-0038 Datainsamling ur Take Care med Intelligence – Karda. Uppföljning via kvalitetsregister av patienter. Utveckling av en fristående webbaserad tillämpning för prospektiv insamling av information från vården. En randomiserad studie av bantningsläkemedel i jämförelse med effektiv livsstilsintervention planerades men kunde ej realiseras på grund av resursbrist. Datainsamling från patienter med hjälp av Mina Vårdkontakter. Alla modellerna ovan har sina för- och nackdelar och fortsatt metodutveckling krävs. Val av modell måste också anpassas till vilken typ av läkemedel som skall följas upp och vilken information som skall inhämtas. 7.2. Organisation Tillämpningen av modellen leds av en Beslutsgrupp för nya läkemedel. Beslutsgruppen fattar alla beslut när ett nytt läkemedel genomlöper processen. Beslutsgruppen består av representanter för flera enheter inom SLL. Som ett minimum finns en representant från SLL:s beställarorganisation, HSN-f, en från kunskapsorganisationen och en från vården. För varje nytt läkemedel som ska följa modellen så utses en person som är ansvarig för strukturerad uppföljning (Ansvarig för SU) av det aktuella läkemedlet. Personen följer läkemedlet igenom hela den process som beskrivs i modellen. Befintliga enheter i organisationen ska arbeta enligt modellen efterhand som de aktiveras (till exempel expertgrupper, fortbildningsenheten inom MKC, KI, vårdpersonal). 8. Nationellt samarbete Projektet identifierade tidigare behovet av samverkan med andra landsting och myndigheter. I bilden nedan visas specialläkemedelsarbetets komponenter, markerade i olika färger beroende på om aktiviteterna bör genomföras regionalt, delvis nationellt eller helt nationellt. 32(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 Nationellt Delvis nationellt Enskilt landsting/region SPL-0038 Industrikontakter Horizon scanning - identifiering - filtrering - värdering R1 Prognos Värdering R2 Prioritering/beslut Strukturerat införande - rek/konsensus - uppföljningsplan Kommunikation Budgetering Kontakter SOS/TLV/SBU/LV Genomföra strukturerat inf. Utvärdering - medicinskt - hälsoekon. NLT-gruppen (SKL) Bild 6. Fördelning av specialläkemedelsarbetet nationellt vs regionalt 8.1. 4-länsgruppen Region Skåne, Stockholms läns landsting, Västra Götalandsregionen och Landstinget i Östergötland har sedan många år ett etablerat samarbete för läkemedelsfrågor inom den så kallade 4-länsgruppen. Under 2008 beslöt den övergripande styrgruppen för 4-länssamarbetet att bilda en gemensam arbetsgrupp för att utveckla arbetet kring introduktion av nya läkemedelsbehandlingar. Under 2008-2009 har ett successivt samarbete vuxit fram mellan specialläkemedelsprojektet och motsvarande grupperingar i de andra landstingen/regionerna. Detta hade vid slutet av 2009 resulterat i: - gemensam händelselista (för patentbevakning mm) mellan landstingen - samverkan kring gemensam databas för framtidsspaning (se avsnitt 3). - benchmarking av prognoser och kostnadsutvecklingen inom läkemedelsområdet - samordning av kontakter med läkemedelsindustri och myndigheter (se nedan) - erfarenhetsutbyte om andra aspekter kring specialläkemedel såsom kontakter med kvalitetsregister och modeller för decentraliserat kostnadsansvar Samarbetet kommer att vidareutvecklas under 2010 och ske i form av gemensamma aktiviteter men också genom att fler arbetsuppgifter fördelas mellan landstingen. Skåne har rekryterat en koordinator som samordnar arbetet. 8.2. SKL och övriga landsting Sommaren 2007 erbjöd SLL andra landsting samverkan med SLL runt specialläkemedel för en årlig grundavgift och ersättning proportionell mot landstingets andel av statsbidraget för läkemedelsförmånen (REF erbjudandet). En möjlighet gavs även för andra landsting att påverka sin kostnad genom aktiv medverkan i projektet (t ex att skriva tidiga 33(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 bedömningsrapporter). Erbjudandet presenterades vid möte med alla landstingsdirektörer och mötte flera positiva reaktioner. Av flera orsaker (bl.a. osäkerheter om bildandet av NLT hos SKL och samtidiga framväxten av fyrlänsarbetet) resulterade det i att samarbetsavtal enbart tecknades med Västmanland. Inom ramen för detta samarbete har dock Västmanland prenumererat på bedömningsrapporter och värderingar samt deltagit vid pipelinemöten med företag och haft fortlöpande access till specialläkemedelsprojektets interna arbetsmateriel. Prognosworkshop arrangerades hösten 2008 och i december 2009. Vid dessa deltog förutom Västmanland även representanter från fyrlänsgruppen, Uppsala, Gävleborg, Värmland, Södermanland och Dalarna. Under 2009 bildade SKL en ny landstingsgemensam arbetsgrupp för riktlinjer om uppföljning och utvärdering av nya läkemedel och nya läkemedelsbehandlingar, kallad Landstingens beredningsgrupp Nya LäkemedelsTerapier (NLT-gruppen). Gruppens arbetsformer och inriktning är inte helt klara. Vid landstingsdirektörsmötet i oktober diskuterades att SLL:s arbete med framtidsspaning och tidiga bedömningar av nya läkemedel från 2010 med nationell finansiering helt skall utföras i samverkan med övriga i 4länsgruppen och kopplas till NLT. Definitivt beslut väntas i februari 2010 8.3. Myndigheter Vissa myndighetskontakter har ägt rum inom ramen för projektet. Läkemedelsverket inbjöds tidigt till en dialog kring pipeline och möjligheterna att utbyta information för bedömning och värdering av nya läkemedel. Detta visade sig dock av juridiska skäl svårt och förnyade diskussioner har inte förts. Samarbete inleddes dock med Läkemedelsverket kring uppföljning där Läkemedelsverket bidrog med expertis i rapporten om läkemedel i kvalitetsregister (se 6.4) som följdes upp av en workshop i Uppsala kring biverkningsuppföljning i kvalitetsregister. Vid workshopen gavs flera bra exempel på hur en god läkemedelsregistrering kan ordnas i registren och en fortsatt handlingsplan diskuterades. Socialstyrelsen har bjudits in till vissa fyrlänsmöten och deltagit i diskussioner främst kring prognoser. Kontakterna med TLV begränsar sig till diskussion hösten 2009 om access till specialläkemedelsprojektets pipelineinformation. Inga kontakter har hafts med SBU. I framtiden planeras myndighetskontakterna kring specialläkemedel att kanaliseras via NLT. 9. Industrikontakter Inom specialläkemedelsprojektet har successivt utvecklats former för dialog med LIF och enskilda läkemedelsföretag kring olika delar av processen kring nya läkemedels introduktion. Möten har ägt rum med flera läkemedelsföretag omväxlande i Läkemedelscentrums lokaler respektive hos berörda läkemedelsföretag. Specialläkemedelsprojektet har representerats av olika personer från arbetsutskottet. Karaktären på dessa möten har varierat från att vara av mer sonderande natur och beröra SLL:s organisation och arbete i allmänhet kring introduktion av nya läkemedel i sjukvården till mer konkreta fokuserade diskussioner kring de olika företagens pipeline och andra förväntade förändringar på läkemedelsmarknaden (tex. patentutgångar, nya studier). Under hösten 2009 har det i SLL bildats en övergripande samverkansgrupp mellan LIF och SLL för allmänna diskussioner kring läkemedelsfrågor. 34(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Gruppen har bara haft några möten och vid dessa diskuterat läkemedelsfrågorna i stort i SLL. Proceduren kring nya läkemedels introduktion har dock lyfts som ett angeläget ämne som kommer att diskuteras i den grupperingen, med målet att finna ett ”generiskt” samverkansavtal för strukturerade uppföljningsstudier. 9.1. Möten om läkemedel i pipeline Pipelinemöten har arrangerats med 11 företag (BMS, Glaxo, Wyeth, Pfizer, Novartis, Shering-Plough, AstraZeneca, Abbott, Sanofi, MSD och UCB Pharma). På några företag har även prognosen presenterats och diskuterats. Företagen har visat ett öppet intresse för samverkan och i de flesta fall redovisat mycket detaljerad information kring läkemedel under klinisk utveckling. Den information som har diskuterats angående nya läkemedels har bland annat omfattat avslutade och pågående kliniska studier, nya läkemedels plats i terapin, förväntade patientpopulationer samt tidplan för förväntat godkännande, men i vissa fall t.o.m. även strategier kring lanseringen. Informationen har varit värdefull för projektets tidiga bedömningar och prognoser. 9.2. Hearing-möten Läksak har haft specifika hearingar för samtliga ledamöter och inbjudna expertgruppsordföranden kring bl.a. antikoagulantia, onkologiska medel, TNF-alfahämmare, diabetes och generaliserad smärta. Vid dessa diskuteras läkemedel i pipeline. Samtliga berörda företag bjuds in att ge en kort muntlig presentation för att besvara vissa i förväg formulerade frågeställningar. Dessa är inte en del av specialläkemedelsprojektet och behandlas därför inte mer i detalj i detta dokument. De utgör dock en väl fungerande modell för dialog med industrin kring införande av nya terapier. 9.3. Möten om strukturerad uppföljning Projektets modell för strukturerad uppföljning har inte oväntat rönt särskilt intresse från företagen. Några företag upplever att en ökad styrning enbart syftar till att spara pengar i landstingsbudgeten genom att fördröja introduktionen av läkemedel, medan andra även uttryckt stort intresse för de möjligheter som modellen ger att följa upp användningen av egna läkemedel i klinisk praxis. Flera företag har understrukit att de har samma intressen som vi, nämligen att få en adekvat effekt- och säkerhetsuppföljning av sina respektive läkemedel. De har också framhållit att det finns en parallell till TLV:s krav på uppföljning av läkemedelsförskrivningen i relation till förmånsbegränsningar. Konkreta diskussioner kring samverkan runt strukturerat införande/strukturerad uppföljning för specifika produkter har förts med några företag. Något konkret avtal har detta ännu inte lett till. Principdiskussioner kring samverkan med industrin har förts med Läksak som ställt sig positiva till att samverka kring protokoll och uppföljningsstudier, dock med reservation för samverkan runt fortbildning av vårdpersonal. Avtal bör kunna tecknas för intresserade företag, gärna även i samverkan med akademin/Karolinska Institutet som tredje part för uppföljningsstudier,. Detta förutsätt dock att det går att finna samsyn mellan SLL och företaget kring hur ett specifikt läkemedel bör användas. Då någon etablerad modell för uppföljningsstudier ännu inte kommit till stånd föreslås en fortsatt satsning på detta under 2010. Det inkluderar även att i samverkan med LIF ta fram ett generiskt avtal. 35(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 10. Internationellt samarbete De flesta nya läkemedel introduceras samtidigt i hela EU. Det skulle vara en stor fördel med enhetliga principer för strukturerat införande inom sjukvården i hela EU för att mer systematiskt kunna följa upp läkemedlens effekt och säkerhet. Ett ökat internationellt samarbete inom sjukvården är också angeläget för att bättre kunna möta läkemedelsföretagen som i allt större utsträckning arbetar globalt. Tänkbara områden för internationellt samarbete som identifierats av projektet är: - horizon scanning - (kriterier för) läkemedelsvärdering - miniminivå för innovation och registrering - Effekt- och säkerhetsvärdering av särläkemedel - prisförhandling av biologiska läkemedel - finansiering, koordinering och metodutveckling för producentobunden klinisk forskning, i synnerhet för små patientgrupper 10.1. Piperska gruppen I januari 2008 stod specialläkemedelsprojektet i samarbete med Karolinska Institutet värd för en internationell konferens kring rationell läkemedelsterapi och introduktionen av nya dyra läkemedel i Europa. Representanter från nio länder deltog och behovet av systematisk introduktion och uppföljning av nya dyra läkemedel diskuterades som ett prioriterat område. Då mötet ägde rum på Piperska Murens konferensgård tog sig arbetsgruppen namnet ”Piperska gruppen”. Sedan mötet ägde rum har gruppens arbete resulterat i ett antal publikationer och en kurs i Glasgow sommaren 2009 med titeln ”The managed entry of new medicines”. Programmet byggdes upp kring processen runt ett nytt läkemedels introduktion i sjukvården med omväxlande föreläsningar och seminarier kring olika komponenter som horizon scanning, prognostisering, kritisk läkemedelsvärdering, uppföljningsstudier och hur man utvecklar kliniska guidelines. Nästa möte i gruppen planeras äga rum i Berlin i februari 2010. 10.2. Hur bedrivs strukturerad introduktion av nya läkemedel i andra länder Sommaren 2009 gjorde Cecilia Eriksson en litteraturstudie om hur andra länder arbetar med introduktion av nya medel, The managed introduction of new medicines in Europe ref [22]. Strukturerade informationssökningar gjordes på PubMed och Google med följande sökord: Introduction of new drugs, horizon scanning, forecasting, critical drug evaluation, monitoring prescribing, independent studies, risk sharing, pricing and reimbursement. Mail skickades även till utvalda kontaktpersoner i ett tjugotal EU-länder för att undersöka hur länderna arbetar med dessa frågor. Rapporten visar att flera länder idag arbetar strukturerat med horizon scanning och värdering av nya terapier (s k health technology assessment). Arbetsformerna skiljer sig dock mellan länder där vissa länder har separata organisationer för läkemedel och övriga medicinska teknologier medan andra har integrerade lösningar. Det skiljer sig också avseende om arbetet sker regionalt eller nationellt. Även regelverk och innovativa modeller för prissättning och förmånsbeslut kring nya läkemedel finns dokumenterat från flera länder. Variationerna är dock stora. Ett område det i stora drag saknas litteratur om är prognoser och strukturerade uppföljningsstudier utifrån sjukvårdshuvudmännens behov. Sannolikt publiceras det mesta enbart på respektive lands 36(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 originalspråk. Det är angeläget att de erfarenheter som skapats genom specialläkemedelsprojektet publiceras internationellt. 11. Hälsoekonomi I projektplanen för Specialläkemedelsprojektet står under rubriken Projektmål bland annat • ”Föreslå hur hälsoekonomiska beräkningar ska kunna appliceras för att belysa de ekonomiska effekterna av användning av specialläkemedel. Tydliggöra ekonomiska konsekvenser av introduktion av nya läkemedel. ” När en patient behandlas med ett läkemedel uppstår kostnader och effekter. Det är då rimligt att söka svar på om kostnaden står rimlig proportion till den uppnådda effekten och hur kostnad-effektivitet är i förhållande till annan behandling. Den hälsoekonomiska analysen görs för att – i kombination med andra data – kunna användas för att bedöma ett nytt läkemedels ändamålsenlighet och för att kunna prioritera inom och mellan patientgrupper. Modeller kan ibland vara användbara för att få en tidig uppfattning om de ekonomiska konsekvenserna av ny terapi och samverkan med hälsoekonomisk expertis kan sannolikt bidra till en förbättrad analys av data För att få ett mått på den hälsoekonomiska effekten av ett nytt läkemedel jämförs effekterna med motsvarande kostnader och effekter om behandlingen inte genomförs. En sådan hälsoekonomisk analys baseras vanligen på kliniska studier med ideala förutsättningar och ett snävt urval av patienter samt en schablonisering av kringkostnader. Modellen riskerar att bli väl teoretisk och det kan finnas ett behov att se hur den förhåller sig i en klinisk verklighet baserad på faktiska data, som skulle kunna härröra från en strukturerad uppföljning. Behovet av hälsoekonomisk analys är beroende av vilken typ av användning man kan förvänta sig av ett nytt läkemedel. Ibland är hälsoekonomisk analys inte motiverad, medan den i de flesta fall kan utgöra en avgörande del av den totala utvärderingen. Är priset lågt, förskrivningen mycket låg och/eller att läkemedlet fyller ett länge eftersökt behov är behovet av en avancerad hälsoekonomisk modell oftast begränsat. En typisk indelning av kostnader och effekter för behandling är: 1. Direkta kostnader för behandlingen (läkemedelskostnad, övrig behandlingskostnad) 2. Övriga vårdkostnader (öppenvårdskostnader, slutenvårdskostnader, hjälpmedel, hemtjänst) 3. Indirekta kostnader (reskostnader för patient och anhöriga, transporter, produktionsbortfall i samband med sjukvård och sjukskrivning) 4. Effekter för patienten (livskvalitet, livslängd, kvalitetsjusterade levnadsår, antal symptomfria dagar, arbetsduglighet, förtidspension). Hälsoekonomi kan analyseras med flera olika metoder, såsom sjukdomskostnadsanalys, kostnadsnyttoanalys, kostnadsintäktsanalys, kostnadseffektanalys och 37(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 kostnadsminimeringsanalys. En viktig aspekt i alla hälsoekonomiska studier är ur vems perspektiv beräkningarna görs. I Sverige gör idag TLV hälsoekonomiska bedömningar av alla nya läkemedel som avses inkluderas i läkemedelsförmånen. TLV:s uppdrag är att värdera kostnadseffektiviteten ur ett samhällsperspektiv. Det innebär att TLV även tar hänsyn till hur en behandling påverkar sjukskrivningar, kommunal omsorg mm utanför sjukvården. I teorin skulle TLVs underlag kunna utgöra ett underlag för prioriteringar mellan olika områden i samhället och inte bara mellan olika insatser inom hälso- och sjukvården. Sådana omprioriteringar kräver dock att intäkter och utgifter inom olika samhällssektorer synliggörs samt att utgifter och intäkter går ihop. I verkligheten är det svårt att fördela om pengar mellan olika samhällsektorer. Att läkemedel blir subventionerade ur ett samhällsekonomiskt perspektiv kan därmed, trots att läkemedlen bedöms vara kostnadseffektiva, leda till att utrymmet för andra angelägna åtgärder inom hälso- och sjukvården minskar. Det är därför naturligt att landstingen bedömer nyttan av nya läkemedel ur ett sjukvårdsperspektiv och prioriterar mellan olika patientgrupper och behov. Idag saknas ofta bra underlag för hur de samhällsekonomiska kostnaderna och vinsterna fördelas mellan landsting, kommun, stat och patient. Av de 250 ansökningar för nya läkemedel som TLV beslutat om mellan åren 2003-2008 var endast 5 % utformade så att det gick att identifiera kostnader för landstingen. Denna problematik samt det faktum att TLV endast bedömer öppenvårdsläkemedel har uppmärksammats och lett till en ny handlingsplan för effektivare läkemedelsanvändning som kom ut våren 2009. Där föreslås TLV få i uppdrag att årligen ta fram en rapport, som belyser de beräknade effekterna av de prisbeslut som fattats under året samt att följa upp tidigare fattade beslut för de läkemedel som står för den mest betydande kostnadsökningen under året. I handlingsplanen föreslås även TLV ges i uppdrag att värdera alla läkemedel ur ett samhällsekonomiskt perspektiv oavsett om de skall förskrivas i öppen eller sluten vård. Specialläkemedelsprojektet hade för avsikt att skapa bättre underlag för hälsoekonomiska analyser utifrån sjukvårdens perspektiv. I projektet skisserades en modell för bedömning av ekonomiska konsekvenser för olika intressenter av introduktion av nya läkemedel. I de tidiga bedömningsrapporter (R1) som getts ut har vi redovisat en analys av potentiella målgrupper och tänkbara kostnader för nya läkemedel i relation till befintlig terapi. Ett naturligt ytterligare steg vore därför att belysa övriga kostnader för vård av den aktuella sjukdomen. I förlängningen planerades hälsoekonomiska bedömningar av kostnader och nytta i verklig sjukvård med nya läkemedelsterapier delvis också baserade på observationella data över hur läkemedlen använts i verklig sjukvård där data skiljer sig en hel del från de resultat som kommer fram inom ramen för de hårt strukturerade kliniska prövningarna som ligger till grund för registreringen av läkemedel. Någon sådan prospektiv studie blev dock aldrig genomförd. Inför framtiden föreslår vi en differentierad hantering – strukturerad uppföljning – av nya läkemedel beroende på vilka effekter introduktionen av ett nytt läkemedel i varje enskilt fall kan förväntas medföra (se ovan). Möjligheterna till, liksom behovet av ekonomisk analys blir helt olikartade med de olika föreslagna alternativen till uppföljning, vilket en beslutsgrupp föreslås ta ställning till. Behovet påverkas också av den behandlade sjukdomens prevalens, 38(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 svårighetsgrad och varaktighet samt vilka behandlingsalternativ som fanns innan introduktion av det nya läkemedlet. Det är rimligt att beslutsgruppen tar ställning till vilken hälsoekonomisk analys som bör göras i samband med beslut om typ av strukturerad uppföljning. I samband med prospektiva observationella studier bör en noggrann planering göras tillsammans med hälsoekonom. Ambitionsnivån för en analys med faktiska kliniska data måste bestämmas på förhand för att få med nödvändiga parametrar i uppföljningen. Man behöver också bestämma vilken/vilka analyser som är möjliga ur ett datainsamlingsperspektiv. Med hänsyn till de stora kostnaderna för läkemedel och de stora resurser som läggs ner på medicinska genomgångar och bedömningar inom Läkemedelscentrum och Läksak kan det synas anmärkningsvärt att hälsoekonomisk expertis inte finns mer rutinmässigt tillgänglig för initialt bistånd vid beslut om handläggning av information och uppföljning av ett nytt läkemedel. Detta är sannolikt önskvärt för framtiden. En ökad hälsoekonomisk ansats kräver ett utvidgat samarbete med andra aktörer nationellt och internationellt. Inom 4-länssamarbetet (se ovan) har vi gjort en viss uppdelning av åtaganden och Landstinget i Östergötland har tagit på sig ett speciellt ansvar för hälsoekonomiska analyser. Vad detta i praktiken kommer att innebära är ännu oklart. Det regionala uppdraget måste även anpassas till TLV:s framtida roll. En tidig dialog bör därför föras med TLV och SBU. Förslagsvis organiseras denna i samverkan med SKLs NLT-grupp. Även internationella erfarenheter måste tas tillvara i högre grad i framtiden. Hälsoekonomiska analyser görs idag av flera stora nationella organisationer, tex NICE/UK, SMC/Skottland, IQWIG/Tyskland och HAS/Frankrike. Många länder (tex AIFA/Italien) har även register under uppbyggnad för strukturerad uppföljning av nya läkemedel. En dynamisk utveckling sker även kring modeller för att finansiera utvecklingen av nya läkemedel. Landstingen och enskilda kliniker kommer sannolikt i framtiden att erbjudas olika riskdelningsprogram där sjukvården endast betalar läkemedelföretagen för de patienter där man ser att behandlingen fungerar. Modellerna kan ha fördelar genom att läkemedel i högre grad förskrivs till de patienter som verkligen har nytta av behandlingen, men det finns också problem som att avtal med enskilda företag riskerar att snedvrida konkurrensen så att inte de mest kostnadseffektiva läkemedlen används. I ett framtida utvecklat specialläkemedelsarbete måste dessa frågor kunna hanteras av en lämplig gruppering inom landstinget. En ökad hälsoekonomisk kompetens är därmed angeläget för att skapa en bättre dialog mellan landstingen, läkemedelsindustrin och olika myndigheter. 39(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 12. Beskrivning av Specialläkemedelsprojektet 12.1. Projektprocess Projektet påbörjades under 2006. Arbetet bedrevs till en början i en mindre arbetsgrupp för att finna omfattningen av och formen för det kommande projektet. Projektet har sedan 2007 drivits enligt SLL:s projektmodell PROJEKTiL. Projektdirektivet godkändes i maj 2007, se SPL-0001 Projektdirektiv Specialläkemedelsprojektet 1.0 [23]. Under hösten 2007 tog projektgruppen fram en projektplan, SPL-0017 Projektplan Specialläkemedelsprojektet 1.0 [24]. Beslut om projektgenomförande (BP2) togs i februari 2008. I samband med en större förändring av projektet i december 2008 reviderades projektplanen, till SPL-0017 Projektplan Specialläkemedelsprojektet 2.0 [25]. Projektet avslutas planenligt i december 2009. 12.2. Övergripande projektplan 12.2.1 Projektets syfte och effektmål Alla nya specialläkemedel för vilka uppföljning av användningen kan förväntas generera viktiga medicinska eller ekonomiska data, ska introduceras på ett kontrollerat, prospektivt och högkvalitativt sätt. Detta innebär att tydligt definierade patientgrupper ska behandlas med specialläkemedel under kontinuerlig uppföljning under en fastställd tid. Därefter görs en analys av läkemedlets effekter, säkerhet och vinster för den enskilda patienten samt också för sjukvården i stort och för samhället. Även vidgade indikationer för befintliga dyra läkemedel kan komma att behöva analyseras enligt samma principer. Rationellt införande av specialläkemedel/fokusläkemedel kan även understödjas av producentobunden fortbildning, öppen redovisning av resultat, incitamentsstyrning genom kvalitetsredovisning samt begränsning av läkemedelsförmånen under läkemedlets första tid på marknaden. Syftet med projektet är att ta ett samlat grepp på specialläkemedel/fokusläkemedel för att uppnå en rationell och kostnadseffektiv användning med hög medicinsk kvalitet. Avsikten är att all behandling med specialläkemedel/fokusläkemedel ska introduceras, utvärderas och relateras till behov för att optimera vårdkvalitet. Efter projektets avslutande förväntas man inom SLL ha en ytterligare förbättrad överblick över läkemedelsområdet och en mer adekvat användning av nyligen introducerade preparat. • • • Nya läkemedel ska identifieras minst 6 månader innan de introduceras på marknaden. Producentobunden värdering ska finnas tillgänglig för förskrivare vid introduktionen. Strukturerat införande ska genomföras för alla nya specialläkemedel för vilka uppföljning av användningen kan förväntas generera viktiga medicinska eller ekonomiska data. Adekvat uppföljning (vilken kan vara olika för olika preparat) inkluderande medicinsk och hälsoekonomisk utvärdering ska genomföras. Resultaten ska på ett konstruktivt och incitamentsstimulerande sätt göras tillgängliga för förskrivare och andra intressenter. 40(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin • Datum 2010-02-10 Version p1.0-11 SPL-0038 Prognoser över utvecklingen inom läkemedelsområdet ska fortlöpande uppdateras, så att de kan vara till nytta för sjukvårdsplaneringen. 12.2.2 Projektmål Huvudmålet är att åstadkomma en ur såväl medicinsk som ekonomisk synvinkel ändamålsenlig användning av specialläkemedel/fokusläkemedel. Delmål • Utveckla processer för Horizon scanning, Värdering och Prognostisering • Utveckla protokoll (mall) för strukturerat införande av nya läkemedel • Upprätta dialoger med berörda förskrivargrupper, vårdgivare, läkemedelskommittéer, beställare och andra beslutsfattare. • Utveckla former för nationell samverkan. • Utveckla tekniska lösningar för extraktion och bearbetning av data för kvalitetsuppföljning. • Följa introduktionen av det nya bantningsläkemedlet Acomplia i SLL. • Följa introduktionen av TNF-alfa-antagonist vid svår psoriasis i SLL. • Följa introduktion av viktiga nya onkologiska läkemedel. • Medverka till att användning av läkemedel för behandling av osteoporos registreras. 12.2.3 Projektorganisation Styrgrupp Henrik Almkvist, Projektägare, HSN Gunilla Thörnvall Bergendahl, HSN Maria von Witting, Läkemedelscentrum Lars L Gustafsson, Läkemedelscentrum, styrgruppens ordförande Bo Ringertz, LÄKSAK Margaretha Julander, LÄKSAK Mats Kalin, projektledare Göran Holm, Läkemedelscentrum Richard Malmström, Klinisk farmakologi, Karolinska Universitetssjukhuset (2008) Projektgrupp Projektledare: Mats Kalin Delprojektledare för Horizon Scanning, prognostisering och värdering: Marie Persson Delprojektledare för modeller för strukturerat införande: Seher Korkmaz Delprojektledare för nationellt samarbete: Björn Wettermark Delprojektledare för att skapa IT-system för strukturerat införande: Gunilla Evanth Delprojektledare för strukturerat införande av rimonabant (Acomplia): Paul Hjemdahl Delprojektledare för strukturerat införande TNF-PSO: Carl Olav Stiller Delprojektledare för strukturerat införande onkologiläkemedel: Nils Wilking Delprojektledare för strukturerat införande osteoporos: Ove Törring Representant för LÄKSAK: Bo Ringertz Representant för Beställare Vård: Henrik Almkvist Kommunikatör: Lucienne Fredriksson Projektkoordinator -administratör: Tore Andersson Projektekonom: Göran Holm 41(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 12.2.4 Tidplan Projektets tidplan definieras i ett antal beslutspunkter och milstolpar. Milstolparna är redovisade per delprojekt, se [24] och [25]. 12.2.5 Budget Projektet kommer att genomföras 2007-2009 på maximalt 20 000 timmar samt till en maximal kostnad av 16 mkr. Projektet finansieras under 2007 och 2009 av medel från SLL HSN. De totala kostnaderna för åren 2007 – 2009 och 1: a kv. 2010 uppgick till 13,5 MSEK, vilket var 5,5 MSEK lägre än budget. De lägre kostnaderna jämfört med budget avsåg i stort utveckling av IT-system för uppföljning 2,7 MSEK, orsakade av svårigheter att skapa ett funktionellt system för uppföljning, delprojekten 1,5 MSEK, bl.a. beroende av att bantningsmedlet Rimonabant i delprojektet IRIS drogs tillbaka av Läkemedelsverket, projektledning och styrning 0,6 MSEK och nationellt samarbete 0,7 MSEK, beroende av att samarbetet fördröjdes och kom igång först under slutet av 2009. Fördelat på funktioner och delprojekt var kostnadsutfallet för, • projektledning och styrning 3,7 MSEK • horizon scanning, prognostisering och värdering 4,2 MSEK • modell för strukturerat införande 0,6 MSEK • skapa IT-system 1,1 MSEK • nationellt samarbete 0,5 MSEK • delprojekt IRIS 0,7 MSEK • delprojekt TNF antagonister 0,8 MSEK • delprojekt Onkologiläkemedel 1,9 MSEK Utfallet för kostnaderna fördelades på • personalkostnader 3,4 MSEK • konsultkostnader 9,8 MSEK • licenskostnader 0,1 MSEK • resor och konferenser 0,1 MSEK • övriga kostnader 0,1 MSEK 12.2.6 Kommunikation Upprätta dialoger med berörda förskrivargrupper, vårdgivare, läkemedelskommittéer, beställare och andra beslutsfattare om hur specialläkemedel/fokusläkemedel ska förskrivas och följas upp. 12.3. Kommunikation i projektet Projektet gjorde tidigt en intressentanalys och upprättade en kommunikationsplan, SPL-0010 Kommunikationsplan ref [26]. Projektets huvudsakliga externa kanal har varit en hemsida under Jaunsinfo, http://www.janusinfo.se/imcms/servlet/GetDoc?meta_id=10405, där projektets uppbyggnad och aktuella händelser rapporterats. 42(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Projektet har också tagit fram en tryckt broschyr, På spaning mot nya läkemedel, SPL-0026 Speciallakemedel ref [27]. Den interna kommunikationen har skötts informellt i arbetsmöten och mera strukturerat i månatliga projekt- och styrgruppsmöte. 12.4. Måluppfyllelse 12.4.1 Projektmål Projektets ursprungliga mål är inte uppfyllda i alla delar. • Delarna om Framtidsspaning, värdering och prognostisering överlämnas till förvaltning enligt plan. • Modell för strukturerad uppföljning finns. Den innehåller ett kondensat av gjorda erfarenheter, men utgör inte en plan för alla önskvärda former för uppföljning och är inte prövad i praktisk användning. F f a saknas erfarenheter av prospektiv uppföljning. • IT-stödsystem för prospektiv uppföljning är inte levererat (enligt styrgruppsbeslut 2009-02-09). • Nationellt och internationellt samarbete är etablerat. Projektet har hållit sin tidplan på övergripande nivå. Några milstolpar har senarelagts. Projektets budget har underskridits med cirka 4 mkr. Det beror dels på att planerad utveckling av IT-system inte har genomförts, dels på att projektet i vissa aktiviteter har haft mindre resurser än planerat och att planerad aktivitet därför inte fullföljts. 12.4.2 Effekter av projektet Det är ännu för tidigt att mäta huvuddelen av effekterna av projektet. Styrgruppen beslöt i september 2009 att en första effektmätning ska genomföras under hösten 2010. Vissa resultat från projektet har redan gjort nytta, t ex prognosrapporterna och projektets påverkan på införande av vissa läkemedel. Projektet har genomfört en nyttoanalys, en så kallad PENG-analys enligt SLL:s process. Se rapport PENG Specialläkemedelsprojektet, ref [28]. 43(43) Landstingsstyrelsens förvaltning Specialläkemedelsprojektet Mats Kalin Datum 2010-02-10 Version p1.0-11 SPL-0038 Referenser [1] Gustafsson LL, Wettermark B, Kalin M, Korkmaz S, Persson M, Almkvist H, Hjemdahl P, Kristianson K, Ringertz B, Thörnwall-Bergendahl G, Wilking N. Strukturerad modell för introduktion av nya läkemedel. Läkartidningen 2008;105:2917-22 [2] kriterier, sid. 8 [3] se respektive SOP, sid. 8 [4] NHSC:s rapporter, sid. 10 [5] Läkemedelsvärderingarna, sid 11 [6] Prognos kostnadsutveckling LM SLL 2007_2008 [7] Prognos kostnadsutveckling LM SLL 2008_2009 [8] Prognos kostnadsutveckling LM SLL 2009_2010 [9] SOP prognosprocessen sid 13 [10] Hur använder vi onkologiska och hematologiska läkemedel på ett optimalt sätt? (Kostnadsutveckling onkologiska läkemedel 1997-2008) [11] LÄKSAK-rapport onkologi 2008 [12] Wettermark B, Raaschou P, Forslund T, Hjemdahl P. Fortsatta frågetecken kring bantningsmedlet Acomplia. Läkartidningen 2007;104:3879-81 [13] Undersökning av introduktionen av två nya diabetesläkemedel - sitagliptin och exenatid, Somaya Salim [14] Artikel i Läkartidningen väntar för närvarande på publicering, Forslund T, Hjemdahl P, Wettermark B, Raaschou P, Krakau I: Primärvårdsstudie tyder på tveksam nytta av bantningsläkemedel [15] SPL-0039 Rapport LM-extraktioner TakeCare Final [16] SPL-0024 Läkemedel i kvalitetsregister, Desirée Loikas [17] PSOREG strukturerad uppföljning cos 1.1 [18] SPL-0029 Specialläkemedel, Krav och förslag på teknisk lösning [19] SPL-0031 Informationsmodell inkl klassdiagramrapport [20] Utvärdering_MVK_pilot091210 [21]SPL-0040 Modell för strukturerad uppföljning [22] The managed introduction of new medicines in Europe [23] SPL-0001 Projektdirektiv Specialläkemedelsprojektet 1.0 [24] SPL-0017 Projektplan Specialläkemedelsprojektet 1.0 [25] SPL-0017 Projektplan Specialläkemedelsprojektet 2.0 [26] SPL-0010 Kommunikationsplan [27] SPL-0026 Speciallakemedel [28] PENG Specialläkemedelsprojektet