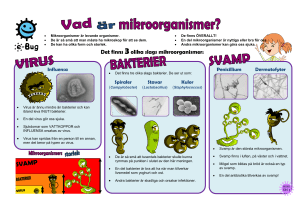
Smittrisker och hygien i tandvården
advertisement

Smittrisker och hygien i tandvården Stig Edwardsson Nils Bäckman ISBN 978-91-979918-3-4 Förord Smittrisker och hygien i tandvården Syftet är att redogöra för det aktuella kunskapsläget om risker och infektioner som kan drabba patienter och personal i samband med tandbehandling – tandvårdrelaterade infektioner. Kunskapen om de tandvårdsrelaterade infektionerna är begränsad. Förhoppningen är att Smittrisker och hygien i tandvården ska öka intresset för och leda till bättre kunskap om dessa infektioner och hur de ska kunna förebyggas samt utgöra ett underlag vid utarbetande av tandvårdsmottagningarnas hygienrutiner. Vi vänder oss till samtliga personalgruppen inom tandvården, således tandläkare, tandhygienister, tandsköterskor och tandtekniker. Rapporten inleds med en minneslista för god klinikhygien och en checklista för egenkontroll av klinikens hygien. Den fortsätter med en genomgång av mikroorganismer som kan förekomma i munnen och kroppens infektionsförsvar. En väsentlig del av innehållet omfattar mikroorganismer och infektioner, som vi känner till att de har orsakat tandvårdrelaterade infektioner men även mikrobiella grupper, som anses utgöra potentiella smittrisker, diskuteras. Vikten av rengöring och smittrening av instrument samt andra medicintekniska produkter, som används inom tandvården, t.ex. tandtekniska arbeten samt engångsartiklar och betydelsen av egenkontroll gås igenom - en bakgrund till mera detaljerade och anpassade anvisningar, vilka bör finnas i varje kliniks hygienplan. Som bilaga finns ett axplock ur aktuella lagar och föreskrifter. Författarna vill framföra ett tack till universitetslektorn Anders Berglund, Institutionen för Odontologi, Umeå Universitet samt juristen Pål Resare, Socialstyrelsen för ett utmärkt samarbete och värdefulla synpunkter. Vi vill också tacka överläkaren Ann Tammelin Södersjukhuset Stockholm, överläkaren Ingemar Quarford Sahlgrenska sjukhuset Göteborg, tandläkaren Lars Svärd Praktikertjänst och tandsköterskan Inger Spencer Folktandvården Västra Götaland för värdefulla förslag och påpekande. Malmö och Umeå juni 2012 Stig Edwardsson Odont. Dr., professor em., Malmö Nils Bäckman Med. Dr. h.c., f.d. medicinalråd, Umeå 2 (93) Innehåll Förord ...................................................................................................................................... 2 Introduktion ............................................................................................................................ 3 Minneslista för god klinikhygien .............................................................................. 6 Exempel på egenkontroll av klinikhygien genom checklista ................................................. 8 Mikroorganismer och infektionsförsvar Osynliga men ändå där ........................................................................................................... 9 Bakterier Mikroskopiska svampar Virus Prioner Hur håller kroppen mikroorganismerna i schack ................................................................... 15 Ospecifika infektionsförsvaret Specifika infektionsförsvaret Första försvarslinjen Andra försvarslinjen Hur orsakar mikroorganismerna infektioner? ........................................................................ 19 Termer och begrepp Bakterierinfektioner Virusinfektioner Akuta infektioner kan delas in i tre stadier Bakteriemi Hur sprids infektioner Tandvårdsrelaterade infektioner Endogena infektioner Sepsis Infektiösa endokarditer Hjärninfektioner Ledinfektioner Svalginfektioner Lunginfektioner Andra bakteriella infektioner Candidoser ............................................................................... 22 Exogena infektioner ................................................................................................................ 27 Konstaterade exogena infektioner Hepatit B-infektioner HIV/AIDS Herpes infektioner Stafylokockinfektioner Tuberkulos (TBC) Pseudomonasinfektioner Legionellainfektioner Patogena mikroorganismerm som utgör smittrisk ........................................................... 34 Hepatit C-virus Humant herpes virus (HHV 2-8) Humant papillom virus Rhino-, adeno-, corona-, influensa-virus Virus som orsakar barnsjukdomar Enterobakterier 3 (93) Helicobacter pylori Difteribakterier Luftburen smitta – ett tandvårdrelaterat problem? ........................................................... 40 Risker och riskbedömning Endogena infektioner Exogena infektioner Verifiera ett misstänkt samband Basala hygienrutiner ......................................................................................... 41 ...................................................................................................... 45 Handen – hygienens svaga länk Rena händer en förutsättning Handdesinfektion Skyddshandskar Munskydd Andningsskydd Visir/Skyddsglasögon Arbetskläder/Skyddskläder Mikrobiell renhet ............................................................................................................. 51 Rengöring – viktig förutsättning Värmedesinfektion Kemiska desinfektionsmedel Sterilisering – varför? Steriliseringsprocessen Håliga instrument – särskilda problem Engångsprodukter Unitens vattenledningssystem Sugsystem Kompressorer Smittförande avfall Tandtekniska laboratorier, tandtekniska arbeten Kliniken Laboratorium Sammanfattning .............................................. 62 .............................................................................................................. 65 Referenser .......................................................................................................................... 67 Läsa vidare ......................................................................................................................... 86 Bilaga Axplock ur aktuella lagar och föreskrifter ………………………………………………….. 87 4 (93) Introduktion Infektionssjukdomar är människans ständiga följeslagare. För närvarande anser man att mer än 14 miljoner människor varje år avlider i smittsamma sjukdomar, främst i utvecklingsländerna (Heyman, 2004). Men infektionssjukdomarna bjuder också på överraskningar och problem i länder med god hälso- och sjukvård. Även om en del smittosamma sjukdomar är på väg att försvinna, byter andra skepnad och nya kommer till. Britton (2003) beskriver aktuella förändringar och noterar bl.a. följande. ”Nya smittor” uppträder t.ex. legionärsjukan, HIV/AIDS, hepatit C och svår akut respiratorisk sjukdom (SARS); ”gamla” infektioner som tuberkulos ”återkommer” och genom vården förändrade smittämnen, som ger upphov till iatrogena infektioner, främst orsakade av antibiotikaresistenta bakterier, t.ex. meticillinresistenta stafylokocker och multiresistenta tuberkelbaciller, som kräver omfattande insatser. Influensavirus drabbar oss regelbundet; ibland i större omfattning som spanska sjukan, ryska snuvan, asiaten, Hongkonginfluensan och senast den ”nya influensan” A(H1N1)2009 – missvisande kallad svininfluensan. Vårdrelaterade infektionssjukdomar är ett stort problem i hälso- och sjukvården. Man uppskattar att ca 10 % av de patienter som behandlas på sjukhus, drabbas av vårdrelaterade infektioner (Lundholm, 2006). Tillförlitliga uppgifter om omfattningen av vårdrelaterade infektioner i tandvården saknas men tandvårdens natur innebär uppenbara risker. Av anmälningar till Socialstyrelsen framgår bl.a. att infektioner i munhålan lett till komplikationer som t.ex. dental sinuit, endokardit, ledinflammation, mediastinit och i något fall till döden. Sambandet mellan vårdrelaterade infektionssjukdomar och hygienisk standard är entydigt och detta har lett till ökade hygienkrav inom hälso-, sjuk- och tandvård. Det finns emellertid risk för att problemet med vårdrelaterade sjukdomar bagatelliseras eftersom förebyggande åtgärder inte bara innebär uppstramning av hygienrutiner utan i regel också medför kostnader för vårdgivaren. Vid arbete med tandtekniska produkter finns alltid mikroorganismer på avtryck, gipsmodell och använda proteser där de kan överleva från någon timme till flera dagar. Särskild uppmärksamhet bör därför ägnas åt hanteringen av dessa arbeten och betona att tandläkare och tandtekniker har ett gemensamt ansvar för att förhindra smittspridning via tandtekniska arbeten. Socialstyrelsen gav 1994 ut ett meddelandeblad om hygien i tandvården (reviderat år 2000) och för ett par år sedan publicerades ett ”kunskapsunderlag” med bl.a. rekommendationer om hygien i tandvården (Bäckman & Edwardsson, 2006a). Tandvårdslagen (1985:125) har stramats upp vilket innebär att från 1 juli 2006 ska tandvården bedrivas med god hygienisk standard och särskild vikt ska läggas vid förebyggande åtgärder. Det är en väsentlig skärpning av tidigare hygienkrav och skall ses som ett uttryck för en ökad insikt om hygienens betydelse för en god och säker vård. Motsvarande skrivning finns i Hälso- och sjukvårdslagen (1982:763). Vårdgivaren har således ett lagstadgat ansvar för hygienen i vården. Socialstyrelsen har också gett ut en föreskrift om ”Basalhygien inom hälso- och sjukvården m.m.” (SOSFS 2007:19). 5 (93) Minneslista för god klinikhygien 1. Hygienplan • Genomtänkta hygienrutiner dokumenterade i hygienplan underlättar arbetet. • Egenkontroll är en viktig del av det systematiska kvalitetearbetet. • Checklista underlättar egenkontrollen av klinikens hygienstandard (exempel se tabell 1). • Kliniken bör bygga upp egen checklista anpassad till verksamheten. • Kliniken bör utarbeta skriftliga anvisningar för varje arbetsmoment - steg för steg – mot bakgrund av de förutsättningar som finns vid kliniken. 2. Basala hygienrutiner • Flytande tvål används vid handtvätt. Naglarna ska vara kortklippta. Handens hud bör behandlas med kräm innehållande vattenbindande ämnen för att hållas mjuk, smidig och fri från sprickor. • Handdesinfektion skall alltid ske före och efter kliniskt arbete/hantering av instrument oavsett om man använder handskar eller ej. Alkoholer har en mycket snabb och god desinfekterande effekt. • Skyddshandskar skall alltid bäras vid kontakt med kroppsvätskor och bytas mellan varje patient. o • Arbetskläder skall bytas varje dag och bör tvättas vid minst 70 C. Om man väljer att tvätta vid lägre temperatur bör detta framgå av och motiveras i hygienplanen. • Engångsförkläde/skyddsrock ska användas vid risk för kontakt med kroppsvätskor eller annat biologiskt material. Inom flera landsting har man tagit fram anvisningar när särskilda, för tandvården lämpade skyddsförkläden/plastförkläden ska användas. Detta bör framgå av hygienplanen. • Munskydd och visir är främst avsedda för att förhindra stänk av blod/saliv men minskar också risken för inandning av mikrobiell aerosol. • Andningsskydd med särskild hög avskiljningsgrad ska användas (klass FFP3) då särskild smittrisk föreligger, t.ex. vid behandling av patient med pågående akut lungtuberkulos eller svår respiratorisk sjukdom (SARS). • Tandvårdspersonal bör vara vaccinerad mot hepatit B-virus (HBV) samt ev. komplettera grundskyddet mot t.ex. tbc (BCG). Information om behov av ytterligare vaccinationer framgår på Smittskyddsinstitutets hemsida (www.smittskyddsinstitutet.se). 2. Instrumenthygien • Instrument indelas efter krav på mikrobiell renhet i sterila, höggradigt rena och rena. • Oavsett vilken nivå av mikrobiell renhet som avses, är rengöring en grundläggande åtgärd. Kan ske manuellt med ultraljud eller i diskdesinfektor. Använd alltid handskar, skyddsrock/plastförkläde och ev. stänkskydd. 2.1 Instrument vid konventionell tandvård • Höggradigt rena instrument är tillräckligt i rutintandvård men inte vid avsiktlig penetration av hud, slemhinna och tanden in i pulpan då sterila instrument krävs. • Godset ska vara rent och torrt. Särskilda testkit för kontroll av renheten kan användas men ersätter inte den batchvisa, okulära inspektionen. • Höggradig rena instrument uppnås lättast genom behandling i en diskdesinfektor. • Vid installation av diskdesinfektorn genomförs validering omfattande installations-, funktions- och processkontroll. Processkontrollen upprepas minst en gång varje år eller efter reparation. • Vid batchvis/daglig kontroll jämförs tid och temperatur för desinfektionsfasen med motsvarande värden i den ursprungliga processkontrollen. • När äldre autoklav används för att uppnå höggradigt rena instrument, finns inga formella krav på validering men daglig och kvartalsvis funktionskontroll skall utföras. Kvartalsvis kontroll sker med biologiska indikatorer (sporprov). Denna funktionskontroll utförs också efter reparation. • Höggradig renhet uppnås inte med vanlig diskmaskin men rengöringen kan kombineras med värmebehandling (autoklav med N-program/äldre autoklaver utan vakuum). • Höggradig renhet kan uppnås genom kemisk desinfektion, som dock bara används när värmebehandling inte kan utnyttjas. • För att behålla sin renhetsgrad transporteras och förvaras instrumenten fritt från damm och fukt. 6 (93) • Delar av uniten och arbetsytor som kontamineras av mikroorganismer under arbetet behandlas med kemiskt desinfektionsmedel till vilket rengörande komponent satts. • Övriga ytor i behandlingsrummet kan behandlas mekaniskt med vatten och rengöringsmedel. 2.2 Instrument och föremål som endast berör intakt hud • Artiklarna diskas (skall vara för ögat rena). • Efter behandling förvaras artiklarna fritt från damm och fukt. 2.3 Instrument som används vid penetration av slemhinna och dentin • Sterila instrument krävs vid endodonti, kirurgi och parodontalkirurgi. • Sterilisering sker i autoklav med validerade processer. Autoklav försedd med B-program kan användas för sterilisering av homogena instrument, förpackade instrument, vinkelstycken, textilier. N-program används endast för sterilisering av homogena instrument på öppna brickor. • Nya autoklaver skall genomgå funktions-, installations-, och processkontroll (validering). Processkontrollen upprepas en gång årligen (upprepad processkontroll) och efter reparation. • Den dagliga kontrollen av B-program omfattar läcktest, ångpenetrationstest samt kontroll av tryck, temperatur och tid, som jämförs med avläsningarna utförda vid valideringen. • Dagliga kontroller dokumenteras. • Vid urlastningen kontrolleras att instrument och förpackningar är torra. • Förpackning av gods, som har steriliseras med B-program, sker i särskilda påsar, vilka försluts med svetsning eller vikning/tejpning. • Spårbarhet. Förpackning märks med datum och löpnummer så att den kan spåras samt med sista förbrukningsdag. Steriliserat gods skall kunna skiljas från icke steriliserat t.ex. genom en processindikator, som visar att den värmebehandlats. • Alla kontroller ska dokumenteras. Dokumentation av varje steriliseringsomgång (batchkontroll) ska sparas under de steriliserade instrumentens maximala hållbarhetstid plus den tid för spårbarhet som bestäms av klinikens hygienplan. • Lagring av de steriliserade förpackningarna skall ske på ett säkert sätt och fritt från damm och fukt. Längsta förvaringstid i svetsad förpackning är sex månader och för förpackning försluten med vikning och tejp en månad. Instrument som steriliserats i kassett (bricka med lock) skall användas omedelbart. 3. Håliga instrument • Hand- och vinkelstycken, blästerspetsar och (tandsanerings-) ultraljudsscalers måste dekontamineras både utvändigt och invändigt mellan varje patient. • Inre grovrengöring sker inledningsvis genom att instrumentet spolas igenom med vatten från utrustningen innan det kopplas bort. • Yttre och inre rengöring av vinkelstycken utförs bäst med hjälp av speciell rengöringsapparatur. Detta leder normalt till höggradig renhet. • Håliga/rörformade instrument som blästerspetsar och arbetsdelar till tandsaneringsapparater behandlas i ultraljudsapparat innan rengöring och desinfektion. I diskdesinfektorn placeras rörformade instrument så att vattnet kan spola genom instrumentets lumen. • Hand- och vinkelstycken, blästerspetsar samt tandsanerings-instrument som skall steriliseras, behandlas i en autoklav med pulserande förvakuum omfattande flera pulser (B-program). 4. Dentala unitens vattenlednings- och sugsystem • För att effektivt reducera antalet mikroorganismer i färskvattensledningarna måste den mikrobiella biofilmen minimeras. Systemet behandlas med rengöringsmedel (t.ex. natriumhydroxid) med efterföljande daglig ”underhållsdesinfektion” (t.ex. klorförening). • Unitens vattenkvalitet kontrolleras regelbundet (minst en gång per år). Om antalet heterotrofa mikroorganismer överstiger gränsvärdet för dricksvatten (100 cfu/ml) vidtas åtgärder. • Sterilt vatten används vid alla ingrepp in i steril vävnad. • Sugmunstycket byts mellan varje patient. Vid arbetsdagens slut sugs hela systemet igenom med rengöringsmedel. Innan service, behandlas systemet med rengörings- och desinfektionsmedel. 7 (93) 5. Tandteknik • Tandtekniska arbeten ska, så snart de tagits ut ur munnen, dekontamineras. Avtryck sköljs i rinnande kallt vatten, behandlas med desinfektionslösning varefter det på nytt sköljs i vatten innan det sänds till tandtekniskt laboratorium. • I regel kan persyror eller hypokloriter användas. Tillverkarens anvisningar ska följas. • Tandtekniskt arbete rengörs på laboratoriet före leverans till tandläkare och desinfekteras när de kommer till kliniken. • Instrument och redskap på laboratoriet, som lätt kontamineras, rengörs efter varje arbetsmoment. 6. Smittförande avfall • Avfall från en tandläkarpraktik kan vara smittförande och klassas då som farligt avfall, t.ex. skärande/ stickande föremål och avfall från behandling av en patient med känd eller misstänkt smittrisk. 7. Lex Maria • Enligt Lex Maria-föreskriften skall en anmälan göras till Socialstyrelsens inom två månader om en patient drabbas av eller utsätts för risk att drabbas av allvarlig skada eller sjukdom. Tabell 1. Exempel på egenkontroll genom checklista (efter Bäckman et al. 2000). Ja 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. Kontroll av tillämpning av de basala hygienföreskrifterna? Görs upprepad processkontroll av autoklav och diskdesinfektorer och apparatur för håliga instrument (vinkelstycken, ultraljudsscaler)? Finns dokumentation av vad som ska vara sterilt och höggradigt rent? Finns rutin för rengöring och desinfektion av tandtekniska arbeten? Finns entydiga rutiner för förvaring av instrument? Finns metodbeskrivning för smittrening av hand-/vinkelstycken och ultraljudsinstrument? Finns metodbeskrivning för rengöring och ytdesinfektion av unit och övriga arbetsytor samt instrument? Kontrolleras unitens mikrobiella vattenkvalitet minst en gång per år? Finns metodbeskrivning för skötsel/underhåll av vattenreningsanläggning? Finns metodbeskrivning för lokalvård av behandlingsrum, steril och övriga lokaler? Görs en systematisk riskbedömning av patienterna (ASA)? Finns rutiner för användning och val av antibiotika? Finns rutiner för registrering av utebliven effekt av antibiotikabehandling eller biverkning av antibiotikabehandling? Finns rutiner för registrering av sårinfektion hos patient efter operativa ingrepp och/eller större blödning efter behandling? Finns åtgärdsprogram vid stick- och skärskador? Har all personal, även vikarier, adekvat och aktuell information om klinikens hygienrutiner? Deltar personalen i efterutbildning om smittförebyggande åtgärder? Finns vaccinationsprogram för personalen? Registreras och analyseras åtgång av tvål, handdesinfektionsmedel och handskar? 8 (93) Nej Åtgärd Mikroorganismer och infektionsförsvar Osynliga men ändå där Den mikrobiella kolonisationen av munnen börjar redan vid födelsen för att sedan hos den tandförsedda individen successivt utvecklas till en komplext sammansatt mikroflora (Marsh & Martin, 2009). Exempel på bakteriesläkten identifierade med konventionella metoder och som mera regelbundet förekommer på tänder och orala slemhinnor (normalflora/residient mikroflora) presenteras i tabell 2. På slemhinnorna är antalet 109/mg; således c:a en miljard mikroorganismer; i plack och tandköttsficka 10100 gånger fler. Floran är mycket artrik och bakterier dominerar. Man anser att det finns mellan 500-600 olika bakteriearter och mellan 200-300 arter hos den enskilde individen. Fortfarande har c:a hälften inte kunnat odlas och identifieras med konventionella bakteriologiska metoder; identifieringen har istället utförts med molekylärbiologisk teknik (Paster et al., 2001; Marsh & Martin, 2009). Tabell 2. Exempel på bakteriesläkten (genus) och arter som identifierats med konventionella metoder och som mera regelbundet påträffas i munnen (residient flora/normal mikroflora). Släkten och arter i kursiv stil är anaeroba. Grampositiva Kocker Gramnegativa Streptococcus - S. oralis - S. mitis - S. sanguinis - S. anginosus - S. constellatus - S. mutans - S. salivarius Peptostreptococcus - P. micros Neisseria - N. sicca Veillonella - V. parvula Stavar Actinomyces - A. israelii - A. naeslundii Bifidobacterium - B. dentium Lactobacillus - L. casei - L. fermentum Propionibacterium - P. acnes Aggregatibacter - A. actinomycetemcomitans Eikenella - E. corrodens Fusobacterium - F. nucleatum Haemophilus - H. aphrophilus Porphyromonas - P. gingivalis Prevotella - P. intermedia Tannerella - T. forsythia Spiralvridna Treponema - T. socranskii 9 (93) Miljön i munnen skapar förutsättningar för normalfloran. Saliv, vätska i tandköttsfickor och sekret från slemhinnorna, näringskedjor som bakterierna producerar mellan varandra, bildar tillsammans med munhålans olika ytor (tänder, tandköttsfickor, tungrygg, och slemhinnor) grundförutsättningar för en artrik normalflora. Exogena faktorer, som vår kost, har ett inflytande på utvecklingen av karies. Vid parodontit och karies uppträder förskjutningar och obalans i sammansättningen av den existerande normalfloran (Marsh, 1994). Sjukdomarna är multifaktoriella; även genetiska faktorer bidrar till deras uppkomst och utveckling. När den initiala kariesskadan uppträder är miljön sur och här finner man ett stort antal bakterier som tolererar låga pH-värden främst olika streptokockgrupper, bl.a. S. mutans, S. mitis och lactobaciller. Tränger karies djupare och når dentinet, ändras miljön så att det i skadans djupare delar förekommer rikligt med grampositiva stavar, t.ex. actinomyceter, bifidobakterier och lactobaciller. När angreppet sedan penetrerar in i pulpan möts bakterierna av vävnadsvätska, blod och olika substanser innehållande rikligt med protein, vilket gynnar gramnegativa anaeroba stavar som fusobakterier, prevotella och porphyromonas. Mikrofloran i den infekterade pulpan kommer därför att bestå av en blandflora innehållande dessa bakteriegrupper tillsammans med grampositiva stavar och streptokocker. När parodontit utvecklas strömmar stora mängder vätska och substanser - rika på protein - ut från gingivalvävnaden. Det leder till en kraftig ökning av gramnegativa anaeroba stavar som fusobakterier, prevotella, porphyromonas, tanerella m.fl. Särskilt vid akuta former av parodontit uppträder också stora mängder spiralvridna stavformade bakterier som treponema. Men den orala mikrofloran kan också sägas vara potentiellt patogen, dvs. sjukdomsframkallande eftersom den - under vissa förutsättningar - kan spridas till andra kroppsvävnader och där orsaka allvarliga infektioner. Det förekommer även andra mikroorganismer, ofta i lågt antal, hos friska personer eller vid pågående sjukdom i munnen eller annan vävnad (s.k. genomgångsflora/transient mikroflora (Tabell 3). Tabell 3. Bakteriesläkten (genus) och arter, mikrosvampar och virus som till och från kan påträffas i munnen utan symptom på pågående infektion (transient mikroflora). Bakterier Mikrosvampar Virus Staphylococcus - S. epidermidis - S. aureus Klebsiella - K. oxytoca - K. pneumonae Pseudomonas - P. aerugenosa - P. maltophilia Enterobacteria - E. cloacae Escherichia - E. coli Mycobacterium - M. tuberculosis Helicobacter - H- pylori Clostridium - C. ssp Streptococcus - S. pyogenes Candida - C. albicans - C. glabrata - C. tropicalis - C. krusei - C. parapsilosis Sacchromyces - S. cerevisiae Herpes simplex virus 1 Herpes simplex virus 2 Varicella-zoster virus Cytomegalo virus Epstein-Barr virus Coxsackie virus Humant papillom virus - olika HPV-typer Humant immunbristvirus (HIV) Hepatit B virus Hepatit C virus Mässlingvirus Påssjukevirus Influensavirus 10 (93) Eftersom vår munhåla är rik på ”vanliga” mikroorganismer och dessutom ”inkörsport” för många sjukdomsframkallande mikroorganismer, leder det oundvikligen till mikrobiell kontamination av tandläkarens och tandhygienistens händer, arbetskläder, instrument, material och delar av den fasta utrustningen. Även tandsköterskans och tandteknikerns arbete innebär i stor utsträckning kontakt med föremål som är mer eller mindre kontaminerade. De mikroorganismer som främst förekommer i munnen är bakterier, mikrosvampar och virus. Bakterier Bakteriers morfologi (form och struktur) varierar och man skiljer mellan tre former: kocker (kulformade), stavar och spiralvridna bakterier (Figur 1). Det förekommer också övergångsformer (Carlsson & Linder 2008). Figur 1. Utseendet hos olika bakterier A. Kocker i kedjor, t.ex. streptokocker, (0,7-0,9 µm). B. Kocker i klasar, t.ex. stafylokocker (0,9-1,1 µm). C. Korta stavar (2-4 µm långa) med raka ändar (lactobaciller), avrundade ändar (porphyromonas,), spetsiga ändar (fusobakterier). D. Mångformade (pleomorfa) stavar och trådformade celler, kan vara förgrenade t.ex. Actinomyces. E. Spiralvridna celler s.k. spiroketer, t.ex Treponema. F. Jästsvampar ovala celler (6-8 µm). Delar sig genom knoppning. Bildar ofta rader av celler, hyfertrådar, som kan forma nätverk, mycelium. Teckning: Mikael Rehn Bakterierna förökar sig genom enkel delning, dvs. en cell dubblerar sitt innehåll i två dotterceller. De nybildade cellerna kan orientera sig på olika sätt i förhållande till varandra. Två kocker kan hänga samman två och två som diplokocker, (t.ex. neisserier); bilda kortare eller längre kedjor (streptokocker, t.ex. Streptococcus mutans) eller dela sig i alla tre plan, vilket resulterar i vad som kan liknas vid druvklasar (stafylokocker, t.ex. Staphylococcus aureus). Även stavformade bakterier (t.ex. lactobaciller) kan bilda kedjor. De spiralvridna bakterierna kallas vanligen spiroketer. Storleken hos en kockformad bakteriecell brukar variera mellan 0,7 och 1,1 mikrometer (µm = 0,001 mm). Stavformade celler kan vara upp till 20 µm långa. Storleksrelationen mellan en bakterie och olika virus framgår av figur 2A (sid. 13). 11 (93) Bakterier har arvsmassa (deoxyribonukleinsyra, DNA) och andra egenskaper förknippade med levande organismer, som ämnesomsättning och förmåga att föröka sig. Dessa funktioner upprätthålls i en och samma cell. Detta skiljer dem från människans vävnadsceller, som är specialiserade på olika sätt. Vidare har bakterier en cellvägg, vilket saknas hos våra vävnadsceller (Carlsson & Linder, 2008). Skillnaderna gör att antibiotika t.ex. penicillin, angriper bakteriens cellvägg, kan hämma eller döda bakterier utan att skada våra vävnadsceller. För att leva och föröka sig, tar bakterien upp ämnen från omgivningen. Bakterien transporterar ut enzymer som sönderdelar högmolekylära ämnen, t.ex. stärkelsens långa glukoskedjor som spjälkas upp till fria glukosmolekyler vilka kan tas in i bakteriecellens cytoplasma där det omsätts till energi och olika byggstenar för cellens olika beståndsdelar. Vissa bakterier kan också bilda giftiga ämnen (toxiner) som endera frigörs när bakterien faller sönder (endotoxiner) eller utsöndras från den levande bakterien (exotoxiner) (Thougaard et al., 2001). Enzymer och toxiner är viktiga för bakteriens fortlevnad men det betyder samtidigt att en lokal inflammation utvecklas vilket leder till att ämnen eller vävnader som finns i bakteriecellens omgivning bryts ned och förstörs. Bakterier kan delas in i tre grupper beroende på deras förhållande till luftens syre, nämligen aeroba, fakultativt anaeroba och anaeroba bakterier. De aeroba bakterierna kan inte klara sig utan syre; fakultativt anaeroba är anpassningsbara och kan ändra ämnesomsättningen så att de kan leva och föröka sig både med och utan att syre är närvarande. Anaeroba bakterier påträffas i miljöer med begränsad eller ingen förekomst av syre. Miljön i munnen gynnar framförallt fakultativt anaeroba och anaeroba bakterier (Tabell 2). Bakteriernas cellvägg har olika uppbyggnad, vilket gör att man kan dela in dem i två huvudgrupper med hjälp av en enkel färgmetod (gramfärgning), som används för studier av bakterieceller i mikroskop (Carlsson & Linder, 2008). Bakterieceller som färgas röda kallas gramnegativa och de som färgas blåa grampositiva. Vissa egenskaper hos cellväggen är förknippade med färgreaktionen, t.ex. så verkar vissa desinfektionsmedel och antibiotika bättre mot grampositiva bakterier än mot gramnegativa. Vidare har toxiner från grampositiva och gramnegativa bakterier olika egenskaper. De grampositiva bakterierna överlever i regel bättre i torr miljö än de gramnegativa, som ofta påträffas i fuktig miljö. När en bakterie tar upp näring och det sker en tillväxt, brukar man säga att bakterien befinner sig i vegetativ fas eller form; något som står i kontrast till perioder av svält eller ”vila”, då endast begränsad ämnesomsättning sker i cellen. Beteckningen vegetativ fas används bl.a. när en sporbildande bakterie växer. Vissa bakteriegrupper kan nämligen bilda överlevnadsformer - s.k. endosporer - inne i cellen; i dagligt tal kallade bakteriesporer. Sporbildningen hos dessa bakterier sker vid näringsbrist och i denna form är cellen helt inaktiv men kan överleva under lång tid – t.o.m. flera år. Om näringsförhållandena blir gynnsamma på nytt, växer bakterien ut. Endosporer tål höga temperaturer, t.ex. kokande vatten, och uttorkning. För att inaktivera (avdöda) endosporer måste man t.ex. använda fuktig värme vid temperaturer över +100°C (sid. 56). Bakterier som tillhör släktet Clostridium (tabell 3) kan bilda endosporer. Mikroskopiska svampar I naturen förekommer ett mycket stort antal svamparter, dels makroskopiska, exempelvis kantareller, dels mikroskopiska t.ex. mögelsvamp. Ett fåtal av de mikroskopiska svamparna kan orsaka infektioner hos människa, s.k. humanpatogena svampar. Efter växtsättet kan de grovt delas in i jästsvampar och trådsvampar (Ericson & Ericson, 2003). Vid odling på laboratoriet uppträder jästsvampar i regel i encellig äggform 12 (93) (6-8 µm i diameter) som förökar sig genom knoppning (Figur 1). Däremot bildar trådsvampar alltid långa förgrenade trådformade celler i kedjor (hyfer), som kan forma nätverk (mycelium). Humanpatogena jästsvampar och trådsvampar, som kan finnas i vår arbetsmiljö orsakar i regel endast ytliga infektioner på hud, hår, naglar och slemhinnor. Till jästsvampar hör släktet Candida som är en del av människans normalflora. Candida koloniserar främst munnen, mag-tarmkanalen och vagina men kan även förekomma på huden. Jästsvampar är vanligt förekommande i lågt antal på orala slemhinnor och påträffas främst på tungryggens dorsala delar och på buckala slemhinnan. Olika Candida-arter förekommer men vanlig är C. albicans (Stenderup, 1990; Cannon & Firth, 2007). I en population är i genomsnitt c:a 50% av friska individer bärare av jästsvamp. Varför vissa individer härbärgerar dessa mikroorganismer medan andra inte gör det är inte helt klarlagt men bl.a. näringsintag och immunsystem har betydelse. Symptomfria bärare av Candida ökar i regel med stigande ålder (Stenderup, 1990). Antalet personer med bärarskap är närmare 100 % bland individer, som står på immunosuppressiva medel eller behandlas med bredspektriskt antibakteriellt medel, t.ex. tetracykliner (Helovuo, 1988; Stenderup, 1990; Wahlin et al., 1995). Candida kan under vissa förhållanden orsaka orala slemhinneinfektioner, s.k. candidoser (sid. 27). Trådsvamp (dermatofyter) är en grupp svampar som orsakar speciella svampinfektioner (tinea) i keratinhaltig vävnad. Dessa kan förekomma i överhudens hornlager, hår och naglar (Ericson & Ericson, 2003). Ett mycelium som bildas av svampens trådar (hyfer) bryter ned hornlagret i keratin men det angriper inte levande vävnad. Det innebär att dermatofyter endast orsakar ytliga infektioner. Eftersom svampen angriper hår, skägg och naglar, kan de förekomma i vår ”arbetsmiljö”. Vid infektioner i hår och skägg är symptomen ofta kliande och fjällande hårbotten med kala fläckar. Naglar kan bli förtjockade, missfärgade med mjöliga fläckar på ovansidan. Smittan sprids främst med hudflagor som lossnar från infekterade individer. Denna indirekta kontaktsmitta kan spridas, t.ex. via kläder, där det förekommer att svampceller överlever under lång tid. Virus Virus utgör en egen grupp bland mikroorganismerna (Ericson & Ericson, 2003; Carlson & Linder, 2008), är mindre än 0,5 µm (500 nanometer) (Figur 2A) och kan endast studeras i elektronmikroskop. Uppbyggnaden är relativt enkel; i princip består virus av deoxyribonukleinsyra (DNA) eller ribonukleinsyra (RNA) omgivet av ett skyddande proteinskal, som kallas kapsid (Figur 2B). Det förekommer också vissa virusarter som utanför kapsiden är försedda med ett hölje, som består av protein, fett och kolhydrater (höljevirus). Saknar en virusart hölje, talar man om nakna virus. På kapsidens eller höljets utsida har alla virus särskilda strukturer eller vidhäftningsproteiner s.k. adhesiner, vilka har förmåga att binda till särskilda receptorer på ytan av de vävnadsceller, som virus kan fästa till med hög bindningsstyrka (affinitet). På så sätt söker sig olika virusarter till sina s.k. målceller, som de angriper (brukar beskrivas med termen viral tropism; tropism=söker sig till). Virus måste således först känna igen sin ”värdcell”. (sid. 21). Exempelvis gulsotsvirus (hepatit B-virus; HBV) fäster endast till människans leverceller. Influensavirus infekterar främst cellerna i nedre luftvägarna. Figur 2B illustrerar influensavirus med sina särskilda vidhäftningsproteiner/adhesiner, haemagglutinen (H) och neuraminidas (N) (se även sid 21 och 37). 13 (93) Figur 2A och B (A) Storleksrelationen mellan en bakteriecell och olika virus. 1. kockformad bakteriecell (0,9-1,1 µm stor), som är c:a 10 gånger mindre än en vävnadscell. 2. adenovirus (0,08 µm), 3. Herpesvirus (0,2 µm), 4. influensavirus (0,1 µm). (B) Den principiella uppbyggnaden av ett virus. 5. hölje, 6. kapsid, 7. kärna (DNA eller RNA). Här illustreras influensavirus med sina särskilda adhesiner 8. haemagglutinin (H), 9. neuraminidas (N). Sammansättningen hos H och N varierar mellan olika subtyper av influensavirus. Subtyperna betecknas med olika siffror, t.ex. nya influensan A(H1N1) och Hongkong-influensan H3N2. Teckning: Mikael Rehn Prioner Prioner är kroppsegna glykoproteiner, (prionproteiner, PrP), som förekommer på ytan av celler i centrala nervsystemet och hos vissa celler i det lymforetikulära systemet (lymfkörtlar, lever, mjälte och tarm) hos både människa och djur (Laurell, 2006). De kan orsaka sjukdom när normala prionmolekyler byter skepnad och utvecklar defekta former. Den exakta mekanismen för denna typ av förändring är ofullständigt känd. Prionsjukdomar är mycket sällsynta men kan orsaka dödliga degenerativa sjukdomar i centrala nervsystemet, t.ex. CreutzfeldtJacobs sjukdom (CJD) hos människa. Sjukdomen överförs bl.a. med smittat material från sjuka nötkreatur som drabbats av den s.k. ”galna kosjukan” (BSE = Bovin Spongiform Encefalopati). Varianter av CJD (vCJD) kan även förekomma i perifera nervsystemet och har påvisats i 5:e hjärnnervens ganglier (trigeminusnerven med utbredningsområde i ansikte och mun). Prioner är mycket motståndskraftiga mot värme, desinfektionsmedel, lösningsmedel och proteinspjälkande enzymer. Enda säkra sättet att eliminera smittämnet är förbränning (Laurell, 2006). Detta är anledning till att man kremerar all nötkreatur som drabbats av BSE; något som skedde i stor omfattning i Storbritannien, när sjukdomen härjade som värst. Totalt har 211 fall av vCJD rapporterats t.o.m. juli 2009; av dessa har de flesta förekommit i Storbritannien (165 fall) medan enstaka fall rapporterats från flera andra länder; Sverige inte har haft något fall av vCJD (Hammarin personligt meddelande 2009). I Storbritannien insjuknade de flesta under perioden 1996-2003 varefter incidensen sjunkit. År 2008 rapporterades endast ett fall (CJD Statistics 2009). Man har inte kunnat isolera defekta prioner från pulpavävnad (Blauquet-Grossard et al., 2000; Head et al., 2003). Det pågår brittiska undersökningar för att belysa om vCJD skulle kunna spridas i samband med tandbehandling (Everington et al., 2007). 14 (93) Hur håller kroppen mikroberna i schack? Kroppen har flera samverkande system i ständig beredskap för att säkerställa ett effektivt skydd mot bl.a. mikroorganismer (Rollof, 1997; Bränden & Andersson, 2004). Man brukar tala om ett ospecifikt och ett specifikt infektionsförsvar. Ospecifika infektionsförsvaret Det ospecifika infektionsförsvaret bekämpar alla mikroorganismer. Det ingriper snabbt och omfattar flera komponenter och fungerar oavsett vilken främmande eller sjukdomsframkallande mikroorganism som försöker tränga in i kroppen. Hud och slemhinnor i mag-tarmkanalen bildar en mekanisk barriär. Avstötning (desquamation) av celler från epitelet transporterar bort mikroorganismer. Genom sitt flöde bidrar tårvätska, saliv och urin till att avlägsna mikroorganismer. Flimmerhårens rörelse i luftvägarna medför en ständig transport ut ur kroppen av slem och mikroorganismer. Magens saltsyra och hudens fettsyror, t.ex. mjölksyra, skapar fysiologiska barriärer bl.a. genom surt pH. I hud och slemhinnor finns flera olika peptider och proteiner med antimikrobiell effekt. I orala slemhinnor och i saliv bildas bl.a. s.k. antimikrobiella peptider kallade defensiner och calprotectin med effekt mot bakterier, svampar och virus (Figur 4). Den artrika bakteriefloran i hud och på alla slemhinnor i hela mag-tarmkanalen försvårar tillväxt av sjukdomsframkallande bakterier. Under normala förhållanden föreligger balans mellan mikroorganismerna i den normala floran som gör att ingen bakteriegrupp kan föröka sig kraftigt på de andras bekostnad. Viktiga komponenter i det ospecifika försvaret är fagocyterande (fago=äta, cyt=cell) celler (Figur 3A) och komplementsystemet. Leukocyter (vita blodkroppar) tillhör de fagocyterande cellerna. De har aktiv rörelseförmåga och söker sig snabbt till ställen i kroppen som skadats eller invaderats av mikroorganismer. Där tar de upp främmande ämnen, t.ex. bakterier, i cytoplasman och bryter ned dem med särskilda enzym (fagocytos). Andra fagocyterande celler är makrofagerna som angriper främmande ämnen på samma sätt som leukocyterna. Makrofagerna samarbetar också med det specifika försvaret genom att ta upp främmande ämnen t.ex. mikroorganismer och presenterar dem för lymfocyterna (se nedan), som sedan attackerar inkräktaren. Därför kallas de också för antigenpresenterande celler. En viktig antigenpresenterande cell är dendritcellen, som förekommer i flera av kroppens vävnader (bl.a. i hud och munslemhinnans epitel, där de också kallas Langerhanska celler). Cellerna är försedd med långa förgrenade utskott och har fått sitt namn efter det grekiska ordet för träd, dendron. Dendritcellen arbetar aktivt; genom cellen passerar stora mängder vätska; från vätskan plockas främmande ämnen upp som presenteras för lymfocyterna (se nedan). Komplementsystemet består av ett antal proteiner, vilka normalt finns i blodplasman. Systemet aktiveras när det första proteinet fastnar på en bakteriyta. Då påverkar proteinerna varandra i en bestämd turordning. Till slut bildas porer i bakteriecellens yta; den ”punkteras” och dödas eller så ”smaksätter” (opsoniserar) proteinerna bakteriens yta så att de fagocyterande cellerna lättare kan ”äta upp” den. Inflammation är en del av det ospecifika försvaret och en samlande beteckning på reaktioner som kan utlösas av främmande ämnen t.ex. bakterier. Inflammation innebär en vidgning av blodkärl i området där bakterierna finns. Detta ger en ökad genomblödning av området som medför rodnad och värmeökning. Det är den rodnad 15 (93) som ses vid utveckling av gingivit och parodontit. Olika substanser kommer ut i vävnaden genom de läckande kärlen vilket leder, dels till svullnad, dels till att nervändarna i området retas (smärta). Leukocyter och makrofager, vandrar också ut, lockade till området för att fagocytera t.ex. bakterier. Specifika infektionsförsvaret Det specifika infektionsförsvaret kan inte bara skilja kroppsegna substanser från främmande (antigener), t.ex. mikroorganismer utan också skilja enskilda olika främmande substanser från varandra. Det specifika försvarssystemet kan alltså identifiera en inträngande mikroorganism och har en selektiv antimikrobiell funktion. Första gången en mikroorganism tränger in i kroppen tar det en viss tid innan det specifika försvaret fungerar fullt ut. Nästa gång kommer svaret både snabbare och mera kraftfullt. Det beror på att cellerna i det specifika försvaret den här gången känner igen inkräktaren. Det finns således i systemet inbyggt dels förmåga till specifik identifiering, dels en minnesfunktion. Andra gången individen drabbas av en infektionssjukdom är därför chansen stor att mikroorganismerna inte lyckas i sitt uppsåt. Individen har blivit immun (immunitet = skadeslös, undantagen). I det specifika försvaret medverkar T-hjälparlymfocyter, T- lymfocyter och B-lymfocyter (Figur 3B). För att fungera fullt ut måste både B-lymfocyter och T-lymfocyter få hjälp av en tredje typ av lymfocyter kallade T-hjälparlymfocyt (Th-celler) som troligtvis spelar en central roll i immunsystemet. Cellen tillverkar och utsöndrar s.k. signalsubstanser – cytokiner – som bidrar till att lymfocyterna aktiveras. Th-cellen medverkar också som ”effektor”-cell genom att starta en reaktion, som drar fagocyterande celler till platsen där den invaderande mikroorganismen finns (fördröjd överkänslighetsreaktion; väsentlig i t.ex. försvaret mot tuberkelbacillen). Th-cellen upptäcktes i samband med kartläggningen av humant immunbristvirus (HIV). Den brukar också kallas för CD4-positiva T-celler (CD4+) då de är bärare av ett särskilt markörprotein på sin yta. T-lymfocyter bildas i benmärgen och mognar i tymus (T syftar på tymus). Efter mognadsprocessen har de bl.a. lärt sig att t.ex. skilja bakterier från kroppens egna celler och vävnadskomponenter. T-cellerna cirkulerar i kroppen tills de träffar på ett för kroppen främmande ”föremål”, t.ex. en mikroorganism, som den är programmerad att bindas till. Genom medverkan av T-hjälparlymfocyten innebär bindningen att T-lymfocyten aktiveras till cytotoxisk T-cell/T-mördarcell. För mikroorganismen toxiska ämnen bildas och den lyserar (faller sönder). Virus och vissa bakterier kan ta sig in i kroppens vävnadsceller. Denna intracellulära förekomst innebär att Tlymfocyten/cytotoxiska T-cellen känner att vävnadscellen avviker (är infekterad) varför denna angrips och lyseras. Vid varje aktivering bildas dessutom minnes-T-celler, som är långlivade och som snabbt kan mobilisera nya T-lymfocyter vid ett nytt angrepp av den aktuella bakterien (Figur 3B). B-lymfocyter bildas i snabb takt i benmärgen. B kommer från ordet bursa; struktur i anslutning till tarmen hos fåglar, från vilket B-lymfocyter först isolerades. Varje dag produceras ungefär en miljard omogna B-celler, som cirkulerar i blodet eller förekommer i lymfkörtlarna. Mognaden sker i flera olika organ som tillhör kroppens lymfsystem, framförallt i mjälten. När B-lymfocyterna stöter på antigenet, t.ex. bakterier och samtidigt binds till T-hjälparlymfocyter, sker en aktivering av B-cellerna och ett stort antal plasmaceller bildas, som i sin tur på kort tid tillverkar flera tusen antikroppar, vars effekt endast riktar sig mot de bakterier som B-lymfocyterna kommit i kontakt med. T-hjälparlymfocyterna medverkan (”förstärker”) produktionen av antikroppar. Antikropparna binds till bakterierna som opsonisera (smaksätts), så att de fagocyterande cellerna lätt kan fånga in och bryta 16 (93) ned dem. Antikroppar kan också klumpa samman bakterier som förekommer i kroppsvätskor, t.ex. saliv och på så sätt hindra dem från att fastna på en slemhinneyta. Precis som T-lymfocyterna bildar B-lymfocyterna minnesceller för att snabbare kunna reagera när mikroorganismen nästa gång infekterar kroppen. T-hjälpar lymfocyterna medverkar också i produktionen av minnesceller och bidrar till långvarig antikroppsförmedlad immunitet. Det specifika infektionsförsvaret bidrar också till slemhinnornas barriärskydd genom att täcka dessa av s.k. immunglobulin, A-antikroppar (IgA), (Figur 3B och 4), som kan binda och klumpa samman mikroorganismer och hindra dem från att tränga in i kroppen. Figur 3A och 3B. Schematisk bild av viktiga celler i det ospecifika och specifika infektionsförsvaret. (A) Från en typ av stamceller i benmärgen bildas bl.a. neutrofila granulocyter [NG] ”vita blodkroppar” och makrofager [MF] som fagocyterar bakterier och virus. Fagocytosen kan ske oberoende av eller i samverkan med T-lymfocyter eller immunglobuliner. (B) Från en annan typ av stamceller bildas T-lymfocyter [TL] och B-lymfocyter [BL]. Både T- och B-lymfocyterna är omogna när de lämnar benmärgen. De omogna T-lymfocyterna passerar tymus [C], där den mognar. På samma sätt mognar B-lymfocyterna i mjälten [D] men också i andra organ. Lymfocyterna cirkulerar sedan med blod och lymfvätska eller förs till olika kroppsorgan. När T- och B-lymfocyterna angriper mikroorganismer, aktiveras de av T-hjälparceller [ThC]. T-hjälparcellaktivering är en förutsättning för optimal T-mördarcellsaktivitering och funktion. Den aktiverade T-lymfocyten (T-mördarcell) angriper t.ex. en vävnadscell som är infekterad av bakterier eller virus [IVC]. T-hjälparlymfocyterna har också en egen effektorfunktion genom att ”dra” fagocyterande celler till platsen där antigenet t.ex. mikroorganismerna finns. I samverkan med ThC bildar den aktiverade B-lymfocyten plasmaceller [PC], som i sin tur producerar ett stort antal immunglobuliner ”antikroppar” [IG] vilka angriper mikroorganismer. Samtidigt bildar ThC, TL och BL minnesceller [MC]. Den viktiga funktionen hos minnescellerna [MC] är att komma ihåg inkräktaren och få immunsystemet att reagera snabbare nästa gång kroppen angrips av samma bakterie eller virus. Teckning: Mikael Rehn Det immunologiska minnet innebär att vi effektivt kan skydda oss mot många infektionssjukdomar genom 17 (93) s.k. vaccination. Små mängder t.ex. fragment av bakterier (antigen) injiceras i eller under huden. På det sättet aktiverar man cellerna i det specifika infektionsförsvaret och bland annat bildas minnesceller, (Figur 3B), som känner igen mikroorganismen nästa gång kroppen utsätts för den. Immunsystemet reagerar då snabbare. Första och andra försvarslinjen Ett annat sätt att beskriva kroppens infektionsförsvar är att likna det vid två försvarslinjer. I den första försvarslinjen medverkar huvudsakligen komponenter från det ospecifika försvaret men också antikroppar som då finns på t.ex slemhinnorna; i första hand s.k. immunglobulin A (A-antikroppar, IgA). De IgA som passerar genom salivkörtlarna kopplas i körteln till en s.k. sekretorisk komponent, vilket skyddar IgA från många enzymer som finns i saliven (S-IgA). Det ospecifika försvaret tillsammans med antikropparna bilder ett barriärskydd i munnen. Figur 4 illustrerar kortfattat komponenter i munnens första försvarslinje. Den andra försvarslinjen, bekämpar främst angripare som tagit sig in i kroppens vävnader. Celler och komponenter ur både det ospecifika och specifika försvaret medverkar. Här är viktiga komponenter i det ospecifika försvaret, komplementsystemet, fagocyterande celler och inflammationsreaktionen samt i det specifika försvaret T-hjälparlymfocyter, B-lymfocyter/plasmaceller och T-lymfocyter/cytotoxiska T-lymfocyter (Figur 3A och B). Figur 4. Schematisk bild av infektionsförsvaret i munnen (1:a försvarslinjen) 18 (93) 1. I saliven finns sekretoriskt immunglobulin S-IgA som dels klumpar samman mikroorganismer i saliven, dels kan fästa vid munslemhinnan (2) och försvåra mikroorganismernas kolonisation i munnen. I saliv finns också antimikrobiella peptider Amp, som lactoferrin och lysozym samt enzymer som salivperoxidaser. Mucin smörjer slemhinnorna och liksom agglutinin försvårar mikroorganismernas kolonisation av munslemhinnan. 3. I munslemhinnans epitel bildas antimikrobiella peptider Amp, (t.ex. calprotectin, β-defensin). 4. Från tandköttsfickan kommer vid frisk gingiva små mängder av immunglobuliner IgG, vita blodkroppar och antimikrobiella peptider Amp som calprotectin. Vid gingivit/parodontit ökar mängden av dessa substanser. Teckning: Mikael Rehn Sammanfattningsvis är det många olika celler och komponenter i kroppens ospecifika och specifika försvar, som samverkar på ett effektivt sätt. Det ospecifika försvaret angriper snabbt där bl.a. den inflammatoriska reaktionen underlättar för cellerna i det ospecifika försvaret att attackera mikroorganismer. Makrofager och dendritceller - en del av det ospecifika försvaret - kan också aktivera det specifika försvaret, som med riktad verkan effektivt angriper mikroorganismer. Komplementsystemet hjälper de fagocyterande cellerna och utgör en länk till det specifika försvaret genom samverkan med antikroppar. I munhålan finns det myriader av bakterier, svampar och virus, som orsakar liten skada under normala förhållanden. Det beror bland annat på att infektionförsvarets samverkande komponenter befinner sig i ständig beredskap. Hur orsakar mikroorganismer infektioner? Termer och begrepp Infektion är en sjukdom orsakad av mikroorganismer. Termen infektion skall hållas isär från kontamination, kolonisation och inflammation. Kontamination betyder nedsmutsning eller förorening. Bakterier kan kontaminera och överleva t.ex. i intorkat blod eller saliv på instrument under kortare eller längre tid men de förökar sig inte. Kolonisation innebär en ökning av kontaminerande mikroorganismer exempelvis på slemhinnor i munnen utan att framkalla infektion. Det är också viktigt att skilja termen inflammation från infektion. Inflammation är kroppens svar på en infektion men kan också uppkomma exempelvis p.g.a. överbelastade leder och muskelfästen. Mikroorganismer som orsakar sjukdomar kallas patogena. Förhållandevis få mikroorganismer är patogena medan flertalet är apatogena dvs. de orsakar inte sjukdom. Den sjukdomsframkallande förmågan varierar mellan olika patogena mikroorganismer; man säger att de har olika virulens. Vissa patogener ger lätt upphov till en infektion och är således högvirulenta, t. ex hepatit B-virus medan andra är lågvirulenta, t.ex. orala streptokocker. Infektionsdosen, d.v.s. antalet mikroorganismer som behövs för att framkalla en infektion, varierar inte bara med smittämnets virulens utan också med den infekterade individens mottaglighet. Antalet mikroorganismer som orsakar infektion är inte alltid avgörande. Som regel gäller dock att fler mikroorganismer ökar risken for en infektion. Varje åtgärd, t.ex. rengöring av ett använt instrument är viktig för att minska risken för infektion. Opportunister är bakterier och virus som man bär på normalt men som blir sjukdomsframkallande när infektionsförsvaret sviktar, t.ex. vid inflammationsdämpande behandling med kortikosteroider, vid organtransplantation, kroniska infektioner samt vid ökad ålder och kan då orsaka s.k. opportunistiska infektioner. 19 (93) Bakterieinfektioner För att kolonisera, tränga in i vävnad och orsaka infektion utnyttjar många bakterier ett tillvägagångssätt baserat på adhesion till vävnaden (bakteriell vidhäftning) i kombination med produktion av enzymer och toxiner (Normark, 1996; Mims et al., 1993). De flesta bakterier har på sin yta utskott av olika slag, ofta trådformade med vilka de kan fästa på ytor, t.ex. mag-tarmkanalens epitelceller eller i pellikeln på tandytan. Andra bakterier bildar ett slemlager/kapsel på ytan (t.ex. polysackarid) med god vidhäftningsförmåga. En annan strategi för att etablera infektion är s.k. ”hög motilitet” d.v.s. att bakterierna har förmåga att röra sig snabbt och på det sättet hålla sig kvar i närmiljön även om den är turbulent såsom i den snabbt dränerande tandköttsfickan. Ett exempel på detta kan vara gruppen treponema-spiroketer vilka är associerade med parodontal sjukdom. För att bakterierna ska kunna etablera infektion krävs att de näringsmässiga förhållandena är gynnsamma och miljön i övrigt lämplig. Bakteriecellen hämtar sin näring från omgivningen; sker detta i vår kropp, kan det leda till nedbrytning av vävnaden. Även om bakteriernas enzymsystem inte alltid anses vara väsentliga patogenitetfaktorer, kan de skapa förutsättningar för en infektion. Bakteriella enzym kan nämligen öppna upp vävnadscellernas cellmembran (fosfolipas), spjälka vävnadsproteiner och peptider, bl.a. fibrinogen och immunoglobuliner (proteas och peptidas), förstöra vävnadscellernas kärna (nukleas); bidra till bakteriers spridning i vävnaden genom att bryta ned kollagenhaltig vävnad (kollagenas) och lösa upp substansen (bl.a. hyaluronsyra) mellan vävnadscellerna (hyaluronidas). Vissa bakteriegrupper har förmåga att bilda och utsöndra s.k. toxiner, som är giftiga för kroppens vävnader. Det finns två slags toxiner, endotoxin och exotoxin. Endotoxiner är delar av bakteriecellen, som frisätts när cellen faller sönder. Hos t.ex. gramnegativa bakterier frigörs från cellväggen bl.a. lipopolysackarider (LPS) som har flera biologiska och immunologiska effekter. Bland annat orsakar det en kraftig inflammationsreaktion och i svåra fall ge upphov till septisk chock eller aktivering av koaguleringssystemet; något som kan leda till blodproppar (trombos). Exotoxiner kan produceras av vissa grampositiva och gramnegativa bakterier. I motsats till endotoxiner utsöndras de från bakteriecellen. Två vanliga grupper av exotoxiner är neurotoxiner, som angriper nervsystemet och enterotoxiner som skadar mag-tarmkanalen. Stelkrampsbakterien (Clostridium tetani) bildar neurotoxin. Bakterien växer endast i ett sår medan toxinet sprids via blodet för att tas upp av nerverna. Nervprocesserna störs vilket medför ihållande (tonisk) kramp i muskler. Staphylococcus aureus kan bilda enterotoxiner i magtarmkanalen med skadlig effekt på tarmslemhinnans celler som medför kräkningar och diarréer. Det finns också exotoxiner med annan verkan, t.ex. mjältbrandsbakterien (Bacillus anthracis) som bildar ett exotoxin, vilket sätter blodets koagulerande förmåga ur funktion. Virusinfektioner Utanför värdcellen är virus fullständigt inaktivt och kallas då virion (Norrby, 1987; Thougaard et al., 2001). I denna ”livlösa” form kan virioner ta sig in i kroppen på olika vägar, via sår, hud, mag-tarmkanal eller luftvägar och föras vidare genom blodbanor, lymfkärl och vävnad tills de stöter på sin ”målcell” till vars yta den varaktigt binder. När virus har tagit sig in i ”målcellen”, tar de över dess metabolism. Nya viruspartiklar bildas, som kan lämna värdcellen på principiellt olika två sätt. Produktionen kan antingen vara långsam och nya virioner lämnar då cellen genom att knoppas av från dess yta. I regel överlever värdcellen och produktionen av virioner kan 20 (93) pågå under lång tid; något som är vanligt för hepatit B virus (HBV). Vid det andra (snabbare) sättet bildas stora mängder virioner på kort tid. Värdcellen dödas genom att dess membran brister och cellen sprängs varvid stora mängder viruspartiklar frisätts. Denna typ av s.k. lytisk infektion då värdcellerna sprängs sönder är karakteristiskt för bl.a. influensavirus. Akuta infektioner kan delas in i tre stadier Vissa tandvårdsrelaterade infektioner kan vara smittsamma innan symtom uppträder. Det kan också förekomma att ospecifika tecken på sjukdom uppträder efter tandbehandling, som tyder på begynnande allvarliga problem orsakade av behandlingen. Vid utredning av misstänkt tandvårdsrelaterad infektion, bör man tänka på att särskilt akuta infektioner kan genomgå olika stadier (Mims et al., 1993; Giesecke, 2003b). (1) Inkubationsperioden, den tid som förlöper mellan smittillfället och tidpunkten då de första symptomen börjar uppträda. Perioden kan vara olika lång; från någon timme till flera månader. Under perioden kan individen vara smittsam, särskilt under den senare delen trots att symtom saknas. Det kan vara svårt att identifiera en symtomfri men infekterad individ med hjälp av anamnes, undersökning eller laboratorietester, t.ex. vid infektiösa hepatiter. (2) Prodromalperioden (prodromos: grekiska = gå före) då allmänna men ospecifika symtom uppträder, som feber, illamående, aptitlöshet och trötthet, t.ex. vid HIV-infektion. (3) Specifika sjukdomsperioden då de karakteristiska symptomen för en sjukdom uppträder, exempelvis vätskefyllda, inflammerade smärtsamma blåsor på läppar vid herpes simplex-infektion. En individ kan sägas vara kronisk bärare av en infektion om kroppen efter en akut infektion inte fullständigt lyckats eliminera de mikroorganismer som orsakat sjukdomen. En infektion kan även vara subklinisk/asymtomatisk dvs. individen visar inga symptom men laboratorietester visar att immunsystemet reagerat på smittämnet t.ex. vid hepatit B-infektion. Hur sprids infektioner? I princip krävs tre faktorer vid smittspridning mellan personer: (1) smittsam person, (2) smittväg och (3) mottaglig person. För att överväga vilka smittskyddsåtgärder som är lämpliga i olika situationer, är det väsentligt att känna till smittvägarna. Överföring av smitta kan ske på flera olika sätt (Ransjö & Åneman 2006). För tandvårdens del kan det vara aktuellt att i första hand nämna följande: • Direkt kontaktsmitta. Från sårsekret orsakad av herpesvirus har smitta spridits från patient till tandvårdpersonal. • • Indirekt kontaktsmitta från en person till en annan via, händer, instrument, arbetskläder etc. En tandläkare som var frisk bärare av meticillinresistenta Staphylococcus aureus (MRSA) har via sina händer orsakat munhåleinfektioner med denna bakteriestam hos två patienter. Blodburen smitta en särskild form av kontaktsmitta då man anser att överföringen sker via blod och blodblandade kroppsvätskor. Icke rengjorda/desinfekterade/steriliserade instrument, som använts på patient med smittsam hepatit B kan överföra smitta till personal och nästa patient. Hepatit B kan spridas till mottaglig tandvårdspersonal från hepatit B-bärande patient vid stick/skärskada oavsett hur väl rengjort/desinfekterat/steriliserat instrumentet 21 (93) • Luftburen smitta (mikrobiellt förorenade droppar/aerosol). Särskilt när man arbetar med snabborrmaskin eller ultraljudsapparatur bildas, dels droppar som är så tunga att de faller ned efter någon meter, dels små droppar som kan hålla sig svävande (aerosol). På så sätt har mikroorganismer från vattnet i dental unit orsakat munhåleinfektioner hos personer med nedsatt infektionsförsvar. Enstaka fallbeskrivningar tyder också på att Legionella från vattnet i uniten kan orsaka allvarlig lunginfektion hos tandvårdpersonal. Inom kroppen kan mikroorganismer spridas på olika sätt från t.ex från ett sår eller en infektion i en kroppsvävnad till en annan kroppsvävnad. Spridningsvägar kan vara blodbanor, lymfsystem men även inne i nervceller eller direkt genom vävnad. I blodbanorna förekommer också transport av mikrobiella toxiner och immunologiska komplex bestående av mikrobiella antigen kopplade till antikroppar, som kan orsaka inflammation i olika vävnader. Bakteriemi innebär förekomst och spridning av bakterier i blodet, som normalt är sterilt. Det inträffar ofta efter odontologiska ingrepp och varierar från 20% efter endodontisk behandling till 100% av patienterna efter tandextraktion (Heimdahl et al., 1990). Bakteriemi kan också förekomma efter enkla fickdjupsmätningar (Kinane et al., 2005; Fomer et al., 2006). Särskilt vid gingivit/parodontit kan tuggning, tandborstning, och användning av tandtråd medföra daglig bakteriemi av orala mikroorganismer (Guntheroth, 1984; Roberts, 1999; Fomer et al 2006). Graden av gingivit är relaterad till mängden av mikroorganismer som förekommer i blodbanorna. Bakterier som cirkulerar med blodet elimineras vanligen på kort tid (≤ 30 min) av vårt infektionsförsvar (Heimdahl et al., 1990, Rajasuo et al., 2004) och orsakar inte några symtom, annat än möjligen en lätt temperaturstegring; s.k. transient bakteriemi (Yagupsky & Nolte, 1990). För att säkerställa diagnosen bakteriemi krävs att bakterier påträffas i blodprov. Tandvårdsrelaterade infektioner Vårdrelaterade infektioner är en av de vanligaste komplikationer som drabbar patienter inom sjukvården. Infektionerna definieras i regeringspropositionen Strategi för ett samordnat arbete mot antibiotikaresistens och vårdrelaterade sjukdomar (2005/06:50) som ”sjukdomar, som uppkommer i samband med vård, undersökning eller behandling inom hälso- och sjukvården eller tandvården, oavsett vilken vårdgivare som svarar för vården och oavsett om patienterna eller den vårdande personalen drabbas”. Variationerna är stora mellan olika sjukvårdinrättningar men som tidigare nämnts uppskattar man att i genomsnitt c:a 10 procent av patienterna drabbas (Lundholm, 2006). För tandvårdens del saknar vi samlad information om tandvårdsrelaterade infektioner, vilket bl.a. framgår av Socialstyrelsens verksamhetsöversyn (SoS rapport 1998:19). I den odontologiska facklitteraturen förekommer få studier som entydigt pekar på ett samband mellan infektioner och tandbehandling. De flesta publikationer är s.k. fallbeskrivningar (case reports) och även i Socialstyrelsens riskdatabas finns case reports som visar att patienter drabbats av infektioner i samband med tandvård. Dessa infektioner orsakas av ett förhållande litet antal mikrobiella arter (se sidorna 22-33). I munnen kan emellertid förekomma olika sjukdomsframkallande mikroorganismer; både virus och bakterier (Tabell 2) utan symptom och utan att tandvårdsrelaterade infektioner kunnat konstateras. Dessa mikroorganismer har ansetts utgöra en smittrisk enbart genom sin närvaro. 22 (93) Tandvårdsrelaterade infektioner kan indelas i endogena och exogena infektioner. Endogena infektioner Dessa infektioner beror på att den mikroflora, som finns i patientens mun sprids till annat kroppsorgan (bakteriemi), exempelvis vid extraktion av en tand förs orala mikroorganismer med blodet till hjärtat, där de orsakar infektion. Behandlingen har utlöst infektionen; spridningen av mikroorganismerna sker inom patienten (endogen= alstrad inuti kroppen) och inte mellan personal och patient. Man talar om en tandvårdsrelaterad endogen infektion. Det finns ett fåtal publikationer, närmast observationsstudier men flertalet är fallbeskrivningar (case reports). Sepsis Sepsis (septikemi) är bakteriemi med kliniska tecken på infektion. Det kräver dels att bakterier finns i tillräckligt antal i blodet samt att de har börjat föröka sig, dels att infektionsförsvaret inte förmår avlägsna bakterierna tillräckligt snabbt. Bakomliggande orsaker är i regel en infektionshärd utanför blodbanorna eller en större skada, t.ex. av slemhinnan. De kliniska symtomen är i regel måttliga men kan också vara hög feber och frossa. När tillståndet har ett mera långsamt förlopp, exempelvis vid sepsis orsakad av lågvirulenta viridansstreptokocker efter tandextraktion, kan subfebrilitet, illamående, trötthet, muskelsvaghet och huvudvärk uppträda (Dahlström, 2002). Nyligen har ett fall beskrivits där tandextraktion orsakade allvarlig sepsis (Blomgren & Hagberg, 2007). Infektiös endokardit Vid bakteriemi kan en omfattande kolonisation av bakterier ske på hjärtklaffarnas endotel, som skadas och en infektiös endokardit utvecklas. Tandbehandling kan vara primärfokus, pågående tandinfektioner ett annat; gingivit/parodontits roll i detta sammanhang är föremål för diskussion. Personer med hjärtåkommor riskerar i större utsträckning än andra att drabbas. C:a 70-75 % av de personer som drabbas, har lidit av någon hjärtåkomma men även andra sjukdomar anses kunna predisponera (Durack & Phil, 1995). Det har också rapporterats att friska personer insjuknat i infektiös endokardit efter tandbehandling. De vanligaste odontologiska riskfaktorerna (”primärfokus”) för utveckling av endokardit är tandextraktion, andra käkkirurgiska ingrepp och depuration framförallt subgingivalt (Martin el al., 1997). Det finns också rapporter som beskriver enstaka endokarditfall efter endodontisk och ortodontisk behandling, fyllningsterapi, applikation av matrisband och kofferdam, suturtagning samt puts av tänder (Roberts, 1999). Trots att man under senare år framhållit vikten av profylaktisk antibiotikabehandling vid behandling av patienter med hjärtåkommor, har inte antalet infektiösa endokarditer minskat (Moreillon & Que, 2004). För att med någorlunda säkerhet kunna bedöma om en tandvårdsrelaterad infektion föreligger, är det önskvärt att visa att de mikroorganismer, som förekommer i en infektion och/eller i ett blodprov, är desamma som påträffas i prov från munnen (Corson et al., 2001; Pallasch, 2003; Marques da Silva et al., 2004; Thomas et al., 2007). Det kan emellertid vara svårt att fastställa sambandet. Så utgör t.ex. viridansstreptokocker (alfahämolytiska streptokocker) en betydande del av den orala normalfloran, varför munnen ofta betraktas som primär- 23 (93) fokus när dessa streptokocker påvisas i en misstänkt tandvårdsrelaterad infektion. Viridansstreptokocker kan emellertid även kolonisera magtarmkanalen (Whiley et al., 1992). Vi har ofullständiga kunskaper om tandvårdsrelaterade infektiösa endokarditers incidens. I Socialstyrelsens register över infektiös endokardit [SoS årsrapport 2001] anges totala incidensen i Sverige till c:a 5 per 100 000 invånare och år, motsvarande c:a 400 fall årligen. Det överensstämmer med resultat presenterade i andra studier (Fonager et al., 2003, Thomas et al., 2007). Inte i någon av dessa rapporter framgår incidensen orsakad av odontologiska ingrepp. I en retrospektiv amerikansk studie som omfattar data från tiden 1930 – 1996 anges andelen infektiösa endokarditer orsakade av ”dental procedures” till c:a 7,5 % av den totala prevalensen [Drangsholt 1998]. Oberoende av varandra har van der Meer et al. (1992a, b) och Drangsholt (1998) beräknat frekvensen till ett fall på c:a 3 500 ingrepp av karaktären ”dental risk procedures” och man betecknar risken för endokardit efter blodiga odontologiska ingrepp, som ”very low” även för personer med hjärtsjukdomar. Mot bakgrund av det bristfälliga sambandet mellan infektiös endokardit och blodiga tandbehandlingar, har profylax med antibiotika vid dessa ingrepp diskuterats ingående under senare år och rekommendationerna för antibiotikaprofylax ändrats, bl.a. i Sverige och Storbritannien (SOS 2004-102-1; Thomas et al., 2007; Wray et al., 2008). Wray et al. (2008) som sammanfattar de för brittisk tandvård framtagna rekommendationerna av The National Institute for Health and Clinical Excellence (NICE guidelines 2008), skriver ”antibiotic prophylaxis to prevent infective endocarditis (IE) should not be given to people at risk of IE undergoing dental procedures”. Det framhålls i stället att det är väsentligt att tandläkare och tandhygienister poängterar vikten av god munhygien för patienter med risk för infektiös endokardit (Martin, 2008; Wray et al., 2008). Man diskuterar också riskerna för utveckling av antibiotikaresistens och allergier. Här framhåller särskilt Thomas et al. (2007) att underlaget för ett ställningstagande i dessa frågor är mycket begränsat. Statens beredning för medicinsk utvärdering har nyligen presenterarat en rapport om antibiotikaprofylax vid kirurgiska ingrepp (SBU, 2010). Diskussionen om antibiotikaprofylax vid ingrepp i munhålan har sammanfattats av Axelsson och Heimdahl (2010). För svensk del gällande rekommendationer och riktlinjer för endokarditprofylax presenteras i korthet på sidan 43. Infektioner i hjärnan I odontologisk facklitteratur förekommer då och då rapporter - ofta case reports - som beskriver infektioner i hjärnan s.k. hjärnabscess eller hjärnhinneinflammation (meningit) orsakad av bakterier som anses härröra från orala bakteriefloran. Infektionerna sätts i dessa fall i samband med pågående parodontit, endodontisk infektion och ingrepp som tandextraktion, parodontal eller kirurgisk behandling men också puts och polering; även tillsynes friska personer har drabbats (Schuman & Turner, 1994; Renton et al., 1996; Corson et al., 2001). Bakteriefloran i hjärnabscesser som misstänks vara av odontogent ursprung varierar men vanliga är grampositiva kocker, främst streptokocker, och gramnegativa anaeroba stavar, t.ex. fusobakterier och bakteroides (Gendron et al., 2000). Infektionerna är sällsynta, vilket främst anses bero på blod-hjärn barriären, som tillsammans med immunsystemet utgör ett effektivt hinder för bakterier att tränga in i hjärnan. I USA beräknas totala antalet fall per år uppgå till c:a ett fall på 100 000 individer (Corson et al., 2001). Tidigare var mortaliteten hög (30-50%) men med förbättrade undersökningsmetoder och operationstekniker har den sjunkit (4-15%) (Mampalam & 24 (93) Rosenbaum, 1988). I två retrospektiva studier rapporteras, dels att fyra av 60 fall, dels två av 54 fall kunde relateras till ”dental treatment” och tandinfektioner (Brewer et al., 1975, Limeres-Posse et al., 2003). Personer med medfött hjärtfel, bakteriell endokardit och nedsatt immunförsvar kan utgöra riskgrupper (Eiski et al., 1995; Li et al., 1999; Marques da Silva et al., 2004). Ledinfektioner Inopererade ledimplantat har benägenhet att infekteras av mikroorganismer; höftledsproteser anses särskilt känsliga (Gillespie 1990, Waldman et al., 1997). Vanligen indelas ledinfektioner i tidiga och sena. Tidiga infektioner kan bero på mikrobiell kontamination i samband med operationen. Sena infektioner är de som uppträder 3-6 månader efter operationstillfället och sätts främst i samband med spridning av mikroorganismer via blodet (bakteriemi). Antalet sena ledinfektioner som anses vara odontogent betingade varierar i olika studier från 0,04 % till 0,2 % av totalt studerade inopererade höftledsproteser (Yagiela 1995). Vid dessa finner man ofta blandflora med inslag av orala bakterier bl.a. viridansstreptokocker i infektionshärden, vilket varit en avgörande iakttagelse för att beteckna infektionen som odontogent betingad. Pågående parodontal eller endogen infektion ansågs ligga bakom merparten av fallen medan de klart relaterade till själva tandbehandlingen utgjorde en mindre del (Jacobsen & Murray, 1980; Thyne & Ferguson, 1991; Yagiela 1995; Waldman et al., 1997). Vissa sjukdomar kan vara riskfaktorer i de tandvårdsrelaterade fallen, t.ex. reumatoid artrit, diabetes mellitus, grav parodontit och immunosupprimerade patienter (Thyne & Ferguson, 1991; Yagiela et al., 1995). Enstaka fallbeskrivningar förekommer som rapporterar infektioner i normal/frisk led (septisk/infektiös artrit) efter tandbehandling. I dessa fall har infektionen drabbat knäled, fingerled och käkled; i samtliga fall har sambandet till tandbehandling verifierats genom mikrobiologisk undersökning (Marshall et al., 1993; Payne & Wolfe, 1994; Moses et al., 1998). Även om antalet ledinfektioner orsakade av tandbehandling är mycket litet, är infektionerna svåra att behandla och innebär långa invalidiserande perioder för patienten. Svalginfektioner Infektioner i halsens vävnader kan utgå från tandsystemet; apikal parodontit, marginal parodontit och perikoronit är vanliga orsaker. Infektionerna sprider sig från munbotten längs hålrum (s.k. spatier) och bindväv till halsens djupare delar (Meurman & Lindqvist, 2002) och kan då leda till inflammation i lungmellanrummet (mediastinit) eller lungsäcksinflammation (pleurit); tillstånd som är förenad med livsfara och kräver avancerad sjukhusvård. Odontogena infektioner anses ligga bakom c:a 70% av fallen medan bl.a. trauma och mandibelfrakturer kan vara andra bakomliggande faktorer (Adielsson et al., 2000). Vid mikrobiologiska analyser finner man främst fakultativt anaeroba och anaeroba bakterier tillhörande munfloran (Ylijoki et al., 2001). Tidigare tandbehandling kan emellertid också vara en utlösande faktor. I två studier, där man presenterar orsaker, sjukdomsförlopp och behandlingsresultat, fann man att tandextraktion, främst av underkäkens molarer var den utlösande faktorn i 34 % (12/35) respektive 15% (15/100) (Adielsson et al., 2000; Ylijoki et al., 2001) men det förekom också att rotbehandling och depuration framkallat infektionen. Vissa sjukdomar, t.ex. diabetes och nedsatt immunförsvar, orsakad av bl.a. reumatiska sjukdomar kan öka risken för svalginfektion. Trots modern kirurgisk behandling och omfattande antibiotikaterapi är dessa infektioner fortfarande komplicerade och i vissa fall livshotande, varför tidig diagnos och behandling är mycket väsentlig. 25 (93) Lunginfektioner Normalt skyddar immunsystemet och det ospecifika infektionsförsvaret, t.ex. flimmerhår och hostreflex, mikroorganismer från att nå de nedre luftvägarna (bronkerna). Det är emellertid sedan länge känt att saliv- och plackbakterier kan orsaka lunginfektion (bacterial pneumonia) (Rams & Slots, 1989). Försvaret i luftvägarna, framförallt hos äldre med nedsatt immunförsvar och personer som behandlas vid intensivvårdskliniker, försämras (Fourier et al., 1998; Mojon, 2002; Adachi et al., 2007). Dessa infektioner kan vara livshotande och kräva omfattande behandling. I flera studier pekar man på dålig munhygien och parodontit som väsentliga bidragande orsaker till lunginfektioner (Scannapieco & Mylotte, 1996; Scannapieco et al., 2003; Ishikawa et al., 2008). I sputum (upphostning) påträffar man ofta fakultativt anaeroba och anaeroba orala bakterier (Scannapieco, 1999). Åtgärder som sätts in för att förbättra munhälsan har också visat sig reducera förekomst av bakteriella lunginfektioner (Scannapieco et al., 2003). Förebyggande tandvård hos gamla och vårdberoende är således viktigt för att minska risken för dessa endogena infektioner (Wårdh, 2003; Brodam, 2007; Field, 2008). Andra bakteriella infektioner Även andra bakteriella infektioner har satts i samband med odontogena ingrepp och tandinfektioner. I enstaka rapporter redovisas förekomst av blodpropp i sinus cavernosus venplexus beläget på hjärnans undersida; s.k. kavernös sinustrombos (Ristow, 1979; Palmersheim & Hamilton, 1982; Rams & Slots, 1989; Udaondo et al., 2008) och infektioner i ögats vävnader (Abbot et al., 1990; Zachariades et al., 2005; Farrier et al., 2006; Lamont & Booth 2006; Barbeau, 2007). Osteomyelit, den kroniska formen av beninflammation - vanligen med nekrotiska benfragment - har iakttagits efter tandextraktion (Navazesh, 1995). Osteoporos, en sjukdom där benet gradvis förlorar kalcium, behandlas ofta med bisfosfonat, som hämmar osteoklastaktiviteten. Det har emellertid visat sig att bifosfonatbehandlingen ibland efter tandextraktion, kan orsaka svårbehandlad osteomyelit-liknande skada med sekundär infektion av orala bakterier, s.k osteonekros (Jarnbring et al., 2006; Krihika et al., 2009; Sedhizdeh et al.; 2009; Saia et al., 2010). En översikt om biverkningar och komplikationer vid behandling med bisfosfonater har nyligen presenterats (Brokstad Herlofson 2009). Även om dessa komplikationer är sällsynta, kräver de drabbade individerna i regel omfattande behandling. Candidos Jästsvampar koloniserar de orala slemhinnorna hos c:a hälften av befolkningen och påträffas främst på tungryggens dorsala delar och på buccala slemhinnan; ofta i lågt antal. Jästsvampar kan emellertid under vissa förutsättningar orsaka infektion i orala slemhinnor s.k. Candidos. Vid dessa infektioner finns nästan alltid predisponerande faktorer, dels allmänfaktorer, som nedsatt infektionsförsvar (t.ex. HIV/AIDS), immundämpande läkemedel och kortikosteroider eller antibiotika men även åldern kan spela en roll; nyfödda och gamla drabbas lättare än andra, dels lokala faktorer som kraftigt nedsatt salivsekretion och kolhydratrik kost (Budtz-Jörgensen, 1990; Cannon & Firth, 2006, Lewis & Williams 2009). Den kliniska bilden hos candidoser varierar och karakteriseras ibland av vita till gråaktiga beläggningar, som täcker en rodnad, lättblödande och smärtande slemhinna. I andra fall är slemhinnan endast inflammerad och 26 (93) de angripna områdena orsakar sveda och värk (Axell 2000; Lewis & Williams 2009). Jästsvampar, framför allt Candida albicans har benägenhet att fästa på akrylat och förekommer därför rikligt på slemhinnesidan av akrylproteser men även på ortodontisk apparatur med akrylkomponenter (Olsen, 1990; Oksala, 1990). Slemhinnesidan av hela överkäksproteser kan vara en reservoar för jästsvampar, som orsakar protesstomatit (Wilson, 1998; Figueiral et al., 2007). Därför kan det vara lämpligt att rebasera proteser då antimykotiska medel sätts in (Nordström, 2001). Särskilt kan det vara fallet hos patienter – främst äldre - med högt antal av jästsvampar i munnen. Vid riklig förekomst av jästsvampar i saliven hos patienter med candidos eller hos personer, som är bärare av svampen, har spridning via kontaktsmitta observerats inom sjukvården (Cannon & Chaffin, 1999), vilket också torde ske i samband med tandbehandling. Exogena infektioner Den nära kontakten mellan patient och tandläkare/tandhygienist innebär att smittämnen lätt kan föras över från patient till personal eller från personal till patient men även från omgivningen till både patient och personal. Dessa tandvårdsrelaterade exogena infektioner (exogen= som kommer utifrån) förknippas främst med de patogena bakterier och virus, som tillfälligtvis påträffas i munnen (Tabell 2). Risken varierar och smittvägarna är inte alltid kartlagda. Under senare år har antalet publikationer som bl.a. beskriver tandvårdrelaterade hepatit Boch Herpes simplex-smitta (ffa från patient till personal) minskat; något som troligtvis beror på att skyddshandskar används i allt större utsträckning och på förbättrade hygienrutiner. Förändringen talar för att direkt och indirekt kontaktsmitta är de mest förekommande smittvägarna. Även dropp- och aerosolsmitta anses dokumenterad men här är vår kunskap mera bristfällig. Konstaterade exogena infektioner Ett begränsat antal rapporter har publicerats som visar konstaterad smittspridning vid tandbehandling. Både virus och bakteriell smitta har rapporterats. Infektioner som förts över från patient till tandläkare eller tandhygienist anses framförallt orsakad av direkt eller indirekt kontaktsmitta på grund av brister i hygienrutinerna, främst barriärskyddet. Kontaktsmitta rapporteras också som den främsta orsaken till smittspridning från tandläkare/tandhygienist till patient. Hantering och smittrening av använda instrument innebär den största smittrisken för tandsköterskepersonalen (indirekt kontaktsmitta). Få studier visar aersol/droppsmitta. Smittspridningen av de olika mikroorganismerna presenteras nedan i respektive avsnitt. Hepatit B-virus (HBV) Vi känner idag till sex helt obesläktade virus, som kan orsaka leverinflammation; hepatit A-virus till hepatit Gvirus (Struwe, 2003b; Sällberg, 2007). Under 2010 anmäldes totalt 1596 fall av hepatit B-infektion, varav 125 var akut infektion. Antalet fall med akut infektion var under året 13 flera jämnfört med 2009 beroende på ett ökat antal rapporterade fall med intravenöst missbruk. Kronisk infektion (tidigare smittade) förekom hos 1382 individer (SMI 2012). HBV smittar endast mellan människor och överförs med blod eller blodkontaminerade kroppsvätskor som saliv. Inkubationstiden är 2-6 månader. HBV orsakar inflammation i levern men alla får inte karakteristiska 27 (93) tecken för gulsot som bl.a. kännetecknas av att hud och slemhinnor antar en solbränd färg. I stället besväras de flesta av allmänna sjukdomssymtom med trötthet och dålig matlust under lång tid (veckor till månader). Individen är smittsam flera veckor före symtomdebuten. C:a 5% utvecklar med tiden kronisk leverinflammation. Diagnosen ställs genom att man påvisar särskilda markörer i blod (HBsAg = hepatit B ytantigen och HBeAg = hepatit B e-antigen), som är protein ingående i viruspartikeln. Dessa markörer talar inte bara om för oss att individen har insjuknat i hepatit utan indikerar också eventuell smittsamhet (Jörbeck & Samulsson, 2006). Beroende på vilken fas av infektionen som individen befinner sig i (akut eller kronisk) varierar risken för överföring av smitta t.ex. vid stick av en blodkontaminerad kanyl från 0 till 30 % (Struwe, 2003a). Man bör emellertid observera att HBV är mycket smittsam. Så lite som 0,00004 ml blod kan vara tillräckligt för att orsaka smitta (Jörbäck & Samuelsson, 2006). En person som är HBsAg-positiv skall alltid anmälas till smittskyddsläkare. Ytterligare bedömning utförs och serumprov tas för bestämning leverstatus, HBeAg och antikroppar mot HBe. Förekomst av HBeAg indikerar hög smittsamhet medan anti-HBe kan betyda hög, låg eller obetydlig smittsamhet (SLF 2006). Senare prov visar om och när smittsamhet upphör eller om infektionen går över i ett kroniskt stadium. Antikroppar mot ytantigenet (anti-HBs), som uppträder 3-6 månader efter insjuknandet talar för immunitet och att infektionen läkt ut, d.v.s. personen är inte längre smittsam. Anti-HBs uppträder som enda antikropp hos vaccinerade personer. Vid tandbehandling är risken att drabbas av hepatit B alltid förknippad med blod och blodblandad saliv. Det förekommer emellertid att man även diskuterar saliv och gingivalvätska som tänkbara smittvägar eftersom ytantigenet HBs-Ag och kärnmaterial från HBV (HBV-DNA) har påvisats i dessa kroppsvätskor (van der Eijk et al 2004; Lamster et al 2007). Störst anses risken vara vid marginala gingivan som ofta är mer eller mindre inflammerad. (Cottone & Puttaiah, 1996) Det finns flera studier som visar att HBV överförts från tandvårdpersonal till patient och från patient till personal (Rimland et al 1977; Weil et al 1977; Shaw et al., 1986; Scully & Sanaranayake, 1992; Marsh & Martin, 1999; Redd et al., 2007). Smittspridning anses kunna ske både genom direkt och indirekt kontaktsmitta. Rapporter som tyder på direkt kontaktsmitta mellan patient och tandläkare publicerades främst före 1990-talet d.v.s. innan skyddshandskar kom i allmänt bruk. Indirekt kontaktsmitta via blodkontaminerade instrument är dokumenterad för både tandläkare och annan tandvårdspersonal. Men också andra spridningsvägar har diskuterats. I en studie, som visade smittspridning mellan patienter, vilka behandlats av samma oralkirurg, antyds att personalens arbetskläder kunde– teoretiskt sett – vara en möjlig spridningsväg (Redd et al., 2007). Sedan slutet av 1980-talet finns ett effektivt vaccin. Antalet tandläkare som drabbats under sista decenniet har sjunkit kraftigt; incidensen ligger nu på samma nivå som befolkningen i sin helhet. Emellertid löper tandläkare som inte är immuna eller vaccinerats mot HBV 3-6 gånger större risk än befolkningen i allmänhet (Cottone & Puttaiah, 1996). Problem och risker med hepatit B vid tandbehandling har nyligen sammanfattats av Maboobi et al. (2010). HIV (humant immunbristvirus), AIDS (förvärvad immunbristsjukdom) Till och med år 2008 har totalt 8 455 personer med HIV anmälts i Sverige; av dessa lever c:a 5 000 personer (SMI, 2009b). 448 fall rapporterades under 2008, vilket är 93 färre än 2007. 28 (93) De vanligaste smittvägarna för HIV är heterosexuell smitta, sex mellan män och intravenöst missbruk. HIV-infektion läker inte ut spontant. Den smittade bär virus resten av livet. Blod och bl.a. blodblandad saliv är därför smittsamma under mycket lång tid även om smittsamheten vid exponering inte är särskilt stor. Hos personer som är HIV-infekterade utsöndras emellertid kärnmaterial av HIV (HIV-RNA) i saliven i förhållande till sjukdomsförloppet (stiger vid försämring av hälsotillstånd) men även i förhållande till graden av inflammation i gingivan (Navazesh et al 2010). Efter en inkubationsperiod på 1-4 veckor kan en del få lindriga och snabbt övergående period med halsont, feber, svullna lymfkörtlar medan andra inte märker något. Det kan sedan dröja flera år innan man insjuknar i AIDS (Jörbeck & Samuelsson, 2006). Diagnos ställs genom att antikroppar mot HIV (anti-HIV) påvisas i blod. Antikroppar kan detekteras 2-6 veckor efter smittillfället. En person anses smittsam efter att två anti-HIV-prov visat sig vara positiva. Laboratoriediagnostiken utvecklas hela tiden; idag kan man, som nämnts ovan, påvisa kärnmaterial från virus s.k. HIV-RNA (Jörbeck & Samuelsson, 2006; Navazesh et al 2010). Trots att HIV/AIDS varit känt i mer än 25 år, finns det i dag få rapporter som beskriver smittspridning vid tandbehandling. Mest känt är det s.k. Floridafallet där en HIV-positiv tandläkare med stor sannolikhet har spridit HIV till minst 3, möjligen totalt 6 patienter (CDC, 1991). Detta fick utomordentligt stor uppmärksamhet inte bara i USA utan i hela världen och ledde till att vårdrelaterade sjukdomar och hygien hamnade på tandvårdens agenda. Smitta har troligen också spridits från HIV-positiva patienter till 5 tandläkare och 2 tandläkarstuderande (Scully & Greenspan, 2006). Utredningar visar att brister i de basala hygienrutinerna förekommit i dessa fall eller så har vassa instrument med HIV-kontaminerat blod orsakat stickskador. Eftersom man känner till att det finns HIV-positiv vård- och tandvårdpersonal har man genomfört flera kohortundersökningar där patienter vilka behandlats av vård- och tandvårdpersonal som bär smittan, undersökts med HIVtester. Resultaten, som för tandvårdens del, sammanfattats av Scully och Greenspan (2006), tyder på att risken för spridning av HIV vid tandbehandling är mycket liten. Detta under förutsättning att goda hygienrutiner tillämpas. För den som är HIV-positiv eller bärare av annan smittsam sjukdom gäller enligt smittskyddslagen (sid. 88) att behandlande läkare skall utforma individuella förhållningsregler för att förhindra smittspridning. Herpes simplex infektion Inom familjen herpesvirus (Herpesviridae), finns 8 kända humanpatogena typer av virus, vars officiellt antagna beteckning är humant herpes virus, således HHV-1 till HHV-8; samtliga kan förekomma i munnen. Av dessa har endast HHV-1, vanligen kallad Herpesvirus simplex-1 (HSV-1) rapporterats orsaka tandvårdsrelaterade infektioner. Mellan 50 och 90 % av vuxna har antikroppar mot HSV-1, vilket tyder på stor spridning av virus i befolkningen. HSV-1 orsakar först en primär infektion men kvarstannar i kroppen i en latent fas (”vilande”) och kan sedan reaktiveras. Den primära infektionen drabbar främst barn i förskoleåldern och ger i regel obetydliga eller inga symtom. Endast c:a 10 % insjuknar i s.k. herpetisk gingivostomatit med talrika ulcerationer och blåsor i munslemhinnan (Praetorius, 2002; Heyman 2004). Den vanligaste formen av reaktiverad herpesinfektion i och kring munnen är Herpes labialis (Praetorius, 2002; Glick, 2002). Virus kan förekomma inte bara hos patienter med pågående infektion, utan har också påträffats hos 2 till 9 % av personer som är symtomfria samt i c:a 45 % av undersökta fall med sjukdomen i prodromalstadiet, alltså innan karakteristik blås- och sårbildning uppträder (Scott et al., 1997). Hos personer utan kliniska sym- 29 (93) tom har HSV-1 påvisats i saliv, gingival vävnad och parodontala tandköttsfickor (Scott et al., 1997; Contreras et al., 2000; Sällberg, 2007). Gingival vävnad och parodontala fickor anses vara en reservoar för HSV-1 (Contreras et al., 2000; Klemenc et al., 2005). Som väntat förekommer virus i stort antal på orala slemhinnor när kliniska symtom på sjukdomen föreligger (Boivin et al., 2006). En del patientgrupper kan drabbas av svåra HSV-1 infektioner, främst personer med defekter i immunsystemet alternativt behandlas med immundämpande läkemedel eller personer med icke intakt hud, t.ex. eksem (Scully & Samaranayke, 1992). En vanlig smittväg är saliv. Det finns dock få publicerade studier om smittspridning i samband med tandvård. I en studie rapporteras att smitta överförts från tandvårdpersonal till patienter (Manzella et al., 1984); i andra att patienter smittat tandvårdspersonal som drabbats av s.k. herpetic whitlow; en fingerinfektion som orsakats av direkt kontakt med herpesblåsor eller sår (Rowe et al., 1982; Manzella et al., 1984; Günbay et al., 1993). Herpetic whitlow har visat sig vara signifikant högre bland tandläkare än i jämförbara kontrollgrupper (Rowe et al., 1982). Undersökningarna genomfördes innan skyddshandskar började användas mera allmänt inom tandvården. Problem och risker förknippade med tandbehandling av patienter med herpes labialis, herpetic whitlow och keratitis har presenterats (Lewis, 2004). Stafylokockinfektioner De två vanligaste stafylokockarterna är Staphylococcus epidermidis (vita stafylokocker) och S. aureus (gula stafylokocker). S. epidermidis utgör en väsentlig del av människans normala hudflora och påträffas framförallt vid talgkörtelmynningar och svettkörtelporer. Bakterien brukar emellertid betecknas som opportunistisk patogen, eftersom den under vissa omständigheter kan orsaka infektioner, t.ex. hos individer med nedsatt immunförsvar och vid behandling med kateter (Hedin & Hambraeus 1991). S. aureus kan förekomma på och i huden; särskilt gäller det näsöppningen, perineum och axillerna och från dessa områden förorena andra delar av kroppen (Hedin 2006). S. aureus anses inte tillhöra normalfloran utan betraktas som patogen. Methicillin-resistenta Staphylococcus aureus (MRSA) är en mindre grupp S. aureus-stammar som förvärvat resistens mot alla beta-laktamantibiotika bl.a. penicilliner och cefalosporiner (Åhrén et al., 2006). MRSA utgör ett ökande problem inom vården. Sedan MRSA blev anmälningspliktig har antalet fall ökat varje år; år 2010 anmäldes 1580 (SMI, 2010). Det var 100 flera fall än 2009. Under senare år har allt fler smittats utanför sjukvården. MRSA har också påträffats hos grisar, hundar och hästar. Som andra S. aureus-stammar kan MRSA förekomma på huden och i luftvägarna, företrädesvis i främre delen av näsan. Förekommer de endast i näsöppningen, kan personen vara tillfälligt koloniserad men påträffas bakterien samtidigt i svalg, axiller eller ljumskar, bedöms bärarskapet oftast som permanent. Den viktigaste smittvägen för MRSA är direkt kontakt med hudområde eller sår där bakterien förekommer men indirekt kontaktsmitta via personalens händer, naglar, kläder, instrument etc. har också stor betydelse (Åhrén et al., 2006). I ansiktshuden, på yttre delar av läpparna och särskilt i näsöppningarna kan både S. epidermidis och S. aureus kolonisera (Knighton, 1965; Pereira et al., 1999; Murdoch et al., 2004; Hedin, 2006). Man har länge ansett att stafylokockerna inte tillhör normalfloran i munnen varför misstänkta vårdrelaterade infektioner orsakade av denna bakteriegrupp inte bedömts ha oralt ursprung. Bakterierna kan emellertid isoleras från tungan, den dentogingivala regionen och tandköttsfickor (Rams et al., 1990; Dahlén & Wickström, 1995) där de förekommer i lågt antal hos c:a hälften av undersökta individer (Murdoch et al., 2004). Vid pågående antibiotikabehandling har man funnit en markant övergående ökning (Helovuo, 1988; Wahlin & Holm, 1988). Studier utförda under 30 (93) senare år visar att S. aureus troligtvis är mera vanlig i munnen än man tidigare ansett. Även prevalensen av MRSA i munnen är sannolikt underskattad. I undersökningar har man funnit MRSA på orala slemhinnor i olika patientgrupper. (Owen et al., 1994; Rossi et al., 1996; Tawara et al., 1996; Suzuki et al., 1997; Smith et al., 2003). Framförallt förekom MRSA hos personer som vårdades på sjukhem; i en brittisk översikt redovisas bl.a. att 19% av patienterna var bärare av MRSA i munnen (Smith et al 2001). Vi saknar motsvarande svenska undersökningar men eftersom Sverigre fortfarande tillhör den grupp länder i Europa med lägst andel MRSA (Olsson Liljequist, 2012), torde de höga prevalens som redovisas i vissa inernationella odontologiska undersökningar inte gälla för svenska förhållanden. Trots att flera studier visat att MRSA förekommer på munslemhinnorna finns det endast enstaka dokumenterade studier som rapporterar tandvårdsrelaterad spridning av MRSA (Martin & Hardy, 1991). Även meticillinresistenta varianter av Staphylococcus epidermidis (MRSE) har påträffats hos personer med avtagbara proteser (Tawara et al., 1996). Eftersom det är väl känt att både S. aureus, MRSA och S. epidermidis kan kontaminera vårdpersonalens händer och kläder och på så sätt föras över till patienter och orsaka infektion, är det troligt att motsvarande smittspridning äger rum vid tandbehandling när de basala hygienrutinerna inte fungerar. Tuberkulos (TBC) Tuberkulos orsakas av Mycobacterium tuberculosis, vars cellvägg och kapsel innehåller komplexa föreningar med bl.a. fett (lipider) som gör bakterien särskilt motståndskraftig för uttorkning och ger den förmåga att överleva långa perioder i damm och intorkad upphostning (Mims et al., 1993; Jörbeck & Torell, 2006). Tuberkulos drabbar främst lungorna men även andra organ kan någon gång bli infekterade bl.a. munvävnaderna och då särskilt tungan (Porteous 2008). Antalet fall av tuberkulos i Sverige har ökat sedan 2003. Men trorts detta hör Sverige fortfarande till de länder som har lägst incidens av sjukdomen. För 2011 var den 6,3 fall per 100 000 innevånare att jämföra med 7,3 under 2010. Antalet fall beror nästan helt på invandringen från länder med många fall av tuberkulos (SMI 2012). Tuberkulos sprids främst via mikroskopiska droppar/aerosol vid hosta. Mest smittsamma är personer med obehandlad ”öppen” (kavernös) lungtuberkulos. Smittsamheten avtar kort tid efter insatt effektiv behandling och inom 2-3 veckor anses den obetydlig (Jörbeck & Torell, 2006). Det är ofta familjemedlemmar och andra närstående som löper risk att bli smittad. Sjukvårdspersonal som drabbats har främst blivit smittade när patientens tuberkulos varit okänd (Jörbeck & Torell, 2006). Personer med nedsatt immunförsvar t.ex. HIV-infektion är en riskgrupp. En konstaterad tuberkulos hos en HIV-infekterad kan bero på att patienten nyligen blivit smittad (s.k. primär infektion) eller så har sjukdomen reaktiverats från ett latent stadium, s.k. post-primär infektion (Samaranayake, 2002; Rinaggio 2003; SMI, 2009a). Tuberkulos har blivit aktuell på nytt genom kopplingen till HIV-infektion men också då incidensen ökat i länder i vårt närområde och genom invandring från länder där tuberkulos är ofta förekommande. Under 1900-talets första hälft var tuberkulos vanligare bland tandvårdpersonal och tandläkarstuderande än hos jämförbara befolkningsgrupper (Shaw, 1952). Numera avviker inte prevalensen bland tandvårdpersonal 31 (93) från befolkningen som helhet. Generellt sett anses risken för smittspridning vid tandvård som liten (Bagg, 1996; Porteous & Terezhalmy, 2008). Endast enstaka rapporter har publicerats som beskriver smittspridning. En tandläkare med smittsam tuberkulos orsakade hos 15 patienter lungtuberkulos och tuberkulösa infektioner lokalt i munnen efter tandextraktioner (Smith et al., 1982). Sannolikt har också tuberkulos spridits från en anställd vid en tandläkarmottagning till annan person vid samma klinik (Cleveland et al., 1995). Förekomst av tuberkulos i munhålevävnaderna har beskrivits (Kakisi et al., 2010). Även om risken för smittspridning inom tandvården betecknas som liten, åstadkommer den nära kontakten mellan patient och personal samt arbetsmoment som skapar aerosol förutsättningar för smittspridning. Tandvårdspersonal skall alltid använda andningsskydd med hög avskiljnadsgrad (FFP3) vid behandling av patient med säkerställd eller misstänkt smittsam tuberkulos. På motsvarande sätt som sjukvårdspersonal drabbats av tuberkulos torde tandbehandling av patient med okänd smittsam tuberkulos innebära en betydande smittrisk. Rekommendationer hur man inom sjukvården bör gå tillväga vid hälsokontroll och preventiva insatser rörande tuberkulos har nyligen publicerats (SoS 2012). Pseudomonasinfektioner Pseudomonas är en gramnegativ stav, som förekommer i jord och i både sött och salt vatten (Thougaard et al 2001). Släktet innehåller framför allt en humanpatogen art, P. aeruginosa, som kan kolonisera luftvägar och tarmkanal hos nedgångna patienter och orsaka infektioner hos individer med nedsatt infektionsförsvar, t.ex. på grund av hög ålder, blodcancer eller cystisk fibros; däremot drabbas friska individer sällan (Wretling, 1996). P. aeruginosa koloniserar dentala units vattenledningssystem (Barbeau et al., 1996; Walker et al., 2000). I likhet med andra gramnegativa stavar, som Klebsiella, Escherichia och Enterobacter, koloniserar P. aeruginosa mera sällan orala slemhinnor hos friska individer (Rosental, 1975; Valenti et al., 1978). Hos äldre och i samband med cytostatika- och strålbehandling förekommer däremot P. aeruginosa ofta på orala slemhinnor och kan då orsaka lokal inflammation (Dahlén et al., 1982; Wahlin & Holm, 1988). Pseudomonas kan utveckla resistens mot flera antibiotika som används ofta (pencilliner och cefalosporiner), genom att bilda enzymer med ”utvidgat spektrum” (extended spectrum beta-lactamas, ESBL) som bryter ned antibiotika (SMI 2009b). ESBL-producerande bakterier är i första hand ett problem inom sjukvården men även i äldreboenden, där spridning skett via indirekt kontaktsmitta t.ex. vårdpersonalens händer och kläder. Orala pseudomonasinfektioner har drabbat svårt sjuka när s.k. munpenslar kontaminerade med P. aerugonosa har använts för att sköta munhygienen hos dessa patienter (Iversen 2010). Personer med cystisk fibros får ofta en svårbehandlad lunginfektion orsakad av P. aeruginosa (Høiby, 2006) och hos dessa patienter förekommer bakterien ofta i det dentala placket, på tungryggen, kindslemhinnan och i saliven (Komiyama et al., 1985). I en annan studie av patienter med cystisk fibros och som var bärare av den pseudomonas-liknande bakterien Burkholderia cepacia i munnen, fann man att den aerosol som bildades vid tandbehandling inte kontaminerade instrument och inredning utan den smittspridning som skett, ansågs bero på indirekt kontakt via saliv (Pankhurst & Philpott-Howard, 1996). Lokala orala slemhinneabscesser orsakade av P. aeruginosa har också rapporterats hos två immunokomprometterade patienter, vilka med stor sannolikhet orsakats av de P. aeruginosa stammar som man kunde isolera från unitarnas vattenledningssystem (Martin, 1987). Även hos friska personer kan man under kortare eller längre perioder (dagar till veckor) påvisa förekomst av P. aeruginosa på munslemhinnorna 32 (93) utan kliniska symtom efter tandbehandling vid unitar vars vattenledningssystem var kontaminerat med bakterien; något som indikerar spridning via vattnet (Exner et al., 1981; Martin, 1987). P. aeruginosa har också i enstaka fall orsakat rotkanalsinfektioner (Ranta et al., 1988). Legionellainfektioner Legionella är en gramnegativ stav som finns naturligt i låg koncentration i sötvatten och grundvatten. Den koloniserar i biofilmer, som lätt bildas i vattenledningar, kyltorn, luftkonditioneringsapparater, duschar, bubbelbad och ledningar i tandläkarstolar (dental unit). Bakterien växer till vid temperaturer mellan 20-45°C (särskilt 30-40 °C) och anrikas lätt i stillastående vatten och blindledningar. Höga bakterietal påträffas oftast i duschmunstycken och kranpackningar (Darelid & Löfgren, 2006). Tillväxten i ledningar krävs för att bakterien ska orsaka sjukdom; de låga koncentrationer som finns naturligt i sötvatten anses inte orsaka infektion. Att dricka vatten som innehåller legionellabakterier är ofarligt, liksom att få bakterien på huden. Det är framför allt en art inom släktet Legionella – L. pneumophila - som kan orsaka lunginflammation hos människa (legionärssjuka). För att drabbas av legionärssjuka krävs dels att man andas in en vattendimma (aerosol), som innehåller bakterien (Bollin et al., 1985) dels ett nedsatt immunförsvar. Personer som behandlas med immunohämmande läkemedel, rökare, alkoholister och i viss utsträckning äldre (>65 år) löper ökad risk att insjukna (Darelid & Löfgren, 2006). Emellertid kan också helt friska personer drabbas om smittdosen är tillräckligt hög. Sedan c:a 20 år tillbaka känner vi till att L. pneumophila och andra Legionella arter koloniserar vattenledningarna i dentala unitar (Reinthaler & Mascher, 1986; Veronesi et al., 2007; Pasquarella et al., 2010). En multinationell studie (Walker et al., 2004) har rapporterat att Legionella isolerats från kylvattnet till turbinvinkelstycket, från spolvattnet i blästern (trevägssprutan) och från vattenslangarnas biofilm i uniten. Omfattningen av kolonisationen varierar mellan olika unitmodeller, koncentrationen av bakterien är i regel låg och den förekommer intermittent (Challacombe & Fernandes, 1995; Walker et al., 2004). Smittspridning anses främst ske via den aerosol som genereras när unitens kyl- och spolfunktion utnyttjas. Vi saknar emellertid data som pekar på att incidensen av legionärssjuka skulle vara högre bland tandvårdpersonal och patienter inom tandvården än befolkningen i sin helhet. Det uteblivna sambandet anses bero på flera faktorer. Det kan bl.a. bero på att samtliga samhällsförvärvade legionellainfektioner inte diagnosticeras, att legionellainfektioner som endast orsakar feber utan lungengagemang, s.k. Pontiacfeber förekommer och därför inte rapporterats eller att virulensen hos den legionella, som koloniserar i dentala units, är låg (Atlas et al., 1995; Smith et al., 1999). Patienter med nedsatt infektionsförsvar betecknas som en riskgrupp, även om vi saknar data som talar för en hög prevalens (Challacombe & Fernandes, 1995; Atlas et al., 1995; Smith et al., 1999). Tandvårdspersonal kan ha högre prevalens av antikroppar mot Legionella än befolkningen i allmänhet (Fotos et al., 1985; Reinthaler et al., 1988). Det stöds av iakttagelsen att en tandläkare drabbats av legionärssjuka orsakad av samma legionella art som påträffades i uniten på hans klinik (Atlas et al., 1995). Patogena mikroorganismer som kan utgöra smittrisker I munnen kan - under längre eller kortare perioder – förekomma sjukdomsframkallande bakterier och virus (sid 10) utan symtom på pågående infektion I litteratur som beskriver munhåleinfektioner anses att dessa 33 (93) mikroorganismer skulle kunna utgöra potentiella smittrisker vid tandbehandling. Det faktaunderlag, som presenteras i litteraturen varierar. Bland annat nämns att patienter, som har pågående symtomfri kronisk infektion, t.ex. hepatit C, skulle kunna utgöra en risk för tandvårdpersonal via direkt/indirekt kontaktsmitta. Flera rapporter talar för detta men än så länge saknas studier som klart visar att så är fallet. Även risken för spridning av luftburen smitta vid tandbehandling diskuteras, t.ex. influensa från personal till patient eller från patient till personal. Moderna molekylärbiologiska metoder tillämpas i allt större utsträckning vid kartläggning av smittrisker och smittvägar. Det möjliggör säkrare och snabbare bedömning av misstänkta samband (se sid. 44). Bilden kan därför snabbt ändras. Det kan inte uteslutas att mikroorganismer, som i dag betraktas som potentiella smittrisker i en nära framtid kan visa sig vara reella smittrisker vid tandbehandling. Hepatit C-virus (HCV) Hepatit C sprids via blod och är vanlig bland missbrukare och förekom tidigare i samband med blodtransfusioner. Totalt anmäldes under år 2008, 2 526 fall (SMI, 2009b). Inkubationstiden är vanligen 7-8 veckor (≤ 3 månader) men det förekommer också att en infektion föreligger, som inte upptäcks förrän årtioende senare (Kallings, 2003). Sjukdomen orsakar inflammation i levern. I de flesta fall förekommer inga karakteristiska symtom; istället besväras många av trötthet, ledbesvär och dålig matlust under veckor till månader. Förloppet kan vara smygande och kronisk leverinflammation är vanlig. Minst 50 procent av de drabbade utvecklar kronisk leverinfektion och kan bli bärare av virus under mycket lång tid. En del kroniska bärare drabbas så småningom av skrumplever (levercirrhos) eller levercancer. Det finns inget vaccin. Diagnos ställs genom att antikroppar mot hepatit C (anti-HCV) påvisas i blodprov. Antikropparna påträffas några veckor efter sjukdomsdebuten. Om anti-HCV finns i flera prov bedöms personen som smittsam. Spontan utläkning förekommer, som bekräftas genom flera negativa anti-HCV-tester (SLF, 2004; SMI, 2009a). Smittrisken är mindre för hepatit C än för hepatit B; risken vid stickskador i vården beräknas till en tiondel av den som anses föreligga vid hepatit B (Struwe 2003a). Kärnmaterial (ribonukleinsyra; RNA) från HCV har inte bara påvisats i blod utan också i saliv (Nagao et al., 2000). Tandborstar som personer med kronisk HCV använder, har visat sig vara kontaminerade med kärnmaterial från HCV (Lock et al., 2006). Generellt sett anses koncentrationen av HCV i saliv hos infekterade person vara låg (Porter & Lodi, 1996) och varierar med motsvarande koncentration i blod (Hermida et al., 2002; Wang et al., 2006). Det finns inte något klart dokumenterat fall av HCV-smitta inom tandvården (Castro Ferreir et al., 2004). I blodprov har man emellertid funnit att fler käkkirurger än tandläkare verksamma i allmänpraxis var positiva vid anti-HCV test (Molinari, 1996). Vissa anser att tandvårdspersonal har en något förhöjd risk att drabbas av HCV-infektion vid jämförelse med befolkningen i övrigt (Molinari, 1996; Lodi et al., 1997; Lodi et al., 2002) medan andra hävdar motsatsen (Leao et al., 2006; Nago et al., 2008). Bilden är således inte entydig men den höga prevalensen av HCV i populationen understryker vikten av goda hygienrutiner. För närvarande finns ingen rapport som beskriver smittspridning mellan HCV-infekterad tandläkare och patienter (Younai 2010). Herpesvirus (HHV-2 - HHV-8) Samtliga virusarter i familjen Herpesviridae (humant herpesvirus, HHV1-8) kan förekomma i munnen. Problem förknippade med HHV-1, herpes simplex-1 (HSV-1) har presenterats ovan. 34 (93) HHV-2, herpes simplex 2 HSV-2 förekommer främst vid genitala infektioner men har påvisats vid herpesinfektioner i munnen. HHV-3, varizella-zoster virus (VZV) Primärinfektionen orsakad av VZV är vattkoppor, som ofta drabbar förskolebarn i mild form. VZV kan sedan ta sig in i känselnerverna (sensoriska nervers ganglier) och finnas där i ”vilande” (latent) form för att hos vuxna reaktiveras och orsaka bältros (herpes zoster). Infekterar virus Nervus trigeminus uppträder karakteristiska blås- och sårbildningar i ansiktshud och munslemhinnor. De starka smärtor som ofta är förenade med infektionen, kan komma före utslagen och likna pulpitsmärtor (Praetorius, 2002; Eriksson & Eriksson, 2003). VZV har inte påvisats i gingival vävnad eller parodontala fickor. Sår och blåsor på hud och slemhinnor innehåller virus vars virulens ofta är låg. Virus som smittar personer med nedsatt infektionsförsvar kan medföra att dessa patienter insjuknar i vattkoppor. HHV-4, Epstein-Barr virus (EBV) EBV infekterar främst kroppens lymfoida celler. Barn drabbas i regel av en symtomfri infektion medan ungdomar och även äldre insjuknar i feber, svullna tonsiller och förstorade lymfkörtlar, s.k. mononukleos/körtelfeber (Praetorius, 2002; Ericson & Ericson, 2003). EBV är ett av få virus som har klart samband med utveckling av cancer bl.a. i nasofarynx (Sällberg, 2007). Virus har i flera undersökningar påvisats i gingival vävnad och parodontala fickor (Contreras et al., 2000; Saygun et al., 2002; Klemenc et al., 2005; Miller et al., 2005). Smitta sprids främst genom saliv, vilket i regel kräver nära kontakt, sjukdomen kallas ibland för ”kissing disease”. Patienter med mononukleos eller de som är immunosupprimerade kan utsöndra stora mängder virus i saliven men även ≤ 20 % av undersökta friska individer kan vara bärare av EBV i saliv (Scully & Samanarayke, 1992). HHV-5, cytomegalovirus (CMV) CMV infekterar i första hand vita blodkroppar (polymorfkärniga leukocyter) och vissa lymfocyter samt celler i orofarynx. I befolkningen har c:a 50 % av ungdomarna antikroppar mot CMV, vilket tyder på tidig smitta; primärinfektionen är i de allra flesta fall symtomfri (Heyman 2004,). Virus kan ligga vilande (latent) i cellerna för att senare reaktiveras. Även reaktiverad CMV-infektion är många gånger symtomfri. Däremot kan reaktivering hos immunsupprimerade patienter leda till allvarliga infektioner som omfattar lymfvävnad i lungor, magtarmkanal och lever (Scully & Samanarake, 1992; Sällberg, 2007). I vissa fall kan latent virus reaktiveras i samband med graviditet med risk för skador hos barnet (Jörbeck & Samuelsson, 2006). CMV har isolerats från saliv, gingival vävnad, orala slemhinnesår och från tandköttsfickor (Leimola-Virtanen et al., 1995;Contreras et al., 2000; Saygun et al., 2002; Klemenc et al., 2005; Miller et al., 2005). Saliv är en av flera smittvägar men det krävs i regel nära kontakt för spridning eftersom CMV anses lågvirulent. Immunosupprimerade patienter kan kontinuerligt utsöndra virus i stor mängd i saliv och andra kroppsvätskor som bröstmjölk och urin (Scully & Samanarake, 1992). CMV överlever i fuktig miljö på ytor i ≤ 8 timmar och i salivdroppar i upp till 2 timmar. HHV-6, HHV-7 och HHV-8 HHV-6, HHV-7 och HHV-8 har beskrivits under senare år. HHV-6 är närstående CMV och primärinfektionen drabbar främst barn som då får lindriga symtom, ofta lätt feber eller så passerar infektionen utan symtom. 35 (93) HHV-6 kan sedan kvarstå vilande (latent) under lång tid i flera olika celler bl.a. lymfocyter. Mer än hälften av den vuxna befolkningen har antikroppar mot HHV-6. Reaktivering av HHV-6 hos immunokompetenta vuxna innebär ofta infektion med obetydliga symtom medan immunosupprimerade kan drabbas av allvarliga infektioner (Scully & Samaranayake, 1992). HHV-6 kan förekomma i saliv, gingival vävnad och tandköttsfickor (Contreras et al., 2000; Klemenc et al., 2005; Miller et al., 2005). Smittspridning anses främst ske via saliv. HHV-7 är närstående HHV-6 och CMV. Primärinfektionen drabbar barn och ger lindriga symtom och virus kan sedan finnas kvar i latent form i vissa lymfocyter. Virus har påvisats i saliv och vätska från tandköttsficka (Hidaka et al., 1999; Contreras et al., 2000; Miller et al., 2005) och smitta sprids med saliv. Antikroppar mot HHV-7 förekommer hos stora delar av befolkningen (Greenberg, 1996). HHV-7 kan möjligen orsaka komplikationer hos organtransplanterade personer (Sällberg, 2007). HHV-8 är en möjlig bidragande orsak till utvecklingen av tumörsjukdomen Kaposis sarkom, som bl.a. påträffas i munslemhinnan hos AIDS-patienter och smittvägen är troligen saliv (Leao et al., 2000; Sällberg, 2007). Sammanfattningsvis; samtliga herpesvirus orsakar en primärinfektion med eller utan symtom och övergår sedan i en vilande (latent) fas, som kan reaktiveras. Inte bara under reaktivering av infektionen utan även under den symtomfria latensfasen kan virus utsöndras i saliv (Scully & Samaranayake, 1992; Knaup et al., 2000). Saliv utgör således en möjlig smittväg, som innebär en risk framför allt för immunosupprimerade och äldre men även för behandlande personal. Humana papillomvirus (HPV) Humana papillomvirus (HPV) tillhör familjen vårtvirus. HPV infekterar basalcellerna i hudens och slemhinnornas epitelvävnad och är den viktigaste riskfaktorn för cancer i livmoderhalsen (cervixcancer) men kan också orsaka cancer i andra epiteliala basalceller (skivepitelcancer) bl.a. i munnen och farynx (Syrjänen, 2006; Dahlstrand et al., 2007; Ragin et al., 2007). För närvarande känner man till mer än hundra olika HPV-typer, varav vissa infekterar hud; bl.a. HPV typ 2, 4, 7, medan andra angriper slemhinnevävnader, t.ex. HPV typ 6, 11, 42. Cancerrisken varierar mellan de olika typerna; man talar om lågrisktyper (HPV typ 6, 11, och 42) och högrisktyper, t.ex. HPV typ 16, 18 (Syrjänen, 2006). Det finns två olika vacciner mot HPV-infektion (Gardasil, Cervarix) som båda skyddar mot HPV typ 16 och 18; från år 2010 ingår vaccin i barnvaccinationsprogrammet (SMI 2009c). I godartade tumörformer som förekommer i munslemhinnorna, exempelvis vårtor, påträffas olika typer av HPV. Sannolikheten för att påvisa virus i munslemhinnan ökar i takt med graden av vävnadsförändring (Praetorius, 2002; Syrjänen, 2006). Med genteknik har man visat att 10-20 % av den vuxna befolkningen med till synes frisk munslemhinna har HPV i gingivalt epitel (Hormia et al., 2005). Vid sidan av sexuell smittspridning anser man att virus kan överföras mellan individer via saliv (Rintala et al., 2006). Rhino-, adeno-, corona-virus Rhinovirus, adenovirus och de flesta coronavirus ger i regel banala infektioner, t.ex. vanlig ”förkylning” och svalginfektioner men kan också orsaka infektioner i nedre luftvägarna. Däremot orsakar influensavirus och det coronavirus, som ger upphov till SARS (svår akut respiratorisk sjukdom) ofta inflammation i bronkernas slemhinnor (bronkit) och infektion i nedre luftvägarna (pneumoni). Dessa kan framför allt få ett allvarligt förlopp 36 (93) hos äldre och personer med nedsatt infektionsförsvar eller hjärtsvikt. Det finns tre olika typer av influensavirus, (typ A, B och C). Det är främst typ A som ger upphov till epidemier. På influensavirus yta finns två proteiner som betecknas H (hemagglutinin) och N (neuraminidas) (Figur 2B; sid. 11). Mot dessa proteiner bildar vårt immunsystem antikroppar, för att på så sätt hindra virus att tränga in i cellerna i luftvägarna. Emellertid sker ständigt mindre men ibland också större förändringar hos utskotten H och N; vilket försvårar immunsystemets möjlighet att bekämpa virus. Förändringarna innebär att vi får olika undergrupper (subtyper) av influensavirus, som betecknas med H1, H2, H3 eller H5 och N1 eller N2. Flera olika subtyper har orsakat influensaepidemier, t.ex. subtyp H2N2 den s.k. Asiaten 1957 och H3N2 Hongkong-influensa 1968. Olika subtyper av influensa återkommer årligen – infektionen pågår ständigt någonstans i världen. I dag diskuteras framförallt subtyp H5N1 (fågelinfluensa) och den nya influensan subtyp A(H1N1)2009 (den s.k. ”svininfluensan”) (SMI, 2009a). Det finns redan ett virus i befolkningen med beteckning H1N1. Det nya influensavirus, som nu sprids i befolkningen, tillhör denna subtyp men har en genetisk sammansättning som man inte sett förut och benämns därför den nya influensan A(H1N1)2009 men kallas i pressen missvisande för ”svininfluensan”. Man känner inte exakt till dess ursprung. Eftersom det är en ny subtyp, har inte någon tidigare drabbats, vilket troligen betyder att ingen är immun. Viruset sprids mycket lätt mellan människor. Det innebär att vem som helst kan drabbas. Den nya influensan har orsakat en pandemi eftersom den på kort tid spridits över stora delar av världen. När en infekterad individ hostar eller nyser, fastnar virus på små partiklar eller droppar i luften (aerosol, sid. 40), som andra personer andas in. Man kan också få droppar på händerna, från vilka de förs över till mun eller ögon. Infektionen orsakar f.f.a. feber, hosta och halsont. Komplikationer är främst lunginflammation, bihåleinflammation och mellanöreinfektion. En sjuk person är smittsam t.o.m. 7:de dagen efter att man börjat få symtom. När febern gått tillbaka bör man stanna hemma ytterligare 1-2 dagar. En individ som haft influensan är immun. Behandlingen syftar till att lindra symtomen och förkorta sjukdomstiden under förutsättning att influensapreparatet ges inom 2 dagar efter insjuknandet, t.ex. det antivirala läkemedlet Tamiflu, som hindrar virus från att spridas i kroppen genom att interferera med utskottet neuraminidas (N) på virus yta. Under augusti månad i förra året (2010) förklarade World Heath Organization (WHO) att influensapandemin är över. Det är emellertid troligt att viruset kommer att cirkulera i världen under många år men då mera likna de virus som säsongvis förekommit. Den vacinationskampanj som genomfördes under vinter 2009/2010 har avslutats men vaccinet finns tillgängligt för dem som ännu inte vaccinerat sig. Genom att vaccinera sig, kan man minska risken för andra att bli sjuka, t.ex. de som av medicinska skäl inte kan vaccineras. Svår akut respiratorisk sjukdom (SARS), som orsakas av ett coronavirus, beskrevs första gången 2003. SARS spreds över världen på kort tid och även sjukvårdspersonal drabbades (SMI, 2009a). Sjukdomen överförs vid tät kontakt. Huvudsymtom är feber och besvär från luftvägarna; särskilt drabbas äldre och personer med underliggande sjukdom. Specifik terapi saknas. Genom noggranna förebyggande åtgärder, identifikation av fall, smittspårning och isolering har man framgångsrikt hindrat sjukdomen att spridas ytterligare. Senaste inträffade fallet rapporterades från Kina våren 2004 (CDC 2009). Smittskyddsinstitutet (SMI) och Centers for Disease Control and Prevention (CDC) i USA följer utvecklingen kontinuerligt. Förkylningsvirus, influensa och SARS sprids vanligen genom dropp- och kontaktsmitta (Heyman, 2004; Jörbeck & Torell, 2006). Vid influensa förekommer smittspridning mellan patient/sjukvårdspersonal särskilt 37 (93) om infektionen förlöper utan eller med lindriga symtom (Jörbeck & Torell, 2006). Spridning av SARS-virus sker när de kliniska symtomen visar sig (ofta hastigt påkommande hög feber). Sekret från luftvägarna kan förekomma i munnen, t.ex. vid hosta. I samband med SARS-epidemin i Hongkong registrerades ingen tandvårdsrelaterad spridning (Samaranayake personligt meddelande 2003). Under pågående ”influensaperiod” bör särskild hänsyn tas vid behandling av äldre eller personer med nedsatt infektionsförsvar. Goda basala hygienrutiner är väsentligt. Vaccination mot aktuell subtyp av influensa under pågående epidemi bör också övervägas. Myndigheternas krisberedskap om bl.a. luftvägsinfektioner kan följas på www.krisinformation.se där man också finner svar på många frågor. Virus som orsakar barnsjukdomar Mässling (morbilli), påssjuka (parotit) och röd hund (rubella) drabbar i första hand barn och skolungdom. Mässling och röda hund tillhör de s.k. exantemsjukdomarna; den kliniska bilden kännetecknas av karakteristiska rodnande hudutslag s.k. exantem. Båda virusarterna angriper luftvägsepitel, varför virus utsöndras i luftvägarna och smittan sprids som droppar och aerosol. Påssjukevirus angriper körtelvävnad framför allt öronspottkörteln (parotis) och smittar främst via droppar (Scully & Samaranayake, 1992; Ericson & Ericson, 2003). Väsentligt är att samtliga tre virusarter kan ge komplikationer av olika slag, t.ex. vid röda hund fosterskador om kvinnan smittas under tidig graviditet (SMI 2009a). Smittsamhet föreligger för alla tre virusarter 1-4 dagar innan symtomdebut och virus kan finnas i saliv. Det finns sedan många år ett effektivt kombinerat vaccin mot mässling, påssjuka och röda hund, MPR-vaccin (Kaijser, 1999; SBU 2009), som ingår i barnvaccinationsprogrammet. I samband med mässling och röda hund har smittspridning rapporterats mellan patient och sjukvårdspersonal (Jörbeck & Torell, 2006). I februari 2008 konstaterades tre fall av mässling; en vaccinerad person fick sjukdomen lindrigt medan de två andra som inte var vaccinerade utvecklade klassisk mässling med ett besvärligt förlopp (Ringberg, 2008). Det finns grupper av föräldrar, som vägrar vaccinera sina barn med motiveringen att det skulle kunna utlösa olika sjukdomar som autism, vilket diskuterats i litteraturen men inte bevisats (SBU 2009). Påssjuka och mässling orsakas av två olika paramyxovirus, som kan isoleras från saliv under den inledande symptomfria sjukdomsperioden av dess sjukdomar (Scully & Samaranayake, 1992). Febersjukdomen Herpangina orsakas av ett coxsackievirus, som kan isoleras från saliv och munslemhinneepitel och överföras vid nära kontakt eller som luftburen smitta (Scully & Samaranayake, 1992). Enterobakterier Gramnegativa stavformade bakterier, som tillhör familjen Enterobacteriaceae, brukar i dagligt tal kallas enterobakterier (entero = tarm); hit hör bakteriesläktena Klebsiella, Enterobacteria och Escherichia coli, vars naturliga miljö framför allt är tarmkanalen. Dessa bakterier påträffas sällan i munnen hos friska individer (Rosental, 1975; Valenti et al., 1978; Sedgley & Samaranayake 1994). Emellertid predisponerar sjukhusvistelse, brister i immunsystemet, cytostatika- och strålbehandling samt antibiotika för deras kolonisation på orala slemhinnor; här kan enterobakteriernas uppgå till c:a 10 % av den totala odlingsbara mikrofloran. (Dahlén et al., 1982; Wahlin & Holm, 1988; Helovuo, 1988; Sedgley & Samaranayake, 1994). Enterobakterier har också påträffats i djupa 38 (93) tandköttsfickor men då som regel i lågt antal (Dahlén & Wickström, 1995). De kan kolonisera i munnen utan kliniska symtom på infektion eller inflammation. Nyligen har man uppmärksammat att vissa undergrupper (s.k. kloner) av bl.a. Escherichia coli och Klebsiella kan utveckla resistens mot flera antibiotika som används ofta (pencilliner och cefalosporiner), genom att bilda enzymer med ”utvidgat spektrum” (extended spectrum beta-lactamas, ESBL) som bryter ned antibiotika (SMI 2009b). ESBL-producerande bakterier är i första hand ett problem inom sjukvården men även i äldreboenden, där spridning skett via indirekt kontaktsmitta t.ex. vårdpersonalens händer och kläder (SMI, 2009b). Eftersom enterobakterier förekommer på orala slemhinnor hos vissa patientgrupper som behandlas inom tandvården (Wahlin & Holm, 1988; Sedgley & Samaranayake, 1994), kan det inte uteslutas att ESBL-varianter även koloniserar i munnen. Helicobacter pylori Helicobacter pylori är en gramnegativ stav som koloniserar i magsäcken hos c:a hälften av världens befolkning. Alla H. pylori infekterade individer utvecklar olika grad av magkatarr, allt från helt symtomfri till grav atrofisk inflammation. C:a 10 % av alla H. pylori infekterade utvecklar magsårssjukdom - men H. pylori anses också vara en stor riskfaktor för magcancer (Björkholm, 2001). Uppstötningar kan leda till att bakterien förekommer i munnen och H. pylori har isoleras i lågt antal i dentalt plack (Adamsson et al., 1998¸Dowsett & Kowolik 2003). H. pylori hänförs inte till den orala normalfloran men studier tyder på att munnen kan vara en reservoar för bakterien (Bürgers et al., 2008). Spridningen av bakterien sker genom nära kontakt mellan individer och den förekommer ofta samtidigt hos flera medlemmar i en familj; barns magsäck koloniseras i regel vid tidig ålder utan tecken på infektion och oftast från sin moder. En spridningsväg kan vara saliv eller kontaminerade naglar/fingrar (Adamsson, 1999; Dowsett et al., 1999)alternativt aerosoler orsakade av bl.a. sura uppstötningar och/eller t.ex vinterkräksjuka. Risken för smittspridning vid tandvård undviks genom noggranna hygienrutiner (Dowsett & Kowolik 2003). Difteribakterier Difteri orsakas av Corynebacterium diphteriae. Bakterien ger upphov till en svalginfektion ”äkta krupp”, som i inledningsskedet liknar halsfluss och kan förväxlas med virusinfektioner i svalget. Det toxin som C. diphteriae bildar kan ge allvarliga skador på hjärta och njurar men även nervförlamning (Heyman 2004; SMI, 2009a). Man kan också vara bärare av smittan utan att visa några symtom på sjukdom. För att bli smittad krävs nära kontakt med en smittsam person. C. diphteriae sprids genom droppar eller direkt kontakt t.ex. via saliv. Symtomfria smittbärare är mindre smittsamma än de som har halssymtom. Difteri förekommer främst i utvecklingsländer. Allmän difterivaccination infördes för c:a 50 år sedan, vilket innebär att difteri är mycket sällsynt i Sverige. 1984-85 förekom en begränsad epidemi. De senaste difterifallen (svalginfektion) i Sverige rapporterades 1988 (Lepp 2008). Ett större utbrott inträffade i Ryssland och Baltikum under 1990-talets andra hälft och fortfarande rapporteras enstaka fall från dessa länder. Även i Danmark (1998) och Finland (2001) har enstaka fall rapporterats. Bidragande till detta är att de som insjuknat inte varit vaccinerade eller så har vaccinationsskyddet varit ofullständigt (Heyman 2004). I Sverige omfattar barnvaccinationsprogrammet difteri (Kaijser 1999) varför de flesta svenskar är vaccinerade. Skyddet avtar emellertid så småningom; en påfyllningsspruta kan därför behöva ges. Särskilt gäller det personer födda före 1955 (SMI, 2009a). 39 (93) Luftburen smitta - ett tandvårdsrelaterat problem? Preparation med snabbgående borrmaskin, ultraljudsinstrument, användning av bläster (3-vägsspruta) och puts av tänder med luftdrivna instrument sprider alltid stänk (droppar) och aerosol, som innehåller partiklar och mikroorganismer från patientens mun och unitens vattenledningssystem. Dropparna är så stora att de endast når någon meter från patientens mun innan det faller ned medan aerosol består av små finfördelade droppar/partiklar som håller sig svävande kortare eller längre tid (Miller & Micik, 1978; Hartley, 1978; Tammelin & Hambraeus, 2006). Den saliv som på det här sättet sprids som stänk och aerosol från patientens mun innehåller främst bakterier och virus från det dentala placket och tandköttsfickor men även mikroorganismer från svalg och andningsvägar (Harrel & Molinari, 2004). Blod har påträffats i stänk; däremot råder delade meningar om blod förekommer i aerosol (King et al., 1997; Bennett et al., 2000). Den mikrobiellt förorenad saliven i form av stänk och aerosol, kontaminerar behandlande personals ansikte, ögon, händer, armar och arbetskläder men sprids också till instrument och unit där både bakterier och virus kan överleva från ett par timmar till några dagar (Bruun & Solberg, 1973; Craig & Quayle 1985; Noskin et al., 1995; Neely & Maley, 2000). Mikrobiell aerosol som bildas i samband med tandbehandling har uppmärksammats i många undersökningar och man har visat att förhöjda tal av mikroorganismer i luft kan förekomma under c:a 10-30 minuter efter avslutad tandbehandling (Belting et al., 1964; Miller & Micik, 1978; Bennett et al., 2000). Halten mikroorganismer i behandlingsrummet är särskilt hög vid depuration med ultraljudscaler men även preparation med snabbgående borrmaskin och användning av 3-vägsspruta kan ge kraftig aerosolbildning (Bennett et al., 2000; Harrel & Molinari, 2004). Flera olika virus och bakterier har påvisats eller anses kunna förekomma i aerosol vid tandbehandling, bl.a. patogener som hepatit B-virus, förkylningsvirus, influensavirus, SARS-virus, stafylokocker, streptokocker och Mycobacterium tuberculosis (Belding, 1964; Hartly, 1978; Harrel & Molinari, 2004). Man har särskilt studerat och kalkylerat risken för spridning av Mycobacterium tuberculosis, hepatit B-virus (HBV) och humant immunbrist virus (HIV) via aerosol i allmäntandvård (Bennett et al., 2000; Smith, 2000). Även om HBV och HIV kan förekomma i mycket låga koncentrationer i behandlingsrummets luft betecknas risken för infektioner via aersol, som ”extremt osannolik”. Däremot utgör patienter med smittsam icke behandlad tuberkulos en riskgrupp. Personal som vistas i behandlingsrummet vid tandvård av dessa patienter kan utsättas för ”en liten risk för exposition för Mycobacterium tuberculosis”, vilken överskrider den allmänna risk som anses föreligga vid nära samvaro med tbc-infekterad patient. Risken kan emellertid reduceras om man använder särskilt andningsskydd, (klass FFP3) med uttalad förmåga att avskilja mikrobiell aerosol (Ransjö & Åneman 2006; sid. 50)Vid behandling med instrument som producerar stänk och aerosol bör även effektiv sug användas. Har sugsystemet god kapacitet att ta hand om stora mängder luft på kort tid (flödeshastighet c:a 300 liter/minut), kan det reducera mer än 90 % av de luftföroreningar som bildas (Miller & Micik, 1978; Bentley et al., 1994). Förhöjd mikrobiell aerosol som uppmäts i samband med tandbehandling, anses återgå till bakgrundsnivån inom 10-30 minuter och någon spridning av förhöjd mikrobiell aerosol till väntrummet har inte kunnat visas, varför risken att efterföljande patient skall drabbas av luftburen smitta betecknas som mycket liten (Bennett et al., 2000). Emellertid efterlyses ytterligare studier av luftburen smitta, då vi bl.a. saknar förklaring till de förhöjda antikroppstitrar mot Legionella, som kan påträffas hos tandvårdspersonal (Smith, 2000). 40 (93) Risker och riskbedömning Vid tandbehandling finns risk att patient och personal drabbas av infektion eller infektionsrelaterad sjukdom. Även om tandvårdsrelaterade infektioner är mindre vanliga, visar erfarenheten att drabbade patienter kan råka ut för allvarliga problem som är svåra att behandla, leda till långa invalidiserande perioder och kräva omfattande medicinsk behandling. Vissa grupper riskerar mer än andra att drabbas. Det gäller äldre och gamla, personer vars immunsystem är försvagat på grund av sjukdom (cancer, diabetes, reumatiska åkommor, hjärt- och kärlsjukdomar) eller behandling (kortikosteroider, cytostatika, antibiotika). Andra riskgrupper är missbrukare av alkohol och droger men det finns också rapporter som visar att tillsynes friska personer kan drabbas. För att minimera riskerna för smittspridning vid tandbehandling är det viktigt att i varje behandlingssituation känna till patientens allmänna hälsotillstånd. Aktuell anamnes, status och hälsodeklaration är en förutsättning och journalen ska innehålla de bedömningar som görs, bl.a. av infektionsrisker, komplikationer som uppstår under behandlingen och prognos för utförd behandling. För att kunna bedöma eventuella risker vid behandling av en patient måste man kunna göra en snabb och säker riskbedömning. Den riskklassificering, som utarbetats av American Society of Anaesthesiologists (ASA) och modifierats för tandvården (Tabell 4), underlättar både bedömningen av patientens hälsotillstånd och om behov föreligger kommunikation med ansvarig läkare (Bäckman et al., 1998; Larsson et al., 2000). Tabell 4. Riskklassificering enligt ASA, modifierad för tandvård. ASA- Hälsotillstånd Betydelse för tandvård 1. Frisk patient Ingen 2. Patient med mindre allvarlig sjukdom som väl reglerad hypertoni, diabetes mellitus eller astma. Normalt liten betydelse vid tandvård men ökad vaksamhet krävs. 3. Patient med mera allvarlig sjukdom som medför inskränkningar i livsföring men inte i arbetsförmåga som hjärtinsufficiens, under senaste året genomgången hjärtinfarkt, hypertoni med klart förhöjt diastoliskt blodtryck, dåligt reglerad diabetes mellitus, svår astma och pågående allvarlig infektion. Konsultera behandlande läkare vid omfattande behandling. Stress bör så långt som möjligt undvikas. 4. Patient med en allvarlig sjukdom som innebär ständigt livshot som aktuell hjärtinfarkt, gravt hjärtfel, avancerad hypertoni, diabetes mellitus och njursjukdom. Konsultera behandlande läkare; endast akutvård polikliniskt. Omfattande ingrepp bör utföras på sjukhus. riskklass Endogena infektioner Rapporterade fall och översikter talar för att endogena infektioner är vanligare än exogena infektioner. För att förebygga eller minska riskerna för problem efter utförd behandling är det väsentligt att: • alltid uppmana patienten att återkomma eller uppsöka sjukvården vid symtom och tecken på allmänpåverkan, t.ex. feber, frossa, onormal trötthet, känselbortfall, ledbesvär, illamående. 41 (93) Behandlande tandläkare eller tandhygienist har att ta ställning till: • tidsmässigt samband – när debuterade symtomen efter utförd tandbehandling? I regel uppträder de efter några timmar till dagar men kan också komma senare. • kliniska tecken av mera allmän karaktär, som smärta, svullnad sväljningsbesvär, andnöd, bröstsmärtor, känselstörningar, huvudvärk, ledbesvär, vilka kan tyda på ett orsaksmässigt samband med utförd behandling. • om patienten omedelbart ska remitteras för vård, och till vilken remissinstans. Det måste således finnas tydliga rutiner för hur man skall agera när risk föreligger för akuta komplikationer i samband med tandvård. Tidig behandling är avgörande; erfarenheterna visar att sent insatta åtgärder inte sällan leder till svårbehandlade tillstånd. Tandläkaren och tandhygienisten har ett eget ansvar för hur han eller hon fullgör sina arbetsuppgifter, vilket framgår av Patientsäkerhetslagen (2010:659). I samband med behandling av patient med hjärt-kärlsjukdom är det alltid motiverat att överväga antibiotikaprofylax. Särskilt gäller det vid depuration eller annat blodigt ingrepp. Gällande rekommendationer bygger på epidemiologiska undersökningar, som visar begränsad nytta av antibiotikaprofylax (van der Meer et al., 1992a, b; Strom et al., 1998). Bakteriers resistens mot antibiotika ökar i allt snabbare takt; att undvika onödig antibiotikaanvändning är därför nödvändigt (SMI 2009b). Det finns också risker för biverkningar av antibiotika, t.ex. allergier. Rekommendationerna om antibiotikaprofylax för att förebygga infektiös endokardit vid ingrepp i munnen har därför setts över (SOS 2004-102-1). De nya rekommendationerna presenteras nedan (tabell 5). Nyttan med antibiotikaprofylax i samband med tandbehandling har diskuterats (Blomgren & Hogevik, 2004). Inom Smittskyddsinstitutet (SMI) verkar gruppen ”Samverkan mot antibiotikaresistens” (Strama), som idag också omfattar ”Strama Tandvård”; ett diskussionsforum för antibiotikafrågor inom tandvården. Kontaktpersoner är övertandläkare Johan Blomgren ([email protected]) och apotekare Ulrica Dohnhammar ([email protected]). Tabell 5. Endokarditprofylax med engångsdos antibiotika Engångsdos antibiotika ges till: • patienter med hjärtklaffsprotes (mekanisk eller biologisk) • patienter med kirurgiskt åtgärdade hjärtklaffar • patienter med tidigare genomgången endokardit • patienter med komplicerade cyanotiska medfödda hjärtklaffsfel Lämpligt antibiotikaval för: • patienter som tål penicillin: Amoxicillin max 2 g (50 mg/kg) i engångsdos en timme före behandling • patienter som är överkänsliga för penicillin: Klindamycin max 600 mg (15 mg/kg) i engångsdos en timme före behandling Rekommendationerna innebär begränsningar jämfört med tidigare riktlinjer. Generellt sett ska antibiotikaprofylax inte ges patienter som tidigare drabbats av hjärtinfarkt; något som också gäller kranskärlsopererade patienter och patienter med ledprotes eller när titanfixturer sätts in. Individuell prövning bör emellertid alltid göras. De rekommendationer med praktiska råd som landstingen publicerar, torde ge värdefull vägledning (Blomgren 42 (93) & Norén, 2008; Götrick et al., 2009). Vid omfattande behandling av patienter med nedsatt immunförsvar eller som är infektionskänslig av annan anledning, bör samråd alltid ske med behandlande läkare. Exogena infektioner I samband med tandbehandling kan exogena tandvårdsrelaterade infektioner spridas från patient till patient eller mellan patient och personal. Förutsättningarna beror på ett samspel mellan smittämne och individ, där många faktorer kan inverka och utgången är långt ifrån given. Smittkällan kan vara en person med pågående infektion, som befinner sig i inkubationsstadiet av en sjukdom eller som är symtomfri smittbärare. Smittvägarna kan variera. Infektionsmotståndet hos en individ som eventuellt drabbas (mottaglig person) varierar under personens levnadstid och variationen mellan olika individer är stor, därtill påverkas mottagligheten bl.a. av andra pågående sjukdomar. Smittämnet (bakterier eller virus) kan ha olika förmåga att orsaka sjukdom, dels beroende på dess virulens och på infektionsdosens storlek (antal mikroorganismer). Dessutom går det inte alltid att klargöra om en patient bär på smitta med hjälp av undersökning, anamnes eller laboratorietester. I samband med tandbehandling är det – med andra ord - svårt att bedöma smittrisken hos varje enskild patient. Smittförebyggande principer skall därför tillämpas för alla patienter. Senare års erfarenheter visar att de rutiner som rekommenderas i dag och som redogörs för nedan, minimerar riskerna för tandvårdsrelaterade exogena infektioner. Särskilt gäller det basala hygienrutiner. Men en kedja är inte starkare än sin svagaste länk. Inkonsekvent tillämpning av rekommenderade åtgärder, t.ex. av ekonomiska skäl, kan således innebära att hygienrutinerna förlorar sin effektivitet och säkerhet. Vid tandbehandling finns det alltid risk för stick- och skärskador. All personal kan drabbas men särskilt utsatta är tandsköterskor (Cleveland et al., 1997; Ericson, 2009), som i stor utsträckning hanterar alla använda vassa instrument. Även om frekvensen skador successivt minskat (Cleveland et al., 1997), existerar problemet. Stick- och skärskador ska inte nonchaleras; något som tyvärr förekommer både inom sjukvård och tandvård. Blodburen spridning av HIV, HBV och HCV är den vanligaste smittvägen för dessa virussjukdomar. Grovt sett och något förenklat anses att i de fall då tre personer exponeras för HBV-smittat blod, t.ex. via stickskador, drabbas en person av hepatit B (1/3). Vid motsvarande exponering för HCV-smittat blod räknar man med att en person av 30 exponerade (1/30) insjuknar i virussjukdomen medan endast en person av 300 exponerade för HIV-smittat blod (1/300) drabbas av HIV/AIDS (Struwe 2003a). Risken att drabbas av hepatit B är således särskilt påtaglig vid stickskador orsakade av blodkontaminerade vassa instrument; något som också rapporterats för tandvårdens del (Gonzalez & Nalewy, 1988; Gerberding, 1994). Bland annat har Arbetsmiljöverket nyligen rekommenderat särskilda rutiner vid hantering av använda kanyler; dessa ska inte sättas tillbaka i skyddshylsan utan läggas direkt i avfallsbehållare (AFS 2005:1). Alla stick- och skärskador orsakade av orena instrument ska omedelbart tas om hand och de åtgärder som vidtas följa ett fastställt schema för att minimera riskerna för infektion, t.ex. på sätt som finns beskrivna (Struwe & Zimmerman, 2003; Marsh & Martin, 2009). För att förebygga infektioner är vaccination ett viktigt komplement till barriärskydd och åtgärder mot stickskador. Det gäller all tandvårdpersonal, således tandläkare, tandhygienister, tandsköterskor och tandtekniker. Delar av det allmänna vaccinationsprogrammet som ges under förskole- och skolåldern, det s.k. grundskyddet mot t.ex. difteri, stelkramp, kikhosta, polio, mässling, påssjuka och röda hund (Kaijser, 1999; SOSFS 2006:22; SBU 2009) kan behöva kompletteras. Vidare bör alla vara vaccinerade mot hepatit B och vaccination mot tu- 43 (93) berkulos (BCG) övervägas (SOS 2012). Personal som i sitt arbete kommer i kontakt med många äldre eller personer med nedsatt lung- och hjärtfunktion rekommenderas att vaccinera sig mot influensa (Jörbeck & Torell, 2006). Under pågående epidemi kan det bidra till att minska både sjukfrånvaro och smittspridning. En av Smittskyddsinstitutets viktigaste uppgifter är att bevaka det epidemiologiska läget avseende smittsamma sjukdomar i befolkningen. Man följer utvecklingen av s.k. anmälningspliktiga sjukdomar som hepatit B och stafylokockinfektioner orsakade av MRSA men man arbetar också med frivillig smittövervakning, som exempelvis den nya influensan ”svininfluensan” (SMI 2009a). Verifiera ett misstänkt samband Både vid endogena och exogena tandvårdsrelaterade infektioner diskuteras i första hand ett tidsmässigt samband. Sjukdomens debut i förhållande till utförd behandling anses vara ett kriterium för misstänkt tandvårdsrelaterad infektion. För att med någorlunda säkerhet kunna bedöma om en tandvårdsrelaterad infektion föreligger, är det emellertid önskvärt att dessutom kunna visa att de mikroorganismer, som förekommer i en infektion och/eller i ett blodprov, är desamma som de som påträffas i prov från munnen (Corson et al., 2001; Marques da Silva et al., 2004; Thomás Carmona et al. 2007). Med konventionella mikrobiella metoder kan det vara svårt att fastställa primärfokus för en misstänkt tandvårdsrelaterad infektion. Moderna molekylära tekniker börjar emellertid tillämpas vid identifiering av mikroorganismer, t.ex. polymeraskedjereaktion (PCR) kombinerat med dagens snabba och effektiva DNA-sekvensering, pulsfältsgelelektrofores (PFGE, metod för att separera DNA-fragment) och ”fingerprint”-teknik (Rudney et al., 1992; Fiehn et al., 1995; Rudney & Larsson 1999; Alam et al., 1999; Henriques Normark & Magnius 2003; Jonsson 2009). Dessa tekniker kompletterar de konventionella metoderna och leder till större tillförlitlighet vid mikrobiologiska analyser av misstänkta samband. Det torde således vara väsentligt att särskild vikt läggs vid mikrobiologiska och biokemiska analyser när tandvårdsrelaterade infektioner utreds. Vid utredningar av den här arten kan behandlande tandläkare svara för provtagning i munnen medan sjukvård eller specialisttandvård och mikrobiologiskt laboratorium alltid tar hand om övrig provtagning och analys. Basala hygienrutiner Föreskrifter om basala hygienrutiner inom hälso- sjuk- och tandvård har utfärdats av Socialstyrelsen (SOSFS 2007:19). Föreskrifterna, som i likhet med andra myndighetsföreskrifter är bindande, omfattar handhygien, bruk av skyddshandskar och arbets-/skyddskläder. Dessa rutiner är mycket väsentliga åtgärder för att förebygga smittspridning och ska tillämpas vid all sjuk- och tandvård. Det finns anledning att understryka att man vid all tandbehandling men särskilt i samband med depuration med ultraljudsscaler och preparation med snabbgående borrmaskin rutinmässigt bör använda munskydd, skyddsglasögon eller visir. Dessa skyddsåtgärder utgör en viktig del av de basala hygienrutinerna inom tandvården. Handen - hygienens svaga länk Huden är uppbyggd av tre lager, överhud (epidermidis), läderhud (dermis) och underhud (subcutis) som skyddar kroppen på olika sätt, mot bl.a. kyla, värme, mikroorganismer och fungerar som en termostat vid reglering av 44 (93) kroppens temperatur. De vanligaste cellerna i överhuden är keratinocyterna (producerar hornämne, keratin), vilka bildas i basalmembranet vid övergången mot läderhuden. Cellerna förskjuts från basalmembranet mot hudytan samtidigt som de blir allt mera platta och dör för att till sist bilda hornlagret, som är ett viktigt barriärskydd (Figur 5). Figur 5. Tvärsnitt av överhuden. Nya celler bildas hela tiden i basalcellslagret. Cellerna skjuts sedan uppåt och blir allt plattare, förlorar sin viabilitet och förhornas (keratinisering). Mellan de keratiniserade cellerna i hornlagret finns mikroorganismer [1]. Så gott som hela kroppsytan, undantaget handflator och fotsulor, är beklädda av hår. Hårstråna passerar genom överhuden i en rörformad ficka, som i hornlagrets övre del är vidgad [2]. Även svettkörtlarnas utförsgångar mynnar på hudytan (ej avbildade). De mikroorganismer som alltid finns vid hårstrånas och svettkörtlarnas mynningar utgör tillsammans med mikroorganismerna på och i hornlagret hudens normalflora, som hindrar eller hämmar kolonisationen av bl.a. patogena bakterier. Handtvätt eller handdesinfektion reducerar men eliminerar inte helt normalflora. Teckning: Mikael Rehn Vattenhalten i hornlagret får inte bli för lågt (<10 %). Inträffar det, så börjar huden ”strama”; den blir sedan fnasig och narig och i svårare fall uppstår sprickor. Läderhuden utgörs av bindväv och kollagena trådar; här finns också blodkärl, nervändar, svettkörtlar och hårsäckar i vars rörformade fickor talgkörlarnas sekret utsöndras. Fettväv är huvudparten av underhuden (Henriksson & Rasmusson, 2007; Dale, 2003). Naglarna växer ut från en veckbildning i överhuden och består främst av hårt keratin. På nagelns yta finns nagelbandet, en överhudsförhorning som följer med någon millimeter när nageln växer ut. Bandet brukar vid manikyr skjutas tillbaka. Vid nagelns rot och på dess sidor förekommer fasta hudveck, s.k. nagelvallar (Figur 6). Vävnaden vid fingrets spets (fingerblomman) består av fettväv och bindvävsstråk som går från huden in till benet. 45 (93) Figur 6. Transversell genomskärning av fingrets yttre del (fingerblomman). 1. nagel, 2. nagelbädd, 3 nagelvall (Paronychium), 4. benfalang, 5. bindvävssepta, 6. fettväv. Bindvävssepta löper från huden in till benet. Infektion orsakad t.ex. av stickskada i fingerblomman, kan därför spridas i den luckra fettväven in till benfalangen. (Omteckning efter Mann 1988) Teckning Mikael Rehn Mikroorganismer som förekommer på och i huden kan delas in i en permanent (residient) och i en tillfällig (transient) mikroflora (Hedin 2006). Den permanenta floran består främst av stafylokocker; vanlig är Staphylococcus epidermidis och grampositiva stavar som coryne- och propionibakterier men också gramnegativa stavar som Klebsiella, och Enterobacter. Här kanockså kolonisera jästsvampar som Candida. Den permanenta floran koloniserar inte enbart på hudytan utan förekommer också mellan cellerna i yttre delarna av hornlagret (Figur 5). Den permanenta floran är i regel apatogen och försvårar för andra mikroorganismer att kolonisera medan den tillfälliga floran omfattar olika slags mikroorganismer, beroende på vad händerna kommer i kontakt med. Sjukvårdspersonal kan ofta vara bärare av olika patogen mikroorganismer på händerna, bl.a. Staphylococcus aureus i större omfattning än andra jämförbara personalgrupper (Solberg, 2000; Hedin, 2006). Om tandbehandling sker utan handskar är det, på motsvarande sätt, oundvikligt att hud och naglar kontamineras med saliv eller blodblandad saliv och därmed också med mikroorganismer som förekommer i patientens mun, t.ex. de som redovisas i tabellerna 2 och 3. Särskilt naglarna är en svag länk, då mikroorganismer och blod som ansamlas under naglarna är inte bara svåra att avlägsna utan de kan också överleva flera dagar trots normal handhygien (Gross et al., 1979; Taylor, 1978a,b; Allen & Organ, 1982; Noskin et al., 1995). Antalet mikroorganismer som ansamlas under naglarna är mellan 100-1 000 gånger flera än de som förekommer på handhudens övriga delar, t.ex. handryggen (Gross et al., 1979; McGinley et al., 1988). Infektion i nagelbanden, s.k. paronyki (para=nära, onyx=nagel) är en vanlig handinfektion (Figur 7). 46 (93) Figur 7. Tumme med inflammation och svullnad i nagelvallen orsakad av mikroorganismer, ofta stafylokocker eller jästsvampar men även virus, som trängt in i vävnaden (paronyki). Foto: Handkirurgiska kliniken, Universitetssjukhuset SUS, Malmö Paronykier kan uppträda i akut eller kronisk form (Cooper, 2007). Vid akut paronyki inflammeras huden ovanför nagelbasen/roten och nagelvallarna på kort tid samtidigt som fingret smärtar. Den vanligare kroniska formen av paronyki börjar i regel som en mera begränsad svullnad och rodnad med obetydlig smärta. En till synes obetydlig infektion kan, om den inte behandlas ge upphov till en inflammation, som sprider sig runt hela nageln (Mann, 1988). Små sår vid nagelbandets bas, t.ex. orsakade av vassa instrument, manikyr och trasiga naglar skapar förutsättningar för mikrobiell invasion. Främst är det Staphylococcus aureus, ibland i kombination med betahämolytiska streptokocker, som orsakar infektionen. Vid kroniska former, som särskilt ses när händerna utsätts för långvarig fukt, kan jästsvampar framför allt Candida albicans påträffas i såret (Mann, 1988). Eftersom vävnaden i fingerspetsen (fingerblomman) är avgränsad av bindvävsstråk, som går från huden in till benet (Figur 6), kan skador - även små sticksår - orsakade av förorenade instrument, leda till infektion i det mer eller mindre stängda utrymmet, s.k. felon. Nonchaleras skadan, kan infektionen på grund av det begränsade utrymmet tränga ner mot benet och orsaka osteit eller osteomyelit (Mann, 1988; Cooper, 2007). Vi har begränsad kunskap om hur vanlig finger- och handinfektioner är inom tandvården. En enkätstudie från 1989 visar att c:a 60 % av tillfrågade tandläkare under senaste året stuckit sig på osterila instrument (Axell et al., 1989). Av tillgänglig avvikelserapportering framgår att stick- och skärskador fortfarande är ett problem inom tandvården; i rapporter från perioden 2005-2009 (november) har det emellertid inte framkommit något som tyder att dessa skador lett till blodsmitta eller hand-/fingerinfektioner även om det förekommit att man stuckit sig på kanyl, som använts på patient med såväl HIV som hepatit (Ericson 2009). Under perioden 1985-1989 anmäldes till dåvarande Arbetarskyddsstyrelsen 54 fall av smittsamma sjukdomar som arbetsskada, varav hälften av fallen var infektionen lokaliserad till fingrar och händer (Malmros, 1990). Endast nio fall av misstänkta arbetsrelaterade infektioner inom tandvården har anmälts till Arbetsmiljöverket under åren 1998 – 2007; i ett av dessa fall var infektionen lokaliserad till handen (Malmros 2008). Det torde tyda på underrapportering till Arbetsmiljöverket. För att få större klarhet är ytterligare studier av stort värde, bl.a. beträffande frekvensen av både stick- och skärskador samt omfattningen av skador som orsakat allmäninfektioner eller lokala handinfektioner. Rena händer en förutsättning Målet med handhygien (handtvätt och desinfektion) är att avlägsna smuts och minska den tillfälliga (transienta) hudfloran. Däremot kan varken handtvätt eller desinfektion nämnvärt påverka och avdöda den permanenta mikroflora som finns inne i huden (Figur 5; Hedin, 2006). 47 (93) Det finns rikligt med mikroorganismer under naglarna. Dessa måste därför vara kortklippta för att underlätta rengöring och desinfektion. Ringar ökar totalantalet mikroorganismer på och i huden. Hos vårdpersonal påträffas inte sällan opportunistiskt gramnegativa patogener som Klebsiella pneumonae under ringar (Hoffman et al., 1985; Trick et al., 2003). Av lättförståeliga skäl är också konstgjorda naglar, klockor och armband olämpliga. Synlig smuts på händerna avlägsnas med flytande tvål som alltid bör användas eftersom vanlig ”fast” tvål kan vara starkt kontaminerad av både bakterier och svamp (Kjellander & Nygren, 1958). I dag finns hygieniskt framställd flytande tvål utan tillsats av antimikrobiella medel i slutna bruksförpackningar. Det kan synas självklart men bör påpekas att en korrekt teknik krävs för tillfredsställande handtvätt (Wood, 1992; Zimmerman, 2003). Händerna ska alltid torkas med engångshanddukar av papper och inte med textilhanddukar som används flera gånger eftersom mikroorganismer lätt överlever i handduksväven (Henriksson & Kjellander, 1961). Pappershanddukar bör förvaras i behållare med lock för att undvika mikrobiell aerosol och stänk. Handdesinfektion Mikroorganismer som kontaminerar händerna vid tandbehandling minskas effektivast med handdesinfektionsmedel. Handdesinfektion ska alltid ske före och efter kliniskt arbete samt vid hantering av instrument och tandtekniska arbetsmoment oavsett om man använder handskar eller inte. Det finns olika preparat (Hedin, 2006; McDonnell, 2007); i Sverige rekommenderas alkoholbaserade handdesinfektionsmedel av flera skäl, bl.a. beroende på deras breda snabbverkande antimikrobiella effekt (Hedin, 2006; Ransjö & Åneman, 2006). En tvåltvätt kan minska mikrofloran på handen c:a tusen gånger (103) medan minskningen är mer än tiotusen gånger (104) vid alkoholdesinfektion (Rotter, 1984). En nyligen publicerad översikt beskriver alkoholernas positiva värde som handsprit men även förekommande problem (Brolin et al. 2011). Även vid desinfektion av händerna krävs korrekt teknik; så t.ex. tillhör fingertoppen de delar av handel som ofta förbises. Händerna bör gnidas mot varandra tills alkoholen avdunstats för att uppnå effektiv desinfektion samtidigt som återfettningsmedlet får verka. Händerna ska alltid vara torra när desinfektionsmedlet appliceras för att undvika utspädning av alkoholen. Skyddshandskar Inom sjukvården finns sedan många år tillbaka väl dokumenterade studier som visar att skyddshandskar minskar risken för bl.a. spridning av hepatit B-virus (Ransjö & Åneman, 2006). Arbetsmiljöverket rekommenderade på 1980-talet att handskar bör användas som skydd vid allt arbete med risk för blodkontakt. Flera studier visar att handskar i dag används av 60-80 % av tandvårdspersonalen (Wrangsjö & Boman, 2007). Skyddshandskar tillverkas av naturgummilatex, syntetgummi och plastmaterial. Det finns därför problem som eksem och allergi som måste beaktas vid valet av skyddshandskar. En genomgång av handskarnas egenskaper med avseende på smittskydd och intoleransreaktioner har presenterats (Wrangsjö & Boman, 2007). Handskar går lätt sönder när de används vid tandbehandling. Vanligast är små punktformade hål, som är svåra att observera men även större synliga brister förekommer; skador som oftast uppträder på handskens tumme och pekfinger (Otis & Cottone, 1989; Burke & Wilson, 1990; Miller, 1996). Frekvensen defekta handskar varierar från enstaka procent till 20-30 % av använda handskar och är bl.a. beroende på materialet i handskarna; naturgummi är mera hållbart än handskar av plastmaterial. Moderna syntetgummimaterial används i tandvården då de är fria från naturgummi och relativt god elasticitet, draghållfasthet och kemikalieskyddande 48 (93) egenskaper (Wrangsjö & Boman, 2007). Upptäcker man defekter, ska handskarna omedelbart bytas och händerna desinfekteras. Huden under handskar blir fuktig och vätskan (s.k. handsksaft) innehåller stora mängder hudmikroorganismer, varför händerna måste desinfekteras innan man vidrör något (Thomas et al., 2008). Handskar av både naturgummi och plastmaterial minskar smittrisken om man t.ex. sticker sig på en använd kanyl, då blod eller saliv som förekommer på kanylens utsida stryks av när kanylen passerar genom handsken innan den kommer i kontakt med huden. Däremot påverkas inte infekterat material som kan finnas i kanylens lumen (Mast et al., 1993). Eftersom handskar ofta blir defekta under användning, förhindrar de inte smittspridning av mikroorganismer från t.ex. en hudinfektion, exempelvis nagelbandsinfektion. Vid pågående handinfektion bör man därför vara speciellt noggrann vid kontrollen av skyddshandskarna och eventuellt också använda dubbla handskar. Munskydd Munskydd minskar risken för stänk att nå munnens och andningsvägarnas slemhinnor. Materialet i munskydd som brukar användas inom tandvården varierar. Enkla pappersmunskydd ger betydligt sämre skydd än de som är tillverkade av olika plastfibermaterial (Ford & Peterson, 1963; Madsen & Madsen, 1967). Vid användning av munskydd blir både ut- och insida successivt fuktigare och bemängd med mikroorganismer något som försämrar den skyddande kapaciteten. Vid tandbehandling, särskilt när det föreligger risk för stänk och aerosol, bör därför munskydd inte bäras längre än 30 minuter (Craig & Quayle, 1985; Wood 1992) och alltid bytas mellan varje patient. Clinical Research Associates har testat olika fabrikat och fann att endast en del av dessa kunde förhindra penetration av små partiklar av storleksordningen 3,0-3,5 µm (CRA, 1989). Inom vården rekommenderas munskydd som avskiljer >95 % eller >98 % av partiklar som är ≥3 µm (Ransjö & Åneman, 2006). Andningsskydd Man kan också använda andningsskydd särskilt avsedda att hindra små luftburna partiklar att dras ned i de djupare luftvägarna. Skydd med sådan kapacitet ska vara CE-märkt och godkänt enligt svensk standard (SS-EN 149:2001). Dessa skydd är indelade i tre klasser (FFP1, FFP2, FFP3). Avskiljningen av den aerosol som testats (partiklarnas diameter i median 0,6 µm) är för FFP1 80 %, FFP2 94 % och FFP3 99,95 %. Ansiktsskydden med hög avskiljningsgrad (klass FFP3) rekommenderas inom sjukvården då särskilda smittrisker föreligger, t.ex. vid behandling av patient med pågående akut lungtuberkulos eller svår respiratorisk sjukdom (SARS) (Ransjö & Åneman, 2006). Självfallet omfattas även tandvården av detta krav. Visir/skyddsglasögon Visir är ett gott skydd mot stänk och fasta partiklar. Även om det har böjda kanter, utgör visir, naturligt nog, ofullständigt skydd mot mikrobiell aerosol (Wood, 1992). Skyddsglasögon är ett alternativ till visir. Det har rapporterats att ögonskador förekommit hos både personal och patienter vid tandbehandling när man inte skyddat ögonen (Hartley, 1978; Roberts-Harry et al., 1991; Wood, 1992; Barbeau 2007). Även patienten bör därför bära skyddsglasögon. Arbetskläder/Skyddskläder Näst efter kontaktsmitta via händer, är arbetskläderna ett stort problem i sjukvården (Ransjö & Åneman, 49 (93) 2006). Arbetskläder ska skydda hud och underliggande kläder från kontamination av patogena mikroorganismer. Skyddseffekten är bl.a. beroende på hur fuktigt plagget blir och hur tät väven är (Ransjö & Hambraeus, 1979). Redan efter 6 timmar kan arbetskläderna vara kraftigt kontaminerade av mikroorganismer (Nyström, 1981). Mikroorganismer som Staphylococcus aureus kan leva i minst en vecka på kläder och man har även i enstaka fall funnit livsdugliga (viabla) MRSA efter flera veckor (Neely & Maley 2000). Mikroorganismer kan också föras genom väven när plagget kommer i rörelse mot en yta särskilt om tyget är fuktigt (Ransjö & Hambraeus 1979). I vilken omfattning som arbetskläder orsakat smittspridning inom tandvården är inte dokumenterat. Många moment vid tandbehandling medför emellertid stänk och aerosol, som leder till att arbetskläderna på kort tid blir fuktiga och kontaminerade av mikroorganismer; något som förvånansvärt nog endast rapporterats i enstaka studier (Bentley et al., 1994). De rekommendationer och föreskrifter som gäller inom sjukvården är givitvis tillämpliga även inom tandvården. Föreskrifterna om basal hygien (SOSFS 2007:19) anger bl.a. att engångsförkläde eller skyddsrock ska användas vid risk för kontakt med kroppsvätskor eller annat biologiskt material. Inom flera landsting har man tagit fram anvisningar när särskilda, för tandvården lämpade skyddsförkläden/plastförkläden ska användas (Spencer, 2009; Lundholm, 2012). När särskild smittrisk misstänks eller konstaterats, t.ex. vid lungtuberkulos eller bärarskap av MRSA, skall de arbetskläder som använts (tillsammans med vattenavstötande skyddsförklädet) bytas omedelbart efter avslutad behandling. Rekommendationer om särskilda skyddskläder se Ransjö & Åneman (2006). Arbetskläderna ska fylla bestämda funktioner, bl.a. skydda och vara tvättbara vid högre temperatur. För att uppnå detta används blandmaterial som bomull och polyester (SIS-TR 2005). Arbetskläderna ska bytas så snart de är fuktiga, annars minst varje dag. Tvätt som sker vid minst 70 °C med tillsats av vanliga tvättmedel ger tillfredsställande mikrobiologisk renhet och har god rengöringseffekt på blandmaterial medan tvätt som sker vid lägre temperatur än 70 °C har begränsad rengöringseffekt (SIS-TR 2005). Tvätt vid 30-50 °C (s.k. fintvätt) är därför olämpligt eftersom inaktivering av bl.a. stafylokocker kräver högre temperatur. Om man väljer att o tvätta vid lägre temperatur än +70 C, bör detta framgå av och motiveras i hygienplanen. Det pågår ett arbete inom EU i vilket man avser att ta fram standarder för kläder som skyddar bäraren från smittrisker (Ransjö & Åneman, 2006). Mikrobiell renhet För att hindra smittspridning och skapa rationella arbetsmetoder, använts i dag tre olika nivåer av s.k. mikrobiell renhet, som definieras på följande sätt (Sjöberg, 2006a; Edwardsson, 2003b): • Instrument etc. som – vid normal användning – penetrerar hud, slemhinna och vid tandbehandling dentin, skall vara helt fria från levande mikroorganismer s.k. sterila produkter t.ex skalpeller och rotkanalsfilar. • Instrument etc. som – vid normal användning – endast kommer i beröring med intakt hud, slemhinna eller som vid tandbehandling är avsedda för bearbetning av emalj och dentin kan ha en mikrobiell renhet, som kan variera för olika användningsområden från att en mikroorganism finns på en av tusen artiklar till att det finns enstaka mikroorganismer på varje produkt. Godset ska också vara fritt från sjukdomsframkallande 50 (93) mikroorganismer - höggradigt rena produkter, t.ex. instrument för inserering av fyllningsmaterial. • Instrument och annat gods som - vid normal användning - bara kommer i kontakt med intakt hud och inte berör slemhinna eller skadad hud, behöver i regel endast göras rena före återanvändning - rena produkter, t.ex. gummikoppar och spatlar för tillröring av avtrycksmaterial. Rengöring en viktig förutsättning Instrument som används vid tandbehandling blir alltid kontaminerade av varierande mängd saliv, blod, vävnadsrester och fasta partiklar. Rengöring ska ske så snart som möjligt efter användning. Intorkat biologiskt material är svårt att avlägsna och blod kan vara korrosivt på grund av sitt innehåll av järn, syre och natriumklorid. Dessutom dämpar saliv och blod effekten av ånga och desinfektionsmedel. Stora mängder mikroorganismer kan också förekomma (s.k. bioburden: antalet livsdugliga mikroorganismer på/i en produkt). Rengöringen kan ske manuellt, med ultraljudsbehandling eller med diskdesinfektor. Manuell rengöring kan sägas vara ”subjektiv”, bl.a. beroende på tid och teknik som ägnas varje enskilt instrument men påverkas också av rengöringsmedlets egenskaper, vattentemperatur och hjälpmedel som borstar. Dessutom är vinkelstycken och annat håligt gods tidskrävande att hantera manuellt. Den råa ytstrukturen med skarpa vinklar och spalter gör många dentala instrument besvärliga att rengöra manuellt, bl.a. har man funnit att tre fjärdedelar av de rotkanalsfilar som behandlades manuellt fortfarande var kontaminerade efter avslutad rengöring (Smith et al., 2002). I en likartad studie av matrisband och matrisbandshållare var c:a en tredjedel av banden och hållarna fortfarande bemängda med blod efter manuell rengöring (Lowe et al., 2002). Dessutom innebär manuell rengöring av dentala instrument påtaglig risk för handskador; vilket bl.a. kan förklara varför stick och skärsår är mera frekvent bland tandsköterskor än övrig tandvårdspersonal i de avvikelserapporteringar vi haft tillgång till. Den manuella rengöringen bör således undvikas så långt som möjligt. Ultraljudsbehandling innebär att godset placeras i en rengörande vätska som minskar ytspänningen på godsets yta så att kontamination som fett och äggviteämnen lossnar lättare. Desinfektionsmedel saknar denna förmåga och ska inte användas i ultraljudsbad. Ultraljud alstrar högfrekventa ljudvågor, som skapar mikroskopiska bubblor vilka skakar loss förorenande partiklar; en process som underlättas av att vätskan är ytspänningsnedsättande. Svåråtkomliga skrymslen i godset och lumen i håliga instrument kan på det här sättet lättare göras rena. Korrekt ultraljudsrengöring avlägsnar intorkat blod, plack, och cement från metallytor och proteser. När rengöringsvätskan använts flera gånger blir den förorenad av mikroorganismer och organiskt material varför instrumenten ska sköljas noggrant efter behandling (Burkhart & Crawford, 1997). Därför bör vätskan inte användas mer än fyra gånger och kärlet tömmas vid arbetsdagens slut (Walker et al., 2007). I samband med att instrumenten sköljs efter behandling i badet, ska de därför kontrolleras så att det är synbart rena. Efter ultraljudsrengöring desinfekteras eller steriliseras instrumenten. Tillverkare eller leverantör av ultraljudsbad ska anvisa lämpliga processtider, rengöringsvätskor och metoder för att regelbundet testa apparatens rengörande kapacitet exempelvis genom erosionstest med aluminiumfolie (Bagg et al., 2007). Aluminiumfoliet hålls ner i badet under 45-60 sek med apparaten påslagen. I folien uppstår då hål; desto flera hål dess bättre är ultraljudets effekt. Användning av ultraljudsbad underlättar hanteringen och minskar risken för arbetsskador och infektioner. Metoden är effektivare än manuell rengöring (Lowe et al., 2001). 51 (93) Instrument kan också placeras i diskdesinfektor där både rengöring och desinfektion sker med automatiskt program. Användning av diskdesinfektor anses vara en säker metod som avsevärt underlättar arbetet med cirkulationsgods under förutsättning att den uppfyller de krav som ställs på en diskdesinfektor enligt standard SSEN 15883 (Sjöberg, 2006a; Walker et al., 2007). Diskdesinfektorn arbetar med en eller flera rengöringsfaser, en desinfektionsfas, en eller flera sköljfaser och en torkfas. Under den inledande rengöringsfasen ska vattentemperaturen vara låg (<45°C), bl.a. för att hindra äggviteämnen på godset att koagulera (SIS HB, 2007). Erfarenheten visar att man bör kontrollera att rengöringsmedlet som används, kan avlägsna de föroreningar som förekommer på aktuellt gods (Martiny et al., 2004). Jämförande undersökningar har visat att diskdesinfektorer ger renare instrument än manuell rengöring både beträffande håligt gods och vanliga dentala instrument (Miller et al., 2000; Ransjö et al., 2001; Whitworth et al., 2004). Rörformade instrument bör alltid placeras så att vattnet lätt spolar genom lumen; bäst resultat nås med särskild adapter som medger att vattnet pressas genom kanalen (Ransjö et al., 2001). Tillverkare av adapter bör kunna dokumentera dess rengörande kapacitet av de inre ytorna. Godset måste alltid inspekteras efter varje process (rutinkontroll), då det visat sig att instrument med komplex ytstruktur, t.ex. rotkanalsfilar, är svåra att göra rena i diskdesinfektor (Smith et al., 2005; Whitworth et al., 2007; Assaf et al., 2008). På grund av problemen med rengöring av rotkanalsfilarna bör dessa endast användas en gång (Walker et al., 2007; Kahan, 2008). Desinfektion har ett brett användningsområde Desinfektion/höggradigt rent innebär att man minskar antalet kontaminerande bakterier (som inte befinner sig i sporstadium; (sid. 12), mykobakterier (bl.a. tuberkelbakterier) samt virus och svamp på det kontaminerade godset. Det betyder inte att alla mikroorganismer avlägsnas eller avdödas. Däremot ska godset vara fritt från sjukdomsalstrande mikroorganismer (Sjöberg, 2006a) så att det kan användas på nytt utan risk för smittspridning (”safe for handle”). Vid vanlig tandbehandling används de flesta instrument i munnen där det redan finns mikroorganismer utan att instrumenten avsiktligt penetrerar slemhinna, hud eller in i tandens pulpa, vilket innebär att de kan desinfekteras. Desinfektion inom tandvården är aktuell inom följande områden: • • • • • • Hud (handdesinfektion) Instrumentdesinfektion Ytor Färskvattenledningar i unit Suganläggningar Tandtekniska arbeten Fuktig värme I första hand ska fuktig värme användas vid desinfektion (Walder, 2006; SIS HB 2007). Mikroorganismers känslighet för värme varierar; de flesta patogener inaktiveras vid temperaturer över 65 °C. En del kan överleva högre temperatur, exempelvis Legionella, enterokocker och hepatit B-virus. Vid temperaturer mellan 70-90 °C anses emellertid att alla mikroorganismer i s.k. vegetativ fas inaktiveras (avdödas), däremot inte endosporbildande bakterier i sporstadium (McDonnell, 2007). Det är viktigt att tänka på att överlevnaden påverkas, dels av organisk och oorganiskt material, som kan dämpa värmepåverkan och dels att olika kemiska desinfektionsmedel kan ha olika inverkningstid. 52 (93) Instrumentdesinfektion (höggradigt rent) Värmedesinfektion sker enklast i diskdesinfektor som både gör rent och desinfekterar godset. Efter rengöring följer en desinfektionsfas med hetvatten vid 85–95°C under ½ - 1½ minut. Behandlingen avslutas med sköljfas och torkfas. I moderna desinfektorer finns inbyggd kontroll av tid och temperatur för hela processen (SS-EN 15883, SIS HB 2007). När en diskdesinfektor installeras på kliniken ska den genomgå flera tester, s.k. validering (”bekräfta giltigheten av”), som omfattar installationskontroll, funktionskontroll och processkontroll (SIS HB 2007). Vid installationskontrollen görs en översyn av mekanisk funktion och tekniska data. Funktionskontrollen innebär bl.a. att rengöringskapaciteten testas med s.k.typlast. Man använder en särskild metod; koagulerat blod (SISTR3:2002) eller röda blodkroppar och bovint serum albumin, som fördelas på (kontaminerar) instrument och gods, vilka ingår i testet. Därefter utförs processkontrollen som ska visa att desinfektorn – med nämnd rengöringsmetoden - fungerar när gods som ska användas rutinmässigt testas. Resultatet kontrolleras genom att godset inspekteras noggrann. Är det för ögat rent, kompletteras provningen med någon av tre kemiska mätmetoder för kvarvarande proteinrester som anges i standarden (SS-EN ISO 15883). I valideringen ingår också temperaturmätningar på last och kammarväggar. Processkontrollen ska upprepas en gång varje år – så kallad upprepad processkontroll.. Då provas rengö- ringsförmågan med den nationella provningmetoden och med en av de kemiska mätmetoderna för kvarvarande proteinrester. Validering och upprepad processkontroll utförs av särskilt utbildad tekniker och samtliga tester och kontroller dokumenteras. Rutin-/Batchkontrollen samt övervakning omfattar följande (SIS HB 2007): • Kontrollera efter varje process att den temperatur och tid som registrerats samt tillsats av processkemikalier överensstämmer med gällande anvisningar (specifikation). • Inspektera efter varje process att godset är rent. Dessutom utförs de av leverantören/tillverkaren i brukanvisningen rekommenderade dagliga kontrollerna. Dagliga kontroller dokumenteras. Detta gäller även märkning av godset, eftersom det ska kunna härledas till den process då godset desinfekterades. Användning av loggbok underlättar en rationell dokumentation. Förvaring av höggradigt gods ska vara fritt från damm, drag och fukt. Instrument eller kassetter med instrument som inte används inom en vecka behandlas på nytt i diskdesinfektorn. För att underlätta hanteringen märks förslagsvis kasseter med sista förbrukningsdag. Gods kan uppnå höggradig renhet genom desinfektion med värme i autoklav som har ett N-program eller äldre autoklav utan vakuumprogram (Edwardsson et al., 2002). Enstaka instrument kan värmedesinfekteras i kokande vatten (c:a 100°C) under några minuter (Skadhauge, 1973; Walder, 2006). Kemisk desinfektion När fuktig värme av någon anledning uteslutits, kan kemisk desinfektion användas. Man bör emellertid först fråga sig: ” Måste dekontaminationen ske med ett kemiskt desinfektionsmedel?” Utbudet av kemiska desinfektionsmedel är stort, vilket kan försvåra valet. I tabell 6 ges en sammanställning av kemiska desinfektionsmedel 53 (93) som kan vara lämpliga inom tandvården. För att nå optimal effekt ska man framförallt beakta lämplig koncentration, om medlet har effekt mot aktuella grupper av mikroorganismer, hur lång inverkningstid som krävs och vilka hälsorisker och miljöeffekter medlet kan ha. Det är viktigt att alltid följa tillverkarens anvisningar. Man ska också komma ihåg att alla kemiska desinfektionsmedel hämmas i större eller mindre utsträckning av organiskt material som saliv, blod och var. Tabell 6. Desinfektionsmedel lämpliga inom tandvården. Effekt mot: - bakterier - tuberkelbakterier - svamp - nakna virus - höljevirus Användningsområde: - hud - instrument - ytor Värme Alkoholer Klorföreningar Persyror + + + + + + + + + + + + + + + + + + + + + + + + + + + + Organiskt mtrl som inaktiverar, korrosiva, irriterande Korrosiva, irriterande Biverkningar/ nackdelar Hudirriterande i höga konc. Alkoholer Alkoholer är förstahandsvalet för kemisk desinfektion. De har en mycket snabb effekt mot de flesta mikroorganismer och orsakar få problem. Lämpliga alkoholer är propanol och etanol (Walder, 2006). I höga koncentrationer denaturerar alkoholer organiskt material, något som kan dämpa deras antimikrobiella effekt. Man använder därför propanoler som är verksamma i koncentrationer mellan 40-85 volymsprocent och etanol vid 55-85 volymsprocent. Eftersom alkoholer kan vara uttorkande för hud, tillsätts glycerol i handdesinfektionsmedel för att motverka detta. Propanol och etanol är biologiskt nedbrytbara och kan hällas i avloppet. Klorföreningar Klorföreningar har ett brett antimikrobiellt spektrum och kan användas vid yt- och instrumentdesinfektion. Klorföreningar används bl.a. vid desinfektion av vattnet i dentala unitens ledningssystem. Vanliga föreningar är hypokloriter och kloramin (McDonnell, 2007). Risk för frätskador och hudirritation förekommer; även fall med allergiska kontakteksem har rapporterats. Klorlösningar inaktiveras av organiskt material och är mindre stabila i brukslösningar. Material som aluminium och kolstål korroderar när de kommer i kontakt med klorföreningar; hypokloriter är något mera korrosivt än kloramin. Brukslösningar med klor i låga koncentrationer som används i tandvården kan hällas i avloppet. 54 (93) Persyror/persalter Persyror/persalter kan i brukslösningar användas med god effekt mot bakterier, svamp och virus; något högre koncentrationer krävs för att de ska fungera mot tuberkelbakterier (Walder, 2006). Persyror är lämpliga att använda vid desinfektion av ytor som är kraftigt förorenade med blod men även av tandtekniska arbeten. De är irriterande och frätande särskilt i höga koncentrationer samt i pulverform. Korrosion av aluminium och kolstål förekommer, vilket kan dämpas genom tillsats av korrosionshämmande medel. Har begränsad hållbarhet i brukslösning (McDonnell, 2007). Både i flytande form och som pulver kan persyror/persalter läggas i vanliga sopor. Andra desinfektionsmedel Även andra desinfektionsmedel, t.ex. aldehyder, amfolyter, fenolpreparat, jodföreningar, klorhexidin och kvartära ammoniumföreningar kan användas inom tandvården. Dessa begränsas emellertid av varierande antimikrobiell effekt, påtaglig inaktivering av tvål och annat organiskt material, giftighet, risker för allergier eller miljöpåverkan (Walder, 2006; McDonnell, 2007). Alltid skriftlig dokumentation Oavsett vilket kemiskt desinfektionsmedel som man väljer, ska det alltid finnas en skriftlig dokumentation om dess effekter, användningssätt och biverkningar. Desinfektionsmedel är medicintekniska produkter som ska vara CE-märkta för att uppfylla föreskriftens krav (LVFS 2003:11). Det betyder bl.a. att produkten ska vara testad, provad och lämplig för sitt speciella ändamål. Vidare ska det finnas en bruksanvisning och varningsinstruktioner. Informationen ska bygga på dokumenterade utvärderingar (Landvall, 2007), som leverantören tillhandahåller. Desinfektion av ytor Desinfektion ska, efter varje patientbehandling, omfatta alla de ytor som direkt eller indirekt har eller misstänks ha kontaminerats, t.ex. instrumentbordets handtag och reglage till luft och vattensprutor, fattningen till vinkelstyckena, slangar, brickbord, operationsbelysningens och röntgenapparatens handtag, delar av operationsstolen och spitonen. Eftersom alla desinfektionsmedel inaktiveras av organiskt material, som dessutom är svårt att avlägsna när det torkat, är det viktigt att rengöring och desinfektion sker snarast efter kontaminering. Förstahandspreparat är alkoholbaserade medel (etanol/propanol med tillsats av ytspänningsnedsättande medel, s.k. detergent). Efter behandling av särskilt smittspridande patient, t.ex, med Staphylococcus aureus eller enterokocker anses alkohol olämpligt för desinfektion på grund av ångbildning. I ställes rekommenderas att oxiderande desinfektionsmedel användas, t.ex. persyror (Walder, 2006). Sterilisering – varför? Med sterilisering menar man att ett föremål befrias från alla former av levande mikroorganismer. Det innebär, att alla bakterier, mikrosvampar och virus inaktiveras (avdödas); även s.k. endosporer. Det kräver att processen sker vid temperaturer över +100°C, vilket åstadkommes med ånga som är fri från luft. En produkt som genomgått godkänd sterilisering kan märkas med symbolen ”STERIL” (Sjöberg, 2006a). Den mikrobiella renheten ”Steril” rekommenderas för instrument och andra artiklar används vid kirurgiska ingrepp inom sjukvården 55 (93) gäller främst när man skapar en sluten sårhåla eller där det finns risk att man skapar en sådan även när man passerar vävnad med normalflora. Det är vävnadens känslighet för infektion samt art och mängd av smittämne som i kombination med ingreppets art avgör risken för infektion (Hambraeus et al., 1995). Även vid vissa odontologiska ingrepp skapas slutna sårhålor, framförallt i samband med rotkanalsbehandling, implantatkirurgi och parodontal-/käkkirurgi då såret exempelvis täcks av lambå eller liknande. Rotkanalen är särskilt känslig eftersom pulparummet helt saknar infektionsförsvar när ingen vital vävnad finns kvar. Steriliseringsprocessen Det är inte praktiskt möjligt att i efterhand undersöka om alla mikroorganismer har avdödats. Steriliseringsprocessen måste därför fortlöpande kontrolleras med metoder som med stor sannolikhet visar att endast enstaka eller inga livsdugliga mikroorganismer finns på de produkter som behandlats. Principerna för olika steriliseringsmetoder finns beskrivna (Skaudhauge, 1973; SIS HB 2007). För tandvårdens del rekommenderas i första hand fuktig värme under tryck – ångsterilisering (autoklavering). Torr värme – hetluftsterilisering - kan användas (SIS HB 2007) men är mindre lämplig inom tandvården (Bäckman & Edwardsson, 2006a). Baserad på beprövad erfarenhet har man funnit att mättad ånga vid +121°C som får verka under 15 minuter, alternativt +134°C med verkningstid 3 minuter lämpar sig för sterilisering av cirkulationsgods inom sjukoch tandvård (SIS HB 2007). Dessa tider avser endast den fas av processen då den egentliga steriliseringen sker, s.k. hålltid. Till detta kommer för- och efterbehandling. Man skiljer mellan stora och små sterilisatorer. Inom tandvården används nästan uteslutande små ångsterilisatorer, vars kammarvolym är mindre än 60 liter. Den standard som gäller för dessa är SS-EN 13060, som bl.a. beskriver de tre programtyper som apparaten kan vara utrustad med (SIS HB 2007) nämligen: • Programtyp B Sterilisering av förpackade solida, rörformade och porösa produkter • Programtyp N Sterilisering av icke förpackade solida produkter • Programtyp S Sterilisering av produkter angivna av tillverkaren, t.ex. porösa eller rörformade produkter; enkelförpackade eller flerförpackade. Det bör poängteras att programtyp B är den enda av dessa tre som kan utföra samtliga ifrågakommande steriliseringsprocesser som är aktuella inom allmäntandvården. Programtyp N kan t.ex. inte sterilisera vinkelstycken eller instrument som förpackats. Godset kan inte heller sterilförvaras utan måste användas så snart det tas ut ur autoklaven. Eftersom programtyp S endast är avsett för sterilisering av särskilda produkter är dess användningsområde begränsat inom allmäntandvården. Årliga kontroller och daglig övervakning En ångsterilisator, tillverkad för att uppfylla de krav som finns i SS-EN 13060, ska - när den installeras på en klinik - genomgå flera tester, s.k. validering (”bekräfta giltigheten av”), som omfattar installationskontroll, funktionskontroll och processkontroll. Den sistnämnda kontrollen ska visa att sterilisatorn fungerar med det gods, förpackningsmaterial etc. som används vid kliniken (SIS HB 2007). Processkontrollen ska sedan utföras en gång/år (upprepad processkontroll - tidigare kallad upprepad prestandakvalificering); resultatet jämförs med samma variab- 56 (93) ler, som undersöktes vid valideringen/tidigare upprepade processkontroller. Arbetet utförs av särskilt utbildad tekniker och samtliga tester och kontroller ska dokumenteras. Dagliga/batchvisa rutinkontrollen innebär bland annat att följande kontrollåtgärder ska utföras (SIS HB 2007): • Utför den av leverantören rekommenderade sterilisatorkontrollen • Inspektera sterilisatorns dörrpackningar • Utför läcktest om sådant testprogram finns eller kontrollera i kort process utan gods att temperatur, tryck och tid stämmer överens med typkurvan (ӿ). • Utför ångpenetrationstest (Bowie & Dick, Helix-test eller likn.) med speciellt program eller med kort program vid 134 oC i uppvärmd tom sterilisator • I liten sterilisator (tillverkad enl. SS-EN 13060), kontrollera och jämför steriliseringsparametrarna (sterilisator med skrivare) eller processtegen (sterilisator med visuell indikering) med parametrarna från valideringen Dokumentera resultatet genom att signera eventuell skrivarkurva eller loggbok (visuell indikering). • Datummärk och signera dokumentationen över processen innan godset tas om hand • Kontrollera vid urlastningen att förpackningarna är intakta och torra; dessutom godsets märkning och processindikatorer (ӿ): Steriliseringsparametrarnas – tryck- temperatur och tid – förlopp vid steriliseringsprocesser i liten autoklav finns beskrivna och illustrerade; därtill även problem som påverkar tryck och temperatur (Edwardsson et al., 2002; Edwardsson, 2003b). I tandvården finns äldre ångsterilisatorer som inte är tillverkade enligt SS-EN 13060. Man måste vara medveten om att dessa äldre ångsterilisatorer inte uppfyller de krav, som modern tandvård ställer, och därför bör ersättas med moderna sterilisatorer med B-program. Sterilisering med äldre typer av sterilisatorer kan således endast ske av icke förpackade solida produkter, som skall användas omgående. I den mån äldre ångsterilisatorer, trots begränsningarna, används ska dessa uppfylla krav på effektivitet och säkerhet. Tester enligt installations-, funktions- och processkontrollen som tekniskt sett är möjliga att göra, ska således utföras. Den plan som upprättas för dessa kontroller ska innehålla de avsteg som görs. Återkommande kontroll (upprepad processkontroll) av äldre ångsterilisatorer utförs, dels en gång/år, dels en gång var tredje månad (kvartalsvis kontroll), då biologiska indikatorer (sporprov) används (SIS HB 2007). Instrument och annat gods avsedda för aseptiska ingrepp sterilförvaras efter behandling. De ska således skyddas och bevaras under lagring och så att godset på ett säkert sätt kan användas på nytt. (SIS HB 2007). Den längsta förvaringstiden i svetsad förpackning är sex månader och i förpackning försluten genom vikning och tejp en månad. Håliga instrument – särskilda problem Vinkelstycken, bläster (trevägsspruta) och ultraljudsscaler har i större eller mindre omfattning inre ytor, t.ex. lumen i vatten-/luftkanaler och hålrum med skarpa vinklar där mikroorganismer och organiskt material lätt ansamlas. Här kan bakterier och virus från munnen sugas in och dessutom kontamineras inre ytor lätt av mikroorganismer från unitens vatten (Abel et al., 1971; Bagga et al., 1984; Lewis et al., 1992; Epstein et al., 1995; Ojajärvi, 1996; Weightman & Lines 2004). Det gäller roterande instrument, som turbinvinkelstycken, lågvarvsvinkelstycken (axlar/kugghjul) och s.k. profylaxvinkelstycken, trots att dessa instrument kan vara försedda med backventiler, membran, partikelavskiljare eller filter för att minska problemet. Men även spetsar till 57 (93) ultraljudsscaler och bläster är svåra att hålla rena. De inre och yttre ytorna hos dessa håliga instrument ska vara minst höggradigt rena när de återanvänds; vilket kräver särskild behandling. Enklast blir dessa instrument höggradigt rena genom att behandlas i apparatur som med automatiskt program rengör och desinfekterar (värme eller kemiska medel). Det förekommer också program som avslutas med autoklavering. Undersökningar har också utförts där instrumenten behandlats i ångsterilisator (Barnes et al., 1994; Larsen et al., 1997; Andersen et al., 1999). Apparatur som arbetar på något olika sätt finns i dag på marknaden. Dokumentation som visar att utrustningen ger höggradigt rena instrument ska tillhandahållas av tillverkaren. För att få roterande instrument sterila krävs att de behandlas i ångsterilisator med B-program som omfattar flera pulser under förvakuumfasen (Bäckman & Edwardsson, 2006a). Rörformade instrument som blästerspetsar och arbetsdelar till tandsaneringsinstrument bör behandlas i ultraljudsbad innan de görs rena och desinfekteras. I diskdesinfektor ska de sedan placeras så att vattnet spolar genom instrumentets kanal. Idag finns särskilda adaptorer anpassade till diskdesinfektorn som möjliggör detta. Dokument som visar rengörande kapacitet tillhandahållas av tillverkaren. Engångsprodukter Inom tandvården används olika engångsartiklar, t.ex. kanyler för injektion eller för spolning, munstycken till sugutrustning, salivsugar och gummipolerkoppar. Samtliga är s.k. medicintekniska produkter på vilka det ställs krav vad gäller säkerhet och att de är lämpade att användas vid patientbehandling och av brukaren. Tillverkaren av en medicinteknisk produkt ska utfärda en försäkran som bl.a. visar att kraven för CE-märkning är uppfyllda (Landvall, 2007). Produkterna kan vara rena, höggradigt rena eller sterila. Inom tandvården används i mycket stor utsträckning injektionskanyler, som fabrikssteriliseras med joniserad strålning (gammastrålning) eller etylenoxid (McDonnell, 2007). Innan förpackningen öppnas ska den alltid inspekteras; om defekter förekommer betraktas innehållet som osterilt. På varje förpackning och på ytterförpackningen finns ett s.k. LOT- eller batchnummer, som talar om vilken tillverkningssats produkten tillhör och när den framställdes. Om brister konstateras hos aktuell tillverkningssats, kan den därför lätt återkallas. Eftersom rotkanalsfilar är svåra att göra rena med ultraljudsbehandling och i diskdesinfektor, bör filarna bara användas en gång (Walker et al., 2007; Kahan, 2008). Filarna är inte mikrobiellt rena när de levereras (Roth et al., 2006) men kan på sedvanligt sätt steriliseras tillsammans med övriga rotkanalsinstrument. Diskussion om återanvändning av engångsartiklar förekommer. Om en sådan artikel används på sätt som tillverkaren inte avsett, övertar vårdgivaren ansvaret för att produkten är lämpligt att brukas på nytt (Landvall, 2007). Produkten är således att se som egentillverkad. Man måste då ta ställning till olika faktorer, bl.a. säkerhet, materialets förändring vid bearbetning, renhet, hur många gånger den kan återanvändas, arbetsinsats, etc. – en riskanalys ska genomföras (Persson et al 1999; Sjöberg, 2006b). Även så enkla engångsprodukter som sugmunstycken av plast kan vara svåra att göra rena, då mikrobiell biofilm lätt bildas i rörens lumen (Schoenen & Wehse, 1988). Unitens vattenledningssystem Den dentala uniten är försedd med ett system av rör, slangar och ventiler, som leder vattnet fram till kopplingarna för borrmaskinerna, ultraljudsinstrumentet, och blästern. Det är ofta långa plastledningar med ett litet 58 (93) lumen (inre diametern på några enstaka mm). Vattnets genomströmningshastighet är låg och det finns många retentionsställen. Det förekommer långa perioder då vattnet står stilla vid rumstemperatur, vilket skapar förutsättningar för växt av heterotrofa mikroorganismer, som lätt bildar biofilm på ledningarnas insida. (Barbeau et al., 1998; Walker et al., 2000; Szymańska, 2005). Uniten är ansluten till det kommunala vattennätet där antalet mikroorganismer oftast är <100 per mL vatten. När uniten saknar vattenrening bildas alltid en mikrobiell biofilm i ledningarna, varför det inte är ovanligt att antalet heterotrofa mikroorganismer i utgående vatten stiger till c:a 100 000 per mL vatten (Hedman, 1982; Walker et al., 2000; Frandsen et al., 2003). Merparten av dessa mikroorganismer är bakterier, svamp och amöbor, ibland betecknade ”miljö”-mikroorganismer, som är apatogena men det kan finnas potentiellt patogena mikroorganismer, som Legionella pneumophia, mykobakterier, pseudomonas och jästsvampar (Barbaeu et al., 1996; Williams et al., 1996). Vi vet också att mikroorganismer från patientens mun kan förekomma, t.ex. orala viridansstreptokocker, enterokocker och gramnegativa anaerober men även hepatit B-virus och humant immunbrist virus (HIV). De påträffas framför allt i arbetsinstrumentet, exempelvis vinkelstyckets luft- och vattenkanaler men de kan även sugas in i unitens ledningar (Bagga et al., 1984; Fitzgibbon et al., 1984; Crawford & Broderius, 1990; Lewis et al., 1992; Petti & Tarsitani, 2006). Mikroorganismerna i unitens vattenledningssystem utgör inte någon allmän infektionsrisk. Men de kan orsaka infektioner hos personer med nedsatt immunförsvar och hos äldre (Barbeau et al., 1998; Martin, 1987; Mills, 2000; Atlas, 1995). Mikroorganismerna kan också vara en hälsorisk för personalen. Hos tandvårdspersonal kan förekomma högre halt (titer) av antikroppar mot Legionella pneumophia än hos annan vårdpersonal (Fotos et al., 1985; Reinthaler et al., 1988), vilket tyder på yrkesrelaterad exponering. Vidare har astma hos tandläkare satts i samband med förekomst av endotoxin i aerosol som härrör från gramnegativa bakterier i unitens vattenledningar (Pankhurst et al., 2005). För att temporärt reducera antalet mikroorganismer, kan systemet spolas igenom under några minuter (Bäckman & Edwardsson, 2006b). Det krävs emellertid c:a 10 minuters spolning för en markant sänkning (Barbaeu et al., 1996). En annan enkel åtgärd för att eliminera återsuget av mikroorganismerna från patientens mun, kan vara att reglera eller byta den ventil som svarar för återsuget in i unitens ledningar (Bagga, 1984; Berlutti et al., 2003; Petti & Tarsitant, 2006). För varaktig reduktion av den mikrobiella kontaminationen, krävs emellertid att biofilmbildningen minimeras. På marknaden finns i dag särskild apparatur som syftar till att både avlägsna biofilmen och desinfektera vattnet (Möller et al., 2000; Schel et al., 2006; Claesson, 2006; Walker & Marsh, 2007; Möller & Dahlén, 2007). Samtliga bygger på användning av kemikalier. Effekten kan variera; generellt sett fungerar de med kontinuerlig drift bättre än de med intermittent drift (Walker & Marsh, 2007). Man har diskuterat problem med reningsapparaturen. Eftersom klorföreningar ofta används kan metallkorrosion vara ett problem då vissa av dessa föreningar är starkt basiska medan andra ligger på sura sidan (McDonnell 2007). Däremot torde klorföreningar som i vattenlösning ger ett neutral pH-värde, som natriumdikloroisocyanat, orsaka metallkorrosion i mindre utsträckning (Mazzola et al 2003). Man har också pekat på att kemikalier i vattnet skulle kunna sätta ned känsligheten för antimikrobiella medel hos mikroorganismer och störa adhesionen av resin till emalj/dentin; även hälsorisker för personalen vid långvarig exponering för kemikalier i aerosol har uppmärksammats (Walker & Marsh, 2007). Effekten av s.k. pulserande elektromagnetiska fält på mikrobiell biofilm och bakterier i tandlä- 59 (93) karutrustningens färskvattensystem har undersökts (Långmark 2009). Ytterligare studier av en till synes intressant metod bör emellertid utföras; övergång till ”fysikaliska” reningsmetoder måste betecknas som önskvärt. Vi saknar riktlinjer och standarder för krav, utvärdering och skötsel av vattenreningsutrustningar, bl.a. lämpligt gränsvärde för antalet mikroorganismer i unitens vatten. På grund av den mikrobiella kontaminationen i vattenledningarna rekommenderas att sterilt vatten används vid alla ingrepp i steril vävnad; för övrig behandling kan unitens vatten användas under förutsättning att det håller dricksvattenkvalitet (Bäckman & Edwardsson, 2006b). Dricksvatten får inte innehålla patogener men behöver inte vara helt fritt från mikroorganismer. Antalet heterotrofa mikroorganismer ska vara mindre än 100 per ml vatten enligt Livsmedelsverkets och Europaunionens rekommendationer (SLVFS 2001, EU guidelines 1998). Om gränsvärdet överskrids i den dentala unitens vatten, ska åtgärder vidtas för att minska antalet mikroorganismer. Det kan ske med utrustning enligt ovan som automatiskt minimerar biofilmbildningen i ledningarna och desinfekterar vattnet. För att säkerställa unitens vattenkvalitet och utrustningens funktion ska vattnet kontrolleras minst en gång om året (Bäckman & Edwardsson, 2006b). Lämpligen utförs det i samarbete med mikrobiologiskt laboratorium som har möjlighet till kompletterande undersökning och som kan ge värdefull vägledning, bl.a. om de variationer som kan förekomma i påvisat antal mikroorganismer. Sugsystem Unitens sugsystem omfattar slangar, rör och ventiler, där det - på samma sätt som i färskvattenledningarna bildas mikrobiell biofilm. I biofilmen finns ”miljö”-mikroorganismer. Sugfunktionen innebär emellertid att både salivsug alternativt sugmunstycket och slangarna kontamineras av bakterier och virus från munnen. Bristande skötsel kan leda till sämre funktion hos systemet. Mellan varje patient ska salivsug och sugmunstycke bytas, samtidigt som ledningarna spolas med vatten. För att avlägsna biofilmen måste rengöringsmedel användas. Leverantör/tillverkare av sådant medel ska inte bara tillhandahålla praktiska anvisningar utan också dokumentera att medlet på ett effektivt sätt avlägsnar biofilm och andra föroreningar som olja från slangarna och ledningarnas lumen. Daglig rengöring efter arbetets slut ska kunna hämma bildning av biofilm så att desinfektionsmedel endast krävs i samband med service och underhåll av uniten. Patienterna bör instrueras att inte sluta läpparna kring salivsugen, då det kan skapa ett ”negativt” tryck i munnen, vilket leder till att saliv och mikroorganismer som finns i salivsug och slang förs tillbaka (återsug) in i munnen (Watson & Whitehouse, 1993; Thomas et al., 2008). För övrigt torde normal användning av suganläggningar inte innebära någon smittrisk för patienter eller personal. Kompressor Den tryckluft som främst används för drift av turbinvinkelstycken och för torrläggning med 3vägsspruta/bläster produceras i en kompressor. Omgivningens luft kan innehålla mikroorganismer och vattenånga (luftfuktigheten kan variera), som med kompressorns pump sugs in i tryckkärlet. När ångan kommer in i tryckkärlet kan den kondenseras och i det vatten som samlas, skapas förutsättningar för växt av svamp och bakterier (Schneider, 1995; CRA 1996). I en stor kompressor som drivs kontinuerligt, är detta inget större problem vilket däremot kan var fallet i en liten kompressor som oftast drivs intermittent. Vid många tandläkarmottagningar används små kompressorer. Det har visat sig att tryckluft från dessa kompressorer kan innehålla bakterier, främst s.k. saprofyter (lever på död vävnad; vanligen inte sjukdomsframkallande) men också mögel- 60 (93) svamp som Aspergillus och jästsvamp (De Ciccio & Chan, 1998). Aspergillus kan orsaka orala infektioner men det är särskilt när svampen tränger in i levande vävnad (invasiv form) som den kan ge livshotande sjukdomar, som lunginflammation (pneumoni) och allmän blodförgiftning (sepsis), framförallt hos personer med nedsatt immunförsvar (Cannon & Firth; 2006). Genom unitens ledningar kan således saprofyter och svampar som finns i tryckluften föras fram till turbinvinkelstycket och bläster. Vi känner emellertid inte till i vilken omfattning sådan mikrobiellt kontaminerad tryckluft har orsakat infektioner. Oavsett detta är det viktigt att tryckluften håller god kvalitet och är fri från partiklar och fukt som kan störa funktionen hos turbinvinkelstycke och interferera med hantering av kompositmaterial. Kompressorns tryckkärl och pump måste därför skyddas från damm och fukt. Kontroll och service ska följa tillverkarens anvisningar; det innebär bl.a. att filter byts regelbundet, tryckkärlet luftas och kontrolleras beträffande kondensvatten, som alltid ska avlägsnas. Smittförande avfall Med smittförande avfall menas avfall som är eller bedöms kunna vara förorenat med organiskt material från vård eller undersökning av människor med känd eller kliniskt misstänkt sjukdom orsakad av mikroorganismer (AFS 2005:1). Föreskrifter och allmänna råd om hantering av smittförande avfall har publicerats av Socialstyrelsen (SOSFS 2005:26). Inom tandvården är det i första hand använda vassa instrument t.ex. kanyler, skalpeller och rotkanalsfilar, som hänförs till smittförande avfall. Dessa ska omedelbart efter användning placeras i behållare av plåt eller plast, som skyddar mot skär- och stickskador. Behållaren ska vara placerad inom räckhåll från den kliniska arbetsplatsen. Annat avfall efter behandling av patient med känd eller misstänkt sjukdom, som kan medföra smittrisk, ska också betraktas som riskavfall. Smittförande avfall kan omvandlas till konventionellt avfall genom autoklavering. Mindre mängder blod som exempelvis kan förekomma på tork och bomullsrullar vilka använts vid konventionell tandbehandling, betraktas inte som riskavfall. När en behållare fyllts enligt tillverkarens anvisningar och skall bortskaffas, måste den förslutas så att avfall eller smittämnen inte kan läcka ut. Behållaren samt eventuella ytteremballage skall förses med en väl synlig märkning med texten ”skärande/stickande avfall” i svart på gul botten. Tandtekniska laboratorier, tandtekniska arbeten Tandtekniska arbeten av hög kvalitet är en förutsättning för att tandvårdslagens (1985:125) krav på god och säker tandvård ska kunna uppfyllas. Tandtekniker har således en betydelsefull roll i tandvården men tillhör inte hälso- och sjukvårdspersonalen. Tandteknisk verksamhet omfattas i stället av det medicintekniska regelverket och står under Läkemedelsverkets tillsyn. Tandtekniska arbeten vid kliniken Saliv bildar mycket lätt beläggningar på fasta ytor. Det betyder att alla tandtekniska arbeten, även de som provas en kort stund i munnen, kontamineras av en mikrobiell salivfilm. Det är väl känt att man i salivfilm på dentala avtryck påträffar bakterier som normalt finns i munnen (Sofou et al., 2002a). Man har emellertid också isolerat sjukdomsframkallande bakterier som stafylokocker, meticillin-resistenta Staphylococcus aureus (MRSA), Pseudomonas aeruginosa och enterobakterier samt jästsvampar som Candida (Powell et al., 1990; Samaranayake et 61 (93) al., 1991; Honma et al., 1994; Egusa et al., 2008). Dentala avtryck från patienter med öppen lungtuberkulos kan också härbärgera tuberkelbakterier (Ray & Fuller, 1963). I både experimentella och kliniska undersökningar har man funnit att orala bakterier, MRSA, Pseudomonas och Candida kan föras över från avtryck till gipsmodeller där de överlever under olika lång tid; från timmar till flera dagar (Samaranayake et al., 1991; Huizing et al., 1994; Mitchell et al., 1997; Sofou et al., 2002b). Patogena mikroorganismer kan således spridas till laboratoriet. Det gäller inte bara avtryck och gipsmodeller utan också andra tandtekniska arbeten, t.ex. använda proteser som alltid är mer eller mindre kontaminerade av mikroorganismer (Powell et al., 1990; Agostinho et al., 2004). Även om risken för smittspridning till laboratoriet anses liten, ska den inte negligeras - alla tandtekniska arbeten måste rengöras och desinfekteras innan laboratoriearbetet tar vid. Det är tandläkaren som ska se till att tandtekniska arbeten som lämnar kliniken är rengjorda och desinfekterade. Så snart avtrycket tagits ut ur munnen ska det spolas i rinnande vatten för att i möjligaste mån avlägsna saliv, blod etc. och vattnet skakas av; åtgärder som innebär att efterföljande desinfektion blir så effektiv som möjligt. När arbetet sänds till tandtekniskt laboratorium bör det framgå av beställningssedeln att rengöring och desinfektion utförts. Ett tandtekniskt arbete bör sänkas ned eller doppas i desinfektionslösning (Tabell 6). Att duscha det med sprayflaska är mindre lämpligt, dels kan det ge otillräcklig effekt i veck och underskär, dels föreligger risk för inandning av de ångor som bildas (Miller & Palenik, 2001; Walder, 2006). Desinfektionsmedlens inverkningstider varierar beroende på typ av arbete och på materialets känslighet för preparatet (Bergman, 1989; Wood, 1992; Johnson et al., 1998). Tillämpade inverkningstider varierar mellan c:a 10 till 60 minuter, ofta rekommenderas 10-15 minuter. Med hänsyn till antimikrobiell effekt samt biverkningar och miljöaspekter (Walder, 2006) är hypokloriter och persyror lämpade för desinfektion av tandtekniska arbeten; persyror har i allt större utsträckning börjat användas under senare år (Miller & Palenik, 2001; Ahmad, 2007). Vissa avtrycksmaterial, främst alginat (irreversibla hydrokolloider) och reversibla hydrokolloider kan emellertid vara svåra att desinfektera utan påverkan av ytskärpa och dimensioner (Bergman, 1989; Wood, 1992; Ahmed, 2007). Även om avspolning med vatten och efterföljande desinfektion leder till att antalet mikroorganismer på t.ex. avtryck minskar kraftigt, blir de inte helt fria från viabla bakterier (Jenning & Samaranayake, 1991; Sofou et al., 2002a). Avsikten med desinfektion är inte heller att inaktivera alla förekommande mikroorganismer; däremot reducera deras antal, främst patogena bakterier, virus och svamp, till låga nivåer (Walder, 2006; McDonnel, 2007). Desinfektionsmedel ska vara lämpade för sitt speciella ändamål. Det betyder att bruksanvisningen som ska följa med kemiska preparatet avsedda att användas för desinfektion av tandtekniska arbeten, bl.a. bör innehålla information om dess inverkan på avtrycksmaterialens ytskärpa och dimension. Åtgärder på ett tandtekniskt laboratorium Det finns enstaka studier som visar att smitta kan spridas via tandtekniska arbeten till laboratoriepersonalen (Sande et al., 1975). Man har också funnit att prevalensen av serologiska HBV-markörer (sid. 28) kan vara något förhöjd bland tandtekniker jämfört med motsvarande prevalens i genomsnittspopulationer (Scully & Samararnayake, 1992), vilket antyder arbetsrelaterad exponering. Rekommendationerna om basala hygienrutiner, alltså handhygien, klädsel och personlig skyddsutrustning gäller därför i tillämpliga delar för personal vid dentala laboratorier. Laboratoriet ska också kunna lämna information till tandvårdsklinikerna om de hygieniska 62 (93) rutiner som tillämpas vid laboratoriet. Det innebär bl.a. att arbeten som återsändes från laboratoriet ska det vara rengjorda oavsett om de är helt klart eller endast ska provas; något som bör framgå av bifogade handlingar. Det är också viktigt att laboratoriet känner till vilka hygienrutiner som tandvårdsklinikerna tillämpar för tandtekniska arbeten. För att minska smittrisken bör inkommande arbeten tas om hand på särskild plats med tillgång till handdusch, ultraljudsbad för rengöring och möjlighet till desinfektion. Engångshandskar och särskild skyddsrock eller förkläde används och ev. rengöring av arbeten görs i ultraljudsbad. Badet rengörs och dess kapacitet testas regelbundet (sid. 52). Om det finns blod eller smuts på tandtekniska arbeten som kommer till laboratoriet, måste rengöring och desinfektion utföras. Blodiga och smutsiga arbeten, som kommer till laboratoriet, bör dessutom föranleda en diskussion med behandlande tandläkare. Vissa moment under laboratoriearbetet bör särskilt observeras med tanke på hygienen. Pimpstens- och putspasta som använts vid flera arbetsmoment blir lätt kontaminerade med mikroorganismer (Witt & Hart 1990; Verran et al., 1996, 1997), som sedan kan spridas i form av aerosol och orsaka infektioner hos personalen (Sande et al., 1975; Miller & Micik, 1978; Wood, 1992; Agostinho et al., 2004). Den putspasta som begagnats vid ett tillfälle bör därför kasseras. Proteser av akryl som varit i bruk en tid har en porös yta; i porerna förekommer mikroorganismer som vid slipning och polering frisätts till omgivningen (Wood, 1992; Agostinho et al., 2004). Instrument och redskap som använts för slipning och polering vid proteslagning och rebasering bör rengöras efter varje arbete. Även i övrigt bör fräsare, borr, borstar, etc. rengöras dagligen (Verran et al., 2004). 63 (93) Sammanfattning • Hygienrutiner dokumenterade i en hygienplan utgör ett led i kvalitetsarbetet och underlättar upprätthållandet av en god hygiennivå. För att underlätta egenkontrollen av klinikens hygienstandard kan man använda sig av en checklista. • Vårdrelaterade infektioner är ett stort problem i hälso- och sjukvården. • Tillförlitliga uppgifter om omfattningen av vårdrelaterade infektioner inom tandvården saknas men tandvårdens natur innebär uppenbara risker. • Tandvårdsrelaterade infektioner brukar delas in i endogena infektioner orsakade av mikroorganismer som finns hos individen själv och exogena infektioner som kommer ”utifrån”. • Trots att flera olika grupper och arter av mikroorganismer som finns permanent eller tillfälligt i munnen, skulle kunna orsaka tandvårdsrelaterade infektioner, är vår kunskap, att så verkligen sker, begränsad. • Fallbeskrivningar (case reports) förekommer men få rapporter presenterar data som entydigt pekar på ett samband. • I saliv, på orala slemhinnor, i plack och i tandköttsfickor kan man påträffa patogena bakterier och virus, som kan utgöra en smittrisk. • Tandvårdsrelaterade infektioner kan vara både allvarliga och svårbehandlade. Av de drabbade är det många med andra sjukdomar eller äldre personer något som kan medföra långa sjukdomsperioder med betydande sjukvårdsinsatser och kostnader. • Både vid endogena och exogena tandvårdsrelaterade infektioner diskuteras tidsmässiga samband. För att verifiera samband bör konventionell mikrobiologisk analys utföras. Denna bör kompletteras med modern molekylär teknik för identifiering av mikroorganismerna. • Vid tandbehandling sprids den mikrobiellt kontaminerade saliven antingen via direkt/indirekt kontakt eller via stänk och aerosol. Mycket tyder på att de exogena infektionerna sprids främst via kontakt mellan tandvårdspersonal och patienter • Tandvårdsrelaterade exogena infektioner har blivit färre efter uppmärksamheten kring HIV/AIDS i slutet av 80-talet, som innebar en påtaglig förbättring av hygienen i tandvården. • Riskerna för tandvårdsrelaterade endogena infektioner är särskilt påtagliga i samband med blodiga ingrepp framförallt vid behandling av äldre och personer med nedsatt immunförsvar. Man får emellertid inte glömma att dessa infektioner även kan drabba till synes friska individer. • För att minimera riskerna för smittspridning vid tandbehandling är det viktigt att känna till patientens hälsotillstånd. I alla behandlingssituationer ska man se till ”hela” patienten. • Det är viktigt att man har tydliga rutiner för sitt agerande om och när problem dyker upp. Bland annat är det väsentligt att varje patient vid allmänpåverkan efter behandling uppmanas att återkomma eller söka annan vårdgivare. Det är också mycket viktigt att ta ställning till symtom och kliniska observationer som kan tyda på ett orsaksmässigt samband med utförd behandling och snarast se till att patienten får adekvat vård. Tidig behandling är avgörande. • Samma smittförebyggande principer gäller vid all tandbehandling. • Vid tandbehandling finns alltid risk för stick- och skärskador. Av avvikelserapportering framgår att tandsköterskor är särskilt utsatta. Det skall finnas tydliga rutiner för handläggningen vid en inträffad skada. • All tandvårdspersonal bör vara vaccinerad mot hepatit B. Det finns anledning att se över det grundskydd som alla får under förskole- och skolåldern samt skyddet mot tuberkulos. • När tandbehandling sker utan handskar är det oundvikligt att händerna kontamineras av mikroorganismer som finns i patientens mun. Bland annat är nagelbandens bas en svag länk där till synes obetydliga sår kan utvecklas till infektioner, s.k. paronykier. Fingerspetsarna (fingerblomman) kan även vid små stickskador, drabbas av infektioner som går på djupet, s.k. feloner. 64 (93) • Noggrann handhygien, handdesinfektion och skyddshandskar är viktiga smittförebyggande åtgärder. Socialstyrelsen har utfärdat föreskrifter om basala hygienrutiner, som all hälso- och sjukvårdspersonal är skyldiga att följa. • Visir eller munskydd och skyddsglasögon är viktiga delar av de basala hygienrutinerna inom tandvården eftersom många moment vid tandbehandling och arbete på laboratorium orsakar stänk och aerosol. Även patienterna bör bära skyddsglasögon vid vissa arbetsmoment. • Stänk och aerosol medför att arbetskläderna blir fuktiga och kontaminerade av mikroorganismer. Materialet i arbetskläderna ska tåla +70°C - tvättemperatur som ger tillfredsställande mikrobiell renhet. Särskilt skyddsförkläde bärs vid risk för kontakt med kroppsvätskor. • Hantering av instrument/cirkulationsgods i ”sterilen” inleds med grundläggande rengöring som bör ske med ultraljudsapparat och diskdesinfektor. • Desinfektion av cirkulationsgodset sker bäst i diskdesinfektor. Den producerar ett höggradigt rent gods under förutsättning av godkända rutin- och processkontroller. • Kemiska desinfektionsmedel ska användas i så liten utsträckning som möjligt. Om kemiska desinfektionsmedel används, skall tillverkarens anvisningar följas. • Cirkulationsgods som används vid aseptiska ingrepp t.ex. rotkanalsbehandling samt parodontal- och käkkirurgi, då såret täcks med lambå, skall steriliseras. Ångsterilisering - rätt utförd - är en enkel metod som med mycket stor sannolikhet ger ett gods fritt från mikroorganismer och som dessutom tillåter sterilförvaring av instrumenten under lång tid. • Riktlinjer för kontroll av ångsterilisatorer ska finnas. • Vinkelstycken, spetsar till bläster (3-vägsprutor) och ultraljudsscaler samt munstycken till suganläggningar är håliga instrument som görs rena och desinfekteras med automatiska program i särskild apparatur. Sterilisation sker säkrast i ångsterilisator vars program omfattar flera vakuumfaser innan den egentliga steriliseringen (hålltiden) inleds. • Vid tandbehandling används ofta olika engångsartiklar; från sterila kanyler till suganläggningens enkla munstycken. Om de tas i anspråk på sätt som tillverkaren inte avser – t.ex. används på nytt - övertar vårdgivaren ansvaret och en riskanalys måste utföras. • Vattnet i unitens ledningar bör hålla dricksvattenkvalitet (≤100 cfu/ml) och ska därför kontrolleras regelbundet – minst en gång om året. På marknaden finns särskild utrustning med vars hjälp den mikrobiella biofilmen i ledningarna kan avlägsnas och vattnet desinfekteras. • Unitens sugsystem blir hela tiden kontaminerat av mikroorganismer och på ledningarnas insida bildas biofilm och ska därför dagligen göras rent. Desinfektion utförs endast vid service och reparationer av uniten. • Den tryckluft som används till turbinvinkelstycke, bläster och ultraljudsscaler kan var förorenad av mikroorganismer, partiklar och olja. Kompressorn måste därför kontrolleras regelbundet och service alltid ske enligt tillverkarens anvisningar. • I tandvården används ett mycket stort antal medicintekniska produkter alltifrån förhållandevis enkla produkter till komplexa produkter som ställer krav på genomtänkta hygienrutiner. • Alla tandtekniska arbeten, även de som provas en kort stund i munnen, kontamineras av en mikrobiell salivfilm. På dentala avtryck, gipsmodeller och använda proteser påträffas bakterier som normalt finns i munnen och sjukdomsframkallande bakterier som stafylokocker, meticillin-resistenta Staphylococcus aureus (MRSA). • Ett antal lagar och föreskrifter styr hygienverksamheten i tandvården Av tandvårdslagen framgår att tandvården skall hålla god hygienisk standard 65 (93) Referenser Abel LC, Miller RL, Micik RE, Ryge G. Studies on dental aerobiology. IV. Bacterial contamination of water delivered by dental units. J Dent Res 1971;50:1567-9. Abott PV, Hume WR, Pearman JW. Antibiotics and endodontics. Aust Dent J 1990;35(1):50-60. Adachi M, Ishihara K, Abe S, Okuda K. Professional oral health care by dental hygienists reduced respiratory infections in elderly persons requiring nursing care. Int J Dent Hyg 2007;5:69-74. Adamsson I, Edlund C, Seensalu R, Sjöstedt S, Nord CE. The normal gastric microflora and Helicobacter pylori; before, during and after treatment with omeprazole and amoxicillin. Clin Microbiol Infect 1998;4:308-15. Adamsson I. The impact on Helicobacter pylori and the normal gastrointestinal microflora during treatment with acid suppression alone and in combination with antibiotics. Thesis. Stockholm: Karolinska inst. 1999. ISBN 91-628-3396-0. Adielsson A, Nethander G, Stalfors J, Ebenfelt A, Westin T. Infektioner i halsens djupare spatier är inte sällan odontologiska. Tandläkartidningen 2000;92(3):32-40. AFS 2005. Arbetsmiljöverket, AFS 2005:01. Mikrobiologiska arbetsmiljörisker – smitta, toxinpåverkan, överkänslighet. www.av.se/dokument/afs/afs2005_01.pdf Agostinho AM, Miyoshi PR, Gnoatto N, Paranhos HF, Figueiredo LC, Salvador SL. Cross-contamination in the dental laboratory through the polishing procedure of complete dentures. Braz Dent J 2004;15(2):13843. Ahmad S, Tredwin CJ, Nesbit M, Moles DR. Effect of immersion disinfection with Perform-ID on alginate, an alginate alternative, an addition-cured silicone and resultant type III gypsum casts. Br Dent J 2007;202:E1. (Online article number E1, pages:1-7). Alam S, Brailsford SR, Whiley RA, Beighton D. PCR-Based methods for genotyping viridans group streptococci. J Clin Microbiol 1999; 37(9):2772-6. Allan AL, Organ RJ. Occult blood accumulation under the fingernails: a mechanism for the spread of bloodborne infection. J Am Dent Assoc.1982;105(September):455-9. Allos BM, Schaffner W. Transmission of hepatitis B in the health care setting: the Elephant in the room or the mouse? J Infect Dis 2007; 195(9):1245-7. Andersen HK, Fiehn NE, Larsen T. Effect of steam sterilization inside the turbine chambers of dental turbines. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999 87(2):184-8. ASA. Medicinsk riskbedömning Sveriges Tandläkarförbund. Box 1217, 1182 Stockholm. (www.tandlakarforbundet.se). Assaf M, Mellor AC, Qualtrough AJ. Cleaning endodontic files in a washer disinfector. Br Dent J 2008;204(10):562-3:E17. Atlas RM, Williams JF, Huntington MK. Legionella contamination of dental-unit waters. Appl Environ Microbiol 1995;61(4):1208-13. Axell T, Anderberg U, Priwe C et al. Svenska tandläkare och blodsmitta – attityder, kunskaper och beteende. 66 (93) Tandläkartidningen 1989; 81(23):1308-14. Axell T. Munslemhinneförändringar, Klinik och behandling. 5:te upplagan, Gothia, Stockholm 2000. ISBN 917205-264-3. Axelsson S, Heimdahl A. Antibiotikaprofylax vid kirurgiska ingrepp I muhåla och angränsande områden. Tandläkartidningen 2010;102(10):72-77 Bagg J. Tuberculosis: a re-emerging problem for health care workers. Br Dent J 1996;180(10):376-81. Bagg J, Smith AJ, Hurell D, McHugh S, Irvine G. Pre-sterilisation cleaning of re-usable instruments in general dental practice. Br Dent J 2007;202(9):1-7. Bagga BS, Murphy RA, Anderson AW, Punwani I. Contamination of dental unit cooling water with oral microorganisms and its prevention. J Am Dent Assoc 1984;109(5):712-6. Barbeau : Lawsuit against a dentist related to serious ocular infection possibly linked to water from a dental handpiece. JCDA 2007;73(7):618-22. Barbeau J, Tanguay R, Faucher E, Avezard C, Trudel L, Côté L, Prevost AP. Multiparametric analysis of waterline contamination in dental units. Appl Environ Microbiol 1996;62(11):3954-9. Barbeau J, Gauther C, Payment P. Biofilms, infectious agents and dental unit waterlines: a review. Can J Microbiol 1998;44(11):1019-28. Barnes CM, Anderson NA, Li Y, Caufield PW. Effectiveness of steam sterilzation in killing spores of Bacillus stearothermophilus in prophylaxis angles. Gen Dent 1994;42(5):456-8. Belting CM, Haberfelde GC, Juhl LK. Spread of organisms from dental air rotor. J Am Dent Assoc. 1964;68:648-51. Bennett AM, Fulford MR, Walker JT, Bradshaw DJ, Martin MV, Marsh PD. Microbial aerosols in general dental practice. Br Dent J 2000;189(12):664-7. Bentley CD, Burkhart NW, Crawford JJ. Evaluating splatter and aerosol contamination during dental procedures. J Am Dent Assoc. 1994;125(5):579-84. Bergman B. Disinfection of prosthodontic impression materials: a literature review. Int J Prosthodont 1989;2(6)537-42. Berlutti F, Testarelli L, Vaia F, De Luca M, Dolci G. Efficacy of anti-retraction devices in preventing bacterial contamination of dental unit water lines. J Dent 2003;31(2):105-10. Björkholm B. Helicobacter pylori – cellular interactions and pathogenesis. Thesis. Stockholm: Karolinska Inst. 2001. ISBN 91-7349-084-9. Blanquet-Grossard F, Sazdovitch V, Jean A, Deslys JP, Dormont D, Hauw JJ, Marion D, Brown P, Cesborn JY. Prion protein is not detectable in dental pulp from patients with Creutzfeldt-Jacob disease. J Dent Res 2000; 79(2):700. Blomgren J, Hogevik H. Profylax mot infektiös endokardit. Tandläkartidningen 2004;96(13):48-51. Blomgren J, Hagberg L. Allvarlig sepsis efter tandextraktion. Tandläkartidningen 2007;99(8):48-9. Blomgren J, Norén M. Tandvårdens läkemedel. 15:de uppl. 2008. ISBN 978-91-977155-0-8. e-post: [email protected]. Boivin G, Goyette N, Sergerie Y, Keays S, Booth T. Longitudinal evaluation of herpes simplex virus DNA load during episodes of herpes labialis. J Clin Virol 2006;37(4):248-51. 67 (93) Bollin GE, Plouffe JF, Para MF, Hackman B. Aerosols containing Legionella pneumophila generated by shower heads and hot-water faucets. Appl Environ Microbiol 1985;50(5):1128-31. Brewer NS, MacCarty CS, Wellman WE. Brain abscess: a review of recent experience. Ann Intern Med 1975;82(4):571-6. Britton S. Emerging infections. I: Ekdahl K. Giesecke J. (red) Smittskyddsboken. Lund: Studentlitteratur 2003. Kap. 59ISBN 91-44-04197-7. Brodam W. Dårlig mundhygiejne koster liv på danske hospitaler. Tandlægebladet 2007; 8:610-3. Brokstad Herlofson B. Bisfosfonater – biverkningar og komplikationer i munnen. Odontologi 2009:65-83, Munksgaard, København, Danmark. ISBN:978-87-628-0878-2. Brolin M, Anveden Berglind I, Boman A, Wrangsjö K, Meding B. Handsprit mer skonsam än tvål och vatten. Tandläkartidningen 2011;103(7):64-8. Bruun JN, Solberg CO. Hand carriage of gram-negative bacilli and Staphylococcus aureus. Br Med J 1973;2:580-2. Brändén H, Andersson J. Grundläggande immunologi, 3:e uppl. Lund: Studentlitteratur 2004. ISBN 91-4403073-8. Budz-Jörgensen E. Etiology, pathogenesis, therapy and prophylaxis of oral yeast infections. Acta Odont Scand 1990;48(1):61-9. Burke FJ, Wilson NH. The incidence of undiagnosed punctures in non-sterile gloves. Br Dent J 1990;168(12):67-71. Burkhart NW, Crawford J. Critical steps in instrument cleaning: removing debris after sonication. J Am Dent Assoc 1997;(4):456-63. Bürgers R, Schneider-Brachert W, Reischl U, Behr A, Hiller KA, Lehn N, Schmalz G, Ruhl S. Helicobacter pylori in human oral cavity and stomach. Eur J Oral Sci 2008;116(4):297-304. Bäckman N, Holm AK, Folkesson U, Olofsson AL. Behöver kvaliteten i tandläkarnas medicinska riskbedömning förbättras? Tandläkartidningen 1998;90(7):29-33. Bäckman N, Edwardsson S, Marking H. Förslag till kvalitetsindikatorer för hygien i tandvården. Tandläkartidningen 2000;92(5):54-9. Bäckman N, Edwardsson S, a. Hygienrutiner i tandvården. I: Att förebygga vårdrelaterade infektioner: Ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:442-58. ISBN 91-85482-14-5. Bäckman N, Edwardsson S, b. Sidorna i Att förebygga vårdrelaterade infektioner: Ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:403-405. ISBN 91-85482-14-5. Cannon RD, Chaffin WL. Oral colonization by Candida albicans. Crit Rev Oral Biol Med. 1999;10(3):359-83. Cannon RD, Firth NA. Fungi and fungal infections of the oral cavity. In: Richard J. Lamont et al (eds). Oral Microbiology and Immunology. Washington: ASM Press, 2006:333-348. Carlsson K, Linder C. Introduktion till mikrobiologi med inriktning mot naturvetare och farmaceuter. 1:th ed. Lund: Studentlitteratur 2008. ISBN 978-91-44-04846-8. Castro Ferreiro M, Hermida Priato M, Diz Dios P. Sporadic transmission of hepatitis C in dental practice. Med Clin (Barc). 2004;123(7):271-5. CDC 1991. Center of Disease Control. Update transmission of HIV infection during an invasive dental procedure – Florida. MMWR Morb Mortal Wkly Rep 1991;40:21-7, 33. 68 (93) CDC 2009. http://www.cdc.gov/ncidod/sars/situation.htm. Current SARS situation. Challacombe SJ, Fernandes LL. Detecting Legionella pneumophila in water systems: a comparison of various dental units. JADA 1995;126(May):603-8. CJD Statitics 2009. http://www.cjd.ed.ac.uk/figures.htm Claesson R. Umeå har en metod för desinfektion av unitar. Tandläkartidningen 2006;98(11):56-58. Cleveland JL, Kent J, Gooch BF, Valway SE, Marianos DW, Butler WR, Onorato IM. Multidrug-resistant Mycobacterium tuberculosis in an HIV dental clinic. Infect Control Hosp Epidemiol 1995;16(1):7-11. Cleveland JL, Gooch BF, Lookwood SA. Occupational blood exposures in dentistry: a decade in review. Infect Control Hosp Epidemiol 1997;18(10):717-21. Contreras A, Nowzari H, Slots J. Herpesviruses in periodontal pocket and gingival tissue specimens. Oral Microbiol Immunol 2000;15(1):15-8. Cooper C. Fundamentals of hand therapy: Clinical reasoning and treatment guidelines for common diagnoses of the upper extremity. St. Louis, USA: Mosby Elsevier, 2007. Corson MA, Postlethwaite KP, Seymour RA. Are dental infections a cause of brain abscess? Case report and review of the literature. Oral Dis 2001;7(1):61-5. Cottone JA, Puttaiah R. Hepatitis B virus infection. In: Dental Clinic of North America. Philadelphia: WB Saunders Company. 1996:293-307. ISSN 0011-8532 CRA. Clinical Research Associates Newsletter. Face masks. Dental Clinical 1989;13:1-3. CRA. Compressed air status report. Clinical Research Associates Newsletter 1996; 20:1-2. Crawford JJ, Broderius C. Evaluation of a dental unit designed to prevent retraction of oral fluids. Quintessence Int 1990;21(1):47-51. Craig DC, Quayle AA. The efficacy of face-masks. Br Dent J 1985;158(6):87-90. Dahlén G. Linde A, Möller AJ, Öhman A. A retrospective study of microbial samples from oral mucosal lesions. Oral Surg Oral Med Oral Pathol 1982;53(3):250-5. Dahlén G, Wikström M. Occurrence of enteric rods, staphylococci and Candida in subgingival samples. Oral Microbiol Immunol 1995;10:42-6. Dahlstrand H, Hammarstedt L, Lindquist D, Romanitan M, Munck-Wikland E, Dalianis T. Virus viktig faktor vid tonsillcancer. Tandläkartidningen 2007;99(5):52-5. Dahlström U. Bakteriell endokardit. I Internmedicin, Kjell Asplund m. fl (red.), 3:e upplagan 2002: 226-9. Liber AB, Stockholm. ISBN 91-47-04961-8. Dale BA. Fascination with epithelia architecture, proteins and functions. J Dent Res 2003;82(11):866-9. Darelid J, Löfgren S. Legionella i vården. I: Att förebygga vårdrelaterade infektioner ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:391. ISBN 91-85482-14-5. De Ciccio A, Chan EC. Elimination of microorganisms from dental operatory compressed air. J Can Dent Assoc 1998;64(1):42-7. Dowsett SA, Archila L, Segreto VA, Gonzalez CR, Silva A, Vastola KA, Bartizek RD, Kowolik MJ. Helicobacter pylori infection in indigenous families of Central America: serostatus and oral and fingernail carriage. J Clin Microbiol 1999;37(8):2456-60. Dowsett SA, Kowolik MJ. Oral Helicobacter pylori: can we stomach it? Crit Rev Oral Biol Med 69 (93) 2003;14(3):226-33. Drangsholt MT. A new causal model of dental diseases associated with endocarditis. Ann Periodontol 1998;3(1):184-96. Durack DT, Phil D. Prevention of infectious endocarditis. N Engl J Med 1995;332(1):38-44. Edwardsson S, Bäckman N, Zimmerman M, Bruse G. Validering av små autoklaver – ett led i kvalitetssäkringen av det smittförebyggande arbetet. Tandläkartidningen 2002;94(6): 46-55. Edwardsson S (a). Mikroorganismerna, vänner och fiender. I: Zimmermann M. (ed) Hygien och smittskydd i tandvården, 2:a uppl., Stockholm: Gothia, 2003. Kap. 5. ISBN 91-7205-357-7. Edwardsson S (b). Hur ska vi smittrena våra instrument och vår utrustning? I: M Zimmerman (red). Hygien och Smittskydd i Tandvården 2:a uppl. Stockholm: Gothia, 2003:102-44. ISBN 91-7205-357-7. Egusa H, Watamoto T Abe K, Kobayashi M, Kaneda Y, Ashida S, Matsumoto T, Yatani H. An analysis of the persistent presence of opportunistic pathogens on patient-derived dental impressions and gypsum casts. Int J Prosthodont 2008;21(1)::62-8. Eishi K, Kawazoe K, Kuriyama Y, et al. Surgical management of infective endocarditis associated with cerebral complications. Multi-center retrospective study in Japan. J Thorac Cardiovasc Surg 1995; 110(6):1745-55. Epstein JB, Rea G, Sibau L, Sherlock CH. Assessing viral retention and elimination in rotary dental instruments. J Am Dent Assoc 1995;126(January):87-92. Ericson E, Ericson T. Klinisk mikrobiologi. Infektioner – Immunologi – Sjukvårdshygien. 3:e uppl. Stockholm: Liber AB. 2003. ISBN 91-47-05127-2. Ericson E. Folktandvården Skåne kansli, Lund. Personl meddelande 2009. EU guidlines. Council Directive 98/83/EC of November 3, 1998 on the quality of water intended for human consumption. Official Journal of the European Community 1998;330:32-54. Everington D, Smith AJ, Ward HJ et al. Dental treatment and risk of variant CJD – a case-control study. Br Dent J 2007;202(8):470-1. Exner VM, Haun F, Koicikowski R. Zahnärtliche Einheiten als Kontaminationsquelle für Pseudomonas aeruginosa. Dtsch Zahnärztl Z 1981;36:819-24. Farrier SL, Farrier JN, Gilmour ASM. Eye safety in operative dentistry – A study in general dental practice. Br Dent J 2006;200(4):218-23. Fiehn NE, Gutschik E, Larsen T, Bangsborg JM. Identity of streptococcal blood isolates and oral isolates from two patients with infective endocarditis. J Clin Microbiol 1995;33(5):1399-401. Fields LB. Oral care intervention to reduce incidence of ventilator-associated pneumonia in the neurologic intensive care unit. J Neurosci Nurs 2008;40(5):291-8. Figueiral MH, Azul A, Pinto E, Fonseca PA, Branco FM, Scully C. Denture-related stomatitis: identification of aetiological and prediposing factors – a large cohort. J Oral Rehabil 2007;34(6):448-55. Fitzgibbon EJ, Bartokas CA, Matrin MV, Gibson MF, Graham R. The source, frequency and extent of bacterial contamination of dental unit water systems Br Dent J 1984;157(3):98-101. Fomer L, Larsen T, Killan M, Holmstrup P. Incidence of bacteremia after chewing, toothbrushing and scaling in individuals with periodontal inflammation. J Clin Periodontol 2006;33(6):401-7. Fonager K, Lindberg J, Thulstrup AM et al. Incidence and short-term prognosis of infective endocarditis in Denmark, 1980-1997. Scand J Infect Dis 2003;35:27-30. 70 (93) Ford CR, Peterson DE. The efficiency of surgical face masks. Am J Sur 1963;106:954-7. Fotos PG, Westfall HN, Snyder IS, Miller RW, Mutchler BM. Prevalence of Legionella-specific IgG and IgM antibody in a dental clinic population. J Dent Res 1985;64:1382-5. Fourrier F, Duvivier B, Boutigny H, Roussel-Delvallez M, Chopin C. Colonization of dental plaque: source of nosocomial infections in intensive care unit patients. Crit Care Med 1998;26(2):301-8. Frandsen EVG, Østergaard E, Baelum V. Den mikrobiologiske vandkvalitet i danske dentalunits. Tandlægebladet 2003;107(8):584-91. Gendron R, Grenier D, Maheu-Robert L. The oral cavity as a reservoir of bacterial pathogens for focal infections. Microbes Infect 2000;2(8):897-906. Gerberding JL. Incidence and prevalence of human immunodeficency virus, hepatitis B virus, hepatitis C virus and cytomegalovirus among health care personnel at risk for blood exposure; final report from a longitudinal study. J Infect Dis 1994;170(6):1410-7. Giesecke J. (a) Smittsamhet och smittspridning. I: Ekdahl K. Giesecke J. (red) Smittskyddsboken. Lund: Studentlitteratur 2003: Kapitel 4. ISBN 91-44-04197-7. Gieseke J (b). Epidemiologiska grundbegrepp. I: Ekdahl K. Giesecke J. (ed) Smittskyddsboken, Lund: Studentlitteratur 2003: Kap. 5. ISBN 91-44-04197-7. Gillespie WJ. Infection in total joint replacement. Infect Dis Clin North Am 1990;4:465-84. Glick M. Clinical aspects of recurrent oral herpes simplex virus infection. Compend Contin Educ Dent 2002;23(7) (Suppl 2):4-8. Gonzalez E, Naleway C. Assessment of the effectiveness of glove use as a barrier technique in the dental operatory. J Am Dent Assoc. 1988;117(3):467-9. Greenberg MS. Herpesvirus infection. Dent Clin North Am 1996;40(2):359-68. Gross A, Cutright DE, D´Alessandro SM. Effect of surgical scrub on microbial population under the fingernails. Am J Surg 1979;138(3):463-7. Guntheroth WG. How important are dental procedures as a cause of infective endocarditis? Am J Cardiol 1984;54:797-801. Gwaltney JM, Moskalski PB, Hendley JO. Hand-to hand transmission of rhinovirus colds. Ann Intern Med 1978;(4):463-7. Günbay T, Günbay S, Kandemir S. Herpetic whitlow. Quintessence Int 1993;24(5):363-4. Götrick B, Liedholm R, Vult von Steyern P. Tandvårdslistan 2009, Läkemedelsrådet, Region Skåne, Lund, epost: [email protected]. Hambraeus A, Karlberg I, Malmquist H, Nyström B, Sjöberg L. Mikrobiologisk renhet vid medicinska ingrepp. Läkartidningen 1995;92(6):525-6. Harrel SK, Molinari J. Aerosol and splatter in dentistry. A brief review of the literature and infection control implications. J Am Dent Assoc 2004;135(4):429-37. Hartley JL. Eye and facial injuries resulting from dental procedures. Dent Clin North Am 1978;22(3):505-15. Head MW, Ritchie D, McLoughlin V, Ironside JW. Investigation of PrPres in dental tissues in variant CJD. Br Dent J 2003;195:339-43. Hedman B. Bakteriell förorening av vatten som används vid tandbehandling. Tandläkartidningen 1982;74:3023. 71 (93) Hedin G, Hambraeus A. Multiply antibiotic-resistant Staphylococcus epidermidis in patients, staff and environment – a one-week survey in a bone marrow transplant unit. J Hosp Infect 1991;17: 95-106. Hedin G. Desinfektion av hud och slemhinnor. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:330-67. ISBN 91-85482-14-5. Heimdahl A, Hall G, Hedberg M, Sandberg H, Söder PO, Tuner K, Nord CE. Detection and quantification by lysis-filtration of bacteria after different oral surgical procedures. J Clin Microbiol1990;2:2205-9. Heimdahl A. Nord CE. Antimicrobial prophylaxis in oral surgery. Scand J Infect Dis. Suppl. 1990;70:91-101. Helovuo H. Periodontal superinfections. Academic Dissertation 1986, Department of Periodontology, Institute of Dentistry, University of Turku, Turku, Finland. Henriksson V, Kjellander J. Handduken som smittokälla inom sjukvården. Svensk Läkartidn 1961;58:1242-5. Henriksson O, Rasmusson M. Fysiologi – med relevant anatomi, 2:a upp-lagan. Lund: Studentlitteratur, 2009. ISBN 978-91-44-00835-6. Henriques Normark B, Magnius L. Molekylärbiologiska och andra typningsmetoder. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:243-9. ISBN 91-85482-14-5. Hermida M, Ferreiro MC, Barral S, Laredo R, Castro A, Diz Dios P. Detection of HCV RNA in saliva of patients with hepatitis C virus infection by using a highly sensitive test. J Virol Methods. 2002:101(1-2):29-35. Heyman DL. (ed) Control of Communicable Diseases Manual. 18th Edition. American Public Health Association, Washington: Oxford University Press, 2004. ISBN 0-87553-034-6. Hidaka Y, Liu Y, Yamoto M, Mori R, Miyazaki C, Kusuhara K, Okada K, Ueda K. Frequent isolation of human herpes virus 7 from saliva samples. J Med Virol 1999;40(4):343-6. Hoffman PN, Cooke EM, McCarville MR, Emmerson AM. Micro-organisms isolated from skin under wedding rigs worn by hospital staff. Br Med J 1985;290(19 January):206-7. Honma K, Tawara Y, Okuda K. Detection of methicillin-resistant Staphylococcus aureus in human saliva and on denture surfaces. Bull Tokyo Dent Coll 1994;35(4):217-20. Hormia M, Willberg J, Ruokonen H, Syrjänen S. Marginal periodontium as a potential reservoir of human papillomavirus in oral mucosa. J Periodontol 2005; 76(3):358-63. Huizing KL, Palenik CJ, Setcos JC, Sheldrake MA, Miller CH. Method of evaluating the antimicrobial abilities of disinfectant-containing gypsum products. Quintessence of Dental Technology (QDT) 1994;17:172-6. Høiby N. P aeruginosa in cystic fibrosis patients resists host defenses, antibiotics. Microbe 2006;1(12):571-7. Ishikawa A, Yoneyama, T, Hirota K, Mlyake Y, Mlyatake K. Professional oral health care reduces the number of oropharyngeal bacteria. J Dent Res 2008;87(6):594-8. Iversen BG. Contaminated mouth swabs caused a multi-hospital outbreak of Pseudomonasn aeruginosa infektion. J Oral Microbiol. 2010 Apr 20;2. doi: 10.3402/jom.v2i0.5123. Jacobsen PL, Murray W. Prophylactic coverage of dental patients with artificial joints: a retrospective analysis of thirty-three infections in hip prostheses. Oral Surg Oral Med Oral Phatol. 1980;50(2):130-3. Jarnbring F, Ulmner M, Blomlöf J, Saleh H, Ljungman P. Läkemedel mot bennedbrytning kan ge käkbensnekros. Tandläkartidningen 2006;98(14):58-62. Jennings KJ, Samaranayake LP. The persistence of microorganisms on impression materials following disinfection. Int J Prosthodont 1991;4(4):382-7. 72 (93) Johnson GH, Chellis KD,Gordon GE, Lepe X. Dimensional stability and detail reproduction of irreversible hydrocolloid and elastomeric impressions disinfected by immersion. J Prosthet Dent 1998;79:446-53. Jonsson J. Molekylärgenetiska metoder revolutionerar smittspårning. Smittskydd 2009;(5):31-35. Smittskyddsinstitutets tidskrift, Smittskyddsinstitutet, Solna ISSN 1401-0690. Jörbeck H, Samuelson A. Blodburen smitta. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:254-76. ISBN 91-85482-14-5. Jörbeck H, Torell E. Personalinfektioner i vården. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006: 277-303. ISBN 91-85482-14-5. King TB, Muzzin KB, Berry CW, Anders LM. The effectiveness of an aerosol reduction device for ultrasonic scalers. J Periodontol 1997;68(1):45-9. Kahan RS. Comment on: Assaf M, Mellor AC, Qualtrough AJE. Summary of: Cleaning endodontic files in a washer disinfector. Br Dent J 2008;204;(10):562-563. Kakisi OK, Kechagia AS, Kakisis IK, Rafailidis PI, Falagas ME. Tuberculosis of the oral cavity: a systematic review. Eur J Oral Sci 2010;118(2):103-9. Kallings I. Biosäkerhet. I: Ekdahl K. Giesecke J. (red) Smittskydds-boken. Lund: Studentlitteratur 2003:151156. ISBN 91-44-04197-7. Kaijser B. Vaccinationer i Sverige och övriga Norden, 2:a upplagan, Lund: Studentlitteratur, 1999. ISBN 91-4401144-x. Kinane DF, Riggio MP, Walker KF, MacKenzie D, Shearer B. Bacteraemia following periodontal procedures. J Clin Periodontol 2005;32:708-13. Kjellander J, Nygren B. Kan tvål sprida smitta? Svensk Läkartidn 1959;56:2021-5. Klemenc P, Skaleric U, Artnik B, Nograsek P, Marin J. Prevalence of some herpes virus in gingival crevicular fluid. J Clin Virol 2005;34(2):147-52. Komiyama K, Tynan JJ, Habbick BF, Duncan DE, Liepert DJ. Pseudomonas aeruginosa in the oral cavity and sputum of patients with cystic fibrosis. Oral Surg Oral Med Oral Pathol 1985;59(6):590-4. Knaup B, Schünemann S, Wolff MH. Subclinical reactivation of herpes simplex virus type1 in the oral cavity. Oral Microbiol Immunol 2000;15(5):281-3. Knighton HT. Coagulase-positive staphylococci in oral and nasal areas of dental students: a four-year study. J Dent Res 1965;44(3):467-70. Krithika C, Neelakandan RS, Sivapathasundaram B, Koteeswaran D, Rajaram PC, Shetkar GS. Osteopetrosisassociated Osteomyelitis of the jaws: a repot of 4 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009;108(3):e56-65. Lamont M, Booth A. Post-traumatic endophthalmitis following penetrating injury with dental needle. Eye (lond) 2006;20(8):981-2. Lamster IB, Ahlo JK. Analysis of ginival crevicular fluid as applied to the diagnosis of oral and systemic dis eases. Annals of the New York Academy of Science 2007;1098(March):216-29. Landvall P. Medicintekniska produkter: vägledning till CE-märkning, Stockholm: SIS Förlag 2007. ISBN 917162-679-4. 73 (93) Larsen T, Andersen HK, Fiehn NE. Evaluation of a new device for sterilizing dental high-speed handpieces. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997;84(5):513-6. Larsson B, Bäckman N, Holm AK. Medicinsk riskbedömning med hjälp av ASA-klassificering. Tandläkartidningen 2000;92(8):28-32. Laurell M. Prionsjukdomar. I: Att förebygga vårdrelaterade infektioner ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006. ISBN 91-85482-14-5. Leao JC, Porter S, Scully C. Human herpesvirus 8 and oral care: an update. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000;90(6):694-704. Leao JC, Teo CG, Porter SR. HCV infection: aspects of epidemiology and transmission relevant to oral health care workers. Int J Oral Maxillofac Surg 2006;35(4):295-300. Leimola-Virtanen R, Happonen RP, Syrjänen S. Cytomegalovirus (CMV) and Helicobacter pylori (HP) found in oral mucosal ulcers. J Oral Pathol Med 1995;24(1):14-7. Lepp T. Avdelningen för epidemiologi, Smittskyddsinstitutet, Solna. Personligt meddelande 2008. Lewis DL, Arens M, Appleton SS, Nakashima K, Ryu J Boe RK, Patrick JB, Watanabe DT, Suzuki M. Crosscontamination potential with dental equipment. Lancet 1992;340(8830):1252-4. Lewis MA. Herpes simplex virus: an occupational hazard in dentistry. Int Dent J 2004;54(2):103-11. Lewis MAO, Williams DW. Oral fungal infections. In: Marsh P, Martin MV (eds). Oral Microbiology, fifth edition. London: Churchill Livingstone Elsevier, 2009:166-179. ISBN 978-0-443-10144-1. Li X, Tronstad L, Olsen I. Brain abscesses caused by oral infection. Endod Dent Traumatol 1999;15(3):95-101. Limeres-Posse J, Tomas-Carmona I, Fernandez-Feijoo J et al. Cerebral abscesses of oral origin. Rev Neurol 2003;37(3):201-6. Lock G, Dirscheri M, Obermeier F, Gelbmann CM, Hellerbrand C et al. Hepatitis C – contamination of toothbrushes: myth or reality? J Viral Hepat 2006;13(9):571-3. Lodi G, Porter SR, Teo CG, Scully C. Prevalence of HCV infection in health care workers of a UK dental hospital. Br Dent J. 1997;183(9):329-32. Lodi G, Bez C, Porter SR, Scully C, Epstein JB. Infectious hepatitis C, hepatitis G, and TT virus: review and implications for dentists. Spec Care Dentist, 2002;22(2):53-8. Lowe AH, Burke FJ, McHugh S, Bagg J. A survey of the use of matrix bands and their decontamination in general dental practice. Br Dent J 2001;192(1):40-2. Lundholm P. Personligt meddelande, 2012. [email protected] Lundholm R. Vårdrelaterade infektioner – vad är det, hur vanliga är de, vilka drabbas och vilka konsekvenser får de? I: Att förebygga vårdrelaterade infektioner - ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006. ISBN 91-85482-14-5. Långmark J. Bakterier i biofilm och vatten i tandläkarunitar. Testning av CMI-AK utrusningens inverkan. Smittskyddsinstitutets Rapportsserie nr 3:2009. ISSN-nummer 1400-3473. Smittskyddsinstitutet, 171 82 Solna. www.smittskyddsinsitutet.se. Mahboobi N, Agha-Hosseini F, Mahboobi N, Safari S, Lavanchy D, Alavian SM. Hepatitis B virus infection in dentistry: a forgotten topic (Review). Journal of Viral Hepatitis 2010;17:307-16. Madsen PO, Madsen RE. A study of disposable surgical masks. Am J Surg 1967;114(3):431-5. 74 (93) Malmros E. Fakta om arbetsskador i tandvården. Arbetarskyddsstyrelsen ISA, 1990. Malmros E. Arbetsmiljöverket, Statistikenheten, Stockholm. Personligt meddelande 2008. Mampalam TJ, Rosenblum ML. Trends in the management of bacterial brain abscesses: a review of 102 cases over 17 years. Neurosurgery 1988;23(4):451-8. Mann RJ. Infections of the hand. Philadelphia: Lea & Febiger, 1988. ISBN 0-8121-1117-6. Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res 1994;8:263-71. Marsh P, Martin MV. Cross-infection control. chapter 14 In: Oral Microbiology, fourth edition. Oxford: Wright, 1999. ISBN 0-7236-1051-7. Marsh PD, Martin MV. Infection control. In: Oral Microbiology, Fifth edition. London: Churchill Livingstone Elsevier, 2009: 204-12. ISBN 978-0 443-10144-1. Martin MV. The significance of the bacterial contamination of dental unit water systems. Br Dent J 1987;163(5):152-4. Martin MV. An end to antimicrobial prophylaxis against infective endocarditis for dental procedures? Br Dent J 2008;2004(3):107. Martin MV, Butterworth ML, Longman LP. Infective endocarditis and the dental practitioner: a review of 53 cases involving litigation. Br Dent J 1997;182:465-8. Manzella JP, McConville JH, Valenti W, Menegus MA, Swierkosz EM, Arens M. An outbreak of herpes simplex virus I gingivostomatitis in a dental hygiene practice. JAMA 1984;(15):2019-22. Marshall DA, Moussa KM, Sanders PA. Streptococcal arthritis and erysipelas complicating dental extraction. Br J Rheumatol 1993;32(1):83-4. Martin MV, Hardy P. Two cases of oral infection by methicillin-resistant Staphylococcus aureus. Br Dent J 1991;170:63-4. Martiny H, Floss H, Zuhlsdorf B. The importance of cleaning for the overall results of processing endoscopes. J Hosp Infect 2004;56(Suppl. 2):S16-S22. Marques Da Silva R, Caugant DA, Josefsen R, Tronstad L, Olsen I. Caracterization of Streptococcus constellatus strains recovered from a brain abscess and periodontal pockets in an immunocompromised patient. J Periodontal 2004;75:1720-3. Mast ST, Woolwine J, Gerberding JL. Efficacy of gloves in reducing blood volumes transferred during simulated needlestick injury. J Infect Dis 1993;168:1589-92. Mazzola PG, Vessoni Penna TC, Martins AMS. Determination of decimal reduction time (D value) of chemical agents used in hospital for disinfection purposes. BMC Infect Dis 2003;3(24):1-17. McDonnell GE. Antisepsis, Disinfection and Sterilization, Types, action and resistance. Washington: ASM Press. 2007; ISBN-13: 978-1-55581-392-5. McGinley KJ, Larson EL, Leyden JJ. Composition and density of microflora in the subungual space of the hand. J Clin Microbiol. 1988; 26(5):950-3. Meurman JH, Lindqvist C. Livshotande odontogena infektioner. Tandläkartidningen 2002;94(1):18-22. Miller RL, Micik RE. Air pollution and its control in dental office. Dent Clin North Am 1978;22(3):453-76. Miller CH. Infection control. Dent Clin North America 1996;40(2):437-56. 75 (93) Miller CH, Tan CM, Beiswanger MA, Gaines DJ, Setcos JC, Palenik CJ. Cleaning dental instruments: measuring the effectiveness of an instrument washer/disinfector. Am J Dent 2000;13(1):39-43. Miller CH, Palenik CJ. Sterilization, Disinfection and Asepsis in Dentistry. In: Block SS (ed). Disinfection, Sterilization and Preservation. Fourth edition, Philadelphia: Lea & Febiger., 2001:Chapter 39. Miller CS, Avdiushko SA, Kryscio RJ, Danaher RJ, Jacob RJ. Effect of prophylatic valacyclovir on the presence of human herpesvirus DNA in saliva of healthy individuals after dental treatment. J Clin Microbiol 2005;43(5):2173-80. Mills SE. The dental unit waterline controversy: defusing the myth, defining the solutions. J Am Dent Assoc 2000;131:1427-41. Mims CA, Playfair J, Roitt I, Wakelin D, Williams R, Anderson RM. Medical Microbiology. Mosby-Year Book Europe Limited. London: Mosby. 1993. Mitchell DL, Hariri NM, Duncanson MG Jr, Jacobsen NL, McCallum RE. Quantitative study of bacterial colonization of dental casts. J Prosthet Dent 1997;78(5):518-21. Mojon P. Oral health and respiratory infection. J Can Dent Assoc 2002;68(6):340-5. Molinari JA. Hepatitis C virus infection. Dent Clin North Am 1996;40(2):309-25. Moreillon P, Que YA. Infective endocarditis. Lancet 2004 10;363(9403):139-49. Moses JJ, Lange CR, Arredondo A. Septic arthritis of the temporomandibular joint after the removal of third molars. J Oral Maxillofac Surg 1998;56:510-12. Murdoch FE, Sammons RL, Chapple IL. Isolation and characterization of subgingival staphylococci from periodontitis patients and controls. Oral Dis 2004;10:155-62. Möller Å, Dahlén G, Hallen JÅ. En metod för regelbunden rengöring och desinfektion av vattensystemet i dentala units. Tandläkartidningen 2000;92(11):44-53. Möller Å, Dahlén G. Regelbunden rengöring av unitar. Tandläkartidningen 2007;99(11):52-6. Nagao Y, Seki N, Tamatsukuri S, Sata M. Detection of hepatitis C virus in saliva before and after scaling of dental calculus. Kansenshogaku Zasshi. 2000;74(11):961-5. Nagao Y, Matsuoka H, Kawaguchi T, Ide T, Sata M. HBV and HCV infection in Japanese dental care workers. Int J Mol Med. 2008;21(6):791-9. Navazesh M. Systemic dissemination as a result of oral infection in individuals 50 years of age and older. Spec Care Dent 1995;15:11-9. Navazesh M, Mulligan R, Kono N, Kumar SKS, Nowicki M, Alves M, Mack WJ. Oral and systemic health correlates of HIV-1 shedding in saliva. J Dent Res 2010;89(10):1074-9. Neely AN, Maley MP. Survival of enterococci and staphylococci on hospital fabrics and plastic. J Clin Microbiol 2000;38(2):724-6. NICE guidelines 2008. Prophylaxis against infective endocarditis. http://www.nice.org.uk/Guidance/CG64 Nordström G. Funktionella och protetiska problem hos äldre – med fokus på helprotesen. Tandläkartidningen 2001;93(2):40-8. Normark S. Bakteriell patogenes. I: Forsgren A, Kronvall G (red). Klinisk Bakteriologi. Lund: Studentlitteratur 1996:41-50. ISBN 91-44-34141-5. 76 (93) Norrby E. Våra virus. Stockholm: Allmänna Förlaget, 1987. ISBN 91-38-90808-5. Noskin GA. Stoser V, Cooper I, Peterson LR. Recovery of vancomycin-resistant enterococci on fingertips and environmental surfaces. Infect Control Hosp Epidemiol 1996 Dec;17(12):770-2. Nyström B. The contamination of gowns in an intensive care unit. J Hosp Infect 1981;2(2):167-70. Ojajärvi J. Prevention of microbial contamination of the dental unit caused by suction into the turbine drive air lines. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996;81(1):50-2. Oksala E. Factors predisposing to oral yeast infections. Acta Odontol Scand 1990;48(1):71-4. Olsen I. Chemotaxonomy of yeasts. Acta Odontol Scand 1990;48(1):19-25. Otis LL, Cottone JA. Prevalence of perforations in disposable latex gloves during routine dental treatment. J Am Dent Assoc 1989;118(3):321-4. Owen MK. Prevalence of oral methicillin-resistant Staphylococcus aureus in an institutionalized veterans population. Spec Care Dentist 1994;14(2):75-9. Pallasch TJ. Antibiotic prophylaxis: problems in paradise. Dent Clin North Am 2003;47(4):665-79. Palmersheim LA, Hamilton MK. Fatal cavernous sinus thrombosis secondary to third molar removal. J Oral Maxillofac Surg 1982;40(6):371-6. Pankhurst CL, Philpott-Howard J. The environmental risk factors associated with medical and dental equipment in the transmission of Burkholderia (Pseudomonas) cepacia in cystic fibrosis patients. J Hosp Infect 1996;32(4):249-55. Pankhurst CL, Coulter W, Philpott-Howard JN, Surman-Lee S, Warburton F, Challacombe S. Evaluation of potential risk of occupational asthma in dentists exposed to contaminated dental unit waterlines. Prim Dent Care 2005;12(2):53-9. Pasquarella C, Versonesi L, Castiglia P, Liguori G, Montagna MT et al. Italian multicentre study on microbial environmental contamination in dental clinics: a piolot study. Sci Total Environ 2010;408(19):4045-51. Paster BJ, Boches SK, Galvin JL, Ericson RE, Lau CN et al. Bacterial diversity in human subgingival plaque. J Bacteriol 2001;183(12):3770-83. Payne LZ, Wolfe SW. Septic arthritis in a normal interphalangeal joint following a dental procedure. J Hand Surg 1994;19(5).815-6. Pereira ML, Carmo LS, Souki MQ, Santos EJ, Carvalho MAR, Bergdoll MS. Staphylococci from dental personnel. Braz Dent J 1999;10(1):1-5. Persson M, Bäckman N, Lundström K, Resare P. Återanvändning av ortodontiska bågfästen – medicintekniska överväganden. Tandläkartidningen 1999;99(14):35-8. Petti S, Tarsitani G. Detection and quantification of dental unit water line contamination by oral streptococci. Infect Control Hosp Epidemiol 2006;27(5):504-9. Porteous NB, Terezhalmy GT. Tuberculosis: infection control/exposure control issues for oral healthcare workers. J Contemp Dent Pract 2008;9(1):1-13. Porter SR, Lodi G. Hepatitis C virus (HCV) – an occupational risk to dentists? Br Dent J 1996;180(12):473-4. Powell GL, Runnells RD, Saxon BA, Whisenant BK. The presence and identification of organisms transmitted to dental laboratories. J Prosthet Dent 1990;64(2):235-7. Prætorius F. Orala virusinfektioner. Tandläkartidningen 2002;94(14):46-58. 77 (93) Rams TE, Feik D, Slots J. Staphylococci in human periodontal diseases. Oral Microbiol Immunol 1990;5(1):29-32. Ragin CR, Modugno F, Gollin SM. The epidemiology and risk factors of head and neck cancer: a focus on human papillomavirus. J Dent Res 2007;86(2):104-14. Rams TE, Slots J. Systemic manifestations of oral infections. In: Slots J, Taubman MA (eds). Contemporary Oral Microbiology and Immunology. St. Louis: Mosby-Year Book; 1989:500-9. Ransjö U, Hambraeus A. An instrument for measuring bacterial penetration through fabrics used for barrier clothing. J Hyg 1979;82(3):361-8. Ransjö U, Engström L, Håkansson P, Ledel T, Lindgren L, Lindqvist AL, Marcusson E, Rudbäck T. A test for cleaning and disinfection processes in a washer-disinfector. APMIS 2001;109:299-304. Ransjö U, Åneman C. Smittspridning och skyddsåtgärder. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006: 64-95. ISBN 91-85482-14-5. Ranta K, Haapasalo M, Ranta H. Monoinfection of root canal with Pseudomonas aeruginosa. Endod Dent Traumatol 1988;4(6):269-72. Rajasuo A, Perkki K, Nyfors S, Jousimies-Somer H, Meurman JH. Bacteremia following surgical dental extraction with an emphasis on anaerobic strains. J Dent Res 2004;83(2):170-4. Ray KC, Fuller ML. Isolation of mycobacterium from dental impression material. J Prosth Dent 1963;(1):93-4. Redd JT, Baumbach J, Kohn W, Nainan O, Khristova M Williams I. Patient-to-patient transmission of Hepatitis B virus assocated with oral surgery. J Infect Dis 2007:195(9):1311-4. Reinthaler F, Mascher F. Nachweis von Legionella pneumophila in dentaleinheiten. Zentralbl Bakteriol Mikrobiol Hyg B. 1986 Dec;183(1):86-8. Reinthaler FF, Mascher F. Stünzner D. Serological examinations for antibodies against Legionella species in dental personnel. J Dent Res 1988;67(6):942-3. Renton TF, Danks J, Rosenfeld JV. Cerebral abscess complicating dental treatment. Case report and review of the literature. Aust Dent J 1996;41(1):12-5. Rimland D, Parkin WE, Miller GB Jr, Schrack WD. Hepatitis B outbreak tracted to an oral surgeon. N Engl J Med 1977;296(17):953-8. Rinaggio J. Tuberculosis. Dent Clin North Am 2003;47(3):449-65. Ringberg H. Tre fall av mässling i Skåne. Smittskydd Skåne 2008,(1):5. Rintala M, Grénman S, Puranen M, Syrjänen S. Natural history of oral papillomavirus infections in spouses: a prospective Finnish HPV family study. J Clin Virol 2006;35:89-94. Ristow W, Bohl J, Lange HP, Schober R. Cranial mucormycosis with thrombosis of the sinus cavernosus. HNO 1979;27(2):63-8. Roberts GJ. Dentists are innocent! "Everyday" bacteremia is the real culprit: a review and assessment of the evidence that dental surgical procedures are a principal cause of bacterial endocarditis in children. Pediatr Cardiol 1999;20:317-25. Roberts-Harry TJ, Cass AE, Jagger JD. Ocular injury and infection in dental practice. A survey and a review of the literature. Br Dent J 1991;170(1):20-2. 78 (93) Rollof J. Mikroorganismers kamp mot immunförsvaret. Lund: Studentlitteratur 1997. ISBN 91-44-00307-2. Rosenthal S, Tager IB. Prevalence of gram-negative rods in the normal pharyngeal flora. Ann Intern Med 1975;83(3):355-7. Rossi T, Peltonen R, Laine J, Eerola E, Vuopio-Varkila J, Kotilainen P. Eradication of long-term carriage of methicillin-resistant Staphylococcus aureus in patients wearing dentures: a follow-up of 10 patients. J Hosp Infect 1996;34(4):311-20. Roth TP, Whitney SI, Walker SG, Friedman S. Microbial contamination of endodontic files received from the manufacturer. J Endod 2006;32:649-51. Rotter ML. Hygienic hand disinfection. Infect Control 1984;(5):18-22. Rowe NH, Heine CS, Kowalski CJ. Herpetic whitlow: an occupational diesaese of practicing dentists. J Am Dent Assoc 1982;105(3):471-3. Rudney JD, Neuvar EK, Soberay AH. Restriction endonuclease-fragment polymorphisms of oral viridans streptococci, compared by conventional and field-inversion gel electrophoresis J Den Res 1992;71(5):11828. Rudney JD, Larson CJ. Identification of oral mitis group streptococci by arbitrarily primed polymerase chain reaction. Oral Microbiol Immunol 1999;14(1):33-42 Saia G, Blandamura S, Bettini G, Tronchet A, Totola A et al. Occurrence of bisphosphonate-related osteonecrosis of the jaw after surgical tooth extraction. J Oral Maxillofac Surg 2010;68(4):797-804. Samaranayake LP. Re-emergence of tuberculosis and its variants: implications for dentisty. Int Dent J 2002;52(5):330-6. Samaranayake LP, Hunjan M, Jennings KJ. Carriage of oral flora on irreversible hydrocolloid elastomeric impression materials. J Prosthet Dent 1991;65(2):244-9. Sande MA, Gadot F, Wenzel RP. Point source epidemic of Mycoplasma pneumoniae infection in a prosthodontics laboratry. Am Rev Respir Dis 1975; 112(2):213-7. Saygun I, Sahin S, Ozdemir A, Kurtis B, Yapar M, Kubar A, Ozcan G. Detection of human viruses in patients with chronic periodontitis and the relationship between viruses and clinical parameters. J Periodontol 2002;73(12):1437-42. SBU 2009. Vacciner till barn. Skyddseffekter och biverkningar. En systematisk litteraturöversikt. Statens Beredning för medicisk utvärdering, 2009. ISBN 978-91-85413-28-7. SBU, 2010. Antibiotikaprofylax vid kirurgiska ingrepp. En systematisk litteraturöversikt. Stockholm: Statens beredning för medicinsk utvärdering (SBU); 2010. SBU-rapport nr 200. ISBN 978-91-85413-36-2. Scannapieco FA. Role of oral bacteria in respiratory infection. J Periodontol 1999;70(7):793-802. Scannapieco FA, Mylotte JM. Relationships between periodontal disease and bacterial pneumonia. J Periodontol 1996;67:1114-22. Scannapieco FA, Bush RB, Paju S. Associations between periodontal disease and risk for nosocomial bacterial pneumonia and chronic obstructive pulmonary disease. A systematic review. Ann Periodontol 2003;8(1):5469. Schel AJ, Marsh PD, Bradshaw DJ, Finney M, Fulford MR, Frandsen E, Østergaard E, ten Cate JM et al. 79 (93) Comparison of the efficacies of disinfectants to control microbial contamination in dental unit water systems in general dental practices across the European Union. Appl Environ Microbiol 2006;72(2):1380-7. Schneider RT. In quest of clean compressed air. Hydraulics Pneumatices 1995; 48:53-4. Schoenen D, Wehse A. Mikrobielle Kontamination des Wassers durch Rohr- und Schlauchmaterialien. 1. Mitteilung: Nachweis von Koloniezahlveränderungen Zbl Bakt Hyg 1988;186:108-17. Schuman NJ, Turner JE. Brain abscess and dentistry: A review of the literature. Quintessence Int 1994; 12(6):411-3. Scott DA, Coulter WA, Lamey PJ. Oral shedding of herpes simplex virus type 1: a review. J Oral Pathol Med 1997;26:441-7. Scully C, Samaranayake L. Clinical Virology in Oral Medicine and Dentistry. Cambridge: Cambridge University Press. 1992. ISBN 0-521 401-2 X. Scully C, Greenspan JS. Human immunodeficiency virus (HIV) transmission in dentistry. J Dent Res 2006;85(9):794-800. Sedgley CM, Samaranayake LP. Oral and oropharyngeal prevalence of Enterobacteriacea in humans: a review. J Oral Pathol Med 1994;23:104-13. Sedghizadeh PP, Kumar SK, Gorur A, Schaudinn C, Shuler CF, Costerton JW. Microbial biofilms in osteomyelitis of the jaw and osteonecrosis of the jaw secondary to bisphosphonate therapy. J Am Dent Assoc 2009;140(10):1259-65. Shaw AB. Tuberculosis in medical and dental students; a study at Guy´s hospital. Lancet 1952;(2):400-4. Shaw FE, Barrett, CL, Hamm R, Peare RB, Coleman PJ, Hadler SC, Fields HA, Maynard JE. Lethal outbreak of hepatitis B in a dental practice. JAMA 1986;255(23):3260-4. Sjöberg L, a. Mikrobiologisk renhet hos medicintekniska produkter i hälso- och sjukvården samt tandvården. Sidorna 304-21 i Att förebygga vårdrelaterade infektioner - ett kunskapsunderlag. Socialstyrelsen 2006. Sjöberg L, b. Medicintekniska produkter från ett vårdhygieniskt perspektiv – förutsättningar och krav. Sidorna 322-9 i Att förebygga vårdrelaterade infektioner Ett kunskapsunderlag. Socialstyrelsen 2006. Skadhauge K. Principper for sterilisation og desinfektion i sygehus og almen-praksis. Köpenhamn: Munksgaard 1973. ISBN 87-16-01354-3. SLF 2004. www.slf.se. SLF 2006. www.slf.se/hepatit B, läkarinformation SFS. Statens livsmedelsverks föreskrifter om dricksvatten. Statens livsmedelsverks författningssamling 2001:30. Uppsala: Livsmedelsverket 2001. SIS-TR3:2002. Disk- och spoldesinfektorer – provning av rengöringsförmåga. SIS Förlag AB, 118 80 Stockholm. SIS-TR 2005. Textilhandboken – avsedd för textilier inom vård och omsorg. Svenska standardiseringsinstitutet Teknisk rapport SIS-TR 11:2005. SIS HB. Steriliseringsprocesser – Validering och rutinkontroll inom svensk hälso-, sjuk och tandvård. SIS Handbok 600, Stockholm: SIS Förlag. ISBN 91-7162-689-1. SMI 2002. Munpenslar trolig orsak till pseudomonasinfektioner. Smittskyddsinstitutets tidskrift ”Smittskydd” 2002; (2):25. 80 (93) SMI 2009a. www.smittskyddsinstitutet.se/sjukdomar/ SMI 2009b. Epidemiologisk årsrapport 2008. SMI-tryck 167-2009. ISSN 1400-3473. SMI2009c. www.smittskyddsinstitutet.se/amnesomraden/vaccinationer/vaccinationer-a-o/humantpapillomvirus-hpv/ SMI 2012. www.smittskyddsinsttutet.se/statistik/ Smith A. Occupational health: are microbes getting up your nose? Br Dent J 2000;189(12):660. Smith A, Dickson M, Aitken J, Bagg J. Contaminated dental instruments. J Hosp Infect 2002;51:233-5. Smith WH, Davies D, Mason KD, Onions JP. Intraoral and pulmonary tuberculosis following dental treatment. Lancet 1982;(1):842-3. Smith AJ, Hood J, Bagg J, Burke FT. Water, water everywhere but not a drop to drink? Br Dent J 1999;186(1):12-4. Smith AJ, Jackson MS, Bagg J. The ecology of Staphylococcus species in the oral cavity.J Med Microbiol 2001;50:940-6. Smith AJ, Brewer A, Kirkpatrick P, Jackson MS, Young J, Watson S, Thakker B. Staphylococcal species in the oral cavity from patients in a regional burns unit. J Hosp Infect 2003;55(3):184-9. Smith A, Letters S, Lange A, Perrett D, McHugh S, Bagg J. Residual protein levels on reprocessed dental instruments. J Hosp Infect 2005;61:237-41. Sofou A, Larsen T, Fiehn NE, Öwall B, a. Contamination level of alginate impressions arriving at a dental laboratory. Clin Oral Investig 2002;6:161-5. Sofou A. Larsen T, Öwall B, Fiehn NE, b. In vitro study of transmission of bacteria from contaminated metal models to stone models via impressions. Clin Oral Investig 2002;6:166-70. SoS 1998. Vårdrelaterade infektioner. En verksamhetsöversyn. SoS-rapport 1998:19. ISBN 91-7201-303-6. SoS 2012. Rekommendationer för preventiva insatser mot tuberkulos – hälsokontroll, smittspårning och vaccination. Socialstyrelsen, artikelnr. 2012-3-16. ISBN 978-91-87169-13-7. Socialstyrelsens beställningsservice, 120 88 Stockholm. www.socialstyrelsen.se/publikationer Solberg CO. Spread of Staphylococcus aureus in hospitals: causes and prevention. Scand J Infect Dis 2000;32:587-95. SOSFS 2006:22. Socialstyrelsens föreskrifter om vaccination av barn. www.socialstyrelsen.se SOSFS 2006:26. Socialstyrelsens föreskrifter och allmänna råd om hantering av smittförande avfall från hälsooch sjukvården. www.socialstyrelsen.se SOSFS 2007. Basal hygien inom hälso- och sjukvården m.m. Socialstyrelsens författningssamling 2007:19 (M). Spencer I. Personligt meddelande 2009. [email protected] SS-EN 149:2001. Andningsskydd-filtrerande halvmasker mot partiklar – fodringar, provning, märkning. 20105-04. SS-EN 13060. Beteckning: SS-EN 13060:2004+A1:2009, Sterilisering av medicintekniska produkter - Små ångsterilisatorer. Fastställd: 2009-05-25. SS-EN 15883. Beteckning: SS-EN ISO 15883-1:2009, Disk- och spoldesinfektorer Del 1: Allmänna krav, definitioner och provningsmetoder (ISO 15883-1:2006). Stenderup A. Oral Mycology. Acta Odontol Scand 1990;48 (1):3-10. 81 (93) Strom BL, Abrutyn E, Berlin JA, Kinman JL, et al. Dental and cardiac risk factors for infective endocarditis. A population-based, case-control study. Ann Intern Med 1998;129(10):761-9. Struwe J (a). Vårdrelaterade infektioner. I: Ekdahl K, Giesecke J (red). Smittskydsboken. Lund: Studentlitteratur 2003:341-48. ISBN 91-44-04197-7 Struwe J (b). Infektioner av intresse för tandvård. I: Zimmerman M (red). Hygien och smittskydd i tandvården. 2:a uppl. , Stockholm: Förlagshuset Gothia AB, 2003:78-101. ISBN 91-7205-357-7. Struwe J, Zimmerman M. Förebyggande av infektioner hos personal. I: . Zimmerman M (red). Hygien och smittskydd i tandvården, 2: a uppl. Stockholm: Gothia AB, 2003:169-72. ISBN 91-7205-357-7. Suzuki J, Komatsuzawa H, Sugai M, Suzuki T, Kozai K, Miyake Y, Suginaka H, Nagasaka N. A long-term survey of methicillin-resistant Staphylococcus aureus in the oral cavity of children. Microbiol Immunol 1997;41(9):681-6. Syrjänen S. Humana papillomvirus och orala infektioner. Tandläkartidningen 2006;98(2):40-8. Szymaska J. Endotoxin level as a potential marker of concentration of Gram-negative bacteria in water effluent from dental units and in dental aerosol. Ann Agric Environ Med 2005;12(2):229-32. Sällberg M. Oral Virology. In: RL Lamont et al (ed). Oral Microbiology and Immunology. Washington: ASM Press2006:295-332. ISBN-10:1-55581-262-7. Tammelin A, Hambraeus A. Infektioner i sår och operationsområde efter operation. I: Att förebygga vårdrelaterade infektioner - ett kunskapsunderlag, Stockholm: Socialstyrelsen 2006:139-66. ISBN 91-85482-14-5. Tawara Y, Honma K, Naito Y. Methicillin-resistant Staphylococcus aureus and Candida albicans on denture surfaces. Bull Tokyo Dent Coll 1996;37(3):119-28. Taylor LJ. An evaluation of handwashing techniques. Nurs Times 1978(2):54-5. Thomas MV, Jarboe G, Frazer RQ. Infection control in the dental office. Dent Clin North Am 2008;52:60928. Thomás Carmona I, Diz Dios P, Scully C. Efficacy of antibiotic prophylactic regimens for the prevention of bacterial endocarditis of oral origin. J Dent Res 2007;86(12):1142-59. Thougaard H, Varlund V, Madsen RM. Grundläggande Mikrobiologi med livsmedelsapplikationer. Lund: Studentlitteratur 2001. ISBN 91-44-01569-0. Thyne GM, Ferguson JW. Antibiotic prophylaxis during dental treatment in patient with prosthetic joints. J Bone Joint Surg Br. 1991; 73-B(2):191-4. Trick WE,Veronon MO, Hayes RA, Nathan C, Rice TW, Peterson BJ et al. Impact of ring wearing on hand contamination and comparison of hand hygiene agents in a hospital. Clin Infect Dis 2003,36(11):1383-90. Udaondo P, Garcia-Delpech S, Diaz-Llopis M, Salom D, Garcia-Pous M, Strottmann JM. Bilateral intraorbital abscesses and cavernous sinus thromboses secondary to Streptococcus milleri with a favorable outcome. Ophthal Plast Reconstr Surg 2008;24(5):408-10. Valenti WM, Trudell RG, Bentley DW. Factors predisposing to oropharyngeal colonization with gram-negative bacilli in the aged. N Engl J Med 1978;298;1108-11. Walder M. Desinfektion av ytor och föremål. sidorna 368-78 I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag, Stockholm: Socialstyrelsen 2006. ISBN 91-85482-14-5. 82 (93) Waldman BJ, Mont MA, Hungerford DS. Total knee arthroplasty infections associated with dental procedures. Clin Orthop Relat Res 1997; 343:164-72. Wahlin YB, Holm AK. Changes in the oral microflora in patients with acute leukemia and related disorders during the period of induction therapy. Oral Surg Oral Med Oral Pathol 1988;65:411-7. Wahlin YB, Nihlson A, Rundquist L. Odontologiskt omhändertagande av patienter med maligna hematogena sjukdomar. Sidorna 28-46, I: Jontell M, Koch G (red). Odontologiskt omhändertagande av immunosupprimerade patienter. Konsensuskonferens i Örebro 5-7 oktober 1995. Svenska Sjukhustandläkarföreningen. ISBN 91-630-3921-4. Walker JT, Bradshaw DJ, Bennett AM, Fulford MR, Martin MV, Marsh PD. Microbial biofilm formation and contamination of dental-unit water systems in general dental practice. Appl Environ Microbiol 2000;66(8):3363-7. Walker JT, Bradshaw DJ, Finney M, Fulford MR, Frandsen E, Östergaard E, Ten Cate JM et al. Microbiological evaluation of dental unit water systems in general dental practice in Europe. Eur J Oral Sci 2004;112:412-8. Walker JT, Dickinson J, Sutton JM, Raven NDH, Marsh PD. Cleanability of dental instruments – implications of residual protein and risk from Creutzfeldt-Jakob disease. Br Dent J 2007;203(7):395-401. Walker JT, Marsh PD. Microbial biofilm formation in DUWS and their control using disinfectants. J Dent 2007;35(9):721-30. Wang CC, Morishima C, Chung M, Engelberg R, Krantz E, Krows M, Sullivan DG, Gretch DR, Corey L. High serum hepatitis C virus (HCV) RNA load predicts the presence of HCV RNA in saliva from HGM, Götz HM, Janssen HLA, Schalm SW et al. Paired measurements individuals with chronic and acute HCV infection. J Infect Dis. 2006;193(5):672-6. Van der Eijk AA, Niesters of quantitative hepatitis B virus in saliva and serum of chronic hepatitis B patients: implications for saliva as infectios agent. Journal of Clinical Virology 2004;29:92-4. 2004. Van der Meer JTM, van Wijk W, Thompson J et al (a). Efficacy of antibiotic prophylaxis for prevention of native-valve endocarditis. Lancet 1992;339:135-9. Van der Meer JMT, Thompson J, Valkenburg HA, Michel MF. Epidemiology of bacterial endocarditis in the Netherlands. II Antecedent procedures and use of prophylaxis. Arch Intern Med 1992;152:1869-73. Watson CM, Whitehouse RL. Possibility of cross conamination between dental patients by means of the saliva ejector. J Am Dent Assoc 1993; 124(april) 77-80. Weightman NC, Lines LD. Problems with the decontamination of dental handpieces and other intra-oral dental equipment in hospital. J Hosp Infect 2004;56:1-5. Weil RB, Lyman DO, Jackson RJ, Bernstein B. A hepatitis serosurvey of New York dentists. N Y State D J 1977;43(10):587-90. Verran J, Kossar S, McCord JF. Microbiological study of selected risk areas in dental technology laboratories. J Dent 1996;24(1-2):77-80. Verran J, Winder C, McCord JF, Maryan CJ. Pumics slurry as a crossinfection hazard in nonclinical (teaching) dental technology laboratories. Int J Prosthodont 1997;10(3):283-6. Verran J, McFord JF, Maryan C, Taylor RL. Microbiological hazard analysis in dental technology laboratories. 83 (93) Eur J. Prosthodont Rest Dent 2004; 12(3):115-20. Whiley RA, Beighton D, Winstanley TG, Fraser HY, Hardie JM. Streptococcus intermedius, Streptococcus constellatus and Streptococcus anginosus (the Streptococcus milleri group): association with different body sites and clinical infection. J Clin Microbiol 1992;30:243-4. Whitworth CL, Martin MV, Gallagher M, Worthington HV. A comparison of decontamination methods used for dental burs. Br Dent J 2004;197:635-40. Whitworth CL, Davies K, Palmer NOA, Martin MV. Research summary: Decontamination of Siqveland matrix bands. Br Dent J 2007;202(4):220-1. Online article number E12, Br Dent J 2007;202:E12. Williams HN, Paszko-Kolva C, Shahamat M, Palmer C, Pettis C, Kelley J. Molecular techniques reveal high prevalence of Legionella in dental units. J Am Dent Assoc. 1996;127(8):1188-93. Wilson J. The aetiology, diagnosis and management of denture stomatitis. Br Dent J 1998;185:380-4. Witt S, Hart P. Cross-infection hazards associated with the use of pumice in dental laboatories. J Dent. 1990;18(5):281-3. Wood PR, Cross infection control in dentistry: a practical illustrated guide. London: Wolfe Publishing Ltd 1992. ISBN 0-7234-1767-9. Wrangsjö K, Boman A. Handskar i tandvården. Kunskapsdokument från KDM – VII, Kunskapscenter för dentala material, Socialstyrelsen, Stockholm 2004. Wray D, Ruiz F, Richey R, Stokes T. Prophylaxis against infective endocarditis for dental procedures – summary of the NICE-guidelines. Br Dent J 2008;204(10):555-7. Wretlind B. Pseudomonas. I: Forsgren A, Kronvall G (red). Klinisk bakteriologi, Lund: Studentlitteratur 1996:398-401. ISBN 91-44-34141-5. Wårdh I. Munhälsovårdsarbete inom omvårdnad. Tandläkartidningen 2003;95(3):46-49. Yagiela JA. Prophylactic antibiotics: cardiac and prosthetic considerations. J Calf Dent Assoc 1995;23(10):2940. Yagupsky P, Nolte FS. Quantitative aspects of septicemia. Clin Microbiol Rev 1990;3(3):269-79. Ylijoki S, Suuronen R, Jousimies-Somer H, Meurman JH, Lindqvist C. Differences between patients with or without the need for intensive care due to severe odontogenic infections. J Oral Maxillofac Surg 2001;59(8):867-72. Younai FS. Health care-associated transmission of hepatitis B & C viruses in dental care (Dentistry). Clin Liver Dis 2010;14:93-104. Zachriades N, Vairaktaris E, Mezitis M, Rallis G, Kokkinis C, Moschos M. Orbital abscess: visual loss following extraction of a tooth – case repot. Oral Surg Oral Med Oral Pathol Oral Radiiol Endod. 2005;100(4)e70-3. Zimmerman M. Barriärer. I: Zimmerman M (red), Hygien och smittskydd i tandvården. 2:dra uppl. Stockholm Gothia AB, 2003:145-53. ISBN 91-7205-357-7. Åhrén C, Torell E, Burman LG. Antibiotikaresistena bakterier i vården. I: Att förebygga vårdrelaterade infektioner: ett kunskapsunderlag. Stockholm: Socialstyrelsen 2006:96-121. ISBN 91-85482-14-5. 84 (93) Läsa vidare Smittskydd • • • • Att förebygga vårdrelaterade infektioner, ett kunskapsunderlag. Socialstyrelsen 2006. ISBN 91-85482-14-5. Hygien och Smittskydd i Tandvården. 2:a upplagan, Red. M Zimmerman. Gothia AB 2003. ISBN 917205-357-7. Klinisk Mikrobiologi, infektioner, immunologi, sjukvårdshygien, 3:e upplagan. E. Ericson och T. Ericson, Liber AB 2003. ISBN 91-47-05127-2 Smittskyddsboken, K. Ekdahl och J. Giesecke (red), Studentlitteratur 2003. ISBN 91-44-04197-7. Mikrobiologi • • • • • • Introduktion till Mikrobiologi – med inriktning mot naturvetare och farmaceuter. 1:a upplagan K Carlsson, C Linder. Studentlitteratur, 2008. ISBN 978-91-44-04846-8. Grundläggande immunologi, 3:e upplagan, Brändén H, Andersson J. Studentlitteratur, 2004. ISBN 91-4403073-8. Miller CH, Palenik CJ. Infection Control and Management of Hazardous Materials for the Dental Team. Mosby/Elsevier, St. Louis, Missouri, USA. Fourth edition, 2010. ISBN 978-0-323-05631-1. Mikroorganismers kamp mot immunförsvaret. Rollof J, Studentlitteratur 1997. ISBN 91-44-00307-2. Oral Microbiology, 5:th edition, Marsh PD, Martin MV. Elsevier LtD 2009. ISBN 978-0-443-10144-1. Oral Microbiology and Immunology, 1:st edition, Lamont RJ, Lantz MS, Burne RA, LeBlanc DL (editors), ASM Press, Washington DC, USA, 2006. ISBN-13: 978-1-55581-262-1. 85 (93) Bilaga Axplock ur aktuella lagar och föreskrifter Till författningar räknas i första hand lagar och förordningar, men även föreskrifter och allmänna råd, som ges ut av statliga myndigheter som Socialstyrelsen., räknas hit. Riksdagen beslutar om lagar medan regeringen utfärdar förordningar. För att regeringen ska ha rätt att ensam utfärda en förordning krävs ett bemyndigande från Riksdagen. Bemyndiganden finns i regeringsformen men kan också stå i en lag. Regeringen får enligt Tandvårdslagen meddela ytterligare föreskrifter om tandvården som behövs till skydd för enskilda eller för tandvårdens bedrivande i övrigt. Regeringen får också överlåta åt Socialstyrelsen att meddela föreskrifter. Lagar, förordningar och föreskrifter är bindande. Socialstyrelsens föreskrifter liksom andra statliga myndigheters föreskrifter måste alltså följas. Aktuella webbplatser: www.riksdagen.se www.regeringen.se www.socialstyrelsen.se www.smittskyddsinstitutet.se www.lakemedelsverket.se www.arbetsmiljoverket.se Tandvårdslagen (1985:125) Tandvårdslagen (TL) är motsvarigheten till Hälso- och sjukvårdslagen (1982:763) (HSL). Orsaken till att tandvården har en egen lag är historisk. Tandvårdslagen är nämligen en vidareutveckling av den folktandvårdslag som utfärdades år 1973 i anslutning till att den allmänna tandvårdsförsäkringen infördes. Som framgick av namnet riktade sig folktandvårdslagen endast till landstingen. I lagen gavs landstingen ett vårdansvar för alla barn och ungdomar till och med 19 års ålder. Tandvården för dessa grupper skulle vara kostnadsfri, medan de vuxna omfattades av tandvårdsförsäkringen. Tandvårdsutredningen 1978 (TU 78) förslog bl.a. att tandvården skulle ingå i Hälso- och sjukvårdslagen. Regeringen ansåg emellertid inte att tiden var mogen för att bestämmelserna i Hälso- och sjukvårdslagen även skulle omfatta privat vård. Av tandvårdslagen framgår att tandvården ska bedrivas så att den uppfyller kravet på en god tandvård. Detta innebär bl.a. att den ska vara av god kvalitet med en god hygienisk standard och att särskild vikt ska läggas vid förebyggande åtgärder. Tillägget om god hygienisk standard trädde i kraft den 1 juli 2006 och innebär en väsentlig skärpning av tidigare hygienkrav och ska ses som ett uttryck för en ökad insikt om hygienens betydelse för patientsäkerheten. Motsvarande skrivning finns i Hälso- och sjukvårdslagen. 86 (93) Patientsäkerhetslagen (2010:659) Av Patientsäkerhetslagen framgår att den som tillhör hälso- och sjukvårdspersonalen har ett uttalat eget yrkesansvar och ska utföra sitt arbete i överensstämmelse med vetenskap och beprövad erfarenhet. Sambandet mellan god hygien och patientsäkerhet är otvetydigt. Skyldigheten att bedriva tandvård med god hygienisk standard faller således inom ramen för vad som omfattas av begreppet vetenskap och beprövad erfarenhet. Smittskyddslagen (2004:168) och Smittskyddsförordningen (2004:255) Syftet med smittskyddslagen är att begränsa förekomsten av smittsamma sjukdomar inom landet. Detta innebär att man ska försöka förhindra vidare spridning från personer som bär på det aktuella smittämnet och att smittade personer ska hittas för att erbjuda behandling eller på annat sätt begränsa fortsatt spridning. Samhällets smittskydd ska alltså tillgodose befolkningens behov av skydd mot spridning av smittsamma sjukdomar. Socialstyrelsen ansvarar för samordning av smittskyddet, för att ta de initiativ som krävs för att upprätthålla ett effektivt smittskydd samt för att följa och vidareutveckla smittskyddet. Smittskyddsinstitutet ska som expertmyndighet följa och analysera det epidemiologiska läget och föreslå åtgärder för att landets smittskydd ska fungera effektivt. I varje landsting ska det finnas en smittskyddsläkare. Smittskyddslagen ger smittskyddsläkaren en mycket stark ställning i smittskyddsarbetet där hon/han utgör en egen myndighet. I smittskyddsläkarens arbetsuppgifter ingår att planera, organisera och leda smittskyddsarbetet samt att undervisa, ge råd till hälso- och sjukvårdspersonal samt se till att allmänheten har tillgång till den information och de råd som behövs, för att var och en ska kunna skydda sig mot smitta som kan hota liv eller hälsa. Är man tveksam i en smittskyddsfråga kan man alltid rådgöra med smittskyddsläkaren. Behandlande läkare ska ge den som bär på eller misstänks bära på en smittsam sjukdom som omfattas av bestämmelserna i smittskyddslagen individuellt utformade medicinska och praktiska råd om hur han eller hon ska undvika att utsätta andra för smittrisk. Förhållningsreglerna vid en allmänfarlig sjukdom ska meddelas skriftligt så snart det är möjligt samt föras in i den undersöktes patientjournal. Läkaren ska så långt som det är möjligt se till att förhållningsreglerna följs. En patient som bär på en allmänfarlig sjukdom som omfattas av smittskyddslagen är således skyldig att informera behandlande tandvårdspersonal om sin smitta. Ett problem i detta sammanhang är att ett förhållandevis stort antal individer är bärare av allmänfarliga sjukdomar utan att känna till detta. Något lagstagat hinder att utöva sitt yrke finns inte för tandläkare eller annan hälso- och sjukvårdspersonal, som är bärare av en allmänfarlig sjukdom men behandlande läkares förhållningsregler måste alltid följas vilket kan leda till att man inte ska utöva sitt yrke. Det finns inte heller något hinder för en smittad att utbilda sig för ett yrke inom vården. Det är emellertid viktigt att smittbäraren diskuterar sitt yrkesval med behandlande läkare. 87 (93) Förhållningsregler enligt smittskyddslaglagstiftningen Förhållningsreglerna får endast avse. 1. 2. 3. 4. 5. 6. 7. 8. inskränkningar som gäller arbete, skolgång eller deltagande i viss annan verksamhet förbud mot att donera blod och organ förbud mot att låna ut eller på annat sätt överlåta begagnade injektionsverktyg skyldighet att informera vårdgivare och sådana som utför icke-medicinska ingrepp om att man är smittbärare skyldighet att informera sexualpartner om att man är smittbärare skyldighet att vid sexuella kontakter iaktta ett beteende som minimerar risken för smittspridning skyldighet att iaktta särskilda hygienrutiner skyldighet att hålla regelbunden kontakt med behandlande läkare. Tandläkare som grupp har ingen specifik skyldighet enligt smittskyddslagen att rapportera till läkare om misstanke om att en smittosam sjukdom föreligger. Det framgår emellertid av smittskyddslagen att hälso- och sjukvårdspersonal inkl. tandvårdspersonal ska vara uppmärksamma på förekomsten av smittsamma sjukdomar och vidta de åtgärder som kan krävas från smittskyddssynpunkt. Vidare framgår det att smittskyddet, andra berörda myndigheter, läkare samt annan hälso- och sjukvårdspersonal ska samverka för att förebygga och begränsa utbrott eller spridning av smittsamma sjukdomar. Eftersom det förekommer att patienter som är smittbärare först identifieras i tandvården, bör tandläkare remittera patienter till läkare om misstanke om smittosam sjukdom uppstår. Ser tandläkaren en förändring i munhålan som kan leda till misstanke om t.ex. HIV bör tandläkaren konsultera en kollega med kompetens inom området. Anmälningspliktiga sjukdomar ska anmälas eller bli föremål för smittspårning. Anmälan ska utan dröjsmål göras av laboratoriet, som utfört analysen och behandlande läkare till smittskyddsläkaren i respektive län samt till Smittskyddsinstitutet. Tandläkare bör således i frågor som faller inom ramen för smittskyddslagen samverka med behandlande läkare. Tandläkaren kan även vid oklarheter vända sig direkt till landstingets smittskyddsläkare. Förteckning över anmälningspliktiga sjukdomar Flertalet anmälningspliktiga sjukdomar är också smittspårningspliktiga. Det innebär att behandlande läkare (eller kurator) ska fråga om var eller av vem patienten kan ha blivit smittad och till vem smittan kan ha förts vidare. Detta görs i syfte att begränsa spridningen av sjukdomen. Om behandlande läkare inte kan fullgöra smittspårningen kan smittskyddsläkaren ta över uppgiften. I tabell 1 presenteras anmälningspliktiga sjukdomar av intresse för tandvården. Den fullständiga listan och aktuell information om anmälningspliktiga sjukdomar finns på Smittskyddsinstitutets hemsida (www.smittskyddsinstitutet.se). 88 (93) Tabell 1 Anmälningspliktiga sjukdomar av intresse för tandvården. Med (S) anges vilka sjukdomar som också är smittspårningspliktiga. Sjukdomar Difteri (S) EHEC (Enterohemorragisk E. Coliinfektion)(S) Pertussis (kikhosta) (S) Pneumokocker (penicillinresistenta) (S) ESBL (samlingsnamn på antibiotikaresistenta tarmbakterier) Fågelinfluensa (S) Rubella (Rödahund) (S) Hepatit A-E (S) SARS (S) HIV(HTLVIII) (S) Shigellos (bacillärdysenteri) (S) Streptokocker– invasiv infektion GAS (Grupp A Streptokocker) Syfilis (S) Tuberkulos (S) Pneumokockinfektion (invasiv) HTLV (I och II) (Humant Lymfotropt Virus) (S) Legionellainfektion (S) MRSA (meticillinresistenta gula stafylo-kocker) Mykobakterier, atypiska (S) Morbilli (Mässling) (S) Parotit (Påssjuka) (S) Vancomycinresistenta enterokocker (VRE) A (H1N1)2009 (den nya influensan ”svininflu(S) ensan” (¤)) ¤: Data om antal influensafall kommer från Smittskyddsinstitutets (SMI) webbaserade anmälningssystem, SmiNet. Lagen (1993:584) om medicintekniska produkter Med en medicinteknisk produkt avses i lagen en produkt som enligt tillverkarens uppgift ska användas, separat eller i kombination med annat, för att bl.a. hos människor påvisa, förebygga, övervaka, behandla eller lindra en sjukdom eller kompensera för en skada eller ett funktionshinder. I tandvården används ett mycket stort antal medicintekniska produkter alltifrån förhållandevis enkla produkter som förbrukningsmaterial till instrument och komplexa produkter som avancerade röntgenapparater. Komplexa medicintekniska produkter ställer höga krav på användarens kompetens men också på genomtänkta hygienrutiner. Även om de medicintekniska produkterna fortlöpande utvecklas, är skötseln ofta komplicerad och kan innebära hygieniska problem och särskilt gäller detta håliga instrument som hand- och vinkelstycken, blästerspetsar samt arbetsdelen till tandsaneringsinstrument. Kraven på validering och prestandakontroll av autoklaver och diskdesinfektorer är förankrade i det medicintekniska regelverket. Tillsynen av de medicintekniska produkterna utövas av Läkemedelsverket medan Socialstyrelsen utövar tillsynen över användning av de medicintekniska produkterna samt över egentillverkade medicintekniska produkter. 89 (93) Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter (innehåller krav på tandtekniska arbeten) Tandtekniska arbeten är medicintekniska produkter och ska vara av hög kvalitet som är en förutsättning för en god och säker tandvård. Tandteknikerna innehar en viktig roll i tandvården men betraktas inte som hälso- och sjukvårdspersonal. Tandteknisk verksamhet står under Läkemedelsverkets tillsyn och är att se som tillverkning av specialanpassade medicintekniska produkter. Verksamheten ska alltså leva upp till kraven i det medicintekniska regelverket. Av detta framgår bl.a. när det gäller infektion och mikrobiologisk kontamination att riskerna för patient, användare eller andra personer ska ha eliminerats eller vara så små som möjligt. Vidare sägs att konstruktionen ska medge enkel hantering samt när så behövs under användningen minimera risken för att produkten kontamineras av patienterna eller att patienterna infekteras av produkten. Tandklinikerna och laboratorierna bör vara väl underrättade om varandras hygienrutiner av tandtekniska arbeten. I praktiken innebär detta att tandläkare och tekniker måste samråda och gemensamt utarbeta rutiner för att uppnå en optimal hygiennivå på de tandtekniska arbetena. Tandläkaren, som enligt patientsäkerhetslagen (2010:659) har det slutgiltiga patientansvaret, måste således vara medveten om vilken hygiennivå som det tandtekniska laboratoriet tillämpar. Hygienrutinerna ska framgå av det tandtekniska laboratoriets kvalitetssystem. Socialstyrelsens föreskrifter (SOSFS 2008:1) om användning av medicintekniska produkter i hälso- och sjukvården I föreskriften ställs krav på rutiner i hälso- och sjukvårdens och tandvårdens ledningssystem för medicintekniska produkter. Såväl användning som hantering av den medicintekniska produkten ingår. I begreppet hantering ingår t.ex. hygien, underhåll och transporter. Särskilda krav ställs på egentillverkade medicintekniska produkter som en vårdgivare har tagit ansvar för som tillverkare och som konstruerats och tillverkats för att uteslutande användas i den egna verksamheten (Persson et al., 1999). Här ingår även befintliga medicintekniska produkter som har modifierats eller flera medicintekniska produkter som har kombinerats på ett nytt sätt som den ursprungliga tillverkaren inte har avsett. Dessa egentillverkade medicintekniska produkter ska uppfylla de krav som ställs på CE-märkta medicintekniska produkter i lagen (1993:584) om medicintekniska produkter, Läkemedelsverkets föreskrifter (LVFS 2003:11) om medicintekniska produkter, Läkemedelsverkets föreskrifter (LVFS 2001:7) om medicintekniska produkter för in vitro diagnostik, och Läkemedelsverkets föreskrifter (LVFS 2001:5) om aktiva medicintekniska implantat. Egentillverkade medicintekniska produkter ska om möjligt ha identifikationsnummer, inte ha CE-märke men ha bruksanvisningar på svenska språket. Om en negativ händelse eller ett tillbud har inträffat med en medicinteknisk produkt är förfarandet detsamma som vid övrig avvikelsehantering, dvs. en utredning görs och en bedömning av det inträffade ska anmälas. Om utredningen visar att det finns brister i verksamhetens kvalitet ska förbättringsåtgärder vidtas. Anmälan till tillverkaren samt till Läkemedelsverket om en negativ händelse eller ett tillbud med en medicinteknisk produkt ska göras så snart som möjligt. Anmälan ska göras vid funktionsfel och försämring av en produkts egenskaper eller prestanda samt vid felaktigheter och brister i märkningen eller bruksanvisningen som kan leda till eller har lett till att en patient eller en användare eller någon annan person avlider eller en allvarlig försämring av en patients, en användares eller någon annan persons hälsotillstånd. 90 (93) Anmälan om negativa händelser och tillbud med egentillverkade medicintekniska produkter ska göras till Socialstyrelsen. Vårdgivaren ska biträda Socialstyrelsen med den ytterligare information, utöver anmälan, som kan behövas och ge Socialstyrelsen möjlighet att vid behov undersöka den egentillverkade medicintekniska produkt som varit inblandad i den händelsen eller tillbudet. Lex Maria (SOSFS 2005:28) Om en patient drabbas av allvarlig skada eller utsätts för risk att drabbas av skada ska detta snarast, senast inom två månader, anmälas till Socialstyrelsens regionala enhet enligt Lex Maria. All vård innebär risker och anmälningsplikten till Socialstyrelsen har skapats för att riskerna ska identifieras och så långt som möjligt förebyggas. I Socialstyrelsens föreskrifter och allmänna råd om anmälningsskyldighet enligt Lex Maria anges vårdrelaterade infektioner som en av de sjukdomar som kan vara anmälningspliktiga enligt Lex Maria. Det framgår även att det ska finnas en fungerande avvikelsehantering dvs. rutiner för att identifiera, dokumentera och rapportera negativa händelser och tillbud samt för att fastställa och åtgärda orsaker, utvärdera åtgärdernas effekt och sammanställa och återföra erfarenheterna. Antalet vårdrelaterade infektioner i hälso- och sjukvården brukar uppskattas till ca 100 000 årligen. Någon motsvarande uppskattning av antalet vårdrelaterade infektioner i tandvården finns inte men antalet Lex Maria anmälningar är lågt och dessutom föreligger stora regionala skillnader. Det finns således goda skäl att tro att det föreligger en betydande underrapportering av vårdrelaterade infektioner i tandvården. Detta är naturligtvis olyckligt eftersom kunskaperna om omfattningen av vårdrelaterade infektioner i tandvården är bristfälliga. Om tveksamhet föreligger om en händelse ska föranleda en Lex Maria-anmälan bör Socialstyrelsens regionala enhet rådfrågas. Socialstyrelsens föreskrifter (SOSFS 2007:19) om basala hygienrutiner Det är naturligtvis omöjligt att identifiera alla individer som kan innebära risk för smittoöverföring i tandvården samt hälso- och sjukvård. Man kan således inte utesluta att ännu ej identifierade smittbärare kan finnas både bland patienter och bland personal. Tandvårdens hygienrutiner måste därför utformas på ett sätt som så långt som möjligt begränsar risken för smitta. Basala hygienrutiner • Arbetskläderna ska ha korta ärmar • Arbetskläderna ska bytas dagligen, eller vid behov oftare • Händerna och underarmarna ska vara fria från armbandsur och smycken • Händerna ska desinfekteras med ett alkoholbaserat handdesinfektionsmedel, eller något annat medel med motsvarande effekt, omedelbart före och efter varje direktkontakt med en patient • Händerna ska desinfekteras både före och efter användning av handskar • Händerna ska, om de är synligt smutsiga, tvättas med vatten och flytande tvål innan de desinfekteras • Vid vård av en patient med gastroenterit (mag-tarmkatarr) ska händerna alltid tvättas med vatten och flytande tvål före desinfektion • Händer som har tvättats ska vara torra innan de desinfekteras 91 (93) • Ett engångsförkläde av plast eller en skyddsrock ska användas, om det finns en risk för att arbetskläderna kommer i kontakt med kroppsvätskor eller annat biologiskt material • Skyddshandskar för engångsbruk ska användas vid kontakt med eller risk för kontakt med kroppsvätskor eller annat biologiskt material • Skyddshandskarna ska tas av direkt efter ett arbetsmoment och bytas ut mellan olika arbetsmoment. Socialstyrelsens föreskrifter och allmänna råd (SOSFS 2005:26) om hantering av smittförande avfall från hälso- och sjukvården Föreskriften ska tillämpas på hantering och märkning av det smittförande avfall som bl.a. uppkommer i tandvården. Med smittförande avfall menas avfall som är eller bedöms kunna vara förorenat med organiskt material från vård eller undersökning av människor med känd eller kliniskt misstänkt sjukdom som är orsakad av mikroorganismer (AFS 2005:1). Som smittförande avfall räknas t.ex. kanyler, skalpeller och rotkanalsfilar som inte behandlats så att de smittförande egenskaperna upphört. Mindre mängder blod som exempelvis kan förekomma på tork och bomullsrullar vilka använts vid konventionell tandbehandling, betraktas inte som riskavfall. Smittförande avfall kan autoklaveras för att därefter hanteras som ej smittförande avfall. Skärande/stickande avfall samlas upp i förpackningar eller behållare som dessutom skyddar mot skär- och stickskador. När en behållare fyllts enligt tillverkarens anvisningar och ska bortskaffas, måste den förslutas så att avfall eller smittämnen inte kan läcka ut. Behållaren samt eventuella ytteremballage ska förses med en väl synlig märkning. I förekommande fall ska förpackningen eller behållaren även förses med texten ”skärande/stickande avfall” i svart på gul botten. Amalgamavfall klassas som miljöfarligt avfall och måste tas om hand på särskilt sätt. Vid oklarheter om hantering av farligt avfall ska kommunens miljöenhet kontaktas. Socialstyrelsens föreskrifter och allmänna råd (SOSFS 2011:9) om ledningssystem för systematiskt kvalitetsarbete Tandvårdens målsättning är att kunna ge alla vård. Tandvårdens polikliniska karaktär med täta patientbyten och behandlingar av olika svårighetsgrad förutsätter väl fungerande hygienrutiner för en vård där varken personal eller patienter utsätts för smitta. Av Socialstyrelsens föreskrifter och allmänna råd (SOSFS 2011:9) om ledningssystem för systematiskt kvalitetsarbete framgår bl.a. att vårdgivaren (t.ex. landstingen, i vissa fall staten (tandläkarhögskolorna), vårdbolag eller enskild praktiker) ska ansvara för att det finns ett ledningssystem för verksamheten. Ledningssystemet ska användas för att systematiskt och fortlöpande utveckla och säkra verksamhetens kvalitet. Vårdgivaren ska ange hur uppgifterna som ingår i arbetet med att systematiskt och fortlöpande utveckla och säkra kvaliteten är fördelade i verksamheten. Verksamhetschefen (klinikchefen), som ansvarar för att rutiner finns och förbättras allteftersom behov uppstår, har en central roll i det systematiska kvalitetsarbetet. Rutinerna ska dels beskriva ett bestämt tillvägagångssätt för hur en aktivitet ska utföras, dels ange hur ansvaret för utförandet är fördelat i verksamheten. Hygienrutinerna ska således vara aktuella och revideras vid fastställda intervaller eller vid behov. De ska vara anpassade till verksamheten omfattning och inriktning och kan med fördel vara dokumenterade i en hygienplan. Den 92 (93) planen utgör ett viktigt led i kvalitetsarbetet och ska ge en bild av tillämpningen av de basala hygienrutinerna, övriga hygienrutiner samt egenkontrollen. En fungerande egenkontroll är en förutsättning för det systematiska kvalitetsarbetet. För egenkontrollen av klinikens hygienstandard kan man använda sig av en checklista (se exempel på sid. 8). Genomgång av checklistan bör ske var 6:e månad eller i samband med förändringar på kliniken. Arbetsmiljöverket, AFS 2005:1. Mikrobiologiska arbetsmiljörisker – smitta toxinpåverkan, överkänslighet Uppenbara risker är förknippade med tandvård. Även om risker för smitta framförallt är i fokus finns även risker förknippade med toxiner och överkänslighet. Det behövs därför alltid göras en bedömning av de risker som föreligger och åtgärder vidtas för att så långt som möjligt minimera riskerna. AFS 2005:1 innehåller bland annat regler om riskbedömning, riskbegränsning, skyddsåtgärder, dekontaminering och hantering av dekontaminerat material ch utrustning, personlig hygien, personlig skyddsutrustning, samt åtgärder vid och rapportering av ohälsa och oönskade händelser. 93 (93)