Kompendium i virologi - Ping Pong
advertisement

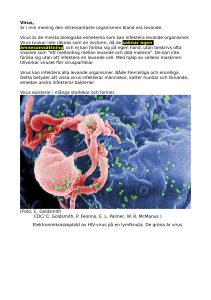
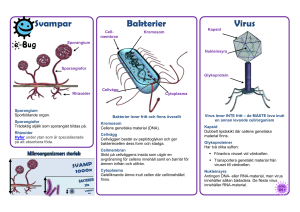
Kompendium i virologi för optikerutbildningen Gunilla Karlsson Hedestam MTC, Karolinska Institutet (2006) Vårterminen 2008 Inledning Infektioner orsakade av virus är vanliga och virus har funnit så länge människan har funnits och längre. Troligen är virus en av de första formerna av liv som utvecklades. Olika virus har sedan anpassat sig till att överleva och spridas effektivt mellan olika typer av värddjur under tidens gång. Att ständigt förändra sig och anpassa sig till omgivningen är en kontinuerlig process som virus är speciellt bra på och som gör att nya virustyper dyker upp med jämna mellanrum. Denna anpassningsförmåga är en fundamental egenskap hos virus som påverkar vår förmåga att behandla virussjukdomar och att utveckla skyddande vaccin. Virussjukdomar är vanliga, speciellt hos barn i förskoleåldern som leker tätt inpå varann. Barn stöter också på många virus för första gången och de har därför inte utvecklat någon immunitet mot dessa virus. Klassiska exempel är barnsjukdomar som RSV, mässling, påssjuka och röda hund. De virus som orsakar de senare tre sjukdomarna vaccineras barn dock mot numera så naturlig infektion med just dessa virus är ovanlig i sverige idag. Man räknar med att det finns upp emot 600 olika virus som orsakar sjukdom (mild eller allvarlig) i människa, varav man kan infekteras med vissa virus flera gånger. Ett välkänt exempel är influensa som förändrar sig så snabbt så den immunitet vi utvecklat mot en influensastam inte är effektiv mot en annan influensastam. Vill man skydda sig mot influensa kan man vaccinera sig men ett nytt vaccin måste tillverkas varje år för att följa med virusets förändringar. Målet med den här virologitexten är att ge en överblick över vad virus är, vad de består av och hur de förökar sig. Efter denna grundläggande del följer en beskrivning av de vanligaste virus som infekterar ögat och andra viktiga virusfamiljer som orsakar sjukdom i människa. Kompendiet avslutas med en beskrivning av kroppens försvar mot infektion samt strategier för vaccination och behandling. Ambitionen är att ge en ökad förståelse för virus och dess sätt att överleva samt att belysa en del av de utmaningar som möter kliniker och virusforskare idag. Virus klassificering och struktur Virus skiljer sig från bakterier på ett par väsentliga sätt. Den första skillnaden är att virus är beroende av en värdcell för att kunna föröka sig. Den andra viktiga skillnaden är att virus inte förökar sig genom delning utan genom att nya virusproteiner syntetiseras inne i värdcellen och att dessa sedan sätts ihop till nya partiklar som tar sig ut ur cellen och sprids. Viruset tar sig ut ur cellen via lys (för virus utan hölje) vilket innebär att cellen sprängs sönder, eller genom avknoppning genom cellmembranet (för virus med hölje). Virus är alltså så små och så enkla enheter att de ej själva kan föröka sig. Den extracellulära formen av virus är helt enkelt bara små ”transportpaket” som finns till för att flytta virusets genetiska material (DNA eller RNA) till en ny värdcell för maximal förökning och spridning. En lämplig värdcell kan vara en bakterie, en insektcell, en växtcell eller en cell från ett ryggradsdjur, beroende på vilket virus det handlar om. Även svampar och alger kan infekteras av virus. De virus som infekterar bakterier kallas fager och vissa bakteriofager har fått stor användning inom bioteknologin. Väl inne i värdcellen utnyttjar viruset värdcellens maskineri för proteinsyntes. Många virus tar helt enkelt över cellens proteinsyntesmaskineri så att cellen inte längre kan göra några egna proteiner utan blir en virusfabrik. Det leder till att cellen dör och elimineras av immunförsvaret. Innan detta sker har dock cellen hunnit producerat tusentals nya viruspartiklar som spridit sig och infekterat nya celler. Virus klassificeras baserat på hur de är uppbyggda. Man tar hänsyn till följande: ! ! ! ! Typ av nukleinsyra (DNA eller RNA, dubbelsträngat eller enkelsträngat) Typ av kapsid (Ikosahedral, helikal eller komplex) Förekomst av hölje eller ej Storlek (antal kapsomerer hos ikosahedrala och diameter hos helikala virus) En extracellulär viruspartikel kallas en virion eller en viruspartikel. Ett virion varierer i storlek mellan cirka 20 nm till cirka 200-300 nm och de kan således inte urskiljas i ett vanligt ljusmikroskop. Elekronmikroskop används istället för att studera virus. Den ungefärliga storleken av et typiskt virus (50 nm) i relation till celler är illustrerad nedan. Virusgenomet Virusets genom, som är väl inneslutet inuti den virala kapsiden, består av DNA eller RNA. Det är viktigt för viruset att skydda sitt genom tills det att viruset kommit in i en värdcell där genomet ska repliceras (kopieras upp/förökas). DNA virus delas upp i de virus som har ett dubbelsträngat DNA genom och de som har ett enkelsträngat DNA genom. På samma sätt klassificeras RNA virus efter om de har ett dubbelsträngat eller ett enkelsträngat RNA genom. Enkelsträngade RNA genom består vidare antingen av en minus-strängad (-) RNA genom eller en plus-strängad (+) RNA genom. Ett visst virus har alltid samma typ av genetiskt material eftersom hela virusets livscykel är anpassat efter detta. Typen av genom (DNA eller RNA och vilken typ av DNA eller RNA) hålls alltså konstant även om små förändringar i baspar (mutationer) ofta sker under virusreplikationen. Ett (+) RNA kan användas som messenger RNA (mRNA) direkt och proteintranslation sker således direkt från genomet. Det gör att virusets proteinproduktion kommer igång extremt snabbt efter att viruset tagit sig in i cellen. För virus med (-) RNA genom måste detta först omvandlas till ett mRNA innan protein tranlation kan ske. Det kräver ett enzym som cellen inte har utan som viruset bär med sig. För att kopiera upp sitt genom måste också (+) RNA virus omvandla sitt (+) RNA till (-) RNA som sedan fungerar som mall för nya (+) RNA molekyler. Även detta steg kräver ett enzym som värdcellen ej har och som viruset därför kodar för. Enzym som gör om (-) RNA till (+) RNA eller (+) RNA till (-) RNA kallas RNA-beroende RNA polymeraser och de är bara RNA virus som kodar för dessa enzym. Ytterligare en typ av virus finns, nämligen retrovirus. HIV hör till denna virusfamilj. Retrovirus har två enkel-strängade (+) RNA molekyler som genom. Dessa virus bär på ett mycket speciellt enzym som kallas omvänt transkriptas som omvandlar RNA till DNA. Eftersom detta steg aldrig sker normalt i en cell kallas enzymet ”omvänt” och virusfamiljen ”retro” (i alla andra fall omvandlas DNA till RNA). Retrovirus sätter in sitt DNA i våra egna kromosomer där de sedan använder cellens normala maskineri för att göra mRNA och proteiner. Retrovirusfamiljen och HIV beskrivs i större detalj senare i kompendiet. Kapsiden Kapsiden hos ett visst virus byggs upp av flera likadana proteiner, s.k. kapsomerer. Inuti kapsiden finns det plats för det virala genomet och de enzym viruset måste ha med sig in i sin värdcell, inget annat får plats. En viruspartikel är alltså välpackad och kapsidens storlek bestäms av antalet kapsomerer som fogas samman. Ihopsättningen drivs av kapsomerernas egenskaper till ”self-assembly”, en mycket välordnad process. Kapsiden antar hos de flesta virus en ikosahedral symmetri vilket förklarar varför en eller ett par virala proteiner är tillräckligt för att bygga upp hela partikelns struktur. En annan typ av kapsidstruktur som är vanlig är den helikala symmetrin. Hos dessa virus binder proteinmolkylerna direkt på nukleinsyran (genomet) och bildar en skruvformad struktur. Det finns virus som varken har ikosahedral eller helikal struktur utan en mer assymetrisk ”komplex” struktur, men de är mer ovanliga. Exempel på ikosahedral och helikal symmetri är avbildat nedan. Ikosahedral och helikal kapsid struktur. Hölje Utanför kapsiden har en del virus ett hölje det tagit med sig från värdcellens membran, oftast från plasmamembranet men ibland från intracellulära membran. Virusets hölje består alltså av ett cellulärt membran innehållande fettmolekyler (lipider). Som nämdes ovan tar sig virus ut ur värdcellen via lys eller via avknoppning. Det är endast virus som tar sig ut via avknoppning som tar med sig ett hölje. Det är mycket lite cellmembran som tas med varje ny viruspartikel och cellen blir därför inte lidande av denna förlust. I cellmembranet har tidigare virala glykoproteiner infogats. Den syntetiseras på samma sätt som cellulära glykoproteiner och transporteras till cell membranet där de fångas upp av de nya viruspartiklarna när de knoppas av. Dessa virus glykoprotein hamnar på ytan av viruset där de sticker ut och används av viruset för att binda in till nya celler när en ny infektionscykel påbörjas. Eftersom de syns på ytan av viruset är dessa molekyler viktiga målprotein för antikroppar i kroppens försvar mot infektionen. Antikroppar som binder virus och blockerar nyinfektion kallas neutraliserande antikroppar. Om ett virus har hölje eller inte avgör hur stabilt viruset blir. Virus med hölje tål oftast inte den sura mag-tarm kanalen. De flesta virus som sprids via mat eller vatten har alltså inte hölje. Virus med hölje blir också mer känsliga mot detergenter (tvål och tvättmedel) och mot torka, på grund av att lipidmembranet faller sönder. En fördelför viruset att ha hölje är att infektionen inte behöver orsaka celldöd till skillnad från nakna virus som tar sig ut via lys (då cellen sprängs sönder). Att inte ta död på sin värdcell är bra för virus som vill etablera kronisk infektion. Det är viktigt att komma ihåg att alla virus som produceras inte blir funktiondugliga. Virusproduktionen är oftast mycket hög och de virala polymeraserna gör många fel när de kopierar genomet som ska packas in i nya viruspartiklar. Om tusen nya virioner produceras från en och samma cell kanske endast några virus har egenskaper som gör viruset bättre anpassat till omständigheterna. Andra virus blir sämre eller till och med defekta. Om ett defekt virus infekterar en cell blir infektionen abortiv, dvs den leder inte till nyproduktion av virus. Dock är selektionen alltid stark för de mest överlevnadskraftiga viruspartiklarna som kan föröka sig i snabb takt. Man kan säga att det är en slags accelererad evolution där det viktiga inte är att en enskild viruspartikel ska överleva utan att viruspopulationen som helhet överlever och för ”släktet” vidare. Virus som har stor benägenhet att göra misstag (generera mutationer i den virala arvsmassa) är svårare att kontrollera eftersom immunförsvaret kan inte hålla jämn takt med viruset som hela tiden ligger före. Detta är ett av de stora problemen med HIV som har högre variabilitet än något annat virus man känner till. Förutom produktiv infektion (nya virus produceras) och abortiv infektion (inga nya virus produceras) kan virus också ge upphov till latent infektion. Ett välkänt exempel är Herpesvirus som ligger kvar i kroppen under hela vår livstid men som bara reaktiveras och ger symtom ibland. Under den tid infektionen är latent sker ingen viral protein syntes eller nyproduktion av virus men det virala genomet finns lagrat i våra celler. Det krävs någon typ av signal för att reaktivera viruset, tex vet man att stress kan orska virus reaktivernig, men exakt hur detta är kontrollerat är fortfarande inte helt klart. Vissa virus har också en förmåga att påverka den annars mycket starkt kontrollerade celltillväxten. Troligen gör virus detta för att gynna omständigheterna för sin egen tillväxt eftersom en delande cell har mer ”resurser” än en icke-delande cell. Resultatet av sådana virusinfektioner kan vara att värdcellen börjar dela sig okontrollerat vilken leder till transformation och i värsta fall cancer. Endast vissa virus, tex. humant papilloma virus, en del herpesvirus och Hepatit C viruset har transformerade egenskaper. Forskningen inom dessa områden är för närvarande mycket intensiv. Viruset livscykel Processen efter att ett virus binder till en cell och tills det att nya viruspartiklar produceras från den cellen kallas virusets livscykel. Olika virus genomgår lite olika steg för att fullfölja sin livscykel. Exakt vilka steg som behövs beror på vilken typ av nukleinsyra (genom) viruset har (RNA eller DNA) samt om viruset har ett hölje eller inte. Ett antal generella steg kan dock beskrivas som alla virus har gemensamt. Det första steget för ett virus att ta sig in i en cell är att binda till en cellulär receptor. Dessa receptorer är ytmolekyler som har en normal fysiologiskt funktion för cellen, men virus har lärt sig att utnyttja dem för att förankra sig vid cell membranet. Exempel på receptorer är CD4 molekylen på hjälpar T celler som HIV använder, CD21 på B celler som EBV förankrar sig vid och ICAM-1 som rhinovirus använder sig av för att ta sig in i epitelceller. När viruset bundit in till cellen sker oftast konformationsförändringar i viruset som gör att virusets membran (för virus med hölje) smälter samman med cellens membran, så kallad fusion. Konsekvensen är att membranet skalas av virus partikeln och den virala kapsiden släpps in i cellens cytoplasma. Fusionen sker vid cell ytan för vissa virus medan andra virus fuserar efter upptag av viruset in i vesiklar med lågt pH via receptormedierad endocytos. Virus utan hölje kan också ta sig in i cellen via receptormedierad endocytos. I andra fall penetrerar dessa virus cellmembranet genom viropexis där hydrofoba regioner i virusets yta hjälper viruset att glida igenom cellmembranet direkt. Inbinding och fusion Avknoppning Efter inbindning och fusion faller den virala kapsiden samman och genomet släpps ut i cytoplasman. I vissa fall transporteras det direkt till cellens kärna, beroende på var virusgenomet ska repliceras. Som nämnts tidigare sker replikationen ofta med virala polymeras som har en tendens att göra många fel vid nukleinsyrakopieringen (de saknar ”proof-reading” mekanismer till skillnad från cellulära polymeras). Det gör att nya virus partiklar med olika mutationer genereras. Det virala genomet ska dels kopieras upp i höga mängder för att packeteras in i nya partiklar och det ska dels fungera som mall för proteinsyntes av virala proteiner. Många virus tar helt enkelt över hela det cellulära proteinsyntesmaskineriet så att inga cellulära proteiner bildas längre. Det leder efter ett tag till att cellen dör. När de virala proteinerna har syntetiserats sker en snabb ihopsättning av nya partiklar. För att ett virus ska vara funktionellt (kunna infektera en ny cell) måste kapsiden innehålla det virala genomet. Intressant nog packeteras ingen cellulärt RNA eller DNA in i kapsiden, troligen på grund av att det finns en specificitet mellan de virala proteinerna och det virala genomet så bara ”korrekt” nukleinsyra får plats. För virus med hölje sker ihopsättning av nya partiklar vid något av de cellulära membranen (plasmamembranet, det nukleära membranet, ER eller Golgi) innan viruset avknoppas från cellen. För virus utan hölje behövs inte det eftersom de nya virus partiklarna tar sig ut genom att cellen sprängs sönder och släpper ut allt sitt innehåll. Virus som infekterar ögat Adenovirus Adenovirus ligger bakom de flesta virala ögoninfektioner. Det är vanligt men inte speciellt farligt. Adeno betyder körtel och de första adenovirusisolaten gjordes från körtelvävnad bakom näsan. Adenovirus är medelstora virus med ett DNA genom som omsluts av kapsomerer som bygger upp en ikosahedral struktur. Fler än 40 olika adenovirus serotyper har identifierats hos människa. De delas upp i subgrupperna A-F. Varje adenovirustyp bär två olika typspecifika antigena determinanter som är målprotein för neutraliserande antikroppar. Immunitet som stimulerats efter infektion med en viss adenovirustyp ger inte skydd mot andra serotyper och man kan därför drabbas av adenovirus infektion många gånger. De olika typerna ger varierande förkylningssymptom och infektionen sker via svalg, tarm eller konjunktiva och viruset sprids sedan vidare till regionala lymfkörtlar. Hos små barn kan adenovirus ibland ge upphov till svåra pneumonier, vanligen av subgrupp B. Serotyp 8, 19 och 37 är vanligast vid infektion av ögat och det resulterar nästan alltid i en konjunktivit. Ibland kan även hornhinnan infekteras. Vid de tillfällen en viral infektion uppstår från orena kontaktlinser är den oftast orsakad av adenovirus. Röda ögon är det mest markanta tecknet vid adenovirus konjunktivit. Herpesvirus Ett 90-tal olika herpesvirus har isolerats från djur och människa. De kännetecknas av att de är jämförelsevis stora, ca 200 nm i diameter, och har ett större genom än de flesta andra virus. Det gör att de kan koda för många egna gener (ett 100-tal) och de därför är mycket specialiserade. De flesta andra virus kodar bara för 5-10 gener. Herpesvirusinfektion kan vara produktiv eller latent och viruset kan således stanna kvar hos den infekterade värden efter primärinfektion hela livet i ett sovande tillstånd. Reaktivering sker oftare i vissa individer än i andra, troligen beroende av olika ärftliga anlag hos olika individer. ! Herpes Simplex 1 (HSV-1): HSV-1 orsakar gingivostomatit, faryngit och lättare feber vid en normal primärinfektion. Vid reaktivering uppstår små blåsor, ofta kring eller vid sidan av läpparna. Blåsorna är smärtsamma och smittsamma eftersom de är fyllda med nyproducerat virus. Allvarligare infektioner förekommer i ögonen och i eksem, särskilt hos eksembarn. En ovanlig men allvarlig komplikation av HSV-1 infektion är hjärninfektion, encephalit. ! HSV-2 ger blåsor och sår i slemhinnorna kring genitalregionen. Likartade besvär uppstår vid eventuell reaktivering. ! Varicella Zoster virus, VZV, ger upphov till vattkoppor i barndomen, men vid reaktivering ser man små grupper av vätskefyllda blåsor på rodnad botten på övre kroppshalvan (bältros). Bältros ger blåsor som uppträder motsvarande 3-4 dermatom och vanligen bara på ena sidan. ! Cytomegalovirus, CMV, orsakar en rad symptom vid primärinfektion. Dessa kan likna de man erfar vid EBV-mononukleos, men kan också ta sig uttryck av en näst intill renodlad hepatit. Särskilt allvarliga är kongenitala infektioner som kan ge upphov till missbildningar i bla. ögon och hjärnvävnad. Sedan HIV började spridas är också CMV reaktivering vanlig, vilket kan leda till retinit och viral pneumonit. CMV reaktivering är också en vanlig konsekvens hos personer som behandlas med immunosupprimerande mediciner efter en transplantation. ! Epstein-barr virus, EBV, ger upphov till sjukdomen mononukleos främst hos tonåringar. Några symptom vid reaktivering är inte kända. EBV förknippas också med två typer av tumörer, dels Burkitts lymfom som utgår från B celler och är vanlig hos AIDS patienter samt hos barn i östra afrika, och dels i nasopharynxcancer, den vanligaste formen av cancer bland vuxna i sydostasien. ! Humant herpesvirus 6, HHV-6, har nyligen visats orsaka exanthema subitum eller tredagarsfeber, en mild barnsjukdom som börjar med feber i tre dagar och när den släpper får barnet ett övergående utslag över kroppen. ! Ytterligare två humana herpesvirus har identifierats, HHV-7 och HHV-8. HHV-8 är associerat med Kaposis sarcom som drabbar AIDS sjuka. Olika herpesvirus infekterar och etablerar latens i olika värdceller. HSV-1, HSV-2 och VZV etablerar latens i sensoriska nervganglieceller, EBV i B celler och CMV sannolikt både i endotelceller och monocyter. Hos de flesta människor stannar viruset kvar i det latenta tillståndet större delen av livet och viruset förs vidare och smittar andra endast när reaktivering och nya viruspartiklar bildas. Alla dessa herpesvirus är mycket vanliga bland människor, 95% av alla vuxna bär på EBV och ca 80% på HSV-1 och/eller HSV-2. Den virusproducerande livscykeln tar ungefär 24-48 timmar att fullborda och äger rum i andra celler än de latent infekterade. Virus måste alltås först aktiveras från sitt sovande tillstånd och sedan överföras till andra celler, vanligen epitelceller i bl.a. munhålans slemhinnor eller i huden där de ger upphov till produktiv lytisk infektion. Mycket forskning bedrivs för att klargöra de mekanismer som styr latens och reaktivering, men ännu så länge vet man bara säkert att faktorer som UV-ljus, stress, hormonförändringar, cancersjukdomar och immunbrist kan leda till reaktivering. Förloppet under lytisk produktiv infektion har varit lättare att kartlägga i laboratorieförsök där herpesvirus växer bra. Den lytiska cykeln består av minst fyra olika urskiljbara faser på vägen till mogen viruspartikel: 1) uttryck av mycket tidiga gener (transkriptionsfaktorer), 2) uttryck av tidiga gener (enzymer), 3) virus DNA replikation och 4) uttryck av sena gener (kapsidprotein och andra byggstenar). Den infekterade cellen dör i slutfasen av den lystiska cykeln under frisättning av något tusental nya viruspartiklar. Herpesvirus bär med sig många av de enzym som behövs för att fullfölja sin livscykel (till skillnad från de flesta andra virus) och behöver bara förlita sig på värdcellen för sin energiförsörjning. Flera antivirala mediciner har utvecklats som hämmar virusets polymeras och tymidinkinas. De verkar bara på produktivt infekterade celler och kan alltså inte användas för att bli av med latent infekterade celler. De vanligaste herpesvirusinfektionerna som drabbar ögat är orsakade av HSV-1 och VZV. Primär HSV-1 infektion kan yttra sig som blepharit, en infektion i ögonlocken. Det drabbar oftast barn under 5 år. En sekundär HSV-1 infektion yttrar sig oftast som keratit, där röda ögon är det första tecknet på infektion. I vissa fall etablerar viruset också en infektion i hornhinnan, en så kallad keratokonjunktivit. Om den blir kronisk kan keratit nekros uppstå vilket kan leda till nedsatt syn. VZV kan också etablera sig i ögat, det sker oftast i äldre personer vid virusreaktivering. Vid Herpes Zoster Opthalmicus syns symptom främst runt ögat men en konjunktivit eller en keratit kan också utvecklas. HSV-1 blepharitis HSV-1 ulcererande keratit Efter det att HIV började spridas har reaktivering av CMV blivit mycket vanligare. Ett av de tidiga tecknen på att en HIV positiv person utvecklat en immunbrist är att synen blir suddig. Det är orsakat av reaktivering av CMV i retina, en retinit utvecklas. Samma symptom kan ses i personer som genomgår immunsupprimerande behandling till följd av en transplantation, eller i personer med andra immunbristsjukdomar. Aktiv CMV infektion under graviditeten kan leda till fosterskador där ögat kan bli allvarligt drabbat. Poxvirus Poxvirus är liksom herpesvirus stora virus med ett DNA genom. Det finns många olika poxvirus, men det mest kända exemplet är smittkoppor som nu lyckligtvis är utrotat tack vare en effektiv vaccinationskampanj. Andra poxvirus är mindre patogena och leder inte till någon allvarlig sjukdom i människa. Et exempel på poxvirus är Molluscum contagiosum virus, MCV I, MCV II eller MCV III, som orsakar den smittsamma sjukdomen Molluscum Contagiosum. MC viruset etablerar sig i i hud, ibland runt ögat, och orsakar hudvårtor. MCV infektion är vanligt hos barn men är en ofarlig åkomma som läker ut av sig själv hos personer med ett fungerande immunförsvar. Hos AIDS patienter kan vårtor orsakade av MCV vara mer bestående. Picornavirus En annan vanlig typ av virus är picornavirusfamiljen. De är små virus (ca 25 nm), utan hölje, med en ikosahedral struktur och ett RNA genom. Förkylningsvirus som rhinovirus hör till picornavirusfamiljen. Det gör även coxsackievirus och enterovirus. Enterovirus smittar oftast genom svalget och eftersom dessa virus inte har något hölje kan de ta sig igenom den sura mag-tarm kanalen utan att förstöras. Virus i sekret från näsa och svalg, eller i fekala föroreningar, kan överföras med mat och dryck. Särskilt barn kan vara duktiga smittspridare av dessa virus. Enterovirus ger många olika symptom, poliovirus tex. är ett enterovirus som kan orsaka förlamningar. Rhinovirus som ger förkylning är det vanligaste förkylningsviruset hos människa. Ungefär en fjärdedel av alla förkylningar orsakas av rhinovirus. Öven hundratalet olika rhinovirusstammar finns identifierade idag och nya hittas hela tiden. De vanligaste symptomen av rhinovirusinfektion är sinuit och otit. De flesta förkylningar sprids vid skolstarten när många människor förs samman efter att ha vistats på olika orter där de plockat upp olika virus. Coxsackievirus och enterovirus kan infektera ögat och ge konjunktivit. Tillståndet akut hemorrhagic konjunktivit, kännetecknat av brustna blodkärl, orsakas av coxsackievirus A24 eller enterovirus E70. Det läker dock oftast ut av sig själv utan några komplikationer. Togavirus Detta är höljebärande virus med ikosahedral kapsid och en diameter på 50-70 nm. Det mest välkända viruset i togavirusfamiljen är rubella (röda hund virus). Rubella smittar via personkontakt och kan ge allvarliga fosterskador om man exponeras för första gången under den första delen av graviditeten. Utvecklingen av fostrets öga kan då bli påverkat och leda till katarakt, glaukom eller mikrophtalmos. Om man blir infekterad med rubella under den senare delen av graviditeten dominerar risken för hörselskador. Idag erbjuds alla barn i sverige att vaccineras mot rubella, mässling och påsjuka i ett och samma vaccin (MPR). Det sker vid 18 månaders ålder. Gravida kvinnor immunitetsprövas också för att förebygga eventuella fosterskador orsakat av rubella infektion. I barn som ej vaccineras orsakar rubella oftast en lindrig barnsjukdom med feber, men den är relativt snabbt övergående och ger livslång immunitet som följd. Insektsburna togavirus finns också och de kan ge allvarliga hjärninflammationer. Andra viktiga virusfamiljer Retrovirus Retrovirus utgör en grupp virus som har en del speciella egenskaper. Retrovirus har två (+) RNA strängar i sin kapsid och dessa omvandlas till dubbelsträngat DNA som sedan inkorporeras i cellens kromosomala DNA. Denna egenskap gör att virus genomet kan ligga i ett latent tillstånd under hela vår livstid genom att det förs vidare till nya celler under celldelningen. Det är därför svårt, om inte omöjligt, att bli av med en retrovirusinfektion när den väl etablerats. Familjen retrovirus delas in i tre grupper: 1) onkovirus som associeras med olika tumörer, 2) lentivirus som orsakar långsamma kvardröjande infektioner t.ex. HIV och 3) spumavirus som ger kroniska infectioner utan sjukdomssymptom hos både människa och djur. Utmärkande för alla retrovirus är enzymet omvänt transkriptase som gör om RNA genomet till DNA. Den mest kända medlemmen i familjen retrovirus är HIV-1, humant immunbrist virus. Ett närbesläktat virus, HIV-2, finns också vilket är mindre patogent och det har ej spridit sig med samma hastighet som HIV-1. Ett tredje retrovirus som orsakar sjukdom i människa är HTLV1, humant T lymfocyt virus, men det har mycket begränsad spridning i världen. HIV-1 har visat sig vara ovanligt svårt att kontrollera och utan behandling leder HIV-1 infektion till en allvarlig immunbristsjukdom, AIDS. Att HIV-1 är en så allvarlig infektion är framförallt en konsekvens av att viruset infekterar våra hjälparceller, de CD4+ T cellerna. Dessa celler är kritiska för ett funktionellt immunförsvar och de slås gradvis ut av viruset i HIV-1 infekterade personer. En annan anledningen till den allvarliga sjukdomsbilden är att viruset muterar ofta och det kan på så sätt smita undan antikroppar och cytotoxiska T celler. Det är framförallt virusets ytproteiner, gp120 och gp41, som varierar starkt. De få regioner som hålls konstanta (de som krävs för inbindning till CD4 receptorn) är väl gömda i proteinets inre struktur och exponeras inte lätt mot antikroppar. Även andra virala protein varierar starkt, vilket gör att viruset också kan smita undan kroppens virus-specifika T cells svar. HIV-1 överförs huvudsakligen via samlag och via infekterat blod eller blodprodukter. Globalt sett sker de flesta nyinfektioner via heterosexuell transmission, men infektion från mor till barn under födsel eller ammning sker också. De flesta nyinfektioner sker i den fattiga delen av världen, framförallt i afrika söder om sahara samt i sydostasien och indien. På senaste år har antalet nya HIV-1 fall också ökat i Ryssland och dess grannländer inklusive i Sverige. HIV-1 är ett enormt problem som världen fortfarande inte kan hantera. Antivirala preparat har utvecklats, de så kallade bromsmedicinerna, och de har visats vara mycket effektiva. Tyvärr har bara de rikare länderna råd med sådan behandling och resistens mot läkemedlen uppkommer i många behandlade individer. Arbetet att utveckla ett preventivt vaccin mot HIV-1 har visats vara svårt men forskningen är intensiv och många nya vaccinkandidater testas nu i kliniska försök. Blodgivarblod och blodprodukter testas numera alltid för HIV-1, liksom för Hepatit C virus som många HIV-1 positiva personer också bär på. Narkomaner som delar sprutor utgör en speciell riskgrupp eftersom smittat blod kan finnas kvar i sprutan. Man märker ofta inte av några symptom efter den akuta HIV-1 infektionen. Vissa kan känna förkylningslikande symptom, men i de flesta fall upptäcks inte infektionen för förrän långt efter smittotillfället då infektionen går in i ett symtomgivande stadium. Symptom inkluderar lindriga infektioner, svåra autoimmuna rubbningar och slutligen livshotande opportunistiska infektioner. När den infekterade utveckar sin första allvarliga opportunistiska infektion eller neoplasi har AIDS utvecklats, alltså en allvarlig immunbrist. Ortomyxovirus Ett annat mycket välkänt virus är influensa. Influensa är medlem i ortomyxovirusfamiljen, ett höljebärande virus med (-) RNA genom, helikal kapsidsymmetri och en storlek på 80-90 nm. Influensa är, som de flesta kan intyga, mycket smittsamt och är liksom HIV är det ett virus som snabbt kan förändra sig. Genomet hos ortomyxoviruset är uppdelat på flera RNA strängar och det gör att stora genfragment kan bytas ut om två olika influensavirus infekterar samma cell. Variationen hos influensa kan alltså uppkomma på två skilda sätt, dels via enstaka mutationer (så kallat antigendrift) och dels via utbyte av RNA fragment mellan olika virus (antigenskift). De virus som uppkommer efter antigenskift kan ha drastiskt förändrade egenskaper och kan därför vara mycket patogent. Detta skedde under spanska sjukan pandemin i början av 1900-talet och man är nu orolig att något liknande ska ske om fågelinfluensan ändrar sig till ett virus som kan spridas mellan människor. Klassificeringen av influensavirus baseras på de antigena egenskaperna hos viruset, framförallt ytproteinerna hemagluttinin (HA) och neuraminidas (N). Genom immunreaktioner mellan dessaantigen kan man bestämma graden av antigens släktskap mellan olika virus. Detta är också basen för de val man gör varje år ett nytt influensavaccin ska tillverkas. Dagens influensavaccin ger en genomsnittlig skyddseffekt på 50-90% och skyddet kvarstår i ett halvt till ett år. Influensainfektion ger oftast hög feber, frossa, muskelvärk, huvudvärk samt öronnäsa-hals symptom. Komplikationer av influensa kan vara mycket allvarliga speciellt hos äldre och de är oftast baketriellt betingade. Lunginflammation svarar för hälften av dödligheten under influensaepidemier. Flavivirus En virusfamilj också värd att nämna är flavivirusfamiljen. Dessa virus är ofta vektorburna, dvs de sprids till människa via insekter (myggor eller fästingar). Flavivirus är höljebärande RNA virus ungefär 40-50 nm och med ikosahedral kapsid. De omfattar en rad olika virus med olika geografisk spridning. Exempel på flavivirus är de virus som orsakar gula febern, denguefeber, japansk encephalit, TBE (tickborn encephalitis) och West Nile encephalit vilka är vektorburna. Hepatit C virus är ett flavivirus som smittar via blod eller blodprodukter. Nya virus identifieras hela tiden. Ett exempel som skrämde världen nyligen är SARS (severe acute respiratory syndrome), ett coronavirus. Lyckligtvis verkar SARS ha kunnat kontrolleras ganska fort men nya virus kommer alltid att dyka upp. Kroppens försvar mot virusinfektion Ospecifik immunitet Vårt immunsvar mot virusinfektion är liksom mot alla andra infektioner uppdelat i den snabba ospecifika immuniteten och den specifika adaptiva immuniteten. De första barriärerna smo skyddar kroppen mot infektion består av vår hud, slem och cilier i slemhinnorna, temperatur (de flesta virus trivs bäst i 37 graders värme, feber är därför ett ogynnsamt tillstånd för virus), gallsyra och magsaft och fagocytos, dvs upptag och destruktion av virus av immunceller som macrofager. Dessutom har kroppen förmåga att svara snabbt och specifikt mot virus genom produktion av typ I interferoner. Interferoner är en typ av cytokiner som ger en signal till oinfekterade celler att upp-reglera en rad antivirala proteiner som hämmar virusproduktion. Rekombinanta interferoner används ibland kliniska för att kontrollera virus, tex vid Hepatit C infektion. En viktig celltyp som bidrar till den tidiga kontrollen av virus är NK (natural killer) cellerna. NK cellerna aktiveras av interferon och eftersom de virusinfekterade cellerna utsöndrar interferon blir de speciellt känsliga för den cytotoxiska aktiviteten hos NK celler. Förutom dessa mekanismer kan även blod-hjärnbarriären och placenta begränsa spridning av virus till hjärnan respektive till fostret. Specifik immunitet Det specifika immunförsvaret utgörs dels av antikroppsförmedlad immunitet (humoral immunitet) som är beroende av B celler, och dels av den cellförmedlade immuniteten som är beroende av cytotoxiska T celler (CD8+). Hjälpar T celler (CD4+) är viktiga för att utveckla både humoral och cellulär immunitet. Båda typerna av specifik immunitet är viktiga för kontroll av virusinfektion, men dess respektive roll att bekämpa infektionen kan vara olika för olika virus. Det som kännetecknar den specifika immuniteten är att minnesceller etableras, både B och T minnesceller. Minnescellerna bibehålls under en lång tid, ofta under hela vår livstid och det gör att vi blir immuna mot många virus efter en första exponering. För virus som ändrar sig mycket gäller detta ej eftersom minnescellernas inte längre känner igen de nya virus partiklarna. Primära virusinfektioner orsakar ofta en hög antigenstimulering och ger upphov till antikroppar som är viktiga för både eliminering av pågående infektion samt skydd mot reinfektion. Antikroppar kan inte penetrera cellmembranet så de kan inte påverka viruset intracellulärt utan är bara aktiva på extracellulära virioner. Antikroppar hindrar virusreplikation genom att hämma virusets inbinding till de cellulära receptorerna eller genom att inducera virolys. Virolys sker när antikroppar och komplementfaktorer tillsammans binder virus och viruset blir perforerat och förlorar sin infektivitet. Antikroppar kan även underlätta fagocytos eller genom att mediera antikroppsberoende cellulär cytotoxicitet (ADCC). Olika sorters antikroppar bildas vid virusinfektion, framför allt IgM, IgD, IgG och IgA. IgM uppräder först vid virusinfektion och de är endast närvarade i det akuta skedet. Senare vartefter att de specifika B cellerna mognar och differentierar börjar de producera IgG. IgG antikroppar har hög affinitet och de ansvarar oftast för skydd mot reinfektion. IgA finns framförallt i slemhinnor och de tros därför vara speciellt viktiga för skydd mot infektioner via magtarm kanal, luftvägar eller mot sexuellt överförbara virus. Den cellförmedlade immuniteten utvecklas efter stimulering av virus-specifika thymusderiverade T celler. Små fragment av virusantigen presenteras för naiva T celler i komplex med histokompatibilitetsantigen som finns på ytan av dendritiska celler (DC). DC är den viktigaste typen av antigenpresenterande cell i detta skede. Även andra DC molekyler är viktiga för denna initiala stimulering av T cellerna, de så kallade costimulerande molekylerna. Efter aktivering börjar T cellerna producera cytokiner som bidrar till att cellerna delar på sig (klonal expansion) så att det blir fler celler av just de som känner igen det specifika antigenet. När T cellerna en gång har stimulerats av antigen kallas de antigenerfarna. De kan då känna igen antigenfragment som presenteras av histokompatibilitetsantigen även på andra celler än DC. De cytotoxiska T cellerna (också kallade CTL) och hjälpar T cellerna har olika funktioner. Som namnen antyder har CTL en förmåga att lysera virusinfekterade celler som uttrycker rätt antigen på sin yta. Det sker via utsöndring av cytotoxiska faktorer som penetrerar cellmembranet och dödar målcellen. Samma CTL kan döda flera virusinfekterade celler så den kan flytta sig och eliminera flera infekterade celler efter att den aktiverats av en cell. Hjälparcellerna producerar cytokiner som stimulerar expansion och mognad av både CTL och B celler. Det förklarar varför HIV infekterade personer utvecklar immunbristsjukdom varteftersom hjälparcellerna gradvis slås ut och immunförsvaret forlorar sin funktion. Vaccination och antiviral behandling Vaccination Vaccination är en av medicinens mest framgångsrika strategier att hantera virusinfektioner. Vaccination upptäcktes empiriskt redan på 1700-talet då Edward Jenner fann att människor som kommit i kontakt med sjuka kor fick lindriga kokoppor och förvärvade skydd mot smittkoppor. Vaccination mot smittkoppor utvecklades i modern tid och en mycket lyckad vaccinationskampanj avslutades 1977 då världshälsoorganisationen deklarerade världen fri från smittkoppor. Det finns numera många olika vaccinationssätt och i kort kan de delas in i passiv immunsering och aktiv immunisering. Passiv immunisering ger ett kortvarigt skydd eftersom man då endast tillför antikroppar i form av immunoglobulin som renats fram från givare. Eftersom en nidivid bara kan förses med en viss mängd och antikropparna i sig har en begränsad livstid är de effektiva endast under ungefär 2-3 månader. Passiv immunsering utförs ibland som post-exponeringsprofylax. Överföring av antikroppar från mor till barn i modersmjölken är ett exempel på naturlig passiv immunisering. Definitionen är att man ej stimulerar ett aktivt immunsvar med B och T celler. Aktiv vaccinering är det som Jenner gjorde och som är det vanliga vid vaccinering. Det är också det enda sätt lång-levad immunitet kan etableras vilket ju är målet för det mesta. Aktiv vaccinering kräver att det adaptive immunsvaret stimuleras så att minnes B och T celler bildas. Många vaccin vi får idag är baserade på levande försvagade virus som ger en mycket mild (oftast ej märkbar och mycket begränsad) infektion. Exempel på levande vaccin är trippelvaccinet mot röda hund, mässling och påssjuka, MPR. Levande vaccin stimulerar både humoral och cellulär immunitet. Vaccin kan också framställas genom att odla upp virus och sedan inaktivera det med kemikalier så att det förlorar sin infektivitet helt. Sådana avdödade vaccin stimulerar inte lika bra immunsvar och man måste oftast få två eller tre immunseringar innan minnesceller etableras. Avdödade vaccin stimulerar antikroppar men oftast inte cellulär immunitet. Exempel på vaccin baserade på avdödade virus är influensavaccinet som måste nytillverkas varje år. Även poliovaccinet som ges till barn i sverige är ett avdödat virusvaccin. Fördelar med levande vaccin är att ett starkare och bredare immunsvar oftast genereras. Dock ska man vara försiktig med levande vaccin vad det gäller personer med immunbrist eftersom de kanske inte kontrollerar infektionen lika väl som en person med intakt immunsvar. Fördelen med avdödade vaccin å andra sidan är att de är säkra och stabila. Den nya molekylärbiologiska tekniken tillåter också nya sätt att framställa vaccin. Man kan till exempel uttrycka enskilda virusproteiner i så kallade DNA vaccin eller med rekombinanta virus vektorer. Effektiviten av sådana vaccinkandidater testas just nu mot virus som HIV, SARS, Hepatit C och många andra virus. Subenhetsvaccin som ges i form av rekombinanta protein finns redan på marknaden mot Hepatit B. Antivirala medel Det finns endast ett fåtal antivirala medel som används på människa, inte alls lika många som det finns antibiotika mot bakterieinfektioner. Anledningen är att virus är så små och så enkla att det finns väldigt få virus-specifika funktioner att hämma (virus använder ju cellens maskineri för att bygga upp nya partiklar). Länge var rekombinant interferon det enda antivirala medlet som fanns, men på senare tid har man lyckats utveckla små substanser som speciellt blockerar virusinfektion, framförallt genom att hämma virala enzym. Exempel på vanliga antivirala läkemedel och de virus de används mot är listade nedan. ! ! ! ! ! ! ! ! ! Acyclovir Ganciklovir Foscarnet Ribavirin Zidovudin Nevirapin Indinavir Amantadin Tamiflu HSV och VZV CMV CMV RSV, HCV HIV-1 HIV-1 HIV-1 Influensa Influensa