Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm
advertisement

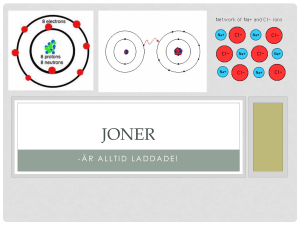
-1Blommensbergsskola/kemiht13/HSA Kemin, läran om ämnena, vad de innehåller, hur de tillverkas mm. Dessa frågor och svar ger dig grundläggande kunskaper i kemi för grundskolan. Det innebär att du får de viktiga orden/begreppen med förklaringar inom atomer, molekyler, grundämnen, rena ämnen, blandningar, joner, sura lösningar, basiska lösningar, neutralisation och salter. 1. Hur började människans intresse för kemi? Här kan du svara t.ex. När våra förfäder blev sjuka försökte de att få fram botemedel. Det betyder att de har sysslat med kemi. 2. Vilka är alkemisterna? Man kallar tidigare kemister alkemister. De kan finnas nu också. I alla fall har alkemisterna arbetat på en ytlig nivå. Det innebär att de inte har arbetat på proton, elektron eller jon nivå. 3. Alkemister har hittat på många saker som används idag. Ge några exempel. De har kommit på hur man kan förvara mat, tillverka medicin, legeringar, alkohol mm. 4. Alkemister försökte göra guld men lyckades inte med det. Varför? De har inte lyckats med att komma åt atomkärnan. De blandade ihop några metaller genom att smälta. De har fått olika legeringar som brons, mässing, stål mm. De har inte lyckats förändra antalet protoner i atomkärnan. Man måste ha rätt antal protoner i kärnan för respektive grundämne. Guld har 79 protoner. På så djup nivå har de inte arbetat. 5. Vem har kommit på atom tecken och det kemiska språket? Berzelius införde det kemiska språket och tecken. H är kemiskt tecken för väte (på latin Hydrogen) och O är kemiskt tecken för syre (på latin Oxygen), He är kemiskt tecken för helium. 6. Vilka kemiska tecken och formler har grundämnen och kemiska föreningar (sammansatta ämnen)? Grundämnen brukar ha kemiska tecken. T.ex. metaller som järn Fe, koppar Cu, Natrium Na och ickemetaller som kol C. Men gaserna brukar ha molekylformel som vätgas H2 eller syrgas O2. Kemiska föreningar har molekylformel som t.ex. vatten H2O. Det innebär att det har skett en kemisk reaktion mellan syrgas och vätgas. Så en vattenmolekyl är en kemisk förening mellan två väteatomer och en syreatom. Med andra ord är vattenmolekylen ett sammansatt ämne. 7. Vem införde det periodiska systemet? Mendelejev, en rysk kemist, införde det periodiska systemet. En tabell som innehåller kemiska tecken, atomnummer mm. Nu har vi drygt 100 atomslag som är placerade i tabellen enligt atomnummer (antal protoner i kärnan). Om antal protoner ändras får vi ett nytt grundämne. Mendelejev tabell kallas för det periodiska systemet. Med andra ord är det en tabell över grundämnena i atomnummerordning. 8. Vem kom på atommodellen (atomkärna och elektroner)? Bohr, dansk fysiker, påvisade att det finns partiklar i en atom, proton och neutron i atomkärnan och elektroner runt kärnan. Elektronerna kan finnas på olika banor, så kallade skal. Skal ordning från kärnan är K L M N O P Q, enligt Bohrs atommodell. -2Blommensbergsskola/kemiht13/HSA 9. Rita olika atommodeller, t.ex. kol, syre, väte, klor, natrium mm. 10. Vad menas med valensskal, valenselektroner och ädelgasstruktur? Det yttersta skalet för en atom kallas valensskal och de elektroner som finns där kallas valenselektroner. Ädelgasstruktur innebär att valensskalet inte har plats för extra elektroner. 11. Hur många valenselektroner har C, O, H, Cl och Na? (Titta på ritningen ovanpå) C har 4 O har 6 H har 1 Cl har 7 och Na har 1. 12. Redogör i huvuddrag det periodiska systemet, Mendelejev tabell. I naturen finns ämnen i tre olika tillstånd (faser/former), fast-, flytande- och gas fas. Därtill kan man säga att ämnen delas i metaller, halvmetaller och icke-metaller. Man ser ämnets form eller fas i det periodiska systemet genom markering eller färg i respektive ruta. Undantag för Hg (kvicksilver) som är en tung och hälsofarlig metall men den finns i flytande form. Dessutom kan man ändra på ämnets form, genom så kallad fysikalisk förändring eller fasförändring. Den kan ske genom att öka eller sänka ämnets temperatur och tryck. I det periodiska systemet finns alla grundämnena i atomnummerordning. Atomnummer ger information om hur många protoner (positiva laddningar) det finns i atomkärnan och hur många elektroner det finns på skal (banor) runt kärnan. Här kan man se hur många skal, elektronbanor, finns runt atomkärnan genom att se var respektive atom ligger i tabellen. Rad nummer, period, gäller för antal skal, antal elektronbanor. Hur många skal kan en atom ha? Det beror på i vilken period atomen finns. Antalet perioder ger information på antalet skal. Varje skal har sin beteckning, de första skalet är K och kan ha max 2 elektroner, 2-ra skalet heter L och kan ha max 8 elektroner, 3-je skalet heter M och kan ha max 8 elektroner för atomer som ligger i period 3. Men det kan variera med antal elektroner på skal M för atomer som ligger på period 4, 5, 6 och 7. Sedan kan man se i vilken kolumn/grupp atomen ligger. Grupp1 ligger till vänster om tabellen. I grupp 1 har alla atomer en valenselektron. De är metaller utom väte som kallas alkalimetaller. Grupp 2 har två valenselektroner. Grupp 13 har 3 valenselektroner. Grupperna 3, 4, 5, 6, 7, 8, 9, 10, 11 och 12 kallas övergångsmetaller, från atomnr 21 till atomnr 79. Hur många valenselektroner kan en övergångsmetall ha? Svar: det kan skifta från 1, 2 eller 3. T.ex. Fe järn kan ha 2 eller 3 valenselektroner. Grupp 14 har 4 valenselektroner, grupp 15 har 5 valenselektroner, grupp 16 har 6 valenselektroner och grupp 17 har 7 valenselektroner. I grupp 17 finns halogener. Grupp 18 är ädelgaser med fullsatt valensskal. 13. Är luft materia? Motivera ditt svar. Luften är materia eftersom den har massa, vikt. Det finns gaser i luften som kväve, syre, koldioxid, vattenånga mm. Så luften är en blandning av olika gaser eller olika molekyler. Dessutom består varje molekyl av atomer. Det finns även andra små partiklar i luften. 14. Hur vet du att en atom har neutral laddning? Atomer med kemiska tecken utan positivt tecken eller utan minus tecken är atomer som har en neutral laddning som H, O, Na, Cl. Det innebär att atomen har lika många protoner som elektroner. 15. Hur bildas joner? När en atom lämnar ut elektroner eller tar in elektroner får den ett nytt läge. Då har atomen inte lika många protoner som elektroner. Det innebär att atomen får elektrisk laddning. Ett sådant läge kallas jon. -3Blommensbergsskola/kemiht13/HSA 16. Vad menas med en positiv jon, förklara med ett exempel? När en atom lämnar ut en elektron får atomen ett nytt läge. Då blir atomen positivt laddad. Den kallas positiv jon. T.ex. vätejon H+, natrium jon Na+ . Då har jonen en ädelgasstruktur. 17. Vilka atomer från det periodiska systemet kan omvandlas till positiva joner? Atomer från grupp 1 till och med grupp 13 kan skicka ut valenselektroner. T.ex. H+ Na+ Ca2+ och Al3+ Fe 2+ Fe 3+ . Då får respektive jon ädelgasstruktur. 18. Vad menas med en negativ jon? När en atom tar in en elektron får atomen i ett nytt läge. Då blir atomen negativt laddad. Den kallas negativ jon. T.ex. klorid jon Cl-. 19. Vilka atomer från det periodiska systemet kan omvandlas till negativa joner? Atomer från grupp 14 till och med grupp 17 kan ta in valenselektroner. T.ex. Cl- F- O2- N3- . Då får respektive jon ädelgasstruktur. 20. Vad menas med sammansatta joner? Då sitter minst två atomer ihop men de har tillsammans positiv eller negativ laddning. Sammansatta joner kan vara hydroxidjonen OH- eller sulfatjoner SO42- eller karbonat CO32nitrat NO3- eller fosfatjonen PO43− 21. Vad menas med molekyl, grundämne och sammansatt ämne? Ange exempel. En molekyl (består av minst två atomer) som syre (syrgas) O2 eller väte (vätgas) H2 vatten H2O eller koksalt NaCl eller saltsyra HCl. Ett grundämne (molekyl som består av samma atomer, atomslag) för gaser har ett tal efter det kemiska tecknet som exempelvis syre (syrgas) O2 eller väte (vätgas) H2 men för metaller står talet ofta inte med som Fe Cu osv. Alltså ser man Fe kan det betyda en järnatom eller grundämnet, järnrör. Ofta förstår man genom texten vad det handlar om. Ett sammansatt ämne är en kemisk förening som består av minst två olika atomer som vatten H2O eller koksalt NaCl eller saltsyra HCl. 22. Hur många molekyler och atomer finns det i följande kemiska molekylformler? H2O 3H2O O2 5O2 H2 2H2 Na Fe Cu Au H2O är en vattenmolekyl, dieväteoxid, som innehåller två väteatomer och en syreatom och är ett sammansatt ämne. 3 H2O är tre vattenmolekyler som innehåller sex syreatomer och tre syreatomer och är ett sammansatt ämne. O2 är en syremolekyl som innehåller två syreatomer och är ett grundämne. -4Blommensbergsskola/kemiht13/HSA 5O2 är tre syremolekyler som innehåller tio syreatomer och är ett grundämne. H2 är en vätemolekyl som innehåller två väteatomer och är ett grundämne. 2H2 är två vätemolekyler som innehåller fyra väteatomer och är ett grundämne. Na kan vara det kemiska tecknet för en natriumatom eller grundämnet natrium. Fe kan vara det kemiska tecknet för en järnatom eller grundämnet järn. Cu kan vara en kopparatom eller grundämnet koppar. Au kan vara en guldatom eller grundämnet guld. 23. Vilka bindningar kan det vara mellan atomerna i ett ämne? Detta beror på ämnet. T.ex. ett järnrör, består av järnatomer. Järnatomerna håller ihop varandra med elektroner. Det bildas ett moln av elektroner runt alla järnatomer. På så sätt binds alla järnatomer ihop. En sådan bindning kallas metallbildning. T.ex. vattenmolekyl H2O består av två väteatomer och en syreatom. Då binds syreatomen med varje väteatom genom elektronparbindning. Bindningen kallas molekylbindning eller kovalent bindning. -T.ex. koksalt, natriumklorid, NaCl saltsyra, väteklorid, HCl och natriumhydroxid NaOH har jonbindning. Här har elektroner hoppat mellan atomerna, t.ex. mellan Na och Cl. Då bildas positiva och negativa joner, Na+ och CL-. Den kemiska föreningen bildas genom jonförening. Eftersom de negativa och positiva jonerna attraherar varandra. 24. Vad är skillnaden mellan en kemisk reaktion och fysikalisk förändring (fas förändring)? Vid en fysikalisk förändring eller en fas förändring sker en förändring på utseende. Det innebär att det är samma ämne men i en annan form/fas. T.ex. Is är fast fas, vatten är flytande fas och vattenånga är gas fas. Här har vi samma vattenmolekyler i alla faser. Det som skiljer är avståndet mellan molekylerna och deras rörelse. Detta beror på temperaturen. Vid hög temperatur ökar avståndet och rörelse mellan molekylerna och vid låg temperatur minskar avståndet och rörelse mellan molekylerna. Vid en kemisk reaktion sker en kemisk förening mellan minst två ämnen. Här kan det bildas minst ett nytt ämne. Det nya ämnet har andra egenskaper än de som ingår i kemiska reaktionen från början. T.ex. natrium är en giftig metall och klor är en giftig gas. När de reagerar med varandra bildas ett nytt ämne som kallas natriumklorid, koksalt som vi använder i maten och som inte är giftigt. 25. Hur skriver du en kemisk reaktion med ord? Jag skriver namnet på ämnena ingår i den kemiska reaktionen och ritar en pil. Sedan skriver jag namnet på de nya ämnena. T.ex. Natrium + klor → natriumklorid Vätgas + syrgas → vatten + värme Kol + syrgas → koldioxid vid fullständig förbränning -5Blommensbergsskola/kemiht13/HSA Kol + syrgas → koloxid vid ofullständig förbränning. Kallas även kolmonoxid. 26. Hur skriver du kemiska reaktionen med reaktionsformel med balansering? Na + Cl → NaCl Här ser jag antal atomer som finns på vänstra sidan om pilen som är lika många atomer som finns på höger sida om pilen. 2H2 + O2 → 2 H2O + värme Här får jag multiplicera med 2 på västra sida om pilen, H2, och multiplicera med 2 på höger sida om pilen H2O. Om salter, syror och baser löser sig i vatten bildas joner i vattnet. 27. Vilka joner bildas om a) Koksalt löser sig? NaCl blir Na+ och Clb) Kalciumkarbonat löser sig? CaCO3 blir Ca2+ och CO32Lakrits är salt som heter ammoniumklorid med kemisk formel NH4Cl. Vilka joner har lakrits? NH4+ och ClVilka joner innehåller saltsyralösning? HCl blir H+ och ClVilka joner innehåller salpetsyralösning? HNO3 blir H+ och NO3Vilka joner innehåller svavelsyralösning? H2SO4 blir 2H+ och SO4228. Vad har alla sura lösningar gemensamt? Vad avgör surhetsgraden? Alla sura lösningar innehåller vätejoner, H+ och antalet vätejoner avgör surhetsgraden. En sur lösning har många vätejoner. 29. Vilka konsekvenser kan ickemetall oxider orsaka? Motivera ditt svar. Ickemetall oxiderar som svaveldioxid SO2, kvävedioxid NO2 och koldioxid CO2 och de är ofta i gasfas. De sprider sig lätt i luften. Men i luften kan de reagera med vattenånga. Därefter kan det regna surt. Det sura regnet kan skada miljön. Eftersom miljön får ett rikligt överskott av vätejoner. Dessutom kan det sura regnet lösa mineraler från marken eller bergen och ta med sig dessa ämnen till vattendrag, sjöar eller hav. Det sura regnet kan även påskynda rost bildning i bilar mm. Det har skadat en del av vårt kulturarv som statyer, byggnader vilka byggdes för tusentals år sedan. Fenomenet kallas vittring. 30. Vilka joner bildas när bränt kalk löser sig? När CaO löser sig i vatten bildas Ca2+ och 2OHAlltså kan man få kalciumhydroxid Ca(OH)2 31. Vilka joner innehåller natriumhydroxid? NaOH blir Na+ och OH32. Vad har basiska lösningar gemensamt? Vad avgör hur besk en lösning är? -6Blommensbergsskola/kemiht13/HSA Alla basiska lösningar innehåller hydroxidjoner, OH- och avgörs av antalet hydroxidjoner. En besk lösning har många hydroxidjoner. 33. Vad menas med en neutralisation? I vilket fall kan man använda en sådan process? Motivera ditt svar. I kemi tolkas en neutralisation som ett neutralt läge där antal vätejoner är lika många som hydroxidjoner. Det innebär att lösningen är neutral. Den kemiska reaktionen för en neutralisation kan skrivas generellt som En sur lösning + en basisk lösning → salt + vatten Man kan använda neutralisation konceptet exempelvis i en sur sjö. Man tar vattenprov och får sjöns surhetsgrad. Därefter kalkar man sjön med en lämplig mängd. Att kalka innebär att man lägger kalcium i vattnet. Kalcium är en metall och vid reaktion med vatten bildas kalciumjoner och hydroxidjoner. På så sätt försöker man jämna ut antal vätejoner med hydroxidjoner så att vattnet i sjön får ett neutralt läge, neutralt pH värde = 7. 34. Vad har kunskaper i atomer, joner, molekyler, sura och basiska lösningar hjälpt dig? Motivera ditt svar. Nu börjar jag förstå hur det kan uppstå miljöproblem som surt regn och vilka konsekvenser det för med sig. Att släppa ut mindre ickemetalloxider genom att minska användning av bensin eller diesel motordrivna fordon kan vara ett sätt för att minimera det sura regnet. Dessutom har jag förstått hur man kan komma åt en sur sjö genom att kalka. Här kommer man på att antal vätejoner och hydroxidjoner som jämnas ut. Dessutom kan man använda sådana kunskaper när man har plantering. Där kan olika grönsaks- eller frukt träd växa bra på rätt miljö med anpassat pH-värde. 35. Förklara följande begrepp: Fysikalisk förändring/fasförändring – en förändring som sker på utseendet exempelvis genom temperatur eller tryck. Ämnets partiklar får större eller mindre avstånd mellan varandra beroende på förändringen i temperatur eller tryck. Vid ökad temperatur rör sig partiklarna mer och vid låg temperatur rör dem sig mindre, det samma händer vid ökat och sänkt tryck. Rent ämne – Ett ämne som består av samma molekyler eller atomer. Exempelvis 24 karat guld. Blandningar – En blandning som kan bestå av minst två olika ämnen. Mellan gaser – En blandning mellan olika gaser exempelvis luften. Mellan vätskor – En blandning mellan minst två olika vätskor, exempelvis citronlösning. Mellan metaller, legering – En sammansättning av minst två olika metaller. Exempelvis 18 karat guld, Brons, mässing, stål, rostfritt stål. Lösningar – En lösning innebär att minst en vätska har löst andra ämnen. Exempelvis sockerlösning. Homogena lösningar – Lösningar som har osynliga beståndsdelar, exempelvis saltlösning. -7Blommensbergsskola/kemiht13/HSA Heterogena lösningar – Lösningar som har synliga beståndsdelar, exempelvis vatten och olja. Den kan även kallas emulsion. Omättade lösningar – Lösningar som kan lösa mer av det andra ämnet. Exempelvis 5 g socker i en liter vatten. Lösningen har 5/1005 ca 0,5% sockerhalt. En sådan lösning ka ta 5 g socker till. Eftersom den är omättad. Den blir då 10/1010 ca 1%. Mättade lösningar – Lösningar som inte kan lösa mer av det andra ämnet. Exempelvis 350 g socker i en liter vatten. Vatten löser en del av 350 g socker. Resten av sockret blir kvar och syns. Mellan vätskor Alla vätskor kan inte lösa varandra. Exempelvis vatten kan inte lösa matolja från kläder. Därför använder man tvättmedel som innehåller tensider. Då bryter tensiderna stora oljemolekylerna till små och omger den. Härefter kan vattnet ta bort oljan med tensiderna. 36. Vilka faktorer påverkar löslighet? Uppvärmning, omröring och finfördelning av det lösta ämnet kan påverka. Men beståendesdelarna syns när man slutar med uppvärmning eller omröring. På samma sätt försöker man lösa svårlösliga ämnen. 37. Blandningarna går att separera. Ange några sätt för separationer. Sedimentering, filtrering, extrahering, indunstning, destillering och kromatografi. 38. I människokroppen sker separationer. I vilka kroppsorgan sker separationer? I lungorna (syrgas skiljs från inandningsluften), i njuren filtreras blodet, i magsäcken finfördelas maten och proteiner skiljs från resten tack vare enzymer som pepsin och saltsyra. Från levern och gallan kommer enzymer som finfördelar fett. Kolhydrater och socker skiljs från maten i tolvfingertarmen med hjälp av enzymer som insulin som kommer från bukspottskörteln. I tunna och tjocka tarmen sugs mineraler in mm. Enzymerna är katalysatorer som påskyndar matspjälkningen. 39. Vad har du för nytta av kunskaper om blandningar och separationer? Motivera ditt svar. Genom det vet jag vad några kroppsorgan har för funktion. Med det får jag vara försiktig med vad jag konsumerar. Överkonsumtion av näringsämnen som kolhydrater, socker, salter, kött eller fett kan leda till att respektive kroppsorgan inte klarar sitt uppdrag. Detta i sin tur kan leda till ohälsa eller sjukdomar hos en individ. 40. Rent vatten är ett sammansatt ämne. Förklara varför. Rent vatten är ett rent ämne som består av vattenmolekyler. Men varje vattenmolekyl, dieväteoxid H2O, består av 2 väteatomer och en syreatom. Alltså finns olika atomer i varje vattenmolekyl. Därför kallas vatten för ett sammansatt ämne. 41. Luften är en blandning. Förklara varför. I luften finns olika gaser som kväve, syre, koldioxid, vattenånga mm. Så luften är en blandning av olika gaser eller olika molekyler. Det finns även andra små partiklar i luften. 42. Sockerlösning, saltlösning, citronlösning och te är exempel på homogena lösningar. Förklara varför. De är lösningar som har osynliga beståndsdelar. Så länge lösningarna är omättade ser man inte exempelvis salt i saltlösningen. -8Blommensbergsskola/kemiht13/HSA 43. Vilken av följande är en kemisk reaktion: att koka vatten eller att bränna/elda ett papper? Förklara varför. Att koka vatten är en fas förändring. Här har vi samma vattenmolekyler men avstånd och rörelse skiljer sig i respektive fas. Att bränna/elda ett papper är en kemisk reaktion. Eftersom man får nya ämnen som vattenånga och koldioxid. 44. Kan man framställa salter genom fysikalisk förändring (fasförändring)? Motivera ditt svar. Då har man tänkt på havsvatten som innehåller salt. Man kan utvinna saltet ur havsvattnet genom indunstning. Alltså förvara havsvattnet i en bassäng där vattnet avdunstar och saltet blir kvar. Man kan även framställa salt genom att koka havsvatten. 45. Hur framställer man salter genom en kemisk reaktion? Genom neutralisation och därefter indunstning eller kokning. H++ Cl- + Na++ OH- → Na++ Cl- + H2O efter indunstning eller kokning blir NaCl kvar. Genom att lägga en metall i saltsyra och därefter indunstning eller kokning. Mg + H++Cl- → MgCl2 + H2 46. Vilken typ av salt använder man som gips? Motivera ditt svar. Kalciumsulfat, CaSO4, används. Eftersom den är hård. Men krossas till pulver för att lösas och blandas till en smet. Gasbindor dränks i gipssmetwt. Direkt därefter lindar man kring benbrott. När det torkar (vatten avdunstar) blir det hårt igen. På så sätt hålls benbrottet stabilt så att benen växer ihop rätt. 47. Var kan följande salter som kalciumkarbonat och kalciumfosfat finnas? Kalciumkarbonat, CaCO4, finns i kalksten, krita och marmor. Kalciumfosfat, Ca3(PO4)2, finns i skelettet. Kalcium salter kan vara hårda. Utan dem skulle vi inte kunna ha hårda och lätta skelett. Därför bör man dricka mjölk eller äta ost för att komplettera skelettets behov av kalcium. 48. Vad kan finnas i bakpulver eller brustabletter? Varför? Det kan finnas några ämnen i dem. En av dem är koldioxid. Syftet med det kan vara flera punkter. Men en av dem är: I bakpulver är att tillåta degen att växa upp eftersom koldioxid gasen frigörs genom att öppna kanaler som gör att vi får en mjuk kaka eller bulle. I brustabletten frigörs koldioxid gasen när brustabletten löses i vatten. På så sätt får man en färsk smak när man dricker brustablettlösningen. 49. Salter kan vara nyttiga och skadliga. Ange exempel för dem. Motivera varför du anser att respektive salt kan vara nyttigt och skadligt. Det finns lättlösliga och svårlösliga salter. Mineraler som bygger upp jorden är svårlösliga salter. Utan dem kan vi inte gå, cykla, eller bygga hus på. De lättlösliga salterna som koksalt som innehåller järn, koppar mm får man konsumera i lagom mängd. Ett överskott av saltkonsumering kan leda till att det bildas sten i urinledarna eller njuren. 50. Hur kan man undvika överskott av salt? Konsumera lagom mängd enligt kroppens behov och drick vatten. -9Blommensbergsskola/kemiht13/HSA 51. Man saltar/sandar isiga vägar. Vilka nackdelar kan det finnas med det? Motivera ditt svar. Saltet gör att isen smälter men bidrar till att det bildas joner. Jonerna hamnar med regnvattnet i åkrar, sjöar, hav osv. Detta påverkar växt- och djurlivet negativt. Dessutom kan saltjonerna påskynda rostbildning. Jonerna underlättar för syrgas för att komma åt skyddade metaller. Även en rostskyddad bil kan få rost. 52. Hur undviker man rostbildning? Motivera ditt svar. Det finns en rad åtgärder som målning, förzinkning mm. Jag tycker att man tar hand om sina föremål så att de inte rostar. Annars kasseras dem och soptipparna växer. Dessutom tas mycket energi för att framställa nya föremål. 53. Vilka skillnader finns det mellan järnoxiderna Fe3O4 och Fe2O3? Man ser att antal atomer inte stämmer mellan järnoxiderna. Fe3O4 är svart stenmalm och heter magnetit. Fe2O3 är röd stenmalm och kallas hematit. Av dessa kan man framställa rent järn. Sedan kan man ha i rätt mängd kol mellan 0,1-2% genom färskningsprocess. Järn som innehåller kol kallas stål. Den är hård och lämplig för konstruktionsmaterial men det kan rosta. Man kan återvinna järn från skrot också. 54. Hur rostar respektive metall? Järn har en gråaktig färg. Men rostig järnplåt blir brun. När järn rostar bildas det hål och så småningom smulas det sönder. Koppar är brun till färgen. När det rostar bildas ett skikt som kallas kopparoxid eller ärg, som får en grön färg. Skiktet skyddar resten av kopparn som ligger under. Man kan ta bort ärg eller kopparoxid med rätt polermedel eller till och med ketchup. Pröva! Aluminium kan ha mellan silver till grå färg. När det rostar bildas ett skikt som kallas aluminiumoxid som har en gråare färg. Skiktet skyddar resten av aluminiumet som ligger under. Man kan ta bort aluminiumoxid med rätt polermedel. Zink har en grå färg. När det rostar bildas ett skikt som kallas zinkoxid som har en gråare färg. Skiktet skyddar resten av zink som ligger under. Man kan ta bort zinkoxid med polermedel. 55. Vad menas med mjukt vatten och hårt vatten? Mjukt vatten kan innehålla spår av joner som magnesium eller kalcium. Hårt vatten innehåller rikligt med joner som magnesium och kalcium. I hårt vatten kan det bli svårt att tvätta sig eftersom det blir svårt att bilda skum. Då får man destillera vattnet eller montera ett speciellt filter på kranen som kan fånga magnesium- och kalciumjonerna. Ibland kan det fungera genom att koka det hårda vattnet så att kalciumet och magnesiumet samlas på vattenytan som en vit hinna som man kan ta bort. Använder man hårt vatten ofta kan det leda till att man får njurskador eller andra sjukdomar. Hårt vatten kan även bidra till skador på hushållsmaskiner som tvättmaskin eller diskmaskin.